Penicilina
 Estructura del núcleo de la penicilina, donde "R" es el grupo variable | |
| Datos clínicos | |
|---|---|
| AHFS / Drogas.com | Información detallada para el consumidor de Micromedex |
| Vías de administración | Intravenosa , intramuscular , por boca |
| Código ATC | |
| Estatus legal | |
| Estatus legal |
|
| Datos farmacocinéticos | |
| Metabolismo | Hígado |
| Vida media de eliminación | Entre 0,5 y 56 horas |
| Excreción | Riñones |
Las penicilinas ( P , PCN o PEN ) son un grupo de antibióticos β-lactámicos obtenidos originalmente de mohos Penicillium , principalmente P. chrysogenum y P. rubens . La mayoría de las penicilinas en uso clínico son sintetizadas por P. chrysogenum mediante fermentación en tanque profundo [2] y luego purificadas. [3] [4] Se han descubierto varias penicilinas naturales, pero solo dos compuestos purificados están en uso clínico: penicilina G ( uso intramuscular o intravenoso ) y penicilina V (administrada por vía oral). Las penicilinas estuvieron entre los primeros medicamentos en ser eficaces contra muchas infecciones bacterianas causadas por estafilococos y estreptococos . Todavía se usan ampliamente hoy en día para varias infecciones bacterianas, aunque muchos tipos de bacterias han desarrollado resistencia después de un uso extensivo.
El diez por ciento de la población afirma tener alergia a la penicilina , pero como la frecuencia de resultados positivos en las pruebas cutáneas disminuye un 10% con cada año de abstinencia, el 90% de estos pacientes pueden llegar a tolerar la penicilina. Además, las personas con alergia a la penicilina suelen tolerar las cefalosporinas (otro grupo de betalactámicos) porque la reactividad cruzada de la inmunoglobulina E (IgE) es solo del 3%. [5]
La penicilina fue descubierta en 1928 por el científico escocés Alexander Fleming como un extracto crudo de P. rubens . [6] El estudiante de Fleming, Cecil George Paine, fue el primero en usar con éxito la penicilina para tratar la infección ocular ( conjuntivitis neonatal ) en 1930. El compuesto purificado (penicilina F) fue aislado en 1940 por un equipo de investigación dirigido por Howard Florey y Ernst Boris Chain en la Universidad de Oxford. Fleming utilizó por primera vez la penicilina purificada para tratar la meningitis estreptocócica en 1942. [7] El Premio Nobel de Fisiología o Medicina de 1945 fue compartido por Chain, Fleming y Florey.
Varias penicilinas semisintéticas son eficaces contra un espectro más amplio de bacterias: estas incluyen las penicilinas antiestafilocócicas , las aminopenicilinas y las penicilinas antipseudomonas .
Nomenclatura
El término "penicilina" se define como el producto natural del moho Penicillium con actividad antimicrobiana. [8] Fue acuñado por Alexander Fleming el 7 de marzo de 1929 cuando descubrió la propiedad antibacteriana del Penicillium rubens . [9] Fleming explicó en su artículo de 1929 en el British Journal of Experimental Pathology que "para evitar la repetición de la frase bastante engorrosa 'filtrado de caldo de moho', se utilizará el nombre 'penicilina'". [10] El nombre se refiere así al nombre científico del moho, como lo describió Fleming en su discurso del Nobel en 1945:
Con frecuencia me han preguntado por qué inventé el nombre de "penicilina". Simplemente seguí líneas perfectamente ortodoxas y acuñé una palabra que explicaba que la sustancia penicilina se derivaba de una planta del género Penicillium, de la misma manera que hace muchos años se inventó la palabra " digitalina " para una sustancia derivada de la planta Digitalis . [11]
En el uso moderno, el término penicilina se utiliza de forma más amplia para referirse a cualquier antimicrobiano β-lactámico que contiene un anillo de tiazolidina fusionado al núcleo β-lactámico y puede o no ser un producto natural. [12] Como la mayoría de los productos naturales, la penicilina está presente en los mohos Penicillium como una mezcla de componentes activos ( la gentamicina es otro ejemplo de un producto natural que es una mezcla mal definida de componentes activos). [8] Los principales componentes activos de Penicillium se enumeran en la siguiente tabla: [13] [14]
| Nombre químico | Nomenclatura del Reino Unido | Nomenclatura estadounidense | Potencia relativa a la penicilina G [15] |
|---|---|---|---|
| 2-Pentenilpenicilina | Penicilina I | Penicilina F [16] | 70–82% |
| Bencilpenicilina | Penicilina II | Penicilina G [17] | 100% |
| p -Hidroxibencilpenicilina | Penicilina III | Penicilina X [18] | 130–140% |
| n -Heptilpenicilina | Penicilina IV | Penicilina K [19] | 110–120% |
Otros componentes activos menores de Penicillium incluyen penicilina O , [20] [21] penicilina U1 y penicilina U6. Posteriormente se descubrió que otros componentes nombrados de Penicillium natural , como la penicilina A, no tenían actividad antibiótica y no están relacionados químicamente con las penicilinas antibióticas. [8]
La constitución precisa de la penicilina extraída depende de la especie de moho Penicillium utilizada y del medio nutritivo utilizado para cultivar el moho. [8] La cepa original de Penicillium rubens de Fleming produce principalmente penicilina F, llamada así en honor a Fleming. Pero la penicilina F es inestable, difícil de aislar y el moho la produce en pequeñas cantidades. [8]
La principal cepa comercial de Penicillium chrysogenum (la cepa Peoria) produce penicilina G como componente principal cuando se utiliza licor de maceración de maíz como medio de cultivo. [8] Cuando se añade fenoxietanol o ácido fenoxiacético al medio de cultivo, el moho produce penicilina V como penicilina principal. [8]
El ácido 6-aminopenicilánico (6-APA) es un compuesto derivado de la penicilina G. El 6-APA contiene el núcleo beta-lactámico de la penicilina G, pero sin las cadenas laterales; el 6-APA es un precursor útil para la fabricación de otras penicilinas. Existen muchas penicilinas semisintéticas derivadas del 6-APA y se dividen en tres grupos: penicilinas antiestafilocócicas, penicilinas de amplio espectro y penicilinas antipseudomonas. Las penicilinas semisintéticas se denominan penicilinas porque todas se derivan en última instancia de la penicilina G.
Unidades de penicilina
- Una unidad de penicilina G sódica se define como 0,600 microgramos. Por lo tanto, 2 millones de unidades (2 megaunidades) de penicilina G equivalen a 1,2 g. [22]
- Una unidad de penicilina V potásica equivale a 0,625 microgramos. Por lo tanto, 400.000 unidades de penicilina V equivalen a 250 mg. [23]
El uso de unidades para prescribir penicilina es un accidente histórico y está en gran parte obsoleto fuera de los EE. UU. Dado que la penicilina original era una mezcla mal definida de compuestos activos (un polvo amarillo amorfo), la potencia de cada lote de penicilina variaba de un lote a otro. Por lo tanto, era imposible prescribir 1 g de penicilina porque la actividad de 1 g de penicilina de un lote sería diferente de la actividad de otro lote. Después de la fabricación, cada lote de penicilina tenía que estandarizarse con una unidad conocida de penicilina: cada frasco de vidrio se llenaba entonces con la cantidad de unidades requeridas. En la década de 1940, un frasco de 5000 unidades Oxford era estándar, [24] pero, dependiendo del lote, podía contener desde 15 mg hasta 20 mg de penicilina. Más tarde, se convirtió en estándar un frasco de 1.000.000 de unidades internacionales, que podía contener de 2,5 a 3 g de penicilina natural (una mezcla de penicilinas I, II, III y IV e impurezas naturales). Con la llegada de las preparaciones de penicilina G pura (un polvo cristalino blanco), ya no hay motivos para prescribir penicilina en unidades.
La "unidad" de penicilina ha tenido tres definiciones previas, y cada definición fue elegida por ser aproximadamente equivalente a la anterior.
- Unidad Oxford o Florey (1941). Originalmente se definió como la cantidad mínima de penicilina disuelta en 50 ml de extracto de carne que inhibiría el crecimiento de una cepa estándar de Staphylococcus aureus (el Staphylococcus de Oxford ). El estándar de referencia era un lote grande de penicilina impura almacenada en Oxford . [25] El ensayo fue modificado posteriormente por el grupo de Florey para convertirlo en un "ensayo de taza" más reproducible: en este ensayo, se definió que una solución de penicilina contenía una unidad/ml de penicilina cuando 339 microlitros de la solución colocados en una "taza" sobre una placa de agar sólido producían una zona de 24 milímetros de inhibición del crecimiento del Staphylococcus de Oxford. [26] : 107 [27] [28]
- Primer estándar internacional (1944). En el Instituto Nacional de Investigación Médica de Mill Hill, en Londres, se almacenó un único lote de 8 gramos de penicilina G sódica cristalina pura (el estándar internacional). Una unidad de penicilina se definió como 0,6 microgramos del estándar internacional. También se definió un "estándar de trabajo" impuro, que estaba disponible en cantidades mucho mayores y se distribuía por todo el mundo: una unidad del estándar de trabajo era de 2,7 microgramos (la cantidad por unidad era mucho mayor debido a las impurezas). Al mismo tiempo, se perfeccionó el ensayo de copa, donde en lugar de especificar un diámetro de zona de 24 mm, el tamaño de la zona se representó gráficamente frente a una curva de referencia para proporcionar una lectura de la potencia. [28] [13] [29]
- Segundo estándar internacional (1953). Se obtuvo un único lote de 30 gramos de penicilina G sódica cristalina pura, que también se almacenó en Mill Hill. Una unidad de penicilina se definió como 0,5988 microgramos del segundo estándar internacional. [30]
Existe una unidad más antigua para la penicilina V que no es equivalente a la unidad actual de penicilina V. La razón es que la FDA de los EE. UU. asumió incorrectamente que la potencia de la penicilina V es la misma mol por mol que la de la penicilina G. De hecho, la penicilina V es menos potente que la penicilina G, y la unidad actual de penicilina V refleja ese hecho.
- Primera unidad internacional de penicilina V (1959). Una unidad de penicilina V se definió como 0,590 microgramos de un estándar de referencia conservado en Mill Hill, Londres. [31] Esta unidad está ahora obsoleta.
También se estableció una norma similar para la penicilina K. [32]
Tipos
Las penicilinas constan de un anillo beta-lactámico distintivo de 4 miembros , además de un anillo tiazolida y una cadena lateral R. La principal característica distintiva entre las variantes dentro de esta familia es el sustituyente R.
Esta cadena lateral está conectada al residuo de ácido 6-aminopenicilánico y da lugar a variaciones en el espectro antimicrobiano, la estabilidad y la susceptibilidad a las betalactamasas de cada tipo.
Penicilinas naturales
La penicilina G (bencilpenicilina) se produjo por primera vez a partir de un hongo penicillium que se encuentra en la naturaleza. La cepa de hongo que se utiliza actualmente para la fabricación de penicilina G se creó mediante ingeniería genética para mejorar el rendimiento del proceso de fabricación. Ninguna de las otras penicilinas naturales (F, K, N, X, O, U1 o U6) se encuentra actualmente en uso clínico.
Penicilina semisintética
En esta sección falta información sobre el motivo. Es necesario tomar información de la sección Historia del artículo de PV sobre cómo genera más por arte de magia. ( Diciembre de 2022 ) |
La penicilina V (fenoximetilpenicilina) se produce añadiendo el precursor ácido fenoxiacético al medio en el que se cultiva una cepa genéticamente modificada [ dudoso – discutir ] del hongo penicillium .
Antibióticos creados a partir de 6-APA
Existen tres grupos principales de otros antibióticos semisintéticos relacionados con las penicilinas. Se sintetizan añadiendo varias cadenas laterales al precursor 6-APA , que se aísla de la penicilina G. Se trata de los antibióticos antiestafilocócicos, los antibióticos de amplio espectro y los antibióticos antipseudomónicos.
Antibióticos antiestafilocócicos
- Cloxacilina (por vía oral o por inyección)
- Dicloxacilina (por vía oral o por inyección)
- Flucloxacilina (por vía oral o por inyección)
- Meticilina (solo inyección)
- Nafcilina (solo inyección)
- Oxacilina (por vía oral o por inyección)
Los antibióticos antiestafilocócicos se denominan así porque son resistentes a la degradación por la penicilinasa estafilocócica . Por ello, también se los denomina resistentes a la penicilinasa.
Antibióticos de amplio espectro
Este grupo de antibióticos se denomina de "amplio espectro" porque son activos contra una amplia gama de bacterias gramnegativas como Escherichia coli y Salmonella typhi , para las que la penicilina no es adecuada. Sin embargo, en la actualidad es frecuente la aparición de resistencias en estos organismos.
Existen muchos precursores de la ampicilina. Se trata de compuestos inactivos que se descomponen en el intestino para liberar ampicilina. Ninguno de estos profármacos de la ampicilina se encuentra en uso actualmente:
- Pivampicilina (éster pivaloiloximetílico de ampicilina)
- Bacampicilina
- Metampicilina (éster de formaldehído de ampicilina)
- Talampicilina
- Hetacilina (ampicilina conjugada con acetona)
La epicilina es una aminopenicilina que nunca ha tenido un uso clínico generalizado.
Antibióticos antipseudomónicos
La especie gramnegativa Pseudomonas aeruginosa es naturalmente resistente a muchas clases de antibióticos. En los años 1960 y 1970 se hicieron muchos esfuerzos para desarrollar antibióticos que fueran activos contra las especies de Pseudomonas . Hay dos clases químicas dentro del grupo: carboxipenicilinas y ureidopenicilinas. Todas se administran mediante inyección: ninguna puede administrarse por vía oral.
Carboxipenicilinas
Ureidopenicilinas
Inhibidores de la β-lactamasa
Uso médico
El término "penicilina", cuando se utiliza solo, puede referirse a cualquiera de dos compuestos químicos , penicilina G o penicilina V.
| Nombre común | Nombre químico | Modo de administración |
|---|---|---|
| Penicilina V | fenoximetilpenicilina | oral |
| Penicilina G | bencilpenicilina | intramuscular intravenosa |
Penicilina G
La penicilina G se destruye con el ácido del estómago, por lo que no se puede administrar por vía oral, pero se pueden administrar dosis de hasta 2,4 g (mucho más altas que la penicilina V). Se administra por inyección intravenosa o intramuscular. Puede formularse como una sal insoluble, y existen dos formulaciones de este tipo en uso actualmente: penicilina procaínica y bencilpenicilina benzatínica . Cuando se debe mantener una alta concentración en la sangre, la penicilina G debe administrarse a intervalos relativamente frecuentes, porque se elimina con bastante rapidez del torrente sanguíneo por los riñones.
La penicilina G está autorizada para su uso en el tratamiento de la septicemia , empiema , neumonía , pericarditis , endocarditis y meningitis causadas por cepas susceptibles de estafilococos y estreptococos. También está autorizada para el tratamiento del ántrax , la actinomicosis , la enfermedad cervicofacial, la enfermedad torácica y abdominal, las infecciones por clostridios , el botulismo , la gangrena gaseosa (con desbridamiento y/o cirugía acompañantes según se indique), el tétanos (como terapia complementaria a la inmunoglobulina antitetánica humana), la difteria (como terapia complementaria a la antitoxina y para la prevención del estado de portador), la endocarditis por erisipelotrix , la fusoespiroquetosis (infecciones graves de la orofaringe, el tracto respiratorio inferior y el área genital), las infecciones por Listeria , la meningitis, la endocarditis, las infecciones por Pasteurella , incluidas la bacteriemia y la meningitis, la fiebre de Haverhill ; fiebre por mordedura de rata e infecciones gonocócicas diseminadas , meningitis meningocócica y/o septicemia causadas por organismos sensibles a la penicilina y sífilis. [33]
Penicilina V
La penicilina V se puede tomar por vía oral porque es relativamente resistente al ácido del estómago. Las dosis superiores a 500 mg no son totalmente eficaces debido a su mala absorción. Se utiliza para las mismas infecciones bacterianas que la penicilina G y es la forma de penicilina más utilizada. [34] Sin embargo, no se utiliza para enfermedades, como la endocarditis , en las que se requieren altos niveles de penicilina en sangre.
Susceptibilidad bacteriana
Debido a que la resistencia a la penicilina es tan común en la actualidad, otros antibióticos son la opción preferida para los tratamientos. Por ejemplo, la penicilina solía ser el tratamiento de primera línea para las infecciones por Neisseria gonorrhoeae y Neisseria meningitidis , pero ya no se recomienda para el tratamiento de estas infecciones. La resistencia a la penicilina es ahora muy común en Staphylococcus aureus , lo que significa que la penicilina no debe usarse para tratar infecciones causadas por S. aureus a menos que se sepa que la cepa infectante es susceptible.
| Bacteria | Susceptible (S) | Intermedio (I) | Resistente (R) |
|---|---|---|---|
| Estafilococo áureo | ≤0,12 mcg/ml | - | ≥0,25 mcg/ml |
| Meningitis por estreptococo pneumoniae | ≤0,06 mcg/ml | - | ≥0,12 mcg/ml |
| Streptococcus pneumoniae (no meningitis) | ≤2 mcg/ml | ≥8 mcg/ml | |
| Grupo de Streptococcus Viridans | 0,12 mcg/ml | 0,25–2 mcg/ml | 4 mcg/ml |
| Listeria monocytogenes | ≤2 mcg/ml | - | - |
| Bacillus anthracis | ≤0,12 mcg/ml | - | ≥0,25 mcg/ml |
Efectos secundarios
Las reacciones adversas comunes (≥ 1% de las personas) asociadas con el uso de penicilinas incluyen diarrea , hipersensibilidad , náuseas , erupción cutánea , neurotoxicidad , urticaria y sobreinfección (incluida candidiasis ). Los efectos adversos poco frecuentes (0,1-1% de las personas) incluyen fiebre , vómitos , eritema , dermatitis , angioedema , convulsiones (especialmente en personas con epilepsia ) y colitis pseudomembranosa . [35] La penicilina también puede inducir enfermedad del suero o una reacción similar a la enfermedad del suero en algunas personas. La enfermedad del suero es una reacción de hipersensibilidad de tipo III que ocurre de una a tres semanas después de la exposición a medicamentos, incluida la penicilina. No es una verdadera alergia a medicamentos, porque las alergias son reacciones de hipersensibilidad de tipo I , pero la exposición repetida al agente agresor puede provocar una reacción anafiláctica. [36] [37] La alergia se presenta en el 1-10% de las personas, como una erupción cutánea después de la exposición. La anafilaxia mediada por IgE se presenta en aproximadamente el 0,01% de los pacientes. [38] [35]
El dolor y la inflamación en el lugar de la inyección también son comunes en el caso de la bencilpenicilina benzatínica, la bencilpenicilina y, en menor medida, la bencilpenicilina procaínica administradas por vía parenteral . La afección se conoce como dermatitis livedoide o síndrome de Nicolau. [39] [40]
Estructura
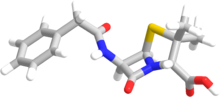
El término " penam " se utiliza para describir el esqueleto central común de un miembro de las penicilinas. Este núcleo tiene la fórmula molecular RC 9 H 11 N 2 O 4 S, donde R es la cadena lateral variable que diferencia a las penicilinas entre sí. El núcleo de penam tiene una masa molar de 243 g/mol, y las penicilinas más grandes tienen una masa molar cercana a 450; por ejemplo, la cloxacilina tiene una masa molar de 436 g/mol. El 6-APA (C 8 H 12 N 2 O 3 S) forma la estructura básica de las penicilinas. Está formado por un dipéptido encerrado formado por la condensación de L -cisteína y D -valina . Esto da como resultado la formación de anillos β-lactámicos y tiazolidínicos. [41]
La característica estructural clave de las penicilinas es el anillo de β-lactama de cuatro miembros; esta fracción estructural es esencial para la actividad antibacteriana de la penicilina. El anillo de β-lactama está fusionado a su vez a un anillo de tiazolidina de cinco miembros . La fusión de estos dos anillos hace que el anillo de β-lactama sea más reactivo que las β-lactamas monocíclicas porque los dos anillos fusionados distorsionan el enlace amida de la β-lactama y, por lo tanto, eliminan la estabilización por resonancia que normalmente se encuentra en estos enlaces químicos. [42] Una cadena lateral del lado acilo unida al anillo de β-lactama. [43]
Se han producido diversos antibióticos β-lactámicos tras la modificación química de la estructura 6-APA durante la síntesis, concretamente mediante la realización de sustituciones químicas en la cadena lateral acilo. Por ejemplo, la primera penicilina alterada químicamente, la meticilina, tenía sustituciones por grupos metoxi en las posiciones 2' y 6' del anillo bencénico 6-APA de la penicilina G. [41] Esta diferencia hace que la meticilina sea resistente a la actividad de la β-lactamasa , una enzima por la que muchas bacterias son naturalmente insensibles a las penicilinas. [44]
Farmacología
Entrada en bacterias
La penicilina puede entrar fácilmente en las células bacterianas en el caso de las especies Gram-positivas . Esto se debe a que las bacterias Gram-positivas no tienen una membrana celular externa y simplemente están encerradas en una pared celular gruesa . [45] Las moléculas de penicilina son lo suficientemente pequeñas como para pasar a través de los espacios de las glicoproteínas en la pared celular. Por esta razón, las bacterias Gram-positivas son muy susceptibles a la penicilina (como se evidenció por primera vez con el descubrimiento de la penicilina en 1928 [46] ). [47]
La penicilina, o cualquier otra molécula, entra en las bacterias Gram-negativas de una manera diferente. Las bacterias tienen paredes celulares más delgadas, pero la superficie externa está recubierta con una membrana celular adicional, llamada membrana externa. La membrana externa es una capa lipídica ( cadena de lipopolisacáridos ) que bloquea el paso de moléculas solubles en agua ( hidrófilas ) como la penicilina. Por lo tanto, actúa como la primera línea de defensa contra cualquier sustancia tóxica, que es la razón de la resistencia relativa a los antibióticos en comparación con las especies Gram-positivas. [48] Pero la penicilina todavía puede entrar en las especies Gram-negativas difundiéndose a través de canales acuosos llamados porinas (proteínas de membrana externa), que se dispersan entre las moléculas grasas y pueden transportar nutrientes y antibióticos a las bacterias. [49] Las porinas son lo suficientemente grandes para permitir la difusión de la mayoría de las penicilinas, pero la velocidad de difusión a través de ellas está determinada por el tamaño específico de las moléculas del fármaco. Por ejemplo, la penicilina G es grande y entra a través de las porinas lentamente; mientras que la ampicilina y la amoxicilina, más pequeñas, se difunden mucho más rápido. [50] Por el contrario, la vancomicina de gran tamaño no puede atravesar las porinas y, por lo tanto, no es eficaz para las bacterias gramnegativas. [51] El tamaño y la cantidad de porinas son diferentes en las distintas bacterias. Como resultado de los dos factores (tamaño de la penicilina y porina), las bacterias gramnegativas pueden ser insensibles o tener un grado variable de sensibilidad a una penicilina específica. [52]
Mecanismo de acción


La penicilina mata las bacterias al inhibir la finalización de la síntesis de peptidoglicanos , el componente estructural de la pared celular bacteriana . Inhibe específicamente la actividad de las enzimas que son necesarias para la reticulación de los peptidoglicanos durante el paso final en la biosíntesis de la pared celular. Lo hace uniéndose a las proteínas de unión de penicilina con el anillo β-lactámico, una estructura que se encuentra en las moléculas de penicilina. [54] [55] Esto hace que la pared celular se debilite debido a menos enlaces cruzados y significa que el agua fluye sin control hacia la célula porque no puede mantener el gradiente osmótico correcto. Esto resulta en lisis celular y muerte.
Las bacterias remodelan constantemente sus paredes celulares de peptidoglicano, construyendo y descomponiendo simultáneamente porciones de la pared celular a medida que crecen y se dividen. Durante las últimas etapas de la biosíntesis de peptidoglicano, se forma el pentapéptido de ácido N -acetilmurámico-difosfato de uridina (UDP-MurNAc), en el que el cuarto y quinto aminoácidos son ambos D -alanil- D -alanina. La transferencia de D -alanina se realiza (cataliza) por la enzima DD -transpeptidasa ( las proteínas de unión a la penicilina son este tipo). [50] La integridad estructural de la pared celular bacteriana depende de la reticulación de UDP-MurNAc y N -acetilglucosamina. [56] La penicilina y otros antibióticos β-lactámicos actúan como un análogo de D -alanina- D -alanina (el dipéptido) en UDP-MurNAc debido a similitudes conformacionales. La DD -transpeptidasa se une entonces al anillo β-lactámico de cuatro miembros de la penicilina en lugar de UDP-MurNAc. [50] Como consecuencia, la DD -transpeptidasa se inactiva, la formación de enlaces cruzados entre UDP-MurNAc y N -acetil glucosamina se bloquea, de modo que se desarrolla un desequilibrio entre la producción y degradación de la pared celular, lo que hace que la célula muera rápidamente. [57]
Las enzimas que hidrolizan los enlaces cruzados de peptidoglicano continúan funcionando, incluso mientras que las que forman dichos enlaces cruzados no lo hacen. Esto debilita la pared celular de la bacteria y la presión osmótica se vuelve cada vez más descompensada, lo que finalmente causa la muerte celular ( citólisis ). Además, la acumulación de precursores de peptidoglicano desencadena la activación de hidrolasas y autolisinas de la pared celular bacteriana, que digieren aún más los peptidoglicanos de la pared celular. El pequeño tamaño de las penicilinas aumenta su potencia, al permitirles penetrar toda la profundidad de la pared celular. Esto contrasta con los antibióticos glucopeptídicos vancomicina y teicoplanina , que son mucho más grandes que las penicilinas. [58]
Las bacterias grampositivas se denominan protoplastos cuando pierden sus paredes celulares. Las bacterias gramnegativas no pierden sus paredes celulares por completo y se denominan esferoplastos después del tratamiento con penicilina. [53]
La penicilina muestra un efecto sinérgico con los aminoglucósidos , ya que la inhibición de la síntesis de peptidoglicano permite que los aminoglucósidos penetren la pared celular bacteriana con mayor facilidad, lo que permite que alteren la síntesis de proteínas bacterianas dentro de la célula. Esto da como resultado una menor CMB en los organismos susceptibles. [59]
Las penicilinas, al igual que otros antibióticos β -lactámicos, bloquean no sólo la división de bacterias, incluidas las cianobacterias , sino también la división de las cianelas, los orgánulos fotosintéticos de las glaucófitas , y la división de los cloroplastos de las briofitas . Por el contrario, no tienen efecto sobre los plástidos de las plantas vasculares altamente desarrolladas . Esto apoya la teoría endosimbiótica de la evolución de la división de plástidos en plantas terrestres. [60]
Algunas bacterias producen enzimas que descomponen el anillo de β-lactama, llamadas β-lactamasas , que hacen que las bacterias sean resistentes a la penicilina. Por lo tanto, algunas penicilinas se modifican o se administran con otros medicamentos para su uso contra bacterias resistentes a los antibióticos o en pacientes inmunodeprimidos. El uso de ácido clavulánico o tazobactam, inhibidores de β-lactamasa, junto con penicilina proporciona actividad de penicilina contra bacterias productoras de β-lactamasa. Los inhibidores de β-lactamasa se unen irreversiblemente a la β-lactamasa impidiendo que descomponga los anillos de β-lactama en la molécula de antibiótico. Alternativamente, la flucloxacilina es una penicilina modificada que tiene actividad contra las bacterias productoras de β-lactamasa debido a una cadena lateral de acilo que protege el anillo de β-lactama de la β-lactamasa. [38]
Farmacocinética
La penicilina tiene una baja unión a las proteínas plasmáticas. La biodisponibilidad de la penicilina depende del tipo: la penicilina G tiene una biodisponibilidad baja, inferior al 30%, mientras que la penicilina V tiene una biodisponibilidad más alta, entre el 60 y el 70%. [61]
La penicilina tiene una vida media corta y se excreta por vía renal. [61] Esto significa que debe administrarse al menos cuatro veces al día para mantener niveles adecuados de penicilina en la sangre. Por lo tanto, los primeros manuales sobre el uso de la penicilina recomendaban inyecciones de penicilina con una frecuencia de hasta tres horas, y se ha descrito que la dosificación de penicilina es similar a intentar llenar una bañera sin el tapón. [8] Esto ya no es necesario, ya que se pueden conseguir dosis mucho mayores de penicilina de forma barata y sencilla; sin embargo, algunas autoridades recomiendan el uso de infusiones continuas de penicilina por este motivo. [62]
Resistencia
Cuando Alexander Fleming descubrió la penicilina cruda en 1928, una observación importante que hizo fue que muchas bacterias no eran afectadas por la penicilina. [46] Este fenómeno fue descubierto por Ernst Chain y Edward Abraham mientras intentaban identificar la composición exacta de la penicilina. En 1940, descubrieron que las bacterias no susceptibles como Escherichia coli producían enzimas específicas que pueden descomponer las moléculas de penicilina, haciéndolas resistentes al antibiótico. Llamaron a la enzima penicilinasa . [63] La penicilinasa ahora se clasifica como miembro de las enzimas llamadas β-lactamasas. Estas β-lactamasas están presentes de forma natural en muchas otras bacterias, y muchas bacterias las producen tras la exposición constante a los antibióticos. En la mayoría de las bacterias, la resistencia puede ser a través de tres mecanismos diferentes: permeabilidad reducida en las bacterias, afinidad de unión reducida de las proteínas de unión a la penicilina (PBP) o destrucción del antibiótico a través de la expresión de β-lactamasa. [64] Al utilizar cualquiera de estos, las bacterias comúnmente desarrollan resistencia a diferentes antibióticos, un fenómeno llamado resistencia a múltiples fármacos .
El proceso real del mecanismo de resistencia puede ser muy complejo. En caso de permeabilidad reducida en bacterias, los mecanismos son diferentes entre bacterias Gram-positivas y Gram-negativas. En bacterias Gram-positivas, el bloqueo de la penicilina se debe a cambios en la pared celular. Por ejemplo, la resistencia a la vancomicina en S. aureus se debe a la síntesis adicional de peptidoglicano que hace que la pared celular sea mucho más gruesa impidiendo la entrada efectiva de la penicilina. [47] La resistencia en bacterias Gram-negativas se debe a variaciones mutacionales en la estructura y número de porinas. [52] En bacterias como Pseudomonas aeruginosa , hay un número reducido de porinas; mientras que en bacterias como especies de Enterobacter , Escherichia coli y Klebsiella pneumoniae , hay porinas modificadas como porinas no específicas (como los grupos OmpC y OmpF) que no pueden transportar penicilina. [65]
La resistencia debida a alteraciones de PBP es muy variada. Un caso común se encuentra en Streptococcus pneumoniae donde hay mutación en el gen de PBP, y las PBP mutantes tienen una afinidad de unión reducida para las penicilinas. [66] Hay seis PBP mutantes en S. pneumoniae , de las cuales PBP1a, PBP2b, PBP2x y a veces PBP2a son responsables de la afinidad de unión reducida. [67] S. aureus puede activar un gen oculto que produce una PBP diferente, PBD2, que tiene una baja afinidad de unión para las penicilinas. [68] Hay una cepa diferente de S. aureus llamada S. aureus resistente a la meticilina (MRSA) que es resistente no solo a la penicilina y otras β-lactámicas, sino también a la mayoría de los antibióticos. La cepa bacteriana se desarrolló después de la introducción de la meticilina en 1959. [44] En MRSA, las mutaciones en los genes ( sistema mec ) para PBP producen una proteína variante llamada PBP2a (también denominada PBP2'), [69] mientras se producen cuatro PBP normales. PBP2a tiene poca afinidad de unión para la penicilina y también carece de la actividad de glicosiltransferasa requerida para la síntesis completa de peptidoglicano (que se lleva a cabo por las cuatro PBP normales). [67] En Helicobacter cinaedi , hay múltiples mutaciones en diferentes genes que producen variantes de PBP. [70]
La destrucción enzimática por las β-lactamasas es el mecanismo más importante de resistencia a la penicilina, [71] y se describe como "la mayor amenaza para el uso [de penicilinas]". [72] Fue el primer mecanismo descubierto de resistencia a la penicilina. Durante los experimentos cuando se realizaron pruebas de purificación y actividad biológica de la penicilina en 1940, se encontró que E. coli no era susceptible. [73] La razón se descubrió como la producción de una enzima penicilinasa (de ahí, la primera β-lactamasa conocida) en E. coli que degrada fácilmente la penicilina. [63] Hay más de 2.000 tipos de β-lactamasas, cada una de las cuales tiene una secuencia de aminoácidos única y, por lo tanto, actividad enzimática. [72] Todas ellas pueden hidrolizar anillos de β-lactama, pero sus sitios objetivo exactos son diferentes. [74] Se secretan en la superficie bacteriana en grandes cantidades en las bacterias grampositivas, pero en menor medida en las gramnegativas. Por lo tanto, en una infección bacteriana mixta, las bacterias grampositivas pueden proteger a las células gramnegativas, que de otro modo serían susceptibles a la penicilina. [50]
Existen mecanismos inusuales en P. aeruginosa , en los cuales puede haber resistencia mediada por biopelícula y formación de células persistentes tolerantes a múltiples fármacos . [75]
Historia
Descubrimiento
.jpg/440px-Sample_of_penicillin_mould_presented_by_Alexander_Fleming_to_Douglas_Macleod,_1935_(9672239344).jpg)
A partir de finales del siglo XIX se empezaron a publicar informes sobre las propiedades antibacterianas del moho Penicillium , pero los científicos no pudieron discernir qué proceso estaba causando el efecto. [76] El médico escocés Alexander Fleming, del St. Mary's Hospital de Londres (ahora parte del Imperial College ), fue el primero en demostrar que el Penicillium rubens tenía propiedades antibacterianas. [77] El 3 de septiembre de 1928 observó por casualidad que la contaminación fúngica de un cultivo bacteriano ( Staphylococcus aureus ) parecía matar las bacterias. Confirmó esta observación con un nuevo experimento el 28 de septiembre de 1928. [78] [79] Publicó su experimento en 1929 y llamó a la sustancia antibacteriana (el extracto fúngico) penicilina. [46]
CJ La Touche identificó el hongo como Penicillium rubrum (posteriormente reclasificado por Charles Thom como P. notatum y P. chrysogenum , pero luego corregido como P. rubens ). [80] Fleming expresó optimismo inicial de que la penicilina sería un antiséptico útil, debido a su alta potencia y toxicidad mínima en comparación con otros antisépticos de la época, y señaló su valor de laboratorio en el aislamiento de Bacillus influenzae (ahora llamado Haemophilus influenzae ). [81] [82]
Fleming no convenció a nadie de la importancia de su descubrimiento. [81] Esto se debió en gran medida a que la penicilina era tan difícil de aislar que su desarrollo como fármaco parecía imposible. Se especula que si Fleming hubiera tenido más éxito a la hora de despertar el interés de otros científicos por su trabajo, la penicilina posiblemente se habría desarrollado años antes. [81]
La importancia de su trabajo ha sido reconocida con la colocación de un Monumento Químico Histórico Internacional en el Museo Laboratorio Alexander Fleming en Londres el 19 de noviembre de 1999. [83]
Desarrollo y aplicación médica

En 1930, Cecil George Paine, un patólogo del Royal Infirmary de Sheffield , trató con éxito la oftalmía neonatal , una infección gonocócica en bebés, con penicilina (extracto de hongos) el 25 de noviembre de 1930. [84] [85] [86]
En 1940, el científico australiano Howard Florey (más tarde Barón Florey) y un equipo de investigadores ( Ernst Chain , Edward Abraham , Arthur Duncan Gardner , Norman Heatley , Margaret Jennings , Jean Orr-Ewing y Arthur Gordon Sanders) de la Escuela de Patología Sir William Dunn de la Universidad de Oxford lograron avances en la elaboración de penicilina concentrada a partir de caldo de cultivo fúngico que mostró una acción bactericida tanto in vitro como in vivo . [87] [88] En 1941, trataron a un policía, Albert Alexander , con una infección facial grave; su condición mejoró, pero luego se agotaron los suministros de penicilina y murió. Posteriormente, varios otros pacientes fueron tratados con éxito. [89] En diciembre de 1942, los sobrevivientes del incendio de Cocoanut Grove en Boston fueron los primeros pacientes con quemaduras en ser tratados con éxito con penicilina. [90]
El primer uso exitoso de penicilina pura fue en 1942, cuando Fleming curó a Harry Lambert de una infección del sistema nervioso ( meningitis estreptocócica ) que de otra manera habría sido fatal. En ese momento, el equipo de Oxford solo pudo producir una pequeña cantidad. Florey le dio voluntariamente la única muestra disponible a Fleming. Lambert mostró una mejoría desde el día siguiente del tratamiento y se curó por completo en una semana. [91] [92] Fleming publicó su ensayo clínico en The Lancet en 1943. [7] Después del avance médico, el Gabinete de Guerra británico creó el Comité de Penicilina el 5 de abril de 1943, que condujo a proyectos para la producción en masa . [93] [94]
Producción en masa
Una vez establecida la aplicación médica, el equipo de Oxford descubrió que era imposible producir cantidades utilizables en su laboratorio. [89] Al no poder persuadir al gobierno británico, Florey y Heatley viajaron a los EE. UU. en junio de 1941 con sus muestras de moho para interesar al gobierno estadounidense en la producción a gran escala. [95] Se acercaron al Laboratorio de Investigación Regional del Norte del USDA (NRRL, ahora el Centro Nacional para la Investigación de Utilización Agrícola ) en Peoria, Illinois, donde se establecieron instalaciones para fermentaciones a gran escala. [96] El cultivo masivo del moho y la búsqueda de mejores mohos siguieron inmediatamente. [95]
El 14 de marzo de 1942, el primer paciente fue tratado por sepsis estreptocócica con penicilina de fabricación estadounidense producida por Merck & Co. [97] La mitad del suministro total producido en ese momento se utilizó en esa paciente, Anne Miller. [98] Para junio de 1942, solo había suficiente penicilina estadounidense disponible para tratar a diez pacientes. [99] En julio de 1943, la Junta de Producción de Guerra elaboró un plan para la distribución masiva de existencias de penicilina a las tropas aliadas que luchaban en Europa. [100] Los resultados de la investigación de fermentación en licor de maceración de maíz en el NRRL permitieron a los Estados Unidos producir 2,3 millones de dosis a tiempo para la invasión de Normandía en la primavera de 1944. Después de una búsqueda mundial en 1943, se encontró que un melón mohoso en un mercado de Peoria, Illinois, contenía la mejor cepa de moho para la producción utilizando el proceso de licor de maceración de maíz. [101] El científico de Pfizer Jasper H. Kane sugirió utilizar un método de fermentación en tanques profundos para producir grandes cantidades de penicilina de calidad farmacéutica. [102] [26] : 109 La producción a gran escala fue el resultado del desarrollo de una planta de fermentación en tanques profundos por parte de la ingeniera química Margaret Hutchinson Rousseau . [103] Como resultado directo de la guerra y de la Junta de Producción de Guerra, en junio de 1945, se producían más de 646 mil millones de unidades por año. [100]
G. Raymond Rettew hizo una contribución significativa al esfuerzo bélico estadounidense con sus técnicas para producir cantidades comerciales de penicilina, en las que combinó su conocimiento de las semillas de hongos con la función del separador de crema de Sharples. [104] En 1943, el laboratorio de Rettew producía la mayor parte de la penicilina del mundo. Durante la Segunda Guerra Mundial , la penicilina marcó una diferencia importante en el número de muertes y amputaciones causadas por heridas infectadas entre las fuerzas aliadas , salvando aproximadamente entre el 12 y el 15 % de las vidas. [105] Sin embargo, la disponibilidad estaba severamente limitada por la dificultad de fabricar grandes cantidades de penicilina y por la rápida depuración renal del fármaco, lo que requería una dosificación frecuente. Los métodos para la producción en masa de penicilina fueron patentados por Andrew Jackson Moyer en 1945. [106] [107] [108] Florey no había patentado la penicilina, habiendo sido advertido por Sir Henry Dale de que hacerlo sería poco ético. [89]
La penicilina se excreta activamente y aproximadamente el 80% de una dosis de penicilina se elimina del cuerpo en tres o cuatro horas desde su administración. De hecho, durante la era temprana de la penicilina, el fármaco era tan escaso y tan valorado que se hizo común recolectar la orina de los pacientes que estaban siendo tratados, de modo que la penicilina presente en la orina pudiera aislarse y reutilizarse. [109] Esta no fue una solución satisfactoria, por lo que los investigadores buscaron una forma de ralentizar la excreción de penicilina. Esperaban encontrar una molécula que pudiera competir con la penicilina por el transportador de ácido orgánico responsable de la excreción, de modo que el transportador excretara preferentemente la molécula competidora y la penicilina quedara retenida. El agente uricosúrico probenecid resultó ser adecuado. Cuando el probenecid y la penicilina se administran juntos, el probenecid inhibe competitivamente la excreción de penicilina, aumentando la concentración de penicilina y prolongando su actividad. Con el tiempo, la aparición de técnicas de producción en masa y penicilinas semisintéticas resolvió los problemas de suministro, por lo que el uso de probenecid disminuyó. [109] Sin embargo, el probenecid sigue siendo útil para ciertas infecciones que requieren concentraciones particularmente altas de penicilinas. [110]
Después de la Segunda Guerra Mundial, Australia fue el primer país que puso el fármaco a disposición de la población civil. En los Estados Unidos, la penicilina se puso a disposición del público en general el 15 de marzo de 1945. [111]
Fleming, Florey y Chain compartieron el Premio Nobel de Fisiología o Medicina de 1945 por el desarrollo de la penicilina.
- Un técnico preparando penicilina en 1943
- La penicilina se empezó a producir en masa en 1944.
- Cartel de la Segunda Guerra Mundial que ensalza el uso de la penicilina
- Dorothy Hodgkin determinó la estructura química de la penicilina.
Determinación de la estructura y síntesis total
.jpg/440px-Molecular_model_of_Penicillin_by_Dorothy_Hodgkin_(9663803982).jpg)
La estructura química de la penicilina fue propuesta por primera vez por Edward Abraham en 1942 [87] y luego fue confirmada en 1945 mediante cristalografía de rayos X por Dorothy Crowfoot Hodgkin , quien también trabajaba en Oxford. [112] Más tarde, en 1964, recibió el Premio Nobel de Química por esta y otras determinaciones de estructura.
El químico John C. Sheehan del Instituto Tecnológico de Massachusetts (MIT) completó la primera síntesis química de penicilina en 1957. [113] [114] [115] Sheehan había comenzado sus estudios sobre la síntesis de penicilina en 1948, y durante estas investigaciones desarrolló nuevos métodos para la síntesis de péptidos , así como nuevos grupos protectores —grupos que enmascaran la reactividad de ciertos grupos funcionales. [115] [116] Aunque la síntesis inicial desarrollada por Sheehan no era apropiada para la producción en masa de penicilinas, uno de los compuestos intermedios en la síntesis de Sheehan fue el ácido 6-aminopenicilánico (6-APA), el núcleo de la penicilina. [113] [114] [115] [117]
El 6-APA fue descubierto por investigadores de los Laboratorios de Investigación Beecham (posteriormente el Grupo Beecham ) en Surrey en 1957 (publicado en 1959). [118] La unión de diferentes grupos al "núcleo" 6-APA de la penicilina permitió la creación de nuevas formas de penicilinas que son más versátiles y tienen mejor actividad. [119]
Evolución de la penicilina
El estrecho espectro de enfermedades tratables o "espectro de actividad" de las penicilinas, junto con la escasa actividad de la fenoximetilpenicilina, activa por vía oral, condujo a la búsqueda de derivados de la penicilina que pudieran tratar una gama más amplia de infecciones. El aislamiento del 6-APA, el núcleo de la penicilina, permitió la preparación de penicilinas semisintéticas, con diversas mejoras respecto de la bencilpenicilina (biodisponibilidad, espectro, estabilidad, tolerancia).
El primer gran desarrollo fue la ampicilina en 1961. Ofrecía un espectro de actividad más amplio que cualquiera de las penicilinas originales. El desarrollo posterior produjo penicilinas resistentes a la β-lactamasa, incluyendo flucloxacilina, dicloxacilina y meticilina. Estas fueron importantes por su actividad contra especies bacterianas productoras de β-lactamasa, pero fueron ineficaces contra las cepas de Staphylococcus aureus resistente a la meticilina (MRSA) que surgieron posteriormente. [120]
Otro desarrollo de la línea de penicilinas verdaderas fueron las penicilinas antipseudomonas, como la carbenicilina, la ticarcilina y la piperacilina, útiles por su actividad contra bacterias gramnegativas. Sin embargo, la utilidad del anillo β-lactámico fue tal que los antibióticos relacionados, entre ellos las mecillinas, los carbapenémicos y, más importante, las cefalosporinas, aún lo conservan en el centro de sus estructuras. [121]
Producción

La penicilina se produce por la fermentación de varios tipos de azúcar por el hongo Penicillium rubens . [122] El proceso de fermentación produce penicilina como metabolito secundario cuando el crecimiento del hongo se inhibe por estrés. [122] La vía biosintética descrita a continuación experimenta una inhibición por retroalimentación que involucra al subproducto l -lisina que inhibe la enzima homocitrato sintasa . [123]
- α-cetoglutarato + AcCoA → homocitrato → ácido L -α-aminoadípico → L -lisina + β-lactámico
Las células de Penicillium se cultivan mediante una técnica denominada cultivo en lotes alimentados , en la que las células se someten constantemente a estrés, que es necesario para la inducción de la producción de penicilina. Mientras que el uso de glucosa como fuente de carbono reprime las enzimas de biosíntesis de penicilina, la lactosa no ejerce ningún efecto y los niveles de pH alcalinos anulan esta regulación. El exceso de fosfato , oxígeno disponible y el uso de amonio como fuente de nitrógeno reprimen la producción de penicilina, mientras que la metionina puede actuar como única fuente de nitrógeno/azufre con efectos estimulantes. [124]
El método biotecnológico de evolución dirigida se ha aplicado para producir mediante mutación un gran número de cepas de Penicillium . Estas técnicas incluyen PCR propensa a errores , reordenamiento de ADN , ITCHY y PCR de superposición de cadenas .
Biosíntesis

En general, hay tres pasos principales e importantes para la biosíntesis de la penicilina G (bencilpenicilina).
- El primer paso es la condensación de tres aminoácidos : ácido L -α-aminoadípico, L -cisteína, L -valina en un tripéptido . [125] [126] [127] Antes de condensarse en el tripéptido, el aminoácido L -valina debe sufrir epimerización para convertirse en D -valina. [128] [129] El tripéptido condensado se llama δ-( L -α-aminoadipil) -L -cisteína - D -valina (ACV). La reacción de condensación y la epimerización son catalizadas por la enzima δ-( L -α-aminoadipil) -L -cisteína -D -valina sintetasa (ACVS), una sintetasa de péptidos no ribosómicos o NRPS.
- El segundo paso en la biosíntesis de la penicilina G es la conversión oxidativa del ACV lineal en el intermediario bicíclico isopenicilina N por la isopenicilina N sintasa (IPNS), que está codificada por el gen pcbC . [125] [126] La isopenicilina N es un intermediario muy débil, porque no muestra una fuerte actividad antibiótica. [128]
- El paso final es una transamidación por la isopenicilina N N-aciltransferasa , en la que se elimina la cadena lateral α-aminoadipilo de la isopenicilina N y se intercambia por una cadena lateral fenilacetilo . Esta reacción está codificada por el gen penDE , que es único en el proceso de obtención de penicilinas. [125]
Véase también
Referencias
- ^ Walling AD (15 de septiembre de 2006). «Consejos de otras revistas: uso de antibióticos durante el embarazo y la lactancia». American Family Physician . 74 (6): 1035. Archivado desde el original el 15 de diciembre de 2016 . Consultado el 25 de septiembre de 2015 .
- ^ "Monumentos químicos históricos nacionales de la Sociedad Química Estadounidense. Producción de penicilina mediante fermentación en tanques profundos". Sociedad Química Estadounidense . 2008-06-12. Archivado desde el original el 2020-10-24 . Consultado el 2022-06-15 .
- ^ Barreiro C, García-Estrada C (abril de 2019). "Proteómica y Penicillium chrysogenum: Desvelando los secretos detrás de la producción de penicilina". Journal of Proteomics . 198 . Elsevier: 119–31. doi :10.1016/j.jprot.2018.11.006. PMID 30414515. S2CID 53250114.
- ^ Meštrović T (29 de agosto de 2018). "Producción de penicilina". Noticias Ciencias Médicas de la Vida . Archivado desde el original el 4 de abril de 2023. Consultado el 15 de junio de 2022 .
- ^ Wanat M, Anthierens S, Butler CC, Savic L, Savic S, Pavitt SH, et al. (junio de 2021). "Manejo de la alergia a la penicilina en atención primaria: un estudio cualitativo con pacientes y médicos de atención primaria". BMC Family Practice . 22 (1): 112. doi : 10.1186/s12875-021-01465-1 . PMC 8194168 . PMID 34116641.
- ^ Lalchhandama K (2020). "Reevaluación de los mocos y el moho de Fleming". Science Vision . 20 (1): 29–42. doi : 10.33493/scivis.20.01.03 .
- ^ ab Fleming A (1943). "Meningitis estreptocócica tratada con penicilina". The Lancet . 242 (6267): 434–38. doi :10.1016/S0140-6736(00)87452-8.
- ^ abcdefgh Robinson FA (julio de 1947). "Química de la penicilina". The Analyst . 72 (856): 274–76. Bibcode :1947Ana....72..274R. doi :10.1039/an9477200274. PMID 20259048.
- ^ Diggins FW (1999). "La verdadera historia del descubrimiento de la penicilina, con refutación de la desinformación en la literatura". British Journal of Biomedical Science . 56 (2): 83–93. PMID 10695047.
- ^ Krylov AK (1929). "[Aspectos gastroenterológicos del cuadro clínico de las enfermedades internas]". Terapevticheskii Arkhiv . 63 (2): 139–41. PMC 2041430 . PMID 2048009. ; Reimpreso como Fleming A (1979). "Sobre la acción antibacteriana de cultivos de Penicillium, con especial referencia a su uso en el aislamiento de B. influenzae". British Journal of Experimental Pathology . 60 (1): 3–13. JSTOR 4452419. PMC 2041430 .
- ^ Fleming A (1945). «Nobel Lecture». www.nobelprize.org . Archivado (PDF) del original el 31 de marzo de 2018. Consultado el 19 de julio de 2020 .
- ^ Patrick GL (2017). Química medicinal (6.ª ed.). Oxford, Reino Unido: Oxford University Press. pág. 425. ISBN 978-0198749691.
- ^ ab "Recomendaciones de la Conferencia Internacional sobre Penicilina". Science . 101 (2611): 42–43. 1945-01-12. Bibcode :1945Sci...101...42.. doi :10.1126/science.101.2611.42. PMID 17758593.
- ^ Comité de Investigación Médica, Consejo de Investigación Médica (1945). "Química de la penicilina". Science . 102 (2660). Asociación Estadounidense para el Avance de la Ciencia: 627–29. Bibcode :1945Sci...102..627M. doi :10.1126/science.102.2660.627. ISSN 0036-8075. JSTOR 1673446. PMID 17788243. Archivado desde el original el 9 de mayo de 2022 . Consultado el 9 de mayo de 2022 .
- ^ Eagle H (julio de 1946). "La actividad relativa de las penicilinas F, G, K y X contra espiroquetas y estreptococos in vitro". Journal of Bacteriology . 52 (1): 81–88. doi :10.1128/JB.52.1.81-88.1946. PMC 518141 . PMID 16561156.
- ^ "Penicilina F". PubChem . Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina. Archivado desde el original el 7 de mayo de 2021 . Consultado el 26 de diciembre de 2020 .
- ^ "Penicilina G". PubChem . Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina. Archivado desde el original el 25 de diciembre de 2020 . Consultado el 26 de diciembre de 2020 .
- ^ "Penicilina X". PubChem . Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina. Archivado desde el original el 5 de mayo de 2021 . Consultado el 26 de diciembre de 2020 .
- ^ "Penicilina K". PubChem . Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina. Archivado desde el original el 2021-05-06 . Consultado el 2020-12-26 .
- ^ "Penicilina O". PubChem . Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina. Archivado desde el original el 5 de mayo de 2021 . Consultado el 26 de diciembre de 2020 .
- ^ Fishman LS, Hewitt WL (septiembre de 1970). "Las penicilinas naturales". Clínicas Médicas de Norteamérica . 54 (5): 1081–99. doi :10.1016/S0025-7125(16)32579-2. PMID 4248661.
- ^ Genus Pharmaceuticals (30 de noviembre de 2020). "Polvo inyectable de bencilpenicilina sódica de 1200 mg". Compendio electrónico de medicamentos . Datapharm Ltd. Archivado desde el original el 15 de enero de 2021. Consultado el 28 de diciembre de 2020 .
- ^ Sandoz GmbH. «Penicillin-VK» (PDF) . FDA de EE. UU. Archivado (PDF) del original el 21 de enero de 2021. Consultado el 28 de diciembre de 2020 .
- ^ "Penicilina, 5000 unidades Oxford". Museo Nacional de Historia Estadounidense . Centro Behring, Washington, DC. Archivado desde el original el 6 de mayo de 2021. Consultado el 28 de diciembre de 2020 .
- ^ Robinson GL (febrero de 1947). "Penicilina en la práctica general". Revista Médica de Postgrado . 23 (256): 86–92. doi :10.1136/pgmj.23.256.86. PMC 2529492 . PMID 20284177.
- ^ ab Greenwood D (2008). Medicamentos antimicrobianos: una crónica de un triunfo médico del siglo XX . Oxford, Reino Unido: Oxford University Press. p. 107. ISBN 978-0-19-953484-5.
- ^ Abraham EP, Chain E, Fletcher CM, Gardner AD, Heatley NG, Jennings MA, et al. (1941). "Observaciones adicionales sobre la penicilina". Lancet . 238 (6155): 177–189. doi :10.1016/S0140-6736(00)72122-2.
- ^ ab Foster JW, Woodruff HB (agosto de 1943). "Aspectos microbiológicos de la penicilina: I. Métodos de ensayo". Journal of Bacteriology . 46 (2): 187–202. doi :10.1128/JB.46.2.187-202.1943. PMC 373803 . PMID 16560688.
- ^ Hartley P (junio de 1945). "Estándar mundial y unidad para la penicilina". Science . 101 (2634): 637–38. Bibcode :1945Sci...101..637H. doi :10.1126/science.101.2634.637. PMID 17844083.
- ^ Humphrey JH, Musset MV, Perry WL (1953). "El segundo estándar internacional para la penicilina". Boletín de la Organización Mundial de la Salud . 9 (1): 15–28. PMC 2542105 . PMID 13082387.
- ^ Humphrey JH, Lightbown JW, Mussett MV (1959). «Estándar internacional para la fenoximetilpenicilina». Boletín de la Organización Mundial de la Salud . 20 (6): 1221–27. PMC 2537888. PMID 14405369 .
- ^ Humphrey JH, Lightbown JW (1954). "La preparación de referencia internacional de penicilina K". Boletín de la Organización Mundial de la Salud . 10 (6): 895–99. PMC 2542178 . PMID 13199652.
- ^ "Inyección de penicilina G potásica, USP" (PDF) . FDA de EE. UU. Julio de 2016. Archivado (PDF) del original el 2021-04-01 . Consultado el 2020-12-28 .
- ^ Pandey N, Cascella M (2020), "Antibióticos beta-lactámicos", StatPearls , Treasure Island (FL): StatPearls Publishing, PMID 31424895, archivado desde el original el 2020-12-15 , consultado el 2021-01-05
- ^ ab Rossi S, ed. (2006). Manual de medicamentos australianos . Adelaida: Manual de medicamentos australianos. ISBN 978-0-9757919-2-9.
- ^ Bhattacharya S (enero de 2010). "Los hechos sobre la alergia a la penicilina: una revisión". Revista de tecnología farmacéutica avanzada e investigación . 1 (1): 11–17. doi : 10.4103/2231-4040.70513 . PMC 3255391 . PMID 22247826.
- ^ Blumenthal KG, Peter JG, Trubiano JA, Phillips EJ (enero de 2019). "Alergia a los antibióticos". Lancet . 393 (10167): 183–98. doi :10.1016/S0140-6736(18)32218-9. PMC 6563335 . PMID 30558872.
- ^ ab Hitchings A, Lonsdale D, Burrage D, Baker E (2015). Los 100 medicamentos más utilizados: farmacología clínica y prescripción práctica . Churchill Livingstone. págs. 174–81. ISBN 978-0-7020-5516-4.
- ^ Kim KK, Chae DS (2015). "Síndrome de Nicolau: una revisión de la literatura". Revista Mundial de Dermatología . 4 (2): 103. doi : 10.5314/wjd.v4.i2.103 .
- ^ Saputo V, Bruni G (1998). "[Síndrome de Nicolau causado por preparaciones de penicilina: revisión de la literatura en busca de posibles factores de riesgo]". La Pediatria Medica e Chirurgica . 20 (2): 105–23. PMID 9706633.
- ^ ab Fernandes R, Amador P, Prudêncio C (2013). "β-Lactamas: estructura química, modo de acción y mecanismos de resistencia". Reseñas en Microbiología Médica . 24 (1): 7–17. doi : 10.1097/MRM.0b013e3283587727 . hdl : 10400.22/7041 .
- ^ Nicolaou (1996), pág. 43.
- ^ Fisher JF, Mobashery S (octubre de 2009). "Tres décadas de la acil-enzima beta-lactamasa de clase A". Current Protein & Peptide Science . 10 (5): 401–07. doi :10.2174/138920309789351967. PMC 6902449 . PMID 19538154.
- ^ ab Morell EA, Balkin DM (diciembre de 2010). "Staphylococcus aureus resistente a la meticilina: un patógeno generalizado que destaca la necesidad de desarrollar nuevos antimicrobianos". The Yale Journal of Biology and Medicine . 83 (4): 223–33. PMC 3002151 . PMID 21165342.
- ^ Silhavy TJ, Kahne D, Walker S (mayo de 2010). "La envoltura celular bacteriana". Cold Spring Harbor Perspectives in Biology . 2 (5): a000414. doi :10.1101/cshperspect.a000414. PMC 2857177 . PMID 20452953.
- ^ abc Fleming A (1929). "Sobre la acción antibacteriana de cultivos de un Penicillium, con especial referencia a su uso en el aislamiento de B. influenzæ". British Journal of Experimental Pathology . 10 (3): 226–36. PMC 2048009 . Reimpreso como Fleming A (1980). "Clásicos en enfermedades infecciosas: sobre la acción antibacteriana de cultivos de un penicillium, con especial referencia a su uso en el aislamiento de B. influenzae por Alexander Fleming, Reimpreso de British Journal of Experimental Pathology 10:226–36, 1929". Reseñas de enfermedades infecciosas . 2 (1): 129–39. doi :10.1093/clinids/2.1.129. PMC 2041430 . PMID 6994200.
- ^ ab Lambert PA (2002). "Impermeabilidad celular y absorción de biocidas y antibióticos en bacterias grampositivas y micobacterias". Journal of Applied Microbiology . 92 (Supl.): 46S–54S. doi :10.1046/j.1365-2672.92.5s1.7.x. PMID 12000612. S2CID 24067247.
- ^ Vergalli J, Bodrenko IV, Masi M, Moynié L, Acosta-Gutiérrez S, Naismith JH, et al. (marzo de 2020). "Porinas y translocación de moléculas pequeñas a través de la membrana externa de bacterias Gram-negativas" (PDF) . Nature Reviews. Microbiología . 18 (3): 164–76. doi :10.1038/s41579-019-0294-2. PMID 31792365. S2CID 208520700. Archivado (PDF) desde el original el 22 de octubre de 2021 . Consultado el 30 de julio de 2021 .
- ^ Masi M, Winterhalter M, Pagès JM (2019). "Porinas de la membrana externa". Paredes celulares y membranas bacterianas . Bioquímica subcelular. Vol. 92. págs. 79–123. doi :10.1007/978-3-030-18768-2_4. ISBN 978-3-030-18767-5. Número de identificación personal 31214985. Número de identificación personal 195066847.
- ^ abcd Soares GM, Figueiredo LC, Faveri M, Cortelli SC, Duarte PM, Feres M (2012). "Mecanismos de acción de los antibióticos sistémicos utilizados en el tratamiento periodontal y mecanismos de resistencia bacteriana a estos fármacos". Revista de Ciencias Orales Aplicadas . 20 (3): 295–309. doi :10.1590/s1678-77572012000300002. PMC 3881775 . PMID 22858695.
- ^ Antonoplis A, Zang X, Wegner T, Wender PA, Cegelski L (septiembre de 2019). "El conjugado de vancomicina-arginina inhibe el crecimiento de E. coli resistente a carbapenémicos y actúa sobre la síntesis de la pared celular". ACS Chemical Biology . 14 (9): 2065–70. doi :10.1021/acschembio.9b00565. PMC 6793997 . PMID 31479234.
- ^ ab Breijyeh Z, Jubeh B, Karaman R (marzo de 2020). "Resistencia de las bacterias gramnegativas a los agentes antibacterianos actuales y enfoques para resolverla". Moléculas . 25 (6): 1340. doi : 10.3390/molecules25061340 . PMC 7144564 . PMID 32187986.
- ^ ab Cushnie TP, O'Driscoll NH, Lamb AJ (diciembre de 2016). "Cambios morfológicos y ultraestructurales en células bacterianas como indicador del mecanismo de acción antibacteriano". Ciencias de la vida celular y molecular . 73 (23): 4471–92. doi :10.1007/s00018-016-2302-2. hdl : 10059/2129 . PMC: 11108400. PMID : 27392605. S2CID: 2065821. Archivado desde el original el 2017-10-07 . Consultado el 2019-10-10 .
- ^ Yocum RR, Rasmussen JR, Strominger JL (mayo de 1980). "El mecanismo de acción de la penicilina. La penicilina acila el sitio activo de la carboxipeptidasa de D-alanina de Bacillus stearothermophilus". The Journal of Biological Chemistry . 255 (9): 3977–86. doi : 10.1016/S0021-9258(19)85621-1 . PMID 7372662.
- ^ "Bencilpenicilina". www.drugbank.ca . Archivado desde el original el 23 de enero de 2019 . Consultado el 22 de enero de 2019 .
- ^ DeMeester KE, Liang H, Jensen MR, Jones ZS, D'Ambrosio EA, Scinto SL, et al. (agosto de 2018). "Síntesis de ácidos N-acetilmurámicos funcionalizados para investigar el reciclaje y la biosíntesis de la pared celular bacteriana". Revista de la Sociedad Química Estadounidense . 140 (30): 9458–65. doi :10.1021/jacs.8b03304. PMC 6112571. PMID 29986130 .
- ^ Gordon E, Mouz N, Duée E, Dideberg O (junio de 2000). "La estructura cristalina de la proteína de unión a penicilina 2x de Streptococcus pneumoniae y su forma acil-enzima: implicación en la resistencia a fármacos". Journal of Molecular Biology . 299 (2): 477–85. doi :10.1006/jmbi.2000.3740. PMID 10860753.
- ^ Van Bambeke F, Lambert D, Mingeot-Leclercq MP, Tulkens P (1999). Mecanismo de acción (PDF) . Archivado (PDF) desde el original el 25 de enero de 2022 . Consultado el 13 de marzo de 2014 .
- ^ Winstanley TG, Hastings JG (febrero de 1989). "Sinergia de penicilina-aminoglucósido y efecto post-antibiótico para enterococos". The Journal of Antimicrobial Chemotherapy . 23 (2): 189–99. doi :10.1093/jac/23.2.189. PMID 2708179.
- ^ Kasten B, Reski R (30 de marzo de 1997). "Los antibióticos β-lactámicos inhiben la división de cloroplastos en un musgo (Physcomitrella patens) pero no en el tomate (Lycopersicon esculentum)". Journal of Plant Physiology . 150 (1–2): 137–40. Bibcode :1997JPPhy.150..137K. doi :10.1016/S0176-1617(97)80193-9. Archivado desde el original el 21 de julio de 2011 . Consultado el 30 de marzo de 2009 .
- ^ ab Levison ME, Levison JH (diciembre de 2009). "Farmacocinética y farmacodinámica de agentes antibacterianos". Clínicas de enfermedades infecciosas de Norteamérica . 23 (4): 791–815, vii. doi :10.1016/j.idc.2009.06.008. PMC 3675903. PMID 19909885 .
- ^ Walton AL, Howden BP, Grayson LM, Korman TM (mayo de 2007). "Terapia domiciliaria con penicilina en infusión continua para infecciones graves debidas a patógenos sensibles a la penicilina". Revista internacional de agentes antimicrobianos . 29 (5): 544–48. doi :10.1016/j.ijantimicag.2006.10.018. PMID 17398076.
- ^ ab Abraham EP, Chain E (1940). "Una enzima de bacterias capaz de destruir la penicilina. 1940". Reseñas de enfermedades infecciosas . 10 (4): 677–78. Bibcode :1940Natur.146..837A. doi : 10.1038/146837a0 . PMID 3055168. S2CID 4070796.
- ^ Rice LB (febrero de 2012). "Mecanismos de resistencia y relevancia clínica de la resistencia a β-lactáminas, glicopéptidos y fluoroquinolonas". Mayo Clinic Proceedings . 87 (2): 198–208. doi :10.1016/j.mayocp.2011.12.003. PMC 3498059 . PMID 22305032.
- ^ Pagès JM, James CE, Winterhalter M (diciembre de 2008). "La porina y el antibiótico permeante: una barrera de difusión selectiva en bacterias gramnegativas" (PDF) . Nature Reviews. Microbiology . 6 (12): 893–903. doi :10.1038/nrmicro1994. PMID 18997824. S2CID 6969441. Archivado (PDF) desde el original el 23 de noviembre de 2018 . Consultado el 30 de julio de 2021 .
- ^ Jacobs MR (mayo de 1999). "Streptococcus pneumoniae resistente a fármacos: opciones racionales de antibióticos". The American Journal of Medicine . 106 (5A): 19S–25S, discusión 48S–52S. doi :10.1016/s0002-9343(98)00351-9. PMID 10348060.
- ^ ab Zapun A, Contreras-Martel C, Vernet T (marzo de 2008). "Proteínas de unión a penicilina y resistencia a beta-lactamas". FEMS Microbiology Reviews . 32 (2): 361–85. doi : 10.1111/j.1574-6976.2007.00095.x . PMID 18248419.
- ^ Peacock SJ, Paterson GK (2015). "Mecanismos de resistencia a la meticilina en Staphylococcus aureus" (PDF) . Revisión anual de bioquímica . 84 : 577–601. doi :10.1146/annurev-biochem-060614-034516. PMID 26034890.
- ^ Reygaert W (2009). «Staphylococcus aureus resistente a la meticilina (MRSA): aspectos moleculares de la resistencia y virulencia a los antimicrobianos». Clinical Laboratory Science . 22 (2): 115–19. PMID 19534446. Archivado desde el original el 2021-01-12 . Consultado el 2021-01-08 .
- ^ Rimbara E, Mori S, Kim H, Suzuki M, Shibayama K (febrero de 2018). "Las mutaciones en los genes que codifican las proteínas de unión a la penicilina y las bombas de eflujo desempeñan un papel en la resistencia a las β-lactámicas en Helicobacter cinaedi". Agentes antimicrobianos y quimioterapia . 62 (2): e02036-17. doi :10.1128/AAC.02036-17. PMC 5786776 . PMID 29203490.
- ^ Tooke CL, Hinchliffe P, Bragginton EC, Colenso CK, Hirvonen VH, Takebayashi Y, et al. (agosto de 2019). "β-Lactamasas e inhibidores de β-Lactamasa en el siglo XXI". Revista de Biología Molecular . 431 (18): 3472–3500. doi :10.1016/j.jmb.2019.04.002. PMC 6723624 . PMID 30959050.
- ^ ab Bonomo RA (enero de 2017). "β-Lactamasas: un enfoque en los desafíos actuales". Cold Spring Harbor Perspectives in Medicine . 7 (1): a025239. doi :10.1101/cshperspect.a025239. PMC 5204326 . PMID 27742735.
- ^ Davies J, Davies D (septiembre de 2010). "Orígenes y evolución de la resistencia a los antibióticos". Microbiology and Molecular Biology Reviews . 74 (3): 417–33. doi :10.1128/MMBR.00016-10. PMC 2937522 . PMID 20805405.
- ^ Bush K (octubre de 2018). "Perspectivas pasadas y presentes sobre las β-lactamasas". Agentes antimicrobianos y quimioterapia . 62 (10): e01076-18. doi :10.1128/AAC.01076-18. PMC 6153792. PMID 30061284 .
- ^ Pang Z, Raudonis R, Glick BR, Lin TJ, Cheng Z (2019). "Resistencia a los antibióticos en Pseudomonas aeruginosa: mecanismos y estrategias terapéuticas alternativas". Avances en biotecnología . 37 (1): 177–92. doi : 10.1016/j.biotechadv.2018.11.013 . PMID 30500353.
- ^ Dougherty TJ, Pucci MJ (2011). Descubrimiento y desarrollo de antibióticos . Springer Science & Business Media. págs. 79–80.
- ^ Landau R, Achilladelis B, Scriabine A (1999). Innovación farmacéutica: revolucionando la salud humana . Chemical Heritage Foundation. pág. 162.
- ^ Haven KF (1994). Maravillas de la ciencia: 50 lecturas fascinantes de 5 minutos . Littleton, Colorado: Libraries Unlimited. pág. 182. ISBN 978-1-56308-159-0.
- ^ Boucher HW, Talbot GH, Benjamin DK, Bradley J, Guidos RJ, Jones RN, et al. (junio de 2013). "10 x '20 Progress – development of new drugs active against gram-negative bacilli: an update from the Infectious Diseases Society of America" (Progreso 10 x '20: desarrollo de nuevos fármacos activos contra bacilos gramnegativos: una actualización de la Sociedad de Enfermedades Infecciosas de Estados Unidos). Enfermedades infecciosas clínicas . 56 (12): 1685–94. doi :10.3201/eid2305.161556. PMC 5403050. PMID 23599308 .
- ^ Houbraken J, Frisvad JC, Samson RA (junio de 2011). "La cepa productora de penicilina de Fleming no es Penicillium chrysogenum sino P. rubens". Hongo IMA . 2 (1): 87–95. doi :10.5598/imafungus.2011.02.01.12. PMC 3317369 . PMID 22679592.
- ^ abc Lax E (2004). El moho en el abrigo del Dr. Florey: la historia del milagro de la penicilina. Holt Paperbacks. ISBN 978-0-8050-7778-0.
- ^ Krylov AK (1991). "[Aspectos gastroenterológicos del cuadro clínico de las enfermedades internas]". Terapevticheskii Arkhiv . 63 (2): 139–41. PMID 2048009.
- ^ "Descubrimiento y desarrollo de la penicilina". Lugares históricos químicos internacionales . Sociedad Química Estadounidense. Archivado desde el original el 28 de junio de 2019. Consultado el 21 de agosto de 2018 .
- ^ Wainwright M, Swan HT (enero de 1986). "CG Paine y los primeros registros clínicos que sobreviven de la terapia con penicilina". Historia médica . 30 (1): 42–56. doi :10.1017/S0025727300045026. PMC 1139580 . PMID 3511336.
- ^ Howie J (julio de 1986). "Penicilina: 1929-40". British Medical Journal . 293 (6540): 158–59. doi :10.1136/bmj.293.6540.158. PMC 1340901 . PMID 3089435.
- ^ Wainwright M (enero de 1987). "La historia del uso terapéutico de la penicilina cruda". Medical History . 31 (1): 41–50. doi :10.1017/s0025727300046305. PMC 1139683 . PMID 3543562.
- ^ ab Jones DS, Jones JH (1 de diciembre de 2014). «Sir Edward Penley Abraham CBE. 10 de junio de 1913 – 9 de mayo de 1999». Memorias biográficas de miembros de la Royal Society . 60 : 5–22. doi :10.1098/rsbm.2014.0002. ISSN 0080-4606. S2CID 71557916. Archivado desde el original el 26 de noviembre de 2023. Consultado el 10 de mayo de 2017 .
- ^ "Ernst B. Chain – Conferencia Nobel: La estructura química de las penicilinas". www.nobelprize.org . Archivado desde el original el 2017-04-30 . Consultado el 2017-05-10 .
- ^ abc "Hacer posible la penicilina: Norman Heatley recuerda". ScienceWatch . Thomson Scientific . 2007. Archivado desde el original el 21 de febrero de 2007 . Consultado el 13 de febrero de 2007 .
- ^ Levy SB (2002). La paradoja de los antibióticos: cómo el mal uso de los antibióticos destruye sus poderes curativos . Da Capo Press. pp. 5–7. ISBN 978-0-7382-0440-6.
- ^ Bennett JW, Chung KT (2001). "Alexander Fleming y el descubrimiento de la penicilina". Avances en microbiología aplicada . 49. Elsevier: 163–84. doi :10.1016/s0065-2164(01)49013-7. ISBN . 978-0-12-002649-4. Número de identificación personal 11757350.
- ^ Cairns H, Lewin WS, Duthie ES, Smith H (1944). "Meningitis neumocócica tratada con penicilina". The Lancet . 243 (6299): 655–59. doi :10.1016/S0140-6736(00)77085-1.
- ^ Mathews JA (2008). "El nacimiento de la era de la biotecnología: la penicilina en Australia, 1943-1980". Prometheus . 26 (4): 317-33. doi :10.1080/08109020802459306. S2CID 143123783.
- ^ Baldry P (1976). La batalla contra las bacterias: una nueva mirada. Archivo CUP. p. 115. ISBN 978-0-521-21268-7Archivado desde el original el 5 de mayo de 2021. Consultado el 31 de diciembre de 2020 .
- ^ ab Boucher HW, Talbot GH, Benjamin DK, Bradley J, Guidos RJ, Jones RN, et al. (junio de 2013). "10 x '20 Progress--development of new drugs active against gram-negative bacilli: an update from the Infectious Diseases Society of America" (Progreso 10 x '20: desarrollo de nuevos fármacos activos contra bacilos gramnegativos: una actualización de la Sociedad de Enfermedades Infecciosas de Estados Unidos). Enfermedades infecciosas clínicas . 56 (12): 1685–94. doi :10.1093/cid/cit152. PMC 3707426. PMID 23599308 .
- ^ Carroll A (2 de junio de 2014). "Aquí es donde la penicilina llega a Peoria". HistoryNet . Archivado desde el original el 7 de enero de 2021. Consultado el 4 de enero de 2021 .
- ^ Grossman CM (julio de 2008). "El primer uso de penicilina en los Estados Unidos". Anales de Medicina Interna . 149 (2): 135–36. doi :10.7326/0003-4819-149-2-200807150-00009. PMID 18626052. S2CID 40197907.
- ^ Rothman L (14 de marzo de 2016). «Historia de la penicilina: qué le pasó al primer paciente estadounidense». Time . Archivado desde el original el 17 de marzo de 2019. Consultado el 12 de marzo de 2019 .
- ^ Mailer JS, Mason B. "Penicilina: la droga milagrosa de la medicina en tiempos de guerra y su producción en Peoria, Illinois". lib.niu.edu. Archivado desde el original el 7 de octubre de 2018. Consultado el 11 de febrero de 2008 .
- ^ ab Parascandola J (1980). La historia de los antibióticos: un simposio . Instituto Americano de Historia de la Farmacia N.º 5. ISBN 978-0-931292-08-8.
- ^ "La historia de la penicilina y los antibióticos". ThoughtCo . Archivado desde el original el 8 de abril de 2023. Consultado el 9 de junio de 2024 .
- ^ Lehrer S (2006). Exploradores del cuerpo: avances espectaculares en medicina desde la antigüedad hasta la ciencia moderna (2.ª ed.). Nueva York: iUniverse. pp. 329–30. ISBN 978-0-595-40731-6.
- ^ Madhavan G (20 de agosto de 2015). Piense como un ingeniero. Oneworld Publications. págs. 83-85, 91-93. ISBN 978-1-78074-637-1Archivado desde el original el 23 de marzo de 2017 . Consultado el 20 de noviembre de 2016 .
- ^ "Marcador histórico de G. Raymond Rettew". ExplorePAhistory.com . Archivado desde el original el 5 de enero de 2020. Consultado el 27 de junio de 2019 .
- ^ Goyotte D (2017). "El legado quirúrgico de la Segunda Guerra Mundial. Parte II: La era de los antibióticos" (PDF) . The Surgical Technologist . 109 : 257–64. Archivado (PDF) desde el original el 2021-05-05 . Consultado el 2021-01-08 .
- ^ US 2442141, Moyer AJ, "Método para la producción de penicilina", emitido el 25 de marzo de 1948, asignado a Agricultura de EE. UU.
- ^ US 2443989, Moyer AJ, "Método para la producción de penicilina", emitido el 22 de junio de 1948, asignado a Agricultura de EE. UU.
- ^ US 2476107, Moyer AJ, "Método para la producción de penicilina", emitido el 12 de julio de 1949, asignado a Agricultura de EE. UU.
- ^ ab Silverthorn DU (2004). Fisiología humana: un enfoque integrado (3.ª ed.). Upper Saddle River (Nueva Jersey): Pearson Education. ISBN 978-0-8053-5957-2.
- ^ Luque Paz D, Lakbar I, Tattevin P (marzo de 2021). "Una revisión de las estrategias de tratamiento actuales para la endocarditis infecciosa". Revisión experta de la terapia antiinfecciosa . 19 (3): 297–307. doi :10.1080/14787210.2020.1822165. PMID 32901532. S2CID 221572394.
- ^ "Descubrimiento y desarrollo de la penicilina". American Chemical Society . 1999. Archivado desde el original el 3 de enero de 2015. Consultado el 4 de enero de 2015 .
- ^ "El Premio Nobel de Química 1964". NobelPrize.org . Archivado desde el original el 16 de julio de 2017. Consultado el 9 de mayo de 2022 .
- ^ ab Sheehan JC, Henery-Logan KR (5 de marzo de 1957). "La síntesis total de penicilina V". Revista de la Sociedad Química Americana . 79 (5): 1262–63. doi :10.1021/ja01562a063.
- ^ ab Sheehan JC, Henery-Loganm KR (20 de junio de 1959). "La síntesis total de penicilina V". Revista de la Sociedad Química Americana . 81 (12): 3089–94. doi :10.1021/ja01521a044.
- ^ abc Corey EJ , Roberts JD . «Memorias biográficas: John Clark Sheehan». The National Academy Press. Archivado desde el original el 3 de marzo de 2016. Consultado el 28 de enero de 2013 .
- ^ Nicolaou KC , Vourloumis D, Winssinger N, Baran PS (enero de 2000). "El arte y la ciencia de la síntesis total en los albores del siglo XXI". Angewandte Chemie . 39 (1): 44–122. doi :10.1002/(SICI)1521-3773(20000103)39:1<44::AID-ANIE44>3.0.CO;2-L. PMID 10649349.
- ^ "El profesor John C. Sheehan muere a los 76 años". MIT News . 1 de abril de 1992. Archivado desde el original el 30 de junio de 2008 . Consultado el 28 de enero de 2013 .
- ^ Batchelor FR, Doyle FP, Nayler JH, Rolinson GN (enero de 1959). "Síntesis de penicilina: ácido 6-aminopenicilánico en fermentaciones de penicilina". Nature . 183 (4656): 257–58. Bibcode :1959Natur.183..257B. doi :10.1038/183257b0. PMID 13622762. S2CID 4268993.
- ^ Rolinson GN, Geddes AM (enero de 2007). "El 50 aniversario del descubrimiento del ácido 6-aminopenicilánico (6-APA)". Revista internacional de agentes antimicrobianos . 29 (1): 3–8. doi :10.1016/j.ijantimicag.2006.09.003. PMID 17137753.
- ^ Colley EW, Mcnicol MW, Bracken PM (marzo de 1965). "Estafilococos resistentes a la meticilina en un hospital general". Lancet . 1 (7385): 595–97. doi :10.1016/S0140-6736(65)91165-7. PMID 14250094.
- ^ James CW, Gurk-Turner C (enero de 2001). "Reactividad cruzada de antibióticos betalactámicos". Actas . 14 (1): 106–07. doi :10.1080/08998280.2001.11927741. PMC 1291320 . PMID 16369597.
- ^ ab Kosalková K, Sánchez-Orejas IC, Cueto L, García-Estrada C (2021). "Fermentación de Penicillium chrysogenum y análisis de bencilpenicilina mediante bioensayo y HPLC". En Barreiro C, Barredo JL (eds.). Terapias antimicrobianas . Métodos en biología molecular. vol. 2296. Nueva York, Nueva York: Springer EE. UU. págs. 195-207. doi :10.1007/978-1-0716-1358-0_11. ISBN 978-1-0716-1357-3. Número PMID 33977449.
- ^ Luengo JM, Revilla G, López MJ, Villanueva JR, Martín JF (diciembre de 1980). "Inhibición y represión de la homocitrato sintasa por lisina en Penicillium chrysogenum". Revista de Bacteriología . 144 (3): 869–76. doi :10.1128/jb.144.3.869-876.1980. PMC 294747 . PMID 6777369.
- ^ Ozcengiz G, Demain AL (1 de marzo de 2013). "Avances recientes en la biosíntesis de penicilinas, cefalosporinas y clavamas y su regulación". Avances en biotecnología . 31 (2): 287–311. doi :10.1016/j.biotechadv.2012.12.001. PMID 23228980.
- ^ abc Al-Abdallah Q, Brakhage AA, Gehrke A, Plattner H, Sprote P, Tuncher A (2004). "Regulación de la biosíntesis de penicilina en hongos filamentosos". En Brakhage AA (ed.). Biotecnología molecular de antibióticos fúngicos betalactámicos y sintetasas de péptidos relacionados . Avances en ingeniería bioquímica/biotecnología. Vol. 88. págs. 45–90. doi :10.1007/b99257. ISBN 978-3-540-22032-9. Número de identificación personal 15719552.
- ^ ab Brakhage AA (septiembre de 1998). "Regulación molecular de la biosíntesis de betalactama en hongos filamentosos". Microbiology and Molecular Biology Reviews . 62 (3): 547–85. doi :10.1128/MMBR.62.3.547-585.1998. PMC 98925 . PMID 9729600.
- ^ Schofield CJ, Baldwin JE, Byford MF, Clifton I, Hajdu J, Hensgens C, et al. (diciembre de 1997). "Proteínas de la vía de biosíntesis de la penicilina". Current Opinion in Structural Biology . 7 (6): 857–64. doi :10.1016/s0959-440x(97)80158-3. PMID 9434907.
- ^ ab Martín JF, Gutiérrez S, Fernández FJ, Velasco J, Fierro F, Marcos AT, et al. (Septiembre de 1994). "Expresión de genes y procesamiento de enzimas para la biosíntesis de penicilinas y cefalosporinas". Antonie van Leeuwenhoek . 65 (3): 227–43. doi :10.1007/BF00871951. PMID 7847890. S2CID 25327312.
- ^ Baker WL, Lonergan GT (diciembre de 2002). "Química de algunos derivados de fluorescamina-amina con relevancia para la biosíntesis de bencilpenicilina por fermentación". Journal of Chemical Technology & Biotechnology . 77 (12): 1283–88. Bibcode :2002JCTB...77.1283B. doi :10.1002/jctb.706.
Lectura adicional
- Dürckheimer W, Blumbach J, Lattrell R, Scheunemann KH (1 de marzo de 1985). "Desarrollos recientes en el campo de los antibióticos β-lactámicos". Angewandte Chemie Edición Internacional en Inglés . 24 (3): 180–202. doi :10.1002/anie.198501801.
- Hamed RB, Gomez-Castellanos JR, Henry L, Ducho C, McDonough MA, Schofield CJ (enero de 2013). "Las e-enzimas de la biosíntesis de β-lactamas". Natural Product Reports . 30 (1): 21–107. doi :10.1039/c2np20065a. PMID 23135477.
- Lax E (2004). El moho en el abrigo del Dr. Florey: la historia del milagro de la penicilina . Henry Holt and Co. ISBN 978-0805067903.
- Nicolaou KC , Corey EJ (1996). Clásicos en síntesis total: objetivos, estrategias, métodos (quinta edición). Weinheim, Alemania: VCH. ISBN 978-3-527-29284-4.
Enlaces externos
- Modelo de la estructura de la penicilina, de Dorothy Hodgkin et al., Museo de Historia de la Ciencia, Oxford
- El descubrimiento de la penicilina, una película producida por el gobierno sobre el descubrimiento de la penicilina por Sir Alexander Fleming y el continuo desarrollo de su uso como antibiótico por Howard Florey y Ernst Boris Chain en YouTube .
- La penicilina en la tabla periódica de vídeos (Universidad de Nottingham)
- "La penicilina que se administre a los civiles costará 35 dólares por paciente", Popular Science , agosto de 1944, artículo al pie de página
- Episodio 2 (de 4): "Medicamentos medicinales" del programa de BBC Four y PBS : Extra Life: A Short History of Living Longer (2021)





