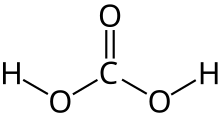
Ácido carbónico
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Ácido carbónico [1] | |
Otros nombres
| |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Química biológica | |
| Araña química | |
| Banco de medicamentos |
|
| Tarjeta informativa de la ECHA | 100.133.015 |
| Número CE |
|
| 25554 | |
| BARRIL | |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| yo 2CO 3 | |
| Apariencia | Gas incoloro |
| Punto de fusión | −53 °C (−63 °F; 220 K) [3] (sublimes) |
| Punto de ebullición | 127 °C (261 °F; 400 K) (se descompone) |
| Reacciona para formar dióxido de carbono y agua. | |
| Acidez (p K a ) |
|
| Base conjugada | Bicarbonato , carbonato |
| Peligros | |
| NFPA 704 (rombo cortafuegos) | |
| Estructura | |
| monoclínico | |
| p21/c, núm. 14 | |
| - | |
a = 5,392 Å, b = 6,661 Å, c = 5,690 Å α = 90°, β = 92,66°, γ = 90° [4] ( D 2CO 3a 1,85 GPa, 298 K) | |
Volumen reticular ( V ) | 204,12 Å3 |
Unidades de fórmula ( Z ) | 4 fórmulas por celda |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El ácido carbónico es un compuesto químico con la fórmula química H2CO3 . La molécula se convierte rápidamente en agua y dióxido de carbono en presencia de agua. Sin embargo, en ausencia de agua, es bastante estable a temperatura ambiente . [5] [6] La interconversión de dióxido de carbono y ácido carbónico está relacionada con el ciclo respiratorio de los animales y la acidificación de las aguas naturales . [4]
En bioquímica y fisiología, el nombre "ácido carbónico" se aplica a veces a soluciones acuosas de dióxido de carbono . Estas especies químicas desempeñan un papel importante en el sistema tampón de bicarbonato , que se utiliza para mantener la homeostasis ácido-base . [7]
Terminología en la literatura bioquímica
En química , el término "ácido carbónico" se refiere estrictamente al compuesto químico con la fórmula H
2CO
3.Algunas publicaciones bioquímicas borran la distinción entre el ácido carbónico y el dióxido de carbono disuelto en el líquido extracelular.
En fisiología , el dióxido de carbono excretado por los pulmones puede denominarse ácido volátil o ácido respiratorio .
Ácido carbónico anhidro
A temperatura ambiente, el ácido carbónico puro es un gas estable. [6] Hay dos métodos principales para producir ácido carbónico anhidro : reacción de cloruro de hidrógeno y bicarbonato de potasio a 100 K en metanol e irradiación de protones de dióxido de carbono sólido puro . [3] Químicamente, se comporta como un ácido de Brønsted diprótico . [8] [9]
Los monómeros de ácido carbónico presentan tres isómeros conformacionales : cis-cis, cis-trans y trans-trans. [10]
A bajas temperaturas y presión atmosférica , el ácido carbónico sólido es amorfo y carece de picos de Bragg en la difracción de rayos X. [11] Pero a alta presión, el ácido carbónico cristaliza y la espectroscopia analítica moderna puede medir su geometría.
Según la difracción de neutrones del ácido carbónico dideuterado ( D
2CO
3) en una celda híbrida sujetada (aleación rusa/ cobre-berilio ) a 1,85 GPa, las moléculas son planas y forman dímeros unidos por pares de enlaces de hidrógeno . Los tres enlaces CO son casi equidistantes a 1,34 Å , intermedios entre las distancias típicas CO y C=O (respectivamente 1,43 y 1,23 Å). Las longitudes inusuales de los enlaces CO se atribuyen a enlaces π deslocalizados en el centro de la molécula y enlaces de hidrógeno extraordinariamente fuertes. Los mismos efectos también inducen una separación O—O muy corta (2,13 Å), a través del ángulo OHO de 136° impuesto por los anillos de 8 miembros doblemente unidos por hidrógeno. [4] Se observan distancias O—O más largas en enlaces de hidrógeno intramoleculares fuertes, por ejemplo en ácido oxálico , donde las distancias superan los 2,4 Å. [11]
En solución acuosa
Incluso en presencia leve de agua, el ácido carbónico se deshidrata a dióxido de carbono y agua , lo que luego cataliza una mayor descomposición. [6] Por esta razón, el dióxido de carbono puede considerarse el anhídrido del ácido carbónico .
La constante de equilibrio de hidratación a 25 °C es[ A
2CO
3]/[CO2 ] ≈ 1,7×10 −3en agua pura [12] y ≈ 1,2×10 −3 en agua de mar . [13] Por lo tanto, la mayoría del dióxido de carbono en las interfaces aire-agua geofísicas o biológicas no se convierte en ácido carbónico, permaneciendo como gas CO 2 disuelto . Sin embargo, el equilibrio no catalizado se alcanza bastante lentamente: las constantes de velocidad son 0,039 s −1 para la hidratación y 23 s −1 para la deshidratación.
En soluciones biológicas
En presencia de la enzima anhidrasa carbónica , el equilibrio se alcanza rápidamente y tiene prioridad la siguiente reacción: [14]
Cuando el dióxido de carbono creado supera su solubilidad, se desprende gas y también debe tenerse en cuenta un tercer equilibrio. La constante de equilibrio para esta reacción está definida por la ley de Henry .
Las dos reacciones se pueden combinar para lograr el equilibrio en solución: Cuando se utiliza la ley de Henry para calcular el denominador, se debe tener cuidado con las unidades, ya que la constante de la ley de Henry se puede expresar comúnmente con 8 dimensionalidades diferentes. [15]
Bajo alto CO2presión parcial
En la industria de las bebidas , el agua con gas o "agua con gas" se suele denominar agua carbonatada . Se elabora disolviendo dióxido de carbono bajo una pequeña presión positiva en agua. Muchos refrescos tratados de la misma manera producen efervescencia .
Cantidades significativas de H molecular
2CO
3existen en soluciones acuosas sometidas a presiones de varios gigapascales (decenas de miles de atmósferas) en el interior de los planetas. [16] [17] Se alcanzan presiones de 0,6-1,6 GPa a 100 K y de 0,75-1,75 GPa a 300 K en los núcleos de grandes satélites helados como Ganímedes , Calisto y Titán , donde hay agua y dióxido de carbono. Se espera que el ácido carbónico puro, al ser más denso, se haya hundido bajo las capas de hielo y las haya separado de los núcleos rocosos de estas lunas. [18]
Relación con el bicarbonato y el carbonato

El ácido carbónico es el ácido conjugado formal de Brønsted–Lowry del anión bicarbonato , estable en solución alcalina . Las constantes de protonación se han medido con gran precisión, pero dependen de la fuerza iónica general I. Los dos equilibrios que se miden más fácilmente son los siguientes: donde los paréntesis indican la concentración de especies . A 25 °C, estos equilibrios satisfacen empíricamente [19] log( β 1 ) disminuye con el aumento de I , al igual que log( β 2 ) . En una solución en ausencia de otros iones (por ejemplo, I = 0 ), estas curvas implican las siguientes constantes de disociación escalonada : Los valores directos para estas constantes en la literatura incluyen p K 1 = 6,35 y p K 2 - p K 1 = 3,49 . [20]
Para interpretar estos números, tenga en cuenta que dos especies químicas en un equilibrio ácido están equiconcentradas cuando p K = p H . En particular, el fluido extracelular ( citosol ) en los sistemas biológicos exhibe un pH H ≈ 7,2 , de modo que el ácido carbónico estará disociado casi en un 50% en el equilibrio.
Acidificación de los océanos

El diagrama de Bjerrum muestra concentraciones típicas de equilibrio, en solución, en agua de mar , de dióxido de carbono y las diversas especies derivadas de él, en función del pH . [8] [9] A medida que la industrialización humana ha aumentado la proporción de dióxido de carbono en la atmósfera de la Tierra , también se espera que aumente la proporción de dióxido de carbono disuelto en el agua de mar y dulce como ácido carbónico. También se espera que este aumento del ácido disuelto acidifique esas aguas, generando una disminución del pH. [21] [22] Se ha estimado que el aumento del dióxido de carbono disuelto ya ha provocado que el pH superficial promedio del océano disminuya aproximadamente 0,1 con respecto a los niveles preindustriales.
Lectura adicional
 "El clima y el ácido carbónico" en Popular Science Monthly , volumen 59, julio de 1901
"El clima y el ácido carbónico" en Popular Science Monthly , volumen 59, julio de 1901- Welch, MJ; Lifton, JF; Seck, JA (1969). "Estudios de trazadores con oxígeno radiactivo-15. Intercambio entre dióxido de carbono y agua". J. Phys. Chem. 73 (335): 3351. doi :10.1021/j100844a033.
- Jolly, WL (1991). Química inorgánica moderna (2.ª ed.). McGraw-Hill. ISBN 978-0-07-112651-9.
- Moore, MH; Khanna, R. (1991). "Estudios infrarrojos y espectrales de masas de hielo de H2O+CO2 irradiado con protones: evidencia de ácido carbónico". Spectrochimica Acta . 47A (2): 255–262. Bibcode :1991AcSpA..47..255M. doi :10.1016/0584-8539(91)80097-3.
- W. Hage, KR Liedl; Liedl, E.; Hallbrucker, A; Mayer, E (1998). "Ácido carbónico en fase gaseosa y su relevancia astrofísica". Science . 279 (5355): 1332–5. Bibcode :1998Sci...279.1332H. doi :10.1126/science.279.5355.1332. PMID 9478889.
- Hage, W.; Hallbrucker, A.; Mayer, E. (1995). "Un polimorfo del ácido carbónico y su posible relevancia astrofísica". J. Chem. Soc. Faraday Trans. 91 (17): 2823–6. Código Bibliográfico :1995JCSFT..91.2823H. doi :10.1039/ft9959102823.
Referencias
- ^ "Front Matter". Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 (Libro azul) . Cambridge: The Royal Society of Chemistry . 2014. págs. P001–4. doi :10.1039/9781849733069-FP001. ISBN . 978-0-85404-182-4.
- ^ abc Perrin, D. D., ed. (1982) [1969]. Constantes de ionización de ácidos y bases inorgánicos en solución acuosa . Datos químicos de la IUPAC (2.ª ed.). Oxford: Pergamon (publicado en 1984). Entrada "Ácido carbónico, H 2 CO 3 ". ISBN 0-08-029214-3. Número de serie LCCN 82-16524.
- ^ ab W. Hage, KR Liedl; Liedl, E.; Hallbrucker, A; Mayer, E (1998). "Ácido carbónico en fase gaseosa y su relevancia astrofísica". Science . 279 (5355): 1332–5. Bibcode :1998Sci...279.1332H. doi :10.1126/science.279.5355.1332. PMID 9478889.
- ^ abc Benz, Sebastian; Chen, Da; Möller, Andreas; Hofmann, Michael; Schnieders, David; Dronskowski, Richard (septiembre de 2022). "La estructura cristalina del ácido carbónico". Inorganics . 10 (9): 132. doi : 10.3390/inorganics10090132 . ISSN 2304-6740.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 310. ISBN 978-0-08-037941-8.
- ^ abc Loerting, Thomas ; Tautermann, Christofer; Kroemer, Romano T.; Kohl, Ingrid; Hallbrucker, Andreas; Mayer, Erwin; Liedl, Klaus R.; Loerting, Thomas; Tautermann, Christofer; Kohl, Ingrid; Hallbrucker, Andreas; Erwin, Mayer; Liedl, Klaus R. (2000). "Sobre la sorprendente estabilidad cinética del ácido carbónico (H 2 CO 3 )". Angewandte Chemie International Edition . 39 (5): 891–4. doi :10.1002/(SICI)1521-3773(20000303)39:5<891::AID-ANIE891>3.0.CO;2-E. PMID 10760883.
- ^ Fisiología ácido-base 2.1 – Equilibrio ácido-base por Kerry Brandis.
- ^ ab Pangotra, Dhananjai; Csepei, Lénárd-István; Roth, Arne; Ponce de León, Carlos; Sieber, Volker; Vieira, Luciana (2022). "Producción anódica de peróxido de hidrógeno utilizando materiales de carbono comerciales". Catálisis Aplicada B: Ambiental . 303 : 120848. doi : 10.1016/j.apcatb.2021.120848. S2CID 240250750.
- ^ ab Andersen, CB (2002). "Comprensión del equilibrio de carbonatos midiendo la alcalinidad en sistemas experimentales y naturales". Journal of Geoscience Education . 50 (4): 389–403. Bibcode :2002JGeEd..50..389A. doi :10.5408/1089-9995-50.4.389. S2CID 17094010.
- ^ Loerting, Thomas; Bernard, Juergen (2010). "Ácido carbónico acuoso (H 2 CO 3 )". ChemPhysChem (11): 2305–9. doi :10.1002/cphc.201000220.
- ^ ab Winkel, Katrin; Hage, Wolfgang; Loerting, Thomas; Price, Sarah L.; Mayer, Erwin (2007). "Ácido carbónico: del poliamorfismo al polimorfismo". Revista de la Sociedad Química Americana . 129 (45): 13863–71. doi :10.1021/ja073594f. PMID 17944463.
- ^ Housecroft, CE; Sharpe, AG (2005). Química inorgánica (2.ª ed.). Prentice-Pearson-Hall. pág. 368. ISBN 0-13-039913-2.OCLC 56834315 .
- ^ Soli, AL; RH Byrne (2002). "Cinética de hidratación y deshidratación del sistema CO2 y relación de equilibrio CO2/H2CO3 en solución acuosa de NaCl ". Química Marina . 78 ( 2–3): 65–73. doi :10.1016/S0304-4203(02)00010-5.
- ^ Lindskog S (1997). "Estructura y mecanismo de la anhidrasa carbónica". Farmacología y terapéutica . 74 (1): 1–20. doi :10.1016/S0163-7258(96)00198-2. PMID 9336012.
- ^ Sander, Rolf; Acree, William E.; Visscher, Alex De; Schwartz, Stephen E.; Wallington, Timothy J. (1 de enero de 2022). «Constantes de la ley de Henry (Recomendaciones IUPAC 2021)». Química pura y aplicada . 94 (1): 71–85. doi : 10.1515/pac-2020-0302 . ISSN 1365-3075.
- ^ Wang, Hongbo; Zeuschner, Janek; Eremets, Mikhail; Troyan, Ivan; Williams, Jonathon (27 de enero de 2016). "H2CO3 sólido y acuoso estable a partir de CO2 y H2O a alta presión y alta temperatura". Scientific Reports . 6 (1): 19902. Bibcode :2016NatSR...619902W. doi : 10.1038/srep19902 . PMC 4728613 . PMID 26813580.
- ^ Stolte, Nore; Pan, Ding (4 de julio de 2019). "Gran presencia de ácido carbónico en fluidos acuosos ricos en CO2 en las condiciones del manto terrestre". The Journal of Physical Chemistry Letters . 10 (17): 5135–41. arXiv : 1907.01833 . doi :10.1021/acs.jpclett.9b01919. PMID 31411889. S2CID 195791860.
- ^ G. Saleh; AR Oganov (2016). "Nuevos compuestos estables en el sistema ternario de CHO a alta presión". Scientific Reports . 6 : 32486. Bibcode :2016NatSR...632486S. doi :10.1038/srep32486. PMC 5007508 . PMID 27580525.
- ^ IUPAC (2006). "Constantes de estabilidad" (base de datos).
- ^ Pines, Dina; Ditkovich, Julia; Mukra, Tzach; Miller, Yifat; Kiefer, Philip M.; Daschakraborty, Snehasis; Hynes, James T.; Pines, Ehud (2016). "¿Qué tan ácido es el ácido carbónico?". J Phys Chem B . 120 (9): 2440–51. doi :10.1021/acs.jpcb.5b12428. PMC 5747581 . PMID 26862781.
- ^ Caldeira, K.; Wickett, ME (2003). "Carbono antropogénico y pH del océano". Nature . 425 (6956): 365. Bibcode :2001AGUFMOS11C0385C. doi : 10.1038/425365a . PMID 14508477. S2CID 4417880.
- ^ Sabine, CL (2004). "El sumidero oceánico del CO2 antropogénico". Science . 305 (5682): 367–371. Bibcode :2004Sci...305..367S. doi :10.1126/science.1097403. hdl : 10261/52596 . PMID 15256665. S2CID 5607281. Archivado desde el original el 6 de julio de 2008 . Consultado el 22 de junio de 2021 .
Enlaces externos
- Equilibrio ácido carbónico/bicarbonato/carbonato en agua: pH de soluciones, capacidad tampón, titulación y distribución de especies en función del pH, calculado con una hoja de cálculo gratuita
- Cómo calcular la concentración de ácido carbónico en el agua






![{\displaystyle {\begin{aligned}{\ce {HCO3^{-}{}+ H+{}<=> CO2(soln){}+ H2O}}&&K_{3}={\frac {[{\ce {H+}}][{\ce {HCO3^-}}]}{[{\ce {CO2(soln)}}]}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a3efe827e57da672cf1c617cebeddb8cf04baa81)
![{\displaystyle {\begin{aligned}{\ce {CO3^{2-}{}+ H+{}<=> HCO3^-}}&&\beta _{1}={\frac {[{\ce { HCO3^-}}]}{[{\ce {H+}}][{\ce {CO3^{2-}}}]}}\\{\ce {CO3^{2-}{}+ 2H+{ }<=> H2CO3}}&&\beta _{2}={\frac {[{\ce {H2CO3}}]}{[{\ce {H+}}]^{2}[{\ce {CO3^ {2-}}}]}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/09f8d396f1143f199cf1136f1ad60c7ce873b848)


