Base no nucleófila
Como sugiere el nombre, una base no nucleófila es una base orgánica impedida estéricamente que es un nucleófilo deficiente . Las bases normales también son nucleófilas, pero a menudo los químicos buscan la capacidad de eliminación de protones de una base sin ninguna otra función. Las bases no nucleófilas típicas son voluminosas, de modo que los protones pueden unirse al centro básico, pero se inhibe la alquilación y la formación de complejos.
Bases no nucleófilas
Una variedad de aminas y heterociclos de nitrógeno son bases útiles de fuerza moderada (pKa del ácido conjugado alrededor de 10-13).
- N , N -Diisopropiletilamina (DIPEA, también llamada Base de Hünig [1] ), pKa = 10,75
- 1,8-Diazabicicloundec-7-eno (DBU): útil para reacciones de eliminación de E2 , pKa = 13,5
- 1,5-Diazabiciclo(4.3.0)non-5-eno (DBN) - comparable a DBU
- 2,6-Di-tert-butilpiridina , una base no nucleófila débil [2] pKa = 3,58
- Bases de fosfaceno , como t -Bu-P 4 [3]
Las bases no nucleófilas de alta fuerza suelen ser aniones. Para estas especies, el pKa de los ácidos conjugados ronda entre 35 y 40.
- Diisopropilamida de litio (LDA), pKa = 36
- Amidas a base de silicio, como bis(trimetilsilil)amida de sodio y potasio (NaHMDS y KHMDS, respectivamente)
- Tetrametilpiperidina de litio (LiTMP o base de arpón)
Otras bases fuertes no nucleófilas son el hidruro de sodio y el hidruro de potasio . Estos compuestos son materiales densos, similares a las sales, insolubles y que funcionan mediante reacciones superficiales.
Algunos reactivos tienen una basicidad elevada (pKa del ácido conjugado de alrededor de 17) pero una nucleofilia modesta pero no despreciable. Algunos ejemplos son el terc -butóxido de sodio y el terc -butóxido de potasio .
Ejemplo
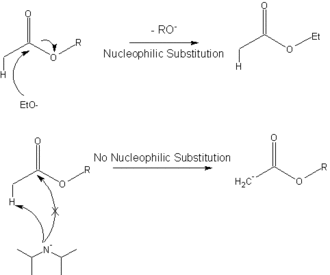
El siguiente diagrama muestra cómo se utiliza la base impedida, diisopropilamida de litio , para desprotonar un éster y dar el enolato en la condensación del éster de Claisen , en lugar de sufrir una sustitución nucleofílica.
Esta reacción (desprotonación con LDA) se utiliza comúnmente para generar enolatos.
Referencias
- ^ KL Sorgi, "Diisopropiletilamina", Enciclopedia de reactivos para síntesis orgánica, 2001. doi :10.1002/047084289X.rd254
- ^ Rafael R. Kostikov, Sánchez-Sancho Francisco, María Garranzo y M. Carmen Murcia Enciclopedia de reactivos para síntesis orgánica "2,6-Di-t-butilpiridina" 2010. doi :10.1002/047084289X.rd068.pub2
- ^ Activación en la polimerización aniónica: ¿Por qué las bases de fosfazeno son promotores muy interesantes? S. Boileau, N. Illy Prog. Polym. Sci., 2011 , 36, 1132-1151, doi :10.1016/j.progpolymsci.2011.05.005