Óxido de etileno
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Oxirano [1] | |||
| Nombre sistemático de la IUPAC Epoxietano oxaciclopropano | |||
| Otros nombres Óxido de etileno Óxido de dimetileno 1,2-Epoxietano [3]-corona-1 Epóxido | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| Abreviaturas | EO, EtO | ||
| 102378 | |||
| EBICh | |||
| Química biológica |
| ||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.000.773 | ||
| Número CE |
| ||
| 676 | |||
| BARRIL | |||
| Malla | Etileno+Óxido | ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 1040 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C2H4O | |||
| Masa molar | 44,052 g·mol −1 [2] | ||
| Apariencia | Gas incoloro | ||
| Olor | Como el éter dietílico [3] | ||
| Densidad | 0,8821 g·cm −3 [2] | ||
| Punto de fusión | -112,46 °C (-170,43 °F; 160,69 K) [2] | ||
| Punto de ebullición | 10,4 °C (50,7 °F; 283,5 K) [2] | ||
| Miscible | |||
| Presión de vapor | 1,46 atm (20 °C) [4] | ||
| −30,5·10 −6 cm3 /mol [ 5] | |||
Índice de refracción ( n D ) | 1,3597 (589 nm) [2] | ||
| 1,94 D [6] | |||
| Termoquímica | |||
Capacidad calorífica ( C ) | 47,9 J·mol −1 ·K −1 [7] | ||
Entropía molar estándar ( S ⦵ 298 ) | 242,5 J·mol −1 ·K −1 [7] | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −52,6 kJ·mol −1 [7] | ||
Energía libre de Gibbs (Δ f G ⦵ ) | −13,0 kJ·mol −1 [7] | ||
| Peligros | |||
| Seguridad y salud en el trabajo (SST/OHS): | |||
Principales peligros | Carcinógeno Extremadamente inflamable | ||
| Etiquetado SGA : | |||
    | |||
| H220 , H230 , H280 , H301 , H314 , H331 , H335 , H336 , H340 , H350 , H360FD , H372 | |||
| P202 , P210 , P260 , P280 , P301+P310+P330 , P303+P361+P353 , P305+P351+P338+P310 , P410+P403 [8] | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | -20 °C (-4 °F; 253 K) [6] | ||
| 429 °C (804 °F; 702 K) [6] | |||
| Límites de explosividad | 3 a 100% | ||
| Dosis o concentración letal (LD, LC): | |||
LC 50 ( concentración media ) | 836 ppm (ratón, 4 h) 4000 ppm (rata, 4 h) 800 ppm (rata, 4 h) 819 ppm (conejillo de indias, 4 h) 1460 ppm (rata, 4 h) 835 ppm (ratón, 4 h) 960 ppm (perro, 4 h) [9] | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | TWA 1 ppm 5 ppm [excursión de 15 minutos] [4] | ||
REL (recomendado) | Ca TWA <0,1 ppm (0,18 mg/m 3 ) C 5 ppm (9 mg/m 3 ) [10 min/día] [4] | ||
IDLH (Peligro inmediato) | Ca [800 ppm] [4] | ||
| Ficha de datos de seguridad (FDS) | ICSC 0155 | ||
| Compuestos relacionados | |||
Heterociclos relacionados | Aziridina , Thiirane , Borirane | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El óxido de etileno es un compuesto orgánico con la fórmula C2H4O . Es un éter cíclico y el epóxido más simple: un anillo de tres miembros que consiste en un átomo de oxígeno y dos átomos de carbono . El óxido de etileno es un gas incoloro e inflamable con un olor ligeramente dulce. Debido a que es un anillo tenso , el óxido de etileno participa fácilmente en una serie de reacciones de adición que dan como resultado la apertura del anillo. El óxido de etileno es isomérico con acetaldehído y con alcohol vinílico . El óxido de etileno se produce industrialmente por oxidación de etileno en presencia de un catalizador de plata .
La reactividad, que es responsable de muchos de los peligros del óxido de etileno, también lo hace útil. Aunque es demasiado peligroso para el uso doméstico directo y generalmente desconocido para los consumidores, el óxido de etileno se utiliza para fabricar muchos productos de consumo, así como productos químicos y productos intermedios no destinados al consumo. Estos productos incluyen detergentes, espesantes, disolventes, plásticos y varios productos químicos orgánicos como etilenglicol , etanolaminas, glicoles simples y complejos , éteres de poliglicol y otros compuestos. Aunque es una materia prima vital con diversas aplicaciones, incluida la fabricación de productos como el polisorbato 20 y el polietilenglicol (PEG), que a menudo son más eficaces y menos tóxicos que los materiales alternativos, el óxido de etileno en sí mismo es una sustancia muy peligrosa. A temperatura ambiente es un gas muy inflamable, cancerígeno , mutagénico , irritante y anestésico . [10]
El óxido de etileno es un desinfectante de superficies que se utiliza ampliamente en hospitales y en la industria de equipos médicos para reemplazar el vapor en la esterilización de herramientas y equipos sensibles al calor, como jeringas de plástico desechables. [11] Es tan inflamable y extremadamente explosivo que se utiliza como componente principal de armas termobáricas ; [12] [13] por lo tanto, se manipula y envía comúnmente como un líquido refrigerado para controlar su naturaleza peligrosa. [10] [14]
Historia
El óxido de etileno fue reportado por primera vez en 1859 por el químico francés Charles-Adolphe Wurtz , [15] quien lo preparó tratando 2-cloroetanol con hidróxido de potasio :
Wurtz midió el punto de ebullición del óxido de etileno en 13,5 °C (56,3 °F), ligeramente más alto que el valor actual, y descubrió la capacidad del óxido de etileno para reaccionar con ácidos y sales de metales. [16] Wurtz asumió erróneamente que el óxido de etileno tiene las propiedades de una base orgánica. Esta idea errónea persistió hasta 1896, cuando Georg Bredig descubrió que el óxido de etileno no es un electrolito . [16] [17] Que se diferenciara de otros éteres , en particular por su propensión a participar en las reacciones de adición típicas de los compuestos insaturados , había sido durante mucho tiempo un tema de debate. La estructura triangular heterocíclica del óxido de etileno se propuso en 1868 o antes. [18]
La síntesis de Wurtz de 1859 siguió siendo durante mucho tiempo el único método para preparar óxido de etileno, a pesar de numerosos intentos, incluso por parte del propio Wurtz, de producir óxido de etileno directamente a partir de etileno . [19] Solo en 1931 el químico francés Theodore Lefort desarrolló un método de oxidación directa de etileno en presencia de un catalizador de plata . [20] Desde 1940, casi toda la producción industrial de óxido de etileno se ha basado en este proceso. [21] La esterilización por óxido de etileno para la conservación de especias fue patentada en 1938 por el químico estadounidense Lloyd Hall . El óxido de etileno alcanzó importancia industrial durante la Primera Guerra Mundial como precursor tanto del refrigerante etilenglicol como del arma química gas mostaza . [ cita requerida ]
Estructura molecular y propiedades


El ciclo epoxi del óxido de etileno es un triángulo casi regular con ángulos de enlace de aproximadamente 60° y una deformación angular significativa correspondiente a la energía de 105 kJ/mol. [22] [23] A modo de comparación, en los alcoholes el ángulo C–O–H es de aproximadamente 110°; en los éteres , el ángulo C–O–C es de 120°. El momento de inercia sobre cada uno de los ejes principales es I A =32,921 × 10 −40 g·cm 2 , yo B =37,926 × 10 −40 g·cm 2 y I C =59,510 × 10 −40 g·cm 2 . [24]
La inestabilidad relativa de los enlaces carbono-oxígeno en la molécula se revela mediante la comparación en la tabla de la energía requerida para romper dos enlaces C-O en el óxido de etileno o un enlace C-O en etanol y éter dimetílico : [25]
| Reacción | ΔH° 298 , kJ/mol | Método |
|---|---|---|
| (C 2 H 4 )O → C 2 H 4 + O (ruptura de dos enlaces) | 354.38 | Calculado a partir de entalpías atómicas |
| C 2 H 5 OH → C 2 H 5 + OH (rompiendo un enlace) | 405,85 | Impacto de electrones |
| CH 3 OCH 3 → CH 3 O + CH 3 (rompiendo un enlace) | 334,72 | Calculado utilizando entalpías de formación de radicales. |
Esta inestabilidad se correlaciona con su alta reactividad, lo que explica la facilidad de sus reacciones de apertura de anillo (ver Propiedades químicas).
Propiedades físicas
El óxido de etileno es un gas incoloro a 25 °C (77 °F) y es un líquido móvil a 0 °C (32 °F); la viscosidad del óxido de etileno líquido a 0 °C es aproximadamente 5,5 veces menor que la del agua. El gas tiene un olor dulce característico de éter, perceptible cuando su concentración en el aire supera las 500 ppm. [26] El óxido de etileno es fácilmente soluble en agua, etanol , éter dietílico y muchos disolventes orgánicos. [27]
Las principales constantes termodinámicas son: [28]
- La tensión superficial del óxido de etileno líquido, en la interfaz con su propio vapor, es de 35,8 mJ/m2 ( 0,00079 cal/pie cuadrado) a -50,1 °C (-58,2 °F) y de 27,6 mJ/m2 ( 0,00061 cal/pie cuadrado) a -0,1 °C (31,8 °F). [29]
- El punto de ebullición aumenta con la presión de vapor de la siguiente manera: [30] 57,7 °C (135,9 °F) (2 atm (200 kPa; 29 psi)), 83,6 °C (182,5 °F) (5 atm (510 kPa; 73 psi)) y 114,0 °C (237,2 °F) (10 atm (1000 kPa; 150 psi)).
- La viscosidad disminuye con la temperatura con valores de 0,577 kPa·s a -49,8 °C (-57,6 °F), 0,488 kPa·s a -38,2 °C (-36,8 °F), 0,394 kPa·s a -21,0 °C (-5,8 °F) y 0,320 kPa·s a 0 °C (32 °F). [31]
Entre −91 y 10,5 °C (−131,8 y 50,9 °F), la presión de vapor p (en mmHg) varía con la temperatura ( T en °C) como
- . [32]
| Temperatura, °C | Presión de vapor, kPa | Entalpía del líquido, J/g | Entalpía de vaporización, J/g | Densidad, kg/L | Capacidad calorífica , J/(kg·K) | Conductividad térmica , W/(m·K) |
|---|---|---|---|---|---|---|
| -40 | 8.35 | 0 | 628.6 | 0,9488 | 1878 | 0,20 |
| -20 | 25,73 | 38.8 | 605.4 | 0,9232 | 1912 | 0,18 |
| 0 | 65,82 | 77.3 | 581.7 | 0,8969 | 1954 | 0,16 |
| 20 | 145,8 | 115.3 | 557.3 | 0,8697 | 2008 | 0,15 |
| 40 | 288.4 | 153.2 | 532.1 | 0,8413 | 2092 | 0,14 |
| 60 | 521.2 | 191,8 | 505.7 | 0,8108 | 2247 | 0,14 |
| 80 | 875.4 | 232.6 | 477,4 | 0,7794 | 2426 | 0,14 |
| 100 | 1385.4 | 277,8 | 445,5 | 0,7443 | 2782 | 0,13 |
| 120 | 2088 | 330.4 | 407,5 | 0,7052 | 3293 | N / A* |
| 140 | 3020 | 393,5 | 359,4 | 0,6609 | 4225 | N / A |
| 160 | 4224 | 469.2 | 297.1 | 0,608 | N / A | N / A |
| 180 | 5741 | 551.2 | 222,5 | 0,533 | N / A | N / A |
| 195,8 | 7191 | N / A | N / A | N / A | N / A | N / A |
*N/A – datos no disponibles.
| Temperatura, K | Entropía, J/(mol·K) | Calor de formación, kJ/mol | Energía libre de formación, kJ/mol | Viscosidad, μPa·s | Conductividad térmica, W/(m·K) | Capacidad calorífica, J/(mol·K) |
|---|---|---|---|---|---|---|
| 298 | 242.4 | −52,63 | -13,10 | N / A | N / A | 48,28 |
| 300 | 242,8 | −52,72 | -12,84 | 9.0 | 0,012 | 48,53 |
| 400 | 258,7 | −56,53 | 1.05 | 13.5 | 0,025 | 61,71 |
| 500 | 274.0 | −59,62 | 15.82 | 15.4 | 0,038 | 75,44 |
| 600 | 288.8 | -62,13 | 31.13 | 18.2 | 0,056 | 86.27 |
| 700 | 302.8 | −64,10 | 46,86 | 20.9 | 0,075 | 95.31 |
| 800 | 316.0 | -65,61 | 62,80 | N / A | 0.090 | 102.9 |
*N/A – datos no disponibles.
Propiedades químicas
El óxido de etileno reacciona fácilmente con diversos compuestos con apertura del anillo. Sus reacciones típicas son con nucleófilos que proceden por el mecanismo S N 2 tanto en medios ácidos (nucleófilos débiles: agua, alcoholes) como alcalinos (nucleófilos fuertes: OH − , RO − , NH 3 , RNH 2 , RR'NH, etc.). [23] El esquema general de reacción es
y a continuación se describen reacciones más específicas.
Adición de agua y alcoholes.
Las soluciones acuosas de óxido de etileno son bastante estables y pueden existir durante mucho tiempo sin que se observe ninguna reacción química. Sin embargo, al añadir una pequeña cantidad de ácido, como ácido sulfúrico muy diluido , se produce inmediatamente la formación de etilenglicol , incluso a temperatura ambiente:
- (CH 2 CH 2 )O + H 2 O → HO–CH 2 CH 2 –OH
La reacción también ocurre en fase gaseosa, en presencia de una sal de ácido fosfórico como catalizador. [33]
La reacción se lleva a cabo normalmente a unos 60 °C (140 °F) con un gran exceso de agua, para evitar la reacción del etilenglicol formado con óxido de etileno que formaría di- y trietilenglicol : [34]
- 2 (CH 2 CH 2 )O + H 2 O → HO–CH 2 CH 2 –O–CH 2 CH 2 –OH
- 3 (CH 2 CH 2 )O + H 2 O → HO–CH 2 CH 2 –O–CH 2 CH 2 –O–CH 2 CH 2 –OH
El uso de catalizadores alcalinos puede conducir a la formación de polietilenglicol :
- n (CH 2 CH 2 )O + H 2 O → HO–(–CH 2 CH 2 –O–) n –H
Las reacciones con alcoholes se desarrollan de manera similar produciendo éteres de etilenglicol:
- (CH 2 CH 2 )O + C 2 H 5 OH → HO–CH 2 CH 2 –OC 2 H 5
- 2 (CH 2 CH 2 )O + C 2 H 5 OH → HO–CH 2 CH 2 –O–CH 2 CH 2 –OC 2 H 5
Las reacciones con alcoholes inferiores ocurren de forma menos activa que con agua y requieren condiciones más severas, como calentar a 160 °C (320 °F) y presurizar a 3 MPa (440 psi) y agregar un catalizador ácido o alcalino.
Las reacciones del óxido de etileno con alcoholes grasos ocurren en presencia de sodio metálico, hidróxido de sodio o trifluoruro de boro y se utilizan para la síntesis de surfactantes . [33]
Adición de ácidos carboxílicos y sus derivados
Las reacciones del óxido de etileno con ácidos carboxílicos en presencia de un catalizador dan lugar a mono y diésteres de glicol:
- (CH 2 CH 2 )O + CH 3 CO 2 H → HOCH 2 CH 2 –O 2 CCH 3
- (CH 2 CH 2 )O + (CH 3 CO) 2 O → CH 3 CO 2 CH 2 CH 2 O 2 CCH 3
La adición de amidas ácidas se realiza de forma similar:
- (CH 2 CH 2 )O + CH 3 CONH 2 → HOCH 2 CH 2 NHC (O) CH 3
La adición de óxido de etileno a ácidos carboxílicos superiores se lleva a cabo a temperaturas elevadas (normalmente 140–180 °C (284–356 °F)) y presión (0,3–0,5 MPa (44–73 psi)) en una atmósfera inerte, en presencia de un catalizador alcalino (concentración 0,01–2%), como hidróxido o carbonato de sodio o potasio. [35] El ion carboxilato actúa como nucleófilo en la reacción:
- (CH 2 CH 2 )O + RCO 2 − → RCO 2 CH 2 CH 2 O −
- RCO2CH2CH2O − + RCO2H → RCO2CH2CH2OH + RCO2 −
Adición de amoniaco y aminas
El óxido de etileno reacciona con el amoníaco formando una mezcla de mono-, di- y tri- etanolaminas . La reacción se estimula añadiendo una pequeña cantidad de agua.
- (CH 2 CH 2 )O + NH 3 → HO–CH 2 CH 2 –NH 2
- 2 (CH 2 CH 2 )O + NH 3 → (HO–CH 2 CH 2 ) 2 NH
- 3 (CH 2 CH 2 )O + NH 3 → (HO–CH 2 CH 2 ) 3 N
De manera similar proceden las reacciones con aminas primarias y secundarias:
- (CH 2 CH 2 )O + RNH 2 → HO–CH 2 CH 2 –NHR
Los dialquilaminoetanoles pueden reaccionar además con óxido de etileno, formando aminopolietilenglicoles: [19]
- n ( CH2CH2 ) O + R2NCH2CH2OH → R2NCH2CH2O – ( – CH2CH2O– ) n –H
La trimetilamina reacciona con óxido de etileno en presencia de agua, formando colina : [36]
- ( CH2CH2 ) O + ( CH3 ) 3N + H2O → [ HOCH2CH2N ( CH3 ) 3 ] + OH −
Las aminas aromáticas primarias y secundarias también reaccionan con el óxido de etileno, formando los alcoholes arilamino correspondientes.
Adición de haluro
El óxido de etileno reacciona fácilmente con soluciones acuosas de ácidos clorhídrico , bromhídrico y yodhídrico para formar halohidrinas . La reacción se produce más fácilmente con los dos últimos ácidos:
- (CH 2 CH 2 )O + HCl → HO–CH 2 CH 2 –Cl
La reacción con estos ácidos compite con la hidratación catalizada por ácidos del óxido de etileno; por lo tanto, siempre hay un subproducto de etilenglicol con una mezcla de dietilenglicol . Para obtener un producto más limpio, la reacción se lleva a cabo en fase gaseosa o en un disolvente orgánico.
La fluorohidrina de etileno se obtiene de otra manera: hirviendo fluoruro de hidrógeno con una solución de óxido de etileno al 5-6 % en éter dietílico . El éter normalmente tiene un contenido de agua del 1,5-2 %; en ausencia de agua, el óxido de etileno se polimeriza. [37]
Las halohidrinas también se pueden obtener haciendo pasar óxido de etileno a través de soluciones acuosas de haluros metálicos: [33]
- 2 (CH 2 CH 2 )O + CuCl 2 + 2 H 2 O → 2 HO–CH 2 CH 2 –Cl + Cu(OH) 2 ↓
Adición metalorgánica
La interacción del óxido de etileno con compuestos organomagnésicos , que son reactivos de Grignard , puede considerarse como una sustitución nucleofílica influida por compuestos organometálicos carbaniónicos . El producto final de la reacción es un alcohol primario:
Un mecanismo similar es válido para otros compuestos organometálicos, como el alquil-litio:
Otras reacciones de adición
Adición de cianuro de hidrógeno
El óxido de etileno reacciona fácilmente con el cianuro de hidrógeno formando cianhidrina de etileno:
- (CH 2 CH 2 )O + HCN → HO–CH 2 CH 2 –CN
Se puede utilizar una solución acuosa ligeramente fría (10–20 °C) de cianuro de calcio en lugar de HCN: [38]
- 2 (CH 2 CH 2 )O + Ca(CN) 2 + 2 H 2 O → 2 HO–CH 2 CH 2 –CN + Ca(OH) 2
La cianhidrina de etileno pierde agua fácilmente y produce acrilonitrilo :
- HO–CH 2 CH 2 –CN → CH 2 =CH–CN + H 2 O
Adición de sulfuro de hidrógeno y mercaptanos
Al reaccionar con el sulfuro de hidrógeno , el óxido de etileno forma 2-mercaptoetanol y tiodiglicol , y con alquilmercaptanos produce 2-alquilmercaptoetanol:
- (CH 2 CH 2 )O + H 2 S → HO–CH 2 CH 2 –HS
- 2 (CH 2 CH 2 )O + H 2 S → (HO–CH 2 CH 2 ) 2 S
- (CH 2 CH 2 )O + RHS → HO–CH 2 CH 2 –SR
El exceso de óxido de etileno con una solución acuosa de sulfuro de hidrógeno conduce al hidróxido de tris-(hidroxietil) sulfonilo:
- 3 (CH 2 CH 2 )O + H 2 S → [(HO–CH 2 CH 2 ) 3 S + ]OH −
Adición de ácidos nitroso y nítrico
La reacción del óxido de etileno con soluciones acuosas de nitrito de bario , nitrito de calcio , nitrito de magnesio, nitrito de zinc o nitrito de sodio conduce a la formación de 2-nitroetanol: [39]
- 2 (CH 2 CH 2 )O + Ca(NO 2 ) 2 + 2 H 2 O → 2 HO–CH 2 CH 2 –NO 2 + Ca(OH) 2
Con ácido nítrico , el óxido de etileno forma mono y dinitroglicoles : [40]
Reacción con compuestos que contienen grupos metileno activos
En presencia de alcóxidos , las reacciones del óxido de etileno con compuestos que contienen un grupo metileno activo conducen a la formación de butirolactonas : [41]
Alquilación de compuestos aromáticos
El óxido de etileno entra en la reacción de Friedel-Crafts con el benceno para formar alcohol fenetílico :
El estireno se puede obtener en una etapa si esta reacción se lleva a cabo a temperaturas elevadas (315–440 °C (599–824 °F)) y presiones (0,35–0,7 MPa (51–102 psi)), en presencia de un catalizador de aluminosilicato. [42]
Síntesis de éteres corona
Se pueden sintetizar una serie de compuestos heterocíclicos polinómicos , conocidos como éteres corona , con óxido de etileno. Un método es la ciclopolimerización catiónica del óxido de etileno, lo que limita el tamaño del ciclo formado: [43]
- norte (CH 2 CH 2 )O → (–CH 2 CH 2 –O–) norte
Para suprimir la formación de otros polímeros lineales, la reacción se lleva a cabo en una solución altamente diluida. [43]
La reacción del óxido de etileno con dióxido de azufre en presencia de sales de cesio conduce a la formación de un compuesto heterocíclico de 11 miembros que tiene las propiedades complejantes de los éteres corona: [44]
Isomerización
Cuando se calienta a aproximadamente 400 °C (750 °F), o a 150–300 °C (300–570 °F) en presencia de un catalizador ( Al 2 O 3 , H 3 PO 4 , etc.), el óxido de etileno se isomeriza en acetaldehído : [45]
Para explicar esta reacción en fase gaseosa se propuso el mecanismo radicalario, que comprende las siguientes etapas: [46]
| ( CH2CH2 ) O ↔ • CH2CH2O • → CH3CHO * | ( 1 ) |
| CH 3 CHO* → CH 3 • + CHO• | ( 2 ) |
| CH3CHO * + M → CH3CHO + M * | ( 3 ) |
En la reacción ( 3 ), M se refiere a la pared del recipiente de reacción o a un catalizador heterogéneo. La fracción CH3CHO * representa una molécula de acetaldehído activada de corta duración (10 −8,5 segundos). Su exceso de energía es de aproximadamente 355,6 kJ/mol, que excede en 29,3 kJ/mol la energía de enlace del enlace CC en el acetaldehído. [46]
En ausencia de un catalizador, la isomerización térmica del óxido de etileno nunca es selectiva y, aparte del acetaldehído, produce una cantidad significativa de subproductos (véase la sección Descomposición térmica). [47]
Reacción de reducción
El óxido de etileno se puede hidrogenar en etanol en presencia de un catalizador, como níquel , platino , paladio , [47] boranos , hidruro de litio y aluminio y algunos otros hidruros . [48]
Por el contrario, con otros catalizadores, el óxido de etileno puede reducirse mediante hidrógeno a etileno con un rendimiento de hasta el 70%. Los catalizadores de reducción incluyen mezclas de polvo de zinc y ácido acético , de hidruro de litio y aluminio con tricloruro de titanio (el agente reductor es en realidad dicloruro de titanio , formado por la reacción entre LiAlH 4 y TiCl 3 ) y de cloruro de hierro (III) con butillitio en tetrahidrofurano . [48]
Oxidación
El óxido de etileno puede oxidarse aún más, dependiendo de las condiciones, a ácido glicólico o dióxido de carbono :
La oxidación profunda en reactor de fase gaseosa de óxido de etileno a 800–1000 K (527–727 °C; 980–1340 °F) y una presión de 0,1–1 MPa (15–145 psi) produce una mezcla compleja de productos que contienen O 2 , H 2 , CO , CO 2 , CH 4 , C 2 H 2 , C 2 H 4 , C 2 H 6 , C 3 H 6 , C 3 H 8 y CH 3 CHO . [49]
Dimerización
En presencia de catalizadores ácidos, el óxido de etileno se dimeriza para producir dioxano :
El mecanismo de reacción es el siguiente: [47]
La reacción de dimerización no es selectiva. Entre los subproductos se encuentra el acetaldehído (debido a la isomerización). La selectividad y la velocidad de la dimerización se pueden aumentar añadiendo un catalizador, como platino, platino-paladio o yodo con sulfolano . En este último caso, se forma 2-metil-1,3- dioxolano como subproducto. [50]
Polimerización
El óxido de etileno líquido puede formar polietilenglicoles . La polimerización puede realizarse a través de mecanismos radicales e iónicos, pero solo este último tiene una amplia aplicación práctica. [51] La polimerización catiónica del óxido de etileno es asistida por ácidos próticos ( HClO 4 , HCl ), ácidos de Lewis ( SnCl 4 , BF 3 , etc.), compuestos organometálicos o reactivos más complejos: [51]
El mecanismo de reacción es el siguiente. [52] En la primera etapa, el catalizador (MX m ) es iniciado por halógeno alquílico o acilo o por compuestos con átomos de hidrógeno activos, generalmente agua, alcohol o glicol:
- MX m + ROH → MX m RO − H +
El complejo activo resultante reacciona con el óxido de etileno a través del mecanismo S N 2 :
- ( CH2CH2 ) O+ MXm RO − H + → ( CH2CH2 ) O ••• H + O − RMXm
- (CH 2 CH 2 )O•••H + O − RMX m → HO–CH 2 CH 2 + + MX m RO − 2
- HO–CH 2 CH 2 + + n (CH 2 CH 2 )O → HO–CH 2 CH 2 –(O–CH 2 CH 2 ) n +
La cadena se rompe como
- HO – CH2CH2– ( O – CH2CH2 ) n ++ MXmRO− → HO – CH2CH2– ( O – CH2CH2 ) n – OR + MXm
- H ( O–CH2CH2 ) n – O –CH2 – CH2 + + MXmRO − → H ( O–CH2CH2 ) n – O–CH= CH2 + MXm + ROH
La polimerización aniónica del óxido de etileno es asistida por bases, como alcóxidos , hidróxidos , carbonatos u otros compuestos de metales alcalinos o alcalinotérreos . [51] El mecanismo de reacción es el siguiente: [52]
- (CH 2 CH 2 )O + RONa → RO–CH 2 CH 2 –O − Na +
- RO–CH 2 CH 2 –O − Na + + n (CH 2 CH 2 )O → RO–(CH 2 CH 2 –O) n –CH 2 CH 2 –O − Na +
- RO–(CH 2 CH 2 –O) n –CH 2 CH 2 –O − Na + → RO–(CH 2 CH 2 –O) n –CH=CH 2 + NaOH
- RO–(CH 2 CH 2 –O) n –CH 2 CH 2 –O − Na + + H 2 O → RO–(CH 2 CH 2 –O) (n+1) OH + NaOH
Descomposición térmica
El óxido de etileno es relativamente estable al calentamiento: en ausencia de un catalizador, no se disocia hasta 300 °C (572 °F), y solo por encima de 570 °C (1058 °F) hay una descomposición exotérmica importante , que se realiza a través del mecanismo radical. [47] La primera etapa implica isomerización, sin embargo, la temperatura alta acelera los procesos radicales. Dan como resultado una mezcla de gases que contiene acetaldehído, etano, etilo, metano, hidrógeno, dióxido de carbono, cetena y formaldehído . [53] La pirólisis a alta temperatura (830–1200 K (557–927 °C; 1034–1700 °F)) a presión elevada en una atmósfera inerte conduce a una composición más compleja de la mezcla de gases, que también contiene acetileno y propano . [54] Al contrario de la isomerización, la iniciación de la cadena ocurre principalmente de la siguiente manera: [54]
- ( CH2CH2 ) O → • CH2CH2O • → CH2O + CH2 :
Al llevar a cabo la descomposición térmica del óxido de etileno en presencia de compuestos de metales de transición como catalizadores, es posible no sólo reducir su temperatura, sino también tener al etilo como producto principal, es decir revertir la reacción de síntesis del óxido de etileno.
Otras reacciones
Los iones de tiocianato o tiourea transforman el óxido de etileno en tiirano (sulfuro de etileno): [55]
La reacción del pentacloruro de fósforo con óxido de etileno produce dicloruro de etileno : [33]
- (CH2CH2 ) O + PCl5 → Cl – CH2CH2 – Cl + POCl3
Otros derivados dicloro del óxido de etileno pueden obtenerse mediante la acción combinada de cloruro de sulfurilo (SOCl 2 ) y piridina y de trifenilfosfina y tetracloruro de carbono . [56]
El tricloruro de fósforo reacciona con el óxido de etileno formando ésteres cloroetílicos del ácido fosforoso: [33]
- ( CH2CH2 ) O + PCl3 → Cl – CH2CH2 – OPCl2
- 2 (CH2CH2 ) O + PCl3 → (Cl – CH2CH2 – O ) 2PCl
- 3(CH2CH2 ) O + PCl3 → Cl – CH2CH2 – O ) 3P
El producto de reacción del óxido de etileno con cloruros de acilo en presencia de yoduro de sodio es un éster yodoetílico complejo: [56]
- (CH 2 CH 2 )O + RCOCl + NaI → RC(O)–OCH2 CH 2 –I + NaCl
Calentar óxido de etileno a 100 °C con dióxido de carbono , en un disolvente no polar en presencia de bis- (trifenilfosfina)-níquel(0), da como resultado carbonato de etileno : [57]
En la industria, se lleva a cabo una reacción similar a alta presión y temperatura en presencia de sales de amonio cuaternario o de fosfonio como catalizador. [58]
La reacción del óxido de etileno con formaldehído a 80–150 °C en presencia de un catalizador conduce a la formación de 1,3-dioxolano : [59]
La sustitución del formaldehído por otros aldehídos o cetonas da como resultado un 1,3-dioxolano 2-sustituido (rendimiento: 70-85 %, catalizador: bromuro de tetraetilamonio). [59]
La hidroformilación catalítica del óxido de etileno produce hidroxipropanal, que puede hidrogenarse a propano-1,3-diol : [60]
Síntesis de laboratorio
Deshidrocloración del etileno y sus derivados
La deshidrocloración del 2-cloroetanol , desarrollada por Wurtz en 1859, sigue siendo una ruta de laboratorio común para obtener óxido de etileno:
La reacción se lleva a cabo a temperatura elevada y, además de hidróxido de sodio o hidróxido de potasio , se pueden utilizar hidróxido de calcio , hidróxido de bario , hidróxido de magnesio o carbonatos de metales alcalinos o alcalinotérreos. [61]
Con un alto rendimiento (90%) se puede producir óxido de etileno tratando el óxido de calcio con hipoclorito de etilo; la sustitución del calcio por otros metales alcalinotérreos reduce el rendimiento de la reacción: [62]
Oxidación directa del etileno por peroxiácidos
El etileno se puede oxidar directamente a óxido de etileno utilizando peroxiácidos , por ejemplo, ácido peroxibenzoico o meta -cloro-peroxibenzoico: [63]
La oxidación con peroxiácidos es eficaz para los alquenos superiores, pero no para el etileno. La reacción anterior es lenta y tiene un bajo rendimiento, por lo que no se utiliza en la industria. [62]
Otros métodos de preparación
Otros métodos de síntesis incluyen [62] la reacción de diyodoetano con óxido de plata :
y descomposición del carbonato de etileno a 200–210 °C (392–410 °F) en presencia de hexacloroetano :
Síntesis industrial
Historia
La producción comercial de óxido de etileno se remonta a 1914, cuando BASF construyó la primera fábrica que utilizó el proceso de clorhidrina (reacción de la clorhidrina de etileno con hidróxido de calcio). El proceso de clorhidrina no era atractivo por varias razones, incluida la baja eficiencia y la pérdida de cloro valioso en cloruro de calcio . [64] Lefort inventó una oxidación directa más eficiente del etileno por aire en 1931 y en 1937 Union Carbide abrió la primera planta que utilizó este proceso. Shell Oil Co. lo mejoró aún más en 1958 al reemplazar el aire con oxígeno y usar una temperatura elevada de 200–300 °C (390–570 °F) y presión (1–3 MPa (150–440 psi)). [65] Esta ruta más eficiente representó aproximadamente la mitad de la producción de óxido de etileno en la década de 1950 en los EE. UU., y después de 1975 reemplazó por completo los métodos anteriores. [65] La producción de óxido de etileno representa aproximadamente el 11% de la demanda mundial de etileno. [66]
Proceso de producción de óxido de etileno mediante clorhidrina
Aunque el proceso de clorhidrina ha sido reemplazado casi en su totalidad en la industria por la oxidación directa del etileno, el conocimiento de este método sigue siendo importante por razones educativas y porque todavía se utiliza en la producción de óxido de propileno . [67] El proceso consta de tres pasos principales: síntesis de clorhidrina de etileno, deshidrocloración de clorhidrina de etileno a óxido de etileno y purificación de óxido de etileno. Estos pasos se llevan a cabo de forma continua. En la primera columna, la hipocloración del etileno se lleva a cabo de la siguiente manera: [68]
- Cl2 + H2O → HOCl + HCl
- CH 2 =CH 2 + HOCl → HO–CH 2 CH 2 –Cl
- CH2 = CH2 + Cl2 → Cl – CH2CH2 – Cl
Para suprimir la conversión de etileno en dicloruro de etileno (la última reacción), la concentración de etileno se mantiene en alrededor del 4-6% y la solución se calienta con vapor hasta el punto de ebullición. [68]
A continuación, la solución acuosa de clorhidrina de etileno ingresa a la segunda columna, donde reacciona con una solución al 30% de hidróxido de calcio a 100 °C (212 °F): [68]
- 2 HO–CH 2 CH 2 –Cl + Ca(OH) 2 → 2 (CH 2 CH 2 )O + CaCl 2 + 2H 2 O
El óxido de etileno producido se purifica mediante rectificación . El proceso de clorhidrina permite alcanzar el 95% de conversión de clorhidrina de etileno. El rendimiento de óxido de etileno es de aproximadamente el 80% del valor teórico; por cada tonelada (0,98 toneladas largas; 1,1 toneladas cortas) de óxido de etileno, se producen aproximadamente 200 kg (440 lb) de dicloruro de etileno. [68] Pero, los principales inconvenientes de este proceso son el alto consumo de cloro y la carga de efluentes. Este proceso ahora está obsoleto.
Oxidación directa del etileno
Uso en la industria global
La oxidación directa del etileno fue patentada por Lefort en 1931. Este método fue modificado en repetidas ocasiones para su uso industrial y se conocen al menos cuatro variantes importantes. Todas ellas utilizan la oxidación con oxígeno o aire y un catalizador a base de plata, pero difieren en los detalles tecnológicos y las implementaciones de hardware. [69]
Union Carbide (actualmente una división de Dow Chemical Company ) fue la primera empresa en desarrollar el proceso de oxidación directa. [70]
Scientific Design Co. desarrolló un método de producción similar, pero su uso se extendió debido al sistema de licencias: representa el 25% de la producción mundial y el 75% de la producción mundial autorizada de óxido de etileno. [70] [71] Japan Catalytic Chemical Co. utiliza una variación patentada de este método, que adaptó la síntesis de óxido de etileno y etilenglicol en un único complejo industrial.
Shell International Chemicals BV desarrolló una modificación diferente. Su método es bastante flexible en lo que respecta a los requisitos específicos de industrias específicas; se caracteriza por una alta selectividad con respecto al producto de óxido de etileno y una larga vida útil del catalizador (3 años). Representa aproximadamente el 40% de la producción mundial. [70]
Las fábricas más antiguas suelen utilizar aire para la oxidación, mientras que las plantas y procesos más nuevos, como METEOR y Japan Catalytic, prefieren el oxígeno. [72]
Química y cinética del proceso de oxidación directa.
Formalmente, el proceso de oxidación directa se expresa mediante la siguiente ecuación:
- , ΔH=−105 kJ/mol
Sin embargo, en la práctica se observa una producción significativa de dióxido de carbono y agua, lo que se puede explicar por la oxidación completa del etileno o del óxido de etileno:
- CH2 =CH2 + 3O2 → 2CO2 + 2H2O , ΔH=−1327 kJ / mol
- (CH2CH2 ) O + 2,5 O2 → 2 CO2 + 2 H2O , ΔH=−1223 kJ/mol
Según un análisis cinético de Kilty y Sachtler, las siguientes reacciones describen la vía que conduce al EO. En el primer paso, se forma una especie de superóxido (O 2 − ): [73]
- O2 + Ag → Ag + O2 −
Esta especie reacciona con el etileno.
- Ag + O 2 − + H 2 C=CH 2 → (CH 2 CH 2 )O + AgO
El óxido de plata resultante oxida el etileno o el óxido de etileno a CO2 y agua. Esta reacción repone el catalizador de plata. Por lo tanto, la reacción general se expresa como
- 7 CH 2 =CH 2 + 6 O 2 → 6 (CH 2 CH 2 )O + 2 CO 2 + 2 H 2 O
y se predice teóricamente que el grado máximo de conversión de etileno en óxido de etileno es 6/7 o 85,7%, [73] aunque en la práctica se logran rendimientos más altos. [74]
El catalizador para la reacción es plata metálica depositada en varias matrices, incluyendo piedra pómez , gel de sílice , varios silicatos y aluminosilicatos , alúmina y carburo de silicio , y activada por ciertos aditivos ( antimonio , bismuto , peróxido de bario , etc.). [75] La temperatura del proceso se optimizó a 220–280 °C (430–540 °F). Las temperaturas más bajas reducen la actividad del catalizador y las temperaturas más altas promueven la oxidación completa del etileno, reduciendo así el rendimiento de óxido de etileno. La presión elevada de 1–3 MPa (150–440 psi) aumenta la productividad del catalizador y facilita la absorción de óxido de etileno de los gases que reaccionan. [75]
Aunque todavía se utiliza la oxidación con aire, se prefiere el oxígeno (> 95 % de pureza) por varias razones, como un mayor rendimiento molar de óxido de etileno (75-82 % para oxígeno frente a 63-75 % para aire), una mayor velocidad de reacción (sin dilución de gas) y no es necesario separar el nitrógeno en los productos de reacción. [19] [76]
Descripción general del proceso
La producción de óxido de etileno a escala comercial se logra con la unificación de los siguientes procesos unitarios :
- Reactor principal
- Depurador de óxido de etileno
- Desorbedor de óxido de etileno
- Columna de destilación y desorción
- Depurador de CO2 y depurador de CO2
Reactor principal: El reactor principal consta de miles de tubos catalizadores en haces. Estos tubos tienen generalmente de 6 a 15 m (20 a 50 pies) de largo con un diámetro interior de 20 a 50 mm (0,8 a 2,0 pulgadas). El catalizador empaquetado en estos tubos tiene forma de esferas o anillos de diámetro de 3 a 10 mm (0,12 a 0,39 pulgadas). Las condiciones de operación de 200–300 °C (390–570 °F) con una presión de 1–3 MPa (150–440 psi) prevalecen en el reactor. Para mantener esta temperatura, el sistema de enfriamiento del reactor juega un papel vital. Con el envejecimiento del catalizador, su selectividad disminuye y produce más productos secundarios exotérmicos de CO 2 .
Depurador de óxido de etileno: después de que la corriente gaseosa del reactor principal, que contiene óxido de etileno (1-2%) y CO2 ( 5%), se enfría, se pasa al depurador de óxido de etileno. Aquí, se utiliza agua como medio de depuración que elimina la mayoría del óxido de etileno junto con algunas cantidades de CO2 , N2 , CH2 = CH2 , CH4 y aldehídos ( introducidos por la corriente de reciclaje). Además, una pequeña proporción del gas que sale del depurador de óxido de etileno (0,1-0,2%) se elimina de forma continua (se quema) para evitar la acumulación de compuestos inertes (N2 , Ar y C2H6 ) , que se introducen como impurezas con los reactivos.
Desorbedor de óxido de etileno: La corriente acuosa resultante del proceso de depuración anterior se envía luego al desorbedor de óxido de etileno. Aquí, el óxido de etileno se obtiene como producto de cabeza, mientras que el producto de fondo obtenido se conoce como purga de glicol . Cuando el óxido de etileno se depura del gas de reciclaje con una solución acuosa, inevitablemente se producen etilenglicoles (a saber, monoetilenglicol, dietilenglicol y otros polietilenglicoles). Por lo tanto, para evitar que se acumulen en el sistema, se purgan continuamente.
Columna de destilación y arrastre: aquí, la corriente de óxido de etileno se separa de sus componentes de bajo punto de ebullición y luego se destila para separarla en agua y óxido de etileno.
Depurador de CO2: La corriente de reciclaje obtenida del depurador de óxido de etileno se comprime y se alimenta una corriente secundaria al depurador de CO2. Aquí, el CO2 se disuelve en la solución acuosa caliente de carbonato de potasio (es decir, el medio de depuración). La disolución del CO2 no es solo un fenómeno físico, sino también químico, ya que el CO2 reacciona con el carbonato de potasio para producir hidrogenocarbonato de potasio.
- K 2 CO 3 + CO 2 + H 2 O → 2 KHCO 3
Depurador de CO2 : La solución de carbonato de potasio anterior (enriquecida con CO2 ) se envía luego al depurador de CO2 , donde el CO2 se depura mediante una evaporación instantánea en etapas (normalmente en dos etapas) . La primera etapa se realiza para eliminar los gases de hidrocarburos y la segunda etapa se emplea para eliminar el CO2 .
Producción mundial de óxido de etileno
La producción mundial de óxido de etileno fue de 20 Mt (22 millones de toneladas cortas) en 2009, [77] 19 Mt (21 millones de toneladas cortas) en 2008 y 18 Mt (20 millones de toneladas cortas) en 2007. [78] Esto coloca al óxido de etileno en el puesto 14 de los productos químicos orgánicos más producidos, mientras que el más producido fue el etileno con 113 Mt (125 millones de toneladas cortas). [79] SRI Consulting pronosticó un crecimiento del consumo de óxido de etileno del 4,4% anual durante 2008-2013 y del 3% entre 2013 y 2018. [78]
En 2004, la producción mundial de óxido de etileno por región fue la siguiente: [80]
| Región | Número de productores principales | Producción, miles de toneladas |
|---|---|---|
| América del Norte Estados Unidos Canadá México | 10 3 3 | 4009 1084 350 |
| Sudamérica Brasil Venezuela | 2 1 | 312 82 |
| Europa Bélgica Francia Alemania Países Bajos España Turquía Reino Unido Europa del Este | 2 1 4 2 1 1 1 Sin datos | 770 215 995 460 100 115 300 950 |
| Oriente Medio Irán Kuwait Arabia Saudita | 2 1 2 | 201 350 1781 |
| Asia China Taiwán India Indonesia Japón Malasia Corea del Sur Singapur | Sin datos 4 2 1 4 1 3 1 | 1354 820 488 175 949 385 740 80 |
Los mayores productores mundiales de óxido de etileno son Dow Chemical Company (3–3,5 Mt (3,3–3,9 millones de toneladas cortas) en 2006 [81] ), Saudi Basic Industries (2.000–2.500 toneladas (2.200–2.800 toneladas cortas) en 2006 [81] ), Royal Dutch Shell (1,328 Mt (1,464 millones de toneladas cortas) en 2008–2009 [82] [83] [84] ), BASF (1,175 Mt (1,295 millones de toneladas cortas) en 2008–2009 [85] ), China Petrochemical Corporation (~1 Mt (1,1 millones de toneladas cortas) en 2006 [81] ), Formosa Plastics (~1 Mt (1,1 millones de toneladas cortas) en 2006 [81] ) e Ineos (0,92 Mt (1,01 millones de toneladas cortas) en 2008-2009). [86]
Aplicaciones

El óxido de etileno es una de las materias primas más importantes que se utilizan en la producción química a gran escala. La mayor parte del óxido de etileno se utiliza para la síntesis de etilenglicoles , incluidos el dietilenglicol y el trietilenglicol, que representan hasta el 75% del consumo mundial. Otros productos importantes incluyen éteres de etilenglicol, etanolaminas y etoxilatos. Entre los glicoles, el etilenglicol se utiliza como anticongelante , en la producción de poliéster y tereftalato de polietileno (PET, materia prima para botellas de plástico), refrigerantes líquidos y disolventes.
| Sector | Participación de la demanda (%) |
|---|---|
| Agroquímicos | 7 |
| Productos químicos para yacimientos petrolíferos | 10 |
| Detergentes | 25 |
| Textil | 35 |
| Cuidado personal | 10 |
| Productos farmacéuticos | 8 |
| Otros | 5 |
| Total [2009] | 5,2 millones de toneladas |
Los polietilenglicoles se utilizan en perfumes, cosméticos, productos farmacéuticos, lubricantes , diluyentes de pintura y plastificantes . Los éteres de etilenglicol forman parte de líquidos de frenos, detergentes, disolventes, lacas y pinturas. Las etanolaminas se utilizan en la fabricación de jabón y detergentes y para la purificación de gas natural. Los etoxilatos son productos de reacción del óxido de etileno con alcoholes superiores, ácidos o aminas. Se utilizan en la fabricación de detergentes, tensioactivos, emulsionantes y dispersantes . [87]
Si bien la síntesis de etilenglicoles es la principal aplicación del óxido de etileno, su porcentaje varía mucho según la región: desde el 44% en Europa occidental , el 63% en Japón y el 73% en América del Norte hasta el 90% en el resto de Asia y el 99% en África . [88]
Producción de etilenglicol
El etilenglicol se produce industrialmente mediante hidratación no catalítica de óxido de etileno a una temperatura de 200 °C (392 °F) y una presión de 1,5 a 2 MPa (220 a 290 psi): [89]
Los subproductos de la reacción son dietilenglicol, trietilenglicol y poliglicoles con un total de aproximadamente 10%, que se separan del etilenglicol por destilación a presión reducida. [90]
Otro método de síntesis es la reacción de óxido de etileno y CO2 (temperatura 80–120 °C (176–248 °F) y presión de 5,2 MPa (750 psi)) produciendo carbonato de etileno y su posterior hidrólisis con descarboxilación: [89]
Las tecnologías modernas de producción de etilenglicol incluyen las siguientes. [91] La tecnología Shell OMEGA (Only Mono-Ethylene Glycol Advantage) es una síntesis de dos pasos de carbonato de etileno utilizando un haluro de fosfonio como catalizador. El rendimiento de glicol es del 99-99,5%, con otros glicoles prácticamente ausentes. La principal ventaja del proceso es la producción de etilenglicol puro sin la necesidad de una purificación adicional. La primera planta comercial que utiliza este método se inauguró en 2008 en Corea del Sur. [92] Dow METEOR (Most Effective Technology for Ethylene Oxide Reactions) es una tecnología integrada para producir óxido de etileno y su posterior hidrólisis en etilenglicol. El rendimiento de glicol es del 90-93%. La principal ventaja del proceso es la relativa simplicidad, utilizando menos etapas y menos equipo.
La conversión a etilenglicol es también el medio por el cual se depura el óxido de etileno residual antes de liberarlo al medio ambiente. Normalmente, el EtO pasa por una matriz que contiene ácido sulfúrico o permanganato de potasio. [ cita requerida ]
Producción de éteres de glicol
Los principales ésteres industriales de mono-, di- y trietilenglicoles son los éteres de metilo, etilo y butilo normal, así como sus acetatos y ftalatos. La síntesis implica la reacción del alcohol apropiado con óxido de etileno: [93]
La reacción de los monoésteres con un ácido o su anhídrido conduce a la formación de los ésteres:
Producción de etanolaminas
En la industria, las etanolaminas (mono-, di- y trietanolaminas) se producen haciendo reaccionar amoníaco y óxido de etileno en un medio anhidro a una temperatura de 40–70 °C (100–160 °F) y una presión de 1,5–3,5 MPa (220–510 psi) MPa: [94]
En el proceso se producen las tres etanolaminas, mientras que el amoníaco y parte de la metilamina se reciclan. Los productos finales se separan mediante destilación al vacío . Las hidroxialquilaminas se producen en un proceso similar:
Los productos monosustituidos se forman al hacer reaccionar un gran exceso de amina con óxido de etileno en presencia de agua y a una temperatura inferior a 100 °C (212 °F). Los productos disustituidos se obtienen con un pequeño exceso de óxido de etileno, a una temperatura de 120–140 °C (250–280 °F) y una presión de 0,3–0,5 MPa (45–75 psi). [95] [96]
Producción de etoxilatos
La producción industrial de etoxilatos se realiza mediante una reacción directa de alcoholes superiores, ácidos o aminas con óxido de etileno en presencia de un catalizador alcalino a una temperatura de 120–180 °C (250–360 °F). Las plantas modernas que producen etoxilatos se basan generalmente en la tecnología de reactores BUSS LOOP, [97] que se basa en un proceso continuo de tres etapas. En la primera etapa, el iniciador o catalizador de la reacción y la materia prima se introducen en el contenedor, donde se mezclan, se calientan y se secan al vacío. Luego, la reacción se lleva a cabo en un reactor aislado especial en una atmósfera inerte (nitrógeno) para evitar una posible explosión de óxido de etileno. Finalmente, la mezcla de reacción se neutraliza, se desgasifica y se purifica. [98]
Producción de acrilonitrilo
En la actualidad, la mayor parte del acrilonitrilo (90% en 2008) se produce mediante el método SOHIO, que se basa en la oxidación catalítica del propileno en presencia de amoníaco y fosfomolibdato de bismuto. Sin embargo, hasta 1960 un proceso de producción clave era la adición de cianuro de hidrógeno al óxido de etileno, seguida de la deshidratación de la cianhidrina resultante : [99] [100]
- ( CH2CH2 ) O + HCN → HOCH2CH2CN →− H2O CH2 =CH − CN
La adición de ácido cianhídrico al óxido de etileno se lleva a cabo en presencia de un catalizador ( hidróxido de sodio y dietilamina ), y la deshidratación de la cianhidrina ocurre en fase gaseosa tras la acción catalítica del óxido de aluminio . [101]
Usos no industriales
El uso directo de óxido de etileno representa sólo el 0,05% (datos de 2004) de su producción mundial. [80] El óxido de etileno se utiliza como agente esterilizante, desinfectante y fumigante en mezcla con dióxido de carbono (8,5-80% de óxido de etileno), nitrógeno o diclorodifluorometano (12% de óxido de etileno). Se aplica para la esterilización en fase gaseosa de equipos e instrumentos médicos, materiales de embalaje, ropa y equipo quirúrgico y científico; [80] para el procesamiento de instalaciones de almacenamiento (tabaco, paquetes de grano, sacos de arroz, etc.), ropa, pieles y documentos valiosos. [102]
Esterilizante para uso sanitario
El óxido de etileno es uno de los métodos de esterilización más utilizados en la industria de la salud debido a sus efectos no dañinos para instrumentos y dispositivos delicados que requieren esterilización, y por su amplia gama de compatibilidad de materiales. [103] Se utiliza para instrumentos que no toleran el calor, la humedad o los productos químicos abrasivos, como la electrónica, los equipos ópticos, el papel, el caucho y los plásticos. [104] Fue desarrollado en la década de 1940 como esterilizante por el ejército de los EE. UU., y su uso como esterilizante médico se remonta a fines de la década de 1950, cuando se patentó el proceso McDonald para dispositivos médicos. [105] El sistema Anprolene fue patentado en la década de 1960 [106] por Andersen Products, [107] y sigue siendo el sistema más utilizado en varios nichos de mercado, en particular el mercado veterinario y algunos mercados internacionales. [108] Se basa en el uso de una cámara de esterilización flexible y un cartucho de EtO para la esterilización de volúmenes pequeños y cuando consideraciones ambientales o de portabilidad dictan el uso de una dosis baja. Por lo tanto, se lo denomina método de "esterilización en cámara flexible" o método de "esterilización por difusión de gas".
En los Estados Unidos, la operación de esterilización con EtO está supervisada por la EPA a través de las Normas Nacionales de Emisiones para Contaminantes Atmosféricos Peligrosos (NESHAP). [109]
Usos de nicho
El óxido de etileno se utiliza como fungicida y como acelerador de la maduración de las hojas de tabaco. [102] El óxido de etileno también se utiliza como componente principal de las armas termobáricas (explosivos de combustible-aire). [12] [13] [110]
Identificación del óxido de etileno
La cromatografía de gases es el método principal para el análisis y detección de óxido de etileno. [80]
Una prueba económica para el óxido de etileno aprovecha su precipitación de hidróxidos sólidos de metales cuando se pasa a través de soluciones acuosas de sus sales:
De manera similar, el óxido de etileno se detecta por el color rosa brillante del indicador al pasar aire a través de soluciones acuosas de algunas sales de sodio o potasio (cloruros, yoduros, tiosulfatos, etc.) con la adición de fenolftaleína : [111]
Otros métodos de detección de óxido de etileno son [111] las reacciones de color con derivados de piridina y la hidrólisis de etilenglicol con ácido peryódico . El ácido yódico producido se detecta con nitrato de plata .
Accidentes
El óxido de etileno es extremadamente inflamable y sus mezclas con el aire son explosivas. Cuando se calienta, puede expandirse rápidamente, provocando incendios y explosiones. [112] Se han atribuido varios accidentes industriales a explosiones de óxido de etileno. [113] [114] [115]
La temperatura de autoignición es de 429 °C (804 °F), la temperatura de descomposición de 571 °C (1060 °F) a 101,3 kPa (14,69 psi), el contenido mínimo inflamable en el aire es del 2,7 %, [116] y el límite máximo es del 100 %. La clasificación NFPA 704 es Salud, 3; Inflamabilidad, 4; Inestabilidad 2. [117] El óxido de etileno en presencia de agua puede hidrolizarse a etilenglicol y formar óxido de polietileno, que luego finalmente se oxida por el aire y conduce a puntos calientes que pueden desencadenar una descomposición explosiva.
Los incendios provocados por óxido de etileno se extinguen con medios convencionales, como espuma , dióxido de carbono o agua. La supresión de esta actividad se puede realizar mediante una capa de gas inerte hasta que la presión total alcance el rango no explosivo. La extinción del óxido de etileno en llamas es complicada por su capacidad de seguir ardiendo en una atmósfera inerte y en soluciones acuosas. La supresión del incendio se alcanza solo mediante una dilución con agua superior a 22:1. [118]
Accidente en La Canonja, España
El 14 de enero de 2020, en un polígono industrial cercano a Tarragona , se produjo una explosión de un reactor de etoxilación propiedad de la empresa química Industrias Químicas de Óxido de Etileno (IQOXE, parte del Grupo Industrial CL). [119] [120] El accidente lanzó escombros sustanciales en un radio de aproximadamente dos kilómetros y medio, uno de los cuales penetró en una casa distante y mató a un ocupante. [121] Se informa de que al menos tres personas murieron y siete resultaron heridas como resultado directo de la explosión. [122]
La empresa era, hasta el momento de la explosión, el único productor de óxido de etileno en España con una capacidad instalada de 140.000 toneladas/año. La mitad de esa producción se destinaba a la fabricación de etilenglicol para la producción de PET. [123] El accidente será investigado con arreglo a la normativa de la UE en el contexto de la Agencia Europea para la Seguridad y la Salud en el Trabajo .
Contaminación de semillas de sésamo 2020
En septiembre de 2020, se encontraron altos niveles de pesticidas en 268 toneladas de semillas de sésamo de la India . La contaminación tenía un nivel de 1000 a 3500 veces el límite de 0,05 miligramos por kilogramo de óxido de etileno permitido en Europa . Este pesticida está prohibido en Europa, se sabe que es cancerígeno y mutagénico . Se realizó un retiro del producto , la mitad de los productos tenían certificación orgánica . [124] [125]
En septiembre, Bélgica dio la alerta a través de RASFF, pero el producto también se ha vendido en otros países del mercado único de la UE, como Francia [126] e Irlanda.
Efectos fisiológicos
Efecto sobre los microorganismos
La exposición al gas de óxido de etileno provoca la alquilación de microorganismos a nivel nuclear. [127] El efecto desinfectante del óxido de etileno es similar al de la esterilización por calor, pero debido a su penetración limitada, afecta solo a la superficie. La esterilización con óxido de etileno puede tardar hasta 12 horas debido a su acción lenta sobre los microorganismos y al largo tiempo de procesamiento y aireación. [128]
Efectos sobre los seres humanos y los animales
El óxido de etileno es un agente alquilante ; tiene efectos irritantes, sensibilizantes y narcóticos. [129] La exposición crónica al óxido de etileno también es mutagénica . La Agencia Internacional para la Investigación sobre el Cáncer clasifica al óxido de etileno en el grupo 1, lo que significa que es un carcinógeno comprobado . [130] [131] El óxido de etileno está clasificado como un carcinógeno de clase 2 por la comisión MAK alemana y como un carcinógeno de clase A2 por la ACGIH. Un estudio de 2003 de 7.576 mujeres expuestas mientras trabajaban en instalaciones de esterilización comercial en los EE. UU. sugiere que el óxido de etileno está asociado con la incidencia de cáncer de mama . [132] Un estudio de seguimiento de 2004 que analizó a 18.235 trabajadores hombres y mujeres expuestos al óxido de etileno entre 1987 y 1998 concluyó que "había poca evidencia de un exceso de mortalidad por cáncer para la cohorte en su conjunto, con la excepción del cáncer de huesos basado en pequeñas cifras. Se encontraron tendencias positivas de exposición-respuesta para tumores linfoides sólo en los machos. No se conocen las razones de la especificidad sexual de este efecto. También hubo alguna evidencia de una exposición-respuesta positiva para la mortalidad por cáncer de mama". [133] Se encontró una mayor incidencia de tumores cerebrales y leucemia de células mononucleares en ratas que habían inhalado óxido de etileno en concentraciones de 10, 33 o 100 mL/m3 ( 0,0100, 0,0329 o 0,0997 imp fl oz/cu ft) durante un período de dos años. [134] También se observó una mayor incidencia de mesoteliomas peritoneales en los animales expuestos a concentraciones de 33 y 100 mL/m3 ( 0,0329 y 0,0997 imp fl oz/cu ft). Los resultados de los estudios epidemiológicos humanos sobre trabajadores expuestos al óxido de etileno difieren. Hay evidencia de estudios tanto en humanos como en animales de que la exposición por inhalación al óxido de etileno puede producir una amplia gama de efectos cancerígenos.
El óxido de etileno es tóxico por inhalación, con un límite de exposición permisible de la OSHA de EE. UU. calculado como un TWA (promedio ponderado en el tiempo) durante 8 horas de 1 ppm, y un límite de exposición a corto plazo (límite de excursión) calculado como un TWA durante 15 minutos de 5 ppm. [135] En concentraciones en el aire de aproximadamente 200 partes por millón, el óxido de etileno irrita las membranas mucosas de la nariz y la garganta; contenidos más altos causan daño a la tráquea y los bronquios, progresando hacia el colapso parcial de los pulmones. Altas concentraciones pueden causar edema pulmonar y dañar el sistema cardiovascular; el efecto dañino del óxido de etileno puede ocurrir solo después de 72 horas después de la exposición. [26] El contenido máximo de óxido de etileno en el aire según las normas de EE. UU. ( ACGIH ) es de 1,8 mg/m 3 (0,00079 gr/pie cúbico). [136] NIOSH ha determinado que el nivel inmediatamente peligroso para la vida y la salud (IDLH) es de 800 ppm. [137]
Como el umbral de olor del óxido de etileno varía entre 250 y 700 ppm, el gas ya se encuentra en concentraciones tóxicas cuando se puede oler. Incluso en ese caso, el olor del óxido de etileno es dulce y aromático y puede confundirse fácilmente con el aroma del éter dietílico , un disolvente de laboratorio común de muy baja toxicidad. En vista de estas propiedades insidiosas, el control electroquímico continuo es una práctica estándar y está prohibido utilizar óxido de etileno para fumigar el interior de los edificios en la UE y algunas otras jurisdicciones. [138]
El óxido de etileno causa intoxicación aguda, acompañada de una variedad de síntomas. [129] Los efectos del sistema nervioso central se asocian frecuentemente con la exposición humana al óxido de etileno en entornos laborales. Se han reportado dolores de cabeza, náuseas y vómitos. [ aclaración necesaria ] Se han reportado neuropatía periférica, alteración de la coordinación mano-ojo y pérdida de memoria en estudios de casos más recientes de trabajadores expuestos crónicamente a niveles de exposición promedio estimados tan bajos como 3 ppm (con posibles picos a corto plazo tan altos como 700 ppm). [134] El metabolismo del óxido de etileno no se conoce por completo. Los datos de estudios animales indican dos posibles vías para el metabolismo del óxido de etileno: hidrólisis a etilenglicol y conjugación de glutatión para formar ácido mercaptúrico y mettio-metabolitos.
El óxido de etileno penetra fácilmente a través de la ropa y el calzado habituales, provocando irritación de la piel y dermatitis con formación de ampollas, fiebre y leucocitosis . [129]
Los datos de toxicidad del óxido de etileno son los siguientes: [135]
- Exposición ocular: 18 mg (0,28 gr)/6 horas (conejo)
- Oral: 72 mg/kg (0,00115 oz/lb) (rata, LD 50 ), 1186 mg/kg (0,01898 oz/lb) (rata, TD Lo ), 5112 mg/kg (0,08179 oz/lb) (rata, TD )
- Inhalación: 12 500 ppm (humano, TC Lo ), 960 ppm/4 horas (perro, LC 50 ), 33–50 ppm (rata o ratón, TC), 800 ppm/4 horas (rata o ratón, LC 50 ).
- Inyección subcutánea : 100 mg/kg (0,0016 oz/lb) (gato, LD Lo ), 292 mg/kg (0,00467 oz/lb) (ratón, TD Lo ), 900–2600 mg/kg (0,014–0,042 oz/lb) (ratón, TD), 187 mg/kg (0,00299 oz/lb) (rata, LD 50 ).
- Inyección intraperitoneal : 750 mg/kg (0,0120 oz/lb) (ratón, TD Lo ), 175 mg/kg (0,00280 oz/lb) (ratón, LD 50 )
- Inyección intravenosa: 175 mg/kg (0,00280 oz/lb) (conejo, LD 50 ), 290 mg/kg (0,0046 oz/lb) (ratón, LD 50 )
- En 2016, la Agencia de Protección Ambiental de Estados Unidos (USEPA) estimó [139] que, en el caso de dosis bajas, la inhalación de óxido de etileno durante toda la vida podría aumentar el riesgo de cáncer de por vida de una persona hasta en 3,0 × 10 −3 por μg/m 3 (sin tener en cuenta que las exposiciones en los primeros años de vida probablemente sean más potentes). La USEPA estimó la pendiente de la disminución de la relación dosis-respuesta en dosis más altas, y se calcularon estimaciones adicionales del riesgo de cáncer para varios escenarios de exposición ocupacional.
Demanda global
La demanda mundial de EO se ha expandido de 16,6 Mt (18,3 millones de toneladas cortas) en 2004 a 20 Mt (22 millones de toneladas cortas) en 2009, mientras que la demanda de EO refinado se expandió de 4,64 Mt (5,11 millones de toneladas cortas) en 2004 a 5,6 Mt (6,2 millones de toneladas cortas) en 2008. En 2009, se estima que la demanda ha disminuido a alrededor de 5,2 Mt (5,7 millones de toneladas cortas). La demanda total de EO registró una tasa de crecimiento del 5,6% anual durante el período 2005 a 2009 y se proyecta que crezca a un 5,7% anual durante 2009 a 2013. [77]
Normas de salud y seguridad
Según la hoja de datos de seguridad de 2020 de Merck Life Science UK proporcionada al Registro, evaluación, autorización y restricción de sustancias y preparados químicos (REACH) de la Agencia Europea de Sustancias y Preparados Químicos (un reglamento de la Unión Europea de 2006 ), [140] se "presume que el óxido de etileno tiene potencial cancerígeno para los seres humanos". [8]
La EPA de los Estados Unidos publicó un aviso anticipado de propuesta de reglamentación (NPRM) en el Registro Federal del 12 de diciembre de 2019 con el fin de limitar las emisiones de EtO. [141] Durante los dos años siguientes, se recopiló información y se publicó una propuesta de reglamentación sobre sustancias tóxicas del aire en el Registro Federal del 13 de abril de 2023. [142] Tras un período de comentarios de 60 días que podría extenderse, debido a muchos comentarios que solicitan una extensión, las normas de la EPA que podrían reducir las emisiones de EtO, tanto directas como fugitivas, en más del 80% podrían implementarse dentro de los 18 meses posteriores a la publicación de la regla final en el Registro Federal. [143] Los emisores de EtO de laboratorio seguirían estando exentos del cumplimiento más estricto. Además, si bien se reducen eficazmente las emisiones de EtO en los EE. UU., muchos emisores industriales pueden simplemente trasladar su producción de EtO a países cercanos menos estrictos: Canadá, México, etc.
En 2024, Estados Unidos investigó las denuncias de que las populares marcas de curry indio MDH y Everest Spices contenían óxido de etileno después de que Hong Kong y Singapur detectaran la contaminación y tomaran medidas coercitivas contra los productos. [144]
Referencias
- ^ Unión Internacional de Química Pura y Aplicada (2014). Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013. The Royal Society of Chemistry . pág. 714. doi :10.1039/9781849733069. ISBN . 978-0-85404-182-4.
- ^ abcde Haynes, pág. 3.430
- ^ Óxido de etileno, olor
- ^ abcd Guía de bolsillo del NIOSH sobre peligros químicos. "#0275". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Haynes, pág. 3.576
- ^ abc Haynes, pág. 15.20
- ^ abcd Haynes, pág. 5.22
- ^ ab «Óxido de etileno 387614». Sigma-Aldrich . Archivado desde el original el 5 de diciembre de 2020. Consultado el 1 de septiembre de 2020 .URL alternativa
- ^ "Óxido de etileno". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ ab Rebsdat, Siegfried y Mayer, Dieter (2005) "Óxido de etileno" en la Enciclopedia de química industrial de Ullmann . Wiley-VCH, Weinheim. doi :10.1002/14356007.a10_117.
- ^ McKetta, John J.; Cunningham, William A. (1984). Enciclopedia de procesamiento y diseño químico. Vol. 20. CRC Press. pág. 309. ISBN 0-8247-2470-4.
- ^ ab Croddy, Eric; Wirtz, James J. (2005). Armas de destrucción masiva: una enciclopedia de política, tecnología e historia a nivel mundial, volumen 2. ABC-CLIO. pág. 136. ISBN 1-85109-490-3.
- ^ ab Meyer, Rudolf; Kohler, Josef; Homburg, Axel (2007). Explosivos. Wiley-VCH. pag. 142.ISBN 978-3-527-31656-4.
- ^ Esterilización con óxido de etileno: ¿Son seguras las especias tratadas con ETO?, SuperFoodly, 10 de abril de 2017
- ^ Wurtz, A. (1859). "Sobre el óxido de étilo". Cuentas rendus . 48 : 101-105.
- ^ ab Zimakov, PV; Dyment, OH, eds. (1967). "Parte I. Estructura y propiedades del óxido de etileno. Características de la reactividad del óxido de etileno y la estructura de sus moléculas". Óxido de etileno . Khimiya. págs. 15–17.
- ^ Bredig, G.; Usoff, A. (1896). "¿Ist Acetylen ein Elektrolyt?" [¿Es el acetileno un electrolito?]. Zeitschrift für Elektrochemie . 3 : 116-117.
- ^ Eugen F. von Gorup-Besanez , ed., Lehrbuch der organischen Chemie für den Unterricht auf Universitäten... [Libro de texto de química orgánica para la enseñanza en universidades ...], 3ª ed. (Braunschweig, Alemania: Friedrich Vieweg und Sohn, 1868), vol. 2, pág. 286.
Véase también pág. 253 de la edición de 1876: Eugen F. von Gorup-Besanez, ed., Lehrbuch der organischen Chemie für den Unterricht auf Universitäten ..., 5ª ed. (Braunschweig, Alemania: Friedrich Vieweg und Sohn, 1876), vol. 2. - ^ abcde "Óxido de etileno". Enciclopedia Kirk-Othmer de tecnología química. Elastómeros, sintéticos para sistemas expertos . Vol. 9 (4.ª ed.). Nueva York: John Wiley & Sons. 1994. págs. 450–466. ISBN 978-0-471-48514-8.
- ^ Lefort, TE (23 de abril de 1935) "Proceso para la producción de óxido de etileno". Patente estadounidense 1.998.878
- ^ McClellan, PP (1950). "Fabricación y usos de óxido de etileno y etilenglicol". Ind. Eng. Chem . 42 (12): 2402–2407. doi :10.1021/ie50492a013.
- ^ Knunyants, IL, ed. (1988). "Moléculas de voltaje". Enciclopedia química . Enciclopedia soviética . Vol. 3. págs. 330–334.
- ^ de Traven VF (2004). VF Traven (ed.). Química orgánica: libro de texto para escuelas . Vol. 2. ECC "Academkniga". págs. 102–106. ISBN 5-94628-172-0.
- ^ Cunningham GL; Levan WI; Gwinn WD (1948). "El espectro rotacional del óxido de etileno". Phys. Rev . 74 (10): 1537. Bibcode :1948PhRv...74.1537C. doi :10.1103/PhysRev.74.1537.
- ^ Kondrat'ev, VN, ed. (1974). Energía de los enlaces químicos. Potenciales de ionización y afinidad electrónica . Nauka. págs. 77-78.
- ^ ab "Pautas de manejo médico para el óxido de etileno". Pautas de manejo médico (MMG) . Agencia para Sustancias Tóxicas y Registro de Enfermedades. Archivado desde el original el 6 de junio de 2011. Consultado el 29 de septiembre de 2009 .
- ^ "Этилена окись (óxido de etileno)" (en ruso). Gran enciclopedia soviética . Consultado el 25 de septiembre de 2009 .
- ^ "Термодинамические показатели органических соединений" (en ruso). ChemAnalitica.com. 1 de abril de 2009 . Consultado el 21 de septiembre de 2009 .
- ^ "Tensión superficial del gas licuado en la frontera con su propio vapor". ChemAnalitica.com. 1 de abril de 2009. Consultado el 21 de septiembre de 2009 .
- ^ "Punto de ebullición o sublimación (°C) de materia orgánica a presión de vapor superior a 101,3 kPa". ChemAnalitica.com. 1 de abril de 2009. Consultado el 21 de septiembre de 2009 .
- ^ "Viscosidad de compuestos orgánicos". ChemAnalitica.com. 1 de abril de 2009. Consultado el 21 de septiembre de 2009 .
- ^ "Presión de vapor de compuestos orgánicos". ChemAnalitica.com. 1 de abril de 2009. Consultado el 21 de septiembre de 2009 .
- ^ abcde Zimakov, PV; Dyment, OH, eds. (1967). "Capítulo III. Revisión de las reacciones individuales del óxido de etileno". Óxido de etileno . Khimiya. págs. 90–120.
- ^ "Epoxietano (óxido de etileno)". Menú de alquenos . Chemguide . Consultado el 5 de octubre de 2009 .
- ^ van Os; NM, eds. (1998). Surfactantes no iónicos: química orgánica. CRC Press. págs. 129-131. ISBN 978-0-8247-9997-7.
- ^ Petrov, AA; Balian HV; Troshchenko AT (2002). "Capítulo 12. Aminoalcohol". En Stadnichuk (ed.). Química orgánica (5.ª ed.). San Petersburgo. p. 286. ISBN 5-8194-0067-4.
{{cite book}}: CS1 maint: location missing publisher (link) - ^ Sheppard, William A.; Sharts, Clay M. (1969). Química orgánica del flúor . W. A. Benjamin. pág. 98. ISBN 0-8053-8790-0.
- ^ Kendall, EC y McKenzie, B. (1923). "o-Chloromercuriphenol". Síntesis orgánicas . 3 : 57
{{cite journal}}: CS1 maint: multiple names: authors list (link). - ^ Noland, Wayland E. (1973). "2-Nitroetanol". Síntesis orgánicas . 5 : 833.
- ^ Orlova, EY (1981). Química y tecnología de explosivos de alta potencia: libro de texto para escuelas secundarias (3.ª ed.). Khimiya. pág. 278.
- ^ Vogel, AI (1989). Vogel's Textbook of practical organic chemistry (5.ª ed.). Reino Unido: Longman Scientific & Technical. pág. 1088. ISBN 0-582-46236-3.
- ^ Watson, James M. y Forward, Cleve (17 de abril de 1984) "Reacción de benceno con óxido de etileno para producir estireno" Patente estadounidense 4.443.643
- ^ ab Hiraoka M. (1982). Compuestos corona. Sus características y aplicaciones . Kodansha. págs. 33-34. ISBN 4-06-139444-4.
- ^ HW Roesky; HG Schmidt (1985). "Reacción de óxido de etileno con dióxido de azufre en presencia de iones de cesio: síntesis de 1,3,6,9,2 λ 4 -Tetraoxatia-2-cicloundecanona". Angewandte Chemie International Edition . 24 (8): 695. doi :10.1002/anie.198506951.
- ^ Petrov, AA; Balian HV; Troshchenko AT (2002). "Capítulo 4. Éteres". Química orgánica (5.ª ed.). San Petersburgo. pp. 159-160. ISBN 5-8194-0067-4.
{{cite book}}: CS1 maint: location missing publisher (link) - ^ ab Benson SW (1964). "Pirólisis de óxido de etileno. Una reacción de molécula caliente". The Journal of Chemical Physics . 40 (1): 105. Bibcode :1964JChPh..40..105B. doi :10.1063/1.1729851.
- ^ abcd Zimakov, PV; Dyment, OH, eds. (1967). "Capítulo II. Propiedades químicas del óxido de etileno". Óxido de etileno . Khimiya. págs. 57–85.
- ^ de Hudlický, M. (1984). Reducciones en química orgánica . Chichester: Ellis Horwood Limited. pág. 83. ISBN 0-85312-345-4.
- ^ Dagaut P.; Voisin D.; Cathonnet M.; Mcguinness M.; Simmie JM (1996). "La oxidación del óxido de etileno en un reactor de chorro agitado y su ignición en ondas de choque". Combustion and Flame . 156 (1–2): 62–68. doi :10.1016/0010-2180(95)00229-4.
- ^ Stapp, Paul R. (21 de diciembre de 1976) "Ciclodimerización de óxido de etileno", patente estadounidense 3.998.848
- ^ abc Dyment, EN; Kazanskii, KS; Miróshnikov AM (1976). Dyment, ON (ed.). Гликоли и другие производные окисей этилена и пропилена [ Glicoles y otros derivados del óxido de etileno y del propileno ]. Jimiya. págs. 214-217.
- ^ ab Salamone, Joseph C., ed. (1996). Enciclopedia de materiales poliméricos . Vol. 8. CRC Press. págs. 6036–6037. ISBN 978-0-8493-2470-3.
- ^ Neufeld LM; Blades AT (1963). "La cinética de las reacciones térmicas del óxido de etileno". Revista canadiense de química . 41 (12): 2956–2961. doi :10.1139/v63-434.
- ^ ab Lifshitz A.; Ben-Hamou H. (1983). "Reacciones térmicas de éteres cíclicos a altas temperaturas. 1. Pirólisis de óxido de etileno tras choques reflejados". The Journal of Physical Chemistry . 87 (10): 1782–1787. doi :10.1021/j100233a026.
- ^ Gilchrist T. (1985). Química heterocíclica . Pearson Education. págs. 411-412. ISBN. 81-317-0793-8.
- ^ ab Smith, Michael B.; March, Jerry (2007). Química orgánica avanzada. Reacciones, mecanismos y estructura. Wiley-Interscience. ISBN 978-0-471-72091-1.
- ^ Fieser, L.; Fieser, M. (1979). Reactivos para Síntesis Orgánica . vol. 7. Wiley. pag. 545.ISBN 978-0-471-02918-2.
- ^ Sheldon RA (1983). Productos químicos a partir de gas de síntesis: reacciones catalíticas de CO y CO2, volumen 2. Springer. pág. 193. ISBN 90-277-1489-4.
- ^ ab Fieser, L.; Fieser, M. (1977). Reactivos para Síntesis Orgánica . vol. 6. Wiley. pag. 197.ISBN 978-0-471-25873-5.
- ^ Han, Yuan-Zhang y Viswanathan, Krishnan (13 de febrero de 2003) "Hidroformilación de óxido de etileno", patente estadounidense 20.030.032.845
- ^ Zimakov, PV; Dyment, OH, eds. (1967). "Capítulo V. Producción de óxido de etileno a través del etileno". Óxido de etileno . Khimiya. págs. 155–182.
- ^ abc Zimakov, PV; Dyment, OH, eds. (1967). "Parte II. Síntesis de óxido de etileno. Resumen de las reacciones de formación de óxido de etileno y otros α-óxidos". Óxido de etileno . Khimiya. págs. 145–153.
- ^ McMurry J. (2008). Química orgánica (7.ª ed.). Thomson. pág. 661. ISBN 978-0-495-11258-7.
- ^ Norris, JF (1919). "La fabricación de gases de guerra en Alemania". Revista de química industrial e ingeniería . 11 (9): 817–829. doi :10.1021/ie50117a002.
- ^ ab Weissermel K.; Arpe HJ. (2003). Química orgánica industrial (4 ed.). Weinheim: Wiley-VCH. págs. 145-148. ISBN 978-3-527-30578-0.
- ^ Estudio de mercado: etileno Archivado el 7 de marzo de 2015 en Wayback Machine . Ceresana.com (diciembre de 2010). Recuperado el 8 de mayo de 2017.
- ^ "Informe del programa de economía de procesos 2D". Informe PEP . SRI Consulting. Febrero de 1985. Consultado el 19 de noviembre de 2009 .
- ^ abcd Yukelson II (1968). La tecnología de la síntesis orgánica básica . Khimiya. págs. 554–559.
- ^ Eley, DD; Pines, H.; Weisz, PB, eds. (1967). "Oxidación catalítica de olefinas". Avances en catálisis y temas relacionados . Vol. 17. Nueva York: Academic Press Inc. pp. 156–157.
- ^ abc Bloch HP; Godse A. (2006). Compresores y aplicaciones de procesos modernos . John Wiley and Sons. págs. 295–296. ISBN 978-0-471-72792-7.
- ^ "Proceso de óxido de etileno/glicol de etileno". Licencias de procesos e ingeniería . Scientific Design Company. Archivado desde el original el 16 de julio de 2011. Consultado el 3 de octubre de 2009 .
- ^ Chauvel A.; Lefebvre G. (1989). Procesos petroquímicos 2. Principales derivados oxigenados, clorados y nitrados . Vol. 2 (2.ª ed.). París: Ediciones Technip. p. 4. ISBN 2-7108-0563-4.
- ^ ab Kilty PA; Sachtler WMH (1974). "El mecanismo de la oxidación selectiva del etileno a óxido de etileno". Catalysis Reviews: Science and Engineering . 10 : 1–16. doi :10.1080/01614947408079624.
- ^ Özbek, MO; van Santen, RA (2013). "El mecanismo de catálisis de la epoxidación de etileno". Catalysis Letters . 143 (2): 131–141. doi :10.1007/s10562-012-0957-3. S2CID 95354803.
- ^ ab Lebedev, NN (1988). Química y tecnología de la síntesis orgánica y petroquímica básica (4.ª ed.). Khimiya. págs. 420–424. ISBN 5-7245-0008-6.
- ^ Gunardson H. (1998). Gases industriales en el procesamiento petroquímico . Nueva York: Marcel Dekker, Inc., págs. 131-132. ISBN 0-8247-9908-9.
- ^ ab Dutia, Pankaj (26 de enero de 2010). "Óxido de etileno: un perfil técnico-comercial" (PDF) . Chemical Weekly . Archivado desde el original (PDF) el 2 de abril de 2015.
- ^ ab "Óxido de etileno". Informe WP . SRI Consulting. Enero de 2009. Consultado el 29 de septiembre de 2009 .
- ^ "Etileno". WP Report . SRI Consulting. Enero de 2009 . Consultado el 29 de septiembre de 2009 .
- ^ abcde "Vol. 97. 1,3-Butadieno, óxido de etileno y haluros de vinilo (fluoruro de vinilo, cloruro de vinilo y bromuro de vinilo)". Monografías del IARC sobre la evaluación de los riesgos carcinógenos para los seres humanos . Lyon: Agencia Internacional para la Investigación sobre el Cáncer. 2008. págs. 185–287. ISBN 978-92-832-1297-3Archivado desde el original el 25 de diciembre de 2016 . Consultado el 11 de enero de 2019 .
- ^ abcd Devanney MT (abril de 2007). "Óxido de etileno". SEH Peport . SRI Consulting . Consultado el 19 de noviembre de 2009 .
- ^ "Descripción general". Mitsubishi Chemical Corporation. Archivado desde el original el 25 de febrero de 2017. Consultado el 12 de octubre de 2009 .
- ^ "Shell Chemical LP – Geismar, Estados Unidos de América". Lugares de fabricación . Shell Chemicals. Archivado desde el original el 18 de octubre de 2010 . Consultado el 12 de octubre de 2009 .
- ^ "Shell Nederland Chemie BV – Moerdijk, Países Bajos". Lugares de fabricación . Shell Chemicals. Archivado desde el original el 18 de octubre de 2010 . Consultado el 12 de octubre de 2009 .
- ^ "Segmento Productos Químicos – Productos". BASF. 28 de febrero de 2009. Archivado desde el original el 4 de marzo de 2016. Consultado el 12 de octubre de 2009 .
- ^ "Óxido de etileno (EO)". Óxido de Ineos. Archivado desde el original el 8 de junio de 2013. Consultado el 12 de octubre de 2009 .
- ^ "Descripción general del producto óxido de etileno". Óxido de etileno . Shell Chemicals. Archivado desde el original el 16 de octubre de 2010. Consultado el 8 de octubre de 2009 .
- ^ "Usos y datos de mercado del óxido de etileno (EO)". Chemical Intelligence . Chemical Industry News & Intelligence (ICIS.com). Archivado desde el original el 28 de enero de 2013 . Consultado el 8 de octubre de 2009 .
- ^ ab Knunyants, IL, ed. (1988). "Etileno". Enciclopedia química . Enciclopedia soviética . Vol. 5. págs. 984–985.
- ^ Zoller, Uri; Sosis, Paul, eds. (2008). Manual de detergentes, Parte F: Producción . CRC Press. págs. 518–521. ISBN 978-0-8247-0349-3.
- ^ Naqvi, Syed (septiembre de 2009). "Informe del programa de economía de procesos 2I". PEP Peport . SRI Consulting . Consultado el 20 de octubre de 2009 .
- ^ OMEGA cumple con los requisitos de los fabricantes de etilenglicol, Shell (octubre de 2008).
- ^ McKetta, John J.; Cunningham, William A., eds. (1984). Enciclopedia de procesamiento y diseño químico . Vol. 20. Nueva York: Marcel Dekker, Inc., págs. 259-260. ISBN 0-8247-2470-4.
- ^ "Tecnología de la etanolamina". Tecnología . Himtek Engineering. Archivado desde el original el 2 de marzo de 2005 . Consultado el 22 de octubre de 2009 .
- ^ Chekalin MA, Passet BV, Ioffe BA (1980). La tecnología de los colorantes orgánicos y productos intermedios: un manual para técnicos (2.ª ed.). Khimiya. pág. 185.
- ^ Óxido de etileno Tema de seguridad y salud en el trabajo de NIOSH. Recuperado el 15 de octubre de 2012.
- ^ Farn, RJ, ed. (2006). Química y tecnología de los surfactantes . Blackwell Publishing. pág. 133. ISBN 1-4051-2696-5.
- ^ "Alcoxilación". Reactor BUSS LOOP . Buss ChemTech AG. Archivado desde el original el 8 de marzo de 2012. Consultado el 21 de octubre de 2009 .
- ^ "El proceso de acrilonitrilo de Sohio". Monumentos químicos históricos nacionales . Sociedad Química Estadounidense. Archivado desde el original el 23 de febrero de 2013. Consultado el 25 de junio de 2012 .
- ^ "13.1.3.5. Amonolisis oxidativa de hidrocarburos". ChemAnalitica.com. 1 de abril de 2009. Consultado el 22 de octubre de 2009 .
- ^ Andrés, F.; Grabe, K. (1969). Propilenquimia . Akademie-Verlag. págs. 117-118.
- ^ ab "Óxido de etileno". Chemical Backgrounders Index . The Environment Writer. Archivado desde el original el 28 de agosto de 2006 . Consultado el 29 de septiembre de 2009 .
- ^ "Esterilización con óxido de etileno". Isometrix. Archivado desde el original el 2 de abril de 2016.
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ^ "3M sobre esterilizadores de EtO y proceso de esterilización con EtO" . Consultado el 21 de marzo de 2013 .
- ^ "Historia del óxido de etileno". Isometrix. Archivado desde el original el 2 de abril de 2016.
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ^ "Patente del Dr. HW Andersen sobre el sistema de cámara flexible de óxido de etileno". Archivado desde el original el 6 de marzo de 2016 . Consultado el 21 de marzo de 2013 .
- ^ "Productos Andersen". Archivado desde el original el 26 de febrero de 2013. Consultado el 21 de marzo de 2013 .
- ^ "Universidad de Pensilvania, Usos del óxido de etileno en las prácticas veterinarias". Archivado desde el original el 9 de noviembre de 2013. Consultado el 21 de marzo de 2013 .
- ^ US EPA, OAR (25 de junio de 2015). "Estándares de emisiones de óxido de etileno para instalaciones de esterilización: Estándares nacionales de emisiones para contaminantes atmosféricos peligrosos (NESHAP)" (Otras políticas y orientaciones) . Consultado el 30 de diciembre de 2021 .
- ^ Hardy, Periam B.; Gay, Lewis L.; y Husler, Edward L. (2 de enero de 1979) "Bomba de combustible-aire" Patente estadounidense 4.132.170
- ^ ab Zimakov, PV; Dyment, OH, eds. (1967). "Capítulo IV Métodos de análisis de óxido de etileno". Óxido de etileno . Khimiya. págs. 128–140.
- ^ "Óxido de etileno". ICSC/International Chemical Safety Cards . Instituto de Seguridad Industrial, Protección Laboral y Asociación Social. Archivado desde el original el 28 de diciembre de 2005. Consultado el 21 de septiembre de 2009 .
- ^ "CSB publica informe final sobre la explosión de 2004 en las instalaciones de Sterigenics International en Ontario, California: señala la falta de controles de ingeniería y comprensión de los peligros del proceso - Investigaciones - Noticias - CSB". csb.gov . Consultado el 29 de marzo de 2018 .
- ^ "Explosión de óxido de etileno en Sterigenics – Videos de seguridad – Multimedia – CSB". csb.gov . Consultado el 29 de marzo de 2018 .
- ^ "Detalle de inspección de OSHA". osha.gov . Consultado el 24 de mayo de 2018 .
- ^ "Óxido de etileno". Guía de salud y seguridad . Programa Internacional de Seguridad Química (IPCS) INCHEM. 1988. Consultado el 23 de septiembre de 2009 .
- ^ "ÓXIDO DE ETILENO CON NITRÓGENO | CAMEO Chemicals | NOAA". cameochemicals.noaa.gov . Consultado el 21 de marzo de 2023 .
- ^ "Literatura sobre seguridad del óxido de etileno" (PDF) . Shell Chemicals. Archivado desde el original (PDF) el 3 de marzo de 2016 . Consultado el 23 de octubre de 2009 .
- ^ López, Jonathan. "El parque químico de Tarragona funciona con normalidad tras la explosión del IQOXE que deja dos muertos". Icis . Consultado el 16 de enero de 2020 .
- ^ Galocha, A.; Zafra, M.; y Clemente, Y. (16 de enero de 2020) Reconstrucción visual |Así fue la explosión en la petroquímica de Tarragona. El País
- ^ Explosión en planta química española mata a un hombre a 3 km de distancia. BBC . 15 de enero de 2020
- ^ Muere una tercera persona a causa de la explosión en la planta petroquímica de Tarragona. El Mundo . 15 enero 2020
- ^ Quiénes somos. Empresa IQOXE
- ^ Clark, Marler (30 de septiembre de 2020). "La UE endurece las normas para las semillas de sésamo procedentes de la India". Noticias sobre seguridad alimentaria .
- ^ Mandalia, Bhavi (21 de noviembre de 2020). "franceinfo conso. Un pesticida cancerígeno en las semillas de sésamo". Pledge Times . Archivado desde el original el 1 de diciembre de 2020.
- ^ Sésamo, psyllium, épices et otros productos rappelés comprenant ces ingrédients. economie.gouv.fr
- ^ "Esterilización con óxido de etileno". NASPCO . Archivado desde el original el 8 de julio de 2018. Consultado el 10 de febrero de 2017 .
- ^ "Óxido de etileno (ETO): propiedades, modo de acción y usos". Microbe Online . 26 de diciembre de 2013 . Consultado el 10 de febrero de 2017 .[ enlace muerto permanente ]
- ^ abc "Sustancias nocivas. Sección 4. Compuestos heterocíclicos. Compuestos heterocíclicos triplex". ChemAnalitica.com. 1 de abril de 2009. Consultado el 21 de septiembre de 2009 .
- ^ Collins JL "Compuestos epóxicos". Enciclopedia de la OIT . Instituto de Seguridad Industrial, Protección Laboral y Asociación Social . Consultado el 25 de septiembre de 2009 .
- ^ "Vol. 60. Algunas sustancias químicas industriales". Monografías del IARC sobre la evaluación de los riesgos carcinógenos para los seres humanos . Lyon: Agencia Internacional para la Investigación sobre el Cáncer. 1999. ISBN 978-92-832-1297-3Archivado desde el original el 3 de marzo de 2016 . Consultado el 28 de junio de 2007 .
- ^ Steenland, K.; Whelan, E.; Deddens, J.; Stayner, L.; Ward, E. (2003). "El óxido de etileno y la incidencia del cáncer de mama en un estudio de cohorte de 7576 mujeres (Estados Unidos)". Causas y control del cáncer . 14 (6): 531–9. doi :10.1023/A:1024891529592. PMID 12948284. S2CID 20888472.
- ^ Steenland, K; Stayner, L; Deddens, J (2004). "Análisis de mortalidad en una cohorte de 18 235 trabajadores expuestos al óxido de etileno: seguimiento ampliado de 1987 a 1998". Medicina ocupacional y ambiental . 61 (1): 2–7. PMC 1757803 . PMID 14691266.
- ^ ab Perfil toxicológico del óxido de etileno. Agencia para Sustancias Tóxicas y el Registro de Enfermedades, Servicios de Salud Pública de EE. UU.
- ^ ab Simmons, H. Leslie (1997). Materiales de construcción: propiedades peligrosas de los productos en las divisiones 7 y 9 de MasterFormat. John Wiley & Sons. pág. 146. ISBN 978-0-442-02289-1.Códigos Archivado el 2 de abril de 2015 en Wayback Machine .
- ^ Carson PA; Mumford CJ (1994). Manuales de productos químicos peligrosos . Oxford: Butterworth-Heinemann Ltd., pág. 85. ISBN 0-7506-0278-3.
- ^ Valores de peligro inmediato para la vida o la salud (IDLH). Cdc.gov. Recuperado el 8 de mayo de 2017.
- ^ Dirección de Regulación de Productos Químicos. "Plaguicidas prohibidos y no autorizados en el Reino Unido" . Consultado el 1 de diciembre de 2009 .
- ^ Evaluación de la carcinogenicidad por inhalación del óxido de etileno (PDF) . Agencia de Protección Ambiental de Estados Unidos. 2016.
- ^ Reglamento (CE) n.º 1907/2006. Parlamento Europeo. 18 de diciembre de 2006
- ^ "ETO Advance NPRM" (PDF) .
- ^ "Federal Register :: Request Access" (Registro Federal :: Solicitud de acceso). unblock.federalregister.gov . Consultado el 26 de mayo de 2023 .
- ^ Reunión pública de la EPA de EE. UU.: seminario web público nacional sobre ETO , consultado el 26 de mayo de 2023
- ^ "MDH y Everest: funcionarios de salud de EE. UU. investigan afirmaciones sobre pesticidas en mezclas de especias indias". 27 de abril de 2024. Consultado el 29 de mayo de 2024 .
Fuentes citadas
- Haynes, William M., ed. (2011). Manual de química y física del CRC (92.ª edición). Boca Raton, FL: CRC Press . ISBN 978-1439855119.
Enlaces externos
- EOSA promueve el uso seguro del óxido de etileno para la esterilización
- Página web del libro C2H4O
- Instituto Nacional de Seguridad y Salud Ocupacional – Página temática sobre óxido de etileno
- CDC – Guía de bolsillo de NIOSH sobre peligros químicos
- Nota de la EOSA sobre el óxido de etileno (EtO) Archivado el 15 de octubre de 2017 en Wayback Machine









![{\displaystyle {\ce {(CH2CH2)O{}+RMgBr->R-CH2CH2-OMgBr->[{\ce {H2O}}]{\overset {primario~alcohol}{R-CH2CH2-OH}}} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7c48438564bd8b7fde140b00ad4dfd092cd8f6ce)
![{\displaystyle {\ce {(CH2CH2)O{}+{\overset {alquil~litio}{RLi}}->R-CH2CH2-OLi->[{\ce {H2O}}]R-CH2CH2-OH} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7141d68bc0b387f64be9a5ec8ef6ac288cc78080)
![{\displaystyle {\ce {(CH2CH2)O{}+{\overset {ácido nítrico \atop}{HNO3}}->HO-CH2CH2-ONO2->[{\ce {+HNO3}}][{\ce {-H2O}}]O2NO-CH2CH2-ONO_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2371038f32a4744baec84d923cabd0010e476b31)
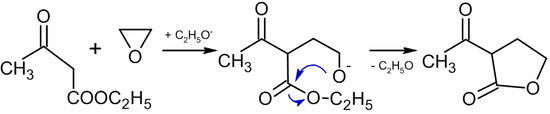


![{\displaystyle {\ce {(CH2CH2)O->[{\ce {200^{\circ }C}}][{\ce {Al2O3}}]{\overset {acetaldehído}{CH3CHO}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/200d83d07cf99e53654b630ae258d28935f164ae)
![{\displaystyle {\ce {(CH2CH2)O{}+H2->[{} \atop {\ce {Ni,Pt,Pd,BH3,LiAlH4}}{\text{ u otros hidruros}}][{\ce {80^{\circ }C}}]{\underset {etanol}{C2H5OH}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a842a87705b878acc5bca8ced590191d4a4d4ba6)
![{\displaystyle {\ce {(CH2CH2)O{}+H2->[{} \atop {\ce {{Zn}+CH3COOH}}]{\underset {etileno}{CH2=CH2}}+H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/75380f885abd2d715c695d5fa331d4c79c140286)
![{\displaystyle {\ce {(CH2CH2)O{}+O2->[{\ce {AgNO3}}]{\overset {ácido\ glicólico}{HOCH2CO2H}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/03dd0ccebb53c85777b3684cd096d167877bc1a9)


![{\displaystyle n{\ce {(CH2CH2)O ->[{\ce {SnCl4}}]}}\ \overbrace {{\ce {(CH2CH2-O-)}}_{n}} ^{{\ ce {polietilenglicol}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c8bba2c593a453d067fd3451b740268bbdcfade3)
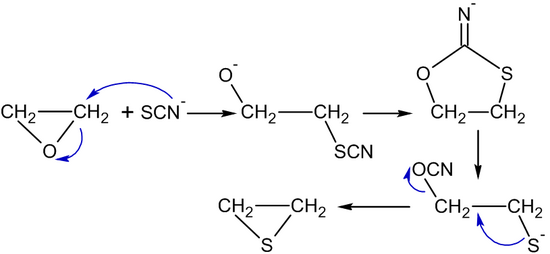
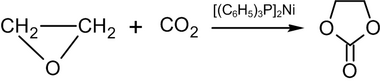
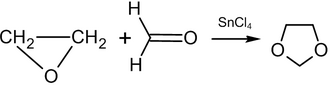
![{\displaystyle {\ce {(CH2CH2)O + CO + H2 -> CHO-CH2CH2-OH ->[{\ce {+H2}}] HO-CH2CH2CH2-OH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/05c6cde688a68ef90108f9182bc519513f78e6b5)




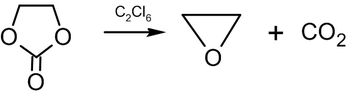
![{\displaystyle {\ce {2CH_2=CH2 + O2 ->[{\ce {Ag}}] 2(CH2CH2)O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3fde14a6cc111cfdc46c6324e44a305aae14f8ce)

![{\displaystyle {\ce {(CH2CH2)O{}+CO2->{\overset {carbonato\ de etileno}{(O-CH2CH_{2}-O)C=O}}->[{\ce {+H2O }}][{\ce {-CO2}}]HOCH2CH2OH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d3a0280675f689878768f65af0ceb86f75fa2e00)











