Cianuro de hidrógeno
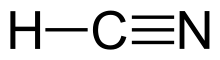 | |||
| |||
 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Formonitrilo [2] | |||
| Nombre sistemático de la IUPAC Metanonitrilo [2] | |||
Otros nombres
| |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 3DMet |
| ||
| EBICh | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.000.747 | ||
| Número CE |
| ||
| BARRIL | |||
| Malla | Hidrógeno + Cianuro | ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 1051 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| Propiedades | |||
| HCN | |||
| Masa molar | 27,0253 g/mol | ||
| Apariencia | Líquido o gas incoloro | ||
| Olor | parecido a la almendra amarga [3] | ||
| Densidad | 0,6876 g/cm3 [ 4] | ||
| Punto de fusión | -13,29 °C (8,08 °F; 259,86 K) [4] | ||
| Punto de ebullición | 26 °C (79 °F; 299 K) [4] : 4,67 | ||
| Miscible | |||
| Solubilidad en etanol | Miscible | ||
| Presión de vapor | 100 kPa (25 °C) [4] : 6,94 | ||
Constante de la ley de Henry ( k H ) | 75 μmol Pa −1 kg −1 | ||
| Acidez (p K a ) | 9.21 (en agua), 12,9 (en DMSO) [5] | ||
| Basicidad (p K b ) | 4,79 (anión cianuro) | ||
| Ácido conjugado | Hidrocianonio | ||
| Base conjugada | Cianuro | ||
Índice de refracción ( n D ) | 1.2675 [6] | ||
| Viscosidad | 0,183 mPa·s (25 °C) [4] : 6,231 | ||
| Estructura | |||
| tetragonal (>170 K) ortorrómbico (<170 K) [7] | |||
| C∞v | |||
| Lineal | |||
| 2,98 dólares | |||
| Termoquímica | |||
Capacidad calorífica ( C ) | 35,9 JK −1 mol −1 (gas) [4] : 5,19 | ||
Entropía molar estándar ( S ⦵ 298 ) | 201,8 JK -1 mol -1 | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | 135,1 kJ mol −1 | ||
| Peligros | |||
| Etiquetado SGA : | |||
    | |||
| Peligro | |||
| H225 , H300+H310+H330 , H319 , H336 , H370 , H410 | |||
| P210 , P261 , P305+P351+P338 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | -17,8 °C (0,0 °F; 255,3 K) | ||
| 538 °C (1000 °F; 811 K) | |||
| Límites de explosividad | 5,6% – 40,0% [8] | ||
| Dosis o concentración letal (LD, LC): | |||
LC 50 ( concentración media ) | 501 ppm (rata, 5 min) 323 ppm (ratón, 5 min) 275 ppm (rata, 15 min) 170 ppm (rata, 30 min) 160 ppm (rata, 30 min) 323 ppm (rata, 5 min) [9] | ||
LC Lo ( valor más bajo publicado ) | 200 ppm (mamífero, 5 min) 36 ppm (mamífero, 2 h) 107 ppm (humano, 10 min) 759 ppm (conejo, 1 min) 759 ppm (gato, 1 min) 357 ppm (humano, 2 min) 179 ppm (humano, 1 h) [9] | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | TWA 10 ppm (11 mg/m 3 ) [piel] [8] | ||
REL (recomendado) | ST 4,7 ppm (5 mg/m 3 ) [piel] [8] | ||
IDLH (Peligro inmediato) | 50 ppm [8] | ||
| Compuestos relacionados | |||
Alcanonitrilos relacionados | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El cianuro de hidrógeno (antes conocido como ácido prúsico ) es un compuesto químico con la fórmula HCN y la fórmula estructural H−C≡N . Es un líquido altamente tóxico e inflamable que hierve ligeramente por encima de la temperatura ambiente , a 25,6 °C (78,1 °F). El HCN se produce a escala industrial y es un precursor muy valorado de muchos compuestos químicos que van desde polímeros hasta productos farmacéuticos. Las aplicaciones a gran escala son para la producción de cianuro de potasio y adiponitrilo , utilizados en minería y plásticos, respectivamente. [10] Es más tóxico que los compuestos de cianuro sólido debido a su naturaleza volátil . Una solución de cianuro de hidrógeno en agua , representada como HCN, se llama ácido cianhídrico . Las sales del anión cianuro se conocen como cianuros .
Si el cianuro de hidrógeno es un compuesto orgánico o no es un tema de debate entre los químicos, y las opiniones varían de un autor a otro. Tradicionalmente, un número significativo de autores lo consideran inorgánico . Contrariamente a esta opinión, otros autores lo consideran orgánico, porque el cianuro de hidrógeno pertenece a la clase de compuestos orgánicos conocidos como nitrilos que tienen la fórmula R−C≡N , donde R es típicamente un grupo organilo (por ejemplo, alquilo o arilo ) o hidrógeno . [11] En el caso del cianuro de hidrógeno, el grupo R es hidrógeno H, por lo que los otros nombres del cianuro de hidrógeno son metanonitrilo y formonitrilo. [2]
Estructura y propiedades generales
El cianuro de hidrógeno es una molécula lineal , con un triple enlace entre el carbono y el nitrógeno . El tautómero del HCN es HNC, isocianuro de hidrógeno . [ cita requerida ]
El HCN tiene un ligero olor a almendra amarga que algunas personas no pueden detectar debido a un rasgo genético recesivo . [12] El compuesto volátil se ha utilizado como rodenticida inhalatorio y veneno humano, así como para matar ballenas. [13] Los iones de cianuro interfieren con las enzimas respiratorias que contienen hierro. [ cita requerida ]
Propiedades químicas
El cianuro de hidrógeno es débilmente ácido con un p K a de 9,2. Se ioniza parcialmente en agua para dar el anión cianuro , CN − . El HCN forma enlaces de hidrógeno con su base conjugada, especies como (CN − )(HCN) n . [14]
El cianuro de hidrógeno reacciona con alquenos para formar nitrilos. La conversión, llamada hidrocianación , emplea complejos de níquel como catalizadores. [15]
- RCH=CH2 + HCN → RCH2 - CH2CN
Cuatro moléculas de HCN se tetramerizarán en diaminomaleonitrilo . [16]
Los cianuros metálicos se preparan típicamente por metátesis de sales de cianuro de metales alcalinos, pero el cianuro mercúrico se forma a partir de cianuro de hidrógeno acuoso: [17]
- HgO + 2 HCN → Hg(CN) 2 + H 2 O
Historia del descubrimiento
El cianuro de hidrógeno fue aislado por primera vez en 1752 por el químico francés Pierre Macquer , quien convirtió el azul de Prusia en un óxido de hierro más un componente volátil y que estos podían usarse para reconstituirlo. [18] El nuevo componente fue lo que ahora se conoce como cianuro de hidrógeno. Posteriormente, el químico sueco Carl Wilhelm Scheele lo preparó a partir del azul de Prusia en 1782, [19] y finalmente recibió el nombre alemán Blausäure ( lit. "ácido azul") debido a su naturaleza ácida en agua y su derivación del azul de Prusia. En inglés, se lo conoció popularmente como ácido prúsico.
En 1787, el químico francés Claude Louis Berthollet demostró que el ácido prúsico no contenía oxígeno, [20] una importante contribución a la teoría de los ácidos, que hasta entonces había postulado que los ácidos deben contener oxígeno [21] (de ahí el nombre del propio oxígeno , que se deriva de elementos griegos que significan "formador de ácido" y también se calcó al alemán como Sauerstoff ). En 1811, Joseph Louis Gay-Lussac preparó cianuro de hidrógeno puro y licuado. [22] En 1815, Gay-Lussac dedujo la fórmula química del ácido prúsico. [23] El cianuro radical en el cianuro de hidrógeno recibió su nombre de cyan , no solo una palabra inglesa para un tono de azul sino la palabra griega para azul ( griego antiguo : κύανος ), nuevamente debido a su derivación del azul de Prusia.
Producción y síntesis
El proceso más importante es la oxidación de Andrussow inventada por Leonid Andrussow en IG Farben, en la que el metano y el amoníaco reaccionan en presencia de oxígeno a unos 1200 °C (2190 °F) sobre un catalizador de platino : [24]
- 2 CH 4 + 2 NH 3 + 3 O 2 → 2 HCN + 6 H 2 O
En 2006, se produjeron en los EE.UU. entre 500 millones y 1.000 millones de libras (entre 230.000 y 450.000 t). [25] El cianuro de hidrógeno se produce en grandes cantidades mediante varios procesos y es un producto de desecho recuperado de la fabricación de acrilonitrilo . [10]
De menor importancia es el proceso Degussa ( proceso BMA ) en el que no se añade oxígeno y la energía debe transferirse indirectamente a través de la pared del reactor: [26]
- CH4 +NH3 → HCN + 3H2
Esta reacción es similar al reformado con vapor , la reacción del metano y el agua para producir monóxido de carbono e hidrógeno .
En el proceso Shawinigan, los hidrocarburos , por ejemplo el propano , reaccionan con amoníaco.
En el laboratorio, se producen pequeñas cantidades de HCN mediante la adición de ácidos a sales de cianuro de metales alcalinos :
- H ++ CN− → HCN
Esta reacción es a veces la base de envenenamientos accidentales porque el ácido convierte una sal de cianuro no volátil en HCN gaseoso.
El cianuro de hidrógeno se puede obtener a partir de ferrocianuro de potasio y ácido:
- 6H + + [Fe(CN) 6 ]−3→ 6 HCN + Fe+3[27] [28]
Métodos históricos de producción
La gran demanda de cianuros para las operaciones mineras en la década de 1890 fue satisfecha por George Thomas Beilby , quien patentó un método para producir cianuro de hidrógeno haciendo pasar amoníaco sobre carbón incandescente en 1892. Este método se utilizó hasta que Hamilton Castner en 1894 desarrolló una síntesis a partir de carbón, amoníaco y sodio produciendo cianuro de sodio , que reacciona con ácido para formar HCN gaseoso.
Aplicaciones
El HCN es el precursor del cianuro de sodio y del cianuro de potasio , que se utilizan principalmente en la minería de oro y plata y para la galvanoplastia de esos metales. Mediante la intermediación de las cianhidrinas , se preparan diversos compuestos orgánicos útiles a partir del HCN, incluido el monómero metacrilato de metilo , a partir de acetona , el aminoácido metionina , mediante la síntesis de Strecker , y los agentes quelantes EDTA y NTA . Mediante el proceso de hidrocianación , el HCN se añade al butadieno para dar adiponitrilo , un precursor del nailon-6,6 . [10]
El HCN se utiliza globalmente como fumigante contra muchas especies de insectos plaga que infestan las instalaciones de producción de alimentos. Tanto su eficacia como su método de aplicación hacen que se utilicen cantidades muy pequeñas del fumigante en comparación con otras sustancias tóxicas utilizadas para el mismo propósito. [29] El uso de HCN como fumigante también tiene un menor impacto ambiental, en comparación con otros fumigantes como el fluoruro de sulfurilo [30] y el bromuro de metilo [31] .
Aparición
El HCN se puede obtener de frutas que tienen hueso , como cerezas , albaricoques , manzanas y nueces como las almendras amargas , de las que se elabora el aceite y el extracto de almendras. Muchos de estos huesos contienen pequeñas cantidades de cianhidrinas como mandelonitrilo y amigdalina , que liberan lentamente cianuro de hidrógeno. [32] [33] Cien gramos de semillas de manzana trituradas pueden producir alrededor de 70 mg de HCN. [34] Las raíces de las plantas de yuca contienen glucósidos cianogénicos como la linamarina , que se descomponen en HCN en rendimientos de hasta 370 mg por kilogramo de raíz fresca. [35] Algunos milpiés , como Harpaphe haydeniana , Desmoxytes purpurosea y Apheloria , liberan cianuro de hidrógeno como mecanismo de defensa, [36] al igual que ciertos insectos, como las polillas de la pimpinela y las larvas de Paropsisterna eucalyptus . [37] El cianuro de hidrógeno está contenido en los gases de escape de los vehículos y en el humo procedente de la quema de plásticos que contienen nitrógeno .

En Titán
El HCN ha sido medido en la atmósfera de Titán por cuatro instrumentos en la sonda espacial Cassini , un instrumento en la Voyager y un instrumento en la Tierra. [38] Una de estas mediciones fue in situ , donde la nave espacial Cassini se sumergió entre 1.000 y 1.100 km (620 y 680 mi) sobre la superficie de Titán para recolectar gas atmosférico para análisis de espectrometría de masas . [39] El HCN se forma inicialmente en la atmósfera de Titán a través de la reacción de metano y radicales de nitrógeno producidos fotoquímicamente que proceden a través del intermediario H 2 CN, por ejemplo, (CH 3 + N → H 2 CN + H → HCN + H 2 ). [40] [41] La radiación ultravioleta descompone el HCN en CN + H; sin embargo, el CN se recicla eficientemente de nuevo en HCN a través de la reacción CN + CH 4 → HCN + CH 3 . [40]
En la Tierra joven
Se ha postulado que el carbono de una cascada de asteroides (conocido como el Bombardeo Pesado Tardío ), resultante de la interacción de Júpiter y Saturno, impactó la superficie de la Tierra joven y reaccionó con el nitrógeno de la atmósfera terrestre para formar HCN. [42]
En los mamíferos
Algunos autores [¿ quiénes? ] han demostrado que las neuronas pueden producir cianuro de hidrógeno tras la activación de sus receptores opioides por opioides endógenos o exógenos. También han demostrado que la producción neuronal de HCN activa los receptores NMDA y desempeña un papel en la transducción de señales entre células neuronales ( neurotransmisión ). Además, el aumento de la producción neuronal endógena de HCN bajo el efecto de opioides era aparentemente necesaria para una analgesia opioide adecuada , ya que la acción analgésica de los opioides era atenuada por los depuradores de HCN. Consideraron que el HCN endógeno era un neuromodulador . [43]
También se ha demostrado que, mientras que la estimulación de los receptores colinérgicos muscarínicos en células de feocromocitoma cultivadas aumenta la producción de HCN, en un organismo vivo ( in vivo ) la estimulación colinérgica muscarínica en realidad disminuye la producción de HCN. [44]
Los leucocitos generan HCN durante la fagocitosis y pueden matar bacterias , hongos y otros patógenos al generar varios productos químicos tóxicos diferentes, uno de los cuales es el cianuro de hidrógeno. [43]
Se ha demostrado que la vasodilatación causada por el nitroprusiato de sodio está mediada no solo por la generación de NO, sino también por la generación de cianuro endógeno, lo que agrega no solo toxicidad, sino también cierta eficacia antihipertensiva adicional en comparación con la nitroglicerina y otros nitratos no cianogénicos que no hacen que aumenten los niveles de cianuro en sangre. [45]
El HCN es un componente del humo del tabaco . [46]
HCN y el origen de la vida
Se ha discutido sobre el cianuro de hidrógeno como precursor de aminoácidos y ácidos nucleicos, y se propone que ha jugado un papel en el origen de la vida . [47] Aunque la relación de estas reacciones químicas con la teoría del origen de la vida sigue siendo especulativa, los estudios en esta área han llevado al descubrimiento de nuevas vías hacia compuestos orgánicos derivados de la condensación de HCN (por ejemplo, adenina ). [48]
En el espacio
Se ha detectado HCN en el medio interestelar [49] y en las atmósferas de estrellas de carbono . [50] Desde entonces, estudios exhaustivos han investigado las vías de formación y destrucción de HCN en varios entornos y han examinado su uso como trazador de una variedad de especies y procesos astronómicos. El HCN se puede observar desde telescopios terrestres a través de varias ventanas atmosféricas . [51] Se han observado las transiciones rotacionales puras J=1→0, J=3→2, J= 4→3 y J=10→9 . [49] [52] [53]
El HCN se forma en las nubes interestelares a través de una de dos vías principales: [54] mediante una reacción neutro-neutro (CH 2 + N → HCN + H) y mediante recombinación disociativa (HCNH + + e − → HCN + H). La vía de recombinación disociativa es dominante en un 30%; sin embargo, el HCNH + debe estar en su forma lineal. La recombinación disociativa con su isómero estructural, H 2 NC + , produce exclusivamente isocianuro de hidrógeno (HNC).
El HCN se destruye en las nubes interestelares a través de varios mecanismos que dependen de la ubicación en la nube. [54] En las regiones dominadas por fotones (PDR), domina la fotodisociación, produciendo CN (HCN + ν → CN + H). A mayores profundidades, domina la fotodisociación por rayos cósmicos, produciendo CN (HCN + cr → CN + H). En el núcleo oscuro, dos mecanismos en competencia lo destruyen, formando HCN + y HCNH + (HCN + H + → HCN + + H; HCN + HCO + → HCNH + + CO). La reacción con HCO + domina por un factor de ~3,5. El HCN se ha utilizado para analizar una variedad de especies y procesos en el medio interestelar. Se ha sugerido como un trazador de gas molecular denso [55] [56] y como un trazador de flujo estelar en regiones de formación estelar de alta masa. [57] Además, se ha demostrado que la relación HNC/HCN es un método excelente para distinguir entre PDR y regiones dominadas por rayos X (XDR). [58]
El 11 de agosto de 2014, los astrónomos publicaron estudios, utilizando por primera vez el Atacama Large Millimeter/Submillimeter Array (ALMA) , que detallaban la distribución de HCN, HNC , H 2 CO y polvo dentro de las comas de los cometas C/2012 F6 (Lemmon) y C/2012 S1 (ISON) . [59] [60]
En febrero de 2016, se anunció que se encontraron rastros de cianuro de hidrógeno en la atmósfera de la súper-Tierra caliente 55 Cancri e con el telescopio espacial Hubble de la NASA . [61]
El 14 de diciembre de 2023, los astrónomos informaron del descubrimiento por primera vez, en las columnas de Encélado , la luna del planeta Saturno , de cianuro de hidrógeno, una posible sustancia química esencial para la vida [62] tal como la conocemos, así como otras moléculas orgánicas , algunas de las cuales aún deben identificarse y comprenderse mejor. Según los investigadores, "estos compuestos [recién descubiertos] podrían sustentar potencialmente las comunidades microbianas existentes o impulsar la síntesis orgánica compleja que conduce al origen de la vida ". [63] [64]
Como veneno y arma química
En la Primera Guerra Mundial , el cianuro de hidrógeno fue utilizado por los franceses a partir de 1916 como arma química contra las Potencias Centrales , y por los Estados Unidos e Italia en 1918. No se encontró que fuera lo suficientemente eficaz debido a las condiciones climáticas. [65] [66] El gas es más ligero que el aire y se dispersa rápidamente en la atmósfera. La rápida dilución hizo que su uso en el campo fuera poco práctico. Por el contrario, los agentes más densos como el fosgeno o el cloro tendían a permanecer al nivel del suelo y se hundían en las trincheras de los campos de batalla del Frente Occidental. En comparación con tales agentes, el cianuro de hidrógeno tenía que estar presente en concentraciones más altas para ser letal.
Una concentración de cianuro de hidrógeno de 100 a 200 ppm en el aire respirable matará a un ser humano en un plazo de 10 a 60 minutos. [67] Una concentración de cianuro de hidrógeno de 2000 ppm (aproximadamente 2380 mg/m 3 ) matará a un ser humano en aproximadamente un minuto. [67] El efecto tóxico es causado por la acción del ion cianuro, que detiene la respiración celular . Actúa como un inhibidor no competitivo de una enzima en las mitocondrias llamada citocromo c oxidasa . Como tal, el cianuro de hidrógeno se incluye comúnmente entre las armas químicas como un agente sanguíneo . [68]
La Convención sobre Armas Químicas la incluye en la Lista 3 como arma potencial con usos industriales a gran escala. Los países signatarios deben declarar las plantas de fabricación que produzcan más de 30 toneladas métricas al año y permitir la inspección por parte de la Organización para la Prohibición de las Armas Químicas .
Tal vez su uso más infame sea el Zyklon B (en alemán: Cyclone B , donde la B significa Blausäure – ácido prúsico; también, para distinguirlo de un producto anterior conocido más tarde como Zyklon A), [69] utilizado en los campos de exterminio de la Alemania nazi durante la Segunda Guerra Mundial para matar judíos y otras minorías perseguidas en masa como parte de su programa de genocidio de Solución Final . El cianuro de hidrógeno también se utilizó en los campos para despiojar la ropa en un intento de erradicar enfermedades transmitidas por piojos y otros parásitos. Uno de los productores checos originales continuó fabricando Zyklon B bajo la marca registrada "Uragan D2" [70] hasta aproximadamente 2015. [71]
Durante la Segunda Guerra Mundial , Estados Unidos consideró usarlo, junto con el cloruro de cianógeno , como parte de la Operación Downfall , la invasión planeada de Japón, pero el presidente Harry Truman decidió no hacerlo y en su lugar utilizó las bombas atómicas desarrolladas por el secreto Proyecto Manhattan . [72]
El cianuro de hidrógeno también fue el agente empleado en ejecuciones judiciales en algunos estados de EE. UU ., donde se produjo durante la ejecución por la acción del ácido sulfúrico sobre el cianuro de sodio o el cianuro de potasio . [73]
Con el nombre de ácido prúsico , el HCN se ha utilizado como agente letal en arpones balleneros , aunque resultó bastante peligroso para la tripulación que lo utilizaba, y se abandonó rápidamente. [13] Desde mediados del siglo XVIII se utilizó en numerosos asesinatos por envenenamiento y suicidios. [74]
El gas de cianuro de hidrógeno en el aire es explosivo en concentraciones superiores al 5,6 %. [75]
Referencias
- ^ "cianuro de hidrógeno (CHEBI:18407)". Chemical Entities of Biological Interest . Reino Unido: European Bioinformatics Institute. 18 de octubre de 2009. Principal . Consultado el 4 de junio de 2012 .
- ^ abc "Cianuro de hidrógeno". PubChem . Centro Nacional de Información Biotecnológica .
- ^ Simeonova, Fina Petrova; Fishbein, Lawrence (2004). Cianuro de hidrógeno y cianuros: aspectos relacionados con la salud humana (Informe). Organización Mundial de la Salud. ISBN 9241530618. ISSN 1020-6167.
- ^ abcdef Haynes, William M., ed. (2011). Manual de química y física del CRC (92.ª edición). CRC Press . ISBN 978-1439855119.
- ^ Evans DA. "pKa de ácidos inorgánicos y oxoácidos" (PDF) . Archivado (PDF) desde el original el 2022-10-09 . Consultado el 19 de junio de 2020 .
- ^ Patnaik P (2002). Manual de productos químicos inorgánicos . McGraw-Hill. ISBN 978-0070494398.
- ^ Schulz, Axel; Surkau, Jonas (21 de septiembre de 2022). "Cianuros del grupo principal: del cianuro de hidrógeno a los complejos de cianuro". Reseñas en Química Inorgánica . 43 (1). Walter de Gruyter GmbH: 49–188. doi : 10.1515/revic-2021-0044 . ISSN 0193-4929.
- ^ abcd Guía de bolsillo del NIOSH sobre peligros químicos. "#0333". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ ab "Cianuro de hidrógeno". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ abc Gail, E.; Gos, S.; Kulzer, R.; Lorösch, J.; Rubo, A.; Sauer, M. "Compuestos cianoinorgánicos". Ullmann's Encyclopedia of Industrial Chemistry . Weinheim: Wiley-VCH. doi :10.1002/14356007.a08_159.pub2. ISBN 978-3527306732.
- ^ "Base de datos del metaboloma humano: se muestra metabocard para cianuro de hidrógeno (HMDB0060292)".
- ^ "Cianuro, incapacidad para oler". Herencia mendeliana en el hombre en línea . Consultado el 31 de marzo de 2010 .
- ^ de Lytle T. "Arpones venenosos". Whalecraft.net . Archivado desde el original el 15 de febrero de 2019.
- ^ Bläsing, Kevin; Harloff, Jörg; Schulz, Axel; Stoffers, Alrik; Stoer, Felipe; Villinger, Alejandro (2020). "Sales de agregados de cianuro-HCN: [CN (HCN) 2] - y [CN (HCN) 3] -". Edición internacional Angewandte Chemie . 59 (26): 10508–10513. doi :10.1002/anie.201915206. PMC 7317722 . PMID 32027458.
- ^ Leeuwen, furgoneta PWNM (2004). Catálisis homogénea: comprensión del arte . Dordrecht: Editores académicos de Kluwer. ISBN 1402019998.OCLC 54966334 .
- ^ Ferris, JP; Sanchez, RA (1968). "Diaminomaleonitrilo (tetrámero de cianuro de hidrógeno)". Organic Syntheses . 48 : 60. doi :10.15227/orgsyn.048.0060.
- ^ F. Wagenknecht; R. Juza (1963). "Cianuro de mercurio (II)". En G. Brauer (ed.). Handbook of Preparative Inorganic Chemistry . Vol. 2 (2.ª ed.). Nueva York, Nueva York: Academic Press.
- ^ Macquer PJ (1756). "Éxamen chymique de bleu de Prusse" [Examen químico del azul de Prusia]. Mémoires de l'Académie royale des Sciences (en francés): 60–77.
- ^ Scheele CW (1782). "Försök, beträffande det färgande ämnet uti Berlinerblå" [Experimento sobre la sustancia colorante del azul Berlín]. Kungliga Svenska Vetenskapsakademiens Handlingar (Actas de la Real Academia Sueca de Ciencias (en sueco). 3 : 264–275.
Reimpreso en latín como: Scheele CW, Hebenstreit EB, eds. (1789). "De materia tingente caerulei berolinensis". Opuscula Chemica et Physica [ La materia oscura tingente caerulei berolinensis ] (en latín). vol. 2. Traducido por Schäfer GH. (Leipzig ("Lipsiae") (Alemania): Johann Godfried Müller, págs. 148-174. - ^ Berthollet CL (1789). "Mémoire sur l'acide prussique" [Memoria sobre el ácido prúsico]. Mémoires de l'Académie Royale des Sciences (en francés): 148–161.
Reimpreso en: Berthollet CL (1789). "Extrait d'un mémoire sur l'acide prussique" [Extracto de una memoria sobre el ácido prúsico]. Anales de Chimié . 1 : 30–39. - ^ Newbold BT (1999-11-01). "Claude Louis Berthollet: Un gran químico en la tradición francesa". Canadian Chemical News . Archivado desde el original el 2008-04-20 . Consultado el 2010-03-31 .
- ^ Gay-Lussac JL (1811). "Note sur l'acide prussique" [Nota sobre el ácido prúsico]. Anales de Chimié . 44 : 128-133.
- ^ Gay-Lussac JL (1815). "Recherche sur l'acide prussique" [Investigación sobre el ácido prúsico]. Anales de Chimié . 95 : 136-231.
- ^ Andrussow L (1935). "La oxidación catalítica de mezclas de amoniaco y metano a cianuro de hidrógeno". Angewandte Chemie . 48 (37): 593–595. Bibcode :1935AngCh..48..593A. doi :10.1002/ange.19350483702.
- ^ "Registros no confidenciales de la IUR de 2006 por sustancia química, incluida la información sobre fabricación, procesamiento y uso". EPA . Archivado desde el original el 10 de mayo de 2013 . Consultado el 31 de enero de 2013 .
- ^ Endter F (1958). "Die technische Synthese von Cyanwasserstoff aus Methan und Ammoniak ohne Zusatz von Sauerstoff". Chemie Ingenieur Technik . 30 (5): 305–310. doi :10.1002/cite.330300506.
- ^ "MSDS para el ferricianuro de potasio" (PDF) . Archivado desde el original (PDF) el 2016-04-18 . Consultado el 2023-04-17 .
- ^ "Ferricianuro de potasio". PubChem . Centro Nacional de Información Biotecnológica .
- ^ "Manual de fumigación para el control de insectos – Fumigación de espacios a presión atmosférica (cont.)". Organización de las Naciones Unidas para la Alimentación y la Agricultura .
- ^ "Se identifica un nuevo gas de efecto invernadero". News.mit.edu . 11 de marzo de 2009.
- ^ "Capítulo 10: Bromuro de metilo" (PDF) . Csl.noaa.gov . Archivado (PDF) del original el 2022-10-09.
- ^ Vetter J (enero de 2000). "Glicósidos cianogénicos de plantas". Toxicon . 38 (1): 11–36. Bibcode :2000Txcn...38...11V. doi :10.1016/S0041-0101(99)00128-2. PMID 10669009.
- ^ Jones DA (enero de 1998). "¿Por qué tantas plantas alimenticias son cianogénicas?". Fitoquímica . 47 (2): 155–162. Bibcode :1998PChem..47..155J. doi :10.1016/S0031-9422(97)00425-1. PMID 9431670.
- ^ "¿Son venenosos los corazones de manzana?". The Naked Scientists. 26 de septiembre de 2010. Archivado desde el original el 6 de marzo de 2014. Consultado el 6 de marzo de 2014 .
- ^ Aregheore EM, Agunbiade OO (junio de 1991). "Los efectos tóxicos de las dietas a base de mandioca (Manihot esculenta grantz) en los seres humanos: una revisión". Toxicología veterinaria y humana . 33 (3): 274–275. PMID 1650055.
- ^ Blum MS, Woodring JP (octubre de 1962). "Secreción de benzaldehído y cianuro de hidrógeno por el milpiés Pachydesmus crassicutis (Wood)". Science . 138 (3539): 512–513. Bibcode :1962Sci...138..512B. doi :10.1126/science.138.3539.512. PMID 17753947. S2CID 40193390.
- ^ Zagrobelny M, de Castro ÉC, Møller BL, Bak S (mayo de 2018). "Cianogénesis en artrópodos: de la guerra química a los regalos nupciales". Insectos . 9 (2): 51. doi : 10.3390/insects9020051 . PMC 6023451 . PMID 29751568.
- ^ Loison JC, Hébrard E, Dobrijevic M, Hickson KM, Caralp F, Hue V, et al. (febrero de 2015). "La fotoquímica neutra de nitrilos, aminas e iminas en la atmósfera de Titán". Icarus . 247 : 218–247. Bibcode :2015Icar..247..218L. doi :10.1016/j.icarus.2014.09.039.
- ^ Magee BA, Waite JH, Mandt KE, Westlake J, Bell J, Gell DA (diciembre de 2009). "Composición de la atmósfera superior de Titán derivada del INMS: métodos de análisis y comparación de modelos". Ciencia planetaria y espacial . 57 (14–15): 1895–1916. Código Bibliográfico :2009P&SS...57.1895M. doi :10.1016/j.pss.2009.06.016.
- ^ ab Pearce BK, Molaverdikhani K, Pudritz RE, Henning T, Hébrard E (2020). "Producción de HCN en la atmósfera de Titán: Acoplamiento de la química cuántica y el modelado atmosférico del desequilibrio". Astrophysical Journal . 901 (2): 110. arXiv : 2008.04312 . Bibcode :2020ApJ...901..110P. doi : 10.3847/1538-4357/abae5c . S2CID 221095540.
- ^ Pearce BK, Ayers PW, Pudritz RE (marzo de 2019). "Una red reducida consistente para la química del HCN en atmósferas tempranas de la Tierra y Titán: cálculos cuánticos de coeficientes de velocidad de reacción". The Journal of Physical Chemistry A . 123 (9): 1861–1873. arXiv : 1902.05574 . Código Bibliográfico :2019JPCA..123.1861P. doi :10.1021/acs.jpca.8b11323. PMID 30721064. S2CID 73442008.
- ^ Wade N (4 de mayo de 2015). "Dar sentido a la química que dio origen a la vida en la Tierra". The New York Times . Consultado el 5 de mayo de 2015 .
- ^ ab Borowitz JL, Gunasekar PG, Isom GE (septiembre de 1997). "Generación de cianuro de hidrógeno por activación del receptor mu-opiáceo: posible papel neuromodulador del cianuro endógeno". Brain Research . 768 (1–2): 294–300. doi :10.1016/S0006-8993(97)00659-8. PMID 9369328. S2CID 12277593.
- ^ Gunasekar PG, Prabhakaran K, Li L, Zhang L, Isom GE, Borowitz JL (mayo de 2004). "Mecanismos receptores que median la generación de cianuro en células PC12 y cerebro de rata". Investigación en neurociencia . 49 (1): 13–18. doi :10.1016/j.neures.2004.01.006. PMID 15099699. S2CID 29850349.
- ^ Smith RP, Kruszyna H (enero de 1976). "Toxicología de algunos aniones antihipertensivos inorgánicos". Actas de la Federación . 35 (1): 69–72. PMID 1245233.
- ^ Talhout R, Schulz T, Florek E, van Benthem J, Wester P, Opperhuizen A (febrero de 2011). "Compuestos peligrosos en el humo del tabaco". Revista internacional de investigación medioambiental y salud pública . 8 (2): 613–628. doi : 10.3390/ijerph8020613 . PMC 3084482 . PMID 21556207.
- ^ Ruiz-Bermejo, Marta; Zorzano, María-Paz; Osuna-Esteban, Susana (2013). "Componentes orgánicos simples y biomonómeros identificados en polímeros de HCN: una descripción general". Life . 3 (3): 421–448. Bibcode :2013Life....3..421R. doi : 10.3390/life3030421 . PMC 4187177 . PMID 25369814.
- ^ Al-Azmi A, Elassar AZ, Booth BL (2003). "La química del diaminomaleonitrilo y su utilidad en la síntesis heterocíclica". Tetrahedron . 59 (16): 2749–2763. doi :10.1016/S0040-4020(03)00153-4.
- ^ ab Snyder LE, Buhl D (1971). "Observaciones de emisión de radio del cianuro de hidrógeno interestelar". Astrophysical Journal . 163 : L47–L52. Código Bibliográfico :1971ApJ...163L..47S. doi :10.1086/180664.
- ^ Jørgensen UG (1997). "Cool Star Models". En van Dishoeck EF (ed.). Moléculas en astrofísica: sondas y procesos . Simposios de la Unión Astronómica Internacional. Moléculas en astrofísica: sondas y procesos. Vol. 178. Springer Science & Business Media. pág. 446. ISBN 978-0792345381.
- ^ Treffers RR, Larson HP, Fink U, Gautier TN (1978). "Límites superiores para trazar constituyentes en la atmósfera de Júpiter a partir de un análisis de su espectro de 5 μm". Icarus . 34 (2): 331–343. Bibcode :1978Icar...34..331T. doi :10.1016/0019-1035(78)90171-9.
- ^ Bieging JH, Shaked S, Gensheimer PD (2000). "Observaciones de longitudes de onda submilimétricas y milimétricas de SiO y HCN en envolturas circunestelares de estrellas AGB". Astrophysical Journal . 543 (2): 897–921. Bibcode :2000ApJ...543..897B. doi : 10.1086/317129 .
- ^ Schilke P, Menten KM (2003). "Detección de una segunda línea láser submilimétrica de HCN hacia estrellas de carbono". Astrophysical Journal . 583 (1): 446–450. Bibcode :2003ApJ...583..446S. doi : 10.1086/345099 . S2CID 122549795.
- ^ ab Boger GI, Sternberg A (2005). "CN y HCN en nubes interestelares densas". Astrophysical Journal . 632 (1): 302–315. arXiv : astro-ph/0506535 . Código Bibliográfico :2005ApJ...632..302B. doi :10.1086/432864. S2CID 118958200.
- ^ Gao Y, Solomon PM (2004). "La tasa de formación de estrellas y el gas molecular denso en las galaxias". Astrophysical Journal . 606 (1): 271–290. arXiv : astro-ph/0310339 . Código Bibliográfico :2004ApJ...606..271G. doi :10.1086/382999. S2CID 11335358.
- ^ Gao Y, olomon PM (2004). "Estudio HCN de galaxias espirales normales, luminosas en el infrarrojo y ultraluminosas". Serie de suplementos de revistas astrofísicas . 152 (1): 63–80. arXiv : astro-ph/0310341 . Código Bibliográfico :2004ApJS..152...63G. doi :10.1086/383003. S2CID 9135663.
- ^ Wu J, Evans NJ (2003). "Indicaciones de movimientos de flujo entrante en regiones que forman estrellas masivas". Astrophysical Journal . 592 (2): L79–L82. arXiv : astro-ph/0306543 . Código Bibliográfico :2003ApJ...592L..79W. doi :10.1086/377679. S2CID 8016228.
- ^ Loenen AF (2007). "Propiedades moleculares de (U)LIRGs: CO, HCN, HNC y HCO + ". Actas del Simposio de la IAU . 242 : 462–466. arXiv : 0709.3423 . Código Bibliográfico : 2007IAUS..242..462L. doi : 10.1017/S1743921307013609. S2CID: 14398456.
- ^ Zubritsky E, Neal-Jones N (11 de agosto de 2014). "Comunicado 14-038: el estudio tridimensional de los cometas de la NASA revela una fábrica de productos químicos en funcionamiento". NASA . Consultado el 12 de agosto de 2014 .
- ^ Cordiner MA, Remijan AJ, Boissier J, Milam SN, Mumma MJ, Charnley SB, et al. (11 de agosto de 2014). "Mapeo de la liberación de volátiles en la coma interna de los cometas C/2012 F6 (Lemmon) y C/2012 S1 (ISON) utilizando la matriz milimétrica/submilimétrica grande de Atacama". La revista astrofísica . 792 (1): L2. arXiv : 1408.2458 . Código Bib : 2014ApJ...792L...2C. doi :10.1088/2041-8205/792/1/L2. S2CID 26277035.
- ^ "Primera detección de una atmósfera de supertierra". ESA/Hubble Information Centre. 16 de febrero de 2016.
- ^ Green, Jaime (5 de diciembre de 2023). «¿Qué es la vida? La respuesta es importante en la exploración espacial, pero todavía no lo sabemos realmente». The Atlantic . Archivado desde el original el 5 de diciembre de 2023. Consultado el 15 de diciembre de 2023 .
- ^ Chang, Kenneth (14 de diciembre de 2023). «Un gas venenoso sugiere potencial para la vida en una luna oceánica de Saturno: un investigador que ha estudiado el mundo helado dijo que «las perspectivas de desarrollo de la vida son cada vez mejores en Encélado»». The New York Times . Archivado desde el original el 14 de diciembre de 2023. Consultado el 15 de diciembre de 2023 .
- ^ Peter, Jonah S.; et al. (14 de diciembre de 2023). «Detección de HCN y química redox diversa en la columna de Encélado». Nature Astronomy . 8 (2): 164–173. arXiv : 2301.05259 . Código Bibliográfico : 2024NatAs...8..164P. doi : 10.1038/s41550-023-02160-0. S2CID: 255825649. Archivado desde el original el 15 de diciembre de 2023. Consultado el 15 de diciembre de 2023 .
- ^ Schnedlitz, Markus (2008) Chemische Kampfstoffe: Geschichte, Eigenschaften, Wirkung . GRIN Verlag. pag. 13. ISBN 3640233603 .
- ^ Armas de guerra: gas venenoso. firstworldwar.com
- ^ Efectos ambientales y para la salud Archivado el 30 de noviembre de 2012 en Wayback Machine . Cyanidecode.org. Recuperado el 2 de junio de 2012.
- ^ "Cianuro de hidrógeno". Organización para la Prohibición de las Armas Químicas . Consultado el 14 de enero de 2009 .
- ^ Van Pelt, Robert Jan ; Dwork, Debórah (1996). Auschwitz, 1270 hasta la actualidad . Norton. pág. 443. ISBN 9780300067552.
- ^ "Humo azul". Fábrica química Draslovka como . Consultado el 6 de julio de 2020 .
- ^ "Uragan D2". 17 de julio de 2015. Archivado desde el original el 17 de julio de 2015. Consultado el 19 de octubre de 2022 .
- ^ Binkov's Battlegrounds (27 de abril de 2022). "¿Cómo habría sido la Segunda Guerra Mundial si Estados Unidos no hubiera usado bombas nucleares contra Japón?". YouTube.Com . Consultado el 23 de junio de 2022 .
- ^ Pilkington, Ed (28 de mayo de 2021). «Arizona 'renueva' su cámara de gas para preparar las ejecuciones, según revelan documentos». The Guardian . Consultado el 14 de junio de 2022 .
- ^ "Sitio web de The Poison Garden". Thepoisongarden.co.uk . Archivado desde el original el 10 de febrero de 2020. Consultado el 18 de octubre de 2014 .
- ^ "Documentación sobre concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) – 74908". NIOSH. 2 de noviembre de 2018.
Enlaces externos
- Instituto Nacional de Investigación y Seguridad (1997). "Cianuro de hidrógeno y soluciones acuosas". Ficha toxicológica n° 4 , París:INRS, 5pp. (archivo PDF, en francés )
- Ficha internacional de seguridad química 0492
- Cianuro de hidrógeno y cianuros ( CICAD 61)
- Inventario Nacional de Contaminantes: Hoja informativa sobre compuestos de cianuro
- Guía de bolsillo del NIOSH sobre peligros químicos
- Revisión del Departamento de Salud
- Densidad del gas cianuro de hidrógeno





