Glucosa
 Fórmula esquelética de la d -glucosa | |
 Proyección de Haworth de α- d -glucopiranosa | |
 Proyección de Fischer de la d -glucosa | |
| Nombres | |
|---|---|
| Pronunciación | / ˈ ɡ l uː k oʊ z / , / ɡ l uː k oʊ s / |
| Nombre IUPAC Nombres triviales permitidos: [1]
| |
| Nombre IUPAC preferido Los PIN no están identificados para productos naturales. | |
Nombre sistemático de la IUPAC
| |
| Otros nombres Azúcares en sangre Dextrosa Azúcar de maíz d -Glucosa Azúcar de uva | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| 3DMet |
|
| Abreviaturas | Glc |
| 1281604 | |
| EBICh | |
| Química biológica | |
| Araña química | |
| Número CE |
|
| 83256 | |
| |
| BARRIL | |
| Malla | Glucosa |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
| |
| Propiedades | |
| C6H12O6 | |
| Masa molar | 180,156 g/mol |
| Apariencia | Polvo blanco |
| Densidad | 1,54 g/ cm3 |
| Punto de fusión | α- d -Glucosa: 146 °C (295 °F; 419 K) β- d -Glucosa: 150 °C (302 °F; 423 K) |
| 909 g/L (25 °C (77 °F)) | |
| −101,5 × 10 −6 cm3 / mol | |
| 10.5674 | |
| Termoquímica | |
Capacidad calorífica ( C ) | 218,6 J/(K·mol) [2] |
Entropía molar estándar ( S ⦵ 298 ) | 209,2 J/(K·mol) [2] |
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −1271 kJ/mol [3] |
| 2.805 kJ/mol (670 kcal/mol) | |
| Farmacología | |
| B05CX01 ( OMS ) V04CA02 ( OMS ), V06DC01 ( OMS ) | |
| Peligros | |
| NFPA 704 (rombo cortafuegos) | |
| Ficha de datos de seguridad (FDS) | ICSC 08655 |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
La glucosa es un azúcar con la fórmula molecular C 6 H 12 O 6 . La glucosa es en general el monosacárido más abundante , [4] una subcategoría de los carbohidratos . La glucosa es producida principalmente por las plantas y la mayoría de las algas durante la fotosíntesis a partir de agua y dióxido de carbono, utilizando la energía de la luz solar. Las plantas utilizan la glucosa para producir celulosa (el carbohidrato más abundante del mundo) para su uso en las paredes celulares , y todos los organismos vivos la utilizan para producir trifosfato de adenosina (ATP), que la célula utiliza como energía. [5] [6] [7]
En el metabolismo energético , la glucosa es la fuente de energía más importante en todos los organismos . La glucosa para el metabolismo se almacena como un polímero , en las plantas principalmente como amilosa y amilopectina , y en los animales como glucógeno . La glucosa circula en la sangre de los animales como azúcar en sangre . [5] [7] La forma natural de glucosa es la d -glucosa, mientras que su estereoisómero l -glucosa se produce sintéticamente en cantidades comparativamente pequeñas y es menos activa biológicamente. [7] La glucosa es un monosacárido que contiene seis átomos de carbono y un grupo aldehído , y por lo tanto es una aldohexosa . La molécula de glucosa puede existir en forma de cadena abierta (acíclica) así como en forma de anillo (cíclica). La glucosa se produce de forma natural y se encuentra en su estado libre en frutas y otras partes de las plantas. En los animales, la glucosa se libera a partir de la descomposición del glucógeno en un proceso conocido como glucogenólisis .
La glucosa, como solución de azúcar intravenosa , está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud . [8] También está en la lista en combinación con el cloruro de sodio (sal de mesa). [8]
El nombre glucosa se deriva del griego antiguo γλεῦκος ( gleûkos ) 'vino, mosto', de γλυκύς ( glykýs ) 'dulce'. [9] [10] El sufijo -osa es un clasificador químico que denota un azúcar.
Historia
La glucosa fue aislada por primera vez de las pasas en 1747 por el químico alemán Andreas Marggraf . [11] [12] La glucosa fue descubierta en las uvas por otro químico alemán, Johann Tobias Lowitz , en 1792, y distinguida por ser diferente del azúcar de caña ( sacarosa ). Glucosa es el término acuñado por Jean Baptiste Dumas en 1838, que ha prevalecido en la literatura química. Friedrich August Kekulé propuso el término dextrosa (del latín dexter , que significa "derecha"), porque en solución acuosa de glucosa, el plano de la luz polarizada linealmente está girado hacia la derecha. En contraste, la l-fructosa (generalmente denominada d -fructosa) (una cetohexosa) y la l-glucosa ( l -glucosa) giran la luz polarizada linealmente hacia la izquierda. La notación anterior según la rotación del plano de luz polarizada linealmente ( nomenclatura d y l ) fue posteriormente abandonada en favor de la notación d y l , que se refiere a la configuración absoluta del centro asimétrico más alejado del grupo carbonilo, y en concordancia con la configuración de d o l gliceraldehído. [13] [14]
Dado que la glucosa es una necesidad básica de muchos organismos, una correcta comprensión de su composición química y estructura contribuyó en gran medida a un avance general en la química orgánica . Esta comprensión se produjo en gran medida como resultado de las investigaciones de Emil Fischer , un químico alemán que recibió el Premio Nobel de Química en 1902 por sus hallazgos. [15] La síntesis de glucosa estableció la estructura de la materia orgánica y, en consecuencia, formó la primera validación definitiva de las teorías de Jacobus Henricus van 't Hoff sobre la cinética química y las disposiciones de los enlaces químicos en las moléculas portadoras de carbono. [16] Entre 1891 y 1894, Fischer estableció la configuración estereoquímica de todos los azúcares conocidos y predijo correctamente los posibles isómeros , aplicando la teoría de Van 't Hoff de los átomos de carbono asimétricos. Los nombres inicialmente se referían a las sustancias naturales. Sus enantiómeros recibieron el mismo nombre con la introducción de nomenclaturas sistemáticas, teniendo en cuenta la estereoquímica absoluta (por ejemplo, nomenclatura de Fischer, nomenclatura d / l ).
Por el descubrimiento del metabolismo de la glucosa, Otto Meyerhof recibió el Premio Nobel de Fisiología o Medicina en 1922. [17] Hans von Euler-Chelpin fue galardonado con el Premio Nobel de Química junto con Arthur Harden en 1929 por su "investigación sobre la fermentación del azúcar y su participación de las enzimas en este proceso". [18] [19] En 1947, Bernardo Houssay (por su descubrimiento del papel de la glándula pituitaria en el metabolismo de la glucosa y los carbohidratos derivados) así como Carl y Gerty Cori (por su descubrimiento de la conversión de glucógeno a partir de glucosa) recibieron el Premio Nobel de Fisiología o Medicina. [20] [21] [22] En 1970, Luis Leloir fue galardonado con el Premio Nobel de Química por el descubrimiento de nucleótidos de azúcar derivados de la glucosa en la biosíntesis de carbohidratos. [23]
Propiedades químicas y físicas
La glucosa forma sólidos blancos o incoloros que son altamente solubles en agua y ácido acético , pero poco solubles en metanol y etanol . Se funden a 146 °C (295 °F) ( α ) y 150 °C (302 °F) ( beta ), se descomponen a partir de 188 °C (370 °F) con liberación de varios productos volátiles, dejando finalmente un residuo de carbono . [24] La glucosa tiene un valor de pKa de 12,16 a 25 °C (77 °F) en agua. [25]
Con seis átomos de carbono, se clasifica como una hexosa , una subcategoría de los monosacáridos . La d -glucosa es uno de los dieciséis estereoisómeros de aldohexosa . El isómero d , d -glucosa, también conocido como dextrosa, se encuentra ampliamente en la naturaleza, pero el isómero l , l -glucosa , no. La glucosa se puede obtener por hidrólisis de carbohidratos como el azúcar de la leche ( lactosa ), el azúcar de caña (sacarosa), la maltosa , la celulosa , el glucógeno , etc. La dextrosa se fabrica comúnmente comercialmente a partir de almidones , como el almidón de maíz en los EE. UU. y Japón, el almidón de patata y trigo en Europa y el almidón de tapioca en áreas tropicales. [26] El proceso de fabricación utiliza hidrólisis mediante vapor presurizado a pH controlado en un chorro seguido de una despolimerización enzimática adicional. [27] La glucosa no unida es uno de los principales ingredientes de la miel . [28] [29] [30] [31] [32]
El término dextrosa se utiliza a menudo en un contexto clínico (relacionado con el estado de salud del paciente) o nutricional (relacionado con la ingesta dietética, como las etiquetas de los alimentos o las pautas dietéticas), mientras que "glucosa" se utiliza en un contexto biológico o fisiológico (procesos químicos e interacciones moleculares), [33] [34] [35] [36] pero ambos términos se refieren a la misma molécula, específicamente D-glucosa. [35] [37]
La dextrosa monohidrato es la forma hidratada de la D-glucosa, lo que significa que es una molécula de glucosa con una molécula de agua adicional unida. [38] Su fórmula química es C 6 H 12 O 6 · H 2 O . [38] [39] La dextrosa monohidrato también se llama D-glucosa hidratada y comúnmente se fabrica a partir de almidones vegetales. [38] [40] La dextrosa monohidrato se utiliza como el tipo predominante de dextrosa en aplicaciones alimentarias, como mezclas de bebidas; es una forma común de glucosa ampliamente utilizada como suplemento nutricional en la producción de alimentos. La dextrosa monohidrato se consume principalmente en América del Norte como jarabe de maíz o jarabe de maíz con alto contenido de fructosa . [35]
La dextrosa anhidra , por otro lado, es glucosa que no tiene ninguna molécula de agua unida a ella. [40] [41] Las sustancias químicas anhidras se producen comúnmente eliminando agua de una sustancia hidratada a través de métodos como el calentamiento o el secado (desecación). [42] [43] [44] La dextrosa monohidrato se puede deshidratar a dextrosa anhidra en un entorno industrial. [45] [46] La dextrosa monohidrato se compone de aproximadamente 9,5% de agua en masa; a través del proceso de deshidratación, este contenido de agua se elimina para producir dextrosa anhidra (seca). [40]
La dextrosa anhidra tiene la fórmula química C 6 H 12 O 6 , sin ninguna molécula de agua unida, que es la misma que la glucosa. [38] La dextrosa anhidra al aire libre tiende a absorber humedad y transformarse en monohidrato, y es más cara de producir. [40] La dextrosa anhidra (D-glucosa anhidra) tiene una mayor estabilidad y una vida útil más larga, [43] tiene aplicaciones médicas, como en la prueba de tolerancia a la glucosa oral . [47]
Mientras que el peso molecular (masa molar) del monohidrato de D-glucosa es 198,17 g/mol, [48] [49] el de la D-glucosa anhidra es 180,16 g/mol [50] [51] [52] La densidad de estas dos formas de glucosa también es diferente. [ especificar ]
En términos de estructura química, la glucosa es un monosacárido, es decir, un azúcar simple. La glucosa contiene seis átomos de carbono y un grupo aldehído , y por lo tanto es una aldohexosa . La molécula de glucosa puede existir en forma de cadena abierta (acíclica) así como en forma de anillo (cíclica); debido a la presencia de grupos funcionales alcohol y aldehído o cetona , la forma que tiene la cadena recta puede convertirse fácilmente en una estructura de anillo hemiacetal similar a una silla que se encuentra comúnmente en los carbohidratos. [53]
Estructura y nomenclatura

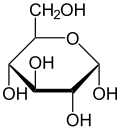
La glucosa está presente en forma sólida como un monohidrato con un anillo de pirano cerrado (α-glucopiranosa monohidrato, a veces conocido con menos precisión como hidrato de dextrosa). En solución acuosa, por otro lado, es una cadena abierta en una pequeña medida y está presente predominantemente como α- o β- piranosa , que se interconvierten. A partir de soluciones acuosas, se pueden cristalizar las tres formas conocidas: α-glucopiranosa, β-glucopiranosa y α-glucopiranosa monohidrato. [54] La glucosa es un componente básico de los disacáridos lactosa y sacarosa (azúcar de caña o remolacha), de oligosacáridos como la rafinosa y de polisacáridos como el almidón , la amilopectina , el glucógeno y la celulosa . [7] [55] La temperatura de transición vítrea de la glucosa es 31 °C (88 °F) y la constante de Gordon-Taylor (una constante determinada experimentalmente para la predicción de la temperatura de transición vítrea para diferentes fracciones de masa de una mezcla de dos sustancias) [55] es 4,5. [56]
| Formas y proyecciones de la d -glucosa en comparación | ||
|---|---|---|
| Proyección de Natta | Proyección de Haworth | |
 |  α- d -glucofuranosa α- d -glucofuranosa | 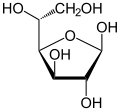 β- d -glucofuranosa β- d -glucofuranosa |
 α- d -glucopiranosa α- d -glucopiranosa |  β- d -glucopiranosa β- d -glucopiranosa | |
| α- d -Glucopiranosa en (1) proyección de Tollens/Fischer (2) proyección de Haworth (3) conformación de silla (4) proyección de Mills | ||
 | ||
Forma de cadena abierta

Una forma de cadena abierta de glucosa constituye menos del 0,02% de las moléculas de glucosa en una solución acuosa en equilibrio. [57] El resto es una de las dos formas hemiacetales cíclicas. En su forma de cadena abierta , la molécula de glucosa tiene una cadena principal abierta (a diferencia de la cíclica ) no ramificada de seis átomos de carbono, donde C-1 es parte de un grupo aldehído H(C=O)− . Por lo tanto, la glucosa también se clasifica como una aldosa o una aldohexosa . El grupo aldehído convierte a la glucosa en un azúcar reductor que da una reacción positiva con la prueba de Fehling .
Formas cíclicas
En soluciones, la forma de cadena abierta de la glucosa (ya sea " D -" o " L -") existe en equilibrio con varios isómeros cíclicos , cada uno de los cuales contiene un anillo de carbonos cerrado por un átomo de oxígeno. Sin embargo, en solución acuosa, más del 99% de las moléculas de glucosa existen como formas de piranosa . La forma de cadena abierta está limitada a aproximadamente el 0,25%, y las formas de furanosa existen en cantidades insignificantes. Los términos "glucosa" y " D -glucosa" también se utilizan generalmente para estas formas cíclicas. El anillo surge de la forma de cadena abierta por una reacción de adición nucleofílica intramolecular entre el grupo aldehído (en C-1) y el grupo hidroxilo C-4 o C-5, formando un enlace hemiacetal , −C(OH)H−O− .
La reacción entre C-1 y C-5 produce un sistema heterocíclico de seis miembros llamado piranosa, que es un azúcar monosacárido (de ahí "-osa") que contiene un esqueleto de pirano derivatizado . La reacción (mucho más rara) entre C-1 y C-4 produce un anillo de furanosa de cinco miembros, llamado así por el éter cíclico furano . En cualquier caso, cada carbono del anillo tiene un hidrógeno y un hidroxilo unidos, excepto el último carbono (C-4 o C-5) donde el hidroxilo es reemplazado por el resto de la molécula abierta (que es −(C(CH 2 OH)HOH)−H o −(CHOH)−H respectivamente).
La reacción de cierre del anillo puede dar lugar a dos productos, denominados "α-" y "β-". Cuando se dibuja una molécula de glucopiranosa en la proyección de Haworth , la designación "α-" significa que el grupo hidroxilo unido a C-1 y el grupo −CH 2 OH en C-5 se encuentran en lados opuestos del plano del anillo (una disposición trans ), mientras que "β-" significa que están en el mismo lado del plano (una disposición cis ). Por lo tanto, el isómero de cadena abierta D -glucosa da lugar a cuatro isómeros cíclicos distintos: α- D -glucopiranosa, β- D -glucopiranosa, α- D -glucofuranosa y β- D -glucofuranosa. Estas cinco estructuras existen en equilibrio y se interconvierten, y la interconversión es mucho más rápida con catálisis ácida .

El otro isómero de cadena abierta, L -glucosa, da lugar de manera similar a cuatro formas cíclicas distintas de L -glucosa, cada una de las cuales es la imagen especular de la D -glucosa correspondiente.
El anillo de glucopiranosa (α o β) puede adoptar varias formas no planas, análogas a las conformaciones de "silla" y "barco" del ciclohexano . De manera similar, el anillo de glucofuranosa puede adoptar varias formas, análogas a las conformaciones de "envoltura" del ciclopentano .
En estado sólido sólo se observan las formas de glucopiranosa.
Algunos derivados de la glucofuranosa, como la 1,2-O-isopropilideno-D-glucofuranosa, son estables y se pueden obtener puros como sólidos cristalinos. [58] [59] Por ejemplo, la reacción de la α-D-glucosa con el ácido para-tolilborónico H 3 C−(C 6 H 4 )−B(OH) 2 reforma el anillo de piranosa normal para producir el éster cuádruple α-D-glucofuranosa-1,2:3,5-bis( p -tolilboronato). [60]
Mutarrotación

La mutarrotación consiste en una inversión temporal de la reacción de formación del anillo, que da como resultado la forma de cadena abierta, seguida de una reformación del anillo. El paso de cierre del anillo puede utilizar un grupo −OH diferente al recreado en el paso de apertura (cambiando así entre las formas piranosa y furanosa), o el nuevo grupo hemiacetal creado en C-1 puede tener la misma o opuesta quiralidad que el original (cambiando así entre las formas α y β). Por lo tanto, aunque la forma de cadena abierta es apenas detectable en solución, es un componente esencial del equilibrio.
La forma de cadena abierta es termodinámicamente inestable y se isomeriza espontáneamente a las formas cíclicas. (Aunque la reacción de cierre de anillo podría en teoría crear anillos de cuatro o tres átomos, estos estarían muy tensos y no se observan en la práctica). En soluciones a temperatura ambiente , los cuatro isómeros cíclicos se interconvierten en una escala de tiempo de horas, en un proceso llamado mutarrotación . [61] A partir de cualquier proporción, la mezcla converge a una relación estable de α:β 36:64. La relación sería α:β 11:89 si no fuera por la influencia del efecto anomérico . [62] La mutarrotación es considerablemente más lenta a temperaturas cercanas a 0 °C (32 °F).
Actividad óptica
Ya sea en agua o en forma sólida, la d -(+)-glucosa es dextrógira , lo que significa que rotará la dirección de la luz polarizada en el sentido de las agujas del reloj, como se ve al mirar hacia la fuente de luz. El efecto se debe a la quiralidad de las moléculas y, de hecho, el isómero de imagen especular, la l -(−)-glucosa, es levógira (rota la luz polarizada en el sentido contrario a las agujas del reloj) en la misma cantidad. La intensidad del efecto es diferente para cada uno de los cinco tautómeros .
El prefijo d- no se refiere directamente a las propiedades ópticas del compuesto. Indica que el centro quiral C-5 tiene la misma lateralidad que el del d -gliceraldehído (que se denominó así porque es dextrógiro). El hecho de que la d -glucosa sea dextrógira es un efecto combinado de sus cuatro centros quirales, no solo del C-5; algunas de las otras d -aldohexosas son levógiras.
La conversión entre los dos anómeros se puede observar en un polarímetro , ya que la α- d -glucosa pura tiene un ángulo de rotación específico de +112,2° mL/(dm·g), la β- d -glucosa pura de +17,5° mL/(dm·g). [63] Cuando se ha alcanzado el equilibrio después de un cierto tiempo debido a la mutarrotación, el ángulo de rotación es de +52,7° mL/(dm·g). [63] Al añadir ácido o base, esta transformación se acelera mucho. El equilibrio se produce a través de la forma de aldehído de cadena abierta.
Isomerización
En hidróxido de sodio diluido u otras bases diluidas, los monosacáridos manosa , glucosa y fructosa se interconvierten (a través de una transformación de Lobry de Bruyn–Alberda–Van Ekenstein ), de modo que se forma un equilibrio entre estos isómeros. Esta reacción se lleva a cabo a través de un enediol :
Propiedades bioquímicas
| Metabolismo de los monosacáridos comunes y algunas reacciones bioquímicas de la glucosa |
|---|
 |
La glucosa es el monosacárido más abundante. La glucosa es también la aldohexosa más utilizada en la mayoría de los organismos vivos. Una posible explicación para esto es que la glucosa tiene una tendencia menor que otras aldohexosas a reaccionar de forma no específica con los grupos amina de las proteínas . [64] Esta reacción, la glicación , perjudica o destruye la función de muchas proteínas, [64] por ejemplo, en la hemoglobina glucosilada . La baja tasa de glicación de la glucosa se puede atribuir a que tiene una forma cíclica más estable en comparación con otras aldohexosas, lo que significa que pasa menos tiempo que ellas en su forma reactiva de cadena abierta. [64] La razón por la que la glucosa tiene la forma cíclica más estable de todas las aldohexosas es que sus grupos hidroxi (con la excepción del grupo hidroxi en el carbono anomérico de la d -glucosa) están en la posición ecuatorial . Presumiblemente, la glucosa es el monosacárido natural más abundante porque está menos glicosilada con proteínas que otros monosacáridos. [64] [65] Otra hipótesis es que la glucosa, al ser la única d -aldohexosa que tiene los cinco sustituyentes hidroxi en la posición ecuatorial en forma de β- d -glucosa, es más fácilmente accesible a las reacciones químicas, [66] : 194, 199 por ejemplo, para la esterificación [67] : 363 o la formación de acetal . [68] Por esta razón, la d -glucosa también es un bloque de construcción altamente preferido en los polisacáridos naturales (glucanos). Los polisacáridos que están compuestos únicamente de glucosa se denominan glucanos .
La glucosa es producida por las plantas a través de la fotosíntesis utilizando la luz solar, [69] [70] agua y dióxido de carbono y puede ser utilizada por todos los organismos vivos como fuente de energía y carbono. Sin embargo, la mayor parte de la glucosa no se presenta en su forma libre, sino en forma de sus polímeros, es decir, lactosa, sacarosa, almidón y otros que son sustancias de reserva energética, y celulosa y quitina , que son componentes de la pared celular en plantas u hongos y artrópodos , respectivamente. Estos polímeros, cuando son consumidos por animales, hongos y bacterias, se degradan a glucosa utilizando enzimas. Todos los animales también son capaces de producir glucosa por sí mismos a partir de ciertos precursores según surja la necesidad. Las neuronas , las células de la médula renal y los eritrocitos dependen de la glucosa para su producción de energía. [70] En los humanos adultos, hay alrededor de 18 g (0,63 oz) de glucosa, [71] de los cuales alrededor de 4 g (0,14 oz) están presentes en la sangre. [72] El hígado de un adulto produce aproximadamente entre 180 y 220 g (6,3 y 7,8 oz) de glucosa en 24 horas. [71]
Muchas de las complicaciones a largo plazo de la diabetes (por ejemplo, ceguera , insuficiencia renal y neuropatía periférica ) probablemente se deben a la glicación de proteínas o lípidos . [73] Por el contrario, la adición de azúcares a las proteínas regulada por enzimas se denomina glicosilación y es esencial para la función de muchas proteínas. [74]
Consumo
La glucosa ingerida se une inicialmente al receptor del sabor dulce en la lengua en los humanos. Este complejo de las proteínas T1R2 y T1R3 permite identificar fuentes de alimentos que contienen glucosa. [75] [76] La glucosa proviene principalmente de los alimentos: alrededor de 300 g (11 oz) por día se producen por la conversión de alimentos, [76] pero también se sintetiza a partir de otros metabolitos en las células del cuerpo. En los humanos, la descomposición de los polisacáridos que contienen glucosa ocurre en parte ya durante la masticación por medio de la amilasa , que está contenida en la saliva , así como por la maltasa , la lactasa y la sacarasa en el borde en cepillo del intestino delgado . La glucosa es un componente básico de muchos carbohidratos y puede separarse de ellos utilizando ciertas enzimas. Las glucosidasas , un subgrupo de las glucosidasas, primero catalizan la hidrólisis de los polisacáridos de cadena larga que contienen glucosa, eliminando la glucosa terminal. A su vez, los disacáridos son degradados principalmente por glicosidasas específicas a glucosa. Los nombres de las enzimas degradadoras a menudo se derivan del poli- y disacárido en particular; entre otras, para la degradación de cadenas de polisacáridos existen amilasas (nombradas por la amilosa, un componente del almidón), celulasas (nombradas por la celulosa), quitinasas (nombradas por la quitina), y más. Además, para la escisión de disacáridos, existen maltasa, lactasa, sacarasa, trehalasa y otras. En los humanos, se conocen alrededor de 70 genes que codifican para glicosidasas. Tienen funciones en la digestión y degradación de glucógeno, esfingolípidos , mucopolisacáridos y poli ( ADP-ribosa ). Los humanos no producen celulasas, quitinasas o trehalasas, pero las bacterias en la microbiota intestinal sí lo hacen.
Para entrar o salir de las membranas celulares de las células y las membranas de los compartimentos celulares, la glucosa requiere proteínas de transporte especiales de la superfamilia de facilitadores principales . En el intestino delgado (más precisamente, en el yeyuno ), [77] la glucosa es absorbida por el epitelio intestinal con la ayuda de transportadores de glucosa [78] a través de un mecanismo de transporte activo secundario llamado simporte de iones de sodio-glucosa a través del cotransportador de sodio/glucosa 1 (SGLT1). [79] La transferencia adicional ocurre en el lado basolateral de las células epiteliales intestinales a través del transportador de glucosa GLUT2 , [79] así como la absorción en células hepáticas , células renales, células de los islotes de Langerhans , neuronas , astrocitos y tanicitos . [80] La glucosa ingresa al hígado a través de la vena porta y se almacena allí como glucógeno celular. [81] En la célula hepática, es fosforilada por la glucoquinasa en la posición 6 para formar glucosa 6-fosfato , que no puede salir de la célula. La glucosa 6-fosfatasa puede convertir la glucosa 6-fosfato nuevamente en glucosa exclusivamente en el hígado, por lo que el cuerpo puede mantener una concentración suficiente de glucosa en sangre. En otras células, la captación ocurre por transporte pasivo a través de una de las 14 proteínas GLUT. [79] En los otros tipos de células, la fosforilación ocurre a través de una hexoquinasa , con lo cual la glucosa ya no puede difundirse fuera de la célula.
El transportador de glucosa GLUT1 es producido por la mayoría de los tipos de células y es de particular importancia para las células nerviosas y las células β pancreáticas . [79] GLUT3 se expresa en gran medida en las células nerviosas. [79] La glucosa del torrente sanguíneo es absorbida por GLUT4 de las células musculares (del músculo esquelético [82] y del músculo cardíaco ) y de las células grasas . [83] GLUT14 se expresa exclusivamente en los testículos . [84] El exceso de glucosa se descompone y se convierte en ácidos grasos, que se almacenan como triglicéridos . En los riñones , la glucosa en la orina se absorbe a través de SGLT1 y SGLT2 en las membranas celulares apicales y se transmite a través de GLUT2 en las membranas celulares basolaterales. [85] Aproximadamente el 90% de la reabsorción de glucosa en los riñones se realiza a través de SGLT2 y aproximadamente el 3% a través de SGLT1. [86]
Biosíntesis
En las plantas y algunos procariotas , la glucosa es un producto de la fotosíntesis . [69] La glucosa también se forma por la descomposición de formas poliméricas de glucosa como el glucógeno (en animales y hongos ) o el almidón (en plantas). La escisión del glucógeno se denomina glucogenólisis, la escisión del almidón se denomina degradación del almidón. [87]
La vía metabólica que comienza con moléculas que contienen de dos a cuatro átomos de carbono (C) y termina en la molécula de glucosa que contiene seis átomos de carbono se llama gluconeogénesis y ocurre en todos los organismos vivos. Los materiales de partida más pequeños son el resultado de otras vías metabólicas. En última instancia, casi todas las biomoléculas provienen de la asimilación de dióxido de carbono en plantas y microbios durante la fotosíntesis. [67] : 359 La energía libre de formación de α- d -glucosa es de 917,2 kilojulios por mol. [67] : 59 En los humanos, la gluconeogénesis ocurre en el hígado y el riñón, [88] pero también en otros tipos de células. En el hígado se almacenan alrededor de 150 g (5,3 oz) de glucógeno, en el músculo esquelético alrededor de 250 g (8,8 oz). [89] Sin embargo, la glucosa liberada en las células musculares tras la escisión del glucógeno no puede ser entregada a la circulación porque la glucosa es fosforilada por la hexoquinasa, y no se expresa una glucosa-6-fosfatasa para eliminar el grupo fosfato. A diferencia de la glucosa, no existe una proteína de transporte para la glucosa-6-fosfato . La gluconeogénesis permite al organismo generar glucosa a partir de otros metabolitos, incluido el lactato o ciertos aminoácidos , mientras consume energía. Las células tubulares renales también pueden producir glucosa.
La glucosa también se puede encontrar fuera de los organismos vivos, en el ambiente. Las concentraciones de glucosa en la atmósfera se detectan mediante la recolección de muestras por avión y se sabe que varían de un lugar a otro. Por ejemplo, las concentraciones de glucosa en el aire atmosférico del interior de China varían de 0,8 a 20,1 pg/L, mientras que las concentraciones de glucosa en la costa este de China varían de 10,3 a 142 pg/L. [90]
Degradación de la glucosa
En los seres humanos, la glucosa se metaboliza mediante la glucólisis [91] y la vía de las pentosas fosfato. [92] La glucólisis es utilizada por todos los organismos vivos, [66] : 551 [93] con pequeñas variaciones, y todos los organismos generan energía a partir de la descomposición de los monosacáridos. [93] En el curso posterior del metabolismo, puede degradarse completamente a través de la descarboxilación oxidativa , el ciclo del ácido cítrico (sinónimo ciclo de Krebs ) y la cadena respiratoria a agua y dióxido de carbono. Si no hay suficiente oxígeno disponible para esto, la degradación de la glucosa en los animales ocurre de forma anaeróbica a lactato a través de la fermentación del ácido láctico y libera mucha menos energía. El lactato muscular ingresa al hígado a través del torrente sanguíneo en los mamíferos, donde ocurre la gluconeogénesis ( ciclo de Cori ). Con un alto suministro de glucosa, el metabolito acetil-CoA del ciclo de Krebs también se puede utilizar para la síntesis de ácidos grasos . [94] La glucosa también se utiliza para reponer las reservas de glucógeno del organismo, que se encuentran principalmente en el hígado y el músculo esquelético. Estos procesos están regulados hormonalmente .
En otros organismos vivos, pueden ocurrir otras formas de fermentación. La bacteria Escherichia coli puede crecer en medios nutritivos que contengan glucosa como única fuente de carbono. [67] : 59 En algunas bacterias y, en forma modificada, también en arqueas, la glucosa se degrada a través de la vía de Entner-Doudoroff . [95] Con la glucosa, se descubrió un mecanismo de regulación genética en E. coli , la represión de catabolitos (antes conocida como efecto glucosa ). [96]
La glucosa se utiliza como fuente de energía en las células mediante respiración aeróbica, respiración anaeróbica o fermentación. [97] El primer paso de la glucólisis es la fosforilación de la glucosa por una hexoquinasa para formar glucosa 6-fosfato . La razón principal de la fosforilación inmediata de la glucosa es evitar su difusión fuera de la célula, ya que el grupo fosfato cargado evita que la glucosa 6-fosfato cruce fácilmente la membrana celular . [97] Además, la adición del grupo fosfato de alta energía activa la glucosa para su posterior descomposición en pasos posteriores de la glucólisis. [98]
En la respiración anaeróbica, una molécula de glucosa produce una ganancia neta de dos moléculas de ATP (cuatro moléculas de ATP se producen durante la glucólisis a través de la fosforilación a nivel de sustrato, pero dos son necesarias para las enzimas utilizadas durante el proceso). [99] En la respiración aeróbica, una molécula de glucosa es mucho más rentable ya que se genera una producción neta máxima de 30 o 32 moléculas de ATP (según el organismo). [100]
Haga clic en los genes, proteínas y metabolitos que aparecen a continuación para acceder a los artículos correspondientes. [§ 1]
- ^ El mapa de la ruta interactiva se puede editar en WikiPathways: "GlycolysisGluconeogenesis_WP534".
Las células tumorales suelen crecer comparativamente rápido y consumen una cantidad de glucosa superior a la media mediante la glucólisis, [101] lo que conduce a la formación de lactato, el producto final de la fermentación en los mamíferos, incluso en presencia de oxígeno. Esto se denomina efecto Warburg . Para la mayor absorción de glucosa en los tumores se producen en exceso diversos SGLT y GLUT. [102] [103]
En la levadura , el etanol se fermenta en concentraciones altas de glucosa, incluso en presencia de oxígeno (lo que normalmente conduce a la respiración en lugar de a la fermentación). Esto se denomina efecto Crabtree .
La glucosa también puede degradarse para formar dióxido de carbono por medios abióticos. Se ha demostrado experimentalmente que esto ocurre mediante oxidación e hidrólisis a 22 °C y un pH de 2,5. [104]
Fuente de energía
La glucosa es un combustible omnipresente en biología . Se utiliza como fuente de energía en los organismos, desde las bacterias hasta los humanos, a través de la respiración aeróbica , la respiración anaeróbica (en bacterias) o la fermentación . La glucosa es la fuente clave de energía del cuerpo humano, a través de la respiración aeróbica, proporcionando alrededor de 3,75 kilocalorías (16 kilojulios ) de energía alimentaria por gramo. [105] La descomposición de los carbohidratos (p. ej., el almidón) produce mono y disacáridos , la mayoría de los cuales es glucosa. A través de la glucólisis y más tarde en las reacciones del ciclo del ácido cítrico y la fosforilación oxidativa , la glucosa se oxida para finalmente formar dióxido de carbono y agua, produciendo energía principalmente en forma de trifosfato de adenosina (ATP). La reacción de la insulina y otros mecanismos regulan la concentración de glucosa en la sangre. El valor calórico fisiológico de la glucosa, dependiendo de la fuente, es de 16,2 kilojulios por gramo [106] o 15,7 kJ/g (3,74 kcal/g). [107] La alta disponibilidad de carbohidratos de la biomasa vegetal ha llevado a una variedad de métodos durante la evolución, especialmente en microorganismos, para utilizar la glucosa para energía y almacenamiento de carbono. Existen diferencias en cuanto a qué producto final ya no se puede utilizar para la producción de energía. La presencia de genes individuales y sus productos genéticos, las enzimas, determina qué reacciones son posibles. La vía metabólica de la glucólisis es utilizada por casi todos los seres vivos. Una diferencia esencial en el uso de la glucólisis es la recuperación de NADPH como reductor para el anabolismo que de otro modo tendría que generarse indirectamente. [108]
La glucosa y el oxígeno suministran casi toda la energía para el cerebro , [109] por lo que su disponibilidad influye en los procesos psicológicos . Cuando la glucosa es baja , los procesos psicológicos que requieren esfuerzo mental (por ejemplo, autocontrol , toma de decisiones con esfuerzo) se ven afectados. [110] [111] [112] [113] En el cerebro, que depende de la glucosa y el oxígeno como principal fuente de energía, la concentración de glucosa suele ser de 4 a 6 mM (5 mM equivalen a 90 mg/dL), [71] pero disminuye a 2 a 3 mM en ayunas. [114] La confusión ocurre por debajo de 1 mM y el coma a niveles más bajos. [114]
La glucosa en la sangre se llama azúcar en sangre . Los niveles de azúcar en sangre están regulados por las células nerviosas que se unen a la glucosa en el hipotálamo . [115] Además, la glucosa en el cerebro se une a los receptores de glucosa del sistema de recompensa en el núcleo accumbens . [115] La unión de la glucosa al receptor dulce en la lengua induce una liberación de varias hormonas del metabolismo energético, ya sea a través de la glucosa o a través de otros azúcares, lo que lleva a una mayor captación celular y niveles más bajos de azúcar en sangre. [116] Los edulcorantes artificiales no reducen los niveles de azúcar en sangre. [116]
El contenido de azúcar en sangre de una persona sana en estado de ayuno breve, por ejemplo después del ayuno nocturno, es de aproximadamente 70 a 100 mg/dl de sangre (4 a 5,5 mM). En el plasma sanguíneo , los valores medidos son aproximadamente un 10-15% más altos. Además, los valores en la sangre arterial son más altos que las concentraciones en la sangre venosa , ya que la glucosa se absorbe en el tejido durante el paso del lecho capilar . También en la sangre capilar, que se utiliza a menudo para la determinación de azúcar en sangre, los valores son a veces más altos que en la sangre venosa. El contenido de glucosa de la sangre está regulado por las hormonas insulina , incretina y glucagón . [115] [117] La insulina reduce el nivel de glucosa, el glucagón lo aumenta. [71] Además, las hormonas adrenalina , tiroxina , glucocorticoides , somatotropina y adrenocorticotropina conducen a un aumento del nivel de glucosa. [71] También existe una regulación independiente de las hormonas, que se denomina autorregulación de la glucosa. [118] Después de la ingesta de alimentos, la concentración de azúcar en sangre aumenta. Los valores superiores a 180 mg/dL en sangre venosa completa son patológicos y se denominan hiperglucemia , los valores inferiores a 40 mg/dL se denominan hipoglucemia . [119] Cuando es necesario, la glucosa-6-fosfatasa libera glucosa en el torrente sanguíneo a partir de la glucosa-6-fosfato que se origina en el glucógeno del hígado y el riñón, regulando así la homeostasis de la concentración de glucosa en sangre. [88] [70] En los rumiantes , la concentración de glucosa en sangre es menor (60 mg/dL en el ganado vacuno y 40 mg/dL en las ovejas ), porque los carbohidratos son convertidos más por su microbiota intestinal en ácidos grasos de cadena corta . [120]
Una parte de la glucosa se convierte en ácido láctico por los astrocitos , que luego se utiliza como fuente de energía por las células cerebrales ; otra parte de la glucosa es utilizada por las células intestinales y los glóbulos rojos , mientras que el resto llega al hígado , al tejido adiposo y a las células musculares , donde se absorbe y se almacena como glucógeno (bajo la influencia de la insulina ). El glucógeno de las células hepáticas se puede convertir en glucosa y devolver a la sangre cuando la insulina es baja o ausente; el glucógeno de las células musculares no se devuelve a la sangre debido a la falta de enzimas. En las células grasas , la glucosa se utiliza para impulsar las reacciones que sintetizan algunos tipos de grasa y tienen otros fines. El glucógeno es el mecanismo de "almacenamiento de energía de glucosa" del cuerpo, porque es mucho más "eficiente en el espacio" y menos reactivo que la propia glucosa.
Como resultado de su importancia en la salud humana, la glucosa es un analito en las pruebas de glucosa que son análisis de sangre médicos comunes . [121] Comer o ayunar antes de tomar una muestra de sangre tiene un efecto en los análisis de glucosa en la sangre; un alto nivel de azúcar en sangre en ayunas puede ser un signo de prediabetes o diabetes mellitus . [122]
El índice glucémico es un indicador de la velocidad de reabsorción y conversión a niveles de glucosa en sangre de los carbohidratos ingeridos, medido como el área bajo la curva de los niveles de glucosa en sangre después del consumo en comparación con la glucosa (la glucosa se define como 100). [123] La importancia clínica del índice glucémico es controvertida, [123] [124] ya que los alimentos con alto contenido de grasa retardan la reabsorción de carbohidratos y reducen el índice glucémico, por ejemplo, el helado. [124] Un indicador alternativo es el índice de insulina , [125] medido como el impacto del consumo de carbohidratos en los niveles de insulina en sangre. La carga glucémica es un indicador de la cantidad de glucosa agregada a los niveles de glucosa en sangre después del consumo, según el índice glucémico y la cantidad de alimento consumido.
Precursor
Los organismos utilizan la glucosa como precursor para la síntesis de varias sustancias importantes. El almidón, la celulosa y el glucógeno ("almidón animal") son polímeros de glucosa comunes (polisacáridos). Algunos de estos polímeros (almidón o glucógeno) sirven como depósitos de energía, mientras que otros (celulosa y quitina , que se fabrica a partir de un derivado de la glucosa) tienen funciones estructurales. Los oligosacáridos de glucosa combinados con otros azúcares sirven como importantes depósitos de energía. Estos incluyen la lactosa, el azúcar predominante en la leche, que es un disacárido de glucosa-galactosa, y la sacarosa, otro disacárido que se compone de glucosa y fructosa. La glucosa también se añade a ciertas proteínas y lípidos en un proceso llamado glicosilación . Esto suele ser fundamental para su funcionamiento. Las enzimas que unen la glucosa a otras moléculas suelen utilizar glucosa fosforilada para impulsar la formación del nuevo enlace acoplándolo con la ruptura del enlace glucosa-fosfato.
Además de su uso directo como monómero, la glucosa se puede descomponer para sintetizar una amplia variedad de otras biomoléculas. Esto es importante, ya que la glucosa sirve tanto como almacén primario de energía como fuente de carbono orgánico. La glucosa se puede descomponer y convertir en lípidos. También es un precursor para la síntesis de otras moléculas importantes como la vitamina C (ácido ascórbico). En los organismos vivos, la glucosa se convierte en varios otros compuestos químicos que son el material de partida para varias vías metabólicas . Entre ellos, todos los demás monosacáridos [126] como la fructosa (a través de la vía del poliol ), [79] la manosa (el epímero de la glucosa en la posición 2), la galactosa (el epímero en la posición 4), la fucosa, varios ácidos urónicos y los aminoazúcares se producen a partir de la glucosa. [81] Además de la fosforilación a glucosa-6-fosfato, que es parte de la glucólisis, la glucosa puede oxidarse durante su degradación a glucono-1,5-lactona. La glucosa se utiliza en algunas bacterias como un bloque de construcción en la biosíntesis de trehalosa o dextrano y en animales como un bloque de construcción de glucógeno. La glucosa también puede convertirse de la xilosa isomerasa bacteriana a fructosa. Además, los metabolitos de la glucosa producen todos los aminoácidos no esenciales, alcoholes de azúcar como manitol y sorbitol , ácidos grasos , colesterol y ácidos nucleicos . [126] Finalmente, la glucosa se utiliza como un bloque de construcción en la glicosilación de proteínas a glicoproteínas , glicolípidos , peptidoglicanos , glicósidos y otras sustancias (catalizada por glicosiltransferasas ) y puede escindirse de ellas por glicosidasas .
Patología
Diabetes
La diabetes es un trastorno metabólico en el que el cuerpo es incapaz de regular los niveles de glucosa en la sangre, ya sea por falta de insulina en el cuerpo o por la incapacidad, por parte de las células del cuerpo, de responder adecuadamente a la insulina. Cada una de estas situaciones puede ser causada por elevaciones persistentemente altas de los niveles de glucosa en sangre, a través del agotamiento pancreático y la resistencia a la insulina . El páncreas es el órgano responsable de la secreción de las hormonas insulina y glucagón. [127] La insulina es una hormona que regula los niveles de glucosa, permitiendo que las células del cuerpo absorban y utilicen la glucosa. Sin ella, la glucosa no puede entrar en la célula y, por lo tanto, no puede usarse como combustible para las funciones del cuerpo. [128] Si el páncreas se expone a elevaciones persistentemente altas de los niveles de glucosa en sangre, las células productoras de insulina en el páncreas podrían dañarse, causando una falta de insulina en el cuerpo. La resistencia a la insulina ocurre cuando el páncreas intenta producir cada vez más insulina en respuesta a niveles de glucosa en sangre persistentemente elevados. Con el tiempo, el resto del cuerpo se vuelve resistente a la insulina que produce el páncreas, por lo que se necesita más insulina para lograr el mismo efecto de reducción de la glucosa en sangre y se obliga al páncreas a producir aún más insulina para competir con la resistencia. Esta espiral negativa contribuye al agotamiento pancreático y a la progresión de la diabetes.
Para controlar la respuesta del organismo a la terapia para reducir la glucemia, se pueden medir los niveles de glucosa. El control de la glucemia se puede realizar mediante varios métodos, como la prueba de glucosa en ayunas, que mide el nivel de glucosa en sangre después de 8 horas de ayuno. Otra prueba es la prueba de tolerancia a la glucosa de 2 horas (GTT, por sus siglas en inglés): para esta prueba, la persona se realiza una prueba de glucosa en ayunas, luego bebe una bebida con glucosa de 75 gramos y se vuelve a realizar la prueba. Esta prueba mide la capacidad del cuerpo de la persona para procesar la glucosa. Con el tiempo, los niveles de glucosa en sangre deberían disminuir a medida que la insulina permite que las células la absorban y la eliminen del torrente sanguíneo.
Manejo de la hipoglucemia

Las personas con diabetes u otras afecciones que provocan niveles bajos de azúcar en sangre suelen llevar consigo pequeñas cantidades de azúcar en diversas formas. Un azúcar que se utiliza habitualmente es la glucosa, a menudo en forma de comprimidos de glucosa (glucosa prensada en forma de comprimido, a veces con uno o más ingredientes adicionales como aglutinante), caramelos duros o sobres de azúcar .
Fuentes

La mayoría de los carbohidratos de la dieta contienen glucosa, ya sea como su único componente básico (como en los polisacáridos almidón y glucógeno), o junto con otro monosacárido (como en los heteropolisacáridos sacarosa y lactosa). [129] La glucosa libre es uno de los principales ingredientes de la miel. La glucosa es extremadamente abundante y se ha aislado de una variedad de fuentes naturales en todo el mundo, incluidos los conos masculinos del árbol conífero Wollemia nobilis en Roma, [130] las raíces de las plantas Ilex asprella en China, [131] y la paja de arroz en California. [132]
Artículo alimenticio | Carbohidratos, totales, [a] incluida la fibra dietética | Azúcares totales | Fructosa libre | Glucosa libre | Sacarosa | Relación fructosa/ glucosa | Sacarosa como proporción de azúcares totales (%) |
|---|---|---|---|---|---|---|---|
| Frutas | |||||||
| Manzana | 13.8 | 10.4 | 5.9 | 2.4 | 2.1 | 2.0 | 19.9 |
| Albaricoque | 11.1 | 9.2 | 0.9 | 2.4 | 5.9 | 0,7 | 63,5 |
| Banana | 22.8 | 12.2 | 4.9 | 5.0 | 2.4 | 1.0 | 20.0 |
| Higo , seco | 63.9 | 47,9 | 22.9 | 24.8 | 0.9 | 0,93 | 0,15 |
| Uvas | 18.1 | 15.5 | 8.1 | 7.2 | 0,2 | 1.1 | 1 |
| Naranja de ombligo | 12.5 | 8.5 | 2.25 | 2.0 | 4.3 | 1.1 | 50.4 |
| Durazno | 9.5 | 8.4 | 1.5 | 2.0 | 4.8 | 0.9 | 56,7 |
| Pera | 15.5 | 9.8 | 6.2 | 2.8 | 0,8 | 2.1 | 8.0 |
| Piña | 13.1 | 9.9 | 2.1 | 1.7 | 6.0 | 1.1 | 60.8 |
| Ciruela | 11.4 | 9.9 | 3.1 | 5.1 | 1.6 | 0,66 | 16.2 |
| Verduras | |||||||
| Remolacha roja | 9.6 | 6.8 | 0,1 | 0,1 | 6.5 | 1.0 | 96.2 |
| Zanahoria | 9.6 | 4.7 | 0.6 | 0.6 | 3.6 | 1.0 | 77 |
| Pimiento rojo dulce | 6.0 | 4.2 | 2.3 | 1.9 | 0.0 | 1.2 | 0.0 |
| Cebolla , dulce | 7.6 | 5.0 | 2.0 | 2.3 | 0,7 | 0.9 | 14.3 |
| Batata | 20.1 | 4.2 | 0,7 | 1.0 | 2.5 | 0.9 | 60.3 |
| batata | 27.9 | 0,5 | Rastros | Rastros | Rastros | — | Rastros |
| Caña de azúcar | 13–18 | 0,2–1,0 | 0,2–1,0 | 11–16 | 1.0 | alto | |
| Remolacha azucarera | 17–18 | 0,1–0,5 | 0,1–0,5 | 16–17 | 1.0 | alto | |
| Granos | |||||||
| Maíz dulce | 19.0 | 6.2 | 1.9 | 3.4 | 0.9 | 0,61 | 15.0 |
- ^ El valor de los carbohidratos se calcula en la base de datos del USDA y no siempre corresponde a la suma de los azúcares, el almidón y la "fibra dietética".
Producción comercial
La glucosa se produce industrialmente a partir del almidón mediante hidrólisis enzimática utilizando glucosa amilasa o mediante el uso de ácidos . La hidrólisis enzimática ha desplazado en gran medida las reacciones de hidrólisis catalizada por ácidos. [134] El resultado es jarabe de glucosa (enzimáticamente con más del 90% de glucosa en la materia seca) [134] con un volumen de producción mundial anual de 20 millones de toneladas (a partir de 2011). [135] Esta es la razón del antiguo nombre común "azúcar de almidón". Las amilasas provienen con mayor frecuencia de Bacillus licheniformis [136] o Bacillus subtilis (cepa MN-385), [136] que son más termoestables que las enzimas utilizadas originalmente. [136] [137] A partir de 1982, las pululanasas de Aspergillus niger se utilizaron en la producción de jarabe de glucosa para convertir la amilopectina en almidón (amilosa), aumentando así el rendimiento de glucosa. [138] La reacción se lleva a cabo a un pH de 4,6–5,2 y una temperatura de 55–60 °C. [11] El jarabe de maíz tiene entre un 20% y un 95% de glucosa en la materia seca. [139] [140] La forma japonesa del jarabe de glucosa, Mizuame , se elabora a partir de almidón de batata o de arroz . [141] La maltodextrina contiene aproximadamente un 20% de glucosa.
Muchos cultivos pueden utilizarse como fuente de almidón. El maíz , [134] el arroz, [134] el trigo , [134] la mandioca , [134] la patata , [134] la cebada , [134] la batata, [142] la cáscara de maíz y el sagú se utilizan en varias partes del mundo. En los Estados Unidos , el almidón de maíz (de maíz) se utiliza casi exclusivamente. Algo de glucosa comercial se presenta como un componente del azúcar invertido , una mezcla aproximadamente 1:1 de glucosa y fructosa que se produce a partir de la sacarosa. En principio, la celulosa podría hidrolizarse a glucosa, pero este proceso aún no es comercialmente práctico. [54]
Conversión a fructosa
En los EE. UU., se utiliza casi exclusivamente maíz (más precisamente, jarabe de maíz) como fuente de glucosa para la producción de isoglucosa , que es una mezcla de glucosa y fructosa, ya que la fructosa tiene un mayor poder edulcorante, con el mismo valor calorífico fisiológico de 374 kilocalorías por 100 g. La producción mundial anual de isoglucosa es de 8 millones de toneladas (a partir de 2011). [135] Cuando se elabora a partir de jarabe de maíz, el producto final es el jarabe de maíz con alto contenido de fructosa (JMAF).
Uso comercial

La glucosa se utiliza principalmente para la producción de fructosa y de alimentos que contienen glucosa. En los alimentos, se utiliza como edulcorante, humectante , para aumentar el volumen y crear una sensación en boca más suave . [134] Varias fuentes de glucosa, como el jugo de uva (para el vino) o la malta (para la cerveza), se utilizan para la fermentación a etanol durante la producción de bebidas alcohólicas . La mayoría de los refrescos en los EE. UU. utilizan JMAF-55 (con un contenido de fructosa del 55% en la masa seca), mientras que la mayoría de los demás alimentos endulzados con JMAF en los EE. UU. utilizan JMAF-42 (con un contenido de fructosa del 42% en la masa seca). [144] En México, por otro lado, los refrescos se endulzan con azúcar de caña, que tiene un mayor poder edulcorante. [145] Además, el jarabe de glucosa se utiliza, entre otras cosas, en la producción de confitería como caramelos , toffee y fondant . [146] Las reacciones químicas típicas de la glucosa cuando se calienta en condiciones sin agua son la caramelización y, en presencia de aminoácidos, la reacción de Maillard .
Además, se pueden producir biotecnológicamente diversos ácidos orgánicos a partir de glucosa, por ejemplo mediante fermentación con Clostridium thermoaceticum para producir ácido acético , con Penicillium notatum para la producción de ácido araboascórbico, con Rhizopus delemar para la producción de ácido fumárico , con Aspergillus niger para la producción de ácido glucónico , con Candida brumptii para producir ácido isocítrico , con Aspergillus terreus para la producción de ácido itacónico , con Pseudomonas fluorescens para la producción de ácido 2-cetoglucónico, con Gluconobacter suboxydans para la producción de ácido 5-cetoglucónico, con Aspergillus oryzae para la producción de ácido kójico , con Lactobacillus delbrueckii para la producción de ácido láctico , con Lactobacillus brevis para la producción de ácido málico , con Propionibacter shermanii para la producción de ácido propiónico , con Pseudomonas aeruginosa para la producción de ácido pirúvico y con Gluconobacter suboxydans para la producción de ácido tartárico . [147] [ cita(s) adicional(es) necesaria(s ) ] Se ha informado recientemente de productos naturales bioactivos potentes como la triptolida que inhibe la transcripción en mamíferos a través de la inhibición de la subunidad XPB del factor de transcripción general TFIIH como un conjugado de glucosa para dirigirse a las células cancerosas hipóxicas con mayor expresión del transportador de glucosa. [148] Recientemente, la glucosa ha estado ganando uso comercial como un componente clave de los "kits" que contienen ácido láctico e insulina destinados a inducir hipoglucemia e hiperlactatemia para combatir diferentes cánceres e infecciones. [149]
Análisis
Cuando se desea detectar una molécula de glucosa en una posición determinada en una molécula más grande, se realiza una espectroscopia de resonancia magnética nuclear , un análisis de cristalografía de rayos X o una inmunotinción de lectina con el conjugado de la enzima reportera concanavalina A , que se une únicamente a la glucosa o la manosa.
Reacciones clásicas de detección cualitativa
Estas reacciones sólo tienen importancia histórica:
Prueba de Fehling
La prueba de Fehling es un método clásico para la detección de aldosas. [150] Debido a la mutarrotación, la glucosa siempre está presente en una pequeña medida como un aldehído de cadena abierta. Al agregar los reactivos de Fehling (solución de Fehling (I) y solución de Fehling (II)), el grupo aldehído se oxida a un ácido carboxílico , mientras que el complejo de tartrato de Cu 2+ se reduce a Cu + y forma un precipitado rojo ladrillo (Cu 2 O).
Prueba de Tollens
En la prueba de Tollens , después de agregar AgNO 3 amoniacal a la solución de muestra, la glucosa reduce Ag + a plata elemental . [151]
Prueba de Barfoed
En la prueba de Barfoed , [152] se añade una solución de acetato de cobre disuelto , acetato de sodio y ácido acético a la solución de azúcar que se va a analizar y posteriormente se calienta en un baño de agua durante unos minutos. La glucosa y otros monosacáridos producen rápidamente un color rojizo y óxido de cobre (I) (Cu 2 O) de color marrón rojizo.
Prueba de Nylander
Como azúcar reductor, la glucosa reacciona en la prueba de Nylander . [153]
Otras pruebas
Al calentar una solución diluida de hidróxido de potasio con glucosa a 100 °C, se desarrolla un fuerte color marrón rojizo y un olor parecido al caramelo. [154] El ácido sulfúrico concentrado disuelve la glucosa seca sin ennegrecerse a temperatura ambiente formando ácido sulfúrico de azúcar. [154] [ verificación necesaria ] En una solución de levadura, la fermentación alcohólica produce dióxido de carbono en la proporción de 2,0454 moléculas de glucosa por una molécula de CO 2 . [154] La glucosa forma una masa negra con cloruro estannoso . [154] En una solución de plata amoniacal, la glucosa (así como la lactosa y la dextrina) conduce a la deposición de plata. En una solución de acetato de plomo amoniacal , se forma glicósido de plomo blanco en presencia de glucosa, que se vuelve menos soluble al cocinarlo y se vuelve marrón. [154] En una solución de cobre amoniacal, se forma hidrato de óxido de cobre amarillo con glucosa a temperatura ambiente, mientras que se forma óxido de cobre rojo durante la ebullición (lo mismo con la dextrina, excepto con una solución de acetato de cobre amoniacal). [154] Con el reactivo de Hager , la glucosa forma óxido de mercurio durante la ebullición. [154] Se utiliza una solución alcalina de bismuto para precipitar bismuto elemental de color negro-marrón con glucosa. [154] La glucosa hervida en una solución de molibdato de amonio vuelve azul la solución. Una solución con carmín índigo y carbonato de sodio se decolora cuando se hierve con glucosa. [154]
Cuantificación instrumental
Refractometría y polarimetría
En soluciones concentradas de glucosa con una proporción reducida de otros hidratos de carbono, su concentración se puede determinar con un polarímetro. En el caso de mezclas de azúcares, la concentración se puede determinar con un refractómetro , por ejemplo, en la determinación de Oechsle durante la producción de vino.
Métodos enzimáticos fotométricos en solución
La enzima glucosa oxidasa (GOx) convierte la glucosa en ácido glucónico y peróxido de hidrógeno mientras consume oxígeno. Otra enzima, la peroxidasa, cataliza una reacción cromogénica (reacción de Trinder) [155] del fenol con 4-aminoantipirina para formar un colorante violeta. [156]
Método de tiras reactivas fotométricas
El método de la tira reactiva utiliza la conversión enzimática antes mencionada de glucosa en ácido glucónico para formar peróxido de hidrógeno. Los reactivos se inmovilizan en una matriz de polímero, la llamada tira reactiva, que adquiere un color más o menos intenso. Esto se puede medir reflectométricamente a 510 nm con la ayuda de un fotómetro portátil basado en LED. Esto permite la determinación rutinaria de azúcar en sangre por parte de no científicos. Además de la reacción del fenol con 4-aminoantipirina, se han desarrollado nuevas reacciones cromogénicas que permiten la fotometría a longitudes de onda más altas (550 nm, 750 nm). [156] [157]
Sensor de glucosa amperométrico
El electroanálisis de la glucosa también se basa en la reacción enzimática mencionada anteriormente. El peróxido de hidrógeno producido se puede cuantificar amperométricamente mediante oxidación anódica a un potencial de 600 mV. [158] El GOx se inmoviliza en la superficie del electrodo o en una membrana colocada cerca del electrodo. Los metales preciosos como el platino o el oro se utilizan en los electrodos, así como electrodos de nanotubos de carbono, que, por ejemplo, están dopados con boro. [159] Los nanocables de Cu–CuO también se utilizan como electrodos amperométricos sin enzimas, alcanzando un límite de detección de 50 μmol/L. [160] Un método especialmente prometedor es el denominado "cableado enzimático", en el que el electrón que fluye durante la oxidación se transfiere a través de un cable molecular directamente desde la enzima al electrodo. [161]
Otros métodos sensoriales
Existen otros sensores químicos para medir la glucosa. [162] [163] Dada la importancia del análisis de la glucosa en las ciencias de la vida, también se han desarrollado numerosas sondas ópticas para sacáridos basadas en el uso de ácidos borónicos, [164] que son particularmente útiles para aplicaciones sensoriales intracelulares donde otros métodos (ópticos) no son o solo se pueden usar de manera condicional. Además de los derivados orgánicos del ácido borónico, que a menudo se unen de manera muy específica a los grupos 1,2-diol de los azúcares, también existen otros conceptos de sonda clasificados por mecanismos funcionales que utilizan proteínas selectivas de unión a la glucosa (por ejemplo, concanavalina A) como receptor. Además, se desarrollaron métodos que detectan indirectamente la concentración de glucosa a través de la concentración de productos metabolizados, por ejemplo, por el consumo de oxígeno utilizando sensores ópticos de fluorescencia. [165] Finalmente, existen conceptos basados en enzimas que utilizan la absorbancia intrínseca o la fluorescencia de enzimas (marcadas con fluorescencia) como reporteros. [162]
Yodometría de cobre
La glucosa se puede cuantificar mediante yodometría de cobre. [166]
Métodos cromatográficos
En particular, para el análisis de mezclas complejas que contienen glucosa, por ejemplo en la miel, a menudo se utilizan métodos cromatográficos como la cromatografía líquida de alto rendimiento y la cromatografía de gases [166] en combinación con la espectrometría de masas . [167] [168] Teniendo en cuenta las proporciones de isótopos, también es posible detectar de forma fiable la adulteración de la miel por azúcares añadidos con estos métodos. [169] La derivatización mediante reactivos de sililación se utiliza habitualmente. [170] Además, se pueden cuantificar las proporciones de di- y trisacáridos.
Análisis in vivo
La captación de glucosa en las células de los organismos se mide con 2-desoxi-D-glucosa o fluorodesoxiglucosa . [114] La ( 18 F)fluorodesoxiglucosa se utiliza como trazador en la tomografía por emisión de positrones en oncología y neurología, [171] donde es, con diferencia, el agente de diagnóstico más utilizado. [172]
Referencias
- ^ Nomenclatura de carbohidratos (Recomendaciones 1996) | 2-Carb-2 Archivado el 27 de agosto de 2023 en Wayback Machine . iupac.qmul.ac.uk .
- ^ ab Boerio-Goates J (1991), "Medidas de capacidad térmica y funciones termodinámicas de la α-D-glucosa cristalina a temperaturas de 10 K a 340 K", J. Chem. Thermodyn. , 23 (5): 403–09, Bibcode :1991JChTh..23..403B, doi :10.1016/S0021-9614(05)80128-4
- ^ Ponomarev VV, Migarskaya LB (1960), "Calores de combustión de algunos aminoácidos", Russ. J. Phys. Chem. (traducción inglesa) , 34 : 1182–83
- ^ Domb AJ, Kost J, Wiseman D (4 de febrero de 1998). Manual de polímeros biodegradables. CRC Press. pág. 275. ISBN 978-1-4200-4936-7.
- ^ ab "NCATS Inxight Drugs — DEXTROSA, FORMA NO ESPECIFICADA". Archivado desde el original el 11 de diciembre de 2023. Consultado el 18 de marzo de 2024 .
- ^ Kamide K (2005). Productos de celulosa y derivados de celulosa: caracterización molecular y sus aplicaciones (1.ª ed.). Ámsterdam: Elsevier. p. 1. ISBN 978-0-08-045444-3. Recuperado el 13 de mayo de 2021 .
- ^ abcd "L-glucosa". Artículos, tutoriales y diccionarios de biología en línea . 7 de octubre de 2019. Archivado desde el original el 25 de mayo de 2022. Consultado el 6 de mayo de 2022 .
- ^ ab Organización Mundial de la Salud (2019). Lista modelo de medicamentos esenciales de la Organización Mundial de la Salud: 21.ª lista de 2019. Ginebra: Organización Mundial de la Salud. hdl : 10665/325771 . OMS/MVP/EMP/IAU/2019.06. Licencia: CC BY-NC-SA 3.0 IGO.
- ^ "Diccionario de etimología en línea". Etymonline.com . Archivado desde el original el 26 de noviembre de 2016. Consultado el 25 de noviembre de 2016 .
- ^ Thénard, Gay-Lussac, Biot y Dumas (1838) "Rapport sur un mémoire de M. Péligiot, intitulé: Recherches sur la Nature et les propriétés chimiques des sucres". Archivado el 6 de diciembre de 2015 en Wayback Machine (Informe sobre las memorias del Sr. Péligiot, titulado: Investigaciones sobre la naturaleza y las propiedades químicas de los azúcares), Comptes rendus , 7 : 106–113. De la página 109. Archivado el 6 de diciembre de 2015 en Wayback Machine : "Il résulte des comparaisons faites par M. Péligot, que le sucre de raisin, celui d'amidon, celui de diabètes et celui de miel ont parfaitement la même listening et les mêmes propriétés, et constituent un seul corps que nous proposons d'appeler Glucose (1... (1) γλευχος, moût, vin doux." De las comparaciones hechas por el Sr. Péligot se desprende que el azúcar de la uva, el del almidón, el de la diabetes y el de la miel tienen exactamente la misma composición y las mismas propiedades y constituyen una sola sustancia que proponemos llamar glucosa ( 1)... (1) γλευχος, mosto, vino dulce.
- ^ ab Enciclopedia de alimentación y salud. Academic Press. 2015. pág. 239. ISBN 978-0-12-384953-3Archivado desde el original el 23 de febrero de 2018.
- ^ Marggraf (1747) "Experiences chimiques faites dans le dessein de tirer un veritable sucre de divers plantes, qui croissent dans nos contrées" Archivado el 24 de junio de 2016 en Wayback Machine [Experimentos químicos realizados con la intención de extraer azúcar real de diversas plantas que crecen en nuestras tierras], Histoire de l'académie royale des sciences et belles-lettres de Berlin , págs. De la página 90: Archivado el 27 de octubre de 2014 en Wayback Machine "Les pasas secs, etant humectés d'une petite quantité d'eau, de maniere qu'ils mollissent, peuvent alors etre pilés, & le suc qu'on en exprime, etant depuré & épaissi, fournira une espece de Sucre." (Las pasas, humedecidas con una pequeña cantidad de agua, de manera que se ablanden, se pueden luego prensar, y el jugo que se exprime, después de ser purificado y espesado, proporcionará una especie de azúcar.)
- ^ John F. Robyt: Fundamentos de la química de los carbohidratos. Springer Science & Business Media, 2012, ISBN 978-1-461-21622-3 . pág. 7.
- ^ Rosanoff MA (1906). "Sobre la clasificación de estereoisomeros de Fischer.1". Journal of the American Chemical Society . 28 : 114–121. doi :10.1021/ja01967a014. Archivado desde el original el 17 de diciembre de 2019. Consultado el 1 de julio de 2019 .
- ^ Emil Fischer, Fundación Nobel, archivado desde el original el 3 de septiembre de 2009 , consultado el 2 de septiembre de 2009
- ^ Fraser-Reid B, "La glucosa de van't Hoff", Chem. Eng. News , 77 (39): 8
- ^ "Otto Meyerhof - Datos - NobelPrize.org" Archivado el 15 de julio de 2018 en Wayback Machine . NobelPrize.org . Consultado el 5 de septiembre de 2018.
- ^ "Hans von Euler-Chelpin - Datos - NobelPrize.org" Archivado el 3 de septiembre de 2018 en Wayback Machine . NobelPrize.org . Consultado el 5 de septiembre de 2018.
- ^ "Arthur Harden - Datos - NobelPrize.org" Archivado el 3 de septiembre de 2018 en Wayback Machine . NobelPrize.org . Consultado el 5 de septiembre de 2018.
- ^ "Bernardo Houssay - Datos - NobelPrize.org" Archivado el 15 de julio de 2018 en Wayback Machine . NobelPrize.org . Consultado el 5 de septiembre de 2018.
- ^ "Carl Cori - Datos - NobelPrize.org" Archivado el 15 de julio de 2018 en Wayback Machine . NobelPrize.org . Consultado el 5 de septiembre de 2018.
- ^ "Gerty Cori - Datos - NobelPrize.org" Archivado el 15 de julio de 2018 en Wayback Machine . NobelPrize.org . Consultado el 5 de septiembre de 2018.
- ^ "Luis Leloir - Datos - NobelPrize.org" Archivado el 15 de julio de 2018 en Wayback Machine . NobelPrize.org . Consultado el 5 de septiembre de 2018.
- ^ Wenyue Kang y Zhijun Zhang (2020): "Producción selectiva de ácido acético mediante pirólisis catalítica rápida de hexosas sobre sales de potasio", Catalysts , volumen 10, páginas 502–515. doi :10.3390/catal10050502
- ^ Bosch L, Fyles T, James T (noviembre de 2004). "Complejos binarios y ternarios de ácido fenilborónico con sacáridos y bases de Lewis". Tetrahedron . 60 (49): 11175–11190. doi :10.1016/j.tet.2004.08.046.
- ^ Yebra-Biurrun M (2005), "Edulcorantes", Enciclopedia de la ciencia analítica , Elsevier, págs. 562-572, doi :10.1016/b0-12-369397-7/00610-5, ISBN 978-0-12-369397-6
- ^ "glucosa". The Columbia Encyclopedia, 6.ª ed., 2015. Encyclopedia.com. 17 de noviembre de 2015 http://www.encyclopedia.com Archivado el 26 de abril de 2009 en Wayback Machine .
- ^ Aga MB, Sharma V, Dar AH, Dash KK, Singh A, Shams R, et al. (2023). "Revisión exhaustiva sobre las propiedades funcionales y nutracéuticas de la miel". Efood . 4 (2). doi : 10.1002/efd2.71 .
- ^ Bobiş O, Dezmirean DS, Moise AR (2018). "Miel y diabetes: la importancia de los azúcares simples naturales en la dieta para prevenir y tratar diferentes tipos de diabetes". Medicina oxidativa y longevidad celular . 2018 : 1–12. doi : 10.1155/2018/4757893 . PMC 5817209 . PMID 29507651.
- ^ Wani HA, Majid S, Khan MS, Bhat AA, Wani RA, Bhat SA, et al. (2020). "Alcance de la miel en la diabetes y los trastornos metabólicos". Aplicaciones terapéuticas de la miel y sus fitoquímicos . págs. 195–217. doi :10.1007/978-981-15-7305-7_9. ISBN 978-981-15-7304-0.
- ^ Alvarez-Suarez JM, Tulipani S, Romandini S, Bertoli E, Battino M (2010). "Contribución de la miel en la nutrición y la salud humana: una revisión". Revista Mediterránea de Nutrición y Metabolismo . 3 : 15–23. doi :10.1007/s12349-009-0051-6.
- ^ Ischayek JI, Kern M (agosto de 2006). "Las mieles estadounidenses con distintos contenidos de glucosa y fructosa generan índices glucémicos similares". Journal of the American Dietetic Association . 106 (8): 1260–1262. doi :10.1016/j.jada.2006.05.003. PMID 16863724.
- ^ "Contribución potencialmente importante de la dextrosa utilizada como diluyente a la hiperglucemia en pacientes hospitalizados | Atención de la diabetes | Asociación Estadounidense de Diabetes". Archivado desde el original el 29 de mayo de 2022. Consultado el 18 de marzo de 2024 .
- ^ "Dextrosa: ¿Por qué está presente en alimentos y medicamentos?". 24 de junio de 2018. Archivado desde el original el 13 de febrero de 2024. Consultado el 18 de marzo de 2024 .
- ^ abc "¿Qué es la dextrosa, cómo se utiliza y es saludable? - The Nutrition Insider". 27 de octubre de 2023. Archivado desde el original el 14 de febrero de 2024. Consultado el 18 de marzo de 2024 .
- ^ "Dextrosa vs. glucosa: ¿son iguales estos azúcares?". Archivado desde el original el 29 de septiembre de 2023. Consultado el 18 de marzo de 2024 .
- ^ Baron DN, McIntyre N (1976). "Carta: La glucosa es dextrosa y es glucosa". British Medical Journal . 2 (6026): 41–42. doi :10.1136/bmj.2.6026.41-c. PMC 1687736 . PMID 938892.
- ^ abcd «Prakash Chemicals International». Archivado desde el original el 6 de junio de 2023. Consultado el 18 de marzo de 2024 .
- ^ "API | glucosa monohidrato". Archivado desde el original el 24 de marzo de 2023. Consultado el 18 de marzo de 2024 .
- ^ abcd «Diferencia entre dextrosa anhidra y dextrosa monohidrato». 28 de diciembre de 2022. Archivado desde el original el 18 de marzo de 2024. Consultado el 18 de marzo de 2024 .
- ^ "Dextrosa anhidra". Archivado desde el original el 18 de marzo de 2024 . Consultado el 18 de marzo de 2024 .
- ^ Khvorova LS, Andreev NR, Lukin ND (enero de 2020). "Estudio de las condiciones para la aplicación de surfactantes en la producción de glucosa cristalina". Ciencias Agrícolas Rusas . 46 (1): 90–93. Código Bibliográfico :2020RuAgS..46...90K. doi :10.3103/S1068367420010048.
- ^ ab "¿Cuál es la diferencia entre glucosa anhidra y glucosa?". Archivado desde el original el 18 de marzo de 2024. Consultado el 18 de marzo de 2024 .
- ^ "Anhidro vs. Monohidrato: ¿Cuál es la diferencia?". Archivado desde el original el 18 de marzo de 2024. Consultado el 18 de marzo de 2024 .
- ^ Trasi NS, Boerrigter SX, Byrn SR, Carvajal TM (15 de marzo de 2011). "Investigación del efecto de las condiciones de deshidratación en la compactibilidad de la glucosa". Revista internacional de farmacia . 406 (1–2): 55–61. doi :10.1016/j.ijpharm.2010.12.042. PMID 21232587.
- ^ Mitra B, Wolfe C, Wu SJ (4 de mayo de 2018). "Dextrosa monohidrato como diluyente alternativo de origen no animal en formulaciones de comprimidos de granulación húmeda de alto cizallamiento". Desarrollo de fármacos y farmacia industrial . 44 (5): 817–828. doi :10.1080/03639045.2017.1414231. PMID 29300107.
- ^ "Pruebas de diabetes y prediabetes - NIDDK". Archivado desde el original el 16 de diciembre de 2023. Consultado el 18 de marzo de 2024 .
- ^ "Dextrosa monohidrato". Archivado desde el original el 2 de diciembre de 2023. Consultado el 18 de marzo de 2024 .
- ^ "D-(+)-glucosa monohidrato". Archivado desde el original el 18 de marzo de 2024 . Consultado el 18 de marzo de 2024 .
- ^ "D-Glucosa". Archivado desde el original el 15 de diciembre de 2023. Consultado el 18 de marzo de 2024 .
- ^ "D-(+)-Glucosa". Archivado desde el original el 18 de marzo de 2024 . Consultado el 18 de marzo de 2024 .
- ^ "D-(+)-Glucosa". Archivado desde el original el 18 de marzo de 2024 . Consultado el 18 de marzo de 2024 .
- ^ "Glucosa (Dextrosa)". 2 de octubre de 2013. Archivado desde el original el 21 de diciembre de 2023. Consultado el 18 de marzo de 2024 .
- ^ ab Schenck FW (2006). "Glucosa y jarabes que contienen glucosa". Ullmann's Encyclopedia of Industrial Chemistry . doi :10.1002/14356007.a12_457.pub2. ISBN 978-3-527-30673-2.
- ^ ab Patrick F. Fox: Química láctea avanzada Volumen 3: Lactosa, agua, sales y vitaminas , Springer, 1992. Volumen 3, ISBN 9780412630200. pág. 316.
- ↑ Benjamín Caballero, Paul Finglas, Fidel Toldrá: Enciclopedia de Alimentación y Salud . Prensa académica (2016). ISBN 9780123849533 , Volumen 1, pág. 76.
- ^ "16.4: Estructuras cíclicas de monosacáridos". Chemistry LibreTexts . 18 de julio de 2014. Archivado desde el original el 17 de abril de 2023 . Consultado el 17 de abril de 2023 .
- ^ Takagi S, Jeffrey GA (1979). "1,2-O-isopropilideno-D-glucofuranosa". Acta Crystallographica Sección B . B35 (6): 1522–1525. Código Bibliográfico :1979AcCrB..35.1522T. doi :10.1107/S0567740879006968.
- ^ Bielecki M, Eggert H, Christian Norrild J (1999). "Un sensor de glucosa fluorescente que se une covalentemente a los cinco grupos hidroxi de la α-D-glucofuranosa. Una nueva investigación". Journal of the Chemical Society, Perkin Transactions . 2 (3): 449–456. doi :10.1039/A808896I.
- ^ Chandran SK, Nangia A (2006). "Estructura cristalina modulada (Z ′ = 2) de α-d-glucofuranosa-1,2:3,5-bis(p-tolil)boronato". CrystEngComm . 8 (8): 581–585. doi :10.1039/B608029D.
- ^ McMurry JE (1988), Química orgánica (2.ª ed.), Brooks/Cole, pág. 866, ISBN 0534079687.
- ^ Juaristi E, Cuevas G (1995), El efecto anomérico , CRC Press, págs. 9-10, ISBN 978-0-8493-8941-2
- ^ ab Manfred Hesse, Herbert Meier, Bernd Zeeh, Stefan Bienz, Laurent Bigler, Thomas Fox: Spektroskopische Methoden in der organischen Chemie . 8ª edición revisada. Georg Thieme, 2011, ISBN 978-3-13-160038-7 , pág. 34 (en alemán).
- ^ abcd Bunn HF, Higgins PJ (1981). "Reacción de monosacáridos con proteínas: posible significado evolutivo". Science . 213 (4504): 222–24. Bibcode :1981Sci...213..222B. doi :10.1126/science.12192669. PMID 12192669.
- ^ Jeremy M. Berg: Stryer Bioquímica. Springer-Verlag, 2017, ISBN 978-3-662-54620-8 , pág. 531. (alemán)
- ^ de Garrett RH (2013). Bioquímica (quinta edición). Belmont, CA: Brooks/Cole, Cengage Learning. ISBN 978-1-133-10629-6.
- ^ abcd Voet D, Voet JG (2011). Bioquímica (4ª ed.). Hoboken, Nueva Jersey: John Wiley & Sons. ISBN 978-0-470-57095-1.
- ^ Albert L. Lehninger, Bioquímica, 6.ª impresión , Worth Publishers Inc. 1972, ISBN 0-87901-009-6 pág. 228.
- ^ ab "Química para biólogos: fotosíntesis". www.rsc.org . Archivado desde el original el 4 de agosto de 2016 . Consultado el 5 de febrero de 2018 .
- ^ abc Peter C. Heinrich: Löffler / Petrides Biochemie und Pathobiochemie. Springer-Verlag, 2014, ISBN 978-3-642-17972-3 , pág. 195. (alemán)
- ^ abcde U. Satyanarayana: Bioquímica. Elsevier Health Sciences, 2014, ISBN 978-8-131-23713-7 . pág. 674.
- ^ Wasserman DH (2009). "Cuatro gramos de glucosa". Revista estadounidense de fisiología. Endocrinología y metabolismo . 296 (1): E11–21. doi :10.1152/ajpendo.90563.2008. PMC 2636990. PMID 18840763 .
- ^ "Hiperglucemia y complicaciones de la diabetes: la acumulación de moléculas conocidas como AGE puede ser el vínculo clave", Diabetes Forecast , American Diabetes Association, 2010, ISSN 0095-8301, archivado desde el original el 14 de octubre de 2013 , consultado el 20 de mayo de 2010
- ^ Varki A, Cummings RD, Esko JD, Freeze HH, Stanley P, Bertozzi CR, et al. (2009). Varki A (ed.). Fundamentos de glicobiología (2.ª ed.). Cold Spring Harbor Laboratories Press. ISBN 978-0-87969-770-9. PMID 20301239. Archivado desde el original el 6 de diciembre de 2016.
- ^ "Mostrando el compuesto D-glucosa (FDB012530) - FooDB". Archivado desde el original el 6 de diciembre de 2022 . Consultado el 18 de marzo de 2024 .
- ^ ab Peter C. Heinrich: Löffler/Petrides Biochemie und Pathobiochemie. Springer-Verlag, 2014, ISBN 978-3-642-17972-3 , pág. 404.
- ^ Harold A. Harper: Bioquímica médica. Springer-Verlag, 2013, ISBN 978-3-662-22150-1 , pág. 641. (en alemán)
- ^ Navale AM, Paranjape AN (2016). "Transportadores de glucosa: funciones fisiológicas y patológicas". Biophysical Reviews . 8 (1): 5–9. doi :10.1007/s12551-015-0186-2. PMC 5425736 . PMID 28510148.
- ^ abcdef Peter C. Heinrich: Löffler/Petrides Biochemie und Pathobiochemie. Springer-Verlag, 2014, ISBN 978-3-642-17972-3 , pág. 199, 200. (en alemán)
- ^ Thorens B (2015). «GLUT2, detección de glucosa y homeostasis de la glucosa» (PDF) . Diabetologia . 58 (2): 221–32. doi : 10.1007/s00125-014-3451-1 . PMID 25421524. Archivado (PDF) del original el 2 de diciembre de 2023. Consultado el 18 de marzo de 2024 .
- ^ ab Peter C. Heinrich: Löffler/Petrides Biochemie und Pathobiochemie. Springer-Verlag, 2014, ISBN 978-3-642-17972-3 , pág. 214. (en alemán)
- ^ Huang S, diputado checo (2007). "El transportador de glucosa GLUT4". Metabolismo celular . 5 (4): 237–52. doi : 10.1016/j.cmet.2007.03.006 . PMID 17403369.
- ^ Govers R (2014). Regulación celular de la captación de glucosa por el transportador de glucosa GLUT4 . Avances en química clínica. Vol. 66. págs. 173–240. doi :10.1016/B978-0-12-801401-1.00006-2. ISBN . 978-0-12-801401-1. Número de identificación personal 25344989.
- ^ Wu X, Freeze HH (diciembre de 2002). "GLUT14, un duplicón de GLUT3, se expresa específicamente en los testículos como formas de empalme alternativas". Genomics . 80 (6): 553–7. doi :10.1006/geno.2002.7010. PMID 12504846.
- ^ Ghezzi C, Loo DDF, Wright EM (2018). "Fisiología del manejo renal de la glucosa a través de SGLT1, SGLT2 y GLUT2". Diabetologia . 61 (10): 2087–2097. doi :10.1007/s00125-018-4656-5. PMC 6133168 . PMID 30132032.
- ^ Poulsen SB, Fenton RA, Rieg T (2015). "Cotransporte de sodio y glucosa". Current Opinion in Nephrology and Hypertension . 24 (5): 463–9. doi :10.1097/MNH.0000000000000152. PMC 5364028 . PMID 26125647.
- ^ Smith, Alison M., Zeeman, Samuel C., Smith, Steven M. (2005). "Degradación del almidón". Annu. Rev. Plant Biol . 56 : 73–98. doi :10.1146/annurev.arplant.56.032604.144257. PMID 15862090.
- ^ por Leszek Szablewski: Homeostasis de la glucosa y resistencia a la insulina. Bentham Science Publishers, 2011, ISBN 978-1-608-05189-2 , pág. 46.
- ^ Peter C. Heinrich: Löffler/Petrides Biochemie und Pathobiochemie. Springer-Verlag, 2014, ISBN 978-3-642-17972-3 , pág. 389. (en alemán)
- ^ Wang G, Kawamura K, Hatakeyama S, Takami A, Li H, Wang W (mayo de 2007). "Medición de aerosoles orgánicos en aeronaves sobre China". Environmental Science & Technology . 41 (9): 3115–3120. Bibcode :2007EnST...41.3115W. doi :10.1021/es062601h. PMID 17539513.
- ^ Adeva-Andany MM, Pérez-Felpete N, Fernández-Fernández C, Donapetry-García C, Pazos-García C (2016). "Metabolismo de la glucosa hepática en humanos". Informes de biociencias . 36 (6): e00416. doi :10.1042/BSR20160385. PMC 5293555 . PMID 27707936.
- ^ H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn: Bioquímica . Estudio Pearson; 4. Auflage actualizado 2008; ISBN 978-3-8273-7312-0 ; pag. 490–496. (Alemán)
- ^ de Brian K. Hall: La evolución de Strickberger. Jones & Bartlett Publishers, 2013, ISBN 978-1-449-61484-3 , pág. 164.
- ^ Jones JG (2016). "Metabolismo hepático de la glucosa y los lípidos". Diabetologia . 59 (6): 1098–103. doi : 10.1007/s00125-016-3940-5 . PMID 27048250.
- ^ Entner N, Doudoroff M (1952). "Oxidación de glucosa y ácido glucónico de Pseudomonas saccharophila". J Biol Chem . 196 (2): 853–862. doi : 10.1016/S0021-9258(19)52415-2 . PMID 12981024.
- ^ Ammar EM, Wang X, Rao CV (enero de 2018). "Regulación del metabolismo en Escherichia coli durante el crecimiento en mezclas de azúcares no glucósidos: arabinosa, lactosa y xilosa". Scientific Reports . 8 (1): 609. Bibcode :2018NatSR...8..609A. doi :10.1038/s41598-017-18704-0. PMC 5766520 . PMID 29330542.
- ^ ab Bonadonna RC, Bonora E, Del Prato S, Saccomani M, Cobelli C, Natali A, et al. (julio de 1996). "Roles of glycosy transport and glycosylation in muscle insulin resistance of NIDDM" (PDF) . Diabetes . 45 (7): 915–25. doi :10.2337/diab.45.7.915. PMID 8666143. S2CID 219249555. Archivado (PDF) del original el 6 de marzo de 2017 . Consultado el 5 de marzo de 2017 .
- ^ "Glucosa". Archivado desde el original el 5 de diciembre de 2023. Consultado el 18 de marzo de 2024 .
- ^ Bioquímica médica de un vistazo @Google books, Blackwell Publishing, 2006, pág. 52, ISBN 978-1-4051-1322-9, archivado desde el original el 23 de febrero de 2018
- ^ Bioquímica médica de un vistazo @Google books, Blackwell Publishing, 2006, pág. 50, ISBN 978-1-4051-1322-9, archivado desde el original el 23 de febrero de 2018
- ^ Annibaldi A, Widmann C (2010). "Metabolismo de la glucosa en células cancerosas". Current Opinion in Clinical Nutrition and Metabolic Care . 13 (4): 466–70. doi :10.1097/MCO.0b013e32833a5577. PMID 20473153. S2CID 205782021.
- ^ Szablewski L (2013). "Expresión de transportadores de glucosa en cánceres". Biochimica et Biophysica Acta (BBA) - Revisiones sobre el cáncer . 1835 (2): 164–9. doi :10.1016/j.bbcan.2012.12.004. PMID 23266512.
- ^ Adekola K, Rosen ST, Shanmugam M (2012). "Transportadores de glucosa en el metabolismo del cáncer". Current Opinion in Oncology . 24 (6): 650–4. doi :10.1097/CCO.0b013e328356da72. PMC 6392426 . PMID 22913968.
- ^ Schümann U, Gründler P (septiembre de 1998). "Degradación electroquímica de sustancias orgánicas en ánodos de PbO2: Monitoreo mediante mediciones continuas de CO2". Water Research . 32 (9): 2835–2842. doi :10.1016/s0043-1354(98)00046-3.
- ^ "Capítulo 3: Cálculo del contenido energético de los alimentos – Factores de conversión de energía", Energía alimentaria – métodos de análisis y factores de conversión , FAO, Documento sobre alimentación y nutrición 77, Roma: Organización de las Naciones Unidas para la Alimentación y la Agricultura, 2003, ISBN 978-92-5-105014-9, archivado desde el original el 24 de mayo de 2010
- ^ Georg Schwedt: Zuckersüße Chemie. John Wiley & Sons, 2012, ISBN 978-3-527-66001-8 , pág. 100 (en alemán) .
- ^ Schmidt, Lang: Physiologie des Menschen , 30. Auflage. Springer Verlag, 2007, pág. 907 (en alemán) .
- ^ Dandekar T, Schuster S, Snel B, Huynen M, Bork P (1999). "Alineación de vías: aplicación al análisis comparativo de enzimas glucolíticas". The Biochemical Journal . 343 (1): 115–124. doi :10.1042/bj3430115. PMC 1220531 . PMID 10493919.
- ^ Dash P. "Barrera hematoencefálica y metabolismo cerebral (sección 4, capítulo 11)". Neuroscience Online: An Electronic Textbook for the Neurosciences (Neurociencia en línea: un libro de texto electrónico para las neurociencias ). Departamento de Neurobiología y Anatomía – Facultad de Medicina de la Universidad de Texas en Houston. Archivado desde el original el 17 de noviembre de 2016.
- ^ Fairclough SH, Houston K (2004), "Una medida metabólica del esfuerzo mental", Biol. Psychol. , 66 (2): 177–190, doi :10.1016/j.biopsycho.2003.10.001, PMID 15041139, S2CID 44500072
- ^ Gailliot MT, Baumeister RF, DeWall CN, Plant EA, Brewer LE, Schmeichel BJ, et al. (2007), "El autocontrol depende de la glucosa como fuente limitada de energía: la fuerza de voluntad es más que una metáfora" (PDF) , J. Pers. Soc. Psychol. , 92 (2): 325–336, CiteSeerX 10.1.1.337.3766 , doi :10.1037/0022-3514.92.2.325, PMID 17279852, S2CID 7496171, archivado (PDF) desde el original el 18 de agosto de 2017
- ^ Gailliot MT, Baumeister RF (2007), "La fisiología de la fuerza de voluntad: vinculación de la glucosa en sangre con el autocontrol", Personal. Soc. Psychol. Rev. , 11 (4): 303–327, CiteSeerX 10.1.1.475.9484 , doi :10.1177/1088868307303030, PMID 18453466, S2CID 14380313
- ^ Masicampo EJ, Baumeister RF (2008), "Hacia una fisiología del razonamiento y el juicio de doble proceso: limonada, fuerza de voluntad y un costoso análisis basado en reglas", Psychol. Sci. , 19 (3): 255–60, doi :10.1111/j.1467-9280.2008.02077.x, PMID 18315798, S2CID 38596025
- ^ abc Donard Dwyer: Metabolismo de la glucosa en el cerebro. Academic Press, 2002, ISBN 978-0-123-66852-3 , pág. XIII.
- ^ abc Koekkoek LL, Mul JD, La Fleur SE (2017). "Detección de glucosa en el sistema de recompensa". Frontiers in Neuroscience . 11 : 716. doi : 10.3389/fnins.2017.00716 . PMC 5742113 . PMID 29311793.
- ^ ab Tucker RM, Tan SY (2017). "¿Influyen los edulcorantes no nutritivos en la homeostasis aguda de la glucosa en humanos? Una revisión sistemática". Fisiología y comportamiento . 182 : 17–26. doi :10.1016/j.physbeh.2017.09.016. PMID 28939430. S2CID 38764657. Archivado desde el original el 29 de julio de 2020 . Consultado el 7 de junio de 2020 .
- ^ La Fleur SE, Fliers E, Kalsbeek A (2014). "Neurociencia de la homeostasis de la glucosa". Diabetes y el sistema nervioso . Manual de neurología clínica. Vol. 126. págs. 341–351. doi :10.1016/B978-0-444-53480-4.00026-6. ISBN 978-0-444-53480-4. Número de identificación personal 25410233..
- ^ Bisschop PH, Fliers E, Kalsbeek A (2015). "Regulación autónoma de la producción hepática de glucosa". Fisiología integral . 5 (1): 147–165. doi :10.1002/cphy.c140009. PMID 25589267.
- ^ WA Scherbaum, BM Lobnig, en: Hans-Peter Wolff, Thomas R. Weihrauch: Internistische Therapie 2006, 2007 . 16ª edición. Elsevier, 2006, ISBN 3-437-23182-0 , pág. 927, 985 (en alemán) .
- ^ Harold A. Harper: Bioquímica médica . Springer-Verlag, 2013, ISBN 978-3-662-22150-1 , pág. 294.
- ^ Clarke SF, Foster JR (2012). "Una historia de los medidores de glucosa en sangre y su papel en el autocontrol de la diabetes mellitus". British Journal of Biomedical Science . 69 (2): 83–93. CiteSeerX 10.1.1.468.2196 . doi :10.1080/09674845.2012.12002443. PMID 22872934. S2CID 34263228.
- ^ "Diagnóstico de la diabetes y conocimiento sobre la prediabetes". Asociación Estadounidense de Diabetes . Archivado desde el original el 28 de julio de 2017. Consultado el 20 de febrero de 2018 .
- ^ de Richard A. Harvey, Denise R. Ferrier: Bioquímica . Quinta edición, Lippincott Williams & Wilkins, 2011, ISBN 978-1-608-31412-6 , pág. 366.
- ^ ab U Satyanarayana: Bioquímica . Ciencias de la Salud Elsevier, 2014, ISBN 978-8-131-23713-7 , pág. 508.
- ^ Holt SH, Miller JC, Petocz P (1997). "Un índice de insulina de los alimentos: la demanda de insulina generada por porciones de 1000 kJ de alimentos comunes". The American Journal of Clinical Nutrition . 66 (5): 1264–1276. doi : 10.1093/ajcn/66.5.1264 . PMID 9356547.
- ^ ab Peter C. Heinrich: Löffler/Petrides Biochemie und Pathobiochemie. Springer-Verlag, 2014, ISBN 978-3-642-17972-3 , pág. 27. (en alemán)
- ^ Röder PV, Wu B, Liu Y, Han W (2016). "Regulación pancreática de la homeostasis de la glucosa". Exp. Mol. Med . 48 (3 de marzo): e219–. doi :10.1038/emm.2016.6. PMC 4892884 . PMID 26964835.
- ^ Estela, Carlos (2011) "Niveles de glucosa en sangre", Undergraduate Journal of Mathematical Modeling: Uno + Dos: Vol. 3: Iss. 2, Artículo 12.
- ^ "Carbohidratos y azúcar en sangre". The Nutrition Source . 5 de agosto de 2013. Archivado desde el original el 30 de enero de 2017. Consultado el 30 de enero de 2017 – a través de Harvard TH Chan School of Public Health.
- ^ Venditti A, Frezza C, Vincenti F, Brodella A, Sciubba F, Montesano C, et al. (febrero de 2019). "Un derivado de syn-ent-labdadieno con una rara función de espiro-β-lactona de los conos masculinos de Wollemia nobilis". Fitoquímica . 158 : 91–95. Código Bib : 2019PChem.158...91V. doi :10.1016/j.phytochem.2018.11.012. PMID 30481664.
- ^ Lei Y, Shi SP, Song YL, Bi D, Tu PF (mayo de 2014). "Saponinas triterpénicas de las raíces de Ilex asprella". Química y biodiversidad . 11 (5): 767–775. doi :10.1002/cbdv.201300155. PMID 24827686.
- ^ Balan V, Bals B, Chundawat SP, Marshall D, Dale BE (2009). "Pretratamiento de biomasa lignocelulósica con AFEX". Biocombustibles . Métodos en biología molecular. Vol. 581. págs. 61–77. doi :10.1007/978-1-60761-214-8_5. ISBN 978-1-60761-213-1. Número de identificación personal 19768616.
- ^ "FoodData Central". fdc.nal.usda.gov . Archivado desde el original el 3 de diciembre de 2019 . Consultado el 18 de marzo de 2024 .
- ^ abcdefghi PJ Fellows: Tecnología de procesamiento de alimentos. Woodhead Publishing , 2016, ISBN 978-0-081-00523-1 , pág. 197.
- ^ por Thomas Becker, Dietmar Breithaupt, Horst Werner Doelle, Armin Fiechter, Günther Schlegel, Sakayu Shimizu, Hideaki Yamada: Biotecnología , en: Ullmann's Encyclopedia of Industrial Chemistry , 7.ª edición, Wiley-VCH, 2011. ISBN 978-3-527-32943-4 . Volumen 6, pág. 48.
- ^ abc Sociedad de Investigación de Amilasa de Japón: Manual de amilasas y enzimas relacionadas. Elsevier, 2014, ISBN 978-1-483-29939-6 , pág. 195.
- ^ Madsen GB, Norman BE, Slott S (1973). "Una nueva amilasa bacteriana termoestable y su uso en la licuefacción a alta temperatura". Almidón – Stärke . 25 (9): 304–308. doi :10.1002/star.19730250906.
- ^ Norman BE (1982). "Una nueva enzima desramificante para su aplicación en la industria del jarabe de glucosa". Starch – Stärke . 34 (10): 340–346. doi :10.1002/star.19820341005.
- ^ James N. BeMiller, Roy L. Whistler (2009). Almidón: química y tecnología. Ciencia y tecnología de los alimentos (3.ª ed.). Nueva York: Academic Press. ISBN 978-0-08-092655-1.
- ^ BeMiller, James N., Whistler, Roy L., eds. (2009). Almidón: química y tecnología. Ciencia y tecnología de los alimentos (3.ª ed.). Nueva York: Academic Press. ISBN 978-0-08-092655-1. Recuperado el 25 de noviembre de 2016 .
- ^ Alan Davidson: Oxford Companion to Food (1999). "Mizuame", pág. 510 ISBN 0-19-211579-0 .
- ^ Alan Davidson: El compañero de Oxford para la comida . OUP Oxford, 2014, ISBN 978-0-191-04072-6 , pág. 527.
- ^ "Azúcar". Aprendizaje, Recursos alimentarios. food.oregonstate.edu . Oregon State University , Corvallis, OR. 23 de mayo de 2012. Archivado desde el original el 18 de julio de 2011. Consultado el 28 de junio de 2018 .
- ^ "Jarabe de maíz con alto contenido de fructosa: preguntas y respuestas". Administración de Alimentos y Medicamentos de Estados Unidos. 5 de noviembre de 2014. Archivado desde el original el 25 de enero de 2018. Consultado el 18 de diciembre de 2017 .
- ^ Kevin Pang: La Coca-Cola mexicana es un éxito en Estados Unidos En: Seattle Times , 29 de octubre de 2004.
- ^ Steve T. Beckett: Fabricación y uso industrial del chocolate de Beckett . John Wiley & Sons, 2017, ISBN 978-1-118-78014-5 , pág. 82.
- ^ James A. Kent: Manual de química industrial de Riegel . Springer Science & Business Media, 2013, ISBN 978-1-475-76431-4 , pág. 938.
- ^ Datan E, Minn I, Peng X, He QL, Ahn H, Yu B, et al. (2020). "Un conjugado de glucosa y triptólido se dirige selectivamente a las células cancerosas en condiciones de hipoxia". iScience . 23 (9): 101536. Bibcode :2020iSci...23j1536D. doi :10.1016/j.isci.2020.101536. PMC 7509213 . PMID 33083765.
- ^ Goodwin ML, Gladden LB, Nijsten MW (3 de septiembre de 2020). "Hipoglucemia protegida por lactato (LPH)". Frontiers in Neuroscience . 14 : 920. doi : 10.3389/fnins.2020.00920 . ISSN 1662-453X. PMC 7497796 . PMID 33013305.
- ^ H. Fehling: Bestimmung des Zuckers im Harn cuantitativo . En: Archiv für psychologische Heilkunde (1848), volumen 7, p. 64–73 (en alemán).
- ↑ B. Tollens: Über ammon-alkalische Silberlösung als Reagens auf Aldehyd Archivado el 19 de febrero de 2022 en Wayback Machine . En Berichte der Deutschen Chemischen Gesellschaft (1882), volumen 15, pág. 1635-1639 (en alemán).
- ^ Barfoed C (1873). "Ueber die Nachweisung des Traubenzuckers neben Dextrin und verwandten Körpern". Zeitschrift für Analytische Chemie (en alemán). 12 : 27–32. doi :10.1007/BF01462957. S2CID 95749674. Archivado desde el original el 29 de julio de 2020 . Consultado el 1 de julio de 2019 .
- ^ Emil Nylander: Über alkalische Wismuthlösung als Reagens auf Traubenzucker im Harne , Zeitschrift für psychologische Chemie . Volumen 8, Número 3, 1884, pág. 175–185 Resumen. Archivado el 23 de septiembre de 2015 en Wayback Machine (en alemán).
- ^ abcdefghi Georg Schwedt: Zuckersüße Chemie . John Wiley & Sons, 2012, ISBN 978-3-527-66001-8 , pág. 102 (en alemán).
- ^ Trinder P (1969). "Determinación de glucosa en sangre utilizando glucosa oxidasa con un aceptor de oxígeno alternativo". Anales de bioquímica clínica . 6 : 24–27. doi : 10.1177/000456326900600108 . S2CID 58131350.
- ^ ab Zhang Q, Zhao G, Yang N, Zhang L (2019). "Niveles de glucosa en sangre en ayunas en pacientes con diferentes tipos de enfermedades". Glicanos y glicosaminoglicanos como biomarcadores clínicos y terapéuticos - Parte A . Progreso en biología molecular y ciencia traslacional. Vol. 162. págs. 277–292. doi :10.1016/bs.pmbts.2019.01.004. ISBN 978-0-12-817738-9. Número de identificación personal 30905457.
- ^ Mizoguchi M, Ishiyama M, Shiga M (1998). "Reactivo cromogénico soluble en agua para la detección colorimétrica de peróxido de hidrógeno: una alternativa a la 4-aminoantipirina que funciona a una longitud de onda larga". Analytical Communications . 35 (2): 71–74. doi :10.1039/A709038B.
- ^ Wang J (2008). "Biosensores electroquímicos de glucosa". Chemical Reviews . 108 (2): 814–825. doi :10.1021/cr068123a. PMID 18154363..
- ^ Chen X, Chen J, Deng C, Xiao C, Yang Y, Nie Z, et al. (2008). "Biosensor amperométrico de glucosa basado en electrodo modificado con nanotubos de carbono dopados con boro". Talanta . 76 (4): 763–767. doi :10.1016/j.talanta.2008.04.023. PMID 18656655.
- ^ Wang G, Wei Y, Zhang W, Zhang X, Fang B, Wang L (2010). "Detección amperométrica de glucosa sin enzimas utilizando nanocables compuestos de Cu-CuO". Microchimica Acta . 168 (1–2): 87–92. doi :10.1007/s00604-009-0260-1. S2CID 98567636.
- ^ Ohara TJ, Rajagopalan R, Heller A (1994). "Electrodos enzimáticos "cableados" para la determinación amperométrica de glucosa o lactato en presencia de sustancias interferentes". Química analítica . 66 (15): 2451–2457. doi :10.1021/ac00087a008. PMID 8092486.
- ^ ab Borisov SM, Wolfbeis OS (2008). "Biosensores ópticos". Chemical Reviews . 108 (2): 423–461. doi :10.1021/cr068105t. PMID 18229952.
- ^ Ferri S, Kojima K, Sode K (2011). "Revisión de las glucosa oxidasas y las glucosa deshidrogenasas: una visión general de las enzimas que detectan la glucosa". Revista de ciencia y tecnología de la diabetes . 5 (5): 1068–76. doi :10.1177/193229681100500507. PMC 3208862 . PMID 22027299.
- ^ Mader HS, Wolfbeis OS (2008). "Sondas basadas en ácido borónico para la microdeterminación de sacáridos y biomoléculas glicosiladas". Microchimica Acta . 162 (1–2): 1–34. doi :10.1007/s00604-008-0947-8. S2CID 96768832.
- ^ Wolfbeis OS, Oehme I, Papkovskaya N, Klimant I (2000). "Biosensores de glucosa basados en sol-gel que emplean transductores ópticos de oxígeno y un método para compensar el fondo de oxígeno variable". Biosensores y bioelectrónica . 15 (1–2): 69–76. doi :10.1016/S0956-5663(99)00073-1. PMID 10826645.
- ^ ab Galant AL, Kaufman RC, Wilson JD (2015). "Glucosa: detección y análisis". Química alimentaria . 188 : 149–160. doi :10.1016/j.foodchem.2015.04.071. PMID 26041177.
- ^ Sanz ML, Sanz J, Martínez-Castro I (2004). "Método cromatográfico de gases-espectrométrico de masas para la determinación cualitativa y cuantitativa de disacáridos y trisacáridos en miel". Journal of Chromatography A . 1059 (1–2): 143–148. doi :10.1016/j.chroma.2004.09.095. PMID 15628134.
- ^ Instituto Max Planck de Fisiología Molecular de Plantas en la base de datos Golm (19 de julio de 2007). «Espectro de masas de glucosa». Base de datos del metaboloma de Golm . Archivado desde el original el 9 de septiembre de 2018. Consultado el 4 de junio de 2018 .
- ^ Cabañero AI, Recio JL, Rupérez M (2006). "Cromatografía líquida acoplada a espectrometría de masas de relación isotópica: una nueva perspectiva en la detección de adulteración de la miel". J Agric Food Chem . 54 (26): 9719–9727. doi :10.1021/jf062067x. PMID 17177492.
- ^ Becker M, Liebner F, Rosenau T, Potthast A (2013). "Enfoque de etoximación-sililación para el análisis de mono y disacáridos y caracterización de sus parámetros de identificación por cromatografía de gases/espectrometría de masas". Talanta . 115 : 642–51. doi :10.1016/j.talanta.2013.05.052. PMID 24054643.
- ^ Gesellschaft Deutscher Chemiker : wayback=20100331071121 Anlagen zum Positionspapier der Fachgruppe Nuklearchemie Archivado el 31 de marzo de 2010 en Wayback Machine , febrero de 2000.
- ^ Maschauer S, Prante O (2014). "Edulcoración de la radioquímica farmacéutica mediante (18)f-fluoroglicosilación: una breve revisión". BioMed Research International . 2014 : 1–16. doi : 10.1155/2014/214748 . PMC 4058687 . PMID 24991541.