Anómero
Este artículo tiene varios problemas. Ayúdenos a mejorarlo o a discutir estos problemas en la página de discusión . ( Aprenda cómo y cuándo eliminar estos mensajes )
|
En la química de los carbohidratos , un par de anómeros (del griego ἄνω 'arriba, encima' y μέρος 'parte') es un par de estereoisómeros o diastereoisómeros casi idénticos que difieren solo en el carbono anomérico , el átomo de carbono que lleva el grupo funcional aldehído o cetona en la forma de cadena abierta del azúcar . Sin embargo, para que existan anómeros, el azúcar debe estar en su forma cíclica , ya que en forma de cadena abierta, el átomo de carbono anomérico es plano y, por lo tanto, aquiral . Dicho de manera más formal, un anómero es un epímero en el átomo de carbono hemiacetal/hemicetal en un sacárido cíclico . [1] La anomerización es el proceso de conversión de un anómero en otro. Como es típico de los compuestos estereoisoméricos, diferentes anómeros tienen diferentes propiedades físicas, puntos de fusión y rotaciones específicas .
Nomenclatura
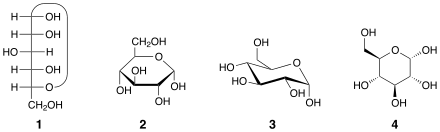
Cada dos anómeros se designan alfa (α) o beta (β), según la relación configuracional entre el centro anomérico y el átomo de referencia anomérico , por lo tanto, son estereodescriptores relativos . [2] El centro anomérico en los hemiacetales es el carbono anomérico C-1; en los hemicetales, es el carbono derivado del carbonilo de la cetona (por ejemplo, C-2 en D -fructosa). En las aldohexosas, el átomo de referencia anomérico es el estereocentro más alejado del carbono anomérico en el anillo (el átomo configuracional, que define el azúcar como D o L ). Por ejemplo, en la α- D -glucopiranosa, el átomo de referencia es C-5.
Si en la proyección cíclica de Fischer [3] el átomo de oxígeno exocíclico en el centro anomérico está en cis (en el mismo lado) con respecto al oxígeno exocíclico unido al átomo de referencia anomérico (en el grupo OH), el anómero es α. Si los dos oxígenos están en trans (en lados diferentes), el anómero es β. [4] Por lo tanto, las configuraciones absolutas del carbono anomérico y del átomo de referencia son las mismas (ambos R o ambos S ) en el anómero α y opuestas (uno R y el otro S ) en el anómero β. [5]
Anomerización
La anomerización es el proceso de conversión de un anómero en otro. En el caso de los azúcares reductores , la anomerización se denomina mutarrotación y se produce fácilmente en solución y está catalizada por un ácido y una base. Este proceso reversible suele dar lugar a una mezcla anomérica en la que, finalmente, se alcanza un equilibrio entre los dos anómeros individuales.
La proporción de los dos anómeros es específica para el azúcar en cuestión. Por ejemplo, independientemente de la configuración de la D -glucosa de partida, una solución se convertirá gradualmente en una mezcla de aproximadamente un 64% de β- D -glucopiranósido y un 36% de α- D -glucopiranósido. A medida que cambia la proporción, cambia la rotación óptica de la mezcla; este fenómeno se denomina mutarrotación .
Mecanismo de anomerización


Aunque las formas cíclicas de los azúcares suelen ser las más favorecidas, los hemiacetales en solución acuosa están en equilibrio con sus formas de cadena abierta . En las aldohexosas, este equilibrio se establece cuando el enlace hemiacetal entre C-1 (el carbono unido a dos oxígenos) y el oxígeno C-5 se escinde (formando el compuesto de cadena abierta) y se reforma (formando el compuesto cíclico). Cuando se reforma el grupo hemiacetal , el grupo OH en C-5 puede atacar a cualquiera de los dos lados estereoquímicamente distintos del grupo aldehído en C-1. El lado al que ataca determina si se forma el anómero α o β.
La anomerización de los glicósidos ocurre típicamente en condiciones ácidas. Normalmente, la anomerización ocurre mediante la protonación del oxígeno del acetal exocíclico, la ionización para formar un ion oxocarbenio con liberación de un alcohol y el ataque nucleofílico de un alcohol en la cara inversa del ion oxocarbenio, seguido de la desprotonación.
Propiedades físicas y estabilidad
Los anómeros tienen estructuras diferentes y, por lo tanto, tienen diferentes efectos estabilizadores y desestabilizadores entre sí. Los principales factores que contribuyen a la estabilidad de un determinado anómero son:
- El efecto anomérico , que estabiliza el anómero que tiene un grupo que atrae electrones (normalmente un átomo de oxígeno o nitrógeno) en orientación axial en el anillo. Este efecto desaparece en disolventes polares como el agua.
- Interacciones 1,3-diaxiales , que suelen desestabilizar el anómero que tiene el grupo anomérico en una orientación axial en el anillo. Este efecto es especialmente notorio en las piranosas y otros compuestos de anillo de seis miembros. Este es un factor importante en el agua.
- Los enlaces de hidrógeno entre el grupo anomérico y otros grupos del anillo conducen a la estabilización del anómero.
- Repulsión dipolar entre el grupo anomérico y otros grupos del anillo, lo que conduce a la desestabilización del anómero.
En el caso del D -glucopiranósido, el anómero β es el más estable en agua. En el caso de la D -manopiranosa , el anómero α es el más estable.
Debido a que los anómeros son diastereómeros entre sí, a menudo difieren en sus propiedades físicas y químicas. Una de las propiedades físicas más importantes que se utilizan para estudiar los anómeros es la rotación específica , que se puede controlar mediante polarimetría .
Véase también
Referencias
- ^ Francis Carey (2000). Química orgánica (4.ª ed.). McGraw-Hill Higher Education.
- ^ IUPAC , Compendio de terminología química , 2.ª edición (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "α (alfa), β (beta)". doi :10.1351/goldbook.A00003
- ^ "Química - Universidad Queen Mary de Londres".
- ^ Nomenclatura de carbohidratos (Recomendaciones 1996) Archivado el 27 de octubre de 2010 en Wayback Machine PDF
- ^ Varki, A.; Cummings, RD; Esko, JD; Freeze, HH; Stanley, P.; Bertozzi, CR; Hart, GW; Etzler, ME; Bertozzi, CR; Rabuka, D. (2009). "Base estructural de la diversidad de glicanos". Fundamentos de glicobiología . Prensa de laboratorio de Cold Spring Harbor. ISBN 9780879697709. Número de identificación personal 20301274.



