Concanavalina A
| Concanavalina A | |||||||
|---|---|---|---|---|---|---|---|
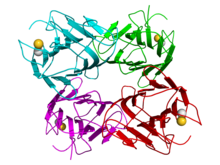 Estructura cristalográfica de un tetrámero de concanavalina A de frijol canavalina (los monómeros están coloreados en cian, verde, rojo y magenta respectivamente). Los cationes calcio (oro) y manganeso (gris) están representados como esferas. [1] | |||||||
| Identificadores | |||||||
| Organismo | |||||||
| Símbolo | ConA | ||||||
| AP | 3CNA | ||||||
| Protección unificada | P81461 | ||||||
| |||||||
La concanavalina A ( ConA ) es una lectina ( proteína de unión a carbohidratos ) extraída originalmente de la haba canavalia ( Canavalia ensiformis ). Es un miembro de la familia de las lectinas de las leguminosas . Se une específicamente a ciertas estructuras que se encuentran en varios azúcares , glicoproteínas y glicolípidos , principalmente grupos α-D- manosilo y α-D-glucosilo terminales internos y no reductores . [2] [3] Sin embargo, su función fisiológica en las plantas aún se desconoce. La ConA es un mitógeno vegetal y es conocida por su capacidad para estimular subconjuntos de células T de ratón dando lugar a cuatro poblaciones de células T funcionalmente distintas, incluidos los precursores de las células T reguladoras ; [4] un subconjunto de células T supresoras humanas también es sensible a la ConA. [4] La ConA fue la primera lectina disponible en forma comercial y se usa ampliamente en biología y bioquímica para caracterizar las glicoproteínas y otras entidades que contienen azúcar en la superficie de varias células. [5] También se utiliza para purificar macromoléculas glicosiladas en cromatografía de afinidad de lectina , [6] así como para estudiar la regulación inmune por varias células inmunes. [4]
Estructura y propiedades
Como la mayoría de las lectinas, la ConA es un homotetrámero : cada subunidad (26,5 kDa , 235 aminoácidos , muy glicosilada) se une a un átomo metálico (normalmente Mn 2+ y un Ca 2+ ). Tiene simetría D 2 . [1] Su estructura terciaria ha sido dilucidada, [7] al igual que la base molecular de sus interacciones con metales, así como su afinidad por los azúcares manosa y glucosa [8] .
La ConA se une específicamente a los residuos α-D-manosilo y α-D-glucosilo (dos hexosas que difieren solo en el alcohol del carbono 2) en la posición terminal de las estructuras ramificadas de los B-glucanos (ricos en α-manosa, o complejos de glucanos híbridos y bi-antenarios). Tiene 4 sitios de unión, correspondientes a las 4 subunidades. [3] El peso molecular es de 104–112 kDa y el punto isoeléctrico (pI) está en el rango de 4,5–5,5.
La ConA también puede iniciar la división celular (mitogénesis), actuando principalmente sobre los linfocitos T, estimulando su metabolismo energético en cuestión de segundos tras la exposición. [9]
Proceso de maduración
ConA y sus variantes (que se encuentran en plantas estrechamente relacionadas) son las únicas proteínas conocidas que experimentan una disposición de secuencia postraduccional conocida como permutación circular en proteínas , por la cual la mitad N-terminal del precursor de conA se intercambia para convertirse en la mitad C-terminal en la forma madura; todas las demás permutaciones circulares conocidas ocurren a nivel genético. [10] [11] La permutación circular de ConA es realizada por la asparaginil endopeptidasa de la haba canavalia, [12] una enzima versátil capaz de escindir y ligar sustratos peptídicos en un único sitio activo. [13] Para convertir conA a la forma madura, la asparaginil endopeptidasa de la haba canavalia escinde el precursor de conA en el medio y liga los dos extremos originales.
Actividad biológica
La concanavalina A interactúa con diversos receptores que contienen carbohidratos de manosa, en particular la rodopsina, los marcadores de grupos sanguíneos , los receptores de insulina, [14] las inmunoglobulinas y el antígeno carcinoembrionario (CEA). También interactúa con lipoproteínas . [15]
ConA aglutina fuertemente los eritrocitos independientemente del grupo sanguíneo y varias células cancerosas. [16] [17] [18] Se demostró que las células transformadas y las células normales tratadas con tripsina no se aglutinan a 4 °C, lo que sugiere que hay un paso sensible a la temperatura involucrado en la aglutinación mediada por ConA. [19] [20]
Se ha informado de la aglutinación mediada por ConA de otros tipos de células, incluidas las células musculares , [21] linfocitos B (a través de inmunoglobulinas de superficie ), [22] fibroblastos , [23] timocitos de rata , [24] células epiteliales intestinales fetales humanas (pero no adultas) , [25] y adipocitos . [26]
La ConA es un mitógeno de linfocitos . De manera similar a la fitohemaglutinina (PHA), es un mitógeno selectivo de células T en relación con sus efectos sobre las células B. La PHA y la ConA se unen y reticulan componentes del receptor de células T , y su capacidad para activar las células T depende de la expresión del receptor de células T. [27] [28]
ConA interactúa con los residuos de manosa de la superficie de muchos microbios, incluidas las bacterias E. coli [ 29] y Bacillus subtilis [30] y el protista Dictyostelium discoideum [31] .
También se ha demostrado que es un estimulador de varias metaloproteinasas de matriz (MMP). [32]
La ConA ha demostrado ser útil en aplicaciones que requieren la inmovilización en fase sólida de glicoenzimas, especialmente aquellas que han demostrado ser difíciles de inmovilizar mediante el acoplamiento covalente tradicional. Utilizando matrices acopladas a ConA, dichas enzimas pueden inmovilizarse en grandes cantidades sin una pérdida concurrente de actividad o estabilidad. Dichos acoplamientos no covalentes de ConA a glicoenzima pueden revertirse con relativa facilidad mediante la competencia con azúcares o a pH ácido. Si es necesario para ciertas aplicaciones, estos acoplamientos pueden convertirse en enlaces covalentes mediante manipulación química. [33]
Un informe de Taiwán (2009) demostró un potente efecto terapéutico de la ConA contra el hepatoma experimental (cáncer de hígado); en el estudio de Lei y Chang, [34] se descubrió que la ConA era secuestrada más por las células tumorales hepáticas, en preferencia a los hepatocitos normales circundantes. La internalización de la ConA ocurre preferentemente en las mitocondrias después de unirse a las glicoproteínas de la membrana celular, lo que desencadena una muerte celular autofágica. Se descubrió que la ConA inhibe parcialmente el crecimiento de nódulos tumorales independientemente de su activación linfocítica; la erradicación del tumor en el modelo murino de hepatoma in situ en este estudio se atribuyó adicionalmente a la acción mitogénica/linfoproliferativa de la ConA que puede haber activado una respuesta inmunitaria mediada por células T CD8+, así como por células NK y T NK en el hígado. [34]
La inyección intravítrea de ConA se puede utilizar en el modelado de la vitreorretinopatía proliferativa en ratas. [35] [36]
Referencias
- ^ ab PDB : 3CNA ; Hardman KD, Ainsworth CF (diciembre de 1972). "Estructura de la concanavalina A con una resolución de 2,4 A". Bioquímica . 11 (26): 4910–4919. doi :10.1021/bi00776a006. PMID 4638345.
- ^ Goldstein, Irwin J.; Poretz, Ronald D. (2012). "Aislamiento, caracterización fisicoquímica y especificidad de unión a carbohidratos de las lectinas". En Liener, Irvin E.; Sharon, Nathan; Goldstein, Irwin J. (eds.). Propiedades, funciones y aplicaciones de las lectinas en biología y medicina . Elsevier. págs. 33–247. ISBN 978-0-323-14444-5.
- ^ ab Sumner JB, Gralën N, Eriksson-Quensel IB (abril de 1938). "Los pesos moleculares de la ureasa, canavalina, concanavalina a y concanavalina B". Science . 87 (2261): 395–396. Bibcode :1938Sci....87..395S. doi :10.1126/science.87.2261.395. PMID 17746464.
- ^ abc Dwyer JM , Johnson C (noviembre de 1981). "El uso de concanavalina A para estudiar la inmunorregulación de las células T humanas". Inmunología clínica y experimental . 46 (2): 237–249. PMC 1536405 . PMID 6461456.
- ^ Schiefer HG, Krauss H, Brunner H, Gerhardt U (diciembre de 1975). "Visualización ultraestructural de las estructuras superficiales de carbohidratos en las membranas de micoplasma mediante concanavalina A". Journal of Bacteriology . 124 (3): 1598–1600. doi :10.1128/JB.124.3.1598-1600.1975. PMC 236075 . PMID 1104592.
- ^ GE Healthcare Life Sciences, Lectina inmovilizada Archivado el 3 de marzo de 2012 en Wayback Machine [ cita completa necesaria ]
- ^ Min W, Dunn AJ, Jones DH (abril de 1992). "La pro-concanavalina A recombinante no glicosilada es activa sin escisión de polipéptidos". The EMBO Journal . 11 (4): 1303–1307. doi :10.1002/j.1460-2075.1992.tb05174.x. PMC 556578 . PMID 1563347.
- ^ Loris R, Hamelryck T, Bouckaert J, Wyns L (marzo de 1998). "Estructura de las lectinas de leguminosas". Biochimica et Biophysica Acta (BBA) - Estructura de proteínas y enzimología molecular . 1383 (1): 9–36. doi :10.1016/S0167-4838(97)00182-9. PID 9546043.
- ^ Krauss S, Buttgereit F, Brand MD (junio de 1999). "Efectos del mitógeno concanavalina A en las vías del metabolismo energético de los timocitos". Biochimica et Biophysica Acta (BBA) - Bioenergetics . 1412 (2): 129–138. doi : 10.1016/S0005-2728(99)00058-4 . PMID 10393256.
- ^ Carrington DM, Auffret A, Hanke DE (1985). "La ligación de polipéptidos ocurre durante la modificación postraduccional de la concanavalina A". Nature . 313 (5997): 64–67. Bibcode :1985Natur.313...64C. doi :10.1038/313064a0. PMID 3965973. S2CID 4359482.
- ^ Hendrix RW (abril de 1991). "Carpintería proteica". Current Biology . 1 (2): 71–73. doi :10.1016/0960-9822(91)90280-a. PMID 15336168. S2CID 45963307.
- ^ Nonis SG, Haywood J, Schmidberger JW, Mackie ER, Soares da Costa TP, Bond CS, Mylne JS (agosto de 2021). "Análisis estructurales y bioquímicos de la permutación circular de concanavalina A por la asparaginil endopeptidasa de frijol canavalina". The Plant Cell . 33 (8): 2794–2811. doi :10.1093/plcell/koab130. PMC 8408470 . PMID 34235541.
- ^ Nonis SG, Haywood J, Mylne JS (abril de 2021). "Endopeptidasas de asparaginilo de plantas y sus determinantes estructurales de función". Biochemical Society Transactions . 49 (2): 965–976. doi :10.1042/BST20200908. PMC 8106488 . PMID 33666219.
- ^ Cuatrecasas P, Tell GP (febrero de 1973). "Actividad similar a la insulina de la concanavalina A y la aglutinina de germen de trigo: interacciones directas con los receptores de insulina". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 70 (2): 485–489. Bibcode :1973PNAS...70..485C. doi : 10.1073/pnas.70.2.485 . JSTOR 62526. PMC 433288 . PMID 4510292.
- ^ Harmony JA, Cordes EH (noviembre de 1975). "Interacción de la lipoproteína de baja densidad del plasma humano con concanavalina A y con ricina". The Journal of Biological Chemistry . 250 (22): 8614–8617. doi : 10.1016/S0021-9258(19)40714-X . PMID 171260.[ enlace muerto permanente ]
- ^ Betton GR (noviembre de 1976). "Reacciones de aglutinación de células tumorales caninas espontáneas, inducidas por concanavalina A, demostradas mediante un ensayo isotópico". Revista internacional del cáncer . 18 (5): 687–696. doi :10.1002/ijc.2910180518. PMID 992901. S2CID 36612952.
- ^ Kakizoe T, Komatsu H, Niijima T, Kawachi T, Sugimura T (junio de 1980). "Aumento de la aglutinabilidad de las células de la vejiga por concanavalina A después de la administración de carcinógenos". Cancer Research . 40 (6): 2006–2009. PMID 7371036.
- ^ Becker FF, Shurgin A (octubre de 1975). "Aglutinación de células de carcinomas hepatocelulares primarios y nódulos hepáticos con concanavalina A inducida por N-2-fluorenilacetamida". Cancer Research . 35 (10): 2879–2883. PMID 168971.
- ^ Inbar M, Ben-Bassat H, Sachs L (noviembre de 1971). "Una actividad metabólica específica en la membrana superficial en la transformación de células malignas". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 68 (11): 2748–2751. Bibcode :1971PNAS...68.2748I. doi : 10.1073/pnas.68.11.2748 . JSTOR 61219. PMC 389516 . PMID 4330939.
- ^ Sela BA, Lis H, Sharon N, Sachs L (diciembre de 1971). "Cuantificación de sitios similares a N-acetil-D-galactosamina en la membrana superficial de células de mamíferos normales y transformadas". Biochimica et Biophysica Acta (BBA) - Biomembranas . 249 (2): 564–568. doi :10.1016/0005-2736(71)90132-5. PMID 4332414.
- ^ Gartner TK, Podleski TR (diciembre de 1975). "Evidencia de que una lectina unida a la membrana media la fusión de mioblastos L6". Biochemical and Biophysical Research Communications . 67 (3): 972–978. doi :10.1016/0006-291X(75)90770-6. PMID 1201086.
- ^ de Petris S (abril de 1975). "Receptores de concanavalina A, inmunoglobulinas y antígeno theta de la superficie de los linfocitos. Interacciones con concanavalina A y con estructuras citoplasmáticas". The Journal of Cell Biology . 65 (1): 123–146. doi :10.1083/jcb.65.1.123. PMC 2111157 . PMID 1092699.
- ^ Noonan KD, Burger MM (octubre de 1973). "La relación entre la unión de la concanavalina A y la aglutinación celular iniciada por lectina". The Journal of Cell Biology . 59 (1): 134–142. doi :10.1083/jcb.59.1.134. PMC 2110924 . PMID 4201706.
- ^ Capo C, Garrouste F, Benoliel AM, Bongrand P, Ryter A, Bell GI (agosto de 1982). "Aglutinación de timocitos mediada por concanavalina-A: un modelo para un estudio cuantitativo de la adhesión celular". Journal of Cell Science . 56 : 21–48. doi :10.1242/jcs.56.1.21. PMID 7166565.
- ^ Weiser MM (agosto de 1972). "Aglutinación de células intestinales del feto humano con concanavalina A". Science . 177 (4048): 525–526. Bibcode :1972Sci...177..525W. doi :10.1126/science.177.4048.525. PMID 5050484. S2CID 23661797.
- ^ Cuatrecasas P (marzo de 1973). "Interacción de la aglutinina de germen de trigo y la concanavalina A con células grasas aisladas". Bioquímica . 12 (7): 1312–1323. doi :10.1021/bi00731a011. PMID 4696755.
- ^ Weiss A, Shields R, Newton M, Manger B, Imboden J (abril de 1987). "Interacciones ligando-receptor necesarias para el compromiso con la activación del gen de la interleucina 2". Journal of Immunology . 138 (7): 2169–2176. doi : 10.4049/jimmunol.138.7.2169 . PMID 3104454. S2CID 35173412.
- ^ Kanellopoulos JM, De Petris S, Leca G, Crumpton MJ (mayo de 1985). "La lectina mitogénica de Phaseolus vulgaris no reconoce el antígeno T3 de los linfocitos T humanos". Revista Europea de Inmunología . 15 (5): 479–486. doi :10.1002/eji.1830150512. PMID 3873340. S2CID 21414006.
- ^ Ofek I, Mirelman D, Sharon N (febrero de 1977). "Adherencia de Escherichia coli a células mucosas humanas mediada por receptores de manosa". Nature . 265 (5595): 623–625. Bibcode :1977Natur.265..623O. doi :10.1038/265623a0. PMID 323718. S2CID 4223466.
- ^ Doyle RJ, Birdsell DC (febrero de 1972). "Interacción de la concanavalina A con la pared celular de Bacillus subtilis". Journal of Bacteriology . 109 (2): 652–658. doi :10.1128/JB.109.2.652-658.1972. PMC 285189 . PMID 4621684.
- ^ West CM, McMahon D (julio de 1977). "Identificación de receptores de concanavalina A y proteínas de unión a galactosa en membranas plasmáticas purificadas de Dictyostelium discoideum". The Journal of Cell Biology . 74 (1): 264–273. doi :10.1083/jcb.74.1.264. PMC 2109878 . PMID 559679.
- ^ Yu M, Sato H, Seiki M, Thompson EW (agosto de 1995). "Regulación compleja de la expresión de la metaloproteinasa de matriz de tipo membrana y la activación de la metaloproteinasa de matriz-2 por concanavalina A en células de cáncer de mama humano MDA-MB-231". Cancer Research . 55 (15): 3272–3277. PMID 7614461.
- ^ Saleemuddin M, Husain Q (abril de 1991). "Concanavalina A: un ligando útil para la inmovilización de glicoenzimas: una revisión". Tecnología enzimática y microbiana . 13 (4): 290–295. doi :10.1016/0141-0229(91)90146-2. PMID 1367163.
- ^ ab Lei HY, Chang CP (enero de 2009). "Lectina de concanavalina A como agente terapéutico antihepatoma". Revista de Ciencias Biomédicas . 16 (1): 10. doi : 10.1186/1423-0127-16-10 . PMC 2644972 . PMID 19272170.
- ^ Erdiakov AK, Tikhonovich MV, Rzhavina EM, Gavrilova SA (mayo de 2015). "[Las características de la retina en el desarrollo de vitreorretinopatía proliferativa en ratas después de la inyección intraocular de concanavalina a y dispasa]". Rossiĭskii Fiziologicheskiĭ Zhurnal Imeni IM Sechenova . 101 (5): 572–585. PMID 26263683.
- ^ Tikhonovich MV, Erdiakov AK, Gavrilova SA (agosto de 2018). "La terapia antiinflamatoria no esteroide suprime el desarrollo de la vitreorretinopatía proliferativa de manera más efectiva que una terapia con esteroides". Oftalmología internacional . 38 (4): 1365–1378. doi :10.1007/s10792-017-0594-3. PMID 28639085. S2CID 4017540.
Enlaces externos
- Concanavalina+A en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Receptores de concanavalina+A+ en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Estructura de la concanavalina A Archivado el 20 de agosto de 2008 en Wayback Machine.
- El mundo de las lectinas, puerta de entrada a las lectinas
- Proteopedia 1bxh con A en complejo con metil alfa1-2 manobiósido
