Selenio
El selenio es un elemento químico , cuyo símbolo es Se y cuyo número atómico es 34. Tiene diversas apariencias físicas, entre ellas un polvo rojo ladrillo, un sólido negro vítreo y una forma gris de aspecto metálico. Rara vez se encuentra en este estado elemental o como compuestos minerales puros en la corteza terrestre . El selenio (del griego antiguo σελήνη ( selḗnē ) 'luna') fue descubierto en 1817 por Jöns Jacob Berzelius , quien notó la similitud del nuevo elemento con el telurio (llamado así por la Tierra) descubierto anteriormente.
El selenio se encuentra en los minerales de sulfuro de metal , donde sustituye al azufre. Comercialmente, el selenio se produce como subproducto en el refinado de estos minerales. Los minerales que son compuestos de seleniuro o selenato puros son raros. Los principales usos comerciales del selenio en la actualidad son la fabricación de vidrio y los pigmentos . El selenio es un semiconductor y se utiliza en fotocélulas . Las aplicaciones en electrónica , que alguna vez fueron importantes, han sido reemplazadas en su mayoría por dispositivos semiconductores de silicio . El selenio todavía se utiliza en algunos tipos de protectores contra sobretensiones de CC y en un tipo de punto cuántico fluorescente .
Aunque las cantidades mínimas de selenio son necesarias para la función celular en muchos animales, incluidos los humanos, tanto el selenio elemental como (especialmente) las sales de selenio son tóxicas incluso en pequeñas dosis, causando selenosis. [9] El selenio figura como ingrediente en muchos multivitamínicos y otros suplementos dietéticos, así como en fórmulas infantiles , y es un componente de las enzimas antioxidantes glutatión peroxidasa y tiorredoxina reductasa (que reducen indirectamente ciertas moléculas oxidadas en animales y algunas plantas), así como en tres enzimas desyodasas . Los requerimientos de selenio en las plantas difieren según la especie, ya que algunas plantas requieren cantidades relativamente grandes y otras aparentemente no requieren ninguna. [10]
Características
Propiedades físicas

El selenio forma varios alótropos que se interconvierten con los cambios de temperatura , dependiendo en cierta medida de la velocidad de cambio de temperatura. Cuando se prepara en reacciones químicas, el selenio suele ser un polvo amorfo de color rojo ladrillo. Cuando se funde rápidamente, forma la forma vítrea negra, que suele venderse comercialmente en forma de perlas. [11] La estructura del selenio negro es irregular y compleja y consta de anillos poliméricos con hasta 1000 átomos por anillo. El selenio negro es un sólido frágil y brillante que es ligeramente soluble en CS 2 . Al calentarlo, se ablanda a 50 °C y se convierte en selenio gris a 180 °C; la temperatura de transformación se reduce por la presencia de halógenos y aminas . [12]
Las formas rojas α, β y γ se producen a partir de soluciones de selenio negro al variar la tasa de evaporación del solvente (generalmente CS 2 ). Todas tienen una simetría cristalina monoclínica relativamente baja ( grupo espacial 14) y contienen anillos de ciclooctaselenio (Se 8 ) fruncidos casi idénticos como en el azufre . [13] Los ocho átomos de un anillo no son equivalentes (es decir, no están mapeados uno sobre otro por ninguna operación de simetría), y de hecho en la forma γ-monoclínica, la mitad de los anillos están en una configuración (y su imagen especular) y la otra mitad en otra. [14] [15] El empaquetamiento es más denso en la forma α. En los anillos de Se 8 , la distancia Se–Se varía dependiendo de dónde esté el par de átomos en el anillo, pero el promedio es de 233,5 pm, y el ángulo Se–Se–Se es en promedio de 105,7°. Otros alótropos de selenio pueden contener anillos Se 6 o Se 7. [12]
La forma más estable y densa del selenio es el gris y tiene una red cristalina hexagonal quiral (grupo espacial 152 o 154 dependiendo de la quiralidad) [16] que consiste en cadenas poliméricas helicoidales, donde la distancia Se-Se es de 237,3 pm y el ángulo Se-Se-Se es de 103,1°. La distancia mínima entre cadenas es de 343,6 pm. El selenio gris se forma por calentamiento suave de otros alótropos, por enfriamiento lento del selenio fundido o por condensación de vapor de selenio justo por debajo del punto de fusión. Mientras que otras formas de selenio son aislantes , el selenio gris es un semiconductor que muestra una fotoconductividad apreciable . A diferencia de los otros alótropos, es insoluble en CS 2 . [12] Resiste la oxidación por aire y no es atacado por ácidos no oxidantes . Con agentes reductores fuertes, forma poliseleniuros. El selenio no exhibe los cambios de viscosidad que sufre el azufre cuando se calienta gradualmente. [11] [17]
Isótopos
El selenio tiene siete isótopos naturales . Cinco de ellos, 74Se , 76Se , 77Se , 78Se , 80Se , son estables, siendo 80Se el más abundante (49,6% de abundancia natural). También se encuentra de forma natural el radionúclido primordial de larga vida 82Se , con una vida media de 8,76×10 19 años. [8] El radioisótopo no primordial 79Se también se encuentra en cantidades minúsculas en los minerales de uranio como producto de la fisión nuclear . El selenio también tiene numerosos isótopos sintéticos inestables que van desde 64Se a 95Se ; los más estables son 75Se con una vida media de 119,78 días y 72Se con una vida media de 8,4 días. [18] Los isótopos más ligeros que los isótopos estables sufren principalmente una desintegración beta positiva a isótopos de arsénico , y los isótopos más pesados que los isótopos estables sufren una desintegración beta negativa a isótopos de bromo , con algunas ramas menores de emisión de neutrones en los isótopos más pesados conocidos.
| Isótopo | Naturaleza | Origen | Vida media |
|---|---|---|---|
| 74 sí | Primordial | Estable | |
| 76 Sí | Primordial | Estable | |
| 77 Sí | Primordial | Producto de fisión | Estable |
| 78 Sí | Primordial | Producto de fisión | Estable |
| 79 Sí | Rastro | Producto de fisión | 327 000 años [19] [20] |
| 80 sí | Primordial | Producto de fisión | Estable |
| 82 Sí | Primordial | Producto de fisión* | 8,76 × 1019 años [8] [a] |
Compuestos químicos
Los compuestos de selenio existen comúnmente en los estados de oxidación −2, +2, +4 y +6. Es un no metal (menos frecuentemente considerado un metaloide ) con propiedades intermedias entre los elementos anteriores y posteriores en la tabla periódica , el azufre y el telurio , y también tiene similitudes con el arsénico . [12]
Compuestos de calcógeno

El selenio forma dos óxidos : dióxido de selenio (SeO 2 ) y trióxido de selenio (SeO 3 ). El dióxido de selenio se forma por combustión del selenio elemental: [11]
Es un sólido polimérico que forma moléculas monoméricas de SeO2 en fase gaseosa. Se disuelve en agua para formar ácido selenoso , H2SeO3 . El ácido selenoso también se puede producir directamente oxidando el selenio elemental con ácido nítrico : [ 21]
A diferencia del azufre, que forma un trióxido estable , el trióxido de selenio es termodinámicamente inestable y se descompone en dióxido por encima de los 185 °C: [11] [21]
El trióxido de selenio se produce en el laboratorio mediante la reacción de selenato de potasio anhidro (K 2 SeO 4 ) y trióxido de azufre (SO 3 ). [22]
Las sales del ácido selenoso se denominan selenitos. Entre ellas se encuentran el selenito de plata ( Ag2SeO3 ) y el selenito de sodio ( Na2SeO3 ).
El sulfuro de hidrógeno reacciona con ácido selenoso acuoso para producir disulfuro de selenio :
El disulfuro de selenio consta de anillos de 8 miembros. Tiene una composición aproximada de SeS 2 , con anillos individuales que varían en composición, como Se 4 S 4 y Se 2 S 6 . El disulfuro de selenio se ha utilizado en champús como agente anticaspa , como inhibidor en la química de polímeros, como tinte para vidrio y como agente reductor en fuegos artificiales . [21]
El trióxido de selenio se puede sintetizar deshidratando el ácido selénico , H 2 SeO 4 , que a su vez se produce por la oxidación del dióxido de selenio con peróxido de hidrógeno : [23]
El ácido selenico concentrado y caliente reacciona con el oro para formar selenato de oro (III). [24]
Compuestos halógenos
El selenio reacciona con el flúor para formar hexafluoruro de selenio :
En comparación con su contraparte de azufre ( hexafluoruro de azufre ), el hexafluoruro de selenio (SeF 6 ) es más reactivo y es un irritante pulmonar tóxico . [25] El tetrafluoruro de selenio es un agente fluorante a escala de laboratorio .
Los únicos cloruros estables son el tetracloruro de selenio (SeCl 4 ) y el monocloruro de selenio (Se 2 Cl 2 ), que podría ser mejor conocido como cloruro de selenio (I) y es estructuralmente análogo al dicloruro de disulfuro . Las soluciones metaestables de dicloruro de selenio se pueden preparar a partir de cloruro de sulfurilo y selenio (la reacción de los elementos genera el tetracloruro en su lugar), y constituyen un reactivo importante en la preparación de compuestos de selenio (por ejemplo, Se 7 ). Los bromuros correspondientes son todos conocidos y recapitulan la misma estabilidad y estructura que los cloruros. [26]
Los yoduros de selenio no son muy conocidos y durante mucho tiempo se creyó que no existían. [27] Hay evidencia espectroscópica limitada de que los yoduros inferiores pueden formarse en soluciones bielementales con solventes no polares, como disulfuro de carbono [28] y tetracloruro de carbono ; [27] pero incluso estos parecen descomponerse bajo iluminación . [29]
Algunos oxihaluros de selenio ( fluoruro de selenilo [SeOF 2 ] y oxicloruro de selenio [SeOCl 2 ]) se han utilizado como disolventes especiales. [11]
Seleniuros metálicos
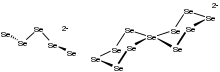
De manera análoga al comportamiento de otros calcógenos, el selenio forma seleniuro de hidrógeno , H 2 Se. Es un gas fuertemente oloroso, tóxico e incoloro. Es más ácido que el H 2 S. En solución se ioniza a HSe − . El dianión seleniuro Se 2− forma una variedad de compuestos, incluidos los minerales de los que se obtiene comercialmente el seleniuro. Los seleniuros ilustrativos incluyen seleniuro de mercurio (HgSe), seleniuro de plomo (PbSe), seleniuro de zinc (ZnSe) y diseleniuro de cobre, indio y galio (Cu(Ga,In)Se 2 ). Estos materiales son semiconductores . Con metales altamente electropositivos, como el aluminio , estos seleniuros son propensos a la hidrólisis, que puede describirse mediante esta ecuación idealizada: [11]
Los seleniuros de metales alcalinos reaccionan con el selenio para formar poliseleniuros, Se2−
n, que existen como cadenas y anillos.
Otros compuestos
El tetranitruro de tetraselenio, Se 4 N 4 , es un compuesto naranja explosivo análogo al tetranitruro de tetraazufre (S 4 N 4 ). [11] [31] [32] Se puede sintetizar mediante la reacción del tetracloruro de selenio (SeCl 4 ) con [((CH
3)
3Si)
2NORTE]
2Véase [33 ]
El selenio reacciona con cianuros para producir selenocianatos : [11]
Compuestos de organoselenio
El selenio, especialmente en el estado de oxidación II, forma una variedad de derivados orgánicos. Son estructuralmente análogos a los compuestos organosulfurados correspondientes . Especialmente comunes son los seleniuros (R 2 Se, análogos de los tioéteres ), los diseleniuros (R 2 Se 2 , análogos de los disulfuros ) y los selenoles (RSeH, análogos de los tioles ). Los representantes de seleniuros, diseleniuros y selenoles incluyen respectivamente selenometionina , difenildiseleniuro y bencenoselenol . El sulfóxido en la química del azufre está representado en la química del selenio por los selenóxidos (fórmula RSe(O)R), que son intermediarios en la síntesis orgánica, como lo ilustra la reacción de eliminación del selenóxido . De acuerdo con las tendencias indicadas por la regla del doble enlace , las selenacetonas, R(C=Se)R, y los selenaldehídos, R(C=Se)H, rara vez se observan. [34]
Historia

El selenio ( del griego σελήνη selene , que significa «luna») fue descubierto en 1817 por Jöns Jacob Berzelius y Johan Gottlieb Gahn . [35] Ambos químicos poseían una planta química cerca de Gripsholm , Suecia, que producía ácido sulfúrico mediante el proceso de cámara de plomo . Las muestras de pirita de la mina Falun produjeron un precipitado sólido rojo en las cámaras de plomo, que se supuso que era un compuesto de arsénico, por lo que se interrumpió el uso de pirita para producir ácido. Berzelius y Gahn, que querían utilizar la pirita, observaron que el precipitado rojo desprendía un olor parecido al del rábano picante cuando se quemaba. Este olor no era típico del arsénico, pero se conocía un olor similar de los compuestos de telurio . Por lo tanto, la primera carta de Berzelius a Alexander Marcet afirmaba que se trataba de un compuesto de telurio. Sin embargo, la falta de compuestos de telurio en los minerales de la mina Falun finalmente llevó a Berzelius a volver a analizar el precipitado rojo, y en 1818 escribió una segunda carta a Marcet describiendo un elemento recién descubierto similar al azufre y al telurio. Debido a su similitud con el telurio, llamado así por la Tierra, Berzelius nombró al nuevo elemento en honor a la Luna . [36] [37]
En 1873, Willoughby Smith descubrió que la conductividad eléctrica del selenio gris se veía afectada por la luz. [38] [39] Esto condujo a su uso como célula para detectar la luz. Los primeros productos comerciales que utilizaban selenio fueron desarrollados por Werner Siemens a mediados de la década de 1870. La célula de selenio se utilizó en el fotófono desarrollado por Alexander Graham Bell en 1879. El selenio transmite una corriente eléctrica proporcional a la cantidad de luz que incide sobre su superficie. Este fenómeno se utilizó en el diseño de fotómetros y dispositivos similares. Las propiedades semiconductoras del selenio encontraron numerosas otras aplicaciones en electrónica. [40] [41] [42] El desarrollo de rectificadores de selenio comenzó a principios de la década de 1930, y estos reemplazaron a los rectificadores de óxido de cobre porque eran más eficientes. [43] [44] [45] Estos duraron en aplicaciones comerciales hasta la década de 1970, después de lo cual fueron reemplazados por rectificadores de silicio menos costosos e incluso más eficientes .
El selenio se hizo conocido en el ámbito médico más tarde debido a su toxicidad para los trabajadores industriales. También se reconoció al selenio como una toxina veterinaria importante, que se observa en animales que han comido plantas con alto contenido de selenio. En 1954, la bioquímica Jane Pinsent descubrió los primeros indicios de funciones biológicas específicas del selenio en microorganismos . [46] [47] Se descubrió que era esencial para la vida de los mamíferos en 1957. [48] [49] En la década de 1970, se demostró que estaba presente en dos conjuntos independientes de enzimas . A esto le siguió el descubrimiento de la selenocisteína en las proteínas. Durante la década de 1980, se demostró que la selenocisteína estaba codificada por el codón UGA . El mecanismo de recodificación se desarrolló primero en bacterias y luego en mamíferos (véase el elemento SECIS ). [50]
Aparición

El selenio nativo (es decir, elemental) es un mineral raro, que no suele formar buenos cristales, pero, cuando lo hace, son romboedros empinados o pequeños cristales aciculares (similares a cabellos). [51] El aislamiento del selenio a menudo se complica por la presencia de otros compuestos y elementos.
El selenio se encuentra de forma natural en diversas formas inorgánicas, entre ellas el seleniuro , el selenato y el selenito , pero estos minerales son raros. El mineral común selenito no es un mineral de selenio y no contiene iones de selenito , sino que es un tipo de yeso (hidrato de sulfato de calcio) que recibió el nombre de selenio por la luna mucho antes del descubrimiento del selenio. El selenio se encuentra más comúnmente como impureza, reemplazando una pequeña parte del azufre en los minerales de sulfuro de muchos metales. [52] [53]
En los sistemas vivos, el selenio se encuentra en los aminoácidos selenometionina , selenocisteína y metilselenocisteína . En estos compuestos, el selenio desempeña un papel análogo al del azufre. Otro compuesto orgánico de selenio que se encuentra en la naturaleza es el seleniuro de dimetilo . [54] [55]
Algunos suelos son ricos en selenio y algunas plantas pueden bioconcentrarlo . En los suelos, el selenio se presenta con mayor frecuencia en formas solubles, como el selenato (análogo al sulfato), que se filtra a los ríos muy fácilmente por la escorrentía. [52] [53] El agua del océano contiene cantidades significativas de selenio. [56] [57]
Las concentraciones típicas de fondo de selenio no superan 1 ng/m3 en la atmósfera, 1 mg/kg en el suelo y la vegetación y 0,5 μg/L en agua dulce y salada. [58]
Las fuentes antropogénicas de selenio incluyen la quema de carbón y la minería y fundición de minerales de sulfuro. [59]
Producción
El selenio se produce más comúnmente a partir del seleniuro en muchos minerales de sulfuro , como los de cobre , níquel o plomo . La refinación electrolítica de metales es particularmente productiva en selenio como subproducto, obtenido del lodo anódico de las refinerías de cobre. Otra fuente fue el lodo de las cámaras de plomo de las plantas de ácido sulfúrico , un proceso que ya no se utiliza. El selenio se puede refinar a partir de estos lodos mediante varios métodos. Sin embargo, la mayor parte del selenio elemental proviene como subproducto de la refinación de cobre o de la producción de ácido sulfúrico . [60] [61] Desde su invención, la extracción por solventes y la electroobtención (SX/EW) de cobre produce una parte cada vez mayor del suministro mundial de cobre. [62] Esto cambia la disponibilidad de selenio porque solo una parte comparativamente pequeña del selenio en el mineral se lixivia con el cobre. [63]
La producción industrial de selenio generalmente implica la extracción de dióxido de selenio de los residuos obtenidos durante la purificación del cobre. La producción habitual a partir del residuo comienza entonces por oxidación con carbonato de sodio para producir dióxido de selenio, que se mezcla con agua y se acidifica para formar ácido selenoso ( paso de oxidación ). El ácido selenoso se burbujea con dióxido de azufre ( paso de reducción ) para dar selenio elemental. [64] [65]
En 2011 se produjeron alrededor de 2.000 toneladas de selenio en todo el mundo, principalmente en Alemania (650 t), Japón (630 t), Bélgica (200 t) y Rusia (140 t), y las reservas totales se estimaron en 93.000 toneladas. Estos datos excluyen a dos grandes productores: Estados Unidos y China. Un aumento brusco anterior se observó en 2004, de 4-5 dólares a 27 dólares la libra. El precio se mantuvo relativamente estable durante 2004-2010 en alrededor de 30 dólares la libra (en lotes de 100 libras), pero aumentó a 65 dólares la libra en 2011. El consumo en 2010 se dividió de la siguiente manera: metalurgia - 30%, fabricación de vidrio - 30%, agricultura - 10%, productos químicos y pigmentos - 10%, y electrónica - 10%. China es el principal consumidor de selenio con 1.500-2.000 toneladas/año. [66]
Aplicaciones
Electrólisis de manganeso
Durante la electroobtención de manganeso, la adición de dióxido de selenio disminuye la potencia necesaria para el funcionamiento de las celdas de electrólisis . China es el mayor consumidor de dióxido de selenio para este fin. Por cada tonelada de manganeso, se utilizan en promedio 2 kg de óxido de selenio. [66] [67]
Producción de vidrio
El mayor uso comercial del selenio, que representa aproximadamente el 50% del consumo, es para la producción de vidrio. Los compuestos de selenio confieren un color rojo al vidrio. Este color anula los tintes verdes o amarillos que surgen de las impurezas de hierro típicas de la mayoría de los vidrios. Para este propósito, se agregan varias sales de selenito y selenato. Para otras aplicaciones, puede ser deseable un color rojo, producido por mezclas de CdSe y CdS. [68]
Aleaciones
El selenio se utiliza con bismuto en los latones para sustituir al plomo, que es más tóxico . La regulación del plomo en aplicaciones de agua potable, como en los EE. UU. con la Ley de Agua Potable Segura de 1974, hizo necesaria una reducción del plomo en el latón. El nuevo latón se comercializa con el nombre de EnviroBrass. [69] Al igual que el plomo y el azufre, el selenio mejora la maquinabilidad del acero en concentraciones de alrededor del 0,15 %. [70] [71] El selenio produce la misma mejora de la maquinabilidad en aleaciones de cobre. [72]
Baterías de litio y selenio
La batería de litio-selenio (Li-Se) se consideró para el almacenamiento de energía en la familia de baterías de litio en la década de 2010. [73]
Células solares
El selenio se utilizó como capa fotoabsorbente en la primera célula solar de estado sólido, lo que fue demostrado por el físico inglés William Grylls Adams y su estudiante Richard Evans Day en 1876. [74] Solo unos pocos años después, Charles Fritts fabricó la primera célula solar de película delgada, también utilizando selenio como fotoabsorbente. Sin embargo, con la aparición de células solares de silicio en la década de 1950, la investigación sobre células solares de película delgada de selenio disminuyó. Como resultado, la eficiencia récord del 5,0% demostrada por Tokio Nakada y Akio Kunioka en 1985 se mantuvo sin cambios durante más de 30 años. [75] En 2017, los investigadores de IBM lograron una nueva eficiencia récord del 6,5% al rediseñar la estructura del dispositivo. [76] Después de este logro, el selenio ha ganado un renovado interés como un fotoabsorbente de banda ancha con el potencial de ser integrado en tándem con fotoabsorbentes de banda ancha más baja. [77] En 2024, se demostró la primera célula solar en tándem basada en selenio, que mostraba una célula superior de selenio integrada monolíticamente con una célula inferior de silicio. [78] Sin embargo, un déficit significativo en el voltaje de circuito abierto es actualmente el principal factor limitante para mejorar aún más la eficiencia, lo que requiere estrategias de ingeniería de defectos para películas delgadas de selenio para mejorar la vida útil del portador . [79] Hasta ahora, la única estrategia de ingeniería de defectos que se ha investigado para las células solares de película delgada de selenio implica la cristalización del selenio utilizando un láser . [80]
Fotoconductores
Las películas delgadas de selenio amorfo (α-Se) se han utilizado como fotoconductores en detectores de rayos X de panel plano . Estos detectores utilizan selenio amorfo para capturar y convertir los fotones de rayos X incidentes directamente en carga eléctrica. El selenio ha sido elegido para esta aplicación entre otros semiconductores debido a una combinación de sus favorables propiedades físicas y tecnológicas: [81] [82]
- El selenio amorfo tiene un punto de fusión bajo, una presión de vapor alta y una estructura uniforme. Estas tres propiedades permiten la deposición rápida y sencilla de películas uniformes de gran superficie con un espesor de hasta 1 mm a una velocidad de 1–5 μm/min. Su uniformidad y la falta de límites de grano, que son intrínsecos a los materiales policristalinos, mejoran la calidad de la imagen de rayos X. Mientras tanto, la gran superficie es esencial para escanear el cuerpo humano o los artículos de equipaje.
- El selenio es menos tóxico que muchos semiconductores compuestos que contienen arsénico o metales pesados como el mercurio o el plomo.
- La movilidad en el campo eléctrico aplicado es suficientemente alta tanto para los electrones como para los huecos, de modo que en un dispositivo típico de 0,2 mm de espesor, aproximadamente el 98% de los electrones y huecos producidos por rayos X se recogen en los electrodos sin quedar atrapados por diversos defectos. En consecuencia, la sensibilidad del dispositivo es alta y su comportamiento es fácil de describir mediante ecuaciones de transporte simples.
Rectificadores
Los rectificadores de selenio se utilizaron por primera vez en 1933. En su mayoría, han sido reemplazados por dispositivos basados en silicio. Una excepción notable es la protección contra sobretensiones de CC , donde las capacidades energéticas superiores de los supresores de selenio los hacen más deseables que los varistores de óxido metálico . [ cita requerida ]
Otros usos
La demanda de selenio por parte de la industria electrónica está disminuyendo. [66] Sus propiedades fotovoltaicas y fotoconductoras aún son útiles en fotocopiadoras , [83] [84] [85] [86] fotocélulas , fotómetros y células solares . Su uso como fotoconductor en fotocopiadoras de papel normal alguna vez fue una aplicación líder, pero en la década de 1980, la aplicación de fotoconductor disminuyó (aunque todavía era un gran uso final) a medida que más y más fotocopiadoras cambiaron a fotoconductores orgánicos. [ cita requerida ]
El seleniuro de zinc fue el primer material para los LED azules , pero el nitruro de galio domina ese mercado. [87] El seleniuro de cadmio fue un componente importante en los puntos cuánticos . [ cita requerida ] Las láminas de selenio amorfo convierten las imágenes de rayos X en patrones de carga en xerorradiografía y en cámaras de rayos X de panel plano de estado sólido. [88] El selenio ionizado (Se+24, donde 24 de los orbitales externos D, S y P se eliminan debido a las altas energías de entrada [ aclaración necesaria ] ) es uno de los medios activos utilizados en los láseres de rayos X. [89] El 75 Se se utiliza como fuente gamma en la radiografía industrial. [90]
El selenio cataliza algunas reacciones químicas, pero no se utiliza ampliamente debido a problemas de toxicidad. [91] En la cristalografía de rayos X , la incorporación de uno o más átomos de selenio en lugar de azufre ayuda con la dispersión anómala de longitudes de onda múltiples y la eliminación gradual de la dispersión anómala de longitudes de onda únicas . [92]
El selenio se utiliza para tonificar las impresiones fotográficas y numerosos fabricantes de productos fotográficos lo venden como tóner. El selenio intensifica y amplía la gama tonal de las imágenes fotográficas en blanco y negro y mejora la permanencia de las impresiones. [93] [94] [95] Se han utilizado pequeñas cantidades de compuestos de organoselenio para modificar los catalizadores utilizados en la vulcanización para la producción de caucho. [63] El selenio se utiliza en algunos champús anticaspa en forma de disulfuro de selenio, como las marcas Selsun y Vichy Dereos [96] .
Contaminación
La contaminación por selenio puede afectar algunos sistemas acuáticos y puede ser causada por factores antropogénicos como la escorrentía agrícola y los procesos industriales. [97] Las personas que comen más pescado son generalmente más saludables que las que comen menos, [98] lo que sugiere que no hay mayores problemas de salud humana debido a la contaminación por selenio, aunque el selenio tiene un efecto potencial en los humanos. [99]
El envenenamiento por selenio de los sistemas hídricos puede producirse cuando nuevos cursos de agua agrícolas atraviesan tierras secas. Este proceso filtra compuestos solubles naturales de selenio (como selenatos) en el agua, que luego pueden concentrarse en los humedales a medida que el agua se evapora. La contaminación por selenio de las vías fluviales también ocurre cuando el selenio se lixivia de las cenizas de los conductos de carbón, la minería y la fundición de metales , el procesamiento de petróleo crudo y los vertederos. [100] Se encontró que los altos niveles de selenio en las vías fluviales causan trastornos congénitos en especies ovíparas, incluidas las aves de humedales [101] y los peces. [102] Los niveles elevados de metilmercurio en la dieta pueden amplificar el daño de la toxicidad del selenio en las especies ovíparas. [103] [104]
El selenio se bioacumula en hábitats acuáticos, lo que da como resultado concentraciones más altas en los organismos que en el agua circundante. Los compuestos organoselénicos pueden ser concentrados más de 200.000 veces por el zooplancton cuando las concentraciones en el agua están en el rango de 0,5 a 0,8 μg Se/L. El selenio inorgánico se bioacumula más fácilmente en el fitoplancton que el zooplancton. El fitoplancton puede concentrar selenio inorgánico en un factor de 3000. Una mayor concentración a través de la bioacumulación ocurre a lo largo de la cadena alimentaria, ya que los depredadores consumen presas ricas en selenio. Se recomienda que una concentración en el agua de 2 μg Se/L se considere altamente peligrosa para los peces sensibles y las aves acuáticas . El envenenamiento por selenio puede transmitirse de padres a hijos a través del huevo, y el envenenamiento por selenio puede persistir durante muchas generaciones. La reproducción de los patos silvestres se ve afectada a concentraciones dietéticas de 7 μg Se/L. Muchos invertebrados bentónicos pueden tolerar concentraciones de selenio de hasta 300 μg/L de selenio en su dieta. [105]
La bioacumulación de selenio en ambientes acuáticos causa la muerte de peces dependiendo de la especie en el área afectada. Sin embargo, hay algunas especies que se han visto que sobreviven a estos eventos y toleran el aumento de selenio. También se ha sugerido que la temporada podría tener un impacto en los efectos nocivos del selenio en los peces. [106] Pueden ocurrir cambios fisiológicos sustanciales en peces con altas concentraciones de selenio en los tejidos. Los peces afectados por el selenio pueden experimentar hinchazón de las láminas branquiales , lo que impide la difusión de oxígeno a través de las branquias y el flujo sanguíneo dentro de las branquias. La capacidad respiratoria se reduce aún más debido a la unión del selenio a la hemoglobina . Otros problemas incluyen la degeneración del tejido hepático, hinchazón alrededor del corazón, folículos ováricos dañados en los ovarios, cataratas y acumulación de líquido en la cavidad corporal y la cabeza. El selenio a menudo causa un feto de pez malformado que puede tener problemas para alimentarse o respirar; la distorsión de las aletas o la columna vertebral también es común. Los peces adultos pueden parecer saludables a pesar de su incapacidad para producir descendencia viable. [ cita requerida ]
Ejemplos
En el lago Belews , en Carolina del Norte, se eliminaron 19 especies de peces debido a que entre 150 y 200 μg de Se/L de aguas residuales se descargaron desde 1974 a 1986 de una planta de energía a carbón de Duke Energy . En el Refugio Nacional de Vida Silvestre Kesterson , en California, miles de peces y aves acuáticas fueron envenenados por el selenio presente en el drenaje de riego agrícola. [ cita requerida ]
Papel biológico
| Peligros | |
|---|---|
| NFPA 704 (rombo cortafuegos) | |
Aunque es tóxico en grandes dosis, el selenio es un micronutriente esencial para los animales. En las plantas, se encuentra como un mineral secundario, [107] a veces en proporciones tóxicas en el forraje (algunas plantas pueden acumular selenio como defensa contra el consumo de animales, [108] pero otras plantas, como la hierba loca , requieren selenio y su crecimiento indica la presencia de selenio en el suelo). [109] Se cree que el contenido de selenio en el cuerpo humano está en el rango de 13 a 20 mg. [110]
El selenio es un componente de los aminoácidos inusuales selenocisteína y selenometionina . [ cita requerida ] En los humanos, el selenio es un oligoelemento que funciona como cofactor para la reducción de enzimas antioxidantes , como las glutatión peroxidasas [111] y ciertas formas de tiorredoxina reductasa que se encuentran en animales y algunas plantas (esta enzima se produce en todos los organismos vivos, pero no todas sus formas en las plantas requieren selenio). [ cita requerida ] La familia de enzimas glutatión peroxidasa (GSH-Px) cataliza reacciones que eliminan especies reactivas de oxígeno como el peróxido de hidrógeno y los hidroperóxidos orgánicos . [ 112 ]
La glándula tiroides y cada célula que utiliza la hormona tiroidea también utilizan selenio, [113] que es un cofactor para tres de los cuatro tipos conocidos de desyodasas de la hormona tiroidea , que activan y luego desactivan varias hormonas tiroideas y sus metabolitos; las desyodasas de yodotironina son la subfamilia de enzimas desyodasas que utilizan selenio como el aminoácido selenocisteína, que de otro modo sería raro. Solo la desyodasa yodotirosina desyodasa , que actúa sobre los últimos productos de degradación de la hormona tiroidea, no utiliza selenio. [114] El selenio también puede inhibir la enfermedad de Hashimoto en la tiroides, en la que las propias células tiroideas del cuerpo son atacadas como extrañas. Se informa de una reducción del 21% en los anticuerpos TPO con la ingesta dietética de 0,2 mg de selenio. [115]
El aumento de selenio en la dieta reduce los efectos de la toxicidad del mercurio, [116] [117] [118] aunque solo es eficaz en dosis bajas o modestas de mercurio. [119] La evidencia sugiere que los mecanismos moleculares de la toxicidad del mercurio incluyen la inhibición irreversible de las selenoenzimas que se requieren para prevenir y revertir el daño oxidativo en el cerebro y los tejidos endocrinos. [120] [121] El compuesto que contiene selenio, la selenoneína, está presente en la sangre del atún rojo . [122] [123] Ciertas especies de plantas se consideran indicadores de un alto contenido de selenio en el suelo porque requieren altos niveles de selenio para prosperar. Las principales plantas indicadoras de selenio son las especies de Astragalus (incluidas algunas locoweeds ), la pluma del príncipe ( Stanleya sp.), los ásteres leñosos ( Xylorhiza sp.) y la falsa hierba dorada ( Oonopsis sp.). [124]
La evolución en la biología
Desde hace unos tres mil millones de años, las familias de selenoproteínas procariotas impulsan la evolución de la selenocisteína, un aminoácido. El selenio se incorpora a varias familias de selenoproteínas procariotas en bacterias, arqueas y eucariotas como selenocisteína, [125] donde las peroxirredoxinas de selenoproteína protegen a las células bacterianas y eucariotas contra el daño oxidativo. Las familias de selenoproteínas de GSH-Px y las desyodasas de las células eucariotas parecen tener un origen filogenético bacteriano . La forma que contiene selenocisteína se presenta en especies tan diversas como las algas verdes, las diatomeas, los erizos de mar, los peces y los pollos. Las enzimas de selenio están involucradas en las pequeñas moléculas reductoras glutatión y tiorredoxina . Una familia de moléculas portadoras de selenio (las glutatión peroxidasas ) destruye el peróxido y repara las membranas celulares peroxidadas dañadas usando glutatión. Otra enzima que contiene selenio en algunas plantas y animales ( tiorredoxina reductasa ) genera tiorredoxina reducida, un ditiol que sirve como fuente de electrones para las peroxidasas y también para la importante enzima reductora ribonucleótido reductasa que produce precursores de ADN a partir de precursores de ARN. [126]
Los oligoelementos involucrados en las actividades de las enzimas GSH-Px y superóxido dismutasa, es decir, selenio, vanadio , magnesio , cobre y zinc , pueden haber estado ausentes en algunas áreas terrestres deficientes en minerales. [125] Los organismos marinos retuvieron y a veces expandieron sus selenoproteomas, mientras que los selenoproteomas de algunos organismos terrestres se redujeron o se perdieron por completo. Estos hallazgos sugieren que, con la excepción de los vertebrados , la vida acuática apoya el uso de selenio, mientras que los hábitats terrestres conducen a un uso reducido de este oligoelemento. [127] Los peces marinos y las glándulas tiroides de los vertebrados tienen la mayor concentración de selenio y yodo. Desde hace unos 500 millones de años, las plantas terrestres y de agua dulce optimizaron lentamente la producción de "nuevos" antioxidantes endógenos, como el ácido ascórbico (vitamina C), los polifenoles (incluidos los flavonoides), los tocoferoles , etc. Algunos de ellos aparecieron en los últimos 50-200 millones de años en frutos y flores de plantas angiospermas . De hecho, las angiospermas (el tipo de planta dominante en la actualidad) y la mayoría de sus pigmentos antioxidantes evolucionaron durante el período Jurásico tardío. [ cita requerida ]
Las isoenzimas desyodasas constituyen otra familia de selenoenzimas eucariotas. Las desyodasas están involucradas en la regulación de la hormona tiroidea, participando en la protección de los tirocitos del daño causado por el H 2 O 2 producido para la biosíntesis de la hormona tiroidea. [128] Hace unos 200 millones de años, se desarrollaron nuevas selenoproteínas como enzimas GSH-Px de mamíferos. [129] [130] [131] [132]
Toxicidad

Aunque el selenio es un oligoelemento esencial , es tóxico si se toma en exceso. Exceder el Nivel Máximo de Ingesta Tolerable de 400 microgramos por día puede provocar selenosis. [134] Este Nivel Máximo de Ingesta Tolerable de 400 μg se basa principalmente en un estudio de 1986 de cinco pacientes chinos que mostraron signos evidentes de selenosis y un estudio de seguimiento de las mismas cinco personas en 1992. [135] El estudio de 1992 encontró que la ingesta dietética máxima segura de selenio era de aproximadamente 800 microgramos por día (15 microgramos por kilogramo de peso corporal), pero sugirió 400 microgramos por día para evitar crear un desequilibrio de nutrientes en la dieta y para concordar con los datos de otros países. [136] En China, las personas que ingirieron maíz cultivado en carbón pétreo extremadamente rico en selenio ( esquisto carbonoso ) han sufrido toxicidad por selenio. Se ha demostrado que este carbón tiene un contenido de selenio de hasta el 9,1%, la concentración más alta jamás registrada en carbón. [137]
Los signos y síntomas de la selenosis incluyen un olor a ajo en el aliento, trastornos gastrointestinales, pérdida de cabello, desprendimiento de uñas, fatiga, irritabilidad y daño neurológico. Los casos extremos de selenosis pueden presentar cirrosis del hígado, edema pulmonar o muerte. [138] El selenio elemental y la mayoría de los seleniuros metálicos tienen toxicidades relativamente bajas debido a la baja biodisponibilidad . Por el contrario, los selenatos y selenitos tienen un modo de acción oxidante similar al del trióxido de arsénico y son muy tóxicos. La dosis tóxica crónica de selenito para humanos es de aproximadamente 2400 a 3000 microgramos de selenio por día. [139] El seleniuro de hidrógeno es un gas extremadamente tóxico y corrosivo. [140] El selenio también se encuentra en compuestos orgánicos, como el seleniuro de dimetilo, la selenometionina , la selenocisteína y la metilselenocisteína , todos ellos de alta biodisponibilidad y tóxicos en grandes dosis.
El 19 de abril de 2009, 21 caballos de polo murieron poco antes de un partido del Abierto de Polo de los Estados Unidos. Tres días después, una farmacia publicó un comunicado explicando que los caballos habían recibido una dosis incorrecta de uno de los ingredientes utilizados en un compuesto de suplemento de vitaminas y minerales que había sido preparado incorrectamente por una farmacia especializada . El análisis de los niveles sanguíneos de compuestos inorgánicos en el suplemento indicó que las concentraciones de selenio eran de 10 a 15 veces más altas de lo normal en las muestras de sangre y de 15 a 20 veces más altas de lo normal en las muestras de hígado. Más tarde se confirmó que el selenio era el factor tóxico. [141]

En los peces y otros animales salvajes, el selenio es necesario para la vida, pero tóxico en dosis altas. En el caso del salmón , la concentración óptima de selenio es de aproximadamente 1 microgramo de selenio por gramo de peso corporal total. Muy por debajo de ese nivel, los salmones jóvenes mueren por deficiencia; [143] muy por encima, mueren por exceso tóxico. [142]
La Administración de Seguridad y Salud Ocupacional (OSHA) ha establecido el límite legal ( límite de exposición permisible ) para el selenio en el lugar de trabajo en 0,2 mg/m 3 durante una jornada laboral de 8 horas. El Instituto Nacional para la Seguridad y Salud Ocupacional (NIOSH) ha establecido un límite de exposición recomendado (REL) de 0,2 mg/m 3 durante una jornada laboral de 8 horas. En niveles de 1 mg/m 3 , el selenio es inmediatamente peligroso para la vida y la salud . [145]
Detección en fluidos biológicos
El selenio se puede medir en sangre, plasma, suero u orina para controlar la exposición ambiental u ocupacional excesiva, para confirmar un diagnóstico de envenenamiento en víctimas hospitalizadas o para investigar un caso sospechoso de sobredosis fatal. Algunas técnicas analíticas pueden distinguir las formas orgánicas e inorgánicas del elemento. Tanto las formas orgánicas como las inorgánicas del selenio se convierten en gran parte en conjugados de monosacáridos (selenoazúcares) en el cuerpo antes de su eliminación en la orina. Los pacientes con cáncer que reciben dosis orales diarias de selentionina pueden alcanzar concentraciones muy altas de selenio en plasma y orina. [146]
Deficiencia
La deficiencia de selenio puede ocurrir en pacientes con una función intestinal gravemente comprometida, aquellos que reciben nutrición parenteral total y [147] en aquellos de edad avanzada (mayores de 90 años). También corren riesgo las personas que dependen de alimentos cultivados en suelos deficientes en selenio. Aunque el suelo de Nueva Zelanda tiene niveles bajos de selenio, los residentes no han detectado efectos adversos para la salud. [148]
La deficiencia de selenio, definida por niveles bajos (<60% de lo normal) de actividad de selenoenzima en el cerebro y los tejidos endocrinos, ocurre solo cuando un nivel bajo de selenio está vinculado con estrés adicional, como altas exposiciones al mercurio [149] o mayor estrés oxidativo por deficiencia de vitamina E. [150]
El selenio interactúa con otros nutrientes, como el yodo y la vitamina E. El efecto de la deficiencia de selenio en la salud sigue siendo incierto, en particular en lo que respecta a la enfermedad de Kashin-Beck . [151] Además, el selenio interactúa con otros minerales, como el zinc y el cobre . Las dosis altas de suplementos de selenio en animales preñados pueden alterar la relación zinc:cobre y provocar una reducción de zinc; en estos casos de tratamiento, se deben controlar los niveles de zinc. Se necesitan más estudios para confirmar estas interacciones. [152]
En las regiones (por ejemplo, regiones dentro de América del Norte) donde los bajos niveles de selenio en el suelo conducen a bajas concentraciones en las plantas, algunas especies animales pueden ser deficientes a menos que el selenio se complemente con la dieta o inyección. [153] Los rumiantes son particularmente susceptibles. En general, la absorción de selenio en la dieta es menor en los rumiantes que en otros animales y es menor en los forrajes que en los granos. [154] Los rumiantes que pastan ciertos forrajes, por ejemplo, algunas variedades de trébol blanco que contienen glicósidos cianogénicos , pueden tener mayores requerimientos de selenio, [154] presumiblemente porque el cianuro se libera de la aglicona por la actividad de la glucosidasa en el rumen [155] y las peroxidasas de glutatión se desactivan por el cianuro que actúa sobre la fracción de glutatión . [156] A los rumiantes neonatos en riesgo de enfermedad del músculo blanco se les puede administrar selenio y vitamina E por inyección; Algunas de las miopatías causadas por WMD responden únicamente al selenio, algunas únicamente a la vitamina E y algunas a cualquiera de ellas. [157]
Fuentes nutricionales de selenio
El selenio en la dieta proviene de la carne, los frutos secos, los cereales y los hongos. Las nueces de Brasil son la fuente dietética más rica (aunque esto depende del suelo, ya que las nueces de Brasil no requieren altos niveles del elemento para sus propias necesidades). [158] [159]
La ingesta diaria recomendada (IDR) de selenio para adolescentes y adultos en los Estados Unidos es de 55 μg /día. El selenio como suplemento dietético está disponible en muchas formas, incluidos los suplementos multivitamínicos/minerales, que normalmente contienen 55 o 70 μg/porción. Los suplementos específicos de selenio suelen contener 100 o 200 μg/porción. [ cita requerida ] En junio de 2015, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) publicó su norma final que establece un requisito para los niveles mínimos y máximos de selenio en las fórmulas infantiles . [ 160 ]
Efectos generales sobre la salud
Los efectos de la ingesta de selenio sobre el cáncer se han estudiado en varios ensayos clínicos y estudios epidemiológicos en humanos. El selenio puede tener un papel quimiopreventivo en el riesgo de cáncer como antioxidante y podría desencadenar la respuesta inmunitaria. En niveles bajos, se utiliza en el cuerpo para crear selenoproteínas antioxidantes ; en dosis más altas de lo normal, causa la muerte celular. [133]
El selenio (en estrecha interrelación con el yodo ) desempeña un papel en la salud de la tiroides. El selenio es un cofactor de las tres hormonas tiroideas desyodasas , que ayudan a activar y luego desactivar varias hormonas tiroideas y sus metabolitos. La deficiencia aislada de selenio se está investigando actualmente por su papel en la inducción de reacciones autoinmunes en la glándula tiroides en la enfermedad de Hashimoto . [161] En un caso de deficiencia combinada de yodo y selenio se demostró que desempeñaba un papel protector de la tiroides. [162]
Véase también
Notas
- ^ Para todos los efectos prácticos, 82 Se es estable.
Referencias
- ^ "Pesos atómicos estándar: selenio". CIAAW . 2013.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip JH; Gröning, Manfred; Holden, Norman E.; Meijer, Harro AJ (4 de mayo de 2022). "Pesos atómicos estándar de los elementos 2021 (Informe técnico de la IUPAC)". Química pura y aplicada . doi :10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ Se ha identificado un átomo de Se(0) utilizando DFT en [ReOSe(2-pySe) 3 ]; véase Cargnelutti, Roberta; Lang, Ernesto S.; Piquini, Paulo; Abram, Ulrich (2014). "Síntesis y estructura de [ReOSe(2-Se-py)3]: Un complejo de renio(V) con selenio(0) como ligando". Inorganic Chemistry Communications . 45 : 48–50. doi :10.1016/j.inoche.2014.04.003. ISSN 1387-7003.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ Arblaster, John W. (2018). Valores seleccionados de las propiedades cristalográficas de los elementos . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ Susceptibilidad magnética de los elementos y compuestos inorgánicos, en Lide, DR, ed. (2005). CRC Handbook of Chemistry and Physics (86.ª ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Manual de química y física . Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN. 0-8493-0464-4.
- ^ abc Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). "La evaluación NUBASE2020 de las propiedades nucleares" (PDF) . Chinese Physics C . 45 (3): 030001. doi :10.1088/1674-1137/abddae.
- ^ Fernández-Bautista, Tamara; Gómez-Gómez, Beatriz; Palacín-García, Roberto; Gracia-Lor, Emma; Pérez-Corona, Teresa; Madrid, Yolanda (2022-01-15). "Análisis de la distribución de biomoléculas de Se y Hg y especiación de Se en fracciones proteicas poco estudiadas de tejidos musculares de peces altamente consumidos mediante SEC-UV-ICP-MS y HPLC-ESI-MS/MS". Talanta . 237 : 122922. doi :10.1016/j.talanta.2021.122922. ISSN 0039-9140. PMID 34736659. S2CID 243761320.
- ^ Ruyle, George. "Plantas venenosas en los pastizales de Arizona" (PDF) . Universidad de Arizona. Archivado desde el original (PDF) el 15 de julio de 2004. Consultado el 5 de enero de 2009 .
- ^ abcdefgh House, James E. (2008). Química inorgánica . Academic Press. pág. 524. ISBN 978-0-12-356786-4.
- ^ abcd Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . págs. 751–752. ISBN 978-0-08-037941-8.
- ^ Olav Foss y Vitalijus Janickis (1980). "Estructura cristalina del selenio γ-monoclínico". Journal of the Chemical Society, Dalton Transactions (4): 624–627. doi :10.1039/DT9800000624.
- ^ "Estructura de β–Se (Al): A_mP32_14_8e". Enciclopedia de prototipos cristalográficos .
- ^ "Estructura de Se (Ak): A_mP64_14_16e". Enciclopedia de prototipos cristalográficos .
- ^ "Estructura de γ–Se (A8): A_hP3_152_a". Enciclopedia de prototipos cristalográficos .
- ^ Vídeo del calentamiento del selenio en YouTube
- ^ Audi, G.; Kondev, FG; Wang, M.; Huang, WJ; Naimi, S. (2017). "La evaluación NUBASE2016 de las propiedades nucleares" (PDF) . Chinese Physics C . 41 (3): 030001. Bibcode :2017ChPhC..41c0001A. doi :10.1088/1674-1137/41/3/030001.
- ^ "La vida media del 79Se". Physikalisch-Technische Bundesanstalt. 23 de septiembre de 2010. Archivado desde el original el 27 de septiembre de 2011 . Consultado el 29 de mayo de 2012 .
- ^ Jörg, Gerhard; Bühnemann, Rolf; Hollas, Simon; et al. (2010). "Preparación de 79Se radioquímicamente puro y determinación altamente precisa de su vida media". Applied Radiation and Isotopes . 68 (12): 2339–2351. Bibcode :2010AppRI..68.2339J. doi :10.1016/j.apradiso.2010.05.006. PMID 20627600.
- ^ abc Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Química inorgánica . San Diego: Academic Press. p. 583. ISBN 978-0-12-352651-9.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 780. ISBN 978-0-08-037941-8.
- ^ Seppelt, K.; Desmarteau, Darryl D. (1980). "Difluoruro de selenonilo". Síntesis inorgánica . Vol. 20. págs. 36-38. doi :10.1002/9780470132517.ch9. ISBN 978-0-471-07715-2.El informe describe la síntesis del ácido selénico.
- ^ Lenher, V. (abril de 1902). "Acción del ácido selénico sobre el oro". Journal of the American Chemical Society . 24 (4): 354–355. doi :10.1021/ja02018a005.
- ^ Proctor, Nick H.; Hathaway, Gloria J. (2004). Hughes, James P. (ed.). Proctor y Hughes, peligros químicos en el lugar de trabajo (5.ª ed.). Wiley-IEEE. pág. 625. ISBN 978-0-471-26883-3.
- ^ Xu, Zhengtao (2007). Devillanova, Francesco A. (ed.). Manual de química de calcógenos: nuevas perspectivas en azufre, selenio y telurio . Royal Society of Chemistry. pág. 460. ISBN 978-0-85404-366-8.
- ^ ab Gopal, Madhuban; Milne, John (octubre de 1992). "Evidencia espectroscópica de yoduros de selenio en solución de disulfuro de carbono: Se3I2, Se2I2 y SeI2". Química inorgánica . 31 (22): 4530–4533. doi :10.1021/ic00048a017. ISSN 0020-1669.
- ^ McCullough, James D. (diciembre de 1939). "Evidencia de la existencia de un yoduro de selenio". Revista de la Sociedad Química Americana . 61 (12): 3401–3402. doi :10.1021/ja01267a052. ISSN 0002-7863.
- ^ Rao, MR Aswatha Narayana. "Yoduro de selenio". En Actas de la Academia de Ciencias de la India, Sección A , vol. 12, págs. 410-415. Springer India, 1940.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 763-765. ISBN 978-0-08-037941-8.
- ^ Woollins, Derek; Kelly, Paul F. (1993). "La reactividad de Se 4 N 4 en amoníaco líquido". Polyhedron . 12 (10): 1129–1133. doi :10.1016/S0277-5387(00)88201-7.
- ^ Kelly, PF; Slawin, AMZ; Soriano-Rama, A. (1997). "Uso de Se 4 N 4 y Se(NSO) 2 en la preparación de aductos de paladio de dinitruro de diselenio, Se 2 N 2 ; estructura cristalina de [PPh
4]
2[Pd
2Es
6(Ver
2norte
2)] ". Dalton Transactions (4): 559–562. doi :10.1039/a606311j. - ^ Siivari, Jari; Chivers, Tristram; Laitinen, Risto S. (1993). "Una síntesis simple y eficiente de tetranitruro de tetraselenio". Química inorgánica . 32 (8): 1519–1520. doi :10.1021/ic00060a031.
- ^ Erker, G.; Hock, R.; Krüger, C.; Werner, S.; Klärner, FG; Artschwager-Perl, U. (1990). "Síntesis y cicloadiciones de selenobenzofenona monomérica". Angewandte Chemie Edición Internacional en inglés . 29 (9): 1067–1068. doi :10.1002/anie.199010671.
- ^ Berzelius, JJ (1818). "Lettre de M. Berzelius à M. Berthollet sur deux métaux nouveaux" [Carta del Sr. Berzelius al Sr. Berthollet sobre dos nuevos metales]. Annales de Chimie et de Physique . 2da serie (en francés). 7 : 199–206.De la pág. 203: "Cependant, pour rappeler les rapports de cette dernière avec le tellure, je l'ai nommée sélénium". (Sin embargo, para recordar las relaciones de esta última [sustancia (es decir, selenio)] con el telurio, la he llamado "selenio".)
- ^ Weeks, Mary Elvira (1932). "El descubrimiento de los elementos. VI. Telurio y selenio". Revista de educación química . 9 (3): 474. Bibcode :1932JChEd...9..474W. doi :10.1021/ed009p474.
- ^ Trofast, Jan (2011). "El descubrimiento del selenio por parte de Berzelius". Chemistry International . 33 (5): 16–19.PDF
- ^ Smith, Willoughby (1873). "La acción de la luz sobre el selenio". Revista de la Sociedad de Ingenieros Telegráficos . 2 (4): 31–33. doi :10.1049/jste-1.1873.0023.
- ^ Smith, Willoughby (20 de febrero de 1873). "Efecto de la luz sobre el selenio durante el paso de una corriente eléctrica". Nature . 7 (173): 303. Bibcode :1873Natur...7R.303.. doi : 10.1038/007303e0 .
- ^ Bonnier Corporation (1876). "Acción de la luz sobre el selenio". Popular Science . 10 (1): 116.
- ^ Levinshtein, ME; Simin, GS (1 de diciembre de 1992). El primer dispositivo semiconductor. Conozcamos los semiconductores. pp. 77–79. ISBN 978-981-02-3516-1.
- ^ Winston, Brian (29 de mayo de 1998). Tecnología de los medios y sociedad: una historia: desde el telégrafo hasta Internet. Psychology Press. pág. 89. ISBN 978-0-415-14229-8.
- ^ Morris, Peter Robin (1990). Una historia de la industria mundial de semiconductores. pág. 18. ISBN 978-0-86341-227-1.
- ^ Bergmann, Ludwig (1931). "Über eine neue Selen-Sperrschicht-Photozelle". Physikalische Zeitschrift . 32 : 286–288.
- ^ Waitkins, GR; Bearse, AE; Shutt, R. (1942). "Utilización industrial de selenio y telurio". Química industrial e ingeniería . 34 (8): 899–910. doi :10.1021/ie50392a002.
- ^ Pinsent, Jane (1954). "La necesidad de selenito y molibdato en la formación de la deshidrogenasa fórmica por miembros del grupo de bacterias Coli-aerogenes". Biochem. J . 57 (1): 10–16. doi :10.1042/bj0570010. PMC 1269698 . PMID 13159942.
- ^ Stadtman, Thressa C. (2002). "Algunas funciones del oligoelemento esencial selenio". Oligoelementos en el hombre y los animales 10. Vol. 10. págs. 831–836. doi :10.1007/0-306-47466-2_267. ISBN 978-0-306-46378-5.
- ^ Schwarz, Klaus; Foltz, Calvin M. (1957). "El selenio como parte integral del factor 3 contra la degeneración hepática necrótica dietética". Revista de la Sociedad Química Americana . 79 (12): 3292–3293. doi :10.1021/ja01569a087.
- ^ Oldfield, James E. (2006). "Selenio: una perspectiva histórica". Selenium . págs. 1–6. doi :10.1007/0-387-33827-6_1. ISBN 978-0-387-33826-2.
- ^ Hatfield, DL; Gladyshev, VN (2002). "Cómo el selenio ha alterado nuestra comprensión del código genético". Biología molecular y celular . 22 (11): 3565–3576. doi :10.1128/MCB.22.11.3565-3576.2002. PMC 133838 . PMID 11997494.
- ^ "Selenio nativo". Webminerals . Consultado el 6 de junio de 2009 .
- ^ ab Kabata-Pendias, A. (1998). "Geoquímica del selenio". Revista de patología ambiental, toxicología y oncología . 17 (3–4): 173–177. PMID 9726787.
- ^ ab Fordyce, Fiona (2007). "Geoquímica del selenio y salud" (PDF) . Ambio: una revista del entorno humano . 36 (1): 94–97. doi :10.1579/0044-7447(2007)36[94:SGAH]2.0.CO;2. PMID 17408199. S2CID 18925825.
- ^ Wessjohann, Ludger A.; Schneider, Alex; Abbas, Muhammad; Brandt, Wolfgang (2007). "El selenio en la química y la bioquímica en comparación con el azufre". Química biológica . 388 (10): 997–1006. doi :10.1515/BC.2007.138. PMID 17937613. S2CID 34918691.
- ^ Birringer, Marc; Pilawa, Sandra; Flohé, Leopold (2002). "Tendencias en la bioquímica del selenio". Natural Product Reports . 19 (6): 693–718. doi :10.1039/B205802M. PMID 12521265.
- ^ Amouroux, David; Liss, Peter S.; Tessier, Emmanuel; et al. (2001). "El papel de los océanos como fuentes biogénicas de selenio". Earth and Planetary Science Letters . 189 (3–4): 277–283. Bibcode :2001E&PSL.189..277A. doi :10.1016/S0012-821X(01)00370-3.
- ^ Haug, Anna; Graham, Robin D.; Christophersen, Olav A.; Lyons, Graham H. (2007). "Cómo utilizar de manera eficiente los escasos recursos de selenio del mundo para aumentar la concentración de selenio en los alimentos". Ecología microbiana en la salud y la enfermedad . 19 (4): 209–228. doi :10.1080/08910600701698986. PMC 2556185 . PMID 18833333.
- ^ Rieuwerts, John (2015). Los elementos de la contaminación ambiental. Londres y Nueva York: Earthscan Routledge. p. 262. ISBN 978-0-415-85919-6.OCLC 886492996 .
- ^ "Declaración de salud pública: selenio" (PDF) . Agencia para Sustancias Tóxicas y Registro de Enfermedades . Consultado el 5 de enero de 2009 .
- ^ "Declaración de salud pública: selenio: producción, importación/exportación, uso y eliminación" (PDF) . Agencia para Sustancias Tóxicas y Registro de Enfermedades . Consultado el 5 de enero de 2009 .
- ^ "Química: Tabla periódica: selenio: información clave". webelements . Consultado el 6 de enero de 2009 .
- ^ Bartos, PJ (2002). "El cobre obtenido por extracción por electrosoldadura y el ciclo tecnológico". Política de recursos . 28 (3–4): 85–94. Bibcode :2002RePol..28...85B. doi :10.1016/S0301-4207(03)00025-4.
- ^ ab Naumov, AV (2010). "Selenio y telurio: estado de los mercados, la crisis y sus consecuencias". Metallurgist . 54 (3–4): 197–200. doi :10.1007/s11015-010-9280-7. S2CID 137066827.
- ^ Hoffmann, James E. (1989). "Recuperación de selenio y telurio de lodos de refinerías de cobre". JOM . 41 (7): 33–38. Bibcode :1989JOM....41g..33H. doi :10.1007/BF03220269. S2CID 138253358.
- ^ Hyvärinen, Olli; Lindroos, Leo; Yllö, Erkki (1989). "Recuperación de selenio de lodos de refinería de cobre". JOM . 41 (7): 42–43. Código Bib : 1989JOM....41g..42H. doi :10.1007/BF03220271. S2CID 138555797.
- ^ abc "Selenio y telurio: estadísticas e información". Servicio Geológico de los Estados Unidos . Consultado el 30 de mayo de 2012 .
- ^ Sun, Yan; Tian, Xike; He, Binbin; et al. (2011). "Estudios del mecanismo de reducción del dióxido de selenio y su impacto en la microestructura del electrodepósito de manganeso". Electrochimica Acta . 56 (24): 8305–8310. doi :10.1016/j.electacta.2011.06.111.
- ^ Bernd E. Langner (2005), "Selenio y compuestos de selenio", Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH, Weinheim. doi :10.1002/14356007.a23_525.
- ^ Davis, Joseph R. (2001). Cobre y aleaciones de cobre. ASM Int. pág. 91. ISBN 978-0-87170-726-0.
- ^ Isakov, Edmund (31 de octubre de 2008). Datos de corte para torneado de acero. Prensa industrial. pág. 67. ISBN 978-0-8311-3314-6.
- ^ Gol'Dshtein, Ya. E.; Mushtakova, TL; Komissarova, TA (1979). "Efecto del selenio en la estructura y propiedades del acero estructural". Metal Science and Heat Treatment . 21 (10): 741–746. Bibcode :1979MSHT...21..741G. doi :10.1007/BF00708374. S2CID 135853965.
- ^ Davis, Joseph R. (2001). Cobre y aleaciones de cobre. ASM International . p. 278. ISBN 978-0-87170-726-0.
- ^ Eftekhari, Ali (2017). "El auge de las baterías de litio-selenio". Energía y combustibles sostenibles . 1 : 14–29. doi :10.1039/C6SE00094K.
- ^ Adams, William Grylls; Day, Richard Evans. "La acción de la luz sobre el selenio". Philosophical Transactions of the Royal Society of London . 167 : 313–349.
- ^ Nakada, Tokio; Kunioka, Akio (1 de julio de 1985). "Células solares policristalinas de película fina TiO 2 / Se". Revista Japonesa de Física Aplicada . 24 (7A): L536. Código Bib : 1985JaJAP..24L.536N. doi :10.1143/JJAP.24.L536. S2CID 118838432.
- ^ Todorov, Teodor K.; Singh, Saurabh; Bishop, Douglas M.; Gunawan, Oki; Lee, Yun Seog; Gershon, Talia S.; Brew, Kevin W.; Antunez, Priscilla D.; Haight, Richard (25 de septiembre de 2017). "Células solares ultradelgadas de alto ancho de banda con eficiencias mejoradas a partir del material fotovoltaico más antiguo del mundo". Nature Communications . 8 (1): 682. Bibcode :2017NatCo...8..682T. doi :10.1038/s41467-017-00582-9. PMC 5613033 . PMID 28947765.
- ^ Youngman, Tomas H.; Nielsen, Rasmus; Crovetto, Andrea; Seger, Brian; Hansen, Ole; Chorkendorff, Ib; Vesborg, Peter CK (julio de 2021). "Células solares de selenio semitransparentes como celda superior para energía fotovoltaica en tándem". Solar RRL . 5 (7). doi :10.1002/solr.202100111. S2CID 235575161.
- ^ Nielsen, Rasmus; Crovetto, Andrea; Assar, Alireza; Hansen, Ole; Chorkendorff, Ib; Vesborg, Peter CK (12 de marzo de 2024). "Células solares en tándem monolíticas de selenio/silicio". PRX Energy . 3 (1): 013013. arXiv : 2307.05996 . Código Bibliográfico :2024PRXE....3a3013N. doi :10.1103/PRXEnergy.3.013013.
- ^ Nielsen, Rasmus; Youngman, Tomas H.; Moustafa, Hadeel; Levcenco, Sergiu; Hempel, Hannes; Crovetto, Andrea; Olsen, Thomas; Hansen, Ole; Chorkendorff, Ib; Unold, Thomas; Vesborg, Peter CK (2022). "Origen de las pérdidas fotovoltaicas en células solares de selenio con voltajes de circuito abierto que se aproximan a 1 V". Journal of Materials Chemistry A . 10 (45): 24199–24207. doi :10.1039/D2TA07729A. S2CID 253315416.
- ^ Nielsen, Rasmus; Hemmingsen, Tobias H.; Bonczyk, Tobias G.; Hansen, Ole; Chorkendorff, Ib; Vesborg, Peter CK (11 de septiembre de 2023). "Recocido láser y epitaxia en fase sólida de células solares de película fina de selenio". ACS Applied Energy Materials . 6 (17): 8849–8856. arXiv : 2306.11311 . doi :10.1021/acsaem.3c01464. S2CID 259203956.
- ^ Huang, Heyuan; Abbaszadeh, Shiva (2020). "Desarrollos recientes de detectores de rayos X basados en selenio amorfo: una revisión". IEEE Sensors Journal . 20 (4): 1694–1704. Bibcode :2020ISenJ..20.1694H. doi : 10.1109/JSEN.2019.2950319 . S2CID 208833373.
- ^ Kasap, Safa; Frey, Joel B.; Belev, George; Tousignant, Olivier; Mani, Habib; Laperriere, Luc; Reznik, Alla; Rowlands, John A. (2009). "Selenio amorfo y sus aleaciones desde la xerorradiografía temprana hasta los detectores de imágenes de rayos X de alta resolución y los tubos de imágenes ultrasensibles". Physica Status Solidi B . 246 (8): 1794–1805. Bibcode :2009PSSBR.246.1794K. doi :10.1002/pssb.200982007. S2CID 122848842.
- ^ Springett, BE (1988). "Aplicación de fotoconductores de selenio-telurio a los procesos de copia e impresión xerográfica". Fósforo y azufre y elementos relacionados . 38 (3–4): 341–350. doi :10.1080/03086648808079729.
- ^ Williams, Rob (2006). Arquitectura de sistemas informáticos: un enfoque de redes. Prentice Hall. pp. 547–548. ISBN 978-0-321-34079-5.
- ^ Diels, Jean-Claude; Arissian, Ladan (2011). "La impresora láser". Láseres . Wiley-VCH. págs. 81–83. ISBN 978-3-527-64005-8.
- ^ Meller, Gregor y Grasser, Tibor (2009). Electrónica orgánica. Saltador. págs. 3–5. ISBN 978-3-642-04537-0.
- ^ Normile, Dennis (2000). "El nacimiento del blues". Popular Science . pág. 57.
- ^ Kasap, Safa; Frey, Joel B.; Belev, George; et al. (2009). "Selenio amorfo y sus aleaciones desde la xerorradiografía temprana hasta los detectores de imágenes de rayos X de alta resolución y los tubos de imágenes ultrasensibles". Physica Status Solidi B . 246 (8): 1794–1805. Bibcode :2009PSSBR.246.1794K. doi :10.1002/pssb.200982007. S2CID 122848842.
- ^ Svelto, Orazio (1998). Principios de los LÁSER cuarta ed . Asamblea plenaria. pag. 457.ISBN 978-0-306-45748-7.
- ^ Hayward, Peter; Currie, Dean. "Radiografía de soldaduras utilizando selenio 75, Ir 192 y rayos X" (PDF) .
- ^ Singh, Fateh V.; Wirth, Thomas (2019). "Reactivos de selenio como catalizadores". Ciencia y tecnología de la catálisis . 9 (5): 1073–1091. doi :10.1039/C8CY02274G. S2CID 104468775.
- ^ Hai-Fu, F.; Woolfson, MM; Jia-Xing, Y. (1993). "Nuevas técnicas de aplicación de datos de dispersión anómala de longitud de onda múltiple". Actas de la Royal Society A: Ciencias matemáticas, físicas y de ingeniería . 442 (1914): 13–32. Bibcode :1993RSPSA.442...13H. doi :10.1098/rspa.1993.0087. S2CID 122722520.
- ^ MacLean, Marion E. (1937). "Un proyecto para estudiantes de química general: Tonalización de color de impresiones fotográficas". Revista de Educación Química . 14 (1): 31. Bibcode :1937JChEd..14...31M. doi :10.1021/ed014p31.
- ^ Penichon, Sylvie (1999). "Diferencias en la tonalidad de la imagen producidas por diferentes protocolos de tonalización para fotografías de colodión mate". Revista del Instituto Americano de Conservación . 38 (2): 124–143. doi :10.2307/3180042. JSTOR 3180042.
- ^ McKenzie, Joy (2003). Exploración de la fotografía básica en blanco y negro . Delmar. pág. 176. ISBN 978-1-4018-1556-1.
- ^ "¿Qué es la caspa?" (PDF) . Vichy UK . Consultado el 3 de octubre de 2023 .
- ^ Lemly, A. Dennis (1 de septiembre de 2004). "La contaminación acuática por selenio es un problema de seguridad ambiental global". Ecotoxicología y seguridad ambiental . 59 (1): 44–56. Bibcode :2004EcoES..59...44L. doi :10.1016/S0147-6513(03)00095-2. ISSN 0147-6513. PMID 15261722.
- ^ Estruch, Ramón; Sacanella, Emilio; Ros, Emilio (4 de enero de 2021). "¿Deberíamos volvernos todos pesco-vegetarianos?". Revista europea del corazón . 42 (12): 1144-1146. doi : 10.1093/eurheartj/ehaa1088 . ISSN 0195-668X. PMID 33393612.
- ^ Gribble, Matthew; Karimi, Roxanne; Feingold, Beth; Nyland, Jennifer; O'Hara, Todd; Gladyshev, Michail; Chen, Celia (8 de septiembre de 2015). "Mercurio, selenio y aceites de pescado en las redes alimentarias marinas e implicaciones para la salud humana". Revista de la Asociación de Biología Marina del Reino Unido . 1 (96): 43–59. doi :10.1017/S0025315415001356. PMC 4720108 . PMID 26834292.
En dosis más altas, el selenio podría ser tóxico para una variedad de animales, incluidos los humanos .
- ^ Lemly, D. (2004). "La contaminación acuática por selenio es un problema de seguridad ambiental global". Ecotoxicología y seguridad ambiental . 59 (1): 44–56. Bibcode :2004EcoES..59...44L. doi :10.1016/S0147-6513(03)00095-2. PMID 15261722.
- ^ Ohlendorf, HM (2003). Ecotoxicología del selenio. Manual de ecotoxicología. Boca Raton: Lewis Publishers. págs. 466–491. ISBN 978-1-56670-546-2.
- ^ Lemly, AD (1997). "Un índice de deformidad teratogénica para evaluar los impactos del selenio en las poblaciones de peces". Ecotoxicología y seguridad ambiental . 37 (3): 259–266. Bibcode :1997EcoES..37..259L. doi :10.1006/eesa.1997.1554. PMID 9378093.
- ^ Penglase, S.; Hamre, K.; Ellingsen, S. (2014). "El selenio y el mercurio tienen un efecto negativo sinérgico en la reproducción de los peces". Toxicología acuática . 149 : 16–24. Bibcode :2014AqTox.149...16P. doi :10.1016/j.aquatox.2014.01.020. PMID 24555955.
- ^ Heinz, GH; Hoffman, DJ (1998). "Interacciones entre el cloruro de metilmercurio y la selenometionina en la salud y la reproducción de los patos silvestres". Toxicología y química ambiental . 17 (2): 139–145. doi :10.1002/etc.5620170202. S2CID 95466655.
- ^ Lemly, Dennis (1998). Evaluación del selenio en los ecosistemas acuáticos: una guía para la evaluación de riesgos y criterios de calidad del agua. Springer. ISBN 0-387-95346-9.
- ^ Hamilton, Steven J. (29 de junio de 2004). "Revisión de la toxicidad del selenio en la cadena alimentaria acuática". Science of the Total Environment . 326 (1): 1–31. Bibcode :2004ScTEn.326....1H. doi :10.1016/j.scitotenv.2004.01.019. ISSN 0048-9697. PMID 15142762.
- ^ Atroshi, Faik (28 de mayo de 2014). Farmacología e intervención nutricional en el tratamiento de enfermedades. BoD – Libros a pedido. ISBN 978-953-51-1383-6.
- ^ Freeman, John L.; Lindblom, Stormy Dawn; Quinn, Colin F.; Fakra, Sirine; Marcus, Matthew A.; Pilon-Smits, Elizabeth AH (2007). "La acumulación de selenio protege a las plantas de la herbivoría de los ortópteros mediante toxicidad y disuasión". The New Phytologist . 175 (3): 490–500. doi : 10.1111/j.1469-8137.2007.02119.x . ISSN 0028-646X. PMID 17635224. S2CID 2330947.
- ^ Concentraciones de selenio en el material foliar de Astragalus oxyphysus (hierba loca del diablo) y Atriplex lentiformis (arbusto de codorniz) en las cordilleras costeras interiores y el oeste del valle de San Joaquín, California (Informe). Servicio Geológico de Estados Unidos. 1986. Informe de investigaciones sobre recursos hídricos 86-4066.
- ^ Una referencia común para esto es Schroeder, HA; Frost, DV; Balassa, JJ (1970). "Metales traza esenciales en el hombre: selenio". Journal of Chronic Diseases . 23 (4): 227–243. doi :10.1016/0021-9681(70)90003-2. OSTI 6424964. PMID 4926392.
- ^ Instituto Linus Pauling de la Universidad Estatal de Oregón lpi.oregonstate.edu
- ^ "Gen Entrez: GPX1 glutatión peroxidasa 1".
- ^ Pakdel, Farzad; Ghazaví, Roghayeh; Heidary, Roghayeh; Nezamabadi, Atenea; Parvizi, Maryam; Haji Safar Ali Memar, Mahsa; Gharebaghi, Reza; Heidary, Fatemeh (2019). "Efecto del selenio sobre los trastornos de la tiroides: análisis cienciométrico". Revista iraní de salud pública . 48 (3): 410–420. ISSN 2251-6085. PMC 6570790 . PMID 31223567.
- ^ "Selenio". Instituto Linus Pauling de la Universidad Estatal de Oregón . Consultado el 5 de enero de 2009 .
- ^ Mazokopakis, EE; Papadakis, JA; Papadomanolaki, MG; et al. (2007). "Efectos de un tratamiento de 12 meses con L-selenometionina sobre los niveles séricos de anti-TPO en pacientes con tiroiditis de Hashimoto". Tiroides . 17 (7): 609–612. doi :10.1089/thy.2007.0040. PMID 17696828.
- ^ Ralston, NV; Ralston, CR; Blackwell, JL III; Raymond, LJ (2008). "Selenio dietético y tisular en relación con la toxicidad del metilmercurio" (PDF) . Neurotoxicology . 29 (5): 802–811. Bibcode :2008NeuTx..29..802R. CiteSeerX 10.1.1.549.3878 . doi :10.1016/j.neuro.2008.07.007. PMID 18761370. Archivado desde el original (PDF) el 24 de julio de 2012 . Consultado el 28 de septiembre de 2012 .
- ^ Penglase, S.; Hamre, K.; Ellingsen, S. (2014). "El selenio previene la regulación negativa de los genes de selenoproteína antioxidante por metilmercurio". Biología y medicina de radicales libres . 75 : 95–104. doi :10.1016/j.freeradbiomed.2014.07.019. hdl : 1956/8708 . PMID 25064324.
- ^ Usuki, F.; Yamashita, A.; Fujimura, M. (2011). "Los defectos postranscripcionales de las selenoenzimas antioxidantes causan estrés oxidativo bajo exposición al metilmercurio". The Journal of Biological Chemistry . 286 (8): 6641–6649. doi : 10.1074/jbc.M110.168872 . PMC 3057802 . PMID 21106535.
- ^ Ohi, G.; Seki, H.; Maeda, H.; Yagyu, H. (1975). "Efecto protector del selenito contra la toxicidad del metilmercurio: observaciones sobre factores de tiempo, dosis y ruta en el desarrollo de la atenuación del selenio". Salud industrial . 13 (3): 93–99. doi : 10.2486/indhealth.13.93 .
- ^ Ralston, NVC; Raymond, LJ (2010). "Efectos protectores del selenio dietético contra la toxicidad del metilmercurio". Toxicología . 278 (1): 112–123. Bibcode :2010Toxgy.278..112R. doi :10.1016/j.tox.2010.06.004. PMID 20561558.
- ^ Carvalho, CML; Chew, Hashemy SI; Hashemy, J.; et al. (2008). "Inhibición del sistema de tiorredoxina humana: un mecanismo molecular de toxicidad por mercurio". Journal of Biological Chemistry . 283 (18): 11913–11923. doi : 10.1074/jbc.M710133200 . PMID 18321861.
- ^ Michiaki Yamashita, Shintaro Imamura, Md. Anwar Hossain, Ken Touhata, Takeshi Yabu y Yumiko Yamashita, "Fuerte actividad antioxidante del nuevo compuesto de imidazol que contiene selenio 'selenoneína'", The FASEB Journal , vol. 26 núm. 1, suplemento 969.13, abril de 2012
- ^ Yamashita, Y.; Yabu, T.; Yamashita, M. (2010). "Descubrimiento del potente antioxidante selenoneína en el atún y el metabolismo redox del selenio". Revista mundial de química biológica . 1 (5): 144–150. doi : 10.4331/wjbc.v1.i5.144 . PMC 3083957 . PMID 21540999.
- ^ Zane Davis, T. (27 de marzo de 2008). "Selenio en las plantas" (PDF) . pág. 8. Consultado el 5 de diciembre de 2008 .
- ^ ab Gladyshev, Vadim N.; Hatfield, Dolph L. (1999). "Proteínas que contienen selenocisteína en mamíferos". Revista de Ciencias Biomédicas . 6 (3): 151–160. doi :10.1007/BF02255899. PMID 10343164.
- ^ Stadtman, TC (1996). "Selenocisteína". Revista Anual de Bioquímica . 65 (1): 83–100. doi :10.1146/annurev.bi.65.070196.000503. PMID 8811175.
- ^ Lobanov, Alexey V.; Fomenko, Dmitri E.; Zhang, Yan; et al. (2007). "Dinámica evolutiva de los selenoproteomas eucariotas: los selenoproteomas grandes pueden asociarse con la vida acuática y los pequeños con la vida terrestre". Genome Biology . 8 (9): R198. doi : 10.1186/gb-2007-8-9-r198 . PMC 2375036 . PMID 17880704.
- ^ Venturi, Sebastiano; Venturi, Mattia (2007). "Evolución de las defensas antioxidantes dietéticas". European EpiMarker . 11 (3): 1–11.
- ^ Castellano, Sergi; Novoselov, Sergey V.; Kryukov, Gregory V.; et al. (2004). "Reconsiderando la evolución de las selenoproteínas eucariotas: una nueva familia no mamífera con distribución filogenética dispersa". EMBO Reports . 5 (1): 71–7. doi :10.1038/sj.embor.7400036. PMC 1298953 . PMID 14710190.
- ^ Kryukov, Gregorio V.; Gladyshev, Vadim N. (2004). "El selenoproteoma procariótico". Informes EMBO . 5 (5): 538–43. doi :10.1038/sj.embor.7400126. PMC 1299047 . PMID 15105824.
- ^ Wilting, R.; Schorling, S.; Persson, BC; Böck, A. (1997). "Síntesis de selenoproteína en arqueas: identificación de un elemento de ARNm de Methanococcus jannaschii que probablemente dirige la inserción de selenocisteína". Journal of Molecular Biology . 266 (4): 637–41. doi :10.1006/jmbi.1996.0812. PMID 9102456.
- ^ Zhang, Yan; Fomenko, Dmitri E.; Gladyshev, Vadim N. (2005). "El selenoproteoma microbiano del Mar de los Sargazos". Genome Biology . 6 (4): R37. doi : 10.1186/gb-2005-6-4-r37 . PMC 1088965 . PMID 15833124.
- ^ ab Razaghi, Ali; Poorebrahim, Mansour; Sarhan, Dhifaf; Björnstedt, Mikaël (1 de septiembre de 2021). "El selenio estimula la inmunidad antitumoral: conocimientos para futuras investigaciones". Revista europea de cáncer . 155 : 256–267. doi : 10.1016/j.ejca.2021.07.013 . ISSN 0959-8049. PMID 34392068.
- ^ "Hoja informativa sobre suplementos dietéticos: selenio". Institutos Nacionales de Salud; Oficina de Suplementos Dietéticos . Consultado el 5 de enero de 2009 .
- ^ Panel sobre antioxidantes dietéticos y compuestos relacionados, subcomités sobre niveles superiores de referencia de nutrientes e interpretación y usos de los IDR, Comité permanente sobre la evaluación científica de las ingestas dietéticas de referencia, Junta de alimentos y nutrición, Instituto de Medicina (15 de agosto de 2000). Ingestas dietéticas de referencia para vitamina C, vitamina E, selenio y carotenoides. Instituto de Medicina. págs. 314–315. doi :10.17226/9810. ISBN 978-0-309-06949-6. Número de identificación personal 25077263.
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Yang, G.; Zhou, R. (1994). "Observaciones adicionales sobre la ingesta máxima segura de selenio en la dieta humana en una zona selenífera de China". Revista de oligoelementos y electrolitos en la salud y la enfermedad . 8 (3–4): 159–165. PMID 7599506.
- ^ Yang, Guang-Qi; Xia, Yi-Ming (1995). "Estudios sobre los requerimientos dietéticos humanos y el rango seguro de ingesta dietética de selenio en China y su aplicación en la prevención de enfermedades endémicas relacionadas". Ciencias biomédicas y ambientales . 8 (3): 187–201. PMID 8561918.
- ^ "Declaración de salud pública: efectos sobre la salud" (PDF) . Agencia para Sustancias Tóxicas y Registro de Enfermedades . Consultado el 5 de enero de 2009 .
- ^ Wilber, CG (1980). "Toxicología del selenio". Toxicología clínica . 17 (2): 171–230. doi :10.3109/15563658008985076. PMID 6998645.
- ^ Olson, OE (1986). "Toxicidad del selenio en animales con énfasis en el hombre". Revista Internacional de Toxicología . 5 : 45–70. doi : 10.3109/10915818609140736 . S2CID 74619246.
- ^ "Los niveles de selenio en los ponis de polo son hasta 20 veces más altos de lo normal". 2009-05-06. Archivado desde el original el 2016-08-19 . Consultado el 2009-05-05 .
- ^ ab Hamilton, Steven J.; Buhl, Kevin J.; Faerber, Neil L.; et al. (1990). "Toxicidad del selenio orgánico en la dieta del salmón chinook". Environ. Toxicol. Chem . 9 (3): 347–358. doi :10.1002/etc.5620090310.
- ^ ab Poston, HA; Combs, GF Jr.; Leibovitz, L. (1976). "Interrelaciones entre la vitamina E y el selenio en la dieta del salmón del Atlántico ( Salmo salar ): signos macroscópicos, histológicos y bioquímicos". Journal of Nutrition . 106 (7): 892–904. doi :10.1093/jn/106.7.892. PMID 932827.
- ^ Brain, P.; Cousens, R. (1989). "Una ecuación para describir las respuestas a las dosis donde hay estimulación del crecimiento a dosis bajas". Weed Research . 29 (2): 93–96. Bibcode :1989WeedR..29...93B. doi :10.1111/j.1365-3180.1989.tb00845.x.
- ^ "Guía de bolsillo del NIOSH sobre peligros químicos: selenio". Estados Unidos: Instituto Nacional de Seguridad y Salud Ocupacional . Consultado el 21 de noviembre de 2015 .
- ^ Baselt, R. (2008). Disposición de sustancias químicas y fármacos tóxicos en el hombre (8.ª ed.). Foster City, California: Biomedical Publications. págs. 1416–1420. ISBN 978-0-9626523-5-6.
- ^ Ravaglia, G.; Forti, P.; Maioli, F.; et al. (2000). "Efecto del estado de micronutrientes en la función inmunitaria de las células asesinas naturales en sujetos sanos de vida libre de ≥90 años". American Journal of Clinical Nutrition . 71 (2): 590–598. doi : 10.1093/ajcn/71.2.590 . PMID 10648276.
- ^ Equipo editorial de MedSafe. "Selenio". Artículos de actualización para prescriptores . Autoridad de seguridad de medicamentos y dispositivos médicos de Nueva Zelanda . Consultado el 13 de julio de 2009 .
- ^ Ralston, NVC; Raymond, LJ (2010). "Efectos protectores del selenio dietético contra la toxicidad del metilmercurio". Toxicología . 278 (1): 112–123. Bibcode :2010Toxgy.278..112R. doi :10.1016/j.tox.2010.06.004. PMID 20561558.
- ^ Mann, Jim; Truswell, A. Stewart (2002). Fundamentos de nutrición humana (2.ª ed.). Oxford University Press. ISBN 978-0-19-262756-8.
- ^ Moreno-Reyes, R.; Mathieu, F.; Boelaert, M.; et al. (2003). "Suplementación con selenio y yodo en niños tibetanos rurales afectados por osteoartropatía de Kashin-Beck". American Journal of Clinical Nutrition . 78 (1): 137–144. doi : 10.1093/ajcn/78.1.137 . PMID 12816783.
- ^ Kachuee, R.; Moeini, M.; Suori, M. (2013). "El efecto de la suplementación dietética con selenio orgánico e inorgánico sobre el estado sérico de Se, Cu, Fe y Zn durante la última etapa del embarazo en cabras Merghoz y sus cabritos". Small Ruminant Research . 110 (1): 20–27. doi :10.1016/j.smallrumres.2012.08.010.
- ^ Consejo Nacional de Investigación, Subcomité sobre Nutrición de las Ovejas (1985). Requerimientos nutricionales de las ovejas . 6.ª ed., National Academy Press, Washington, ISBN 0309035961 .
- ^ ab Consejo Nacional de Investigación, Comité sobre Requerimientos Nutricionales de Pequeños Rumiantes (2007). Requerimientos nutricionales de pequeños rumiantes . National Academies Press, Washington, ISBN 0-309-10213-8 .
- ^ Coop, IE; Blakely, RL (1949). "El metabolismo y la toxicidad de los cianuros y los glucósidos cianogénicos en las ovejas". New Zealand Journal of Science and Technology . 30 : 277–291.
- ^ Kraus, RJ; Prohaska, JR; Ganther, HE (1980). "Formas oxidadas de glutatión peroxidasa de eritrocitos ovinos. Inhibición por cianuro de 4-glutatión:4-selenoenzima". Biochimica et Biophysica Acta (BBA) - Enzimología . 615 (1): 19–26. doi :10.1016/0005-2744(80)90004-2. PMID 7426660.
- ^ Kahn, CM (ed.) (2005). Manual veterinario de Merck . Novena edición. Merck & Co., Inc., Whitehouse Station, ISBN 0911910506 .
- ^ Barclay, Margaret NI; MacPherson, Allan; Dixon, James (1995). "Contenido de selenio en una variedad de alimentos del Reino Unido". Journal of Food Composition and Analysis . 8 (4): 307–318. doi :10.1006/jfca.1995.1025.
- ^ "Hoja informativa sobre el selenio". Estados Unidos: Oficina de Suplementos Dietéticos, Institutos Nacionales de Salud .Incluye una lista de alimentos ricos en selenio.
- ^ "La FDA emite una norma definitiva para añadir el selenio a la lista de nutrientes obligatorios para las fórmulas infantiles". Administración de Alimentos y Medicamentos. Archivado desde el original el 14 de noviembre de 2017. Consultado el 10 de septiembre de 2015 .
- ^ Rostami, Rahim; Nourooz-Zadeh, Sarmad; Mohammadi, Afshin; Khalkhali, Hamid Reza; Ferns, Gordon; Nourooz-Zadeh, Jaffar (31 de octubre de 2020). "Estado del selenio sérico y su interrelación con los biomarcadores séricos de la función tiroidea y la defensa antioxidante en la tiroiditis de Hashimoto". Antioxidantes . 9 (11): E1070. doi : 10.3390/antiox9111070 . ISSN 2076-3921. PMC 7692168 . PMID 33142736.
- ^ Vanderpas, JB; Contempré, B.; Duale, NL; Deckx, H.; Bebe, N.; Longombé, AO; Thilly, CH; Diplock, AT; Dumont, JE (febrero de 1993). "La deficiencia de selenio mitiga la hipotiroxinemia en sujetos con deficiencia de yodo". The American Journal of Clinical Nutrition . 57 (2 Suppl): 271S–275S. doi : 10.1093/ajcn/57.2.271S . ISSN 0002-9165. PMID 8427203.
Enlaces externos
- El selenio en la tabla periódica de vídeos (Universidad de Nottingham)
- Página de los Institutos Nacionales de Salud sobre el selenio
- Ensayo Archivado el 26 de febrero de 2012 en Wayback Machine.
- ATSDR – Perfil toxicológico: Selenio
- CDC – Guía de bolsillo de NIOSH sobre peligros químicos
- Sitio de elementos de Peter van der Krogt












