Seleniuro de hidrógeno
 | |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Seleniuro de hidrógeno | |||
| Otros nombres Ácido hidroselénico, selano, hidruro de selenio | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.029.071 | ||
| Número CE |
| ||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 2202 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| H2Se | |||
| Masa molar | 80,98 g/mol | ||
| Apariencia | Gas incoloro | ||
| Olor | rábano picante podrido [1] | ||
| Densidad | 3,553 g/ dm3 | ||
| Punto de fusión | -65,73 °C (-86,31 °F; 207,42 K) | ||
| Punto de ebullición | −41,25 °C (−42,25 °F; 231,90 K) | ||
| 0,70 g/100 ml | |||
| Solubilidad | soluble en CS 2 , fosgeno | ||
| Presión de vapor | 9,5 atm (21 °C) [1] | ||
| Acidez (p K a ) | 3.89 | ||
| Ácido conjugado | Selenonio | ||
| Base conjugada | Seleniuro | ||
| Estructura | |||
| Doblado | |||
| Peligros | |||
| Seguridad y salud en el trabajo (SST/OHS): | |||
Principales peligros | Extremadamente tóxico e inflamable. | ||
| Etiquetado SGA : | |||
   | |||
| Peligro | |||
| H220 , H330 , H410 | |||
| P210 , P260 , P271 , P273 , P284 , P304+P340 , P310 , P320 , P377 , P381 , P391 , P403 , P403+P233 , P405 , P410+P403 , P501 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | gas inflamable | ||
| Dosis o concentración letal (LD, LC): | |||
LC Lo ( valor más bajo publicado ) | 0,3 ppm (conejillo de indias, 8 horas) 5,9 ppm (rata, 1 hora) [2] | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | TWA 0,05 ppm (0,2 mg/m3 ) [ 1] | ||
REL (recomendado) | TWA 0,05 ppm (0,2 mg/m3 ) [ 1] | ||
IDLH (Peligro inmediato) | 1 ppm [1] | ||
| Ficha de datos de seguridad (FDS) | ICSC 0284 | ||
| Compuestos relacionados | |||
Otros aniones | H2OH2SH2TeH2Po | ||
Otros cationes | Na2SeAg2Se | ||
Compuestos relacionados | Arsina | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El seleniuro de hidrógeno es un compuesto inorgánico con la fórmula H 2 Se. Este calcogenuro de hidrógeno es el hidruro de selenio más simple y más común . El H 2 Se es un gas incoloro e inflamable en condiciones estándar. Es el compuesto de selenio más tóxico [3] con un límite de exposición de 0,05 ppm durante un período de 8 horas. [4] [5] Incluso en concentraciones extremadamente bajas, este compuesto tiene un olor muy irritante parecido al del rábano picante podrido o "gas que se escapa", pero huele a huevos podridos en concentraciones más altas.
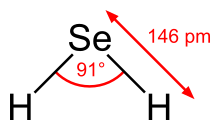
Estructura y propiedades
El H 2 Se adopta una estructura doblada con un ángulo de enlace H−Se−H de 91° [ cita requerida ] . En consonancia con esta estructura, se observan tres bandas vibracionales activas en el IR : 2358, 2345 y 1034 cm −1 . [6]
Las propiedades del H 2 S y del H 2 Se son similares, aunque el seleniuro es más ácido con p K a = 3,89 y el segundo p K a = 11, [6] o 15,05 ± 0,02 a 25 °C. [7]
Preparación
Industrialmente, se produce tratando el selenio elemental a T > 300 °C con gas hidrógeno. [8] Se han descrito varias rutas para obtener H 2 Se, que son adecuadas tanto para preparaciones a gran como a pequeña escala. En el laboratorio, el H 2 Se suele preparar mediante la acción del agua sobre Al 2 Se 3 , concomitante con la formación de alúmina hidratada . Una reacción relacionada implica la hidrólisis ácida de FeSe. [9]
- Al 2 Se 3 + 6 H 2 O ⇌ 2 Al (OH) 3 + 3 H 2 Se
El H 2 Se también se puede preparar mediante diferentes métodos basados en la generación in situ en solución acuosa utilizando hidruro de boro , test de Marsh y aleación de Devarda . Según el método de Sonoda, el H 2 Se se genera a partir de la reacción de H 2 O y CO sobre Se en presencia de Et 3 N . [10] El H 2 Se se puede adquirir en cilindros.
Reacciones
El selenio elemental se puede recuperar del H2Se mediante una reacción con dióxido de azufre acuoso (SO2 ) .
- 2 H 2 Se + SO 2 ⇌ 2 H 2 O + 2 Se + S
Su descomposición se aprovecha para preparar el elemento altamente puro.
Aplicaciones
El H2Se se utiliza habitualmente en la síntesis de compuestos que contienen Se. Se añade a través de alquenos. Un ejemplo ilustrativo es la síntesis de selenoureas a partir de cianamidas : [11]
El gas H2Se se utiliza para dopar semiconductores con selenio.
Seguridad
El seleniuro de hidrógeno es peligroso, ya que es el compuesto de selenio más tóxico [3] y mucho más tóxico que su congénere, el sulfuro de hidrógeno . El valor límite umbral es de 0,05 ppm. El gas actúa como irritante en concentraciones superiores a 0,3 ppm, que es la principal señal de advertencia de exposición; por debajo de 1 ppm, esto es "insuficiente para prevenir la exposición", mientras que a 1,5 ppm la irritación es "intolerable". [5] La exposición a altas concentraciones, incluso durante menos de un minuto, hace que el gas ataque los ojos y las membranas mucosas; esto causa síntomas similares a los de un resfriado durante al menos unos días después. En Alemania, el límite en el agua potable es de 0,008 mg/L, y la EPA de EE. UU. recomienda una contaminación máxima de 0,01 mg/L. [8] [12]
A pesar de su extrema toxicidad, no se han registrado muertes humanas. Se sospecha que esto se debe a la tendencia del gas a oxidarse para formar selenio rojo en las membranas mucosas; el selenio elemental es menos tóxico que los seleniuros. [4]
Véase también
Referencias
- ^ abcde Guía de bolsillo del NIOSH sobre peligros químicos. "#0336". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ "Seleniuro de hidrógeno". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ ab http://www.epa.gov/ttnatw01/hlthef/selenium.html, Agencia de Protección Ambiental de EE. UU., sitio web sobre toxinas del aire
- ^ ab "CDC - Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH): seleniuro de hidrógeno (como Se) - Publicaciones y productos del NIOSH". www.cdc.gov . 2018-11-02 . Consultado el 2023-01-09 .
- ^ ab https://www.cdc.gov/niosh/docs/81-123/pdfs/0336.pdf Directriz de salud ocupacional para el seleniuro de hidrógeno, Instituto Nacional de Seguridad y Salud Ocupacional, 1978
- ^ de William M. Haynes; David R. Lide; Thomas J. Bruno, eds. (2017). Manual de química y física del CRC: un libro de referencia rápida de datos químicos y físicos (97.ª ed.). Boca Ratón, Florida. ISBN 978-1-4987-5429-3.OCLC 957751024 .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Levy, Daniel E.; Myers, Rollie J. (1990). "Determinación espectroscópica de la segunda constante de disociación del seleniuro de hidrógeno y de los coeficientes de actividad y desplazamientos espectrales de sus iones". The Journal of Physical Chemistry . 94 (20): 7842–7847. doi :10.1021/j100383a020.
- ^ por Bernd E. Langner "Selenio y compuestos de selenio" en Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi :10.1002/14356007.a23_525.
- ^ Féher, F. En "Manual de química inorgánica preparativa"; Brauer, E., Ed.; Academic: Nueva York, 1963; 1, pág. 418.
- ^ Sonoda, N.; Kondo K.; Nagano, K.; Kambe, N.; Morimoto, F. Angewandte Chemie Edición internacional Inglés 1980, vol. 19, página 308
- ^ Cohen, VI (1980). "Una síntesis conveniente de selenoureas mono-, N , N ′-di- y trisustituidas a partir de carbamimidotioatos de metilo ( S -Metilpseudotioureas)". Síntesis . 1980 : 60–63. doi :10.1055/s-1980-28927. S2CID 96314420.
- ^ https://www.osha.gov/dts/chemicalsampling/data/CH_246700.html Archivado el 2 de mayo de 2017 en Wayback Machine . , PEL DE LA INDUSTRIA GENERAL DE OSHA: 0,05 ppm, 0,2 mg/m3, PEL DE LA INDUSTRIA DE LA CONSTRUCCIÓN DE OSHA: 0,05 ppm, 0,2 mg/m3 TWA
Enlaces externos
- Página de WebElements sobre las propiedades de los compuestos
- CDC - Guía de bolsillo de NIOSH sobre peligros químicos






