Yodotirosina desyodasa
| Yodotirosina desyodasa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| N.º CE | 1.21.1.1 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista de IntEnz | ||||||||
| BRENDA | Entrada de BRENDA | ||||||||
| Expasí | Vista de NiceZyme | ||||||||
| BARRIL | Entrada de KEGG | ||||||||
| MetaCiclo | vía metabólica | ||||||||
| PRIAMO | perfil | ||||||||
| Estructuras del PDB | RCSB AP APBE APSUMA | ||||||||
| |||||||||
| Año Internacional de la Juventud | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificadores | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Alias | IYD , yodotirosina desyodasa, C6orf71, DEHAL1, TDH4, dJ422F24.1, IYD-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificaciones externas | OMIM : 612025; MGI : 1917587; HomoloGene : 12352; GeneCards : Año Internacional del Año; OMA :IYD - ortólogos | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidatos | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
La yodotirosina desyodasa, también conocida como yodotirosina deshalogenasa 1, es un tipo de enzima desyodasa que elimina el yoduro eliminándolo de los residuos de tirosina yodados en la glándula tiroides . [5] Estas tirosinas yodadas se producen durante la biosíntesis de la hormona tiroidea . [6] El yoduro que elimina la yodotirosina desyodasa es necesario para sintetizar nuevamente las hormonas tiroideas. [7] Después de la síntesis, las hormonas tiroideas circulan por el cuerpo para regular la tasa metabólica, la expresión de proteínas y la temperatura corporal. [8] Por lo tanto, la yodotirosina desyodasa es necesaria para mantener los niveles de yoduro y hormonas tiroideas en equilibrio.
La deshalogenación en organismos aeróbicos se realiza generalmente a través de oxidación e hidrólisis ; [9] sin embargo, la yodotirosina desyodasa utiliza la deshalogenación reductiva. La yodotirosina desyodasa y la yodotironina desyodasa se han determinado como las únicas dos enzimas conocidas que catalizan la deshalogenación reductiva en mamíferos. [8] Aunque estas dos enzimas realizan funciones similares, son estructural y mecánicamente diferentes. La yodotironina desyodasa (no la enzima que es el tema de este artículo) utiliza un sitio activo de selenocisteína para la catálisis, es un miembro de la superfamilia de las tiorredoxinas y elimina el yoduro solo cuando el sustrato está en forma de doble tirosina. [10] Por el contrario, la yodotirosina desyodasa (la enzima en cuestión) no requiere selenocisteína o cisteína para la catálisis, [11] es parte de la superfamilia NADH oxidasa/flavina reductasa, [12] [13] y elimina el yoduro cuando el sustrato es un solo aminoácido . [14] La investigación sobre la yodotirosina desyodasa ha sido históricamente variable y lenta debido a su falta de estabilidad y su ardua purificación. [15] Solo recientemente se ha estudiado esta enzima con más profundidad. [8]
Estructura

El gen que codifica esta enzima ha sido identificado recientemente. [12] [13] La secuencia de aminoácidos de la yodotirosina desyodasa está altamente conservada entre los mamíferos y contiene tres dominios. [8] La yodotirosina desyodasa es una proteína de membrana , con el extremo N-terminal funcionando como un ancla de membrana. [11] [17] Forma un dímero que tiene dominios intercambiados. [14] Inicialmente, se pensaba que la yodotirosina desyodasa contenía solo un mononucleótido de flavina (FMN) en cada dímero, [18] pero ahora se cree que la yodotirosina desyodasa tiene dos moléculas de FMN para cada homodímero. [14] La enzima tiene un pliegue α-β característico que también tienen todas las proteínas de la superfamilia NADH oxidasa/flavina reductasa. Dentro de la interfaz del dímero, hay dos sitios activos equivalentes , cada uno formado por residuos de ambas subunidades. Por lo tanto, la asociación de subunidades es necesaria para la unión y catálisis de FMN. La unión del sustrato provoca un cambio conformacional en la enzima para cerrar el sitio activo, protegiendo el sustrato y la flavina del solvente. [14]
Función
La yodotirosina desyodasa facilita la recuperación de yodo en la tiroides al catalizar la desyodación de la mono y diyodotirosina , los subproductos halogenados de la producción de la hormona tiroidea . [13] El yoduro también es un micronutriente importante en la biosíntesis de la hormona tiroidea, creando un ciclo de uso de yoduro en la tiroides. [14] La homeostasis del yoduro dentro de la glándula tiroides es esencial para producir hormona tiroidea a tasas apropiadas. Por lo tanto, los niveles de yoduro deben regularse para mantener las hormonas tiroideas, y en última instancia la tasa metabólica y la salud general del organismo, en buen estado. [19]
Dentro de la célula folicular tiroidea, la tiroglobulina se hidroliza para formar hormonas tiroideas y mono- y diyodotirosina. Las hormonas tiroideas se liberan en el torrente sanguíneo y las tirosinas yodadas se reciclan. Sin embargo, la descomposición de la tiroglobulina produce de 6 a 7 veces más tirosinas yodadas que la hormona tiroidea. [8] La yodotirosina desyodasa recupera el yoduro de la desyodación de las tirosinas yodadas. [20] La yodotirosina desyodasa se encuentra en la membrana plasmática apical del coloide tiroideo, donde se producen mono- y diyodotirosina a partir de esta descomposición de la tiroglobulina. Sin la actividad de la yodotirosina desyodasa, el yoduro se excretaría con el aminoácido tirosina y se reduciría la biosíntesis de la hormona tiroidea. [14]
También se sabe que la actividad enzimática de la yodotirosina desyodasa existe en los tejidos del hígado y los riñones; [21] sin embargo, la importancia fisiológica de estos hallazgos aún no está clara. [8]
Mecanismo
La yodotirosina desyodasa cataliza la desyodación de mono- y diyodotirosina. La reacción depende del NADPH . [17] El mononucleótido de flavina (FMN) es un cofactor. [22] Aunque la flavina se utiliza comúnmente en varias reacciones catalíticas, [23] su uso en esta deshalogenación reductora es único y aún no se comprende por completo. [14] Tampoco está claro si el mecanismo enzimático utiliza una reacción de transferencia de dos electrones o una serie de transferencias de un electrón. Aunque se deben realizar más investigaciones para determinar los detalles de este mecanismo, la evidencia reciente parece sugerir que la yodotirosina desyodasa actúa a través de reacciones de transferencia de un electrón. [8]
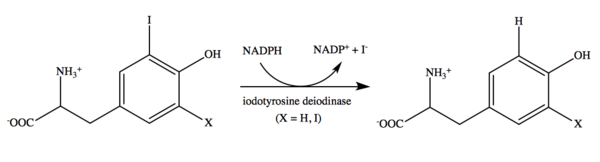
Importancia clínica
Las mutaciones en el gen que codifica la yodotirosina desyodasa pueden afectar la función enzimática y ser perjudiciales para la salud humana. El yoduro es un micronutriente esencial para la salud de los mamíferos. [24] Los niveles bajos de yoduro, ya sea a través de la dieta o a través del metabolismo del yoduro, están asociados con hipotiroidismo , retraso mental, bocio y defectos del desarrollo. [5] [8] [19] Debido a que la yodotirosina desyodasa es responsable de eliminar el yoduro, las mutaciones en esta enzima resultan en deficiencia de yoduro. [25]
Las altas concentraciones de yodotirosina en sangre y orina resultantes se pueden utilizar como medida para el diagnóstico, ya que el yoduro no se elimina de los residuos de tirosina de manera efectiva. [26] En algunos países, se realiza una prueba a los recién nacidos para detectar hipotiroidismo congénito y se los trata de inmediato si se detecta la enfermedad, lo que previene de manera segura el desarrollo de retraso mental. [27] Sin embargo, las mutaciones de la yodotirosina desyodasa a menudo no se detectan hasta que ya se ha producido un daño en el desarrollo. [19] Además, es posible que estas mutaciones no se detecten específicamente utilizando pruebas estándar de la función tiroidea. [19] Para combatir este problema, recientemente se ha creado un ensayo sensible que mide las cantidades de mono y diyodotirosina en la orina. [26]
Véase también
Referencias
- ^ abc GRCh38: Lanzamiento de Ensembl 89: ENSG00000009765 – Ensembl , mayo de 2017
- ^ abc GRCm38: Lanzamiento de Ensembl 89: ENSMUSG00000019762 – Ensembl , mayo de 2017
- ^ "Referencia de PubMed humana:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ "Referencia de PubMed sobre ratón". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ ab Moreno JC, Visser TJ (junio de 2010). "Genética y fenómica del hipotiroidismo y el bocio debido a mutaciones del gen de la yodotirosina desyodasa (DEHAL1)". Endocrinología molecular y celular . 322 (1–2): 91–8. doi :10.1016/j.mce.2010.03.010. PMID 20298747. S2CID 24169254.
- ^ Green WL (agosto de 1968). "Inhibición de la desyodación de yodotirosina tiroidea por análogos de tirosina". Endocrinología . 83 (2): 336–47. doi :10.1210/endo-83-2-336. PMID 5668272.
- ^ Querido A, Stanbury JB, Kassenaar AA, Meijer JW (agosto de 1956). "El metabolismo de las yodotirosinas. III. Actividad deshalogenante de la di-yodotirosina en el tejido tiroideo humano". Revista de endocrinología clínica y metabolismo . 16 (8): 1096–101. doi :10.1210/jcem-16-8-1096. PMID 13345866.
- ^ abcdefghi Rokita SE, Adler JM, McTamney PM, Watson JA (septiembre de 2010). "Uso eficiente y reciclaje del micronutriente yoduro en mamíferos". Biochimie . 92 (9): 1227–35. doi :10.1016/j.biochi.2010.02.013. PMC 2888766 . PMID 20167242.
- ^ Häggblom M, Bossert I (2003). Deshalogenación: procesos microbianos y aplicaciones ambientales . Boston: Kluwer Academic Publishers. pág. 520. ISBN 978-1-4757-7807-6.
- ^ Callebaut I, Curcio-Morelli C, Mornon JP, Gereben B, Buettner C, Huang S, Castro B, Fonseca TL, Harney JW, Larsen PR, Bianco AC (septiembre de 2003). "Las selenodesyodasas de yodotironina son proteínas de la familia de plegamiento de tiorredoxina que contienen una estructura similar a la del clan GH-A de la glicósido hidrolasa". The Journal of Biological Chemistry . 278 (38): 36887–96. doi : 10.1074/jbc.M305725200 . PMID 12847093.
- ^ ab Watson JA, McTamney PM, Adler JM, Rokita SE (marzo de 2008). "La flavoproteína yodotirosina desyodasa funciona sin residuos de cisteína". ChemBioChem . 9 (4): 504–6. doi :10.1002/cbic.200700562. PMID 18228228. S2CID 39353323.
- ^ ab Gnidehou S, Caillou B, Talbot M, Ohayon R, Kaniewski J, Noël-Hudson MS, Morand S, Agnangji D, Sezan A, Courtin F, Virion A, Dupuy C (octubre de 2004). "La yodotirosina dehalogenasa 1 (DEHAL1) es una proteína transmembrana implicada en el reciclaje de yoduro cerca del sitio de yodación de la tiroglobulina". Revista FASEB . 18 (13): 1574–6. doi : 10.1096/fj.04-2023fje . PMID 15289438. S2CID 46192142.
- ^ abc Friedman JE, Watson JA, Lam DW, Rokita SE (febrero de 2006). "La yodotirosina desyodasa es el primer miembro mamífero de la superfamilia de la NADH oxidasa/flavina reductasa". The Journal of Biological Chemistry . 281 (5): 2812–9. doi : 10.1074/jbc.M510365200 . PMID 16316988.
- ^ abcdefg Thomas SR, McTamney PM, Adler JM, Laronde-Leblanc N, Rokita SE (julio de 2009). "Estructura cristalina de la yodotirosina desyodasa, una nueva flavoproteína responsable de la recuperación de yoduro en las glándulas tiroides". The Journal of Biological Chemistry . 284 (29): 19659–67. doi : 10.1074/jbc.M109.013458 . PMC 2740591 . PMID 19436071.
- ^ Rosenberg IN, Goswami A (1 de enero de 1984). "Yodotirosina desyodasa de tiroides bovina". Modificaciones postraduccionales , parte B. Métodos en enzimología. Vol. 107. págs. 488-500. doi :10.1016/0076-6879(84)07033-6. ISBN 9780121820077. PMID 6503724.
- ^ "RCSB PDB - Resultados de la búsqueda". www.rcsb.org . Banco de datos de proteínas del RCSB . Consultado el 1 de marzo de 2016 .[ enlace muerto permanente ]
- ^ ab "Gen Entrez: IYD Iodotirosina desyodasa". Gene Entrez . Biblioteca Nacional de Medicina de los Estados Unidos.
- ^ Rosenberg IN, Goswami A (diciembre de 1979). "Purificación y caracterización de una flavoproteína de tiroides bovina con actividad de yodotirosina desyodasa". The Journal of Biological Chemistry . 254 (24): 12318–25. doi : 10.1016/S0021-9258(19)86318-4 . PMID 500717.
- ^ abcd Moreno JC, Klootwijk W, van Toor H, Pinto G, D'Alessandro M, Lèger A, Goudie D, Polak M, Grüters A, Visser TJ (abril de 2008). "Mutaciones en el gen de la yodotirosina desyodasa e hipotiroidismo". La Revista de Medicina de Nueva Inglaterra . 358 (17): 1811–8. doi : 10.1056/NEJMoa0706819 . PMID 18434651.
- ^ Knobel M, Medeiros-Neto G (agosto de 2003). "Un resumen de los trastornos hereditarios del sistema generador de hormonas tiroideas". Tiroides . 13 (8): 771–801. doi :10.1089/105072503768499671. PMID 14558921.
- ^ Choufoer JC, Kassenaar AA, Querido A (julio de 1960). "El síndrome de hipotiroidismo congénito con deshalogenación defectuosa de yodotirosinas. Observaciones adicionales y un análisis de la fisiopatología". The Journal of Clinical Endocrinology and Metabolism . 20 (7): 983–1003. doi :10.1210/jcem-20-7-983. PMID 13810029.
- ^ Goswami A, Rosenberg IN (diciembre de 1979). "Caracterización de una flavoproteína yodotirosina desyodasa de tiroides bovina. Unión de nucleótidos de flavina y propiedades de oxidación-reducción". The Journal of Biological Chemistry . 254 (24): 12326–30. doi : 10.1016/S0021-9258(19)86319-6 . PMID 500718.
- ^ Mansoorabadi SO, Thibodeaux CJ, Liu HW (agosto de 2007). "Los diversos roles de las coenzimas de flavina: los actores más versátiles de la naturaleza". The Journal of Organic Chemistry . 72 (17): 6329–42. doi :10.1021/jo0703092. PMC 2519020 . PMID 17580897.
- ^ Eastman CJ, Zimmermann M (1 de enero de 2000). De Groot LJ, Beck-Peccoz P, Chrousos G, Dungan K, Grossman A, Hershman JM, Koch C, McLachlan R, New M (eds.). Trastornos por deficiencia de yodo. South Dartmouth (MA): MDText.com, Inc. PMID 25905411.
- ^ Lever EG, Medeiros-Neto GA, DeGroot LJ (1983). "Trastornos hereditarios del metabolismo tiroideo". Endocrine Reviews . 4 (3): 213–39. doi :10.1210/edrv-4-3-213. PMID 6354701.
- ^ ab Afink G, Kulik W, Overmars H, de Randamie J, Veenboer T, van Cruchten A, Craen M, Ris-Stalpers C (diciembre de 2008). "Caracterización molecular de la deficiencia de yodotirosina deshalogenasa en pacientes con hipotiroidismo". The Journal of Clinical Endocrinology and Metabolism . 93 (12): 4894–901. doi : 10.1210/jc.2008-0865 . PMID 18765512.
- ^ New England congenital hypothyroidism collaborative (noviembre de 1981). "Efectos del cribado neonatal del hipotiroidismo: prevención del retraso mental mediante el tratamiento antes de las manifestaciones clínicas". Lancet . 2 (8255): 1095–8. doi :10.1016/s0140-6736(81)91287-3. PMID 6118534. S2CID 44605217.
Lectura adicional
- Moreno JC (2003). "Identificación de nuevos genes implicados en el hipotiroidismo congénito mediante análisis seriado de la expresión génica". Hormone Research . 60 Suppl 3 (3): 96–102. doi :10.1159/000074509. PMID 14671405. S2CID 11397819.
- Afink G, Kulik W, Overmars H, de Randamie J, Veenboer T, van Cruchten A, Craen M, Ris-Stalpers C (diciembre de 2008). "Caracterización molecular de la deficiencia de yodotirosina deshalogenasa en pacientes con hipotiroidismo". The Journal of Clinical Endocrinology and Metabolism . 93 (12): 4894–901. doi : 10.1210/jc.2008-0865 . PMID 18765512.
- Gieger C, Geistlinger L, Altmaier E, Hrabé de Angelis M, Kronenberg F, Meitinger T, Mewes HW, Wichmann HE, Weinberger KM, Adamski J, Illig T, Suhre K (noviembre de 2008). Gibson G (ed.). "La genética se encuentra con la metabolómica: un estudio de asociación de todo el genoma de los perfiles de metabolitos en el suero humano". PLOS Genética . 4 (11): e1000282. doi : 10.1371/journal.pgen.1000282 . PMC 2581785 . PMID 19043545.
- Thomas SR, McTamney PM, Adler JM, Laronde-Leblanc N, Rokita SE (julio de 2009). "Estructura cristalina de la yodotirosina desyodasa, una nueva flavoproteína responsable de la recuperación de yoduro en las glándulas tiroides". The Journal of Biological Chemistry . 284 (29): 19659–67. doi : 10.1074/jbc.M109.013458 . PMC 2740591 . PMID 19436071.
- Krause K, Karger S, Gimm O, Sheu SY, Dralle H, Tannapfel A, Schmid KW, Dupuy C, Fuhrer D (marzo de 2007). "Caracterización de la expresión de DEHAL1 en patologías tiroideas". Revista Europea de Endocrinología . 156 (3): 295–301. doi : 10.1530/EJE-06-0596 . PMID 17322488.
- Gnidehou S, Lacroix L, Sezan A, Ohayon R, Noël-Hudson MS, Morand S, Francon J, Courtin F, Virion A, Dupuy C (agosto de 2006). "Clonación y caracterización de una nueva isoforma de la yodotirosina deshalogenasa 1 (DEHAL1) DEHAL1C de la tiroides humana: comparaciones con DEHAL1 y DEHAL1B". Tiroides . 16 (8): 715–24. doi :10.1089/thy.2006.16.715. PMID 16910871.
- Otowa T, Yoshida E, Sugaya N, Yasuda S, Nishimura Y, Inoue K, Tochigi M, Umekage T, Miyagawa T, Nishida N, Tokunaga K, Tanii H, Sasaki T, Kaiya H, Okazaki Y (febrero de 2009). "Estudio de asociación de todo el genoma del trastorno de pánico en la población japonesa". Revista de genética humana . 54 (2): 122–6. doi : 10.1038/jhg.2008.17 . PMID 19165232.
Enlaces externos
- Yodotirosina + desyodasa en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Resumen de toda la información estructural disponible en el PDB para UniProt : Q6PHW0 (Human Iodotyrosine deyodinase 1) en el PDBe-KB .
- Resumen de toda la información estructural disponible en el PDB para UniProt : Q9DCX8 (Mouse Iodotyrosine deyodasa 1) en PDBe-KB .
Este artículo incorpora texto de la Biblioteca Nacional de Medicina de los Estados Unidos , que se encuentra en el dominio público .






