Diseleniuro de difenilo
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC 1,1′-Diselanediildibenceno | |
| Otros nombres Diseleniuro de fenilo | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Araña química | |
| Tarjeta informativa de la ECHA | 100.015.256 |
| Número CE |
|
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C12H10Se2 | |
| Masa molar | 312,154 g·mol −1 |
| Apariencia | Cristales amarillos |
| Densidad | 1,84 g/ cm3 |
| Punto de fusión | 59 a 61 °C (138 a 142 °F; 332 a 334 K) |
| Insoluble | |
| Solubilidad en otros disolventes | Diclorometano , THF , hexano caliente |
| Estructura | |
| 90° en Se [ cita requerida ] Simetría C 2 [ cita requerida ] | |
| 0 D | |
| Peligros | |
| Etiquetado SGA : | |
   | |
| Peligro | |
| H301 , H331 , H373 , H410 | |
| P260 , P261 , P264 , P270 , P271 , P273 , P301+P310 , P304+P340 , P311 , P314 , P321 , P330 , P391 , P403+P233 , P405 , P501 | |
| Compuestos relacionados | |
Compuestos relacionados | Ph2S2 , C6H5SeH |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El diseleniuro de difenilo es un compuesto químico con la fórmula (C 6 H 5 ) 2 Se 2 , abreviado Ph 2 Se 2 . Este sólido de color amarillo es el derivado oxidado del bencenoselenol . Se utiliza como fuente de la unidad PhSe en la síntesis orgánica .
Preparación y propiedades
El Ph 2 Se 2 se prepara mediante la oxidación del bencenoselenoato, la base conjugada del bencenoselenol que se genera a través del reactivo de Grignard : [1]
La molécula tiene una simetría C2 idealizada , como el peróxido de hidrógeno y moléculas relacionadas. La longitud del enlace Se-Se es de 2,29 Å, el ángulo diedro C-Se-Se-C es de 82° y los ángulos C-Se-Se son cercanos a 110°. [2]
Aplicaciones médicas
El diseleniuro de difenilo alivia el envenenamiento por metilmercurio en la carpa herbívora . [3]
Reacciones
Una reacción característica del Ph 2 Se 2 es su reducción:
- Ph2Se2 + 2Na → 2 PhSeNa
El PhSeNa es un nucleófilo útil que se utiliza para introducir el grupo fenilselenilo mediante sustitución nucleofílica de haluros de alquilo , sulfonatos de alquilo ( mesilatos o tosilatos ) y epóxidos . El ejemplo que se muestra a continuación se tomó de una síntesis de morfina. [4]
Otra reacción característica es la cloración :
- Ph2Se2 + Cl2 → 2 PhSeCl
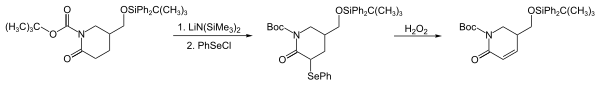
El PhSeCl es un potente electrófilo que se utiliza para introducir grupos PhSe mediante la reacción con una variedad de nucleófilos, incluidos enolatos , éteres de enol sililo , reactivos de Grignard , reactivos de organolitio , alquenos y aminas . En la secuencia siguiente (primeros pasos en la síntesis de estricnofolina), se introduce un grupo PhSe mediante la reacción de un enolato de lactama con PhSeCl. [5] Esta secuencia es un método poderoso para la conversión de compuestos carbonílicos en sus análogos α,β-insaturados. [6]
El propio diselenuro de difenilo también es una fuente de un grupo PhSe débilmente electrofílico en reacciones con nucleófilos relativamente potentes como reactivos de Grignard, reactivos de litio y enolatos de éster (pero no enolatos de cetona o nucleófilos más débiles). El PhSeCl es más reactivo y más eficiente, ya que con Ph2Se2 se desperdicia la mitad del selenio .
- Ph 2 Se 2 + Nu − → PhSeNu + PhSe −
Se puede utilizar N -fenilselenoftalimida (N-PSP) si el PhSeCl es demasiado fuerte y el diselenuro de difenilo es demasiado débil o derrochador. [7]
Referencias
- ^ Reich, HJ; Cohen, ML; Clark, PS (1979). "Reactivos para la síntesis de compuestos de organoselenio: diseluro de difenilo y cloruro de bencenoselenilo". Organic Syntheses . 59 : 141; Volúmenes recopilados , vol. 6, pág. 533.
- ^ Marsh, RE (1952). "La estructura cristalina del diseluro de difenilo". Acta Crystallographica . 5 (4): 458–462. doi : 10.1107/S0365110X52001349 .
- ^ Baldissera, Matheus D.; Souza, Carine F.; da Silva, Aleksandro S.; Henn, Alessandra S.; Flores, Erico MM; Baldisserotto, Bernardo (2020). "La suplementación dietética con diseleniuro de difenilo alivia el deterioro del comportamiento y el daño cerebral en la carpa herbívora (Ctenopharyngodon idella) expuesta al cloruro de metilmercurio". Comparative Biochemistry and Physiology. Toxicology & Pharmacology . 229 : 108674. doi :10.1016/j.cbpc.2019.108674. ISSN 1532-0456. PMID 31760078. S2CID 208274623.
- ^ Taber, DF; Neubert, TD; Rheingold, AL (2002). "Síntesis de (−)-morfina". Revista de la Sociedad Química Estadounidense . 124 (42): 12416–12417. doi :10.1021/ja027882h. PMID 12381175.
- ^ Lerchner, A.; Carreira, EM (2002). "Primera síntesis total de (±)-estricnofolina mediante una reacción de expansión de anillo altamente selectiva". Revista de la Sociedad Química Estadounidense . 124 (50): 14826–14827. doi :10.1021/ja027906k. PMID 12475306.
- ^ Reich, HJ; Wollowitz, S. (1993). "Preparación de compuestos carbonílicos α,β-insaturados y nitrilos mediante eliminación de selenóxido". Organic Reactions . 44 : 1–296. doi :10.1002/0471264180.or044.01. ISBN 0471264180.
- ^ Barrero, AF; Álvarez-Manzaneda, EJ; Chahboun, R.; Cortés, M.; Armstrong, V. (1999). "Síntesis y actividad antitumoral de puupehediona y compuestos relacionados". Tetraedro . 55 (52): 15181–15208. doi :10.1016/S0040-4020(99)00992-8.