Inflamación
This article needs more reliable medical references for verification or relies too heavily on primary sources. (March 2021) |
| Inflamación | |
|---|---|
 | |
| Una reacción alérgica al cefaclor ha provocado una inflamación de la piel del pie. Los signos cardinales de la inflamación incluyen: dolor, calor, enrojecimiento, hinchazón y pérdida de función. Algunos de estos indicadores se pueden ver aquí. | |
| Especialidad | Inmunología , reumatología |
| Síntomas | Calor, dolor, enrojecimiento, hinchazón. |
| Complicaciones | Asma , neumonía , enfermedades autoinmunes. |
| Duración | Aguda : pocos días. Crónica : hasta muchos meses o años. |
| Causas | Infección, lesión física , trastorno autoinmune. |
La inflamación (del latín : inflammatio ) es parte de la respuesta biológica de los tejidos corporales a estímulos dañinos, como patógenos , células dañadas o irritantes . [1] [2] Los cinco signos cardinales son calor, dolor, enrojecimiento, hinchazón y pérdida de función (del latín calor , dolor , rubor , tumor y functio laesa ).
La inflamación es una respuesta genérica y, por lo tanto, se considera un mecanismo de inmunidad innata , mientras que la inmunidad adaptativa es específica de cada patógeno. [3]
La inflamación es una respuesta protectora que involucra células inmunes , vasos sanguíneos y mediadores moleculares. La función de la inflamación es eliminar la causa inicial de la lesión celular, limpiar las células y tejidos dañados e iniciar la reparación tisular. Una inflamación demasiado escasa podría conducir a la destrucción progresiva del tejido por el estímulo dañino (por ejemplo, bacterias) y comprometer la supervivencia del organismo. Sin embargo, la inflamación también puede tener efectos negativos. [4] Demasiada inflamación, en forma de inflamación crónica, se asocia con varias enfermedades, como la fiebre del heno , la enfermedad periodontal , la aterosclerosis y la osteoartritis .
La inflamación puede clasificarse como aguda o crónica . La inflamación aguda es la respuesta inicial del cuerpo a estímulos nocivos y se logra mediante el aumento del movimiento de plasma y leucocitos (en particular granulocitos ) desde la sangre hacia los tejidos lesionados. Una serie de eventos bioquímicos propaga y madura la respuesta inflamatoria, involucrando el sistema vascular local , el sistema inmunológico y varias células en el tejido lesionado. La inflamación prolongada, conocida como inflamación crónica , conduce a un cambio progresivo en el tipo de células presentes en el sitio de la inflamación, como las células mononucleares , e implica la destrucción y curación simultáneas del tejido.
La inflamación también se ha clasificado como tipo 1 y tipo 2 según el tipo de citocinas y células T auxiliares (Th1 y Th2) implicadas. [5]
Significado
La primera referencia conocida del término inflamación data de principios del siglo XV. La raíz de la palabra proviene del francés antiguo inflammation , que data del siglo XIV, y que a su vez proviene del latín inflammatio o inflammem . Literalmente, el término se relaciona con la palabra "llama", como la propiedad de "prenderse fuego" o "quemarse". [6]
El término inflamación no es sinónimo de infección . La infección describe la interacción entre la acción de la invasión microbiana y la reacción de la respuesta inflamatoria del cuerpo: los dos componentes se consideran juntos en la discusión de la infección, y la palabra se utiliza para implicar una causa invasiva microbiana para la reacción inflamatoria observada. La inflamación , por otro lado, describe solo la respuesta inmunovascular del cuerpo, independientemente de la causa. Pero, debido a que los dos a menudo están correlacionados , las palabras que terminan en el sufijo -itis (que significa inflamación) a veces se describen informalmente como una referencia a la infección: por ejemplo, la palabra uretritis significa estrictamente solo "inflamación uretral", pero los proveedores de atención médica clínica generalmente discuten la uretritis como una infección uretral porque la invasión microbiana uretral es la causa más común de uretritis. Sin embargo, la distinción entre inflamación e infección es crucial en situaciones de patología y diagnóstico médico que involucran inflamación que no es impulsada por invasión microbiana, como casos de aterosclerosis , trauma , isquemia y enfermedades autoinmunes (incluida la hipersensibilidad tipo III ).
Causas
- Quemaduras [7]
- Congelación
- Lesión física , contundente o penetrante [8]
- Cuerpos extraños, incluidas astillas , suciedad y residuos.
- Trauma [7]
- Radiación ionizante
Biológico:
- Infección por patógenos [7]
- Reacciones inmunes por hipersensibilidad
- Estrés
Químico: [7]
- Irritantes químicos
- Toxinas
- Alcohol
Psicológico:
- Emoción [9]
Tipos
|
| Agudo | Crónico | |
|---|---|---|
| Agente causal | Patógenos bacterianos, tejidos lesionados | Inflamación aguda persistente debida a patógenos no degradables, infección viral, cuerpos extraños persistentes o reacciones autoinmunes. |
| Principales células implicadas | neutrófilos (principalmente), basófilos (respuesta inflamatoria) y eosinófilos (respuesta a helmintos y parásitos), células mononucleares (monocitos, macrófagos) | Células mononucleares (monocitos, macrófagos, linfocitos, células plasmáticas), fibroblastos |
| Mediadores primarios | Aminas vasoactivas, eicosanoides | IFN-γ y otras citocinas, factores de crecimiento, especies reactivas de oxígeno, enzimas hidrolíticas |
| Comienzo | Inmediato | Demorado |
| Duración | Pocos días | Hasta muchos meses o años |
| Resultados | Resolución, formación de abscesos, inflamación crónica. | Destrucción de tejidos, fibrosis, necrosis. |
Agudo
La inflamación aguda es un proceso de corta duración, que suele aparecer en unos minutos u horas y comienza a cesar cuando se elimina el estímulo nocivo. [10] Implica una respuesta de movilización sistémica y coordinada a nivel local de varios mediadores inmunitarios, endocrinos y neurológicos de la inflamación aguda. En una respuesta sana normal, se activa, elimina el patógeno y comienza un proceso de reparación para luego cesar. [11]
La inflamación aguda se produce inmediatamente después de la lesión y dura solo unos días. [12] Las citocinas y las quimiocinas promueven la migración de neutrófilos y macrófagos al sitio de la inflamación. [12] Los patógenos, los alérgenos, las toxinas, las quemaduras y la congelación son algunas de las causas típicas de la inflamación aguda. [12] Los receptores tipo Toll (TLR) reconocen patógenos microbianos. [12] La inflamación aguda puede ser un mecanismo defensivo para proteger los tejidos contra las lesiones. [12] La inflamación que dura de 2 a 6 semanas se denomina inflamación subaguda. [12] [13]
Signos cardinales
| Inglés | latín |
|---|---|
| Enrojecimiento | Rubor |
| Hinchazón | Tumor |
| Calor | Calor |
| Dolor | Dolor |
| Pérdida de función | Función laesa [b] |
La inflamación se caracteriza por cinco signos cardinales , [16] [17] (cuyos nombres tradicionales provienen del latín):
- Dolor ( dolor )
- Calor (calor)
- Rubor (enrojecimiento)
- Tumor ( hinchazón )
- Functio laesa (pérdida de función) [18]
Los primeros cuatro (signos clásicos) fueron descritos por Celso ( c. 30 a. C. – 38 d. C.). [19]
El dolor se debe a la liberación de sustancias químicas como la bradicinina y la histamina que estimulan las terminaciones nerviosas. [16] (La inflamación aguda del pulmón (generalmente como respuesta a una neumonía ) no causa dolor a menos que la inflamación afecte la pleura parietal , que tiene terminaciones nerviosas sensibles al dolor . [16] ) El calor y el enrojecimiento se deben al aumento del flujo sanguíneo a la temperatura corporal central hacia el sitio inflamado. La hinchazón es causada por la acumulación de líquido.
Pérdida de función
Se cree que el quinto signo, la pérdida de función , fue añadido posteriormente por Galeno , [20] Thomas Sydenham [21] o Rudolf Virchow . [10] [16] [17] Los ejemplos de pérdida de función incluyen dolor que inhibe la movilidad, hinchazón severa que impide el movimiento, tener un peor sentido del olfato durante un resfriado o tener dificultad para respirar cuando hay bronquitis. [22] [23] La pérdida de función tiene múltiples causas. [16]
Proceso agudo
This section needs more reliable medical references for verification or relies too heavily on primary sources. (April 2023) |


El proceso de inflamación aguda es iniciado por células inmunes residentes ya presentes en el tejido involucrado, principalmente macrófagos residentes , células dendríticas , histiocitos , células de Kupffer y mastocitos . Estas células poseen receptores de superficie conocidos como receptores de reconocimiento de patrones (PRR), que reconocen (es decir, se unen) a dos subclases de moléculas: patrones moleculares asociados a patógenos (PAMP) y patrones moleculares asociados a daños (DAMP). Los PAMP son compuestos que están asociados con varios patógenos , pero que son distinguibles de las moléculas del huésped. Los DAMP son compuestos que están asociados con lesiones relacionadas con el huésped y daño celular.
Al inicio de una infección, quemadura u otras lesiones, estas células experimentan una activación (uno de los PRR reconoce un PAMP o DAMP) y liberan mediadores inflamatorios responsables de los signos clínicos de inflamación. La vasodilatación y el aumento del flujo sanguíneo resultante provocan el enrojecimiento ( rubor ) y el aumento del calor ( calor ). El aumento de la permeabilidad de los vasos sanguíneos da como resultado una exudación (fuga) de proteínas plasmáticas y líquido en el tejido ( edema ), que se manifiesta como hinchazón ( tumor ). Algunos de los mediadores liberados, como la bradicinina, aumentan la sensibilidad al dolor ( hiperalgesia , dolor ). Las moléculas mediadoras también alteran los vasos sanguíneos para permitir la migración de leucocitos, principalmente neutrófilos y macrófagos , para fluir fuera de los vasos sanguíneos (extravasación) y hacia el tejido. Los neutrófilos migran a lo largo de un gradiente quimiotáctico creado por las células locales para alcanzar el sitio de la lesión. [10] La pérdida de función ( functio laesa ) es probablemente el resultado de un reflejo neurológico en respuesta al dolor.
Además de los mediadores derivados de las células, varios sistemas de cascada bioquímica acelular (que consisten en proteínas plasmáticas preformadas) actúan en paralelo para iniciar y propagar la respuesta inflamatoria. Entre ellos se incluyen el sistema del complemento activado por bacterias y los sistemas de coagulación y fibrinólisis activados por necrosis (p. ej., quemaduras, traumatismos). [10]
La inflamación aguda puede considerarse la primera línea de defensa contra las lesiones. La respuesta inflamatoria aguda requiere una estimulación constante para mantenerse. Los mediadores inflamatorios tienen una vida corta y se degradan rápidamente en el tejido. Por lo tanto, la inflamación aguda comienza a cesar una vez que se elimina el estímulo. [10]
Crónico
La inflamación crónica es una inflamación que dura meses o años. [13] Los macrófagos, linfocitos y células plasmáticas predominan en la inflamación crónica, en contraste con los neutrófilos que predominan en la inflamación aguda. [13] La diabetes , las enfermedades cardiovasculares , las alergias y la enfermedad pulmonar obstructiva crónica (EPOC) son ejemplos de enfermedades mediadas por la inflamación crónica. [13] La obesidad , el tabaquismo, el estrés y la dieta insuficiente son algunos de los factores que promueven la inflamación crónica. [13] Un estudio de 2014 informó que el 60% de los estadounidenses tenían al menos una condición inflamatoria crónica y el 42% tenía más de una. [13]
Signos cardinales
Los signos y síntomas comunes que se desarrollan durante la inflamación crónica son: [13]
- Dolor corporal, artralgia, mialgia.
- Fatiga crónica e insomnio
- Depresión, ansiedad y trastornos del estado de ánimo
- Complicaciones gastrointestinales como estreñimiento, diarrea y reflujo ácido.
- Aumento o pérdida de peso
- Infecciones frecuentes
Componente vascular
This section needs more reliable medical references for verification or relies too heavily on primary sources. (March 2021) |
Vasodilatación y aumento de la permeabilidad.
Según la definición, la inflamación aguda es una respuesta inmunovascular a estímulos inflamatorios, que pueden incluir infección o trauma. [25] [26] Esto significa que la inflamación aguda se puede dividir en términos generales en una fase vascular que ocurre primero, seguida de una fase celular que involucra células inmunes (más específicamente granulocitos mieloides en el contexto agudo). [25] El componente vascular de la inflamación aguda implica el movimiento del líquido plasmático , que contiene proteínas importantes como fibrina e inmunoglobulinas ( anticuerpos ), hacia el tejido inflamado.
Al entrar en contacto con los PAMP, los macrófagos tisulares y los mastocitos liberan aminas vasoactivas como la histamina y la serotonina , así como eicosanoides como la prostaglandina E2 y el leucotrieno B4 para remodelar la vasculatura local. [27] Los macrófagos y las células endoteliales liberan óxido nítrico . [28] Estos mediadores vasodilatan y permeabilizan los vasos sanguíneos , lo que da como resultado la distribución neta del plasma sanguíneo desde el vaso hacia el espacio tisular. La mayor acumulación de líquido en el tejido hace que se hinche ( edema ). [27] Este líquido tisular exudado contiene varios mediadores antimicrobianos del plasma, como el complemento , la lisozima y los anticuerpos , que pueden dañar inmediatamente a los microbios y opsonizarlos en preparación para la fase celular. Si el estímulo inflamatorio es una herida lacerante, las plaquetas exudadas , los coagulantes , la plasmina y las cininas pueden coagular el área herida utilizando mecanismos dependientes de la vitamina K [29] y proporcionar hemostasia en primera instancia. Estos mediadores de la coagulación también proporcionan un marco de estadificación estructural en el sitio del tejido inflamatorio en forma de una red de fibrina , como lo haría el andamiaje de construcción en un sitio de construcción, con el fin de ayudar al desbridamiento fagocítico y la reparación de la herida más adelante. Parte del líquido tisular exudado también es canalizado por los vasos linfáticos a los ganglios linfáticos regionales, arrastrando bacterias para iniciar la fase de reconocimiento y ataque del sistema inmunológico adaptativo .

La inflamación aguda se caracteriza por cambios vasculares marcados, incluyendo vasodilatación , aumento de la permeabilidad y aumento del flujo sanguíneo, que son inducidos por las acciones de varios mediadores inflamatorios. [27] La vasodilatación ocurre primero a nivel de las arteriolas , progresando al nivel capilar , y produce un aumento neto en la cantidad de sangre presente, causando el enrojecimiento y el calor de la inflamación. El aumento de la permeabilidad de los vasos da como resultado el movimiento del plasma hacia los tejidos, con estasis resultante debido al aumento en la concentración de las células dentro de la sangre, una condición caracterizada por vasos agrandados llenos de células. La estasis permite que los leucocitos marginen (se muevan) a lo largo del endotelio , un proceso crítico para su reclutamiento en los tejidos. El flujo normal de sangre evita esto, ya que la fuerza de corte a lo largo de la periferia de los vasos mueve las células en la sangre hacia el medio del vaso.
Sistemas de cascada de plasma
- El sistema del complemento , cuando se activa, crea una cascada de reacciones químicas que promueven la opsonización , la quimiotaxis y la aglutinación , y producen el MAC .
- El sistema cinina genera proteínas capaces de sostener la vasodilatación y otros efectos inflamatorios físicos.
- El sistema de coagulación o cascada de coagulación , que forma una malla proteica protectora sobre los sitios de lesión.
- El sistema de fibrinólisis , que actúa en oposición al sistema de coagulación , para contrarrestar la coagulación y generar varios otros mediadores inflamatorios.
Mediadores derivados del plasma
* lista no exhaustiva
| Nombre | Producido por | Descripción |
|---|---|---|
| bradicinina | Sistema de kininas | Una proteína vasoactiva que puede inducir vasodilatación, aumentar la permeabilidad vascular, provocar la contracción del músculo liso e inducir dolor. |
| C3 | Sistema del complemento | Se escinde para producir C3a y C3b . C3a estimula la liberación de histamina por los mastocitos, lo que produce vasodilatación. C3b es capaz de unirse a las paredes celulares bacterianas y actuar como una opsonina , que marca al invasor como objetivo para la fagocitosis . |
| C5a | Sistema del complemento | Estimula la liberación de histamina por los mastocitos, lo que produce vasodilatación. También es capaz de actuar como quimioatrayente para dirigir las células mediante quimiotaxis al sitio de la inflamación. |
| Factor XII ( Factor Hageman ) | Hígado | Proteína que circula de forma inactiva hasta que es activada por el colágeno, las plaquetas o las membranas basales expuestas mediante un cambio conformacional . Cuando se activa, a su vez es capaz de activar tres sistemas plasmáticos implicados en la inflamación: el sistema de cininas, el sistema de fibrinólisis y el sistema de coagulación. |
| Complejo de ataque de membrana | Sistema del complemento | Un complejo de las proteínas del complemento C5b , C6 , C7 , C8 y múltiples unidades de C9 . La combinación y activación de esta gama de proteínas del complemento forma el complejo de ataque a la membrana , que es capaz de insertarse en las paredes celulares bacterianas y provocar la lisis celular con la consiguiente muerte bacteriana. |
| Plasmina | Sistema de fibrinólisis | Capaz de romper coágulos de fibrina, escindir la proteína del complemento C3 y activar el factor XII. |
| Trombina | Sistema de coagulación | Escinde la proteína plasmática soluble fibrinógeno para producir fibrina insoluble , que se agrega para formar un coágulo sanguíneo . La trombina también puede unirse a las células a través del receptor PAR1 para desencadenar otras respuestas inflamatorias, como la producción de quimiocinas y óxido nítrico . |
Componente celular
El componente celular involucra leucocitos , que normalmente residen en la sangre y deben moverse hacia el tejido inflamado a través de extravasación para ayudar en la inflamación. [25] Algunos actúan como fagocitos , ingiriendo bacterias, virus y restos celulares. Otros liberan gránulos enzimáticos que dañan a los invasores patógenos. Los leucocitos también liberan mediadores inflamatorios que desarrollan y mantienen la respuesta inflamatoria. En general, la inflamación aguda está mediada por granulocitos , mientras que la inflamación crónica está mediada por células mononucleares como monocitos y linfocitos .
Extravasación de leucocitos

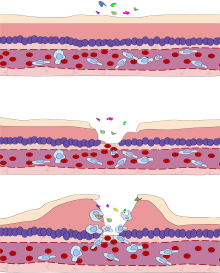
Diversos leucocitos , en particular los neutrófilos, participan de manera crítica en el inicio y el mantenimiento de la inflamación. Estas células deben poder desplazarse al lugar de la lesión desde su ubicación habitual en la sangre, por lo que existen mecanismos para reclutar y dirigir a los leucocitos al lugar apropiado. El proceso de movimiento de los leucocitos desde la sangre hasta los tejidos a través de los vasos sanguíneos se conoce como extravasación y puede dividirse en varios pasos:
- Marginación leucocitaria y adhesión endotelial: Los glóbulos blancos dentro de los vasos, que generalmente están ubicados centralmente, se mueven periféricamente hacia las paredes de los vasos. [30] Los macrófagos activados en el tejido liberan citocinas como IL-1 y TNFα , lo que a su vez conduce a la producción de quimiocinas que se unen a los proteoglicanos formando gradiente en el tejido inflamado y a lo largo de la pared endotelial . [27] Las citocinas inflamatorias inducen la expresión inmediata de P-selectina en las superficies de las células endoteliales y la P-selectina se une débilmente a los ligandos de carbohidratos en la superficie de los leucocitos y hace que "rueden" a lo largo de la superficie endotelial a medida que se crean y se rompen los enlaces. Las citocinas liberadas de las células lesionadas inducen la expresión de E-selectina en las células endoteliales, que funciona de manera similar a la P-selectina. Las citocinas también inducen la expresión de ligandos de integrina como ICAM-1 y VCAM-1 en las células endoteliales, que median la adhesión y frenan aún más la acción de los leucocitos. Estos leucocitos débilmente unidos pueden desprenderse si no son activados por las quimiocinas producidas en el tejido lesionado después de la transducción de señales a través de los respectivos receptores acoplados a la proteína G que activan las integrinas en la superficie de los leucocitos para lograr una adhesión firme. Dicha activación aumenta la afinidad de los receptores de integrina unidos por ICAM-1 y VCAM-1 en la superficie de las células endoteliales, uniendo firmemente los leucocitos al endotelio.
- Migración a través del endotelio, conocida como transmigración, a través del proceso de diapédesis : los gradientes de quimiocinas estimulan a los leucocitos adheridos a moverse entre células endoteliales adyacentes. Las células endoteliales se retraen y los leucocitos pasan a través de la membrana basal hacia el tejido circundante utilizando moléculas de adhesión como ICAM-1. [30]
- Movimiento de los leucocitos dentro del tejido mediante quimiotaxis : los leucocitos que llegan al intersticio tisular se unen a las proteínas de la matriz extracelular a través de las integrinas expresadas y CD44 para evitar que abandonen el sitio. Una variedad de moléculas se comportan como quimioatrayentes , por ejemplo, C3a o C5a (las anafilatoxinas ), y hacen que los leucocitos se muevan a lo largo de un gradiente quimiotáctico hacia la fuente de la inflamación.
Fagocitosis
Los neutrófilos extravasados en la fase celular entran en contacto con los microbios en el tejido inflamado. Los fagocitos expresan receptores de reconocimiento de patrones endocíticos (PRR) de superficie celular que tienen afinidad y eficacia contra patrones moleculares asociados a microbios (PAMP) no específicos . La mayoría de los PAMP que se unen a los PRR endocíticos e inician la fagocitosis son componentes de la pared celular, incluidos carbohidratos complejos como mananos y β- glucanos , lipopolisacáridos (LPS), peptidoglicanos y proteínas de superficie. Los PRR endocíticos en los fagocitos reflejan estos patrones moleculares, con receptores de lectina de tipo C que se unen a mananos y β-glucanos, y receptores carroñeros que se unen a LPS.
Tras la unión endocítica del PRR, se produce un reordenamiento del citoesqueleto de actina - miosina adyacente a la membrana plasmática de forma que se endocitosa la membrana plasmática que contiene el complejo PRR-PAMP y el microbio. Se ha implicado a las vías de señalización del fosfatidilinositol y Vps34 - Vps15 - Beclin1 en el tráfico del fagosoma endocitado a los lisosomas intracelulares , donde la fusión del fagosoma y el lisosoma produce un fagolisosoma. Las especies reactivas de oxígeno , los superóxidos y el blanqueador de hipoclorito dentro de los fagolisosomas matan a los microbios dentro del fagocito.
La eficacia fagocítica puede mejorarse mediante la opsonización . El complemento C3b derivado del plasma y los anticuerpos que exudan en el tejido inflamado durante la fase vascular se unen a los antígenos microbianos y los recubren. Además de los PRR endocíticos, los fagocitos también expresan receptores de opsonina , el receptor Fc y el receptor 1 del complemento (CR1), que se unen a los anticuerpos y al C3b, respectivamente. La coestimulación del PRR endocítico y del receptor de opsonina aumenta la eficacia del proceso fagocítico, mejorando la eliminación lisosomal del agente infeccioso.
Mediadores derivados de células
* lista no exhaustiva
| Nombre | Tipo | Fuente | Descripción |
|---|---|---|---|
| Gránulos de lisosoma | Enzimas | Granulocitos | Estas células contienen una gran variedad de enzimas que realizan diversas funciones. Los gránulos pueden clasificarse como específicos o azurófilos según su contenido y son capaces de descomponer diversas sustancias, algunas de las cuales pueden ser proteínas derivadas del plasma que permiten que estas enzimas actúen como mediadores inflamatorios. |
| FEC-GM | Glicoproteína | Macrófagos, monocitos, células T, células B y células residentes en los tejidos. | Se ha demostrado que el GM-CSF elevado contribuye a la inflamación en la artritis inflamatoria , la osteoartritis , la colitis, el asma , la obesidad y la COVID-19 . |
| Histamina | Monoamina | Mastocitos y basófilos | La histamina, almacenada en gránulos preformados, se libera en respuesta a una serie de estímulos y provoca dilatación de las arteriolas , aumento de la permeabilidad venosa y una amplia variedad de efectos específicos en los órganos. |
| IFN-γ | Citocina | Células T, células NK | Propiedades antivirales, inmunorreguladoras y antitumorales. Este interferón se denominó originalmente factor activador de macrófagos y es especialmente importante en el mantenimiento de la inflamación crónica. |
| IL-6 | Citocina y miocina | Macrófagos, osteoblastos, adipocitos y células musculares lisas (citocinas) Células musculares esqueléticas (miocinas) | Citocina proinflamatoria secretada por macrófagos en respuesta a patrones moleculares asociados a patógenos (PAMP); citocina proinflamatoria secretada por adipocitos, especialmente en la obesidad; miocina antiinflamatoria secretada por células del músculo esquelético en respuesta al ejercicio. |
| IL-8 | Quimiocina | Principalmente macrófagos | Activación y quimioatracción de neutrófilos, con débil efecto sobre monocitos y eosinófilos. |
| Leucotrieno B4 | Eicosanoide | Leucocitos , células cancerosas | Es capaz de mediar la adhesión y activación de los leucocitos, lo que les permite unirse al endotelio y migrar a través de él. En los neutrófilos, también es un potente quimioatrayente y es capaz de inducir la formación de especies reactivas de oxígeno y la liberación de enzimas lisosomales por parte de estas células. |
| LTC4 , LTD4 | Eicosanoide | eosinófilos , mastocitos , macrófagos | Estos tres leucotrienos que contienen cisteína contraen las vías respiratorias pulmonares, aumentan la permeabilidad microvascular, estimulan la secreción de moco y promueven la inflamación basada en eosinófilos en los pulmones, la piel, la nariz, los ojos y otros tejidos. |
| Ácido 5-oxo-eicosatetraenoico | Eicosanoide | Leucocitos , células cancerosas | Potente estimulador de la quimiotaxis de neutrófilos, liberación de enzimas lisosómicas y formación de especies reactivas de oxígeno; quimiotaxis de monocitos; y con mayor potencia aún, quimiotaxis de eosinófilos, liberación de enzimas lisosómicas y formación de especies reactivas de oxígeno. |
| 5-Hete | Eicosanoide | Leucocitos | Precursor metabólico del ácido 5-oxo-eicosatetraenoico, es un estimulador menos potente de la quimiotaxis de los neutrófilos, la liberación de enzimas de los lisosomas y la formación de especies reactivas de oxígeno; la quimiotaxis de los monocitos; y la quimiotaxis de los eosinófilos, la liberación de enzimas de los lisosomas y la formación de especies reactivas de oxígeno. |
| Prostaglandinas | Eicosanoide | Mastocitos | Un grupo de lípidos que pueden causar vasodilatación, fiebre y dolor. |
| Óxido nítrico | Gas soluble | Macrófagos, células endoteliales, algunas neuronas. | Potente vasodilatador, relaja el músculo liso, reduce la agregación plaquetaria, ayuda al reclutamiento de leucocitos, actividad antimicrobiana directa en altas concentraciones. |
| TNF-α y IL-1 | Citocinas | Principalmente macrófagos | Ambos afectan a una amplia variedad de células para inducir muchas reacciones inflamatorias similares: fiebre, producción de citocinas, regulación de genes endoteliales, quimiotaxis, adherencia leucocitaria, activación de fibroblastos . Responsable de los efectos sistémicos de la inflamación, como pérdida de apetito y aumento de la frecuencia cardíaca. El TNF-α inhibe la diferenciación de los osteoblastos. |
| Triptasa | Enzimas | Mastocitos | Se cree que esta serina proteasa se almacena exclusivamente en los mastocitos y se secreta, junto con la histamina, durante la activación de los mastocitos. [31] [32] [33] |
Patrones morfológicos
Se observan patrones específicos de inflamación aguda y crónica durante situaciones particulares que surgen en el cuerpo, como cuando la inflamación ocurre en una superficie epitelial o están involucradas bacterias piógenas .
- Inflamación granulomatosa: Caracterizada por la formación de granulomas , son el resultado de un número limitado pero diverso de enfermedades, que incluyen entre otras la tuberculosis , la lepra , la sarcoidosis y la sífilis .
- Inflamación fibrinosa: La inflamación que produce un gran aumento de la permeabilidad vascular permite que la fibrina pase a través de los vasos sanguíneos. Si está presente un estímulo procoagulante apropiado , como las células cancerosas, [10] se deposita un exudado fibrinoso. Esto se observa comúnmente en las cavidades serosas , donde la conversión del exudado fibrinoso en una cicatriz puede ocurrir entre las membranas serosas, lo que limita su función. El depósito a veces forma una lámina pseudomembranosa. Durante la inflamación del intestino ( colitis pseudomembranosa ), se pueden formar tubos pseudomembranosos.
- Inflamación purulenta: inflamación que produce una gran cantidad de pus , que consiste en neutrófilos, células muertas y líquido. La infección por bacterias piógenas, como los estafilococos, es característica de este tipo de inflamación. Las grandes acumulaciones localizadas de pus encerradas por los tejidos circundantes se denominan abscesos .
- Inflamación serosa: se caracteriza por la abundante efusión de líquido seroso no viscoso, producido habitualmente por las células mesoteliales de las membranas serosas , aunque puede derivar del plasma sanguíneo. Las ampollas en la piel ejemplifican este patrón de inflamación.
- Inflamación ulcerosa: la inflamación que se produce cerca de un epitelio puede provocar la pérdida necrótica de tejido de la superficie, exponiendo las capas inferiores. La excavación posterior en el epitelio se conoce como úlcera .
Trastornos


Las anomalías inflamatorias son un amplio grupo de trastornos que subyacen a una amplia variedad de enfermedades humanas. El sistema inmunitario suele estar involucrado en los trastornos inflamatorios, como se demuestra tanto en las reacciones alérgicas como en algunas miopatías , y muchos trastornos del sistema inmunitario dan lugar a una inflamación anormal. Las enfermedades no inmunitarias con orígenes causales en procesos inflamatorios incluyen el cáncer, la aterosclerosis y la cardiopatía isquémica . [10]
Algunos ejemplos de trastornos asociados con la inflamación incluyen:
- Acné vulgar
- Asma
- Enfermedades autoinmunes
- Enfermedades autoinflamatorias
- Enfermedad celíaca
- Prostatitis crónica
- Colitis
- Diverticulitis
- Fiebre mediterránea familiar
- Glomerulonefritis
- Hidradenitis supurativa
- Hipersensibilidades
- Enfermedades inflamatorias del intestino
- Cistitis intersticial
- Liquen plano
- Síndrome de activación de mastocitos
- Mastocitosis
- Otitis
- Enfermedad inflamatoria pélvica
- Queratitis ulcerativa periférica
- Neumonía
- Lesión por reperfusión
- Fiebre reumática
- Artritis reumatoide
- Rinitis
- Sarcoidosis
- Rechazo de trasplante
- Vasculitis
Aterosclerosis
La aterosclerosis, considerada antiguamente una enfermedad de almacenamiento de lípidos , ahora se entiende como una afección inflamatoria crónica que afecta las paredes arteriales. [34] La investigación ha establecido un papel fundamental de la inflamación en la mediación de todas las etapas de la aterosclerosis desde su inicio hasta su progresión y, en última instancia, las complicaciones trombóticas derivadas de ella. [34]
Estos nuevos hallazgos revelan vínculos entre los factores de riesgo tradicionales, como los niveles de colesterol, y los mecanismos subyacentes de la aterogénesis . Los estudios clínicos han demostrado que esta biología emergente de la inflamación en la aterosclerosis se aplica directamente a las personas. La elevación de los marcadores de inflamación predice los resultados de las personas con síndromes coronarios agudos, independientemente del daño miocárdico. Además, la inflamación crónica de bajo grado, como lo indican los niveles del marcador inflamatorio proteína C reactiva , define prospectivamente el riesgo de complicaciones ateroscleróticas, lo que se suma a la información pronóstica proporcionada por los factores de riesgo tradicionales. [34] Además, ciertos tratamientos que reducen el riesgo coronario también limitan la inflamación. En el caso de la reducción de lípidos con estatinas, el efecto antiinflamatorio no parece correlacionarse con la reducción de los niveles de lipoproteínas de baja densidad. [34] Estos nuevos conocimientos sobre la inflamación contribuyen a la etiología de la aterosclerosis y las aplicaciones clínicas prácticas en la estratificación del riesgo y la focalización de la terapia para la aterosclerosis. [34]
Alergia
Una reacción alérgica, formalmente conocida como hipersensibilidad tipo 1 , es el resultado de una respuesta inmunitaria inapropiada que desencadena inflamación, vasodilatación e irritación nerviosa. Un ejemplo común es la fiebre del heno , que es causada por una respuesta hipersensible de los mastocitos a los alérgenos . Los mastocitos presensibilizados responden desgranulándose , liberando sustancias químicas vasoactivas como la histamina. Estas sustancias químicas propagan una respuesta inflamatoria excesiva caracterizada por la dilatación de los vasos sanguíneos, la producción de moléculas proinflamatorias, la liberación de citocinas y el reclutamiento de leucocitos. [10] La respuesta inflamatoria grave puede madurar hasta convertirse en una respuesta sistémica conocida como anafilaxia .
Miopatías
Las miopatías inflamatorias son causadas por el ataque inadecuado del sistema inmunológico a los componentes del músculo, lo que provoca signos de inflamación muscular. Pueden presentarse junto con otros trastornos inmunológicos, como la esclerosis sistémica , e incluyen dermatomiositis , polimiositis y miositis por cuerpos de inclusión . [10]
Defectos de leucocitos
Debido al papel central de los leucocitos en el desarrollo y propagación de la inflamación, los defectos en la funcionalidad de los leucocitos a menudo resultan en una capacidad reducida para la defensa inflamatoria con la consiguiente vulnerabilidad a las infecciones. [10] Los leucocitos disfuncionales pueden ser incapaces de unirse correctamente a los vasos sanguíneos debido a mutaciones del receptor de superficie, digerir bacterias ( síndrome de Chédiak-Higashi ) o producir microbicidas ( enfermedad granulomatosa crónica ). Además, las enfermedades que afectan a la médula ósea pueden dar lugar a leucocitos anormales o escasos.
Farmacológico
Se sabe que ciertos fármacos o compuestos químicos exógenos afectan la inflamación. La deficiencia de vitamina A , por ejemplo, provoca un aumento de las respuestas inflamatorias [35] y los fármacos antiinflamatorios actúan específicamente inhibiendo las enzimas que producen eicosanoides inflamatorios . Además, ciertas drogas ilícitas como la cocaína y el éxtasis pueden ejercer algunos de sus efectos perjudiciales activando factores de transcripción íntimamente relacionados con la inflamación (por ejemplo, NF-κB ). [36] [37]
Cáncer
La inflamación orquesta el microambiente alrededor de los tumores, contribuyendo a la proliferación, supervivencia y migración. [38] Las células cancerosas usan selectinas , quimiocinas y sus receptores para la invasión, migración y metástasis. [39] Por otro lado, muchas células del sistema inmunológico contribuyen a la inmunología del cáncer , suprimiendo el cáncer. [40] La intersección molecular entre los receptores de hormonas esteroides, que tienen efectos importantes en el desarrollo celular, y los factores de transcripción que juegan papeles clave en la inflamación, como NF-κB , puede mediar algunos de los efectos más críticos de los estímulos inflamatorios en las células cancerosas. [41] Es muy probable que esta capacidad de un mediador de la inflamación para influir en los efectos de las hormonas esteroides en las células afecte la carcinogénesis. Por otro lado, debido a la naturaleza modular de muchos receptores de hormonas esteroides, esta interacción puede ofrecer formas de interferir con la progresión del cáncer, a través de la orientación de un dominio proteico específico en un tipo de célula específico. Este enfoque puede limitar los efectos secundarios que no están relacionados con el tumor de interés y puede ayudar a preservar las funciones homeostáticas vitales y los procesos de desarrollo en el organismo.
Según una revisión de 2009, datos recientes sugieren que la inflamación relacionada con el cáncer (IRC) puede conducir a la acumulación de alteraciones genéticas aleatorias en las células cancerosas. [42]
Papel en el cáncer
En 1863, Rudolf Virchow planteó la hipótesis de que el origen del cáncer se encontraba en sitios de inflamación crónica. [39] [43] En 2012, se estimó que la inflamación crónica contribuía a aproximadamente entre el 15% y el 25% de los cánceres humanos. [43] [44]
Mediadores y daño del ADN en el cáncer
Un mediador inflamatorio es un mensajero que actúa sobre los vasos sanguíneos y/o células para promover una respuesta inflamatoria. [45] Los mediadores inflamatorios que contribuyen a la neoplasia incluyen prostaglandinas , citocinas inflamatorias como IL-1β , TNF-α , IL-6 e IL-15 y quimiocinas como IL-8 y GRO-alfa . [46] [43] Estos mediadores inflamatorios, y otros, orquestan un entorno que fomenta la proliferación y la supervivencia. [39] [46]
La inflamación también causa daños en el ADN debido a la inducción de especies reactivas de oxígeno (ROS) por varios mediadores inflamatorios intracelulares. [39] [46] [43] Además, los leucocitos y otras células fagocíticas atraídas al sitio de la inflamación inducen daños en el ADN en las células proliferantes a través de su generación de ROS y especies reactivas de nitrógeno (RNS). ROS y RNS son normalmente producidas por estas células para combatir infecciones. [39] ROS, por sí solas, causan más de 20 tipos de daño en el ADN. [47] Los daños oxidativos en el ADN causan tanto mutaciones [48] como alteraciones epigenéticas. [49] [43] [50] RNS también causan daños mutagénicos en el ADN. [51]
Una célula normal puede sufrir carcinogénesis y convertirse en una célula cancerosa si se la somete frecuentemente a daños en el ADN durante largos períodos de inflamación crónica. Los daños en el ADN pueden causar mutaciones genéticas debido a una reparación inexacta . Además, los errores en el proceso de reparación del ADN pueden causar alteraciones epigenéticas . [43] [46] [50] Las mutaciones y alteraciones epigenéticas que se replican y proporcionan una ventaja selectiva durante la proliferación de células somáticas pueden ser cancerígenas.
Los análisis de todo el genoma de los tejidos cancerosos humanos revelan que una sola célula cancerosa típica puede poseer aproximadamente 100 mutaciones en regiones codificantes , 10-20 de las cuales son "mutaciones impulsoras" que contribuyen al desarrollo del cáncer. [43] Sin embargo, la inflamación crónica también causa cambios epigenéticos como las metilaciones del ADN , que a menudo son más comunes que las mutaciones. Por lo general, varios cientos a miles de genes están metilados en una célula cancerosa (ver Metilación del ADN en el cáncer ). Los sitios de daño oxidativo en la cromatina pueden reclutar complejos que contienen metiltransferasas de ADN (DNMT), una histona desacetilasa ( SIRT1 ) y una histona metiltransferasa (EZH2) , y así inducir la metilación del ADN. [43] [52] [53] La metilación del ADN de una isla CpG en una región promotora puede causar el silenciamiento de su gen corriente abajo (ver Sitio CpG y regulación de la transcripción en el cáncer ). Los genes de reparación del ADN, en particular, se inactivan con frecuencia por metilación en varios tipos de cáncer (ver hipermetilación de genes de reparación del ADN en el cáncer ). Un informe de 2018 [54] evaluó la importancia relativa de las mutaciones y alteraciones epigenéticas en la progresión a dos tipos diferentes de cáncer. Este informe mostró que las alteraciones epigenéticas eran mucho más importantes que las mutaciones en la generación de cánceres gástricos (asociados con la inflamación). [55] Sin embargo, las mutaciones y las alteraciones epigenéticas fueron de importancia aproximadamente igual en la generación de cánceres de células escamosas de esófago (asociados con sustancias químicas del tabaco y acetaldehído , un producto del metabolismo del alcohol).
VIH y SIDA
Desde hace mucho tiempo se reconoce que la infección por VIH se caracteriza no solo por el desarrollo de una inmunodeficiencia profunda , sino también por una inflamación sostenida y una activación inmunitaria. [56] [57] [58] Un conjunto sustancial de evidencia implica a la inflamación crónica como un factor crítico de disfunción inmunitaria, aparición prematura de enfermedades relacionadas con el envejecimiento y deficiencia inmunitaria. [56] [59] Muchos ahora consideran la infección por VIH no solo como una inmunodeficiencia inducida por el virus en evolución, sino también como una enfermedad inflamatoria crónica. [60] Incluso después de la introducción de una terapia antirretroviral (TAR) eficaz y una supresión eficaz de la viremia en individuos infectados por VIH, la inflamación crónica persiste. Los estudios en animales también respaldan la relación entre la activación inmunitaria y la deficiencia inmunitaria celular progresiva: la infección por SIV sm de sus huéspedes primates no humanos naturales, el mangabey hollín , causa una replicación viral de alto nivel, pero evidencia limitada de enfermedad. [61] [62] Esta falta de patogenicidad está acompañada por una falta de inflamación, activación inmunitaria y proliferación celular. En marcado contraste, la infección experimental con SIV sm en macacos rhesus produce activación inmunitaria y una enfermedad similar al SIDA con muchos paralelismos con la infección humana por VIH. [63]
Delinear cómo se agotan las células T CD4 y cómo se induce la inflamación crónica y la activación inmunológica es fundamental para comprender la patogénesis del VIH, una de las principales prioridades para la investigación del VIH por parte de la Oficina de Investigación del SIDA, Institutos Nacionales de Salud . Estudios recientes demostraron que la piroptosis mediada por caspasa-1 , una forma altamente inflamatoria de muerte celular programada, impulsa el agotamiento de las células T CD4 y la inflamación por el VIH. [64] [65] [66] Estos son los dos eventos característicos que impulsan la progresión de la enfermedad del VIH al SIDA . La piroptosis parece crear un círculo vicioso patogénico en el que las células T CD4 moribundas y otras células inmunes (incluidos los macrófagos y los neutrófilos) liberan señales inflamatorias que reclutan más células en los tejidos linfoides infectados para morir. La naturaleza de retroalimentación de esta respuesta inflamatoria produce inflamación crónica y daño tisular. [67] La identificación de la piroptosis como el mecanismo predominante que causa la depleción de células T CD4 y la inflamación crónica ofrece nuevas oportunidades terapéuticas, en concreto la caspasa-1, que controla la vía piroptótica. En este sentido, la piroptosis de las células T CD4 y la secreción de citocinas proinflamatorias como IL-1β e IL-18 se pueden bloquear en los tejidos linfoides humanos infectados por el VIH mediante la adición del inhibidor de la caspasa-1 VX-765, [64] que ya ha demostrado ser seguro y bien tolerado en ensayos clínicos en humanos de fase II. [68] Estos hallazgos podrían impulsar el desarrollo de una clase totalmente nueva de terapias "anti-SIDA" que actúen dirigiéndose al huésped en lugar del virus. Es casi seguro que dichos agentes se utilizarían en combinación con la terapia antirretroviral. Al promover la "tolerancia" del virus en lugar de suprimir su replicación, el VX-765 o medicamentos relacionados pueden imitar las soluciones evolutivas que ocurren en múltiples huéspedes monos (por ejemplo, el mangabey hollín) infectados con lentivirus específicos de la especie que han llevado a una ausencia de enfermedad, a ninguna disminución en los recuentos de células T CD4 y a ninguna inflamación crónica.
Resolución
La respuesta inflamatoria debe terminarse de forma activa cuando ya no es necesaria para evitar daños innecesarios a los tejidos. [10] Si no se hace esto, se produce una inflamación crónica y destrucción celular. La resolución de la inflamación se produce por diferentes mecanismos en diferentes tejidos. Los mecanismos que sirven para terminar la inflamación incluyen: [10] [69]
- Vida media corta de los mediadores inflamatorios in vivo .
- Producción y liberación del factor de crecimiento transformante (TGF) beta de los macrófagos [70] [71] [72]
- Producción y liberación de interleucina 10 (IL-10) [73]
- Producción de mediadores prorresolutivos especializados antiinflamatorios , es decir, lipoxinas , resolvinas , maresinas y neuroprotectinas [74] [75]
- Regulación negativa de moléculas proinflamatorias, como los leucotrienos .
- Regulación positiva de moléculas antiinflamatorias como el antagonista del receptor de interleucina 1 o el receptor del factor de necrosis tumoral soluble (TNFR)
- Apoptosis de células proinflamatorias [76]
- Desensibilización de receptores.
- Aumento de la supervivencia de las células en regiones de inflamación debido a su interacción con la matriz extracelular (MEC) [77] [78]
- Regulación negativa de la actividad del receptor por altas concentraciones de ligandos
- La escisión de quimiocinas por las metaloproteinasas de matriz (MMP) podría conducir a la producción de factores antiinflamatorios. [79]
La inflamación aguda normalmente se resuelve por mecanismos que han permanecido algo esquivos. Evidencias emergentes ahora sugieren que un programa activo y coordinado de resolución se inicia en las primeras horas después de que comienza una respuesta inflamatoria. Después de entrar en los tejidos, los granulocitos promueven el cambio de prostaglandinas y leucotrienos derivados del ácido araquidónico a lipoxinas, que inician la secuencia de terminación. El reclutamiento de neutrófilos cesa así y se activa la muerte programada por apoptosis . Estos eventos coinciden con la biosíntesis, a partir de ácidos grasos poliinsaturados omega-3 , de resolvinas y protectinas , que acortan críticamente el período de infiltración de neutrófilos al iniciar la apoptosis. Como consecuencia, los neutrófilos apoptóticos experimentan fagocitosis por parte de los macrófagos , lo que conduce a la eliminación de neutrófilos y la liberación de citocinas antiinflamatorias y reparadoras como el factor de crecimiento transformante-β1. El programa antiinflamatorio termina con la salida de los macrófagos a través de los vasos linfáticos . [80]
Conexión con la depresión
Hay evidencia de un vínculo entre la inflamación y la depresión . [81] Los procesos inflamatorios pueden ser desencadenados por cogniciones negativas o sus consecuencias, como el estrés, la violencia o la privación. Por lo tanto, las cogniciones negativas pueden causar inflamación que, a su vez, puede conducir a la depresión. [82] [83] [ dudoso – discutir ] Además, hay cada vez más evidencia de que la inflamación puede causar depresión debido al aumento de citocinas, lo que pone al cerebro en un "modo de enfermedad". [84]
Los síntomas clásicos de estar físicamente enfermo, como el letargo, muestran una gran superposición con los comportamientos que caracterizan la depresión. Los niveles de citocinas tienden a aumentar bruscamente durante los episodios depresivos de las personas con trastorno bipolar y disminuyen durante la remisión. [85] Además, se ha demostrado en ensayos clínicos que los medicamentos antiinflamatorios tomados además de los antidepresivos no solo mejoran significativamente los síntomas, sino que también aumentan la proporción de sujetos que responden positivamente al tratamiento. [86] Las inflamaciones que conducen a una depresión grave podrían estar causadas por infecciones comunes, como las causadas por un virus, una bacteria o incluso parásitos. [87]
Conexión con el delirio
Existe evidencia de un vínculo entre la inflamación y el delirio basado en los resultados de un estudio longitudinal reciente que investigó la PCR en pacientes con COVID-19. [88]
Efectos sistémicos
Un organismo infeccioso puede escapar de los confines del tejido inmediato a través del sistema circulatorio o el sistema linfático , donde puede propagarse a otras partes del cuerpo. Si un organismo no es contenido por las acciones de la inflamación aguda, puede acceder al sistema linfático a través de los vasos linfáticos cercanos . Una infección de los vasos linfáticos se conoce como linfangitis , y la infección de un ganglio linfático se conoce como linfadenitis . Cuando los ganglios linfáticos no pueden destruir todos los patógenos, la infección se propaga aún más. Un patógeno puede acceder al torrente sanguíneo a través del drenaje linfático hacia el sistema circulatorio.
Cuando la inflamación supera al huésped, se diagnostica el síndrome de respuesta inflamatoria sistémica . Cuando se debe a una infección, se aplica el término sepsis , y los términos bacteriemia se aplican específicamente a la sepsis bacteriana y viremia específicamente a la sepsis viral. La vasodilatación y la disfunción orgánica son problemas graves asociados con la infección generalizada que pueden provocar un choque séptico y la muerte. [89]
Proteínas de fase aguda
La inflamación también se caracteriza por niveles sistémicos elevados de proteínas de fase aguda . En la inflamación aguda, estas proteínas resultan beneficiosas; sin embargo, en la inflamación crónica, pueden contribuir a la amiloidosis . [10] Estas proteínas incluyen la proteína C reactiva , el amiloide sérico A y el amiloide sérico P , que causan una variedad de efectos sistémicos, entre ellos: [10]
- Fiebre
- Aumento de la presión arterial
- Disminución de la sudoración
- Malestar
- Pérdida de apetito
- Somnolencia
Número de leucocitos
La inflamación a menudo afecta la cantidad de leucocitos presentes en el cuerpo:
- La leucocitosis se observa a menudo durante la inflamación inducida por una infección, donde da como resultado un gran aumento en la cantidad de leucocitos en la sangre, especialmente células inmaduras. El número de leucocitos generalmente aumenta entre 15 000 y 20 000 células por microlitro, pero en casos extremos puede acercarse a 100 000 células por microlitro. [10] La infección bacteriana generalmente da como resultado un aumento de neutrófilos , creando neutrofilia , mientras que enfermedades como el asma , la fiebre del heno y la infestación parasitaria dan como resultado un aumento de eosinófilos , creando eosinofilia . [10]
- La leucopenia puede ser inducida por ciertas infecciones y enfermedades, incluidas infecciones virales, infecciones por Rickettsia , algunos protozoos , tuberculosis y algunos cánceres. [10]
Interleucinas y obesidad
Con el descubrimiento de las interleucinas (IL), se desarrolló el concepto de inflamación sistémica . Aunque los procesos implicados son idénticos a la inflamación tisular, la inflamación sistémica no se limita a un tejido en particular, sino que involucra al endotelio y a otros sistemas orgánicos.
La inflamación crónica se observa ampliamente en la obesidad . [90] [91] Las personas obesas comúnmente tienen muchos marcadores elevados de inflamación, incluidos: [92] [93]
- IL-6 (interleucina-6) [94] [95]
- IL-8 (Interleucina-8)
- IL-18 (interleucina-18) [94] [95]
- TNF-α (factor de necrosis tumoral alfa) [94] [95]
- PCR (proteína C reactiva) [94] [95]
- Insulina [94] [95]
- Glucemia [94] [95]
- Leptina [94] [95]
La inflamación crónica de bajo grado se caracteriza por un aumento de dos a tres veces en las concentraciones sistémicas de citocinas como TNF-α, IL-6 y PCR. [96] La circunferencia de la cintura se correlaciona significativamente con la respuesta inflamatoria sistémica. [97]
La pérdida de tejido adiposo blanco reduce los niveles de marcadores de inflamación. [90] En 2017, la asociación de la inflamación sistémica con la resistencia a la insulina y la diabetes tipo 2 , y con la aterosclerosis estaba bajo investigación preliminar, aunque no se habían realizado ensayos clínicos rigurosos para confirmar dichas relaciones. [98]
La proteína C reactiva (PCR) se genera en un nivel más alto en personas obesas y puede aumentar el riesgo de enfermedades cardiovasculares . [99]
Resultados
El resultado en una circunstancia particular estará determinado por el tejido en el que se haya producido la lesión y el agente lesivo que la esté causando. Estos son los posibles resultados de la inflamación: [10]
- Resolución
La restauración completa del tejido inflamado a un estado normal. Las medidas inflamatorias como la vasodilatación, la producción química y la infiltración leucocitaria cesan, y las células parenquimatosas dañadas se regeneran. Este suele ser el resultado cuando se ha producido una inflamación limitada o de corta duración. - Fibrosis
La destrucción de grandes cantidades de tejido o el daño en tejidos incapaces de regenerarse no pueden ser regenerados completamente por el cuerpo.En estas áreas dañadas se forman cicatrices fibrosas , que se componen principalmente de colágeno . La cicatriz no contiene ninguna estructura especializada, como células parenquimatosas , por lo que puede producirse un deterioro funcional. - Formación de absceso
Se forma una cavidad que contiene pus, un líquido opaco que contiene glóbulos blancos muertos y bacterias con restos generales de células destruidas. - Inflamación crónica
En la inflamación aguda, si el agente lesivo persiste, se producirá una inflamación crónica. Este proceso, caracterizado por una inflamación que dura muchos días, meses o incluso años, puede conducir a la formación de una herida crónica . La inflamación crónica se caracteriza por la presencia dominante de macrófagos en el tejido lesionado. Estas células son poderosos agentes defensivos del cuerpo, pero las toxinas que liberan, incluidas las especies reactivas de oxígeno , son perjudiciales para los propios tejidos del organismo, así como para los agentes invasores. Como consecuencia, la inflamación crónica casi siempre va acompañada de destrucción tisular.
Ejemplos
La inflamación suele indicarse añadiendo el sufijo "itis", como se muestra a continuación. Sin embargo, algunas afecciones, como el asma y la neumonía , no siguen esta convención. Hay más ejemplos disponibles en Lista de tipos de inflamación .
- Apendicitis aguda
- Dermatitis aguda
- Meningitis infecciosa aguda
- Amigdalitis aguda
Véase también
Notas
- ^ Todos estos signos pueden observarse en casos específicos, pero no es necesario que esté presente un solo signo como cuestión de rutina. [14] Estos son los signos originales o cardinales de la inflamación. [14]
- ^ La función laesa es un concepto anticuado, ya que no es exclusivo de la inflamación y es una característica de muchos estados patológicos. [15]
Referencias
- ^ Ferrero-Miliani L, Nielsen OH, Andersen PS, Girardin SE (febrero de 2007). "Inflamación crónica: importancia de NOD2 y NALP3 en la generación de interleucina-1 beta". Inmunología clínica y experimental . 147 (2): 227–235. doi :10.1111/j.1365-2249.2006.03261.x. PMC 1810472 . PMID 17223962.
- ^ Chen L, Deng H, Cui H, Fang J, Zuo Z, Deng J, et al. (enero de 2018). "Respuestas inflamatorias y enfermedades asociadas a la inflamación en los órganos". Oncotarget . 9 (6). Revistas de impacto, LLC: 7204–7218. doi :10.18632/oncotarget.23208. PMC 5805548 . PMID 29467962. S2CID 3571245.
- ^ Abbas AB, Lichtman AH (2009). "Cap. 2 Inmunidad innata". En Saunders (Elsevier) (ed.). Inmunología básica. Funciones y trastornos del sistema inmunitario (3.ª ed.). Saunders/Elsevier. ISBN 978-1-4160-4688-2.
- ^ "La inflamación y su salud". Cedars-Sinai .
- ^ Berger A (agosto de 2000). "Respuestas Th1 y Th2: ¿qué son?". BMJ . 321 (7258): 424. doi :10.1136/bmj.321.7258.424. PMC 27457 . PMID 10938051. Archivado desde el original el 12 de julio de 2021 . Consultado el 1 de julio de 2021 .
- ^ "inflamación". Etimología de inflamación por etymonline . 28 de septiembre de 2017 . Consultado el 11 de agosto de 2024 .
- ^ abcd Hall J (2011). Guyton y Hall, libro de texto de fisiología médica (12.ª ed.). Filadelfia, Pensilvania: Saunders/Elsevier. pág. 428. ISBN 978-1-4160-4574-8.
- ^ Granger DN, Senchenkova E (2010). "Adhesión de leucocitos a células endoteliales". Inflamación y microcirculación. Fisiología de sistemas integrados: de la célula a la función. Vol. 2. Morgan & Claypool Life Sciences. págs. 1–87. doi :10.4199/C00013ED1V01Y201006ISP008. PMID 21452440. Archivado desde el original el 21 de enero de 2021. Consultado el 1 de julio de 2017 .
- ^ Piira OP, Miettinen JA, Hautala AJ, Huikuri HV, Tulppo MP (octubre de 2013). "Respuestas fisiológicas a la excitación emocional en sujetos sanos y pacientes con enfermedad de la arteria coronaria". Neurociencia autónoma . 177 (2): 280–5. doi :10.1016/j.autneu.2013.06.001. PMID 23916871. S2CID 19823098.
- ^ abcdefghijklmnopqr Robbins SL, Cotran RS, Kumar V, Collins T (1998). Robbins: Bases patológicas de la enfermedad . Filadelfia: WB Saunders Company. ISBN 978-0-7216-7335-6.
- ^ Kumar R, Clermont G, Vodovotz Y, Chow CC (septiembre de 2004). "La dinámica de la inflamación aguda". Revista de biología teórica . 230 (2): 145–55. arXiv : q-bio/0404034 . Bibcode :2004PhDT.......405K. doi :10.1016/j.jtbi.2004.04.044. PMID 15321710. S2CID 16992741.
- ^ abcdef Hannoodee S, Nasuruddin DN (2020). «Respuesta inflamatoria aguda». StatPearls . PMID 32310543. Archivado desde el original el 15 de junio de 2022. Consultado el 28 de diciembre de 2020 .
- ^ abcdefg Pahwa R, Goyal A, Bansal P, Jialal I (28 de septiembre de 2021). «Inflamación crónica». StatPearls . Institutos Nacionales de Salud – Biblioteca Nacional de Medicina. PMID 29630225. Archivado desde el original el 19 de diciembre de 2020 . Consultado el 28 de diciembre de 2020 .
- ^ ab Stedman's Medical Dictionary (vigésima quinta edición). Williams & Wilkins. 1990.
- ^ Rather LJ (marzo de 1971). "Alteración de la función (functio laesa): el legendario quinto signo cardinal de la inflamación, añadido por Claudio Galeno a los cuatro signos cardinales de Celso". Boletín de la Academia de Medicina de Nueva York . 47 (3): 303–22. PMC 1749862 . PMID 5276838.
- ^ abcde Chandrasoma P, Taylor CR (2005). "Parte A. "Patología general", Sección II. "La respuesta del huésped a la lesión", Capítulo 3. "La respuesta inflamatoria aguda", subsección "Signos clínicos cardinales"". Patología concisa (3.ª ed.). McGraw-Hill. ISBN 978-0-8385-1499-3. OCLC 150148447. Archivado desde el original el 5 de octubre de 2008. Consultado el 5 de noviembre de 2008 .
- ^ ab Rather LJ (1971). "Alteración de la función (functio laesa): el legendario quinto signo cardinal de la inflamación, añadido por Galeno a los cuatro signos cardinales de Celso. - PMC". Boletín de la Academia de Medicina de Nueva York . 47 (3): 303–322. PMC 1749862 . PMID 5276838.
- ^ Werner R (2009). Guía de patología para terapeutas de masajes (4.ª ed.). Wolters Kluwer. ISBN 978-0-7817-6919-8Archivado desde el original el 21 de diciembre de 2015 . Consultado el 6 de octubre de 2010 .
- ^ Vogel WH, Berke A (2009). Breve historia de la visión y la medicina ocular. Publicaciones Kugler. pág. 97. ISBN 978-90-6299-220-1.
- ^ Porth C (2007). Fundamentos de fisiopatología: conceptos de estados de salud alterados . Hagerstown, MD: Lippincott Williams & Wilkins. pág. 270. ISBN 978-0-7817-7087-3.
- ^ Dormandy T (2006). El peor de los males: la lucha del hombre contra el dolor . New Haven, Connecticut: Yale University Press. pp. 22. ISBN 978-0-300-11322-8.
- ^ InformedHealth.org [Internet]. Instituto para la Calidad y Eficiencia en la Atención Sanitaria (IQWiG). 22 de febrero de 2018 – vía www.ncbi.nlm.nih.gov.
- ^ "Inflamación | Definición, síntomas, tratamiento y datos | Britannica". www.britannica.com . 11 de marzo de 2024.
- ^ Robbins S, Cotran R, Kumar V, Abbas A, Aster J (2020). Base patológica de la enfermedad (10.ª ed.). Filadelfia, PA: Saunders Elsevier.
- ^ abc Raiten DJ, Sakr Ashour FA, Ross AC, Meydani SN, Dawson HD, Stephensen CB, et al. (mayo de 2015). "Inflamación y ciencia nutricional para programas/políticas e interpretación de la evidencia de investigación (INSPIRE)". The Journal of Nutrition . 145 (5): 1039S–1108S. doi :10.3945/jn.114.194571. PMC 4448820 . PMID 25833893.
- ^ Taams LS (julio de 2018). "Inflamación y resolución inmunitaria". Inmunología clínica y experimental . 193 (1): 1–2. doi :10.1111/cei.13155. PMC 6037995 . PMID 29987840.
- ^ abcd Medzhitov R (julio de 2008). "Origen y funciones fisiológicas de la inflamación". Nature . 454 (7203): 428–435. Bibcode :2008Natur.454..428M. doi :10.1038/nature07201. PMID 18650913. S2CID 205214291.
- ^ Mantovani A, Garlanda C (febrero de 2023). Longo DL (ed.). "Inmunidad innata humoral y proteínas de fase aguda". The New England Journal of Medicine . 388 (5): 439–452. doi :10.1056/NEJMra2206346. PMC 9912245 . PMID 36724330.
- ^ Ferland G (2020), "Vitamina K", Conocimiento actual en nutrición , Elsevier, págs. 137-153, doi :10.1016/b978-0-323-66162-1.00008-1, ISBN 978-0-323-66162-1, consultado el 17 de febrero de 2023
- ^ ab Herrington S (2014). Libro de texto de patología de Muir (15.ª ed.). CRC Press. pág. 59. ISBN 978-1-4441-8499-0.
- ^ Carstens E, Akiyama T, Cevikbas F, Kempkes C, Buhl T, Mess C, et al. (2014). "El papel de la interleucina-31 y la oncostatina M en el prurito y la comunicación neuroinmune". En Carstens M, Akiyama T (eds.). Prurito: mecanismos y tratamiento. Frontiers in Neuroscience. Boca Raton (FL): CRC Press/Taylor & Francis. ISBN 978-1-4665-0543-8. Número de identificación personal 24830021.
- ^ Caughey GH (junio de 2007). "Triptasas y quimasas de mastocitos en la inflamación y la defensa del huésped". Revisiones inmunológicas . 217 (1): 141–54. doi :10.1111/j.1600-065x.2007.00509.x. PMC 2275918 . PMID 17498057.
- ^ Caughey GH (mayo de 2016). "Proteasas de mastocitos como dianas farmacológicas". Revista Europea de Farmacología . Modulación farmacológica de mastocitos y basófilos. 778 : 44–55. doi :10.1016/j.ejphar.2015.04.045. PMC 4636979. PMID 25958181 .
- ^ abcde Libby P (noviembre de 2021). "Inflamación durante el ciclo de vida de la placa aterosclerótica". Investigación cardiovascular . 117 (13): 2525–2536. doi :10.1093/cvr/cvab303. PMC 8783385 . PMID 34550337.
- ^ Wiedermann U, Chen XJ, Enerbäck L, Hanson LA, Kahu H, Dahlgren UI (diciembre de 1996). "La deficiencia de vitamina A aumenta las respuestas inflamatorias". Revista escandinava de inmunología . 44 (6): 578–84. doi :10.1046/j.1365-3083.1996.d01-351.x. PMID 8972739. S2CID 3079540.
- ^ Hargrave BY, Tiangco DA, Lattanzio FA, Beebe SJ (2003). "La cocaína, no la morfina, provoca la generación de especies reactivas de oxígeno y la activación de NF-kappaB en células cardíacas cotransfectadas transitoriamente". Toxicología cardiovascular . 3 (2): 141–51. doi :10.1385/CT:3:2:141. PMID 14501032. S2CID 35240781.
- ^ Montiel-Duarte C, Ansorena E, López-Zabalza MJ, Cenarruzabeitia E, Iraburu MJ (marzo de 2004). "Papel de las especies reactivas de oxígeno, glutatión y NF-kappaB en la apoptosis inducida por 3,4-metilendioximetanfetamina ("Éxtasis") en células estrelladas hepáticas". Farmacología bioquímica . 67 (6): 1025–33. doi :10.1016/j.bcp.2003.10.020. PMID 15006539.
- ^ Ungefroren H, Sebens S, Seidl D, Lehnert H, Hass R (septiembre de 2011). "Interacción de las células tumorales con el microambiente". Comunicación celular y señalización . 9 : 18. doi : 10.1186/1478-811X-9-18 . PMC 3180438. PMID 21914164 .
- ^ abcde Coussens LM, Werb Z (2002). "Inflamación y cáncer". Nature . 420 (6917): 860–7. Bibcode :2002Natur.420..860C. doi :10.1038/nature01322. PMC 2803035 . PMID 12490959.
- ^ Gunn L, Ding C, Liu M, Ma Y, Qi C, Cai Y, et al. (septiembre de 2012). "Funciones opuestas del componente del complemento C5a en la progresión tumoral y el microambiente tumoral". Journal of Immunology . 189 (6): 2985–94. doi :10.4049/jimmunol.1200846. PMC 3436956 . PMID 22914051.
- ^ Copland JA, Sheffield-Moore M, Koldzic-Zivanovic N, Gentry S, Lamprou G, Tzortzatou-Stathopoulou F, et al. (junio de 2009). "Receptores de esteroides sexuales en la diferenciación esquelética y la neoplasia epitelial: ¿es posible una intervención específica de tejido?". BioEssays . 31 (6): 629–41. doi :10.1002/bies.200800138. PMID 19382224. S2CID 205469320.
- ^ Colotta F, Allavena P, Sica A, Garlanda C, Mantovani A (julio de 2009). "Inflamación relacionada con el cáncer, el séptimo sello distintivo del cáncer: vínculos con la inestabilidad genética". Carcinogénesis (revisión). 30 (7): 1073–81. doi : 10.1093/carcin/bgp127 . PMID 19468060.
- ^ abcdefgh Chiba T, Marusawa H, Ushijima T (septiembre de 2012). "Desarrollo de cáncer asociado a inflamación en órganos digestivos: mecanismos y funciones de la modulación genética y epigenética" (PDF) . Gastroenterología . 143 (3): 550–563. doi :10.1053/j.gastro.2012.07.009. hdl : 2433/160134 . PMID 22796521. S2CID 206226588. Archivado (PDF) del original el 29 de agosto de 2022 . Consultado el 9 de junio de 2018 .
- ^ Mantovani A, Allavena P, Sica A, Balkwill F (julio de 2008). «Inflamación relacionada con el cáncer» (PDF) . Nature . 454 (7203): 436–44. Bibcode :2008Natur.454..436M. doi :10.1038/nature07205. hdl : 2434/145688 . PMID 18650914. S2CID 4429118. Archivado (PDF) desde el original el 30 de octubre de 2022 . Consultado el 9 de junio de 2018 .
- ^ Larsen GL, Henson PM (1983). "Mediadores de la inflamación". Revista Anual de Inmunología . 1 : 335–59. doi :10.1146/annurev.iy.01.040183.002003. PMID 6399978.
- ^ abcd Shacter E, Weitzman SA (febrero de 2002). "Inflamación crónica y cáncer". Oncología . 16 (2): 217–26, 229, discusión 230–2. PMID 11866137.
- ^ Yu Y, Cui Y, Niedernhofer LJ, Wang Y (diciembre de 2016). "Aparición, consecuencias biológicas y relevancia para la salud humana del daño del ADN inducido por estrés oxidativo". Chemical Research in Toxicology . 29 (12): 2008–2039. doi :10.1021/acs.chemrestox.6b00265. PMC 5614522 . PMID 27989142.
- ^ Dizdaroglu M (diciembre de 2012). "Daños en el ADN inducidos por oxidación: mecanismos, reparación y enfermedad". Cancer Letters . 327 (1–2): 26–47. doi :10.1016/j.canlet.2012.01.016. PMID 22293091.
- ^ Nishida N, Kudo M (2013). "Estrés oxidativo e inestabilidad epigenética en la hepatocarcinogénesis humana". Enfermedades digestivas . 31 (5–6): 447–53. doi : 10.1159/000355243 . PMID 24281019.
- ^ ab Ding N, Maiuri AR, O'Hagan HM (2017). "El papel emergente de los modificadores epigenéticos en la reparación del daño del ADN asociado con enfermedades inflamatorias crónicas". Mutation Research . 780 : 69–81. doi :10.1016/j.mrrev.2017.09.005. PMC 6690501 . PMID 31395351.
- ^ Kawanishi S, Ohnishi S, Ma N, Hiraku Y, Oikawa S, Murata M (2016). "Daños oxidativos y nitrativos del ADN en la carcinogénesis relacionada con infecciones en relación con las células madre cancerosas". Genes and Environment . 38 (1): 26. Bibcode :2016GeneE..38...26K. doi : 10.1186/s41021-016-0055-7 . PMC 5203929 . PMID 28050219.
- ^ O'Hagan HM, Wang W, Sen S, Destefano Shields C, Lee SS, Zhang YW, et al. (noviembre de 2011). "El daño oxidativo dirige complejos que contienen metiltransferasas de ADN, SIRT1 y miembros de polycomb a las islas CpG del promotor". Cancer Cell . 20 (5): 606–19. doi :10.1016/j.ccr.2011.09.012. PMC 3220885 . PMID 22094255.
- ^ Maiuri AR, Peng M, Podicheti R, Sriramkumar S, Kamplain CM, Rusch DB, et al. (julio de 2017). "Las proteínas reparadoras de desajustes inician alteraciones epigenéticas durante la tumorigénesis impulsada por la inflamación". Cancer Research . 77 (13): 3467–3478. doi :10.1158/0008-5472.CAN-17-0056. PMC 5516887 . PMID 28522752.
- ^ Yamashita S, Kishino T, Takahashi T, Shimazu T, Charvat H, Kakugawa Y, et al. (febrero de 2018). "Las alteraciones genéticas y epigenéticas en tejidos normales tienen impactos diferenciales en el riesgo de cáncer entre los tejidos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 115 (6): 1328–1333. Bibcode :2018PNAS..115.1328Y. doi : 10.1073/pnas.1717340115 . PMC 5819434 . PMID 29358395.
- ^ Raza Y, Khan A, Farooqui A, Mubarak M, Facista A, Akhtar SS, et al. (octubre de 2014). "Daño oxidativo del ADN como un posible biomarcador temprano de carcinogénesis asociada a Helicobacter pylori". Pathology & Oncology Research . 20 (4): 839–46. doi :10.1007/s12253-014-9762-1. PMID 24664859. S2CID 18727504.
- ^ ab Deeks SG (1 de enero de 2011). "Infección por VIH, inflamación, inmunosenescencia y envejecimiento". Revista Anual de Medicina . 62 : 141–55. doi :10.1146/annurev-med-042909-093756. PMC 3759035. PMID 21090961 .
- ^ Klatt NR, Chomont N, Douek DC, Deeks SG (julio de 2013). "Activación inmunitaria y persistencia del VIH: implicaciones para los enfoques curativos de la infección por VIH". Revisiones inmunológicas . 254 (1): 326–42. doi :10.1111/imr.12065. PMC 3694608 . PMID 23772629.
- ^ Salazar-Gonzalez JF, Martinez-Maza O, Nishanian P, Aziz N, Shen LP, Grosser S, et al. (agosto de 1998). "El aumento de la activación inmunitaria precede al punto de inflexión de las células T CD4 y al aumento de la carga viral sérica en la infección por el virus de la inmunodeficiencia humana". The Journal of Infectious Diseases . 178 (2): 423–30. doi : 10.1086/515629 . PMID 9697722.
- ^ Ipp H, Zemlin A (febrero de 2013). "La paradoja de la respuesta inmunitaria en la infección por VIH: cuando la inflamación se vuelve dañina". Clinica Chimica Acta; Revista internacional de química clínica . 416 : 96–9. doi :10.1016/j.cca.2012.11.025. PMID 23228847.
- ^ Nasi M, Pinti M, Mussini C, Cossarizza A (octubre de 2014). "Inflamación persistente en la infección por VIH: conceptos establecidos, nuevas perspectivas". Immunology Letters . 161 (2): 184–8. doi :10.1016/j.imlet.2014.01.008. PMID 24487059.
- ^ Milush JM, Mir KD, Sundaravaradan V, Gordon SN, Engram J, Cano CA, et al. (marzo de 2011). "La falta de SIDA clínico en los mangabeys hollín infectados con SIV con pérdida significativa de células T CD4+ se asocia con células T doblemente negativas". The Journal of Clinical Investigation . 121 (3): 1102–10. doi :10.1172/JCI44876. PMC 3049370 . PMID 21317533.
- ^ Rey-Cuillé MA, Berthier JL, Bomsel-Demontoy MC, Chaduc Y, Montagnier L, Hovanessian AG, et al. (mayo de 1998). "El virus de inmunodeficiencia de los simios se replica a niveles elevados en los mangabeys hollín sin inducir la enfermedad". Journal of Virology . 72 (5): 3872–86. doi :10.1128/JVI.72.5.3872-3886.1998. PMC 109612 . PMID 9557672.
- ^ Chahroudi A, Bosinger SE, Vanderford TH, Paiardini M, Silvestri G (marzo de 2012). "Huéspedes naturales del SIV: mostrando la puerta al SIDA". Science . 335 (6073): 1188–93. Bibcode :2012Sci...335.1188C. doi :10.1126/science.1217550. PMC 3822437 . PMID 22403383.
- ^ ab Doitsh G, Galloway NL, Geng X, Yang Z, Monroe KM, Zepeda O, et al. (enero de 2014). "La muerte celular por piroptosis impulsa la depleción de células T CD4 en la infección por VIH-1". Nature . 505 (7484): 509–14. Bibcode :2014Natur.505..509D. doi :10.1038/nature12940. PMC 4047036 . PMID 24356306.
- ^ Monroe KM, Yang Z, Johnson JR, Geng X, Doitsh G, Krogan NJ, et al. (enero de 2014). "El sensor de ADN IFI16 es necesario para la muerte de células T CD4 linfoides infectadas de forma abortiva con VIH". Science . 343 (6169): 428–32. Bibcode :2014Sci...343..428M. doi :10.1126/science.1243640. PMC 3976200 . PMID 24356113.
- ^ Galloway NL, Doitsh G, Monroe KM, Yang Z, Muñoz-Arias I, Levy DN, et al. (septiembre de 2015). "La transmisión de célula a célula del VIH-1 es necesaria para desencadenar la muerte piroptótica de las células T CD4 derivadas del tejido linfoide". Cell Reports . 12 (10): 1555–1563. doi :10.1016/j.celrep.2015.08.011. PMC 4565731 . PMID 26321639.
- ^ Doitsh G, Greene WC (marzo de 2016). "Análisis de cómo se pierden las células T CD4 durante la infección por VIH". Cell Host & Microbe . 19 (3): 280–91. doi :10.1016/j.chom.2016.02.012. PMC 4835240 . PMID 26962940.
- ^ "Estudio de VX-765 en sujetos con epilepsia parcial resistente al tratamiento – Vista de texto completo – ClinicalTrials.gov". clinicaltrials.gov . 19 de diciembre de 2013. Archivado desde el original el 26 de septiembre de 2022 . Consultado el 21 de mayo de 2016 .
- ^ Eming SA, Krieg T, Davidson JM (marzo de 2007). "Inflamación en la reparación de heridas: mecanismos moleculares y celulares". The Journal of Investigative Dermatology . 127 (3): 514–25. doi : 10.1038/sj.jid.5700701 . PMID 17299434.
- ^ Ashcroft GS, Yang X, Glick AB, Weinstein M, Letterio JL, Mizel DE, et al. (septiembre de 1999). "Los ratones que carecen de Smad3 muestran una cicatrización acelerada de las heridas y una respuesta inflamatoria local deteriorada". Nature Cell Biology . 1 (5): 260–6. doi :10.1038/12971. PMID 10559937. S2CID 37216623.
- ^ Ashcroft GS (diciembre de 1999). "Regulación bidireccional de la función de los macrófagos por TGF-beta". Microbes and Infection . 1 (15): 1275–82. doi :10.1016/S1286-4579(99)00257-9. PMID 10611755. Archivado desde el original el 10 de enero de 2020 . Consultado el 11 de septiembre de 2019 .
- ^ Werner F, Jain MK, Feinberg MW, Sibinga NE, Pellacani A, Wiesel P, et al. (noviembre de 2000). "La inhibición de la activación de macrófagos por el factor de crecimiento transformante beta 1 está mediada por Smad3". The Journal of Biological Chemistry . 275 (47): 36653–8. doi : 10.1074/jbc.M004536200 . PMID 10973958.
- ^ Sato Y, Ohshima T, Kondo T (noviembre de 1999). "Función reguladora de la interleucina-10 endógena en la respuesta inflamatoria cutánea de la cicatrización de heridas en ratones". Biochemical and Biophysical Research Communications . 265 (1): 194–9. doi :10.1006/bbrc.1999.1455. PMID 10548513.
- ^ Serhan CN (agosto de 2008). "Control de la resolución de la inflamación aguda: un nuevo género de mediadores duales antiinflamatorios y prorresolutivos". Journal of Periodontology . 79 (8 Suppl): 1520–6. doi :10.1902/jop.2008.080231. PMID 18673006.
- ^ Headland SE, Norling LV (mayo de 2015). "La resolución de la inflamación: principios y desafíos". Seminarios en inmunología . 27 (3): 149–60. doi :10.1016/j.smim.2015.03.014. PMID 25911383.
- ^ Greenhalgh DG (septiembre de 1998). "El papel de la apoptosis en la cicatrización de heridas". Revista internacional de bioquímica y biología celular . 30 (9): 1019–30. doi :10.1016/S1357-2725(98)00058-2. PMID 9785465.
- ^ Jiang D, Liang J, Fan J, Yu S, Chen S, Luo Y, et al. (noviembre de 2005). "Regulación de la lesión y reparación pulmonar por receptores tipo Toll y ácido hialurónico". Nature Medicine . 11 (11): 1173–9. doi :10.1038/nm1315. PMID 16244651. S2CID 11765495.
- ^ Teder P, Vandivier RW, Jiang D, Liang J, Cohn L, Puré E, et al. (Abril de 2002). "Resolución de la inflamación pulmonar por CD44". Ciencia . 296 (5565): 155–8. Código Bib : 2002 Ciencia... 296..155T. doi : 10.1126/ciencia.1069659. PMID 11935029. S2CID 7905603.
- ^ McQuibban GA, Gong JH, Tam EM, McCulloch CA, Clark-Lewis I, General CM (agosto de 2000). "Inflamación atenuada por la escisión de la proteína-3 quimioatrayente de monocitos por la gelatinasa A". Science . 289 (5482): 1202–6. Bibcode :2000Sci...289.1202M. doi :10.1126/science.289.5482.1202. PMID 10947989.
- ^ Serhan CN, Savill J (diciembre de 2005). "Resolución de la inflamación: el comienzo programa el final". Nature Immunology . 6 (12): 1191–7. doi :10.1038/ni1276. PMID 16369558. S2CID 22379843.
- ^ Berk M, Williams LJ, Jacka FN, O'Neil A, Pasco JA, Moylan S, et al. (septiembre de 2013). "Entonces, la depresión es una enfermedad inflamatoria, pero ¿de dónde proviene la inflamación?". BMC Medicine . 11 : 200. doi : 10.1186/1741-7015-11-200 . PMC 3846682 . PMID 24228900.
- ^ Cox WT, Abramson LY, Devine PG, Hollon SD (septiembre de 2012). "Estereotipos, prejuicios y depresión: la perspectiva integrada". Perspectivas sobre la ciencia psicológica . 7 (5): 427–49. doi :10.1177/1745691612455204. PMID 26168502. S2CID 1512121.
- ^ Kiecolt-Glaser JK, Derry HM, Fagundes CP (noviembre de 2015). "Inflamación: la depresión aviva las llamas y se alimenta del calor". The American Journal of Psychiatry . 172 (11): 1075–91. doi :10.1176/appi.ajp.2015.15020152. PMC 6511978 . PMID 26357876.
- ^ Williams C (4 de enero de 2015). «¿Es la depresión una especie de reacción alérgica?». The Guardian . Archivado desde el original el 21 de octubre de 2022. Consultado el 11 de diciembre de 2016 .
- ^ Brietzke E, Stertz L, Fernandes BS, Kauer-Sant'anna M, Mascarenhas M, Escosteguy Vargas A, et al. (agosto de 2009). "Comparación de los niveles de citocinas en pacientes deprimidos, maníacos y eutímicos con trastorno bipolar". Journal of Affective Disorders . 116 (3): 214–7. doi :10.1016/j.jad.2008.12.001. PMID 19251324.
- ^ Müller N, Schwarz MJ, Dehning S, Douhe A, Cerovecki A, Goldstein-Müller B, et al. (julio de 2006). "El inhibidor de la ciclooxigenasa-2 celecoxib tiene efectos terapéuticos en la depresión mayor: resultados de un estudio piloto doble ciego, aleatorizado, controlado con placebo y complementario a la reboxetina". Psiquiatría molecular . 11 (7): 680–4. doi : 10.1038/sj.mp.4001805 . PMID 16491133.
- ^ Canli T (2014). "Reconceptualización del trastorno depresivo mayor como enfermedad infecciosa". Biología de los trastornos del estado de ánimo y la ansiedad . 4 : 10. doi : 10.1186/2045-5380-4-10 . PMC 4215336. PMID 25364500 .
- ^ Saini A, Oh TH, Ghanem DA, Castro M, Butler M, Sin Fai Lam CC, et al. (octubre de 2022). "Marcadores inflamatorios y de gases en sangre del delirio por COVID-19 en comparación con el delirio sin COVID-19: un estudio transversal". Envejecimiento y salud mental . 26 (10): 2054–2061. doi : 10.1080/13607863.2021.1989375 . PMID 34651536. S2CID 238990849. Archivado desde el original el 22 de octubre de 2021 . Consultado el 20 de febrero de 2023 .
- ^ Ramanlal R, Gupta V (2021). "Fisiología, vasodilatación". StatPearls . Treasure Island (FL): StatPearls Publishing. PMID 32491494. Archivado desde el original el 11 de mayo de 2021 . Consultado el 22 de septiembre de 2021 .
- ^ ab Parimisetty A, Dorsemans AC, Awada R, Ravanan P, Diotel N, Lefebvre d'Hellencourt C (marzo de 2016). "Conversación secreta entre el tejido adiposo y el sistema nervioso central a través de factores secretados: una frontera emergente en la investigación neurodegenerativa". Journal of Neuroinflammation (Revisión). 13 (1): 67. doi : 10.1186/s12974-016-0530-x . PMC 4806498. PMID 27012931 .
- ^ Kershaw EE, Flier JS (junio de 2004). "El tejido adiposo como órgano endocrino". Revista de endocrinología clínica y metabolismo . 89 (6): 2548–56. doi : 10.1210/jc.2004-0395 . PMID: 15181022.
- ^ Bastard JP, Jardel C, Bruckert E, Blondy P, Capeau J, Laville M, et al. (septiembre de 2000). "Los niveles elevados de interleucina 6 se reducen en el suero y el tejido adiposo subcutáneo de mujeres obesas después de la pérdida de peso". The Journal of Clinical Endocrinology and Metabolism . 85 (9): 3338–42. doi : 10.1210/jcem.85.9.6839 . PMID 10999830.
- ^ Mohamed-Ali V, Flower L, Sethi J, Hotamisligil G, Gray R, Humphries SE, et al. (diciembre de 2001). "Regulación beta-adrenérgica de la liberación de IL-6 del tejido adiposo: estudios in vivo e in vitro". The Journal of Clinical Endocrinology and Metabolism . 86 (12): 5864–9. doi : 10.1210/jcem.86.12.8104 . PMID 11739453. S2CID 73100391.
- ^ abcdefg Loffreda S, Yang SQ, Lin HZ, Karp CL, Brengman ML, Wang DJ, et al. (enero de 1998). "La leptina regula las respuestas inmunitarias proinflamatorias". FASEB Journal . 12 (1): 57–65. doi : 10.1096/fasebj.12.1.57 . PMID 9438411.
- ^ abcdefg Esposito K, Nappo F, Marfella R, Giugliano G, Giugliano F, Ciotola M, et al. (octubre de 2002). "Las concentraciones de citocinas inflamatorias aumentan de forma aguda por la hiperglucemia en humanos: papel del estrés oxidativo". Circulation . 106 (16): 2067–72. doi : 10.1161/01.CIR.0000034509.14906.AE . PMID 12379575.
- ^ Petersen AM, Pedersen BK (abril de 2005). "El efecto antiinflamatorio del ejercicio". Revista de fisiología aplicada . 98 (4): 1154–62. doi :10.1152/japplphysiol.00164.2004. PMID 15772055. S2CID 4776835.
- ^ Rogowski O, Shapira I, Bassat OK, Chundadze T, Finn T, Berliner S, et al. (julio de 2010). "La circunferencia de la cintura como contribuyente predominante a la respuesta microinflamatoria en el síndrome metabólico: un estudio transversal". Journal of Inflammation . 7 : 35. doi : 10.1186/1476-9255-7-35 . PMC 2919526 . PMID 20659330.
- ^ Goldfine AB, Shoelson SE (enero de 2017). "Enfoques terapéuticos dirigidos a la inflamación en la diabetes y el riesgo cardiovascular asociado". The Journal of Clinical Investigation . 127 (1): 83–93. doi : 10.1172/jci88884 . PMC 5199685 . PMID 28045401.
- ^ Choi J, Joseph L, Pilote L (marzo de 2013). "Obesidad y proteína C reactiva en varias poblaciones: una revisión sistemática y un metanálisis". Obesity Reviews . 14 (3): 232–44. doi :10.1111/obr.12003. PMID 23171381. S2CID 206227739.
Enlaces externos
- Inflamación en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.







