Hiperalgesia
| Hiperalgesia | |
|---|---|
 | |
| Especialidad | Neurología |
La hiperalgesia ( / ˌh aɪ p ər æ l ˈ dʒ iː z i ə / o /-s i ə / ; hiper del griego ὑπέρ ( huper ) 'sobre' + -algesia del griego ἄλγος (algos) 'dolor') es una sensibilidad anormalmente aumentada al dolor , que puede ser causada por daño a los nociceptores o nervios periféricos y puede causar hipersensibilidad al estímulo. Las prostaglandinas E y F son en gran parte responsables de sensibilizar los nociceptores. [1] El aumento temporal de la sensibilidad al dolor también ocurre como parte del comportamiento de enfermedad , la respuesta evolucionada a la infección. [2]
Tipos
La hiperalgesia puede experimentarse en áreas focales y discretas o en una forma más difusa que afecta a todo el cuerpo. Los estudios de condicionamiento han establecido que es posible experimentar una hiperalgesia aprendida de esta última forma, difusa.
La forma focal suele estar asociada a una lesión y se divide en dos subtipos:
- La hiperalgesia primaria describe la sensibilidad al dolor que ocurre directamente en los tejidos dañados.
- La hiperalgesia secundaria describe la sensibilidad al dolor que ocurre en los tejidos circundantes no dañados.
La hiperalgesia inducida por opioides puede desarrollarse como resultado del uso prolongado de opioides en el tratamiento del dolor crónico . [3] Varios estudios en humanos y animales han demostrado que puede desarrollarse hiperalgesia primaria o secundaria en respuesta a la exposición crónica y aguda a opioides. Este efecto secundario puede ser lo suficientemente grave como para justificar la interrupción del tratamiento con opioides.
Causas
La hiperalgesia es inducida por el factor activador de plaquetas (PAF), que se produce en una respuesta inflamatoria o alérgica . Esto parece ocurrir a través de la interacción de las células inmunes con el sistema nervioso periférico y la liberación de sustancias químicas que producen dolor ( citocinas y quimiocinas ). [4]
Una causa inusual de hiperalgesia focal es el veneno del ornitorrinco . [5]
Los usuarios de opioides a largo plazo (por ejemplo, heroína, morfina) y aquellos que toman medicamentos opioides en dosis altas para el tratamiento del dolor crónico, pueden experimentar hiperalgesia y sentir un dolor desproporcionado a los hallazgos físicos, que es una causa común de pérdida de eficacia de estos medicamentos con el tiempo. [3] [6] [7] Como puede ser difícil distinguirlo de la tolerancia, la hiperalgesia inducida por opioides a menudo se compensa aumentando la dosis de opioides, lo que potencialmente empeora el problema al aumentar aún más la sensibilidad al dolor. La hiperestimulación crónica de los receptores opioides da como resultado una homeostasis alterada de las vías de señalización del dolor en el cuerpo con varios mecanismos de acción involucrados. Una vía principal es a través de la estimulación del receptor de nociceptina , [8] [9] [10] y, por lo tanto, el bloqueo de este receptor puede ser un medio para prevenir el desarrollo de hiperalgesia. [11]
La estimulación de las fibras nociceptivas en un patrón consistente con el de la inflamación activa una forma de amplificación en la médula espinal , la potenciación a largo plazo . [12] Esto ocurre cuando las fibras del dolor hacen sinapsis con la vía del dolor, la sustancia gris periacueductal . La amplificación en la médula espinal puede ser otra forma de producir hiperalgesia.
La liberación de citocinas proinflamatorias como la interleucina-1 por leucocitos activados desencadenada por lipopolisacáridos , endotoxinas y otras señales de infección también aumenta la sensibilidad al dolor como parte del comportamiento de enfermedad , la respuesta evolucionada a la enfermedad. [2] [13] [14]
Diagnóstico
Las pruebas sencillas en la cama del paciente incluyen la respuesta (intensidad y carácter del dolor) a un hisopo de algodón, presión con el dedo, pinchazos, estímulos fríos y calientes, por ejemplo, rodillos térmicos de metal a 20 °C y 40 °C, así como el mapeo del área de la anormalidad. [ cita requerida ]
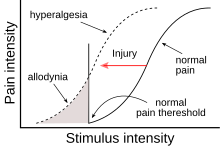
Las pruebas sensoriales cuantitativas se pueden utilizar para determinar los umbrales de dolor (un umbral de dolor reducido indica alodinia ) y las funciones de estímulo/respuesta (una respuesta al dolor aumentada indica hiperalgesia). La alodinia mecánica dinámica se puede evaluar utilizando un hisopo de algodón o un cepillo. Un algómetro de presión y monofilamentos estandarizados o estímulos de punción con peso se utilizan para evaluar la presión y la alodinia e hiperalgesia puntiformes y un comprobador térmico se utiliza para las pruebas térmicas. [15] [16]
Tratamiento
La hiperalgesia es similar a otros tipos de dolor asociado con la irritación o daño nervioso, como la alodinia y el dolor neuropático , y en consecuencia puede responder al tratamiento estándar para estas afecciones, utilizando varios medicamentos como los ISRS o los antidepresivos tricíclicos, [17] [18] los medicamentos antiinflamatorios no esteroides (AINE), [19] los glucocorticoides , [20] la gabapentina [21] o la pregabalina , [22] los antagonistas de NMDA , [23] [24] [25] u opioides atípicos como el tramadol . [26] Cuando la hiperalgesia ha sido producida por dosis altas crónicas de opioides, la reducción de la dosis puede resultar en un mejor manejo del dolor. [27] Sin embargo, al igual que con otras formas de dolor asociado con la disfunción nerviosa, el tratamiento de la hiperalgesia puede ser clínicamente desafiante, y encontrar un medicamento o una combinación de medicamentos adecuados que sean efectivos para un paciente en particular puede requerir prueba y error. Se ha demostrado que el uso de un dispositivo de estimulación nerviosa eléctrica transcutánea alivia la hiperalgesia. [28] [29]
Véase también
Referencias
- ^ "Farmacología clínica". www.clinicalpharmacology-ip.com . Archivado desde el original el 2019-12-10 . Consultado el 2017-06-25 .
- ^ ab Hart BL (1988). "Base biológica del comportamiento de los animales enfermos". Neurosci Biobehav Rev . 12 (2): 123–37. doi :10.1016/S0149-7634(88)80004-6. PMID 3050629. S2CID 17797005.
- ^ ab Chu LF, Angst MS, Clark D (2008). "Hiperalgesia inducida por opioides en humanos: mecanismos moleculares y consideraciones clínicas". Clin J Pain . 24 (6): 479–96. doi :10.1097/AJP.0b013e31816b2f43. PMID 18574358. S2CID 8489213.
- ^ Marchand F, Perretti M, McMahon SB (julio de 2005). "El papel del sistema inmunitario en el dolor crónico". Nat. Rev. Neurosci . 6 (7): 521–32. doi :10.1038/nrn1700. PMID 15995723. S2CID 9660194.
- ^ de Plater GM, Milburn PJ, Martin RL (marzo de 2001). "El veneno del ornitorrinco, Ornithorhynchus anatinus, induce una corriente dependiente del calcio en células ganglionares de la raíz dorsal cultivadas". J. Neurophysiol . 85 (3): 1340–45. doi :10.1152/jn.2001.85.3.1340. PMID 11248005. S2CID 2452708.
- ^ DuPen A, Shen D, Ersek M (septiembre de 2007). "Mecanismos de tolerancia e hiperalgesia inducidas por opioides". Pain Manag Nurs . 8 (3): 113–21. doi :10.1016/j.pmn.2007.02.004. PMID 17723928.
- ^ Mitra S (2018). "Hiperalgesia inducida por opioides: fisiopatología e implicaciones clínicas". J Opioid Manag . 4 (3): 123–30. doi :10.5055/jom.2008.0017. PMID 18717507.
- ^ Okuda-Ashitaka E, Minami T, Matsumura S, et al. (febrero de 2006). "El péptido opioide nociceptina / orfanina FQ media la alodinia inducida por prostaglandina E2, dolor táctil asociado con lesión nerviosa". euros. J. Neurociencias . 23 (4): 995–1004. doi :10.1111/j.1460-9568.2006.04623.x. PMID 16519664. S2CID 39006891.
- ^ Fu X, Zhu ZH, Wang YQ, Wu GC (enero de 2007). "Regulación de la expresión génica de citocinas proinflamatorias por la nociceptina/orfanina FQ en la médula espinal y los astrocitos cultivados". Neuroscience . 144 (1): 275–85. doi :10.1016/j.neuroscience.2006.09.016. PMID 17069983. S2CID 40500310.
- ^ Chen Y, Sommer C (mayo de 2007). "Activación del sistema opioide nociceptina en ratas. Las neuronas sensoriales producen efectos antinociceptivos en el dolor inflamatorio: participación de mediadores inflamatorios" (PDF) . J. Neurosci. Res . 85 (7): 1478–88. doi :10.1002/jnr.21272. hdl : 10161/13662 . PMID: 17387690. S2CID : 41843938.[ enlace muerto permanente ]
- ^ Tamai H, Sawamura S, Takeda K, Orii R, Hanaoka K (marzo de 2005). "Efectos antialodínicos y antihiperalgésicos del antagonista del receptor de nociceptina, JTC-801, en ratas después de una lesión e inflamación del nervio espinal". Eur. J. Pharmacol . 510 (3): 223–28. doi :10.1016/j.ejphar.2005.01.033. PMID 15763246.
- ^ Ikeda H, Stark J, Fischer H, et al. (junio de 2006). "Amplificador sináptico del dolor inflamatorio en el asta dorsal de la médula espinal". Science . 312 (5780): 1659–62. Bibcode :2006Sci...312.1659I. doi :10.1126/science.1127233. PMID 16778058. S2CID 20540556.
- ^ Kelley KW, Bluthé RM, Dantzer R, et al. (febrero de 2003). "Comportamiento de enfermedad inducido por citocinas". Brain Behav . 17 (Supl 1): S112–18. doi :10.1016/S0889-1591(02)00077-6. PMID 12615196. S2CID 25400611.
- ^ Maier SF, Wiertelak EP, Martin D, Watkins LR (octubre de 1993). "La interleucina-1 media la hiperalgesia conductual producida por el cloruro de litio y la endotoxina". Brain Res . 623 (2): 321–24. doi :10.1016/0006-8993(93)91446-Y. PMID 8221116. S2CID 40529634.
- ^ Haanpää M, Attal N, Backonja M, Baron R, Bennett M, Bouhassira D, Cruccu G, Hansson P, Haythornthwaite JA, Iannetti GD, Jensen TS, Kauppila T, Nurmikko TJ, Rice AS, Rowbotham M, Serra J, Sommer C, Smith BH, Treede RD (enero de 2001). "Directrices NeuPSIG sobre evaluación del dolor neuropático". Dolor . 152 (1): 14-27. doi :10.1016/j.pain.2010.07.031. PMID 20851519. S2CID 2032474.
- ^ Jensen TS, Finnerup NB (septiembre de 2014). "Alodinia e hiperalgesia en el dolor neuropático: manifestaciones clínicas y mecanismos". Lancet Neurol . 13 (9): 924–35. doi :10.1016/S1474-4422(14)70102-4. PMID 25142459. S2CID 25011309.
- ^ Sindrup SH, Otto M, Finnerup NB, Jensen TS (junio de 2005). "Antidepresivos en el tratamiento del dolor neuropático". Farmacología básica y clínica y toxicología . 96 (6): 399–409. doi : 10.1111/j.1742-7843.2005.pto_96696601.x . PMID 15910402.
- ^ Matsuzawa-Yanagida K, Narita M, Nakajima M, et al. (julio de 2008). "Utilidad de los antidepresivos para mejorar el estado de dolor neuropático y la ansiedad inducida por el dolor a través de acciones en diferentes sitios cerebrales". Neuropsicofarmacología . 33 (8): 1952–65. doi : 10.1038/sj.npp.1301590 . PMID 17957217.
- ^ Koppert W, Wehrfritz A, Körber N, et al. (marzo de 2004). "Los inhibidores de la isoenzima de la ciclooxigenasa parecoxib y paracetamol reducen la hiperalgesia central en humanos". Pain . 108 (1–2): 148–53. doi :10.1016/j.pain.2003.12.017. PMID 15109518. S2CID 33124447.
- ^ Stubhaug A, Romundstad L, Kaasa T, Breivik H (octubre de 2007). "La metilprednisolona y el ketorolaco reducen rápidamente la hiperalgesia alrededor de una lesión por quemadura cutánea y aumentan los umbrales de dolor por presión". Acta Anaesthesiol Scand . 51 (9): 1138–46. doi :10.1111/j.1399-6576.2007.01415.x. PMID 17714578. S2CID 20639496.
- ^ Gottrup H, Juhl G, Kristensen AD, et al. (diciembre de 2004). "La gabapentina oral crónica reduce los elementos de sensibilización central en la hiperalgesia experimental humana". Anestesiología . 101 (6): 1400–08. doi :10.1097/00000542-200412000-00021. PMID 15564948. S2CID 15060257.
- ^ Chizh BA, Göhring M, Tröster A, Quartey GK, Schmelz M, Koppert W (febrero de 2007). "Efectos de la pregabalina oral y el aprepitant sobre el dolor y la sensibilización central en el modelo de hiperalgesia eléctrica en voluntarios humanos". Br J Anaesth . 98 (2): 246–54. doi : 10.1093/bja/ael344 . PMID 17251214.
- ^ Warncke T, Stubhaug A, Jørum E (agosto de 1997). "La ketamina, un antagonista del receptor NMDA, suprime las propiedades espaciales y temporales de la hiperalgesia secundaria inducida por quemaduras en el hombre: una comparación doble ciego cruzada con morfina y placebo". Pain . 72 (1–2): 99–106. doi :10.1016/S0304-3959(97)00006-7. PMID 9272793. S2CID 1343794.
- ^ De Kock MF, Lavand'homme PM (marzo de 2007). "El papel clínico de los antagonistas del receptor NMDA para el tratamiento del dolor posoperatorio". Best Pract Res Clin Anaesthesiol . 21 (1): 85–98. doi :10.1016/j.bpa.2006.12.006. PMID 17489221.
- ^ Klein T, Magerl W, Hanschmann A, Althaus M, Treede RD (enero de 2008). "Propiedades antihiperalgésicas y analgésicas del antagonista del receptor N-metil-D-aspartato (NMDA), neramexano, en un modelo humano sustituto de hiperalgesia neurogénica". Eur J Pain . 12 (1): 17–29. doi :10.1016/j.ejpain.2007.02.002. PMID 17449306. S2CID 2875679.
- ^ Christoph T, Kögel B, Strassburger W, Schug SA (2007). "El tramadol tiene una mejor relación de potencia con respecto a la morfina en los modelos de dolor neuropático que en los modelos de dolor nociceptivo". Drugs in R&D . 8 (1): 51–57. doi :10.2165/00126839-200708010-00005. PMID 17249849. S2CID 10268544.
- ^ Vorobeychik Y, Chen L, Bush MC, Mao J (septiembre de 2008). "Mejora del efecto analgésico opioide tras la reducción de la dosis de opioides". Pain Med . 9 (6): 724–27. doi : 10.1111/j.1526-4637.2008.00501.x . PMID 18816332.
- ^ DeSantana, JM; Walsh, DM; Vance, C; Rakel, BA; Sluka, KA (diciembre de 2008). "Efectividad de la estimulación nerviosa eléctrica transcutánea para el tratamiento de la hiperalgesia y el dolor". Current Rheumatology Reports . 10 (6): 492–99. doi :10.1007/s11926-008-0080-z. PMC 2746624 . PMID 19007541.
- ^ Sluka, KA; Chandran, P (noviembre de 2002). "Mejora de la reducción de la hiperalgesia mediante la administración combinada de clonidina y TENS". Pain . 100 (1–2): 183–90. doi :10.1016/s0304-3959(02)00294-4. PMID 12435471. S2CID 12117342.