Flagelo
| Flagelo | |
|---|---|
 Estructura del flagelo bacteriano | |
.jpg/440px-Chlamydomonas_(10000x).jpg) | |
| Identificadores | |
| Malla | D005407 |
| El | H1.00.01.1.01032 |
| FMA | 67472 |
| Terminología anatómica [editar en Wikidata] | |
Un flagelo ( / fləˈdʒɛləm / ; pl.: flagella ) ( del latín 'látigo' o 'azote') es un apéndice similar a un cabello que sobresale de ciertas células espermáticas de plantas y animales , de esporas de hongos ( zoosporas ) y de una amplia gama de microorganismos para proporcionar motilidad . [1] [2] [3] [4] Muchos protistas con flagelos se conocen como flagelados .
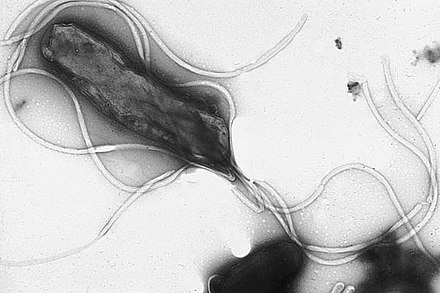
Un microorganismo puede tener de uno a muchos flagelos. Una bacteria gramnegativa, Helicobacter pylori , por ejemplo, utiliza sus flagelos para impulsarse a través del estómago y alcanzar el revestimiento mucoso , donde puede colonizar el epitelio y potencialmente causar gastritis y úlceras , un factor de riesgo para el cáncer de estómago . [5] En algunas bacterias enjambre , el flagelo también puede funcionar como un orgánulo sensorial , siendo sensible a la humedad fuera de la célula. [6]
En los tres dominios de Bacteria , Archaea y Eukaryota , el flagelo tiene una estructura, composición proteica y mecanismo de propulsión diferentes, pero comparte la misma función de proporcionar motilidad. La palabra latina flagellum significa " látigo " para describir su movimiento de natación similar a un látigo. El flagelo en Archaea se llama archaellum para señalar su diferencia con el flagelo bacteriano. [7] [8]
Los flagelos y los cilios eucariotas son idénticos en estructura, pero tienen longitudes y funciones diferentes. [9] Las fimbrias y pili procariotas son apéndices más pequeños y delgados, con funciones diferentes. Los cilios están adheridos a la superficie de los flagelos y se utilizan para nadar o mover líquido de una región a otra. [10]
Tipos

Los tres tipos de flagelos son bacterianos, arqueológicos y eucariotas.
Los flagelos de los eucariotas tienen dineína y microtúbulos que se mueven mediante un mecanismo de flexión. Las bacterias y las arqueas no tienen dineína ni microtúbulos en sus flagelos y se mueven mediante un mecanismo rotatorio. [12]
Otras diferencias entre estos tres tipos son:
- Los flagelos bacterianos son filamentos helicoidales, cada uno con un motor rotatorio en su base que puede girar en el sentido de las agujas del reloj o en sentido contrario. [13] [14] [15] Proporcionan dos de varios tipos de motilidad bacteriana . [16] [17]
- Los flagelos arqueológicos ( archaella ) son superficialmente similares a los flagelos bacterianos en que también tienen un motor rotatorio, pero son diferentes en muchos detalles y se consideran no homólogos . [18] [19] [20]
- Los flagelos eucariotas (de las células animales, vegetales y protistas) son proyecciones celulares complejas que se mueven de un lado a otro. Los flagelos eucariotas y los cilios móviles son idénticos en estructura, pero tienen longitudes, formas de onda y funciones diferentes. Los cilios primarios son inmóviles y tienen un axonema 9+0 estructuralmente diferente en lugar del axonema 9+2 que se encuentra tanto en los flagelos como en los cilios móviles.
Flagelos bacterianos
Estructura y composición
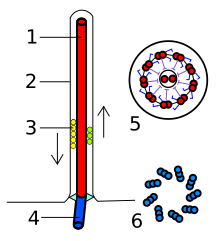
El flagelo bacteriano está formado por subunidades proteicas de flagelina . [12] Su forma es la de un tubo hueco de 20 nanómetros de espesor. Es helicoidal y tiene una curva pronunciada justo fuera de la membrana externa; este "gancho" permite que el eje de la hélice apunte directamente lejos de la célula. Un eje corre entre el gancho y el cuerpo basal , pasando a través de anillos de proteína en la membrana de la célula que actúan como cojinetes. Los organismos grampositivos tienen dos de estos anillos del cuerpo basal, uno en la capa de peptidoglicano y otro en la membrana plasmática . Los organismos gramnegativos tienen cuatro de estos anillos: el anillo L se asocia con los lipopolisacáridos , el anillo P se asocia con la capa de peptidoglicano , el anillo M está incrustado en la membrana plasmática y el anillo S está directamente unido al citoplasma . El filamento termina con una proteína de protección. [21] [22]
El filamento flagelar es el tornillo largo y helicoidal que propulsa a la bacteria cuando es rotada por el motor, a través del gancho. En la mayoría de las bacterias que se han estudiado, incluidas las gramnegativas Escherichia coli , Salmonella typhimurium , Caulobacter crescentus y Vibrio alginolyticus , el filamento está formado por 11 protofilamentos aproximadamente paralelos al eje del filamento. Cada protofilamento es una serie de cadenas de proteínas en tándem. Sin embargo, Campylobacter jejuni tiene siete protofilamentos. [23]
El cuerpo basal tiene varias características en común con algunos tipos de poros secretores , como el "tapón" hueco en forma de varilla que se extiende a través de la membrana plasmática. Las similitudes entre los flagelos bacterianos y las estructuras y proteínas del sistema secretor bacteriano proporcionan evidencia científica que respalda la teoría de que los flagelos bacterianos evolucionaron a partir del sistema de secreción de tipo tres (TTSS).
La estructura atómica tanto de los flagelos bacterianos como del inyectisoma del SSTT se ha dilucidado en gran detalle, especialmente con el desarrollo de la criomicroscopía electrónica . Las partes mejor comprendidas son las que se encuentran entre la membrana interna y la externa , es decir, los anillos de andamiaje de la membrana interna (IM), los pares de andamiaje de la membrana externa (OM) y las secciones de varilla/aguja (inyectisoma) o varilla/gancho (flagelo). [24]
Motor

El flagelo bacteriano es impulsado por un motor rotatorio ( complejo Mot ) compuesto de proteína, ubicado en el punto de anclaje del flagelo en la membrana celular interna. El motor es impulsado por fuerza protón-motriz , es decir, por el flujo de protones (iones de hidrógeno) a través de la membrana celular bacteriana debido a un gradiente de concentración establecido por el metabolismo de la célula ( las especies de Vibrio tienen dos tipos de flagelos, lateral y polar, y algunos son impulsados por una bomba de iones de sodio en lugar de una bomba de protones [26] ). El rotor transporta protones a través de la membrana y gira en el proceso. El rotor solo puede operar a 6.000 a 100.000 rpm , [27] pero con el filamento flagelar unido generalmente solo alcanza de 200 a 1000 rpm. La dirección de rotación puede cambiarse mediante el interruptor del motor flagelar casi instantáneamente, causado por un ligero cambio en la posición de una proteína, FliG , en el rotor. [28] El torque se transfiere del MotAB a la hélice de torque en el dominio D5 de FliG y con el aumento en el requerimiento de torque o velocidad se emplean más MotAB. [25] Debido a que el motor flagelar no tiene interruptor de encendido y apagado, la proteína epsE se utiliza como un embrague mecánico para desacoplar el motor del rotor, deteniendo así el flagelo y permitiendo que la bacteria permanezca en un lugar. [29]
| Parte de una serie sobre |
| Movimiento microbiano y microrobot |
|---|
 |
| Micronadadores |
| Motores moleculares |
La producción y rotación de un flagelo puede consumir hasta el 10% del presupuesto energético de una célula de Escherichia coli y se ha descrito como una "máquina devoradora de energía" [30] . Su funcionamiento genera especies reactivas de oxígeno que elevan las tasas de mutación. [30]
La forma cilíndrica de los flagelos es adecuada para la locomoción de organismos microscópicos; estos organismos operan con un número de Reynolds bajo , donde la viscosidad del agua circundante es mucho más importante que su masa o inercia. [31]
La velocidad de rotación de los flagelos varía en respuesta a la intensidad de la fuerza protónica motriz, lo que permite ciertas formas de control de la velocidad y también permite que algunos tipos de bacterias alcancen velocidades notables en proporción a su tamaño; algunas alcanzan aproximadamente 60 longitudes de célula por segundo. A esa velocidad, una bacteria tardaría unos 245 días en cubrir 1 km; aunque eso puede parecer lento, la perspectiva cambia cuando se introduce el concepto de escala. En comparación con las formas de vida macroscópicas, es realmente muy rápida cuando se expresa en términos de número de longitudes corporales por segundo. Un guepardo, por ejemplo, solo alcanza unas 25 longitudes corporales por segundo. [32]
Mediante el uso de sus flagelos, las bacterias pueden moverse rápidamente hacia los atrayentes y alejarse de los repelentes, por medio de un paseo aleatorio sesgado , con carreras y volteretas provocadas por la rotación de su flagelo en sentido antihorario y horario , respectivamente. Las dos direcciones de rotación no son idénticas (con respecto al movimiento del flagelo) y se seleccionan mediante un interruptor molecular. [33] La rotación en el sentido de las agujas del reloj se denomina modo de tracción con el cuerpo siguiendo a los flagelos. La rotación en el sentido contrario a las agujas del reloj se denomina modo de propulsión con los flagelos rezagados detrás del cuerpo. [34]
Asamblea
Durante el ensamblaje flagelar, los componentes del flagelo pasan a través de los núcleos huecos del cuerpo basal y del filamento naciente. Durante el ensamblaje, los componentes proteicos se agregan en la punta del flagelo en lugar de en la base. [35] In vitro , los filamentos flagelares se ensamblan espontáneamente en una solución que contiene flagelina purificada como única proteína. [36]
Evolución
Al menos 10 componentes proteicos del flagelo bacteriano comparten proteínas homólogas con el sistema de secreción tipo tres (T3SS) que se encuentra en muchas bacterias gramnegativas, [37] por lo que es probable que uno haya evolucionado del otro. Debido a que el T3SS tiene una cantidad similar de componentes que un aparato flagelar (alrededor de 25 proteínas), es difícil determinar cuál evolucionó primero. Sin embargo, el sistema flagelar parece involucrar más proteínas en general, incluidos varios reguladores y chaperonas, por lo que se ha argumentado que los flagelos evolucionaron a partir de un T3SS. Sin embargo, también se ha sugerido [38] que el flagelo puede haber evolucionado primero o que las dos estructuras evolucionaron en paralelo. La necesidad de motilidad (movilidad) de los organismos unicelulares tempranos respalda que los flagelos más móviles serían seleccionados por la evolución primero, [38] pero el T3SS que evoluciona a partir del flagelo puede verse como una "evolución reductiva" y no recibe respaldo topológico de los árboles filogenéticos . [39] La hipótesis de que las dos estructuras evolucionaron por separado a partir de un ancestro común explica las similitudes proteicas entre las dos estructuras, así como su diversidad funcional. [40]
Los flagelos y el debate sobre el diseño inteligente
Algunos autores han argumentado que los flagelos no pueden haber evolucionado, asumiendo que solo pueden funcionar correctamente cuando todas las proteínas están en su lugar. En otras palabras, el aparato flagelar es " irreductiblemente complejo ". [41] Sin embargo, muchas proteínas pueden eliminarse o mutarse y el flagelo aún funciona, aunque a veces con una eficiencia reducida. [42] Además, con muchas proteínas únicas para un cierto número de especies, la diversidad de la composición de los flagelos bacterianos fue mayor de lo esperado. [43] Por lo tanto, el aparato flagelar es claramente muy flexible en términos evolutivos y perfectamente capaz de perder o ganar componentes proteicos. Por ejemplo, se han encontrado varias mutaciones que aumentan la motilidad de E. coli . [44] La evidencia adicional de la evolución de los flagelos bacterianos incluye la existencia de flagelos vestigiales, formas intermedias de flagelos y patrones de similitudes entre las secuencias de proteínas flagelares, incluida la observación de que casi todas las proteínas flagelares centrales tienen homologías conocidas con proteínas no flagelares. [37] Además, se han identificado varios procesos que desempeñan papeles importantes en la evolución flagelar, incluido el autoensamblaje de subunidades repetitivas simples, la duplicación genética con divergencia posterior, el reclutamiento de elementos de otros sistemas ("bricolaje molecular") y la recombinación. [45]
Disposiciones flagelares
Distintas especies de bacterias tienen diferentes números y disposiciones de flagelos, [46] [47] denominados utilizando el término trico , del griego trichos que significa cabello . [48]
- Las bacterias monotricas como Vibrio cholerae tienen un solo flagelo polar . [49]
- Las bacterias anfítricas tienen un solo flagelo en cada uno de los dos extremos opuestos (por ejemplo, Campylobacter jejuni o Alcaligenes faecalis ); ambos flagelos giran pero se coordinan para producir un empuje coherente.
- Las bacterias lofótricas ( lopho, término griego que significa cresta o penacho ) [50] tienen múltiples flagelos ubicados en el mismo punto de la superficie bacteriana, como Helicobacter pylori , que actúan en conjunto para impulsar a las bacterias en una sola dirección. En muchos casos, las bases de múltiples flagelos están rodeadas por una región especializada de la membrana celular, llamada orgánulo polar . [ cita requerida ]
- Las bacterias perítricas tienen flagelos que se proyectan en todas las direcciones (por ejemplo, E. coli ).
La rotación en sentido antihorario de un flagelo polar monotrico empuja a la célula hacia adelante con el flagelo arrastrándose hacia atrás, de manera muy similar a un sacacorchos que se mueve dentro del corcho. El agua a escala microscópica es muy viscosa , a diferencia del agua normal .
Las espiroquetas , por el contrario, tienen flagelos llamados endoflagelos que surgen de polos opuestos de la célula y están ubicados dentro del espacio periplásmico como se muestra al romper la membrana externa y también mediante microscopía criotomográfica electrónica . [51] La rotación de los filamentos en relación con el cuerpo celular hace que toda la bacteria se mueva hacia adelante en un movimiento similar al de un sacacorchos, incluso a través de material lo suficientemente viscoso como para evitar el paso de bacterias normalmente flageladas.
En ciertas formas grandes de Selenomonas , más de 30 flagelos individuales están organizados fuera del cuerpo celular, enroscándose helicoidalmente unos sobre otros para formar una estructura gruesa (fácilmente visible con el microscopio óptico) llamada "fascículo".
En algunas especies de Vibrio (particularmente Vibrio parahaemolyticus [52] ) y bacterias relacionadas como Aeromonas , coexisten dos sistemas flagelares, que utilizan diferentes conjuntos de genes y diferentes gradientes iónicos para obtener energía. Los flagelos polares se expresan de manera constitutiva y proporcionan motilidad en un fluido a granel, mientras que los flagelos laterales se expresan cuando los flagelos polares encuentran demasiada resistencia para girar. [53] [54] [55] [56] [57] [58] Estos proporcionan motilidad de enjambre en superficies o en fluidos viscosos.
Agrupamiento
La agrupación es un evento que puede ocurrir en células multiflageladas, agrupando los flagelos y haciendo que giren de manera coordinada.
Los flagelos son hélices levógiras y, cuando sus rotores los hacen girar en sentido contrario a las agujas del reloj, pueden agruparse y rotar juntos. Cuando los rotores invierten su dirección, girando en el sentido de las agujas del reloj, el flagelo se desenrolla del haz. Esto puede hacer que la célula detenga su movimiento hacia adelante y, en su lugar, comience a moverse en el mismo lugar, lo que se conoce como "tumbling" . El "tumbling" da como resultado una reorientación estocástica de la célula, lo que hace que cambie la dirección de su nado hacia adelante.
No se sabe qué estímulos impulsan el cambio entre el agrupamiento y el volteo, pero el motor es muy adaptable a diferentes señales. En el modelo que describe la quimiotaxis ("movimiento a propósito"), la rotación en el sentido de las agujas del reloj de un flagelo se suprime mediante compuestos químicos favorables para la célula (por ejemplo, alimentos). Cuando se mueve en una dirección favorable, la concentración de dichos atrayentes químicos aumenta y, por lo tanto, los volteos se suprimen continuamente, lo que permite el movimiento hacia adelante; de la misma manera, cuando la dirección del movimiento de la célula es desfavorable (por ejemplo, lejos de un atrayente químico), los volteos ya no se suprimen y ocurren con mucha más frecuencia, con la posibilidad de que la célula se reoriente de esta manera en la dirección correcta.
Incluso si todos los flagelos giraran en el sentido de las agujas del reloj, a menudo no podrían formar un haz debido a razones geométricas e hidrodinámicas. [59] [60]
Flagelos eucariotas


Terminología
Con el objetivo de enfatizar la distinción entre los flagelos bacterianos y los cilios y flagelos eucariotas, algunos autores intentaron reemplazar el nombre de estas dos estructuras eucariotas con " undulipodios " (por ejemplo, todos los artículos de Margulis desde la década de 1970) [61] o "cilios" para ambos (por ejemplo, Hülsmann, 1992; [62] Adl et al., 2012; [63] la mayoría de los artículos de Cavalier-Smith ), preservando "flagelos" para la estructura bacteriana. Sin embargo, el uso discriminatorio de los términos "cilios" y "flagelos" para eucariotas adoptado en este artículo (ver § Flagelos versus cilios a continuación) aún es común (por ejemplo, Andersen et al., 1991; [64] Leadbeater et al., 2000). [65]
Estructura interna
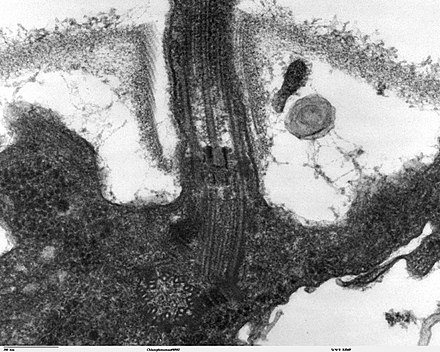
El núcleo de un flagelo eucariota, conocido como axonema, es un haz de nueve pares fusionados de microtúbulos conocidos como dobletes que rodean dos microtúbulos centrales simples ( singletes ). Este axonema 9+2 es característico del flagelo eucariota. En la base de un flagelo eucariota hay un cuerpo basal , "blefaroplasto" o cinetosoma, que es el centro organizador de microtúbulos para los microtúbulos flagelares y tiene unos 500 nanómetros de largo. Los cuerpos basales son estructuralmente idénticos a los centriolos . El flagelo está encerrado dentro de la membrana plasmática de la célula , de modo que el interior del flagelo es accesible al citoplasma de la célula .
Además del axonema y el cuerpo basal, relativamente constantes en morfología, otras estructuras internas del aparato flagelar son la zona de transición (donde se encuentran el axonema y el cuerpo basal) y el sistema radicular (estructuras microtubulares o fibrilares que se extienden desde los cuerpos basales hacia el citoplasma), más variables y útiles como indicadores de relaciones filogenéticas de eucariotas. Otras estructuras, más infrecuentes, son el bastón paraflagelar (o paraxial, paraxonemal), la fibra R y la fibra S. [66] : 63–84 Para las estructuras de superficie, véase a continuación.
Mecanismo
Cada uno de los 9 dobletes de microtúbulos externos extiende un par de brazos de dineína (un brazo "interno" y un brazo "externo") hacia el microtúbulo adyacente; estos producen fuerza a través de la hidrólisis de ATP. El axonema flagelar también contiene radios radiales , complejos polipeptídicos que se extienden desde cada uno de los nueve dobletes de microtúbulos externos hacia el par central, con la "cabeza" del radio mirando hacia adentro. Se cree que el radio radial está involucrado en la regulación del movimiento flagelar, aunque su función exacta y método de acción aún no se entienden. [67]
Flagelos versus cilios

Los patrones regulares de latidos de los cilios y flagelos eucariotas generan movimiento a nivel celular. Los ejemplos van desde la propulsión de células individuales, como la natación de los espermatozoides, hasta el transporte de líquido a lo largo de una capa estacionaria de células, como en el tracto respiratorio . [68]
Aunque los cilios y flagelos eucariotas son en última instancia lo mismo, a veces se los clasifica por su patrón de movimiento, una tradición que data de antes de que se conocieran sus estructuras. En el caso de los flagelos, el movimiento suele ser plano y ondulatorio, mientras que los cilios móviles suelen realizar un movimiento tridimensional más complicado con un movimiento de potencia y recuperación. [68] Otra forma tradicional de distinción es por el número de 9+2 orgánulos en la célula. [67]
Transporte intraflagelar
El transporte intraflagelar , el proceso por el cual las subunidades axonemales, los receptores transmembrana y otras proteínas se mueven hacia arriba y hacia abajo a lo largo del flagelo, es esencial para el funcionamiento adecuado del flagelo, tanto en la motilidad como en la transducción de señales. [69]
Evolución y ocurrencia
Los flagelos o cilios eucariotas, probablemente una característica ancestral, [70] están muy extendidos en casi todos los grupos de eucariotas, como una condición relativamente perenne o como una etapa flagelada del ciclo de vida (por ejemplo, zoides , gametos , zoosporas , que pueden producirse continuamente o no). [71] [72] [63]
La primera situación se encuentra tanto en células especializadas de organismos multicelulares (por ejemplo, los coanocitos de las esponjas , o los epitelios ciliados de los metazoos ), como en ciliados y muchos eucariotas con una "condición flagelada" (o "nivel de organización monadoide", véase Flagellata , un grupo artificial).
Las etapas del ciclo de vida flagelado se encuentran en muchos grupos, por ejemplo, muchas algas verdes (zoosporas y gametos masculinos), briofitas (gametos masculinos), pteridofitas (gametos masculinos), algunas gimnospermas ( cícadas y Ginkgo , como gametos masculinos), diatomeas céntricas (gametos masculinos), algas pardas (zoosporas y gametos), oomicetos (zoosporas y gametos asexuales), hifoquítridos (zoosporas), laberintomicetos (zoosporas), algunos apicomplejos (gametos), algunos radiolarios (probablemente gametos), [73] foraminíferos (gametos), plasmodioforomicetos (zoosporas y gametos), mixogástridos (zoosporas), metazoos (gametos masculinos) y hongos quítridos (zoosporas y gametos).
Los flagelos o cilios están completamente ausentes en algunos grupos, probablemente debido a una pérdida más que a ser una condición primitiva. La pérdida de cilios ocurrió en las algas rojas , algunas algas verdes ( Zygnematophyceae ), las gimnospermas excepto las cícadas y el Ginkgo , las angiospermas , las diatomeas pennadas , algunos apicomplejos , algunos amebozoos , en el esperma de algunos metazoos , [74] y en los hongos (excepto los quitridios ).
Tipología
Se utilizan varios términos relacionados con los flagelos o cilios para caracterizar a los eucariotas. [72] [75] [66] : 60–63 [76] [77] Según las estructuras superficiales presentes, los flagelos pueden ser:
- flagelos en látigo (= flagelos lisos, acronemáticos): sin pelos, p. ej., en Opisthokonta
- flagelos peludos (= oropel, flamígero, flagelo pleuronemático): con pelos (= mastigonemas sensu lato ), divididos en:
- con pelos finos (= no tubulares o pelos simples): se encuentra en Euglenophyceae , Dinoflagellata , algunas Haptophyceae ( Pavlovales )
- con pelos rígidos (= pelos tubulares, retronemas, mastigonemas sensu stricto ), divididos en:
- Pelos bipartitos: con dos regiones. Se presenta en Cryptophyceae , Prasinophyceae y algunos Heterokonta.
- pelos tripartitos (= estraminipilos): con tres regiones (una base, un tallo tubular y uno o más pelos terminales). Se presenta en la mayoría de los heterokontas.
- flagelos esticonémicos: con una sola fila de pelos
- flagelos pantonemáticos: con dos filas de pelos
- acronemático: flagelos con un solo mastigonema terminal o pelo flagelar (p. ej., bodónidos ); [78] algunos autores utilizan el término como sinónimo de latigazo cervical
- con escamas: p. ej., Prasinophyceae
- con espinas: por ejemplo, algunas algas pardas
- con membrana ondulada: p. ej., algunos cinetoplastos , algunos parabasálidos
- con probóscide (protuberancia de la célula en forma de tronco): p. ej., apusomonas , algunos bodónidos [79]
Según el número de flagelos las células pueden ser: (recordando que algunos autores utilizan “ciliadas” en lugar de “flageladas”) [63] [80]
- uniflagelados: por ejemplo, la mayoría de Opisthokonta
- biflagelados: p. ej., todos los dinoflagelados , los gametos de las carofíceas , de la mayoría de las briofitas y de algunos metazoos [74]
- triflagelados: p. ej., los gametos de algunos foraminíferos
- cuadriflagelados: por ejemplo, algunas Prasinophyceae , Collodictyonidae
- Octoflagelados: por ejemplo, algunas Diplomonada , algunas Prasinophyceae
- multiflagelados: p. ej., Opalinata , Ciliophora , Stephanopogon , Parabasalida , Hemimastigophora , Caryoblastea , Multicilia , los gametos (o zoides ) de Oedogoniales ( Chlorophyta ), algunas pteridofitas y algunas gimnospermas
Según el lugar de inserción de los flagelos: [81]
- opistoconto: células con flagelos insertados posteriormente, por ejemplo, en Opisthokonta (Vischer, 1945). En Haptophyceae , los flagelos se insertan de forma lateral a terminal, pero se dirigen posteriormente durante la natación rápida. [82]
- akrokont: células con flagelos insertados apicalmente
- subakrokont: células con flagelos insertados subapicalmente
- pleuroconte: células con flagelos insertados lateralmente
Según el patrón de golpeo:
- planeamiento: un flagelo que se arrastra sobre el sustrato [79]
- heterodinámico: flagelos con diferentes patrones de batido (normalmente un flagelo funciona para capturar alimentos y el otro para planear, anclarse, propulsarse o "dirigirse") [83]
- Isodinámico: los flagelos laten con los mismos patrones
Otros términos relacionados con el tipo flagelar:
- isoconto: células con flagelos de igual longitud. También se utilizaba antiguamente para referirse a las clorofitas.
- anisokont: células con flagelos de longitud desigual, por ejemplo, algunas Euglenophyceae y Prasinophyceae
- heterokonta: término introducido por Luther (1899) para referirse a las Xanthophyceae , debido al par de flagelos de longitud desigual. Ha adquirido un significado específico al referirse a células con un flagelo anterior estraminipilo (con mastigonemas tripartitos, en una o dos filas) y un flagelo posterior generalmente liso. También se utiliza para referirse al taxón Heterokonta
- estefanoconto: células con una corona de flagelos cerca de su extremo anterior, por ejemplo, los gametos y esporas de Oedogoniales , las esporas de algunos Bryopsidales . Término introducido por Blackman y Tansley (1902) para referirse a los Oedogoniales.
- akont: células sin flagelos. También se utilizaba para referirse a grupos taxonómicos, como Aconta o Akonta: las Zygnematophyceae y las Bacillariophyceae (Oltmanns, 1904), o las Rhodophyceae (Christensen, 1962)
Flagelos arqueológicos
El arquelo que poseen algunas especies de Archaea es superficialmente similar al flagelo bacteriano; en la década de 1980, se pensaba que eran homólogos sobre la base de la morfología y el comportamiento generales. [84] Tanto los flagelos como las arquelas consisten en filamentos que se extienden fuera de la célula y giran para impulsarla. Los flagelos de Archaea tienen una estructura única que carece de un canal central. Al igual que las pilinas bacterianas de tipo IV , las proteínas de Archaea (arqueelinas) están hechas con péptidos señal de clase 3 y son procesadas por una enzima similar a la peptidasa de prepilina de tipo IV. Las arqueelinas generalmente se modifican mediante la adición de glicanos ligados a N que son necesarios para el ensamblaje o la función adecuados. [3]
Los descubrimientos realizados en la década de 1990 revelaron numerosas diferencias detalladas entre los flagelos de las arqueas y las bacterias, entre ellas:
- La rotación de los flagelos bacterianos es impulsada por la fuerza motriz de protones (un flujo de iones H +) o, ocasionalmente, por la fuerza motriz de sodio (un flujo de iones Na + ); la rotación de los flagelos arqueológicos es impulsada por ATP . [85]
- Mientras que las células bacterianas suelen tener muchos filamentos flagelares, cada uno de los cuales gira independientemente, el flagelo arqueológico está compuesto por un conjunto de muchos filamentos que giran como un solo conjunto.
- Los flagelos bacterianos crecen mediante la adición de subunidades de flagelina en la punta; los flagelos arqueológicos crecen mediante la adición de subunidades en la base.
- Los flagelos bacterianos son más gruesos que los de las arqueas, y el filamento bacteriano tiene un "tubo" hueco lo suficientemente grande en su interior como para que las subunidades de flagelina puedan fluir hacia arriba por el interior del filamento y agregarse en la punta; el arqueo es demasiado delgado (12-15 nm) para permitir esto. [86]
- Muchos componentes de los flagelos bacterianos comparten una secuencia similar a los componentes de los sistemas de secreción de tipo III , pero los componentes de los flagelos bacterianos y de las arqueas no comparten ninguna secuencia similar. En cambio, algunos componentes de las arqueas comparten una secuencia y una similitud morfológica con los componentes de los pili de tipo IV , que se ensamblan mediante la acción de los sistemas de secreción de tipo II (la nomenclatura de los pili y de los sistemas de secreción de proteínas no es uniforme). [86]
Estas diferencias apoyan la teoría de que los flagelos bacterianos y las arqueas son un caso clásico de analogía biológica o evolución convergente , en lugar de homología . [87] [88] [89] La investigación sobre la estructura de las arqueas logró avances significativos a principios de la década de 2010, con la primera estructura de resolución atómica de una proteína de las arqueas, el descubrimiento de funciones adicionales de las arqueas y los primeros informes de las arqueas en Nanoarchaeota y Thaumarchaeota. [90] [91]
Hongo
Los únicos hongos que tienen un solo flagelo en sus esporas son los quitridios . En Batrachochytrium dendrobatidis, el flagelo tiene una longitud de 19 a 20 μm. [92] Un centriolo no funcional se encuentra adyacente al cinetosoma . Nueve puntales interconectados unen el cinetosoma al plasmalema y hay una placa terminal en la zona de transición. Se ha observado una estructura similar a un anillo interno unida a los túbulos de los dobletes flagelares dentro de la zona de transición en la sección transversal. [92]
Imágenes adicionales
- Múltiples flagelos en disposición lofótrica sobre la superficie de Helicobacter pylori
- Modelo físico de un flagelo bacteriano
Véase también
Referencias
- ^ Bardy, Sonia L.; Ng, Sandy YM; Jarrell, Ken F. (1 de febrero de 2003). "Estructuras de motilidad procariota". Microbiología . 149 (2): 295–304. doi : 10.1099/mic.0.25948-0 . PMID 12624192.
- ^ Silflow, Carolyn D.; Lefebvre, Paul A. (1 de diciembre de 2001). "Ensamblaje y motilidad de cilios y flagelos eucariotas. Lecciones de Chlamydomonas reinhardtii". Fisiología vegetal . 127 (4): 1500–1507. doi :10.1104/pp.010807. PMC 1540183 . PMID 11743094.
- ^ ab Jarrell, Ken F., ed. (2009). Pili y flagelos: investigación actual y tendencias futuras . Norfolk: Caister Academic Press. ISBN 978-1-904455-48-6.
- ^ Malo, Aurelio F; Gomendio, Montserrat; Garde, Julian; Lang-Lenton, Barbara; Soler, Ana J; Roldan, Eduardo RS (22 de junio de 2006). "Diseño y función del esperma". Biology Letters . 2 (2): 246–249. doi :10.1098/rsbl.2006.0449. PMC 1618917 . PMID 17148374.
- ^ Lacy, BE; Rosemore, J (octubre de 2001). "Helicobacter pylori: úlceras y más: el comienzo de una era". The Journal of Nutrition . 131 (10): 2789S–2793S. doi : 10.1093/jn/131.10.2789S . PMID 11584108. Archivado desde el original (página de resumen) el 7 de febrero de 2009 . Consultado el 2 de junio de 2008 .
- ^ Wang, Qingfeng; Suzuki, Asaka; Mariconda, Susana; Porwollik, Steffen; Harshey, Rasika M (1 de junio de 2005). "Detección de humedad: un nuevo papel para el flagelo bacteriano". The EMBO Journal . 24 (11): 2034–2042. doi :10.1038/sj.emboj.7600668. PMC 1142604 . PMID 15889148.
- ^ Albers, Sonja-Verena; Jarrell, Ken F. (27 de enero de 2015). "El arqueobacteria: cómo nadan las arqueas". Frontiers in Microbiology . 6 : 23. doi : 10.3389/fmicb.2015.00023 . PMC 4307647 . PMID 25699024.
- ^ Quax, TEF; Albers, SV; Pfeiffer, F (14 de diciembre de 2018). "Taxis en arqueas". Temas emergentes en ciencias de la vida . 2 (4): 535–546. doi :10.1042/ETLS20180089. PMC 7289035 . PMID 33525831.
- ^ Haimo, LT; Rosenbaum, JL (1 de diciembre de 1981). "Cilia, flagella, and microtubules". Revista de Biología Celular . 91 (3): 125s–130s. doi :10.1083/jcb.91.3.125s. PMC 2112827 . PMID 6459327.
- ^ Wan, Kirsty Y. (21 de noviembre de 2018). "Coordinación de cilios y flagelos eucariotas". Ensayos en bioquímica . 62 (6): 829–838. doi :10.1042/ebc20180029. ISSN 0071-1365. PMC 6281475 . PMID 30464007.
- ^ Streif, Stefan; Staudinger, Wilfried Franz; Marwan, Wolfgang; Oesterhelt, Dieter (diciembre de 2008). "La rotación flagelar en la arqueona Halobacterium salinarum depende del ATP". Journal of Molecular Biology . 384 (1): 1–8. doi :10.1016/j.jmb.2008.08.057. PMID 18786541.
- ^ ab Alberts, Bruce (2015). Biología molecular de la célula (sexta edición). Nueva York, NY. p. 942. ISBN 9780815344643.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Silverman, Michael; Simon, Melvin (mayo de 1974). "Rotación flagelar y mecanismo de motilidad bacteriana". Nature . 249 (5452): 73–74. Bibcode :1974Natur.249...73S. doi :10.1038/249073a0. PMID 4598030. S2CID 10370084.
- ^ Lowe, Graeme; Meister, Markus; Berg, Howard C. (febrero de 1987). "Rotación rápida de haces flagelares en bacterias nadadoras". Nature . 325 (6105): 637–640. Código Bibliográfico :1987Natur.325..637L. doi :10.1038/325637a0. S2CID 4242129.
- ^ Berg, Howard C.; Anderson, Robert A. (octubre de 1973). "Las bacterias nadan rotando sus filamentos flagelares". Nature . 245 (5425): 380–382. Código Bibliográfico :1973Natur.245..380B. doi :10.1038/245380a0. PMID 4593496. S2CID 4173914.
- ^ Jahn, TL; Bovee, EC (octubre de 1965). "Movimiento y locomoción de microorganismos". Revisión anual de microbiología . 19 (1): 21–58. doi :10.1146/annurev.mi.19.100165.000321. PMID 5318439.
- ^ Harshey, RM (2003). "Motilidad bacteriana en una superficie: muchas maneras de alcanzar un objetivo común". Revisión anual de microbiología . 57 : 249–73. doi :10.1146/annurev.micro.57.030502.091014. PMID 14527279.
- ^ Ng, Sandy YM; Chaban, Bonnie; Jarrell, Ken F. (2006). "Flagelos arqueales, flagelos bacterianos y pili tipo IV: una comparación de genes y modificaciones postraduccionales". Fisiología microbiana . 11 (3–5): 167–191. doi :10.1159/000094053. PMID 16983194. S2CID 30386932.
- ^ Metlina, AL (noviembre de 2004). "Flagelos bacterianos y arqueológicos como orgánulos de motilidad procariota". Biochemistry (Moscú) . 69 (11): 1203–1212. doi :10.1007/s10541-005-0065-8. PMID 15627373. S2CID 632440.
- ^ Jarrell, K (2009). "Flagelas y pili arqueales". Pili y flagelos: investigación actual y tendencias futuras . Caister Academic Press. ISBN 978-1-904455-48-6.
- ^ Macnab, Robert M. (octubre de 2003). "Cómo las bacterias ensamblan flagelos". Revisión anual de microbiología . 57 (1): 77–100. doi :10.1146/annurev.micro.57.030502.090832. PMID 12730325.
- ^ Diószeghy, Zoltán; Závodszky, Péter; Namba, Keiichi; Vonderviszt, Ferenc (18 de junio de 2004). "Estabilización de filamentos flagelares mediante protección HAP2". Cartas FEBS . 568 (1–3): 105–109. Código Bib : 2004FEBSL.568..105D. doi :10.1016/j.febslet.2004.05.029. PMID 15196929. S2CID 33886010.
- ^ Galkin, Vitold E.; Yu, Xiong; Bielnicki, Jakub; Heuser, John; Ewing, Cheryl P.; Guerry, Patricia; Egelman, Edward H. (18 de abril de 2008). "Divergencia de estructuras cuaternarias entre filamentos flagelares bacterianos". Science . 320 (5874): 382–385. Bibcode :2008Sci...320..382G. doi :10.1126/science.1155307. PMID 18420936. S2CID 7702002.
- ^ Worrall, Liam J.; Majewski, Dorothy D.; Strynadka, Natalie CJ (15 de septiembre de 2023). "Información estructural sobre los sistemas de secreción de tipo III del flagelo bacteriano y el inyectoma". Revisión anual de microbiología . 77 (1): 669–698. doi : 10.1146/annurev-micro-032521-025503 . ISSN 0066-4227. PMID 37713458. S2CID 261963968.
- ^ ab Singh, Prashant K.; Sharma, Pankaj; Afanzar, Oshri; Goldfarb, Margo H.; Maklashina, Elena; Eisenbach, Michael; Cecchini, Gary; Iverson, TM (17 de abril de 2024). "Las estructuras crioelectrónicas revelan cómo el flagelo bacteriano rota y cambia de dirección". Nature Microbiology . 9 (5): 1271–1281. doi : 10.1038/s41564-024-01674-1 . ISSN 2058-5276. PMC 11087270 . PMID 38632342.
- ^ Atsumi, Tatsuo; McCartert, Linda; Imae, Yasuo (enero de 1992). "Los motores flagelares polares y laterales del Vibrio marino son impulsados por diferentes fuerzas iónicas motrices". Nature . 355 (6356): 182–184. Bibcode :1992Natur.355..182A. doi :10.1038/355182a0. PMID 1309599. S2CID 4315167.
- ^ Kojima, Seiji; Blair, David F (2004), "El motor flagelar bacteriano: estructura y función de una máquina molecular compleja", International Review of Cytology , 233 , Elsevier: 93–134, doi :10.1016/s0074-7696(04)33003-2, ISBN 978-0-12-364637-8, PMID 15037363 , consultado el 23 de abril de 2024
- ^ Dean, Tim (2 de agosto de 2010). "Dentro del motor más eficiente de la naturaleza: el flagelar". Australian Life Scientist .
- ^ Whitfield, John (19 de junio de 2008). «Los motores bacterianos tienen su propio embrague». Nature News : news.2008.903. doi :10.1038/news.2008.903 . Consultado el 17 de mayo de 2017 .
- ^ ab Bhattacharyya, Souvik; Lopez, Shelby; Singh, Abhyudai; Harshey, Rasika M. (2024). "La motilidad flagelar es mutagénica". Actas de la Academia Nacional de Ciencias . 121 (41). Actas de la Academia Nacional de Ciencias. doi : 10.1073/pnas.2412541121 . ISSN 0027-8424.
- ^ Dusenbery, DB (2009). "Capítulo 13". Vivir a escala micro: la física inesperada de ser pequeño . Cambridge: Harvard University Press. ISBN 978-0-674-03116-6.
- ^ Hildebrand, Milton (noviembre de 1959). "Movimientos del guepardo y el caballo al correr". Journal of Mammalogy . 44 (4): 481–495. doi :10.2307/1376265. JSTOR 1376265.Aunque según Hunter, Luke; Hamman, Dave (2003). Cheetah . Struik Publishers. pp. 37–38.
la velocidad más rápida registrada del guepardo fue de 110 km/h (68 mph).
- ^ Meadows, Robin (10 de mayo de 2011). "Cómo cambian de marcha las bacterias". PLOS Biology . 9 (5): e1001061. doi : 10.1371/journal.pbio.1001061 . PMC 3091840 . PMID 21572986.
- ^ Sun, Qifang; Yuan, Chengzhi; Zhou, Sainan; Lu, Jing; Zeng, Meiyan; Cai, Xiong; Song, Houpan (19 de octubre de 2023). "Infección por Helicobacter pylori: un proceso dinámico desde el diagnóstico hasta el tratamiento". Frontiers in Cellular and Infection Microbiology . 13 . doi : 10.3389/fcimb.2023.1257817 . PMC 10621068 . PMID 37928189.
- ^ Minamino, Tohru; Imada, Katsumi; Namba, Keiichi (2008). "Mecanismos de exportación de proteínas de tipo III para el ensamblaje flagelar bacteriano". Molecular BioSystems . 4 (11): 1105–1115. doi :10.1039/b808065h. PMID 18931786.
- ^ Asakura, Sho; Eguchi, Goro; Iino, Tetsuo (octubre de 1964). "Reconstitución de flagelos bacterianos in vitro". Revista de biología molecular . 10 (1): 42–IN9. doi :10.1016/S0022-2836(64)80026-7. PMID 14222895.
- ^ ab Pallen, Mark J.; Matzke, Nicholas J. (octubre de 2006). "Del origen de las especies al origen de los flagelos bacterianos". Nature Reviews Microbiology . 4 (10): 784–790. doi :10.1038/nrmicro1493. PMID 16953248. S2CID 24057949.
- ^ ab Saier, M (marzo de 2004). "Evolución de los sistemas de secreción de proteínas bacterianas de tipo III". Tendencias en microbiología . 12 (3): 113–115. doi :10.1016/j.tim.2004.01.003. PMID 15001186.
- ^ Gophna, Uri; Ron, Eliora Z.; Graur, Dan (julio de 2003). "Los sistemas de secreción de tipo III bacteriano son antiguos y evolucionaron mediante múltiples eventos de transferencia horizontal". Gene . 312 : 151–163. doi :10.1016/S0378-1119(03)00612-7. PMID 12909351.
- ^ McCann, Honour C.; Guttman, David S. (enero de 2008). "Evolución del sistema de secreción tipo III y sus efectores en las interacciones planta-microbio". New Phytologist . 177 (1): 33–47. doi : 10.1111/J.1469-8137.2007.02293.X . PMID 18078471.
- ^ Behe, Michael J. (2007). El límite de la evolución: la búsqueda de los límites del darwinismo . Nueva York, NY: Free Press. ISBN 978-0-7432-9620-5.
- ^ Rajagopala, Seesandra V; Titz, Björn; Goll, Johannes; Parrish, Jodi R; Wohlbold, Katrin; McKevitt, Matthew T; Palzkill, Timothy; Mori, Hirotada; Finley, Russell L; Uetz, Peter (enero de 2007). "La red proteica de la motilidad bacteriana". Biología de sistemas moleculares . 3 (1): 128. doi :10.1038/msb4100166. PMC 1943423 . PMID 17667950.
- ^ Titz, Björn; Rajagopala, Seesandra V.; Ester, Claudia; Häuser, Roman; Uetz, Peter (noviembre de 2006). "Nuevo factor de ensamblaje conservado del flagelo bacteriano". Journal of Bacteriology . 188 (21): 7700–7706. doi :10.1128/JB.00820-06. PMC 1636259 . PMID 16936039.
- ^ Kakkanat, Asha; Phan, Minh-Duy; Lo, Alvin W.; Beatson, Scott A.; Schembri, Mark A. (10 de mayo de 2017). "Nuevos genes asociados con una motilidad mejorada de Escherichia coli ST131". PLOS ONE . 12 (5): e0176290. Bibcode :2017PLoSO..1276290K. doi : 10.1371/journal.pone.0176290 . PMC 5425062 . PMID 28489862.
- ^ Pallen, MJ; Gophna, U. (2007). "Flagelos bacterianos y secreción de tipo III: estudios de casos sobre la evolución de la complejidad". Genome Dynamics . 3 : 30–47. doi :10.1159/000107602. ISBN 978-3-8055-8340-4. Número de identificación personal 18753783.
- ^ "Flagelos bacterianos" (PDF) . Archivado (PDF) del original el 9 de octubre de 2022 . Consultado el 29 de diciembre de 2021 .
- ^ Ruan, Juanfang; Kato, Takayuki; Santini, Claire-Lise; Miyata, Tomoko; Kawamoto, Akihiro; Zhang, Wei-Jia; Bernardac, Alain; Wu, Long-Fei; Namba, Keiichi (11 de diciembre de 2012). "Arquitectura de un aparato flagelar en la bacteria magnetotáctica de natación rápida MO-1". Actas de la Academia Nacional de Ciencias . 109 (50): 20643–20648. Código Bib : 2012PNAS..10920643R. doi : 10.1073/pnas.1215274109 . PMC 3528567 . PMID 23184985.
- ^ "prefijo trico-" . Consultado el 26 de marzo de 2022 .
- ^ Echazarreta, MA; Klose, KE (2019). "Síntesis flagelar de Vibrio". Frontiers in Cellular and Infection Microbiology . 9 : 131. doi : 10.3389/fcimb.2019.00131 . PMC 6504787 . PMID 31119103.
- ^ "Lopho" . Consultado el 26 de marzo de 2022 .
- ^ Kudryashev, Mikhail; Cyrklaff, Marek; Baumeister, Wolfgang; Simon, Markus M.; Wallich, Reinhard; Frischknecht, Friedrich (marzo de 2009). "Tomografía crioelectrónica comparativa de espiroquetas patógenas de la enfermedad de Lyme". Microbiología molecular . 71 (6): 1415–1434. doi : 10.1111/j.1365-2958.2009.06613.x . PMID 19210619. S2CID 19650892.
- ^ Kim, Yun-Kyeong; McCarter, Linda L. (julio de 2000). "Análisis del sistema de genes flagelares polares de Vibrio parahaemolyticus". Journal of Bacteriology . 182 (13): 3693–3704. doi :10.1128/JB.182.13.3693-3704.2000. PMC 94540 . PMID 10850984.
- ^ Atsumi, T; Maekawa, Y; Yamada, T; Kawagishi, yo; Imae, Y; Homma, M (agosto de 1996). "Efecto de la viscosidad sobre la natación de los flagelos laterales y polares de Vibrio alginolyticus". Revista de Bacteriología . 178 (16): 5024–5026. doi :10.1128/jb.178.16.5024-5026.1996. PMC 178290 . PMID 8759871.
- ^ McCarter, Linda L. (2004). "Los sistemas flagelares duales permiten la motilidad en diferentes circunstancias". Fisiología microbiana . 7 (1–2): 18–29. doi :10.1159/000077866. PMID 15170400. S2CID 21963003.
- ^ Merino, Susana; Shaw, Jonathan G.; Tomás, Juan M. (octubre de 2006). "Flagelos laterales bacterianos: un sistema de flagelos inducible". Cartas de microbiología FEMS . 263 (2): 127-135. doi : 10.1111/j.1574-6968.2006.00403.x . PMID 16978346.
- ^ Belas, R; Simon, M; Silverman, M (julio de 1986). "Regulación de la transcripción génica de los flagelos laterales en Vibrio parahaemolyticus". Journal of Bacteriology . 167 (1): 210–218. doi :10.1128/jb.167.1.210-218.1986. PMC 212863 . PMID 3013835.
- ^ Canales, Rocío; Altarriba, María; Vilches, Silvia; Horsburgh, Gavin; Shaw, Jonathan G.; Tomás, Juan M.; Merino, Susana (febrero de 2006). "Análisis del sistema genético flagelar lateral de Aeromonas hydrophila AH-3". Revista de Bacteriología . 188 (3): 852–862. doi :10.1128/JB.188.3.852-862.2006. PMC 1347325 . PMID 16428388.
- ^ Canales, Rocío; Ramírez, Silvia; Vilches, Silvia; Horsburgh, Gavin; Shaw, Jonathan G.; Tomás, Juan M.; Merino, Susana (15 de enero de 2006). "Biogénesis del flagelo polar en Aeromonas hydrophila". Revista de Bacteriología . 188 (2): 542–555. doi :10.1128/JB.188.2.542-555.2006. PMC 1347287 . PMID 16385045.
- ^ Kim, MunJu; Bird, James C.; Van Parys, Annemarie J.; Breuer, Kenneth S.; Powers, Thomas R. (23 de diciembre de 2003). "Un modelo a escala macroscópica de la agrupación flagelar bacteriana". Actas de la Academia Nacional de Ciencias . 100 (26): 15481–15485. arXiv : cond-mat/0312562 . Código Bibliográfico :2003PNAS..10015481K. doi : 10.1073/pnas.2633596100 . PMC 307593 . PMID 14671319.
- ^ Macnab, RM (enero de 1977). "Flagellas bacterianas rotando en haces: un estudio en geometría helicoidal". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 74 (1): 221–5. Bibcode :1977PNAS...74..221M. doi : 10.1073/pnas.74.1.221 . PMC 393230 . PMID 264676.
- ^ Taylor, FJR Max (1 de noviembre de 2003). "El colapso del sistema de dos reinos, el auge de la protistología y la fundación de la Sociedad Internacional de Protistología Evolutiva (ISEP)". Revista Internacional de Microbiología Sistemática y Evolutiva . 53 (6): 1707–1714. doi : 10.1099/ijs.0.02587-0 . PMID 14657097.
- ^ Hülsmann, Norbert (agosto de 1992). "Undulipodium: fin de una discusión inútil". Revista Europea de Protistología . 28 (3): 253–257. doi :10.1016/s0932-4739(11)80231-2. PMID 23195228.
- ^ abc Adl, Sina M.; Simpson, Alastair GB; Lane, Christopher E.; Lukeš, Julius; Bass, David; Bowser, Samuel S.; Brown, Matthew W.; Burki, Fabien; Dunthorn, Micah; Hampl, Vladimir; Heiss, Aaron; Hoppenrath, Mona; Lara, Enrique; le Gall, Line; Lynn, Denis H.; McManus, Hilary; Mitchell, Edward AD; Mozley-Stanridge, Sharon E.; Parfrey, Laura W.; Pawlowski, Jan; Rueckert, Sonja; Shadwick, Laura; Schoch, Conrad L.; Smirnov, Alexey; Spiegel, Frederick W. (septiembre de 2012). "La clasificación revisada de los eucariotas". Revista de microbiología eucariota . 59 (5): 429–514. doi :10.1111/j.1550-7408.2012.00644.x. PMC 3483872. PMID 23020233 .
- ^ Andersen, RA; Barr, DJS; Lynn, DH; Melkonian, M.; Moestrup, Ø.; Sleigh, MA (febrero de 1991). "Terminología y nomenclatura de los elementos del citoesqueleto asociados con el aparato flagelar/ciliar en protistas". Protoplasma . 164 (1–3): 1–8. doi :10.1007/bf01320809. S2CID 40755371.
- ^ Leadbeater, Barry SC; Green, John C., eds. (2000). Flagelados: unidad, diversidad y evolución. Volumen especial de la Asociación Sistemática. Vol. 59. Taylor y Francis. ISBN 978-1-4822-6822-5.
- ^ ab Barsanti, Laura; Gualtieri, Paolo (2006). Algas: anatomía, bioquímica y biotecnología. Florida, EE. UU.: CRC Press. ISBN 9780203492598.
- ^ ab Lindemann, CB; Lesich, KA (15 de febrero de 2010). "Batido flagelar y ciliar: lo comprobado y lo posible". Journal of Cell Science . 123 (Pt 4): 519–28. doi :10.1242/jcs.051326. PMID 20145000. S2CID 18673550.
- ^ ab Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James (2000). "Sección 19.4 Cilios y flagelos: estructura y movimiento". Cilios y flagelos: estructura y movimiento. ISBN 0-7167-3136-3.
- ^ Pazour, Gregory J. (octubre de 2004). "Transporte intraflagelar y enfermedad renal dependiente de cilios: la hipótesis ciliar de la enfermedad renal poliquística". Revista de la Sociedad Americana de Nefrología . 15 (10): 2528–2536. doi : 10.1097/01.ASN.0000141055.57643.E0 . PMID 15466257.
- ^ Yubuki, Naoji; Leander, Brian S. (julio de 2013). "Evolución de los centros organizadores de microtúbulos en el árbol de eucariotas". The Plant Journal . 75 (2): 230–244. doi : 10.1111/tpj.12145 . PMID 23398214.
- ^ Raven, JA (2000). "La condición flagelada". Leadbeater & Green 2000, págs. 27-48 . CRC Press. ISBN 9781482268225.
- ^ ab Webster, John; Weber, Roland (25 de enero de 2007). "Spores of Fungi". 2007 (3.ª ed.). Cambridge: Cambridge University Press. págs. 23-24. ISBN 9781139461504.
- ^ Lahr, Daniel JG; Parfrey, Laura Wegener; Mitchell, Edward AD; Katz, Laura A.; Lara, Enrique (22 de julio de 2011). "La castidad de las amebas: reevaluación de la evidencia de sexo en organismos ameboides". Actas de la Royal Society B: Ciencias Biológicas . 278 (1715): 2081–2090. doi :10.1098/rspb.2011.0289. PMC 3107637 . PMID 21429931.
- ^ ab Austin, CR (1995). Grudzinskas, Jurgis Gediminas; Yovich, JL (eds.). Gametos: el espermatozoide. Cambridge: Cambridge University Press. ISBN 9780521479967.
- ^ South, GR; Whittick, A (1987). Introducción a la ficología. Oxford: Blackwell Scientific Publications. pág. 65. ISBN 9781444314205.
- ^ Dodge, JD (1973). La estructura fina de las células de las algas. Londres: Academic Press. pp. 57–79. ISBN 9780323158237.
- ^ Lee, RE (2008). Ficología (4.ª ed.). Cambridge University Press. pág. 7. ISBN 9781139469876.
lee pelos tubulares.
- ^ Corliss, JO; Lom, J (2000). "Un glosario anotado de términos protozoológicos". En Lee, JJ; Leedale, GF; Bradbury, P. (eds.). Una guía ilustrada de los protozoos . Vol. 2 (2.ª ed.). Sociedad de Protozoólogos. págs. 1346–85. ISBN 1891276239.
- ^ ab Jeuck, Alexandra; Arndt, Hartmut (noviembre de 2013). "Una breve guía de flagelados heterotróficos comunes de hábitats de agua dulce basada en la morfología de organismos vivos". Protist . 164 (6): 842–860. doi : 10.1016/j.protis.2013.08.003 . PMID 24239731.
- ^ Sleigh, M (1989). Protozoos y otros protistas. Londres: Edward Arnold. pp. 98-99. ISBN 9780521428057.
- ^ Sparrow, FK (1960). Ficomicetos acuáticos (2.ª ed.). Ann Arbor: Michigan: University of Michigan Press. pág. 15.
- ^ Hibberd, DJ (1976). "La ultraestructura y taxonomía de las Chrysophyceae y Prymnesiophyceae (Haptophyceae): un estudio con algunas observaciones nuevas sobre la ultraestructura de las Chrysophyceae". Revista de la Sociedad Linneana de Londres, Botánica . 72 (2): 55–80. doi :10.1111/j.1095-8339.1976.tb01352.x.
- ^ Sleigh, MA (1985). «Origen y evolución del movimiento flagelar». Cell Motil . 5 : 137–138. Archivado desde el original el 3 de marzo de 2016. Consultado el 21 de febrero de 2016 .
- ^ Cavalier-Smith, T (1987). "El origen de las células eucariotas y arqueobacterianas". Anales de la Academia de Ciencias de Nueva York . 503 (1): 17–54. Bibcode :1987NYASA.503...17C. doi :10.1111/j.1749-6632.1987.tb40596.x. PMID 3113314. S2CID 38405158.[ enlace muerto permanente ]
- ^ Madigan, Michael T. (2019). Biología de microorganismos de Brock (decimoquinta edición global). Nueva York, Nueva York. Págs. 70-71. ISBN 9781292235103.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ ab Ghosh, Abhrajyoti; Albers, Sonja-Verena (1 de febrero de 2011). "Ensamblaje y función del flagelo arqueológico". Biochemical Society Transactions . 39 (1): 64–69. doi :10.1042/BST0390064. PMID 21265748.
- ^ Thomas, Nikhil A.; Bardy, Sonia L.; Jarrell, Ken F. (abril de 2001). "El flagelo arqueológico: un tipo diferente de estructura de motilidad procariota". FEMS Microbiology Reviews . 25 (2): 147–174. doi :10.1111/j.1574-6976.2001.tb00575.x. PMID 11250034. S2CID 34411164.
- ^ Chimileski, Scott; Papke, R. Thane (2015). "Cómo controlar los pili de tipo IV de las arqueas: un repertorio en expansión de apéndices celulares implica una regulación compleja y funciones diversas". Frontiers in Microbiology . 6 : 362. doi : 10.3389/fmicb.2015.00362 . ISSN 1664-302X. PMC 4419858 . PMID 25999922.
- ^ de Sousa Machado, J. Nuno; Vollmar, Léonie; Schimpf, Julia; Chaudhury, Paushali; Kumariya, Rashmi; van der Does, Chris; Hugel, Thorsten; Albers, Sonja-Verena (2021). "La autofosforilación de la proteína ArlH similar a KaiC inhibe la oligomerización y la interacción con ArlI, la ATPasa motora del archaellum". Microbiología Molecular . 116 (3): 943–956. doi : 10.1111/mmi.14781 . ISSN 0950-382X. PMID 34219289.
- ^ Nuno de Sousa Machado, João; Albers, Sonja-Verena; Daum, Bertram (2022). "Hacia el dilucidar el mecanismo giratorio de la maquinaria Archaellum". Fronteras en Microbiología . 13 . doi : 10.3389/fmicb.2022.848597 . ISSN 1664-302X. PMC 8978795 . PMID 35387068.
- ^ Jarrell, Ken F; Albers, Sonja-Verena; Machado, J Nuno de Sousa (2021). "Una historia completa de la motilidad y la arquelación en arqueas". FEMS Microbes . 2 : xtab002. doi :10.1093/femsmc/xtab002. ISSN 2633-6685. PMC 10117864 . PMID 37334237.
- ^ ab Longcore, Joyce E.; Pessier, Allan P.; Nichols, Donald K. (marzo de 1999). " Batrachochytrium Dendrobatidis gen. et sp. nov. , un quitridio patógeno para los anfibios". Mycologia . 91 (2): 219–227. doi :10.2307/3761366. JSTOR 3761366.
Lectura adicional
- Berg, Howard C. (enero de 2000). "Motile Behavior of Bacteria". Physics Today . 53 (1): 24–29. Bibcode :2000PhT....53a..24B. doi : 10.1063/1.882934 . S2CID 178516210.
- Lindemann, Charles (4 de abril de 2008). "Mecanismos de la motilidad espermática". Universidad de Oakland. Archivado desde el original el 16 de mayo de 2008. Consultado el 18 de mayo de 2008 .
- Purcell, EM (1977). "Life at Low Reynolds Number" (PDF) . American Journal of Physics . 45 (1): 3–11. Bibcode :1977AmJPh..45....3P. doi :10.1119/1.10903. hdl : 2433/226838 . Archivado desde el original (PDF) el 5 de junio de 2011 . Consultado el 19 de octubre de 2009 .
- Matzke, NJ (10 de noviembre de 2003). "Evolución en el espacio (browniano): un modelo para el origen del flagelo bacteriano". talkdesign.org.
Enlaces externos
- Biblioteca de imágenes celulares: flagelos
![]() Este artículo incorpora texto de una publicación que ahora es de dominio público : Chambers, Ephraim , ed. (1728). Cyclopædia, or an Universal Dictionary of Arts and Sciences (1.ª ed.). James y John Knapton, et al.
Este artículo incorpora texto de una publicación que ahora es de dominio público : Chambers, Ephraim , ed. (1728). Cyclopædia, or an Universal Dictionary of Arts and Sciences (1.ª ed.). James y John Knapton, et al. {{cite encyclopedia}}: Falta o está vacío |title=( ayuda )