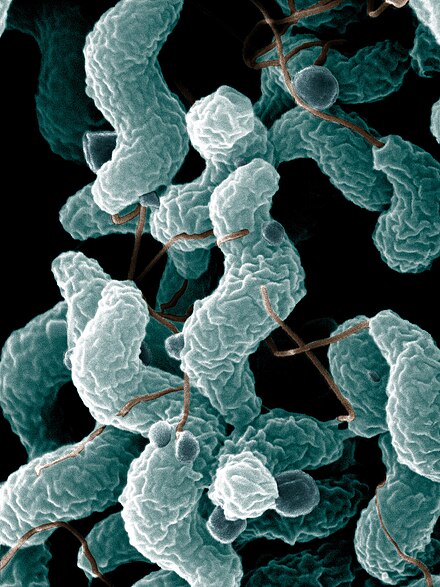
Campylobacter jejuni
| Campylobacter jejuni | |
|---|---|
 | |
| Clasificación científica | |
| Dominio: | Bacteria |
| Filo: | Campylobacterota |
| Clase: | "Campilbacterias" |
| Orden: | Campylobacterales |
| Familia: | Campylobacteraceae |
| Género: | Campylobacter |
| Especies: | C. jejuni |
| Nombre binomial | |
| Campylobacter jejuni (Jones y Little, 1931) Veron y Chatelain, 1973 | |
Campylobacter jejuni es una especie de bacteria patógena que se asocia comúnmente con las aves de corral y también se encuentra a menudo en las heces de los animales . Esta especie de microbio es una de las causas más comunes de intoxicación alimentaria en Europa y en los EE. UU., y la gran mayoría de los casos ocurren como eventos aislados en lugar de brotes masivos. La vigilancia activa a través de la Red de Vigilancia Activa de Enfermedades Transmitidas por Alimentos (FoodNet) indica que se diagnostican alrededor de 20 casos cada año por cada 100 000 personas en los EE. UU., mientras que muchos más casos no se diagnostican o no se informan; los CDC estiman un total de 1,5 millones de infecciones cada año. [1] La Autoridad Europea de Seguridad Alimentaria informó 246 571 casos en 2018 y estimó aproximadamente nueve millones de casos de campilobacteriosis humana por año en la Unión Europea. [2] Las infecciones por Campylobacter jejuni están aumentando a un ritmo alarmante en Europa, América del Norte y Australia. En África, Asia y Oriente Medio, los datos indican que las infecciones por C. jejuni son endémicas . [3]
Campylobacter es un género de bacterias que se encuentra entre las causas más comunes de infecciones bacterianas en humanos en todo el mundo. Campylobacter significa "barra curva", que deriva del griego kampylos (curvo) y baktron (barra). De sus muchas especies, C. jejuni se considera una de las más importantes desde una perspectiva tanto microbiológica como de salud pública. [4] [5]
C. jejuni se asocia comúnmente con aves de corral y también se encuentra comúnmente en heces de animales . Campylobacter es una bacteria móvil , no fermentadora, gramnegativa , microaerófila , no formadora de esporas, con forma helicoidal y con un solo flagelo en uno o ambos polos, [6] que también son oxidasa-positivas y crecen óptimamente a 37 a 42 °C. [7] [8] [9] [10] Cuando se expone al oxígeno atmosférico, C. jejuni puede transformarse en una forma cocal. [11] Esta especie de bacteria patógena es una de las causas más comunes de gastroenteritis humana en el mundo. La intoxicación alimentaria causada por especies de Campylobacter puede ser gravemente debilitante, pero rara vez pone en peligro la vida. Se ha relacionado con el desarrollo posterior del síndrome de Guillain-Barré , que generalmente se desarrolla dos o tres semanas después de la enfermedad inicial. [12] Las personas con infecciones recientes por C. jejuni desarrollan el síndrome de Guillain-Barré a una tasa de 0,3 por cada 1000 infecciones, aproximadamente 100 veces más a menudo que la población general. [13] Otra afección crónica que puede estar asociada con la infección por Campylobacter es la artritis reactiva . [14] La artritis reactiva es una complicación fuertemente asociada con una composición genética particular. Es decir, las personas que tienen el antígeno leucocitario humano B27 (HLA-B27) son más susceptibles. Con mayor frecuencia, los síntomas de la artritis reactiva se presentarán hasta varias semanas después de la infección. [4] [15]
Historia
Campylobacter jejuni fue originalmente llamado Vibrio jejuni debido a su parecido con Vibrio spp. hasta 1963. Seabald y Vernon propusieron el género Campylobacter debido a sus bajos niveles de guanina y citosina, metabolismo no fermentativo y requisitos de crecimiento microaerófilo. [16] El primer incidente bien registrado de infección por Campylobacter ocurrió en 1938. Campylobacter encontrado en la leche causó diarrea entre 355 reclusos en dos instituciones estatales en Illinois. [16] C. jejuni fue descubierto por primera vez en los intestinos delgados de humanos en la década de 1970, sin embargo, los síntomas se han observado desde principios del siglo XX. [17] El CDC , el USDA y la FDA identificaron colectivamente a C. jejuni como responsable de más del 40% de la gastroenteritis bacteriana encontrada en laboratorios a partir de 1996. [18]
Metabolismo
C. jejuni no puede utilizar azúcares como fuente de carbono, sino que utiliza principalmente aminoácidos para su crecimiento. [19] La principal razón por la que C. jejuni carece de capacidades glucolíticas es la falta de glucoquinasa [20] y la falta de la enzima 6-fosfofructoquinasa para emplear la vía EMP . [16] Los cuatro aminoácidos principales que C. jejuni absorbe son serina , aspartato , asparagina y glutamato , que se enumeran en orden de preferencia. [16] Si todos estos se agotan, algunas cepas también pueden utilizar prolina . [16] Tanto el huésped como la actividad metabólica de otros microbios intestinales pueden suministrar estos aminoácidos. [19]
Las vías metabólicas que C. jejuni es capaz de realizar incluyen el ciclo del TCA , una vía no oxidativa de pentosa fosfato , gluconeogénesis y síntesis de ácidos grasos . [21] La serina es el aminoácido más importante utilizado para el crecimiento, introducido en la célula por las proteínas de transporte SdaC y descompuesto posteriormente en piruvato por la SdaA deshidratasa . [20] Aunque este piruvato no se puede convertir directamente en ácido fosfoenolpirúvico (ya que C. jejuni carece de esta sintetasa ), el piruvato puede entrar en el ciclo del TCA para formar intermediarios de ácido oxalacético que se pueden convertir en ácido fosfoenolpirúvico para la gluconeogénesis. [21] Esta producción de carbohidratos es importante para los factores de virulencia de C. jejuni . [21] El piruvato creado a partir de la serina también se puede convertir en acetil CoA y aplicarse a la síntesis de ácidos grasos o continuar en el ciclo del TCA para crear precursores para otras vías biosintéticas. [21] El aspartato y el glutamato se introducen en la célula a través de las proteínas de transporte Peb1A. [20] El glutamato se puede transaminar en aspartato, y el aspartato se puede desaminar para producir fumarato que también alimenta el ciclo del TCA. [20] La asparagina también se puede desaminar en aspartato (que sigue el proceso en el ciclo del TCA mencionado anteriormente). [20] Si bien los aminoácidos enumerados anteriormente se pueden metabolizar, C. jejuni es capaz de absorber muchos de los otros aminoácidos, lo que ayuda a reducir el costo anabólico de la síntesis de novo . [21]
Si se agotan otras fuentes de carbono, C. jejuni también puede utilizar acetato y lactato como fuentes de carbono. [20] El acetato es un subproducto secretado normal del metabolismo de C. jejuni que surge del reciclaje de CoA , y la ausencia de otras fuentes de carbono puede hacer que C. jejuni "cambie" esta reacción para absorber acetato para la conversión a acetil-CoA (catalizada por las enzimas fosfato acetiltransferasa y acetato quinasa ). [20] [21] El lactato es un subproducto normal de muchas bacterias fermentativas en el intestino, y C. jejuni puede absorber y oxidar este lactato para suministrar piruvato a través de la actividad de los complejos enzimáticos de hierro-azufre deshidrogenasa . [20]
Las necesidades energéticas de estas vías anabólicas se satisfacen de múltiples maneras. Las oxidasas terminales del citocromo c y del quinol permiten que C. jejuni utilice el oxígeno como aceptor terminal de electrones para los transportadores reducidos producidos a través del ciclo del TCA (de ahí que C. jejuni se considere un microaerófilo obligado ). [22] La conversión de acetil-CoA en acetato mencionada anteriormente tiene lugar mediante fosforilación a nivel de sustrato , lo que da lugar a otra forma de producción de energía sin el uso de la respiración microaerófila. [21]
C. jejuni puede utilizar muchos donantes de electrones diferentes para sus procesos metabólicos, utilizando NADH y FADH más comúnmente, aunque C. jejuni utiliza NADH deficientemente en comparación con FADH debido a un reemplazo de genes que codifican subunidades para NADH deshidrogenasas por genes que contribuyen a procesos relacionados con la donación de electrones de FADH. [23] Aparte de estos donantes, C. jejuni puede recurrir a productos de la microbiota intestinal del huésped, incluidos hidrógeno, lactato, succinato y formato para contribuir con electrones; el formato, por ejemplo, se genera a través de la fermentación intestinal de ácidos mixtos . [23] A diferencia de casi todas las demás especies de Campylobacter o Helicobacter , C. jejuni también puede aceptar electrones de sulfito y metabisulfito a través de su sistema de citocromo c oxidorreductasa . [23]
Aunque el oxígeno se utiliza principalmente como aceptor terminal de electrones, C. jejuni también puede utilizar nitrato , nitrito, óxidos de azufre (como dimetilsulfóxido o N-óxido de trimetilamina ) o fumarato como aceptores terminales de electrones para sobrevivir como bacteria microaerófila. [23] Debido a las condiciones limitadas de oxígeno en las áreas comunes de colonización, C. jejuni posee dos oxidasas terminales separadas con diferentes afinidades por el oxígeno, donde la oxidasa de baja afinidad puede recuperar electrones directamente de las menaquinonas . [23] Las adaptaciones que permiten múltiples aceptores de electrones ayudan a combatir el problema con las especies reactivas de oxígeno que surgen del uso exclusivo de oxígeno; C. jejuni no puede crecer en condiciones estrictamente aeróbicas. Las enzimas que C. jejuni lleva para impedir los efectos de las especies reactivas de oxígeno incluyen: superóxido dismutasa SodB, alquil hidróxido reductasa AhpC, catalasa KatA y tiol peroxidasas Tpx y Bcp. [23]
Enfermedad

La campilobacteriosis es una enfermedad infecciosa causada por bacterias del género Campylobacter . En la mayoría de los pacientes que presentan campilobacteriosis, los síntomas se desarrollan dentro de los dos a cinco días posteriores a la exposición al organismo y la enfermedad generalmente dura siete días después del inicio. [24] La infección con C. jejuni generalmente produce enteritis o inflamación del intestino delgado, que se caracteriza por dolor abdominal, diarrea voluminosa (a menudo sanguinolenta), fiebre y malestar . Las personas infectadas con esta bacteria pueden experimentar una fase prodrómica de síntomas durante los primeros 1 a 3 días, en los que ocurre la parte más grave de la enfermedad. La fase prodrómica se presenta con síntomas que incluyen escalofríos, fiebre alta, dolores corporales y mareos. Aparte de la fase prodrómica, la fase diarreica aguda de la enteritis generalmente dura alrededor de 7 días, sin embargo, el dolor abdominal puede persistir durante semanas después. [3] La enfermedad generalmente es autolimitante ; sin embargo, responde a los antibióticos . Los casos graves (que se acompañan de fiebre, sangre en las heces) o prolongados pueden requerir eritromicina , azitromicina , ciprofloxacino o norfloxacino . Puede ser necesaria la reposición de líquidos mediante sales de rehidratación oral y puede ser necesaria la administración de líquidos por vía intravenosa en los casos graves. [24] Las posibles complicaciones de la campilobacteriosis incluyen el síndrome de Guillain-Barré y la artritis reactiva . [3]
Transmisión
C. jejuni es una enfermedad zoonótica , lo que significa que se transmite más comúnmente de animales a personas que entre humanos. Las personas suelen contraerla al tocar algo que ha estado en contacto con pollo crudo o poco cocido, además de comer o tocar aves de corral crudas o poco cocidas. [25] Además, también se puede contraer al estar en contacto con animales o comer mariscos poco cocidos. [25] La vía fecal oral es la forma más común de propagación, ya que la bacteria se excreta en las heces de los animales. [26] C. jejuni rara vez causa enfermedades en animales y las infecciones son más comunes en los países de ingresos más bajos. [27] Las infecciones mortales no se ven a menudo en adultos jóvenes, sino más bien entre los jóvenes y los ancianos. [27] Debido a las malas prácticas de saneamiento en algunas áreas, la bacteria también se puede encontrar en el hielo y el agua. Es difícil conocer la ciencia detrás de su transmisión debido a su naturaleza esporádica . [26] [27] El uso de antibióticos y otros tratamientos ayudan a retrasar y prevenir la transmisión de C. jejuni. [26] C. jejuni es un microaerófilo exigente , lo que significa que necesita algo de oxígeno para crecer, propagarse y transmitirse. Sin embargo, es muy adaptable y se ha adaptado a crecer en concentraciones más altas de oxígeno. [28]
Patogenesia
C. jejuni emplea estrategias únicas para romper la capa epitelial intestinal de sus células huésped . [29] Utiliza proteasas , particularmente HtrA , para interrumpir hábilmente las uniones celulares y atravesar temporalmente las células. [29] La proteína unida a la membrana fibronectina es un sitio de unión crítico para C. jejuni en el lado basolateral de la célula epitelial polarizada, lo que facilita este proceso. [29] Una vez dentro de la célula, C. jejuni aprovecha la dineína para acceder al espacio perinuclear dentro de la vesícula recubierta de clatrina , evitando la digestión lisosomal durante hasta 72 horas. [29]
Para iniciar la infección, C. jejuni debe penetrar en los enterocitos intestinales . [30] C. jejuni libera varias toxinas diferentes, principalmente enterotoxinas y citotoxinas, que varían de una cepa a otra y se correlacionan con la gravedad de la enteritis (inflamación del intestino delgado). Durante la infección, aumentan los niveles de todas las clases de inmunoglobulina. De estas, la IgA es la más importante porque puede atravesar la pared intestinal. La IgA inmoviliza los organismos, lo que hace que se agreguen y activen el complemento, y también proporciona inmunidad a corto plazo contra la cepa infecciosa del organismo. [31] Las bacterias colonizan el intestino delgado y grueso, causando diarrea inflamatoria con fiebre. Las heces contienen leucocitos y sangre. El papel de las toxinas en la patogénesis no está claro. Los antígenos de C. jejuni que reaccionan de forma cruzada con una o más estructuras neuronales pueden ser responsables de desencadenar el síndrome de Guillain-Barré . [10]
El lipopolisacárido hipoacilado (LPS) de C. jejuni induce una respuesta inflamatoria moderada mediada por TLR4 en los macrófagos y dicha bioactividad del LPS puede eventualmente resultar en la falla de la eliminación bacteriana local y sistémica en los pacientes. Al mismo tiempo, la moderación de las respuestas antibacterianas puede ser ventajosa para los pacientes infectados en la práctica clínica, ya que un LPS tan atenuado puede no ser capaz de inducir una sepsis grave en individuos susceptibles. [32]
Uno de los factores de virulencia más importantes de C. jejuni son los flagelos . Se ha demostrado que la proteína flagelar FlaA es una de las proteínas más abundantes en la célula. Los flagelos son necesarios para la motilidad, la formación de biopelículas , las interacciones con la célula huésped y la colonización del huésped. Los flagelos en C. jejuni también pueden ayudar en la secreción de proteínas intracelulares. [19] La producción de flagelos es energéticamente costosa, por lo que la producción debe regularse desde el punto de vista metabólico. CsrA es un regulador postranscripcional que regula la expresión de FlaA uniéndose al ARNm de flaA y es capaz de reprimir su traducción. Se han estudiado cepas mutantes de CsrA y las cepas mutantes exhiben desregulación de 120 a 150 proteínas que están incluidas en la motilidad, la adherencia a la célula huésped, la invasión de la célula huésped, la quimiotaxis , la resistencia al estrés oxidativo, la respiración y el metabolismo de aminoácidos y acetato. La regulación transcripcional y postranscripcional de la síntesis flagelar en C. jejuni permite la biosíntesis adecuada de los flagelos y es importante para la patogénesis de esta bacteria. [33]
C. jejuni emplea un sistema de navegación altamente sofisticado llamado quimiotaxis . [29] Este sistema es crucial cuando la bacteria requiere orientación a través de señales químicas. [29] El sistema de quimiotaxis utiliza quimioatrayentes específicos que dirigen a la bacteria hacia áreas con una mayor concentración de los atrayentes. [29] La naturaleza exacta de los quimioatrayentes depende de las condiciones ambientales circundantes. [29] Además, cuando la bacteria necesita alejarse, utiliza quimiotaxis negativa para moverse en la dirección opuesta. [29]
Otros factores de virulencia importantes de C. jejuni incluyen el locus pgl , que confiere la capacidad de producir glicosilación ligada a N de al menos 22 proteínas bacterianas, [34] al menos algunas de las cuales parecen ser importantes para la competencia , la adherencia al huésped y la invasión. [35] C. jejuni secreta antígenos invasivos de Campylobacter (Cia), que facilitan la invasión. La bacteria también produce toxinas distensoras citoletales que participan en el control del ciclo celular y la inducción de la apoptosis de la célula huésped. C. jejuni también explota diferentes estrategias de adaptación en las que los factores del huésped parecen desempeñar un papel en la patogénesis de esta bacteria. [36]
Reparación del ADN
En los intestinos, la bilis funciona como una barrera defensiva contra la colonización por C. jejuni . [37] [38] Cuando C. jejuni se cultiva en un medio que contiene el ácido biliar ácido desoxicólico , un componente de la bilis, el ADN de C. jejuni se daña por un proceso que involucra estrés oxidativo . [39] [37] Para sobrevivir, las células de C. jejuni reparan este daño del ADN mediante un sistema que emplea las proteínas AddA y AddB que son necesarias para la reparación de las roturas de doble cadena del ADN. [37]
C. jejuni utiliza la recombinación homóloga para reparar su ADN, facilitada por las proteínas AddA y AddB. [37] Estas proteínas reemplazan a RecBCD , que se utiliza en otras bacterias como Escherichia coli . [37] AddA y AddB son cruciales para el reconocimiento de nucleasas , helicasas y Chi, [40] que permiten una recombinación homóloga exitosa. [37]
Cuando se introducen AddA y AddB en una variante silvestre de C. jejuni , se forma un gen mutante de deleción añadido, el gen addAB , que repara el ADN dañado por estrés oxidativo . [37] Esta inclusión protege a C. jejuni del desoxicolato que se encuentra en la bilis, lo que permite su supervivencia. [37] Sin embargo, el gen añadido está ausente durante el crecimiento en desoxicolato de 10 a 16 horas y puede regularse positivamente en respuesta a las condiciones ambientales. [37] Además, las proteínas AddAB mejoran la colonización de los intestinos de los pollos por C. jejuni . [37]
Respuesta inmune
La infección por Campylobacter jejuni y la destrucción final de la célula huésped provocan la liberación de quimiocinas que causan inflamación y activan las células de respuesta inmunitaria. Las quimiocinas inflamatorias como CXCL1 , CCL3 / CCL4 , CCL2 y CXCL10 se regulan positivamente, lo que desencadena aún más la respuesta inmunitaria. La activación de la respuesta inmunitaria está impulsada principalmente por el uso de ADP-heptosas para activar ALPK1 , [41] por una infección por C. jejuni [29].
Los granulocitos neutrófilos utilizan la fagocitosis para combatir la infección por C. jejuni , liberando proteínas antimicrobianas y sustancias proinflamatorias . Sin embargo, C. jejuni puede influir en el proceso de diferenciación de tipos específicos de granulocitos neutrófilos, desencadenando la hipersegmentación y el aumento de la reactividad, lo que conduce a una apoptosis retardada y una mayor producción de especies reactivas de oxígeno . En procesos experimentales, las células T de una respuesta inmune solo comienzan a crecer en número en el sitio de la inflamación a partir del séptimo día después de la infección. [29]
Después de 11 días de haber tenido una infección por Campylobacter jejuni , los linfocitos B en el cuerpo aumentan la producción de anticuerpos que luchan específicamente contra la flagelina de C. jejuni . [29] La persistencia de estos anticuerpos en el cuerpo puede durar hasta un año después de la infección. En este caso, el desarrollo del síndrome de Guillain-Barré (SGB) está asociado con anticuerpos IgG1 autoinmunes . [29]
Las infecciones por Campylobacter a menudo preceden al SGB , lo que indica que el mimetismo molecular entre las bacterias y los tejidos nerviosos del huésped puede ser la causa subyacente. [29] C. jejuni , el agente causal más común de la campilobacteriosis humana , puede sobrevivir en el intestino durante varios días, pero no establece una infección a largo plazo debido a su baja tasa de replicación, que es incompatible con una presencia bacteriana persistente. [29] La apoptosis inducida por bacterias de las células intestinales infectadas da como resultado la rápida eliminación del patógeno , lo que probablemente contribuye a la naturaleza autolimitante de la enfermedad. [29]
Fuentes
Campylobacter jejuni se asocia comúnmente con las aves de corral y coloniza naturalmente el tracto digestivo de muchas especies de aves. Todos los tipos de aves de corral y aves silvestres pueden colonizarse con Campylobacter. Un estudio encontró que el 30% de los estorninos europeos en entornos de granjas en Oxfordshire , Reino Unido, eran portadores de C. jejuni . También es común en el ganado, y aunque normalmente es un comensal inofensivo del tracto gastrointestinal en estos animales, puede causar campilobacteriosis en terneros. También se ha aislado de las heces de wombat y canguro , siendo una causa de diarrea de los excursionistas . El agua potable contaminada y la leche no pasteurizada proporcionan un medio eficiente para la distribución. Los alimentos contaminados son una fuente importante de infecciones aisladas, siendo la carne y las aves de corral preparadas incorrectamente la fuente principal de la bacteria. [42] Además, las encuestas muestran que entre el 20 y el 100% de los pollos minoristas están contaminados. Esto no es demasiado sorprendente, ya que muchos pollos sanos portan estas bacterias en sus tractos intestinales y, a menudo, en altas concentraciones, hasta 10 8 ufc/g. [43] Las bacterias contaminan las carcasas debido a la mala higiene durante el proceso de sacrificio. Varios estudios han demostrado mayores concentraciones de Campylobacter en las carcasas después de la evisceración. [44] [43] Los estudios han investigado el microbioma del pollo para comprender cómo, por qué y cuándo aparece Campylobacter dentro del intestino del pollo. [45] También se ha investigado el impacto de los sistemas de producción de sistemas industriales en el microbioma intestinal del pollo y la prevalencia de Campylobacter. [46]
La leche cruda también es una fuente de infecciones. Las bacterias suelen ser transportadas por el ganado sano y por las moscas en las granjas. El agua no clorada también puede ser una fuente de infecciones. Sin embargo, la cocción adecuada del pollo, la pasteurización de la leche y la cloración del agua potable matan las bacterias. [47] Mientras que la salmonela se transmite verticalmente en los huevos, la campylobacter no. Por lo tanto, el consumo de huevos sí da lugar a una infección humana por campylobacter. [48]
Complicaciones
Las complicaciones locales de las infecciones por Campylobacter ocurren como resultado de la propagación directa desde el tracto gastrointestinal y pueden incluir colecistitis , pancreatitis , peritonitis y hemorragia gastrointestinal masiva . Las manifestaciones extraintestinales de la infección por Campylobacter son bastante raras y pueden incluir meningitis, endocarditis, artritis séptica, osteomielitis y sepsis neonatal . La bacteriemia se detecta en <1% de los pacientes con enteritis por Campylobacter y es más probable que ocurra en pacientes inmunodeprimidos o entre los muy jóvenes o muy ancianos. [49] La bacteriemia transitoria en huéspedes inmunocompetentes con enteritis por C. jejuni puede ser más común pero no se detecta porque la acción letal elimina rápidamente la mayoría de los serotipos humanos normales, y los hemocultivos no se realizan rutinariamente para pacientes con enfermedad gastrointestinal aguda. [50]
La infección por Campylobacter rara vez produce enfermedades sistémicas graves, pero puede provocar sepsis y muerte. La tasa de letalidad de la infección por Campylobacter es de 0,05 por 1000 infecciones. Por ejemplo, una de las principales complicaciones que puede causar C. jejuni es el síndrome de Guillain-Barré, que induce parálisis neuromuscular en un porcentaje considerable de quienes lo padecen. Con el tiempo, la parálisis suele ser reversible hasta cierto punto; no obstante, alrededor del 20% de los pacientes con SGB quedan discapacitados y alrededor del 5% muere. Otra afección crónica que puede estar asociada con la infección por Campylobacter es la artritis reactiva . [14] La artritis reactiva es una complicación fuertemente asociada con una composición genética particular. Es decir, las personas que tienen el antígeno leucocitario humano B27 (HLA-B27) son las más susceptibles. La mayoría de las veces, los síntomas de la artritis reactiva se presentarán hasta varias semanas después de la infección. [4] [15]
Epidemiología
Frecuencia
Estados Unidos
Se estima que anualmente se producen 2 millones de casos de enteritis por Campylobacter, lo que representa entre el 5 y el 7 % de los casos de gastroenteritis. [51] Campylobacter tiene un gran reservorio animal: hasta el 100 % de las aves de corral, incluidos pollos, pavos y aves acuáticas, tienen infecciones intestinales asintomáticas. Los principales reservorios de C. fetus son el ganado vacuno y las ovejas. Más del 90 % de las infecciones por Campylobacter se producen durante los meses de verano debido a las carnes poco cocidas de la cocina al aire libre. [3] No obstante, la incidencia de las infecciones por Campylobacter ha ido disminuyendo. La Red de Vigilancia Activa de Enfermedades Transmitidas por Alimentos (FoodNet) ha monitoreado los cambios en la incidencia de las infecciones por Campylobacter confirmadas por cultivo desde 1996. En 2010, la incidencia de Campylobacter mostró una disminución del 27 % en comparación con 1996-1998. En 2010, la incidencia fue de 13,6 casos por cada 100.000 habitantes, y no cambió significativamente en comparación con el período 2006-2008. [52] [53]
Europa
En 2020, hubo alrededor de 120.000 casos de infección por C. jejuni , lo que mostró una disminución de alrededor del 25,4% en comparación con el año anterior. [29] Sin embargo, la pandemia de COVID-19 puede haber influido en esta disminución, y su importancia estadística aún está por determinar. [29] Las infecciones por C. jejuni tienden a alcanzar su pico en julio, lo que podría estar relacionado con el aumento de la temperatura en todo el mundo. [29] Este patrón está asociado con una mayor tasa de reflexión de la bacteria, lo que necesita más investigación para establecer posibles correlaciones. [29]
A nivel mundial
Las infecciones por Campylbacter jejuni son extremadamente comunes en todo el mundo, aunque no se dispone de cifras exactas. Nueva Zelanda informó la tasa nacional más alta, que alcanzó su punto máximo en mayo de 2006 con 400 por 100.000 habitantes. [1] [53] La infección por C. jejuni es un problema de salud mundial importante, con tasas de infección que varían entre el 0,3 y el 2,9%. [29] Es una infección generalizada que afecta a personas de todas las edades, pero es más frecuente en los países en desarrollo . [29] En estas áreas, la diarrea es la presentación clínica más común y tiene un impacto grave en los niños. [29]
Sexo
Campylobacter se aísla con mayor frecuencia en hombres que en mujeres, y los hombres homosexuales parecen tener un mayor riesgo de infección por especies atípicas relacionadas con Campylobacter, como Helicobacter cinaedi y Helicobacter fennelliae . [53]
Edad
Las infecciones por Campylobacter pueden presentarse en todos los grupos de edad. Los estudios muestran una incidencia máxima en niños menores de 1 año y en personas de 15 a 29 años. La tasa de ataque específica por edad es más alta en niños pequeños. En los Estados Unidos, la incidencia más alta de infección por Campylobacter en 2010 se registró en niños menores de 5 años y fue de 24,4 casos por cada 100 000 habitantes. [52] Los estudios basados en la comunidad realizados en países en desarrollo muestran que alrededor de 60 000 de cada 100 000 niños menores de cinco años se ven afectados por infecciones por Campylobacter. [3] Sin embargo, la tasa de cultivos fecales positivos para especies de Campylobacter es mayor en adultos y niños mayores. [53]
Diagnóstico
Existen pruebas diagnósticas para identificar infecciones por campylobacter, incluidas las causadas por C. jejuni. [3] El cultivo de heces se considera el estándar de oro para diagnosticar C. jejuni, [54] [ se necesita una mejor fuente ] y se utilizan técnicas de cultivo selectivo para distinguirlo de otras variantes. [3] Los cultivos de heces se cultivan a 42 grados Celsius en una atmósfera de 85% N 2 , 10% CO 2 y 5% O 2 , ya que C. jejuni requiere estas condiciones debido a que es termófilo y microaerófilo . [55] Un diagnóstico final a partir de una muestra de heces requiere una tinción de Gram o una microscopía de contraste de fases. [54]
Además de los cultivos de heces, C. jejuni se puede detectar mediante inmunoensayo enzimático (EIA) o reacción en cadena de la polimerasa (PCR). [3] Estos métodos son más sensibles que los cultivos de heces, pero la PCR tiende a ser la más sensible, especialmente en niños y países en desarrollo. [56]
Tratamiento
Las infecciones por Campylobacter tienden a ser leves y requieren solo hidratación y reposición de electrolitos mientras dura la diarrea. El mantenimiento del equilibrio electrolítico, no el tratamiento con antibióticos, es la piedra angular del tratamiento de la enteritis por Campylobacter. Dependiendo del grado de deshidratación, se pueden tomar medidas alternativas, incluidos los métodos parenterales de hidratación. [57] [58] De hecho, la mayoría de los pacientes con esta infección tienen una enfermedad autolimitada y no requieren antibióticos en absoluto; sin embargo, pueden ser la mejor forma de tratamiento en casos más graves de infección.
Tratamiento con antibióticos
El tratamiento antibiótico para las infecciones por Campylobacter generalmente no es necesario ni recomendado. Los antibióticos son limitados para tratar a pacientes de alto riesgo, incluidos los individuos inmunodeprimidos y de edad avanzada. Los casos graves que presentan síntomas como heces con sangre, fiebre, dolor abdominal intenso, embarazo, infección por VIH y enfermedad prolongada (síntomas que duran > 1 semana) también pueden requerir tratamiento con antibióticos que pueden ayudar a acortar la duración de los síntomas. [3] [15] [52] Es aconsejable tratar estas infecciones con antibióticos macrólidos , como eritromicina o azitromicina . La eritromicina es barata y limita la exposición tóxica a los pacientes, sin embargo, se informa que las tasas de resistencia están aumentando; sin embargo, su uso continúa, ya que las tasas de resistencia se mantienen por debajo del 5%. [59] El uso de azitromicina está aumentando debido a varias características del fármaco, incluida su dosis una vez al día, la tolerabilidad de los pacientes, la menor relación con la estenosis pilórica hipertrófica infantil (IHPS) y menos síntomas negativos; esto es comparable a la eritromicina. Las fluoroquinolonas son otra fuente de tratamiento, sin embargo las tasas de resistencia de las bacterias a este tipo de antibiótico están aumentando enormemente. [60]
Resistencia a los antibióticos
Las fluoroquinolonas se aprobaron por primera vez como tratamiento para las infecciones por Campylobacter en 1986, y luego fueron aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) en 1996, con el fin de controlar las infecciones en las bandadas de aves de corral. Los CDC comenzaron a monitorear Campylobacter en 1997 en el Sistema Nacional de Monitoreo de la Resistencia a los Antimicrobianos (NARMS). Los datos de NARMS indicaron que la ciprofloxacina , una fluoroquinolona, tuvo tasas de resistencia microbiana del 17% en 1997-1999, que aumentaron aún más al 27% en 2015-2017. [61] El 12 de septiembre de 2005, la FDA suspendió el uso de todas las fluoroquinolonas en la producción avícola, y la prevalencia de cepas de Campylobacter que son resistentes a las fluoroquinolonas en las bandadas de aves de corral, los productos avícolas, las instalaciones de producción y las infecciones humanas se volvió vital para monitorear; esto fue en un esfuerzo por determinar si la prohibición de las fluoroquinolonas condujo a una reducción en las cepas resistentes a los antibióticos. [62] Se ha observado la presencia de resistencia a los fármacos ciprofloxacino en estudios aislados, así como una resistencia significativa a los fármacos de Campylobacter a los antibióticos ácido nalidíxico y tetraciclinas . Existe una baja tasa de resistencia a la eritromicina , la fuente preferida de tratamiento antibiótico para las infecciones por Campylobacter, sin embargo se han detectado cepas resistentes en muchos países entre las fuentes de origen de los alimentos de animales de granja. [63]
Prevención
Algunas prácticas sencillas de manipulación de alimentos pueden ayudar a prevenir infecciones por Campylobacter. [1]
- Cocine bien todos los productos avícolas. Asegúrese de que la carne esté bien cocida (que ya no esté rosada) y que los jugos sean transparentes. Todas las aves deben cocinarse hasta alcanzar una temperatura interna mínima de 165 °F (74 °C).
- Lávese las manos con jabón antes de preparar alimentos.
- Lávese las manos con jabón después de manipular alimentos crudos de origen animal y antes de tocar cualquier otra cosa.
- Evite la contaminación cruzada en la cocina utilizando tablas de cortar separadas para alimentos de origen animal y otros alimentos y limpiando minuciosamente todas las tablas de cortar, encimeras y utensilios con agua caliente y jabón después de preparar alimentos crudos de origen animal.
- No beba leche no pasteurizada ni agua superficial no tratada.
- Asegúrese de que las personas con diarrea, especialmente los niños, se laven las manos cuidadosa y frecuentemente con jabón para reducir el riesgo de propagación de la infección.
- Lávese las manos con jabón después del contacto con heces de mascotas.
Características del laboratorio
| Característica | Resultado |
|---|---|
| Crecimiento a 25 °C | − |
| Crecimiento a 35–37 °C | + |
| Crecimiento a 42 °C | + |
| Reducción de nitratos | + |
| Prueba de catalasa | + |
| Prueba de oxidasa | + |
| Crecimiento en agar MacConkey | + |
| Movilidad (preparación húmeda) | + |
| Uso de glucosa | − |
| Hidrólisis de hipurato | + |
| Resistencia al ácido nalidíxico | − |
| Resistencia a la cefalotina | + |

Bajo microscopio óptico, C. jejuni tiene una forma característica de "gaviota" como consecuencia de su forma helicoidal. Campylobacter se cultiva en placas de agar "CAMP" especialmente selectivas a 42 °C, la temperatura corporal normal de las aves, en lugar de a 37 °C, la temperatura a la que crecen la mayoría de las otras bacterias patógenas. Dado que las colonias son oxidasa positivas, generalmente solo crecen en cantidades escasas en las placas. Se requieren condiciones microaerófilas para un crecimiento lujoso. Se puede utilizar un medio de agar sangre selectivo (medio de Skirrow). Se puede obtener una mayor selectividad con una infusión de un cóctel de antibióticos: vancomicina , polimixina-B , trimetoprima y actidiona (agar de Preston), [64] y crecimiento en condiciones microaerófilas a 42 °C.
Genoma
El genoma de la cepa NCTC11168 de C. jejuni se publicó en 2000 y reveló 1.641.481 pares de bases (30,6 % G+C) que se predice que codifican 1.654 proteínas y 54 especies de ARN estables . El genoma es inusual porque prácticamente no se encuentran secuencias de inserción ni secuencias asociadas a fagos y muy pocas secuencias repetidas . Uno de los hallazgos más sorprendentes en el genoma fue la presencia de secuencias hipervariables. Estas secuencias homopoliméricas cortas se encontraron comúnmente en genes que codifican la biosíntesis o modificación de estructuras superficiales, o en genes estrechamente vinculados de función desconocida. La tasa aparentemente alta de variación de estos tractos homopoliméricos puede ser importante en la estrategia de supervivencia de C. jejuni . [65] El genoma se volvió a anotar en 2007, actualizando el 18,2 % de las funciones del producto. [66] El análisis también predijo la primera isla de patogenicidad en C. jejuni entre cepas seleccionadas, que alberga el sistema de secreción tipo VI de la bacteria y supuestos efectores cognados. [67]
Los análisis iniciales de mutagénesis de transposones revelaron 195 genes esenciales , aunque es probable que este número aumente con análisis adicionales. [68]
Transformación genética natural
C. jejuni es naturalmente competente para la transformación genética. [69] La transformación genética natural es un proceso sexual que implica la transferencia de ADN de una bacteria a otra a través del medio intermedio y la integración de la secuencia donante en el genoma receptor mediante recombinación homóloga . C. jejuni absorbe libremente ADN extraño que alberga información genética responsable de la resistencia a los antibióticos . [69] Los genes de resistencia a los antibióticos se transfieren con mayor frecuencia en biopelículas que entre células planctónicas (células individuales que flotan en medios líquidos). [70]
Referencias
- ^ abc "Campylobacter: preguntas y respuestas". Centros para el Control y la Prevención de Enfermedades de EE. UU . 20 de diciembre de 2019. Consultado el 2 de enero de 2020 .
- ^ "Campylobacter". Autoridad Europea de Seguridad Alimentaria . Consultado el 2 de enero de 2020 .
- ^ abcdefghi Fischer GH, Hashmi MF, Paterek E (2024). "Infección por Campylobacter". StatPearls . Treasure Island (FL): StatPearls Publishing. PMID 30725718 . Consultado el 29 de febrero de 2024 .
- ^ abc "Campylobacter jejuni | Intoxicación alimentaria por Campylobacter". www.about-campylobacter.com . Consultado el 18 de abril de 2016 .
- ^ Gundogdu O, Wren BW (marzo de 2020). "Perfil microbiano: Campylobacter jejuni: instintos de supervivencia". Microbiología . 166 (3): 230–232. doi : 10.1099/mic.0.000906 . PMID 32228803. S2CID 214750673.
- ^ Balaban M, Hendrixson DR (diciembre de 2011). "La biosíntesis flagelar polar y un regulador del número de flagelos influyen en los parámetros espaciales de la división celular en Campylobacter jejuni". PLOS Pathogens . 7 (12): e1002420. doi : 10.1371/journal.ppat.1002420 . PMC 3228812 . PMID 22144902.
- ^ Ryan KJ, Ray CG, eds. (2004). Microbiología médica Sherris (4.ª ed.). McGraw Hill. ISBN 978-0-8385-8529-0.
- ^ "Manual analítico bacteriológico en línea, capítulo 7: Campylobacter". Administración de Alimentos y Medicamentos .
- ^ Gorbach SL, Falagas M, eds. (2001). Consulta de enfermedades infecciosas en 5 minutos (1.ª ed.). Lippincott Williams & Wilkins. ISBN 978-0-683-30736-8."Secuenciación de múltiples genomas de Campylobacter". PLOS Biology . 3 (1): e40. 2005-01-04. doi : 10.1371/journal.pbio.0030040 . PMC 539341 .
- ^ ab Pérez-Pérez GI, Blaser MJ (enero de 1996). Barón S (ed.). Campylobacter y Helicobacter (4ª ed.). Galveston (TX): Rama Médica de la Universidad de Texas en Galveston. ISBN 978-0-9631172-1-2. Número de identificación personal 21413331.
- ^ Crushell E, Harty S, Sharif F, Bourke B (enero de 2004). "Campylobacter entérico: ¿purgando sus secretos?". Pediatric Research . 55 (1): 3–12. doi : 10.1203/01.PDR.0000099794.06260.71 . PMID 14605259.
- ^ Fujimoto S, Amako K (junio de 1990). "Síndrome de Guillain-Barré e infección por Campylobacter jejuni". Lancet . 335 (8701): 1350. doi :10.1016/0140-6736(90)91234-2. PMID 1971411. S2CID 38312888.
- ^ McCarthy N, Giesecke J (marzo de 2001). "Incidencia del síndrome de Guillain-Barré tras infección por Campylobacter jejuni". American Journal of Epidemiology . 153 (6): 610–614. doi : 10.1093/aje/153.6.610 . PMID 11257070.
- ^ ab "¿Qué es la artritis reactiva?". Artritis reactiva . 2019-02-06.
- ^ abc Allos BM (abril de 2001). "Infecciones por Campylobacter jejuni: actualización sobre problemas y tendencias emergentes". Enfermedades infecciosas clínicas . 32 (8): 1201–1206. doi : 10.1086/319760 . PMID 11283810.
- ^ abcde Epps SV, Harvey RB, Hume ME, Phillips TD, Anderson RC, Nisbet DJ (noviembre de 2013). "Campylobacter transmitido por alimentos: infecciones, metabolismo, patogénesis y reservorios". Revista internacional de investigación ambiental y salud pública . 10 (12): 6292–6304. doi : 10.3390/ijerph10126292 . PMC 3881114 . PMID 24287853.
- ^ Allos BM (abril de 2001). "Infecciones por Campylobacter jejuni: actualización sobre problemas y tendencias emergentes". Enfermedades infecciosas clínicas . 32 (8): 1201–1206. doi :10.1086/319760. PMID 11283810.
- ^ Altekruse SF, Stern NJ, Fields PI, Swerdlow DL (febrero de 1999). "Campylobacter jejuni: un patógeno emergente transmitido por los alimentos". Enfermedades infecciosas emergentes . 5 (1): 28–35. doi :10.3201/eid0501.990104. PMC 2627687 . PMID 10081669.
- ^ abc Tegtmeyer N, Sharafutdinov I, Harrer A, Soltan Esmaeili D, Linz B, Backert S (2021). "Factores de virulencia de Campylobacter e interacciones moleculares entre huésped y patógeno". En Backert S (ed.). Temas actuales en microbiología e inmunología . Vol. 431. Cham: Springer International Publishing. págs. 169–202. doi :10.1007/978-3-030-65481-8_7. ISBN 978-3-030-65480-1. Número PMID 33620652.
- ^ abcdefgh Stahl M, Butcher J, Stintzi A (2012). "Adquisición y metabolismo de nutrientes por Campylobacter jejuni". Frontiers in Cellular and Infection Microbiology . 2 : 5. doi : 10.3389/fcimb.2012.00005 . PMC 3417520 . PMID 22919597.
- ^ abcdefg Gao B, Vorwerk H, Huber C, Lara-Tejero M, Mohr J, Goodman AL, et al. (mayo de 2017). Waldor M (ed.). "Determinantes metabólicos y de aptitud para el crecimiento in vitro y la colonización intestinal del patógeno bacteriano Campylobacter jejuni". PLOS Biology . 15 (5): e2001390. doi : 10.1371/journal.pbio.2001390 . PMC 5438104 . PMID 28542173.
- ^ Sellars MJ, Hall SJ, Kelly DJ (agosto de 2002). "El crecimiento de Campylobacter jejuni apoyado por la respiración de fumarato, nitrato, nitrito, trimetilamina-N-óxido o dimetilsulfóxido requiere oxígeno". Journal of Bacteriology . 184 (15): 4187–4196. doi :10.1128/JB.184.15.4187-4196.2002. PMC 135223 . PMID 12107136.
- ^ abcdef Hofreuter D (2014). "Definición de los requisitos metabólicos para el crecimiento y la capacidad de colonización de Campylobacter jejuni". Frontiers in Cellular and Infection Microbiology . 4 : 137. doi : 10.3389/fcimb.2014.00137 . PMC 4178425 . PMID 25325018.
- ^ ab "Campylobacter: preguntas y respuestas". Centros para el Control y la Prevención de Enfermedades de EE. UU . 20 de diciembre de 2019. Consultado el 2 de enero de 2020 .
- ^ ab "Preguntas y respuestas | Campylobacter | CDC". www.cdc.gov . 2023-02-16 . Consultado el 2024-02-28 .
- ^ abc Facciolà A, Riso R, Avventuroso E, Visalli G, Delia SA, Laganà P (junio de 2017). "Campylobacter: de la microbiología a la prevención". Revista de Medicina Preventiva e Higiene . 58 (2): E79-E92. PMC 5584092 . PMID 28900347.
- ^ abc "Campylobacter". www.who.int . Consultado el 28 de febrero de 2024 .
- ^ Bronowski C, James CE, Winstanley C (julio de 2014). "El papel de la supervivencia ambiental en la transmisión de Campylobacter jejuni". FEMS Microbiology Letters . 356 (1): 8–19. doi : 10.1111/1574-6968.12488 . PMID 24888326.
- ^ abcdefghijklmnopqrstu vw Kemper L, Hensel A (mayo de 2023). "Campylobacter jejuni: ataque a células huésped, adhesión, invasión y supervivencia". Applied Microbiology and Biotechnology . 107 (9): 2725–2754. doi :10.1007/s00253-023-12456-w. PMC 10027602 . PMID 36941439.
- ^ Kaakoush NO, Castaño-Rodríguez N, Mitchell HM, Man SM (julio de 2015). "Epidemiología global de la infección por Campylobacter". Clinical Microbiology Reviews . 28 (3): 687–720. doi :10.1128/CMR.00006-15. PMC 4462680 . PMID 26062576.
- ^ Wallis MR (marzo de 1994). "La patogénesis de Campylobacter jejuni". British Journal of Biomedical Science . 51 (1): 57–64. PMID 7841837.
- ^ Korneev KV, Kondakova AN, Sviriaeva EN, Mitkin NA, Palmigiano A, Kruglov AA, et al. (2018). "LPS hipoacilado del patógeno alimentario Campylobacter jejuni induce una respuesta inflamatoria moderada mediada por TLR4 en macrófagos murinos". Frontiers in Cellular and Infection Microbiology . 8 : 58. doi : 10.3389/fcimb.2018.00058 . PMC 5835049 . PMID 29535976.
- ^ El Abbar FM, Li J, Owen HC, Daugherty CL, Fulmer CA, Bogacz M, et al. (7 de agosto de 2019). "Unión de ARN por el regulador postranscripcional CsrA de Campylobacter jejuni". Frontiers in Microbiology . 10 : 1776. doi : 10.3389/fmicb.2019.01776 . PMC 6692469 . PMID 31447808.
- ^ Young NM, Brisson JR, Kelly J, Watson DC, Tessier L, Lanthier PH, et al. (2002). "Estructura del glicano ligado a N presente en múltiples glicoproteínas en la bacteria gramnegativa, Campylobacter jejuni". Revista de química biológica . 277 (45): 42530–42539. doi : 10.1074/jbc.M206114200 . PMID 12186869.
- ^ Karlyshev AV, Ketley JM, Wren BW (2005). "El glicoma de Campylobacter jejuni". FEMS Microbiology Reviews . 29 (2): 377–390. doi : 10.1016/j.fmrre.2005.01.003 . PMID 15808749.
- ^ Dasti JI, Tareen AM, Lugert R, Zautner AE, Gross U (abril de 2010). "Campylobacter jejuni: una breve descripción general de los factores asociados a la patogenicidad y los mecanismos de mediación de la enfermedad". Revista internacional de microbiología médica . 300 (4): 205–211. doi :10.1016/j.ijmm.2009.07.002. PMID 19665925.
- ^ abcdefghij Gourley CR, Negretti NM, Konkel ME (octubre de 2017). "El patógeno transmitido por los alimentos Campylobacter jejuni depende del sistema de reparación del ADN AddAB para defenderse de la bilis en el entorno intestinal". Scientific Reports . 7 (1): 14777. Bibcode :2017NatSR...714777G. doi :10.1038/s41598-017-14646-9. PMC 5665897 . PMID 29089630.
- ^ Alrubaye B, Abraha M, Almansour A, Bansal M, Wang H, Kwon YM, et al. (2019). "El ácido desoxicólico, un metabolito microbiano, moldea la microbiota contra la colonización de pollos por Campylobacter jejuni". PLOS ONE . 14 (7): e0214705. Bibcode :2019PLoSO..1414705A. doi : 10.1371/journal.pone.0214705 . PMC 6611565 . PMID 31276498.
- ^ Negretti NM, Gourley CR, Clair G, Adkins JN, Konkel ME (noviembre de 2017). "El patógeno transmitido por los alimentos Campylobacter jejuni responde al desoxicolato de sales biliares con contramedidas para las especies reactivas del oxígeno". Scientific Reports . 7 (1): 15455. Bibcode :2017NatSR...715455N. doi :10.1038/s41598-017-15379-5. PMC 5684402 . PMID 29133896.
- ^ Smith GR (junio de 2012). "Cómo la enzima RecBCD y Chi promueven la reparación y recombinación de las roturas del ADN: la visión de un biólogo molecular". Microbiology and Molecular Biology Reviews . 76 (2): 217–228. doi :10.1128/MMBR.05026-11. PMC 3372252 . PMID 22688812.
- ^ Sidor K, Skirecki T (mayo de 2023). "Un beso agridulce de bacterias gramnegativas: el papel de la ADP-heptosa en la patogénesis de la infección". Microorganismos . 11 (5): 1316. doi : 10.3390/microorganisms11051316 . PMC 10221265 . PMID 37317291.
- ^ Colles FM, McCarthy ND, Howe JC, Devereux CL, Gosler AG, Maiden MC (enero de 2009). "Dinámica de la colonización por Campylobacter de un huésped natural, Sturnus vulgaris (estornino pinto europeo)". Microbiología medioambiental . 11 (1): 258–267. Bibcode :2009EnvMi..11..258C. doi :10.1111/j.1462-2920.2008.01773.x. PMC 2702492 . PMID 18826435.
- ^ ab Rosenquist H, Sommer HM, Nielsen NL, Christensen BB (abril de 2006). "El efecto de las operaciones de sacrificio en la contaminación de carcasas de pollo con Campylobacter termotolerante". Revista internacional de microbiología alimentaria . 108 (2): 226–232. doi :10.1016/j.ijfoodmicro.2005.12.007. PMID 16478636.
- ^ Oosterom J, DE Wilde GJ, DE Boer E, DE Blaauw LH, Karman H (agosto de 1983). "Supervivencia de Campylobacter jejuni durante el procesamiento de aves de corral y el sacrificio de cerdos". Revista de protección de alimentos . 46 (8): 702–706. doi : 10.4315/0362-028X-46.8.702 . PMID 30921893.
- ^ Ijaz UZ, Sivaloganathan L, McKenna A, Richmond A, Kelly C, Linton M, et al. (octubre de 2018). "El análisis longitudinal integral del microbioma del ciego del pollo revela un cambio de los factores competitivos a los ambientales y una ventana de oportunidad para Campylobacter". Frontiers in Microbiology . 9 : 2452. doi : 10.3389/fmicb.2018.02452 . PMC 6196313 . PMID 30374341.
- ^ McKenna A, Ijaz UZ, Kelly C, Linton M, Sloan WT, Green BD, et al. (septiembre de 2020). "Impacto de los parámetros del sistema de producción industrial en los microbiomas de los pollos: mecanismos para mejorar el rendimiento y reducir Campylobacter". Microbioma . 8 (1): 128. doi : 10.1186/s40168-020-00908-8 . PMC 7488076 . PMID 32907634.
- ^ Centro para la Seguridad Alimentaria y la Nutrición Aplicada. "Bad Bug Book – BBB – Campylobacter jejuni" (Libro de los bichos malos – BBB – Campylobacter jejuni). www.fda.gov . Consultado el 18 de abril de 2016 .
- ^ Fonseca BB, Beletti ME, de Melo RT, Mendonça EP, Coelho LR, Nalevaiko PC, et al. (2014). "Campylobacter jejuni en huevos comerciales". Revista Brasileña de Microbiología . 45 (1): 76–79. doi :10.1590/S1517-83822014000100011. PMC 4059329 . PMID 24948916.
- ^ Skirrow MB, Jones DM, Sutcliffe E, Benjamin J (junio de 1993). "Bacteriemia por Campylobacter en Inglaterra y Gales, 1981-91". Epidemiología e infección . 110 (3): 567-573. doi :10.1017/s0950268800050986. PMC 2272297 . PMID 8519321.
- ^ Allos BM (abril de 2001). "Infecciones por Campylobacter jejuni: actualización sobre problemas y tendencias emergentes". Enfermedades infecciosas clínicas . 32 (8): 1201–1206. doi :10.1086/319760. PMID 11283810.
- ^ Bonheur JL (24 de julio de 2018). Anand BS (ed.). "Gastroenteritis bacteriana". Referencia de Medscape .
- ^ abc "Campylobacter". Foodsafety.gov . Consultado el 18 de abril de 2016 .
- ^ abcd Javid MH, Ahmed SH (2 de febrero de 2019). Talavera F, Bronze MS (eds.). "Infecciones por Campylobacter: antecedentes, fisiopatología, epidemiología". Medscape .
- ^ ab "Diagnóstico de una infección por Campylobacter". Marler Clark . Consultado el 9 de abril de 2024 .
- ^ Davis L, DiRita V (agosto de 2008). "Crecimiento y mantenimiento en laboratorio de Campylobacter jejuni". Protocolos actuales en microbiología . Capítulo 8: Unidad 8A.1.1–8A.1.7. doi :10.1002/9780471729259.mc08a01s10. hdl : 2027.42/154622 . PMID: 18729058.
- ^ Platts-Mills JA, Liu J, Gratz J, Mduma E, Amour C, Swai N, et al. (abril de 2014). Diekema DJ (ed.). "Detección de Campylobacter en heces y determinación de su significación mediante cultivo, inmunoensayo enzimático y PCR en países en desarrollo". Journal of Clinical Microbiology . 52 (4): 1074–1080. doi :10.1128/JCM.02935-13. PMC 3993515 . PMID 24452175.
- ^ Fischer GH, Hashmi MF, Paterek E (2024). "Infección por Campylobacter". StatPearls . Treasure Island (FL): StatPearls Publishing. PMID 30725718 . Consultado el 29 de febrero de 2024 .
- ^ "Resistencia a los antibióticos | Campylobacter". Centros para el Control y la Prevención de Enfermedades (CDC) de EE. UU . . 2022-06-27 . Consultado el 2024-04-11 .
- ^ Eiland LS, Jenkins LS (julio de 2008). "Tratamiento óptimo de la disentería por Campylobacter". Revista de farmacología y terapéutica pediátrica . 13 (3): 170–174. doi :10.5863/1551-6776-13.3.170. PMC 3462042. PMID 23055879 .
- ^ Eiland LS, Jenkins LS (julio de 2008). "Tratamiento óptimo de la disentería por Campylobacter". Revista de farmacología y terapéutica pediátrica . 13 (3): 170–174. doi :10.5863/1551-6776-13.3.170. PMC 3462042. PMID 23055879 .
- ^ Eiland LS, Jenkins LS (julio de 2008). "Tratamiento óptimo de la disentería por Campylobacter". Revista de farmacología y terapéutica pediátrica . 13 (3): 170–174. doi :10.5863/1551-6776-13.3.170. PMC 3462042. PMID 23055879 .
- ^ Price LB, Lackey LG, Vailes R, Silbergeld E (julio de 2007). "La persistencia de Campylobacter resistente a fluoroquinolonas en la producción avícola". Environmental Health Perspectives . 115 (7): 1035–1039. doi :10.1289/ehp.10050. PMC 1913601 . PMID 17637919.
- ^ Portes AB, Panzenhagen P, Pereira Dos Santos AM, Junior CA (marzo de 2023). "Resistencia a los antibióticos en Campylobacter: una revisión sistemática de aislamientos sudamericanos". Antibióticos . 12 (3): 548. doi : 10.3390/antibiotics12030548 . PMC 10044704 . PMID 36978415.
- ^ Bolton FJ, Robertson L (abril de 1982). "Un medio selectivo para aislar Campylobacter jejuni/coli". Revista de patología clínica . 35 (4): 462–467. doi :10.1136/jcp.35.4.462. PMC 497682 . PMID 7042765.
- ^ Parkhill J, Wren BW, Mungall K, Ketley JM, Churcher C, Basham D, et al. (febrero de 2000). "La secuencia del genoma del patógeno transmitido por los alimentos Campylobacter jejuni revela secuencias hipervariables". Nature . 403 (6770): 665–668. Bibcode :2000Natur.403..665P. doi : 10.1038/35001088 . PMID 10688204.
- ^ Gundogdu O, Bentley SD, Holden MT, Parkhill J, Dorrell N, Wren BW (junio de 2007). "Reanotación y reanálisis de la secuencia del genoma NCTC11168 de Campylobacter jejuni". BMC Genomics . 8 (1): 162. doi : 10.1186/1471-2164-8-162 . PMC 1899501 . PMID 17565669.
- ^ Robinson L, Liaw J, Omole Z, Xia D, van Vliet AH, Corcionivoschi N, et al. (29 de junio de 2021). "Análisis bioinformático del sistema de secreción de Campylobacter jejuni tipo VI y predicción de efectores". Frontiers in Microbiology . 12 : 694824. doi : 10.3389/fmicb.2021.694824 . PMC 8285248 . PMID 34276628.
- ^ Stahl M, Stintzi A (junio de 2011). "La identificación de genes esenciales en el genoma de C. jejuni destaca las regiones de plasticidad hipervariable". Genómica funcional e integradora . 11 (2): 241–257. doi :10.1007/s10142-011-0214-7. PMID 21344305. S2CID 24054117.
- ^ ab Bae J, Oh E, Jeon B (diciembre de 2014). "Transmisión mejorada de resistencia a antibióticos en biopelículas de Campylobacter jejuni por transformación natural". Agentes antimicrobianos y quimioterapia . 58 (12): 7573–7575. doi :10.1128/AAC.04066-14. PMC 4249540. PMID 25267685 .
- ^ Michaelis C, Grohmann E (febrero de 2023). "Transferencia horizontal de genes de resistencia a antibióticos en biopelículas". Antibióticos . 12 (2): 328. doi : 10.3390/antibiotics12020328 . PMC 9952180 . PMID 36830238.
Enlaces externos
- Genomas de Campylobacter jejuni e información relacionada en PATRIC, un centro de recursos bioinformáticos financiado por el NIAID
- Investigación actual sobre Campylobacter jejuni en el Parque de Investigación de Norwich Archivado el 14 de junio de 2017 en Wayback Machine.
- Cepa tipo de Campylobacter jejuni en BacDive – la base de metadatos de diversidad bacteriana