Pilo
Un pilus ( del latín pili, pelo ) es un apéndice de la superficie celular parecido a un pelo que se encuentra en muchas bacterias y arqueas . [ 1 ] Los términos pilus y fimbria (del latín fimbriae , franja ) se pueden usar indistintamente, aunque algunos investigadores reservan el término pilus para el apéndice necesario para la conjugación bacteriana . Todos los pili conjugativos están compuestos principalmente de pilina , proteínas fibrosas , que son oligoméricas .
En la superficie de las bacterias y arqueas pueden existir docenas de estas estructuras. Algunas bacterias, virus o bacteriófagos se adhieren a los receptores de los pili al comienzo de su ciclo reproductivo .
Los pili son antigénicos . También son frágiles y se reemplazan constantemente, a veces con pili de diferente composición, lo que resulta en una antigenicidad alterada. Las respuestas específicas del huésped a las estructuras antiguas de los pili no son efectivas en la nueva estructura. La recombinación entre genes de algunos pili (pero no todos) codifica regiones variables (V) y constantes (C) de los pili (similar a la diversidad de inmunoglobulinas ). Como determinantes antigénicos primarios, factores de virulencia y factores de impunidad en la superficie celular de varias especies de bacterias gramnegativas y algunas grampositivas , incluidas Enterobacteriaceae , Pseudomonadaceae y Neisseriaceae , ha habido mucho interés en el estudio de los pili como un orgánulo de adhesión y como un componente de la vacuna. El primer estudio detallado de los pili fue realizado por Brinton y colaboradores, quienes demostraron la existencia de dos fases distintas dentro de una cepa bacteriana: pileada (p+) y no pileada) [2].
Tipos por función
Se dan varios nombres a los distintos tipos de pili según su función. La clasificación no siempre se superpone con los tipos estructurales o evolutivos, ya que se produce una evolución convergente . [3]
Pili conjugativo
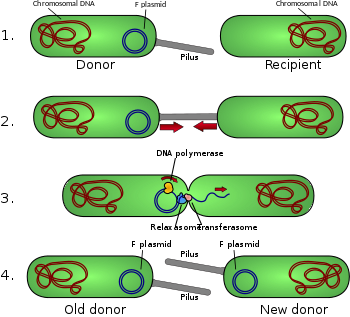
Los pili conjugativos permiten la transferencia de ADN entre bacterias, en el proceso de conjugación bacteriana . A veces se los llama "pili sexuales", en analogía con la reproducción sexual , porque permiten el intercambio de genes mediante la formación de "parejas de apareamiento". Quizás el más estudiado sea el pili F de Escherichia coli , codificado por el factor sexual F.
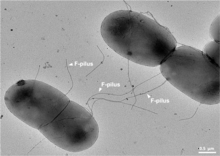
Un pilus sexual tiene típicamente de 6 a 7 nm de diámetro. Durante la conjugación, un pilus que emerge de la bacteria donante atrapa a la bacteria receptora, la atrae hacia sí y finalmente desencadena la formación de un puente de apareamiento , que establece un contacto directo y la formación de un poro controlado que permite la transferencia de ADN del donante al receptor. Por lo general, el ADN transferido consiste en los genes necesarios para producir y transferir pili (a menudo codificados en un plásmido ), por lo que es una especie de ADN egoísta ; sin embargo, a menudo se cotransfieren otros fragmentos de ADN y esto puede dar como resultado la diseminación de rasgos genéticos en una población bacteriana, como la resistencia a los antibióticos . La conexión establecida por el F-pilus es extremadamente resistente mecánica y termoquímicamente gracias a las propiedades robustas del F-pilus, lo que garantiza una transferencia genética exitosa en una variedad de entornos. [5] No todas las bacterias pueden producir pili conjugativos, pero la conjugación puede ocurrir entre bacterias de diferentes especies. [6] [7]
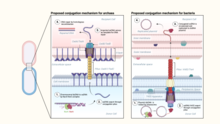
Las arqueas hipertermófilas codifican pili estructuralmente similares a los pili conjugativos bacterianos. [8] Sin embargo, a diferencia de las bacterias, donde el aparato de conjugación típicamente media la transferencia de elementos genéticos móviles, como plásmidos o transposones, la maquinaria conjugativa de las arqueas hipertermófilas, llamada Ced (sistema crenarqueal para el intercambio de ADN) [9] y Ted (sistema termoproteal para el intercambio de ADN), [8] parece ser responsable de la transferencia de ADN celular entre miembros de la misma especie. Se ha sugerido que en estas arqueas la maquinaria de conjugación ha sido completamente domesticada para promover la reparación del ADN a través de la recombinación homóloga en lugar de la propagación de elementos genéticos móviles. [8]
Fimbrias

Fimbria ( del latín "fleco", pl.: fimbriae ) es un término utilizado para un pilus corto, un apéndice que se utiliza para unir la bacteria a una superficie, a veces también llamado "pilus de unión" [10] o pilus adhesivo . El término "fimbria" puede referirse a muchos tipos diferentes (estructurales) de pilus. De hecho, se han utilizado muchos tipos diferentes de pili para la adhesión, un caso de evolución convergente . [3] El sistema Gene Ontology no trata a las fimbrias como un tipo distinto de apéndice, utilizando en su lugar el tipo genérico pilus (GO:0009289).
Este apéndice tiene un diámetro de entre 3 y 10 nanómetros y puede llegar a medir varios micrómetros de largo. Las bacterias utilizan las fimbrias para adherirse entre sí y a las células animales y a algunos objetos inanimados. Una bacteria puede tener hasta 1000 fimbrias. Las fimbrias solo son visibles con el uso de un microscopio electrónico . Pueden ser rectas o flexibles.
Las fimbrias poseen adhesinas que las unen a algún tipo de sustrato para que las bacterias puedan soportar fuerzas de cizallamiento y obtener nutrientes. Por ejemplo, E. coli las utiliza para unirse a los receptores de manosa .
Algunas bacterias aeróbicas forman una capa muy fina en la superficie de un caldo de cultivo . Esta capa, llamada película, está formada por muchas bacterias aeróbicas que se adhieren a la superficie mediante sus fimbrias. Por lo tanto, las fimbrias permiten que las bacterias aeróbicas permanezcan tanto en el caldo, del que toman nutrientes, como cerca del aire.
Las fimbrias son necesarias para la formación de biopelículas , ya que fijan las bacterias a las superficies del huésped para colonizarlas durante la infección. Las fimbrias se encuentran en los polos de una célula o se distribuyen uniformemente por toda su superficie.
Este término también fue utilizado en un sentido laxo para referirse a todos los pili, por aquellos que usan "pilus" para referirse específicamente a los pili sexuales. [11]
Tipos por sistema de montaje o estructura
En esta sección falta información sobre la mención de otros tipos: varias fimbrias chaperonas-acogedoras construidas por T7SS, pili de nucleación-precipitación extracelular construidos por T8SS (incluidos los curli ), LPXTG que incluye pilus tipo 3 (T3P; spaHIG) [3] . ( diciembre de 2020 ) |
Transferir
La familia Tra (de transferencia) incluye todos los pili sexuales conocidos (hasta 2010). Están relacionados con el sistema de secreción de tipo IV (T4SS). [3] Se pueden clasificar en el tipo similar a F (por el pili F) y el tipo similar a P. Al igual que sus contrapartes de secreción, el pilus inyecta material, ADN en este caso, en otra célula. [12]
Pili tipo IV


Algunos pili, llamados pili tipo IV (T4P), generan fuerzas móviles . [14] Los extremos externos de los pili se adhieren a un sustrato sólido, ya sea la superficie a la que está adherida la bacteria o a otras bacterias. Luego, cuando los pili se contraen, tiran de la bacteria hacia adelante como un gancho de agarre. El movimiento producido por los pili tipo IV es típicamente espasmódico, por lo que se llama motilidad de espasmo , a diferencia de otras formas de motilidad bacteriana como la producida por los flagelos . Sin embargo, algunas bacterias, por ejemplo Myxococcus xanthus , exhiben motilidad de deslizamiento . Los pili bacterianos tipo IV son similares en estructura a las proteínas componentes de las arqueas (flagelos arqueales), y ambos están relacionados con el sistema de secreción tipo II (T2SS); [15] están unificados por el grupo de sistemas de filamentos tipo IV . Además de las arqueas, muchas arqueas producen pili adhesivos tipo 4, que permiten que las células arqueales se adhieran a diferentes sustratos. Las porciones alfa helicoidales N-terminales de las pilinas y arqueilinas tipo 4 de las arqueas son homólogas a las regiones correspondientes de la T4P bacteriana; sin embargo, los dominios ricos en cadenas beta de la terminal C parecen no estar relacionados en las pilinas bacterianas y arqueales. [16]
La transformación genética es el proceso por el cual una célula bacteriana receptora toma ADN de una célula vecina e integra este ADN en su genoma por recombinación homóloga . En Neisseria meningitidis (también llamada meningococo), la transformación del ADN requiere la presencia de secuencias cortas de captación de ADN (DUS) que son 9-10 monómeros que residen en regiones codificantes del ADN donante. El reconocimiento específico de las DUS está mediado por una pilina tipo IV . [17] Los pili menningocócicos tipo IV se unen al ADN a través de la pilina menor ComP mediante una franja electropositiva que se predice que estará expuesta en la superficie del filamento. ComP muestra una preferencia de unión exquisita por las DUS selectivas. La distribución de las DUS dentro del genoma de N. meningitides favorece a ciertos genes, lo que sugiere que existe un sesgo por los genes involucrados en el mantenimiento y la reparación genómica. [18] [19]
Esta familia se identificó originalmente como "fimbrias de tipo IV" por su apariencia bajo el microscopio. Esta clasificación sobrevivió ya que corresponde a un clado. [20] Se ha demostrado que algunas pilinas de tipo IV de arqueas pueden existir en 4 conformaciones diferentes, lo que produce dos pili con estructuras radicalmente diferentes. [21] Sorprendentemente, los dos pili fueron producidos por la misma maquinaria de secreción. Sin embargo, cuál de los dos pili se forma parece depender de las condiciones de crecimiento, lo que sugiere que los dos pili son funcionalmente distintos. [21]
Fimbrias tipo 1
Otro tipo de fimbrias son las llamadas fimbrias de tipo 1 [22] . Contienen adhesinas FimH en las "puntas". La vía chaperona-usher es responsable de mover muchos tipos de fimbrias fuera de la célula, incluidas las fimbrias de tipo 1 [23] y las fimbrias P [24] .
Curli

"Las bacterias gramnegativas ensamblan fibras superficiales amiloides funcionales llamadas curli ". [26] Los curli son un tipo de fimbrias. [22] Los curli están compuestos de proteínas llamadas curlinas. [26] Algunos de los genes involucrados son CsgA , CsgB , CsgC , CsgD , CsgE , CsgF y CsgG . [26]
Virulencia
Los pili son responsables de la virulencia en las cepas patógenas de muchas bacterias, incluidas E. coli , Vibrio cholerae y muchas cepas de Streptococcus . [27] [28] Esto se debe a que la presencia de pili mejora en gran medida la capacidad de las bacterias para unirse a los tejidos corporales, lo que luego aumenta las tasas de replicación y la capacidad de interactuar con el organismo huésped. [27] Si una especie de bacteria tiene múltiples cepas pero solo algunas son patógenas, es probable que las cepas patógenas tengan pili mientras que las cepas no patógenas no. [29] [30]
El desarrollo de pili de unión puede dar lugar al desarrollo de otros rasgos de virulencia. Las fimbrias son uno de los principales mecanismos de virulencia de las bacterias E. coli , Bordetella pertussis , Staphylococcus y Streptococcus . Su presencia mejora en gran medida la capacidad de las bacterias para unirse al huésped y causar enfermedades. [31] Las cepas no patógenas de V. cholerae desarrollaron primero pili, lo que les permitió unirse a los tejidos humanos y formar microcolonias . [27] [30] Estos pili sirvieron entonces como sitios de unión para el bacteriófago lisogénico que transporta la toxina causante de la enfermedad . [27] [30] El gen de esta toxina, una vez incorporado al genoma de la bacteria, se expresa cuando se expresa el gen que codifica el pilus (de ahí el nombre de "pilus mediado por toxina"). [27]
Véase también
Referencias
- ^ "pilus" en el Diccionario médico de Dorland
- ^ Brinton, Charles (1954). "Estudios de electroforesis y susceptibilidad de fagos en una variante productora de filamentos de la bacteria E. coli". Biochimica et Biophysica Acta . 15 (4): 533–542. doi :10.1016/0006-3002(54)90011-6. PMID 13230101.
- ^ abcd Chagnot, C; Zorgani, MA; Astruc, T; Desvaux, M (14 de octubre de 2013). "Determinantes proteínicos de la colonización de la superficie en bacterias: adhesión bacteriana y formación de biopelículas desde una perspectiva de secreción de proteínas". Frontiers in Microbiology . 4 : 303. doi : 10.3389/fmicb.2013.00303 . PMC 3796261 . PMID 24133488.
- ^ "Las bacterias intestinales utilizan superpolímeros para esquivar los antibióticos | Imperial News | Imperial College London". Imperial News .
- ^ Patkowski, Jonasz B.; Dahlberg, Tobías; Amin, Himani; Gahlot, Dharmender K.; Vijayrajratnam, Sukhithasri; Vogel, José P.; Francisco, Mateo S.; Panadero, José L.; Andersson, Magnus; Costa, Tiago RD (5 de abril de 2023). "La adaptabilidad biomecánica de F-pilus acelera la diseminación conjugativa de la resistencia a los antimicrobianos y la formación de biopelículas". Comunicaciones de la naturaleza . 14 (1): 1879. doi :10.1038/s41467-023-37600-y. PMC 10076315 . PMID 37019921.
- ^ Petitjean, María; Condamine, Bénédicte; Burdet, Carlos; Denamur, Erick; Ruppé, Etienne (2021). "La barrera del filo y la filogenia intraespecies de Escherichia coli impulsan la adquisición de genes de resistencia a los antibióticos". Genómica microbiana . 7 (8): 000489. doi : 10.1099/mgen.0.000489 . ISSN 2057-5858. PMC 8549366 . PMID 34435947.
- ^ Gschwind, Rémi; Petitjean, Marie; Fournier, Claudine; Lao, Julie; Clermont, Olivier; Nordmann, Patrice; Mellmann, Alexander; Denamur, Erick; Poirel, Laurent; Ruppé, Etienne (3 de abril de 2024). Uhlemann, Anne-Catrin (ed.). "Circulación interfilum de un gen que codifica beta-lactamasa: un evento raro pero observable". Agentes antimicrobianos y quimioterapia . 68 (4): e0145923. doi :10.1128/aac.01459-23. ISSN 0066-4804. PMC 10989005 . PMID 38441061.
- ^ abcd Beltran, Leticia C.; Cvirkaite-Krupovic, Virginija; Miller, Jessalyn; Wang, Fengbin; Kreutzberger, Mark AB; Patkowski, Jonasz B.; Costa, Tiago RD; Schouten, Stefan; Levental, Ilya; Conticello, Vincent P.; Egelman, Edward H.; Krupovic, Mart (7 de febrero de 2023). "El aparato de importación de ADN arqueológico es homólogo a la maquinaria de conjugación bacteriana". Nature Communications . 14 (1): 666. Bibcode :2023NatCo..14..666B. doi :10.1038/s41467-023-36349-8. ISSN 2041-1723. PMC 9905601 . PMID 36750723.
- ^ van Wolferen, Marleen; Wagner, Alexander; van der Does, Chris; Albers, Sonja-Verena (1 de marzo de 2016). "El sistema Ced arqueológico importa ADN". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 113 (9): 2496–2501. Bibcode :2016PNAS..113.2496V. doi : 10.1073/pnas.1513740113 . ISSN 1091-6490. PMC 4780597 . PMID 26884154.
- ^ Proft, T.; Baker, EN (febrero de 2009). "Pili en bacterias gramnegativas y grampositivas: estructura, ensamblaje y su papel en la enfermedad". Ciencias de la vida celular y molecular . 66 (4): 613–635. doi : 10.1007/s00018-008-8477-4 . PMC 11131518 . PMID 18953686. S2CID 860681.
- ^ Ottow, JC (1975). "Ecología, fisiología y genética de las fimbrias y los pili". Revista anual de microbiología . 29 : 79–108. doi :10.1146/annurev.mi.29.100175.000455. PMID 1180526.
- ^ Filloux, A (julio de 2010). "Una variedad de pili bacterianos implicados en la transferencia horizontal de genes". Journal of Bacteriology . 192 (13): 3243–5. doi :10.1128/JB.00424-10. PMC 2897649 . PMID 20418394.
- ^ Joan, Slonczewski (2017). Microbiología: una ciencia en evolución . Foster, John Watkins (cuarta edición). Nueva York: WW Norton & Company. pp. 1000–1002. ISBN. 9780393614039.OCLC 951925510 .
- ^ Mattick JS (2002). "Pili tipo IV y motilidad espasmódica". Annu. Rev. Microbiol . 56 (1): 289–314. doi :10.1146/annurev.micro.56.012302.160938. PMID 12142488.
- ^ Jarrell y col. (2009). "Flagella y pili arqueales". Pili y flagelos: investigación actual y tendencias futuras . Caister Academic Press. ISBN 978-1-904455-48-6.
- ^ Wang, F; Cvirkaite-Krupovic, V; Kreutzberger, MAB; Su, Z; de Oliveira, GAP; Osinski, T; Sherman, N; DiMaio, F; Wall, JS; Prangishvili, D; Krupovic, M; Egelman, EH (2019). "Un pilus de arquea extensamente glicosilado sobrevive a condiciones extremas". Nature Microbiology . 4 (8): 1401–1410. doi :10.1038/s41564-019-0458-x. PMC 6656605 . PMID 31110358.
- ^ Cehovin A, Simpson PJ, McDowell MA, Brown DR, Noschese R, Pallett M, Brady J, Baldwin GS, Lea SM, Matthews SJ, Pelicic V (2013). "Reconocimiento específico de ADN mediado por una pilina tipo IV". Proc. Natl. Sci. USA . 110 (8): 3065–70. Bibcode :2013PNAS..110.3065C. doi : 10.1073/pnas.1218832110 . PMC 3581936 . PMID 23386723.
- ^ Davidsen T, Rødland EA, Lagesen K, Seeberg E, Rognes T, Tønjum T (2004). "Distribución sesgada de secuencias de captación de ADN hacia genes de mantenimiento del genoma". Ácidos nucleicos Res . 32 (3): 1050–8. doi :10.1093/nar/gkh255. PMC 373393 . PMID 14960717.
- ^ Caugant DA, Maiden MC (2009). "Transmisión y enfermedad meningocócica: biología y evolución de la población". Vacuna . 27 Suppl 2 (4): B64–70. doi :10.1016/j.vaccine.2009.04.061. PMC 2719693 . PMID 19464092.
- ^ Nuccio SP, et al. (2007). "Evolución de la vía de ensamblaje de chaperona/acomodador: la clasificación fimbrial se vuelve griega". Microbiology and Molecular Biology Reviews . 71 (4): 551–575. doi :10.1128/MMBR.00014-07. PMC 2168650 . PMID 18063717.
- ^ ab Liu, J; Eastep, GN; Cvirkaite-Krupovic, V; Rich-New, ST; Kreutzberger, MAB; Egelman, EH; Krupovic, M; Wang, F (2024). "Dos estructuras de pili arqueales de tipo IV distintas formadas por proteínas con secuencia idéntica". Nature Communications . 15 (1): 5049. doi :10.1038/s41467-024-45062-z. PMC 11178852 . PMID 38877064.
- ^ ab Cookson, AL; Cooley, WA; Woodward, MJ (2002), "El papel de las fimbrias tipo 1 y curli de Escherichia coli productora de toxina Shiga en la adherencia a superficies abióticas", Int J Med Microbiol , 292 (3–4): 195–205, doi :10.1078/1438-4221-00203, PMID 12398210.
- ^ Kolenda, Rafal; Ugorski, Maciej; Grzymajlo, Krzysztof (14 de mayo de 2019). "Todo lo que siempre quiso saber sobre las fimbrias de Salmonella tipo 1, pero tenía miedo de preguntar". Frontiers in Microbiology . 10 : 1017. doi : 10.3389/fmicb.2019.01017 . PMC 6527747 . PMID 31139165.
- ^ Rice JC, Peng T, Spence JS, Wang HQ, Goldblum RM, Corthésy B, Nowicki BJ (diciembre de 2005). "Escherichia coli pielonefrítica que expresa fimbrias P disminuye la respuesta inmunitaria del riñón del ratón". Journal of the American Society of Nephrology . 16 (12): 3583–91. doi : 10.1681/ASN.2005030243 . PMID 16236807.
- ^ WI, Kenneth Todar, Madison. "Colonización e invasión de patógenos bacterianos". www.textbookofbacteriology.net . Consultado el 3 de diciembre de 2016 .
{{cite web}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ abc Epstein, EA; Reizian, MA; Chapman, MR (2009), "La agrupación espacial de la lipoproteína de secreción de curlin requiere el ensamblaje de fibras de curli.", J Bacteriol , 191 (2): 608–615, doi : 10.1128/JB.01244-08, PMC 2620823 , PMID 19011034.
- ^ abcde Craig, Lisa; Taylor, Ronald (2014). "Capítulo 1: El pili corregulado por la toxina de Vibrio cholerae: estructura, ensamblaje y función con implicaciones para el diseño de vacunas". En Barocchi, Michèle; Telford, John (eds.). Pili bacteriano: estructura, síntesis y función en la enfermedad . CAB International. págs. 1–16. ISBN 978-1-78064-255-0.
- ^ Rinaudo, Daniela; Moschioni, Monica (2014). "Capítulo 13: Desarrollo de vacunas basadas en pili en estreptococos: variabilidad, diversidad y respuestas inmunológicas". En Barocchi, Michèle; Telford, John (eds.). Pili bacterianos: estructura, síntesis y función en la enfermedad . CAB International. págs. 182–202. ISBN 978-1-78064-255-0.
- ^ Todar, Kenneth. "Textbook of Bacteriology: Bacterial Structure in Relationship to Pathogenicity". Textbook of Bacteriology . Consultado el 24 de noviembre de 2017 .
- ^ abc Georgiadou, Michaella; Pelicic, Vladimir (2014). "Capítulo 5: Pili tipo IV: funciones y biogénesis". En Barocchi, Michèle; Telford, John (eds.). Pili bacterianos: estructura, síntesis y función en la enfermedad . CAB International. págs. 71–84. ISBN 978-1-78064-255-0.
- ^ Connell I, Agace W, Klemm P, Schembri M, Mărild S, Svanborg C (septiembre de 1996). "La expresión fimbrial de tipo 1 mejora la virulencia de Escherichia coli en el tracto urinario". Proc. Natl. Sci. EE. UU . . 93 (18): 9827–32. Bibcode :1996PNAS...93.9827C. doi : 10.1073/pnas.93.18.9827 . PMC 38514 . PMID 8790416.
Enlaces externos
- Sex+Pilus en los encabezamientos de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Bacterial+Pilus en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Fimbrias + proteínas en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
