Serina proteasa
| Serina proteasa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estructura cristalina de la quimotripsina bovina. Los residuos catalíticos se muestran como barras amarillas. Imagen obtenida de PDB 1CBW. | |||||||||
| Identificadores | |||||||||
| N.º CE | 3.4.21.- | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista de IntEnz | ||||||||
| BRENDA | Entrada de BRENDA | ||||||||
| Expasí | Vista de NiceZyme | ||||||||
| BARRIL | Entrada de KEGG | ||||||||
| MetaCiclo | vía metabólica | ||||||||
| PRIAMO | perfil | ||||||||
| Estructuras del PDB | RCSB AP APBE APSUMA | ||||||||
| |||||||||
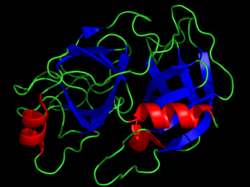
Las serina proteasas (o serina endopeptidasas ) son enzimas que rompen los enlaces peptídicos en las proteínas . La serina actúa como aminoácido nucleofílico en el sitio activo de la enzima . [1] Se encuentran en todas partes, tanto en eucariotas como en procariotas . Las serina proteasas se dividen en dos grandes categorías según su estructura: similares a la quimotripsina (similares a la tripsina) o similares a la subtilisina . [2]
Clasificación
El sistema de clasificación de proteasas MEROPS cuenta con 16 superfamilias (a partir de 2013), cada una de las cuales contiene muchas familias . Cada superfamilia utiliza la tríada o díada catalítica en un pliegue proteico diferente y, por lo tanto, representa una evolución convergente del mecanismo catalítico . La mayoría pertenece a la familia S1 del clan PA (superfamilia) de proteasas.
Para las superfamilias , P: superfamilia, que contiene una mezcla de familias de clases de nucleófilos , S: serina proteasas puras. Dentro de cada superfamilia, las familias se designan por su nucleófilo catalítico, (S: serina proteasas).

| Superfamilia | Familias | Ejemplos |
|---|---|---|
| SB | S8, S53 | Subtilisina ( Bacillus licheniformis ) |
| CAROLINA DEL SUR | S9, S10, S15, S28, S33, S37 | Prolil oligopeptidasa ( Sus scrofa ) |
| ES | Temporada 11, temporada 12, temporada 13 | D-Ala-D-Ala peptidasa C ( Escherichia coli ) |
| SF | S24, S26 | Peptidasa señal I ( Escherichia coli ) |
| EL | S21, S73, S77, S78, S80 | Ensamblina del citomegalovirus ( herpesvirus humano 5) |
| SJ | S16, S50, S69 | Peptidasa Lon-A ( Escherichia coli ) |
| es | S14, S41, S49 | Proteasa Clp ( Escherichia coli ) |
| ENTONCES | S74 | Proteína de autoescisión CIMCD de la endosialidasa del fago K1F (fago K1F de Enterobacteria) |
| ES | S59 | Nucleoporina 145 ( Homo sapiens ) |
| SR | S60 | Lactoferrina ( Homo sapiens ) |
| Espartano | S66 | Tetrapeptidasa de mureína LD-carboxipeptidasa ( Pseudomonas aeruginosa ) |
| CALLE | S54 | Romboide -1 ( Drosophila melanogaster ) |
| Pensilvania | S1, S3, S6, S7, S29, S30, S31, S32, S39, S46, S55, S64, S65, S75 | Quimotripsina A ( Bos taurus ) |
| Pb | S45, S63 | Precursor de la penicilina G acilasa ( Escherichia coli ) |
| ordenador personal | S51 | Dipeptidasa E ( Escherichia coli ) |
| Educación Física | P1 | DmpA aminopeptidasa ( Brucella anthropi ) |
| Ninguno | S48, S62, S68, S71, S72, S79, S81 |
Especificidad del sustrato
Las serina proteasas se caracterizan por una estructura distintiva, que consta de dos dominios de barril beta que convergen en el sitio activo catalítico. Estas enzimas se pueden clasificar además en función de su especificidad de sustrato como similares a la tripsina, similares a la quimotripsina o similares a la elastasa. [5]
Similar a la tripsina
Las proteasas similares a la tripsina rompen los enlaces peptídicos que siguen a un aminoácido con carga positiva ( lisina o arginina ). [6] Esta especificidad está impulsada por el residuo que se encuentra en la base del bolsillo S1 de la enzima (generalmente un ácido aspártico o ácido glutámico con carga negativa ).
Similar a la quimotripsina
El bolsillo S1 de las enzimas similares a la quimotripsina es más hidrófobo que el de las proteasas similares a la tripsina. Esto da como resultado una especificidad para residuos hidrófobos de tamaño mediano a grande, como la tirosina , la fenilalanina y el triptófano .
Similar a la trombina
Entre ellos se encuentran la trombina , el plasminógeno activador de tejidos y la plasmina . Se ha descubierto que desempeñan funciones en la coagulación y la digestión, así como en la fisiopatología de trastornos neurodegenerativos como la demencia inducida por el Alzheimer y el Parkinson. En los venenos de serpiente se encuentran muchas isoformas de serina proteasas similares a la trombina altamente tóxicas. [7]
Similar a la elastasa
Las proteasas similares a la elastasa tienen una hendidura S1 mucho más pequeña que las proteasas similares a la tripsina o la quimotripsina. En consecuencia, tienden a preferirse residuos como la alanina , la glicina y la valina .
Similar a la subtilisina
La subtilisina es una proteasa de serina en procariotas . La subtilisina no está relacionada evolutivamente con el clan de la quimotripsina, pero comparte el mismo mecanismo catalítico que utiliza una tríada catalítica para crear una serina nucleófila . Este es el ejemplo clásico utilizado para ilustrar la evolución convergente , ya que el mismo mecanismo evolucionó dos veces de forma independiente durante la evolución .
Mecanismo catalítico
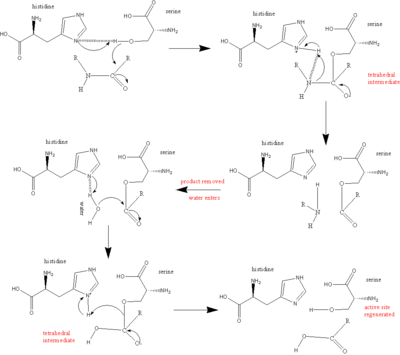
El principal actor en el mecanismo catalítico de las serina proteasas es la tríada catalítica. La tríada se encuentra en el sitio activo de la enzima, donde ocurre la catálisis, y se conserva en todas las superfamilias de enzimas serina proteasas. La tríada es una estructura coordinada que consta de tres aminoácidos : His 57, Ser 195 (de ahí el nombre "serina proteasa") y Asp 102. Estos tres aminoácidos clave desempeñan un papel esencial en la capacidad de escisión de las proteasas. Si bien los aminoácidos miembros de la tríada se encuentran lejos unos de otros en la secuencia de la proteína, debido al plegamiento, estarán muy cerca unos de otros en el corazón de la enzima. La geometría particular de los miembros de la tríada es muy característica de su función específica: se demostró que la posición de solo cuatro puntos de la tríada caracteriza la función de la enzima que los contiene. [8]
En el caso de la catálisis, se produce un mecanismo ordenado en el que se generan varios intermediarios. La catálisis de la escisión del péptido puede verse como una catálisis de ping-pong , en la que se une un sustrato (en este caso, el polipéptido que se está escindiendo), se libera un producto (la "mitad" del extremo C del péptido con el grupo amino visible), se une otro sustrato (en este caso, agua) y se libera otro producto (la "mitad" del extremo N del péptido con el grupo carboxilo visible).
Cada aminoácido de la tríada realiza una tarea específica en este proceso:
- La serina tiene un grupo -OH que es capaz de actuar como nucleófilo , atacando el carbono carbonilo del enlace peptídico escindible del sustrato.
- Un par de electrones en el nitrógeno de la histidina tiene la capacidad de aceptar el hidrógeno del grupo -OH de la serina , coordinando así el ataque del enlace peptídico .
- El grupo carboxilo del ácido aspártico a su vez forma enlaces de hidrógeno con la histidina , haciendo que el átomo de nitrógeno mencionado anteriormente sea mucho más electronegativo .
La reacción completa se puede resumir de la siguiente manera:
- El sustrato polipeptídico se une a la superficie de la enzima serina proteasa de tal manera que el enlace escindible se inserta en el sitio activo de la enzima, con el carbono carbonilo de este enlace posicionado cerca de la serina nucleófila .
- El -OH de la serina ataca al carbono carbonílico y el nitrógeno de la histidina acepta el hidrógeno del -OH de la [serina] y un par de electrones del doble enlace del oxígeno del carbonilo se desplazan hacia el oxígeno. Como resultado, se genera un intermediario tetraédrico.
- El enlace que une el nitrógeno y el carbono en el enlace peptídico ahora está roto. Los electrones covalentes que crean este enlace se mueven para atacar el hidrógeno de la histidina , rompiendo la conexión. Los electrones que previamente se movieron desde el doble enlace de oxígeno del carbonilo se mueven de nuevo desde el oxígeno negativo para recrear el enlace, generando un intermediario acil-enzima.
- Ahora, el agua entra en la reacción. El agua reemplaza el extremo N del péptido escindido y ataca el carbono carbonílico . Una vez más, los electrones del doble enlace se mueven hacia el oxígeno, lo que lo hace negativo, ya que se forma el enlace entre el oxígeno del agua y el carbono. Esto está coordinado por el nitrógeno de la histidina , que acepta un protón del agua. En general, esto genera otro intermediario tetraédrico.
- En una reacción final, el enlace formado en el primer paso entre la serina y el carbono carbonílico se mueve para atacar al hidrógeno que la histidina acaba de adquirir. El carbono carbonílico, ahora deficiente en electrones, vuelve a formar el doble enlace con el oxígeno. Como resultado, el extremo C del péptido queda expulsado.
Efectos estabilizadores adicionales
Se descubrió que aminoácidos adicionales de la proteasa, Gly 193 y Ser 195 , están involucrados en la creación de lo que se llama un agujero de oxianión . Tanto Gly 193 como Ser 195 pueden donar hidrógenos de la cadena principal para la formación de puentes de hidrógeno. Cuando se genera el intermedio tetraédrico del paso 1 y el paso 3, el ion de oxígeno negativo, habiendo aceptado los electrones del doble enlace carbonílico , encaja perfectamente en el agujero de oxianión. En efecto, las serina proteasas se unen preferentemente al estado de transición y se favorece la estructura general, lo que reduce la energía de activación de la reacción. Esta "unión preferencial" es responsable de gran parte de la eficiencia catalítica de la enzima.
Regulación de la actividad de la serina proteasa
Los organismos hospedadores deben garantizar que la actividad de las serina proteasas esté adecuadamente regulada, lo que se logra mediante la activación inicial de las proteasas y la secreción de inhibidores.
Activación del zimógeno
Los zimógenos son los precursores normalmente inactivos de una enzima. Si las enzimas digestivas estuvieran activas cuando se sintetizan, comenzarían inmediatamente a devorar los órganos y tejidos que las sintetizan. La pancreatitis aguda es una afección en la que se produce una activación prematura de las enzimas digestivas en el páncreas, lo que da lugar a una autodigestión (autólisis). También complica las investigaciones post mortem , ya que el páncreas a menudo se digiere a sí mismo antes de que pueda evaluarse visualmente.
Los zimógenos son estructuras grandes e inactivas que tienen la capacidad de desintegrarse o transformarse en enzimas activadas más pequeñas. La diferencia entre los zimógenos y las enzimas activadas radica en que el sitio activo para la catálisis de los zimógenos está distorsionado. Como resultado, el polipéptido sustrato no puede unirse de manera efectiva y no se produce la proteólisis . Solo después de la activación, durante la cual la conformación y la estructura del zimógeno cambian y el sitio activo se abre, puede ocurrir la proteólisis .
| Zimógeno | Enzima | Notas |
|---|---|---|
| Tripsinógeno | tripsina | Cuando el tripsinógeno ingresa al intestino delgado desde el páncreas, las secreciones de enteropeptidasa de la mucosa duodenal escinden el enlace peptídico lisina 15-isoleucina 16 del zimógeno. Como resultado, el zimógeno tripsinógeno se descompone en tripsina. Recordemos que la tripsina también es responsable de escindir los enlaces peptídicos de lisina y, por lo tanto, una vez que se genera una pequeña cantidad de tripsina, participa en la escisión de su propio zimógeno, generando aún más tripsina. El proceso de activación de la tripsina puede, por lo tanto, llamarse autocatalítico . |
| Quimotripsinógeno | quimotripsina | Después de que el enlace Arg 15 - Ile 16 en el zimógeno quimotripsinógeno es escindido por la tripsina, la estructura recién generada llamada pi-quimotripsina sufre autólisis (autodigestión), produciendo quimotripsina activa. |
| Proelastasa | elastasa | Se activa por escisión a través de la tripsina. |
Como se puede observar, la activación del tripsinógeno a tripsina es esencial, ya que activa su propia reacción, así como la reacción tanto de la quimotripsina como de la elastasa . Por lo tanto, es esencial que esta activación no se produzca de forma prematura. Existen varias medidas de protección que toma el organismo para evitar la autodigestión:
- La activación del tripsinógeno por la tripsina es relativamente lenta.
- Los zimógenos se almacenan en gránulos de zimógeno, cápsulas que tienen paredes que se cree que son resistentes a la proteólisis.
Inhibición
Existen ciertos inhibidores que se asemejan al intermediario tetraédrico y, por lo tanto, llenan el sitio activo, impidiendo que la enzima funcione correctamente. La tripsina, una enzima digestiva potente, se genera en el páncreas. Los inhibidores impiden la autodigestión del páncreas.
Las serina proteasas se combinan con inhibidores de serina proteasas , que desactivan su actividad cuando ya no son necesarios. [9] [ fuente autopublicada ? ]
Las serina proteasas son inhibidas por un grupo diverso de inhibidores , incluidos inhibidores químicos sintéticos con fines de investigación o terapéuticos, y también inhibidores proteínicos naturales. Una familia de inhibidores naturales llamados "serpinas" (abreviatura de inhibidores de serina proteasa ) pueden formar un enlace covalente con la serina proteasa, inhibiendo su función. Las serpinas mejor estudiadas son la antitrombina y la alfa 1-antitripsina , estudiadas por su papel en la coagulación / trombosis y enfisema / A1AT , respectivamente. Los inhibidores artificiales irreversibles de moléculas pequeñas incluyen AEBSF y PMSF .
Se ha identificado una familia de inhibidores de la serina peptidasa de los artrópodos , llamada pacifastina , en langostas y cangrejos de río , y puede funcionar en el sistema inmunológico de los artrópodos . [10]
Papel en la enfermedad
Las mutaciones pueden provocar una disminución o un aumento de la actividad de las enzimas. Esto puede tener diferentes consecuencias, dependiendo del funcionamiento normal de la serina proteasa. Por ejemplo, las mutaciones en la proteína C pueden provocar una deficiencia de proteína C y predisponer a la trombosis . Además, algunas proteasas desempeñan un papel vital en la activación de la fusión entre la célula huésped y el virus al preparar la proteína Spike del virus para que muestre la proteína denominada "proteína de fusión" ( TMPRSS2 activa la fusión del SARS-CoV-2 ). Las serina proteasas exógenas del veneno de serpiente causan una amplia gama de coagulopatías cuando se inyectan en un huésped debido a la falta de regulación de su actividad. [7]
Uso diagnóstico
La determinación de los niveles de serina proteasa puede ser útil en el contexto de enfermedades particulares.
- Los niveles de factores de coagulación pueden ser necesarios en el diagnóstico de afecciones hemorrágicas o trombóticas.
- La elastasa fecal se utiliza para determinar la actividad exocrina del páncreas, por ejemplo, en la fibrosis quística o la pancreatitis crónica .
- El antígeno prostático específico sérico se utiliza en la detección del cáncer de próstata , la estratificación del riesgo y el seguimiento posterior al tratamiento.
- La serina proteasa, liberada por los mastocitos , es un marcador diagnóstico importante para las reacciones de hipersensibilidad de tipo 1 , por ejemplo, la anafilaxia . Es más útil que la histamina debido a su vida media más larga , lo que significa que permanece en el sistema durante un período de tiempo clínicamente útil.
Efecto antimicrobiano
Debido a su actividad catalítica, algunas proteasas de serina poseen potentes propiedades antimicrobianas. Varios estudios in vitro han demostrado la eficacia de algunas proteasas para reducir la virulencia al escindir las proteínas de superficie virales. La entrada viral en las células huésped está mediada por la interacción de estas proteínas de superficie con la célula huésped. Cuando estas proteínas se fragmentan o se inactivan en la superficie viral, la entrada viral se ve afectada, lo que conduce a una reducción de la infectividad de un amplio espectro de microorganismos patológicamente relevantes como la influenza , hRSV y otros. [11] [12]
Véase también
- Serina hidrolasa
- Proteasa
- Clan de PA
- Evolución convergente
- Proteólisis
- Tríada catalítica
- El mapa de la proteólisis
- Proteasas en la angiogénesis
- Proteasas intramembrana
- Inhibidor de la proteasa (farmacología)
- Inhibidor de la proteasa (biología)
- TopFIND : base de datos sobre especificidad de proteasas, sustratos, productos e inhibidores
- MEROPS - Base de datos de grupos evolutivos de proteasas
- Queratinasa
- Subtilisina
- Proteinasa K
Referencias
- ^ Hedstrom L (diciembre de 2002). "Mecanismo y especificidad de la serina proteasa". Chemical Reviews . 102 (12): 4501–4524. doi :10.1021/cr000033x. PMID 12475199.
- ^ Madala PK, Tyndall JD, Nall T, Fairlie DP (junio de 2010). "Actualización 1 de: Las proteasas reconocen universalmente las cadenas beta en sus sitios activos". Chemical Reviews . 110 (6): PR1–P31. doi :10.1021/cr900368a. PMID 20377171.
- ^ Khade PM, Kumar A, Jernigan RL (enero de 2020). "Caracterización y predicción de las bisagras de proteínas para obtener información mecanicista". Revista de biología molecular . 432 (2): 508–522. doi :10.1016/j.jmb.2019.11.018. PMC 7029793 . PMID 31786268.
- ^ Khade PM, Scaramozzino D, Kumar A, Lacidogna G, Carpinteri A, Jernigan RL (noviembre de 2021). "hdANM: un nuevo modelo dinámico integral para bisagras de proteínas". Revista Biofísica . 120 (22): 4955–4965. Código Bib : 2021BpJ...120.4955K. doi :10.1016/j.bpj.2021.10.017. PMC 8633836 . PMID 34687719.
- ^ Ovaere P, Lippens S, Vandenabeele P, Declercq W (septiembre de 2009). "Los roles emergentes de las cascadas de serina proteasas en la epidermis". Tendencias en ciencias bioquímicas . 34 (9): 453–463. doi :10.1016/j.tibs.2009.08.001. PMID 19726197.
- ^ Evnin LB, Vásquez JR, Craik CS (septiembre de 1990). "Investigación de la especificidad del sustrato de la tripsina mediante selección genética". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 87 (17): 6659–6663. Bibcode :1990PNAS...87.6659E. doi : 10.1073/pnas.87.17.6659 . JSTOR 2355359. PMC 54596 . PMID 2204062.
- ^ ab Oliveira AL, Viegas MF, da Silva SL, Soares AM, Ramos MJ, Fernandes PA (10 de junio de 2022). "La química del veneno de serpiente y su potencial medicinal". Nature Reviews. Química . 6 (7): 451–469. doi :10.1038/s41570-022-00393-7. PMC 9185726. PMID 35702592 .
- ^ Iván G, Szabadka Z, Ordög R, Grolmusz V, Náray-Szabó G (junio de 2009). "Cuatro puntos espaciales que definen las familias de enzimas". Comunicaciones de investigación bioquímica y biofísica . 383 (4): 417–420. CiteSeerX 10.1.1.150.1086 . doi :10.1016/j.bbrc.2009.04.022. PMID 19364497.
- ^ "Páginas de biología de Kimball, proteasas de serina". Archivado desde el original el 13 de diciembre de 2005. Consultado el 2 de junio de 2008 .
- ^ Breugelmans B, Simonet G, van Hoef V, Van Soest S, Vanden Broeck J (marzo de 2009). "Péptidos relacionados con la pacifastina: características estructurales y funcionales de una familia de inhibidores de la serina peptidasa". Péptidos . 30 (3): 622–632. doi :10.1016/j.peptides.2008.07.026. PMID 18775459. S2CID 8797134.
- ^ Lopes BR, da Silva GS, de Lima Menezes G, de Oliveira J, Watanabe AS, Porto BN, et al. (mayo de 2022). "Las serina proteasas en trampas extracelulares de neutrófilos exhiben actividad anti-virus respiratorio sincitial". Inmunofarmacología internacional . 106 : 108573. doi :10.1016/j.intimp.2022.108573. PMID 35183035.
- ^ Sakai K, Ami Y, Tahara M, Kubota T, Anraku M, Abe M, et al. (mayo de 2014). Dermody TS (ed.). "La proteasa del huésped TMPRSS2 desempeña un papel importante en la replicación in vivo de los virus emergentes H7N9 y de la gripe estacional". Journal of Virology . 88 (10): 5608–5616. doi :10.1128/JVI.03677-13. PMC 4019123 . PMID 24600012.
Enlaces externos
- La base de datos en línea MEROPS para peptidasas y sus inhibidores: Serina Peptidasa Archivado el 4 de abril de 2017 en Wayback Machine.
- Sitio de serina proteasas en la Universidad de Saint Louis (SLU)
- Serina+proteasas en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
