Subtilisina
| Peptidasa S8, relacionada con la subtilisina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
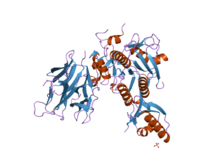 S8 + I9 (abajo a la derecha), Bacillus subtilis ( PDB : 2pmw ) | |||||||||
| Identificadores | |||||||||
| Símbolo | Peptidasa_S8 | ||||||||
| Pfam | PF00082 | ||||||||
| Interprofesional | IPR015500 | ||||||||
| PROSITIO | PDOC00125 | ||||||||
| CATÉTERO | 1cse | ||||||||
| SCOP2 | 1cse / ALCANCE / SUPFAM | ||||||||
| Diligenciamiento de conflictos | cd07477 | ||||||||
| |||||||||
| Subtilisina BPN | |||||||
|---|---|---|---|---|---|---|---|
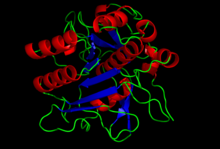 Estructura cristalina del dominio S8 de la subtilisina. [1] | |||||||
| Identificadores | |||||||
| Organismo | |||||||
| Símbolo | abr | ||||||
| Número CAS | 9014-01-1 | ||||||
| Entre | 5712479 | ||||||
| AP | 1st2 Más estructuras | ||||||
| Protección unificada | P00782 | ||||||
| Otros datos | |||||||
| Número CE | 3.4.21.62 | ||||||
| |||||||
| IR:0004252 | |||||||
La subtilisina es una proteasa (una enzima que digiere proteínas ) obtenida inicialmente de Bacillus subtilis . [2] [3] [4] [5] [6] [7] [8]
Las subtilisinas pertenecen a las subtilasas , un grupo de serina proteasas que, como todas las serina proteasas, inician el ataque nucleofílico sobre el enlace peptídico (amida) a través de un residuo de serina en el sitio activo . Las subtilisinas suelen tener pesos moleculares de 27 kDa. Se pueden obtener de ciertos tipos de bacterias del suelo , por ejemplo, Bacillus amyloliquefaciens, de la que se secretan en grandes cantidades.
Nomenclatura
"Subtilisina" no se refiere a una sola proteína, sino a un clado completo de subtilasas que contienen las subtilisinas clásicas. El clado se puede dividir en cuatro grupos: "subtilisinas verdaderas" (que contienen los miembros clásicos), "subtilisinas de alta alcalinidad", "subtilisinas intracelulares" y "subtilisinas filogenéticamente intermedias" (PIS). [9] [10] Las subtilisinas notables incluyen:
| Familia | Organismo | Uniprot | Nombres | Notas |
|---|---|---|---|---|
| Verdadero | B. licheniformis | P00780 | Subtilisina Carlsberg, Alcalase ( Novozymes ), Maxatase (?) "subtilisina DY" (mutante de rayos X) [11] | Endopeptidasa de serina tipo MEROPS de la familia S8. |
| ? | B. licheniformis | ? | Endocut-02L (Tailorzyme ApS) | |
| ? | ? | ? | bioprasa , bioprasa AL | |
| ? | Lederbergia lenta | Esperasa (Novozymes) | Estructura determinada, pero no encontrada en PDB. [12] | |
| Altamente alcalino | Lederbergia lenta | P29600 | Subtilisina Savinasa, Savinasa (Novozymes) | PDB : 1SVN [ 13] |
| Verdadero | B. amyloliquefaciens | P00782 | Subtilisina BPN', Alcalasa (Novozymes) | |
| ? | Geobacillus stearothermophilus | P29142 | Subtilisina J, termoasa (Amano) | [14] |
Otros nombres no comerciales incluyen enzima ALK , bacilopeptidasa , proteinasa alcalina de Bacillus subtilis , colistinasa , genenasa I , proteasa XXVII , subtilopeptidasa , kazusasa , proteasa VIII , proteína A 3L , proteasa S.
Otros nombres comerciales con identidades moleculares no identificadas incluyen SP 266 , orientase 10B (HBI Enzymes), Progress (Novozyme), Liquanase (Novozyme).
Estructura
La estructura de la subtilisina se ha determinado mediante cristalografía de rayos X. La forma madura es una proteína globular de 275 residuos con varias hélices alfa y una gran lámina beta . El extremo N-terminal contiene un dominio propéptido I9 ( InterPro : IPR010259 ) que ayuda al plegamiento de la subtilisina. La eliminación proteolítica del dominio activa la enzima. No está relacionada estructuralmente con el clan quimotripsina de las serina proteasas, pero utiliza el mismo tipo de tríada catalítica en el sitio activo . Esto la convierte en un ejemplo clásico de evolución convergente .
Mecanismo de catálisis
El sitio activo presenta una red de relé de carga que involucra Asp-32, His-64 y el sitio activo Ser-221 dispuestos en una tríada catalítica . La red de relé de carga funciona de la siguiente manera: la cadena lateral carboxilato de Asp-32 se une mediante enlaces de hidrógeno a un protón unido a nitrógeno en el anillo de imidazol de His-64 . Esto es posible porque Asp está cargado negativamente a pH fisiológico . El otro nitrógeno en His-64 se une mediante enlaces de hidrógeno al protón OH de Ser-221. Esta última interacción da como resultado la separación de carga de OH, con el átomo de oxígeno siendo más nucleófilo. Esto permite que el átomo de oxígeno de Ser-221 ataque los sustratos entrantes (es decir, enlaces peptídicos), asistido por una cadena lateral carboxiamida vecina de Asn-155.
Aunque Asp-32, His-64 y Ser-221 están secuencialmente alejados, convergen en la estructura 3D para formar el sitio activo.
Para resumir las interacciones descritas anteriormente, la Ser-221 actúa como un nucleófilo y rompe los enlaces peptídicos con su átomo de oxígeno parcialmente negativo. Esto es posible debido a la naturaleza del sitio de relevo de carga de la subtilisina.
Aplicaciones
Herramienta de investigación
En biología molecular, utilizando B. subtilis como organismo modelo , el gen que codifica la subtilisina ( aprE ) es a menudo el segundo gen de elección después de amyE para integrar construcciones de reporteros, debido a su prescindibilidad.
Comercial
Las subtilisinas modificadas mediante ingeniería proteica se utilizan ampliamente en productos comerciales (la enzima nativa se inactiva fácilmente con detergentes y altas temperaturas) y también se las denomina cortamanchas, por ejemplo, en detergentes para ropa [15] y lavavajillas , cosméticos , procesamiento de alimentos , [16] productos para el cuidado de la piel, limpiadores de lentes de contacto y para la investigación en química orgánica sintética .
Seguridad y salud en el trabajo
Las personas pueden estar expuestas a la subtilisina en el lugar de trabajo al inhalarla, tragarla, por contacto con la piel y con los ojos. El Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH) ha establecido un límite de exposición recomendado (REL) de 60 ng/m 3 durante un período de 60 minutos. [17]
La subtilisina puede causar "asma enzimática por detergentes". Las personas sensibles a la subtilisina (Alcalase) suelen ser también alérgicas a la bacteria Bacillus subtilis . [18]
Véase también
Referencias
- ^ PDB : 1st2 ; Bott R, Ultsch M, Kossiakoff A, Graycar T, Katz B, Power S (junio de 1988). "La estructura tridimensional de la subtilisina de Bacillus amyloliquefaciens a 1,8 A y un análisis de las consecuencias estructurales de la inactivación por peróxido". The Journal of Biological Chemistry . 263 (16): 7895–906. doi : 10.1016/S0021-9258(18)68582-5 . PMID 3286644.
- ^ Ottesen M, Svendsen I (1970). Las subtilisinas . Métodos Enzimol. vol. 19. págs. 199-215. doi :10.1016/0076-6879(70)19014-8. ISBN 978-0-12-181881-4.
- ^ Markland FS, Smith EL (1971). "Subtilisinas: estructura primaria, propiedades químicas y físicas". En Boyer PD (ed.). The Enzymes . Vol. 3 (3.ª ed.). Nueva York: Academic Press. págs. 561–608.
- ^ Philipp M, Bender ML (1983). "Cinética de la subtilisina y la tiolsubtilisina". Bioquímica molecular y celular . 51 (1): 5–32. doi :10.1007/bf00215583. PMID 6343835. S2CID 24136200.
- ^ Nedkov P, Oberthür W, Braunitzer G (abril de 1985). "Determinación de la secuencia completa de aminoácidos de la subtilisina DY y su comparación con las estructuras primarias de las subtilisinas BPN', Carlsberg y amylosacchariticus". Química biológica Hoppe-Seyler . 366 (4): 421–30. doi :10.1515/bchm3.1985.366.1.421. PMID 3927935.
- ^ Ikemura H, Takagi H, Inouye M (junio de 1987). "Requisito de prosecuencia para la producción de subtilisina E activa en Escherichia coli". The Journal of Biological Chemistry . 262 (16): 7859–64. doi : 10.1016/S0021-9258(18)47646-6 . PMID 3108260.
- ^ Polgár L (1987). "Estructura y función de las serina proteasas". En Brocklehurst K, Neuberger A (eds.). Enzimas hidrolíticas . Ámsterdam: Elsevier. ISBN 0-444-80886-8.
- ^ Vasantha N, Thompson LD, Rhodes C, Banner C, Nagle J, Filpula D (septiembre de 1984). "Los genes de la proteasa alcalina y la proteasa neutra de Bacillus amyloliquefaciens contienen un gran marco de lectura abierto entre las regiones que codifican la secuencia señal y la proteína madura". Journal of Bacteriology . 159 (3): 811–9. doi :10.1128/JB.159.3.811-819.1984. PMC 215730 . PMID 6090391.
- ^ Falkenberg, Fabian; Rahba, Jade; Fischer, David; Bott, Michael; Bongaerts, Johannes; Siegert, Petra (octubre de 2022). "Caracterización bioquímica de una nueva subtilisina oxidativamente estable, halotolerante y altamente alcalina de Alkalihalobacillus okhensis Kh10-101 T". FEBS Open Bio . 12 (10): 1729–1746. doi :10.1002/2211-5463.13457. PMC 9527586 . PMID 35727859.
- ^ Falkenberg, F; Bott, M; Bongaerts, J; Siegert, P (2022). "Estudio filogenético de la familia de las subtilasas y búsqueda basada en minería de datos de nuevas subtilisinas de Bacillaceae". Frontiers in Microbiology . 13 : 1017978. doi : 10.3389/fmicb.2022.1017978 . PMC 9549277 . PMID 36225363.
- ^ Eschenburg, S; Genov, N; Peters, K; Fittkau, S; Stoeva, S; Wilson, KS; Betzel, C (15 de octubre de 1998). "Estructura cristalina de la subtilisina DY, un mutante aleatorio de la subtilisina Carlsberg". Revista Europea de Bioquímica . 257 (2): 309–18. doi :10.1046/j.1432-1327.1998.2570309.x. PMID 9826175.
- ^ Betzel, C; Klupsch, S; Branner, S; Wilson, KS (1996). Estructuras cristalinas de las proteasas alcalinas savinasa y esperasa de Bacillus lentus . Avances en medicina experimental y biología. Vol. 379. págs. 49–61. doi :10.1007/978-1-4613-0319-0_7. ISBN 978-0-306-45108-9. Número de identificación personal 8796310.
- ^ Betzel, C; Klupsch, S; Papendorf, G; Hastrup, S; Branner, S; Wilson, KS (20 de enero de 1992). "Estructura cristalina de la proteinasa alcalina Savinase de Bacillus lentus a una resolución de 1,4 A". Journal of Molecular Biology . 223 (2): 427–45. doi :10.1016/0022-2836(92)90662-4. PMID 1738156.
- ^ "THERMOASE PC10F de Amano Enzyme USA Co., Ltd. - Alimentos, bebidas y nutrición". www.ulprospector.com .
- ^ "Contenido del detergente para lavado Spar".
- ^ Chaplin M (20 de diciembre de 2004). "Aplicaciones de las proteasas en la industria alimentaria". Universidad South Bank de Londres . Archivado desde el original el 14 de marzo de 2010. Consultado el 3 de marzo de 2015 .
- ^ "Guía de bolsillo de los CDC y NIOSH sobre peligros químicos: subtilisinas". www.cdc.gov . Consultado el 21 de noviembre de 2015 .
- ^ Diccionario médico, de enfermería y de salud afines de Mosby, 14.ª edición, página 557

