Proteasa romboidal
| Romboidal | |||||||||
|---|---|---|---|---|---|---|---|---|---|
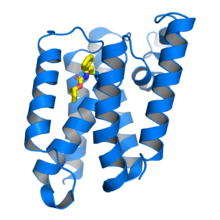 Proteasa romboide GlpG de Escherichia coli en complejo con un inhibidor de beta-lactama (amarillo) unido al residuo de serina catalítica . De PDB : 3ZMH . [1] | |||||||||
| Identificadores | |||||||||
| Símbolo | Romboidal | ||||||||
| Pfam | PF01694 | ||||||||
| Clan Pfam | CL0207 | ||||||||
| Interprofesional | IPR002610 | ||||||||
| MEROPS | S54 | ||||||||
| SCOP2 | 144092 / ALCANCE / SUPFAM | ||||||||
| Superfamilia OPM | 165 | ||||||||
| Proteína OPM | 2ic8 | ||||||||
| |||||||||
Las proteasas romboides son una familia de enzimas que existen en casi todas las especies. Son proteasas : cortan la cadena polipeptídica de otras proteínas. Esta escisión proteolítica es irreversible en las células y un tipo importante de regulación celular. Aunque las proteasas son una de las primeras y mejor estudiadas clases de enzimas, las romboides pertenecen a un tipo descubierto mucho más recientemente: las proteasas intramembrana . Lo que es único acerca de las proteasas intramembrana es que sus sitios activos están enterrados en la bicapa lipídica de las membranas celulares y escinden otras proteínas transmembrana dentro de sus dominios transmembrana . [2] Aproximadamente el 30% de todas las proteínas tienen dominios transmembrana y su procesamiento regulado a menudo tiene importantes consecuencias biológicas. En consecuencia, las romboides regulan muchos procesos celulares importantes y pueden estar involucradas en una amplia gama de enfermedades humanas.
Proteasas intramembrana
Los romboides son serina proteasas intramembrana . [3] [4] [5] [6] : Resumen Los otros tipos de proteasas intramembrana son las aspartil- y metalo-proteasas , respectivamente. Las presenilinas y la familia similar a la peptidasa del péptido señal , que son aspartil proteasas intramembrana, escinden sustratos que incluyen el receptor Notch y la proteína precursora amiloide , que está implicada en la enfermedad de Alzheimer . La familia de proteasas del sitio 2 , que son metaloproteasas intramembrana, regulan entre otras cosas la biosíntesis del colesterol y las respuestas al estrés en las bacterias . Las diferentes familias de proteasas intramembrana no están relacionadas evolutiva y mecanísticamente, pero hay temas funcionales comunes claros que las vinculan. Los romboides son quizás la clase mejor caracterizada.
Historia
Los romboides recibieron su nombre por primera vez a raíz de una mutación en la mosca de la fruta Drosophila , descubierta en un famoso análisis genético que condujo a un Premio Nobel para Christiane Nüsslein-Volhard y Eric Wieschaus . [7] En ese análisis encontraron una serie de mutantes con fenotipos similares: esqueletos de cabeza embrionarios "puntiagudos". [6] : 192 Los nombraron a cada uno con un nombre con temática puntiaguda: uno era romboide. Al principio, esto se notó porque una mutación interrumpió el desarrollo, [8] : 237 El análisis genético demostró más tarde que este grupo de genes eran miembros de la vía de señalización del receptor del factor de crecimiento epidérmico (EGF) , [9] [10] [6] : 192 [8] : resumen, 239 y que el romboide era necesario para generar la señal que activa el receptor de EGF. [11] [12] [6] : 192 La función molecular del romboide tardó un poco más en desentrañar, pero una combinación de genética y técnicas moleculares condujo al descubrimiento de que el romboide de Drosophila [6] : 192, Fig 1 y otros miembros de la familia fueron las primeras serina proteasas intramembrana conocidas. [3]
Función
Los romboides se descubrieron por primera vez como proteasas que regulan la señalización del receptor de EGF en Drosophila . Al liberar el dominio extracelular del factor de crecimiento Spitz, de su precursor transmembrana, el romboides desencadena la señalización. [3] Desde entonces, se han propuesto muchas otras funciones biológicas importantes. [6] : 196 [13]
- Más tarde, se demostró que el Rhomboid-1 de Drosophilas regula el sueño, a través de una nueva función de un mecanismo ya descubierto. [6] : 201–2
- Aunque menos establecido que en Drosophila , hay alguna evidencia de que los romboides pueden participar en la señalización del factor de crecimiento en mamíferos, incluidos los humanos. [14] [8] : 240, Proteasas romboides de mamíferos También se han implicado en la señalización de efrina , [15] la escisión de la proteína anticoagulante trombomodulina [16] y la cicatrización de heridas . [17]
- Todos los eucariotas tienen un romboide mitocondrial . En la levadura, se ha demostrado que esto controla la función y la morfología mitocondrial al regular la fusión de la membrana a través de la escisión de una GTPasa similar a la dinamina llamada Mgm1p, el ortólogo de OPA1 humana . [18] [19] En Drosophila , el romboide mitocondrial (Rhomboid-7) [8] : 240–1, Mitochondrial Rhomboids también regula la fusión de la membrana mitocondrial. [20] Opa1 y Rhomboid-7 de Drosophila parecen tener la misma relación que en la levadura. [6] : 201 También en los mamíferos, la función mitocondrial se altera en mutantes de PARL , el romboide mitocondrial, pero el rango de funciones es más complejo. PARL regula la remodelación de las crestas mitocondriales , [21] está implicado en la muerte celular [21] y el metabolismo , [22] y hay cada vez más evidencia de un papel importante en la enfermedad de Parkinson ; [23] [24] [25]
- Los romboides de los parásitos apicomplejos (incluidos Plasmodium , el agente que causa la malaria , y Toxoplasma ) se utilizan para reposicionarse entre la unión a una célula diana y la entrada, [26] : 582, Figura 1 y la mayoría de las adhesinas producidas por micronemas [27] : 519 son liberadas del micronema por los romboides. [26] : 581 [28] [29] [30] [31] [32] [33] Los romboides también han sido implicados en la patogenicidad de otros parásitos. [34] En Toxoplasma específicamente, algunas serpinas inhiben los romboides. [27] : 519
- En la bacteria Gram negativa Providencia stuartii se requiere un romboide para el funcionamiento de la maquinaria de translocación de proteínas de arginina gemela (TAT). [35]
- Los romboides controlan la señalización del receptor EGF en Caenorhabditis elegans como en Drosophila . [6] : 201
Estructura
Los romboides fueron las primeras proteasas intramembrana para las que se resolvió una estructura cristalina de alta resolución. [36] [37] [38] [39] [40] Estas estructuras confirmaron las predicciones de que los romboides tienen un núcleo de seis dominios transmembrana y que el sitio catalítico depende de una díada catalítica de serina e histidina. Las estructuras también explicaron cómo una reacción proteolítica, que requiere moléculas de agua, puede ocurrir en el entorno hidrofóbico de una bicapa lipídica: uno de los misterios centrales de las proteasas intramembrana. [41] El sitio activo de la proteasa romboide está en una hendidura hidrofílica, en principio accesible al agua de la solución a granel. [36] [37] [38] [39] [40] Sin embargo, se ha propuesto que podría haber un mecanismo auxiliar para facilitar el acceso de las moléculas de agua a la díada catalítica en la parte inferior del sitio activo para garantizar la eficiencia catalítica. [42]
El sitio activo de la proteasa romboide está protegido lateralmente de la bicapa lipídica por sus seis hélices transmembrana constituyentes, lo que sugiere que el acceso del sustrato al sitio activo romboide está regulado. Un área de incertidumbre ha sido la ruta de acceso del sustrato . Inicialmente se propuso que los sustratos ingresaran entre los segmentos transmembrana (TMS) 1 y 3, [36] [39] pero la evidencia actual respalda firmemente un punto de acceso alternativo, entre los TMS 2 y 5. [37] [38] [40] [43] [44] Esta noción también está respaldada por el hecho de que las mutaciones en TMS 5 tienen solo un efecto marginal en la estabilidad termodinámica del romboide, a diferencia de otras regiones de la molécula. [45] Muy recientemente, la primera estructura cocristalina de una proteasa intramembrana [46] – la versión de Escherichia coli de la proteasa romboide GlpG [8] : 239 – y un péptido derivado del sustrato unido al sitio activo [46] confirma y extiende este modelo de acceso al sustrato y proporciona implicaciones para el mecanismo de otras proteínas de la superfamilia romboide. [ cita requerida ] La GlpG de E. coli es inusual por su baja afinidad de unión enzima/sustrato . [8] : 239 Sin embargo, los detalles de cómo un sustrato TMS puede ser reconocido por un romboide aún no están claros. Algunos autores proponen que el acceso al sustrato involucra un gran movimiento de desplazamiento lateral de TMS 5 para abrir el núcleo del romboide. [37] [43] Otros informes sugieren, en cambio, que no se requiere un gran movimiento lateral del TMS 5, [47] y proponen que la superficie de los TMS 2 y 5 sirve más bien como un "exositio intramembrana" que media el reconocimiento del sustrato TMS. [46] [48] El ortólogo romboide en D. suzukii es Dsuz\DS10_00004507. [49]
Especificidad enzimática
Los romboides no escinden todos los dominios transmembrana. De hecho, son altamente específicos, con un número limitado de sustratos. La mayoría de los sustratos romboides naturales conocidos hasta ahora son proteínas de dominio transmembrana único de tipo 1, con sus extremos amino en el compartimento luminal/extracelular. Sin embargo, estudios recientes sugirieron que la proteína de membrana de tipo 2 (es decir, con topología opuesta: el extremo amino es citoplasmático), [50] o incluso las proteínas de membrana de múltiples pasos podrían actuar como sustratos romboides. [51] La especificidad de los romboides subyace a su capacidad para controlar funciones en una amplia gama de procesos biológicos y, a su vez, comprender qué hace que un dominio transmembrana particular se convierta en un sustrato romboide puede arrojar luz sobre la función romboide en diferentes contextos.
Trabajos iniciales indicaron que los romboides reconocen la inestabilidad de la hélice alfa transmembrana en el sitio de escisión como el determinante principal del sustrato. [52] Más recientemente, se ha encontrado que los sustratos romboides se definen por dos elementos separables: el dominio transmembrana y un motivo de secuencia primaria en o inmediatamente adyacente a él. [48] Este motivo de reconocimiento dirige dónde se escinde el sustrato, lo que puede ocurrir dentro o justo afuera del dominio transmembrana, en la región yuxtamembrana. [48] En el primer caso, los residuos desestabilizadores de la hélice aguas abajo en el sustrato TMS también son necesarios para una escisión eficiente. [48] De hecho, un análisis cinético enzimático detallado ha demostrado que las interacciones del motivo de reconocimiento con el sitio activo romboidal determinan la k cat de la escisión del sustrato. [53] Los principios del reconocimiento del sustrato TMS por parte de los romboides siguen siendo poco conocidos, pero numerosas líneas de evidencia indican que los romboides (y quizás también otras proteasas intramembrana ) reconocen de alguna manera la flexibilidad estructural o la dinámica del dominio transmembrana de sus sustratos. [42] [54] La apreciación completa de los principios biofísicos y estructurales involucrados requerirá la caracterización estructural del complejo del romboides con el sustrato transmembrana completo. [55] Como primer paso hacia este objetivo, una estructura cocristalina reciente de la enzima en complejo con un inhibidor basado en mecanismos que contiene péptidos derivados del sustrato explica las preferencias de secuencias de motivos de reconocimiento observadas en los sustratos romboides estructuralmente, y proporciona un avance significativo en la comprensión actual de la especificidad romboidal y el mecanismo de las proteínas de la familia romboidal. [46]
En algunas bacterias Gram-negativas , incluyendo Shewanella y Vibrio , se encuentran hasta trece proteínas con GlyGly-CTERM, un dominio de homología C-terminal que consiste en un motivo rico en glicina, una hélice transmembrana altamente hidrofóbica y un grupo de residuos básicos. Este dominio parece ser la secuencia de reconocimiento para la rombosortasa, una rama de la familia de proteasas romboides limitada solo a aquellas bacterias con el dominio GlyGly-CTERM. [56]
Importancia médica
La diversidad de funciones biológicas que ya se sabe que dependen de los romboides se refleja en la evidencia de que estos desempeñan un papel en una variedad de enfermedades, entre ellas el cáncer , [ cita requerida ] las infecciones parasitarias [13] y la diabetes . [ cita requerida ] Sin embargo, es importante señalar que aún no se ha establecido ningún caso en el que se haya validado por completo un significado médico preciso. [6]
Aún no se han descrito fármacos que modulen la actividad romboide, aunque un estudio reciente ha identificado inhibidores basados en mecanismos de moléculas pequeñas que podrían proporcionar una base para el desarrollo de fármacos en el futuro. [57]
La familia de forma romboidal
Las proteasas romboides parecen estar conservadas en todos los eucariotas y en la gran mayoría de los procariotas . El análisis bioinformático destaca que algunos miembros de la familia romboidal carecen de los residuos de aminoácidos esenciales para la proteólisis, lo que implica que no pueden escindir sustratos. Estas "pseudoproteasas" incluyen una subfamilia que se ha denominado iRhoms [58] (también conocidas como RHBDF1 y RHBDF2 ). Los iRhoms pueden promover la degradación asociada al ER (ERAD) de los ligandos del receptor de EGF en Drosophila , proporcionando así un mecanismo para regular la actividad del receptor de EGF en el cerebro. [59] Esto implica que el mecanismo fundamental de control de calidad celular es explotado por organismos multicelulares para regular la señalización entre células. En ratones, los iRhoms son chaperonas de tráfico clave necesarias para la exportación del ER de ADAM17 /TACE y su maduración. Por lo tanto, los iRhoms son necesarios para la señalización del receptor de TNF-alfa y EGF , lo que los hace muy atractivos desde el punto de vista médico. [59] [60] [61] [62] [63]
El análisis filogenético indica que los romboides son de hecho miembros de una superfamilia o clan más grande de tipo romboidal, que incluye las proteínas derlin , también involucradas en ERAD. [64]
Los cinetoplastos tienen un repertorio familiar romboidal inusualmente pequeño, en Trypanosoma brucei XP 001561764 y XP 001561544, y en T. cruzi XP 805971, XP 802860 y XP 821055. [65]
Varias proteínas de la familia romboidal son vitales para la virulencia y la motilidad de Toxoplasma gondii , incluidas TgMIC2, TgMIC6, varias variantes de AMA1, incluidas TgAMA1, TgROM1, TgROM4 y TgROM5. [66]
Las mitocondrias de los tripanosomas tienen TimRhom I y TimRhom II (dos miembros de la familia romboides con la función proteolítica desactivada) en sus translocasas de presecuencia. La dificultad para encontrar una mayor similitud con parientes eucariotas o bacterianos puede significar que estos llegaron como parte del progenitor mitocondrial original. [67] Los parientes romboides pueden ser proteínas de transporte de membrana en los sistemas ERAD y SELMA. [67] : 105
iRoms
Los iRhoms son proteínas similares a los romboides, pero no son proteasas. Al igual que los romboides, se descubrieron por primera vez en Drosophilae . Sin embargo, a diferencia de los romboides, los iRhoms inhiben la señalización de EGFr. Los ratones knockout para iRhom2 tienen un compromiso inmunológico grave. [8] : 243, iRhoms
Referencias
- ^ Vinothkumar KR, Pierrat OA, Large JM, Freeman M (junio de 2013). "La estructura de la proteasa romboide en complejo con inhibidores de β-lactamas define la cavidad S2'". Estructura . 21 (6): 1051–8. doi : 10.1016/j.str.2013.03.013 . PMC 3690538 . PMID 23665170.
- ^ Brown MS, Ye J, Rawson RB, Goldstein JL (febrero de 2000). "Proteólisis intramembrana regulada: un mecanismo de control conservado desde las bacterias hasta los seres humanos". Cell . 100 (4): 391–8. doi : 10.1016/S0092-8674(00)80675-3 . PMID 10693756. S2CID 12194770.
- ^ abc Urban S, Lee JR, Freeman M (octubre de 2001). "Drosophila rhomboid-1 define una familia de supuestas proteasas de serina intramembrana". Cell . 107 (2): 173–82. doi : 10.1016/s0092-8674(01)00525-6 . PMID 11672525. S2CID 9026083.
- ^ Lemberg MK, Menendez J, Misik A, Garcia M, Koth CM, Freeman M (febrero de 2005). "Mecanismo de proteólisis intramembrana investigado con proteasas romboides purificadas". The EMBO Journal . 24 (3): 464–72. doi :10.1038/sj.emboj.7600537. PMC 548647 . PMID 15616571.
- ^ Urban S, Wolfe MS (febrero de 2005). "La reconstitución de la proteólisis intramembrana in vitro revela que el romboide puro es suficiente para la catálisis y la especificidad". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 102 (6): 1883–8. Bibcode :2005PNAS..102.1883U. doi : 10.1073/pnas.0408306102 . PMC 548546 . PMID 15684070.
- ^ abcdefghij Freeman M (2008). "Proteasas romboides y sus funciones biológicas". Revisión anual de genética . 42 : 191–210. doi :10.1146/annurev.genet.42.110807.091628. PMID 18605900.
- ^ Jürgens G, Wieschaus E, Nüsslein-Volhard C, Kluding H (septiembre de 1984). "Mutaciones que afectan el patrón de la cutícula larvaria en Drosophila melanogaster: II. Loci cigóticos en el tercer cromosoma". Archivos de biología del desarrollo de Wilhelm Roux . 193 (5): 283–295. doi :10.1007/BF00848157. PMID 28305338. S2CID 26608498.
- ^ abcdefg Freeman M (2014). "La superfamilia de tipo romboidal: mecanismos moleculares y funciones biológicas". Revisión anual de biología celular y del desarrollo . 30 : 235–54. doi : 10.1146/annurev-cellbio-100913-012944 . PMID: 25062361. S2CID : 31705365.
- ^ Sturtevant MA, Roark M, Bier E (junio de 1993). "El gen romboide de Drosophila media la formación localizada de las venas de las alas e interactúa genéticamente con los componentes de la vía de señalización del EGF-R". Genes & Development . 7 (6): 961–73. doi : 10.1101/gad.7.6.961 . PMID 8504935.
- ^ Freeman M (octubre de 1994). "El gen spitz es necesario para la determinación de los fotorreceptores en el ojo de Drosophila, donde interactúa con el receptor de EGF". Mecanismos del desarrollo . 48 (1): 25–33. doi :10.1016/0925-4773(94)90003-5. PMID 7833286. S2CID 40396109.
- ^ Wasserman JD, Urban S, Freeman M (julio de 2000). "Una familia de genes de tipo romboidal: el romboide-1 y el rugoso/romboide-3 de Drosophila cooperan para activar la señalización del receptor de EGF". Genes & Development . 14 (13): 1651–63. doi :10.1101/gad.14.13.1651. PMC 316740 . PMID 10887159.
- ^ Bang AG, Kintner C (enero de 2000). "Rhomboid y Star facilitan la presentación y el procesamiento del homólogo Spitz de TGF-alfa de Drosophila". Genes & Development . 14 (2): 177–86. doi :10.1101/gad.14.2.177. PMC 316351 . PMID 10652272.
- ^ ab Urban S (junio de 2009). "Haciendo el corte: roles centrales de la proteólisis intramembrana en microorganismos patógenos". Nature Reviews. Microbiology . 7 (6): 411–23. doi :10.1038/nrmicro2130. PMC 2818034 . PMID 19421188.
- ^ Adrain C, Strisovsky K, Zettl M, Hu L, Lemberg MK, Freeman M (mayo de 2011). "Activación del receptor de EGF en mamíferos por la proteasa romboide RHBDL2". EMBO Reports . 12 (5): 421–7. doi :10.1038/embor.2011.50. PMC 3090019 . PMID 21494248.
- ^ Pascall JC, Brown KD (abril de 2004). "Escisión intramembrana de ephrinB3 por la proteasa de la familia romboidal humana, RHBDL2". Comunicaciones de investigación bioquímica y biofísica . 317 (1): 244–52. doi :10.1016/j.bbrc.2004.03.039. PMID 15047175.
- ^ Lohi O, Urban S, Freeman M (febrero de 2004). "Diversos mecanismos de reconocimiento de sustratos para romboides; la trombomodulina es escindida por romboides de mamíferos". Current Biology . 14 (3): 236–41. doi : 10.1016/j.cub.2004.01.025 . PMID 14761657. S2CID 17760607.
- ^ Cheng TL, Wu YT, Lin HY, Hsu FC, Liu SK, Chang BI, et al. (diciembre de 2011). "Funciones de la proteasa de la familia romboidal RHBDL2 y la trombomodulina en la cicatrización de heridas". The Journal of Investigative Dermatology . 131 (12): 2486–94. doi : 10.1038/jid.2011.230 . PMID 21833011.
- ^ Herlan M, Vogel F, Bornhovd C, Neupert W, Reichert AS (julio de 2003). "El procesamiento de Mgm1 por la proteasa de tipo romboide Pcp1 es necesario para el mantenimiento de la morfología mitocondrial y del ADN mitocondrial". The Journal of Biological Chemistry . 278 (30): 27781–8. doi : 10.1074/jbc.m211311200 . PMID 12707284.
- ^ McQuibban GA, Saurya S, Freeman M (mayo de 2003). "Remodelación de la membrana mitocondrial regulada por una proteasa romboide conservada". Nature . 423 (6939): 537–41. Bibcode :2003Natur.423..537M. doi : 10.1038/nature01633 . PMID 12774122. S2CID 4398146.
- ^ McQuibban GA, Lee JR, Zheng L, Juusola M, Freeman M (mayo de 2006). "La dinámica mitocondrial normal requiere romboide-7 y afecta la longevidad y la función neuronal de Drosophila". Current Biology . 16 (10): 982–9. doi : 10.1016/j.cub.2006.03.062 . PMID 16713954. S2CID 18751418.
- ^ ab Cipolat S, Rudka T, Hartmann D, Costa V, Serneels L, Craessaerts K, et al. (julio de 2006). "La PARL romboidal mitocondrial regula la liberación de citocromo c durante la apoptosis a través de la remodelación de crestas dependiente de OPA1". Cell . 126 (1): 163–75. doi : 10.1016/j.cell.2006.06.021 . PMID 16839884. S2CID 6396519.
- ^ Civitarese AE, MacLean PS, Carling S, Kerr-Bayles L, McMillan RP, Pierce A, et al. (mayo de 2010). "Regulación de la capacidad oxidativa del músculo esquelético y la señalización de insulina por la proteasa romboide mitocondrial PARL". Metabolismo celular . 11 (5): 412–26. doi :10.1016/j.cmet.2010.04.004. PMC 3835349 . PMID 20444421.
- ^ Whitworth AJ, Lee JR, Ho VM, Flick R, Chowdhury R, McQuibban GA (2008). "Rhomboid-7 y HtrA2/Omi actúan en una vía común con los factores de la enfermedad de Parkinson Pink1 y Parkin". Disease Models & Mechanisms . 1 (2–3): 168–74, discusión 173. doi :10.1242/dmm.000109. PMC 2562193 . PMID 19048081.
- ^ Deas E, Plun-Favreau H, Gandhi S, Desmond H, Kjaer S, Loh SH, et al. (marzo de 2011). "Escisión de PINK1 en la posición A103 por la proteasa mitocondrial PARL". Human Molecular Genetics . 20 (5): 867–79. doi :10.1093/hmg/ddq526. PMC 3033179 . PMID 21138942.
- ^ Meissner C, Lorenz H, Weihofen A, Selkoe DJ, Lemberg MK (junio de 2011). "La proteasa intramembrana mitocondrial PARL escinde la proteína Pink1 humana para regular el tráfico de Pink1". Journal of Neurochemistry . 117 (5): 856–67. doi : 10.1111/j.1471-4159.2011.07253.x . PMID 21426348.
- ^ ab Bisio H, Soldati-Favre D (septiembre de 2019). "Cascadas de señalización que rigen la entrada y salida de las células huésped por Toxoplasma gondii". Revisión anual de microbiología . 73 (1). Revisiones anuales : 579–599. doi :10.1146/annurev-micro-020518-120235. PMID 31500539. S2CID 202405949.
- ^ ab McKerrow JH, Caffrey C, Kelly B, Loke P, Sajid M (2006). "Proteasas en enfermedades parasitarias". Revisión anual de patología . 1 (1). Revisiones anuales : 497–536. doi :10.1146/annurev.pathol.1.110304.100151. PMID 18039124.
- ^ Urban S, Freeman M (junio de 2003). "La especificidad del sustrato de las proteasas intramembrana romboides está regida por residuos que rompen la hélice en el dominio transmembrana del sustrato". Molecular Cell . 11 (6): 1425–34. doi : 10.1016/s1097-2765(03)00181-3 . PMID 12820957.
- ^ Baker RP, Wijetilaka R, Urban S (octubre de 2006). "Dos proteasas romboides de Plasmodium escinden preferentemente diferentes adhesinas implicadas en todas las etapas invasivas de la malaria". PLOS Pathogens . 2 (10): e113. doi : 10.1371/journal.ppat.0020113 . PMC 1599764 . PMID 17040128.
- ^ O'Donnell RA, Hackett F, Howell SA, Treeck M, Struck N, Krnajski Z, et al. (septiembre de 2006). "La proteólisis intramembrana media el desprendimiento de una adhesina clave durante la invasión de eritrocitos por el parásito de la malaria". The Journal of Cell Biology . 174 (7): 1023–33. doi :10.1083/jcb.200604136. PMC 2064393 . PMID 17000879.
- ^ Santos JM, Ferguson DJ, Blackman MJ, Soldati-Favre D (enero de 2011). "La escisión intramembrana de AMA1 hace que Toxoplasma pase de un modo invasivo a uno replicativo". Science . 331 (6016): 473–7. Bibcode :2011Sci...331..473S. doi :10.1126/science.1199284. PMID 21205639. S2CID 26806264.
- ^ Srinivasan P, Coppens I, Jacobs-Lorena M (enero de 2009). "Roles distintos de Plasmodium rhomboid 1 en el desarrollo del parásito y la patogénesis de la malaria". PLOS Pathogens . 5 (1): e1000262. doi : 10.1371/journal.ppat.1000262 . PMC 2607553 . PMID 19148267.
- ^ Lin JW, Meireles P, Prudêncio M, Engelmann S, Annoura T, Sajid M, et al. (abril de 2013). "Los análisis de pérdida de función definen funciones vitales y redundantes de la familia de proteasas romboides de Plasmodium". Microbiología molecular . 88 (2): 318–38. doi : 10.1111/mmi.12187 . PMID 23490234.
- ^ Baxt LA, Baker RP, Singh U, Urban S (junio de 2008). "Una proteasa romboide de Entamoeba histolytica con especificidad atípica escinde una lectina de superficie implicada en la fagocitosis y la evasión inmunitaria". Genes & Development . 22 (12): 1636–46. doi :10.1101/gad.1667708. PMC 2428061 . PMID 18559479.
- ^ Stevenson LG, Strisovsky K, Clemmer KM, Bhatt S, Freeman M, Rather PN (enero de 2007). "La proteasa romboide AarA media la detección de quórum en Providencia stuartii activando TatA de la translocasa gemela de arginina". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 104 (3): 1003–8. Código Bib : 2007PNAS..104.1003S. doi : 10.1073/pnas.0608140104 . PMC 1783354 . PMID 17215357.
- ^ abc Wang Y, Zhang Y, Ha Y (noviembre de 2006). "Estructura cristalina de una proteasa intramembrana de la familia romboidal". Nature . 444 (7116): 179–80. Bibcode :2006Natur.444..179W. doi :10.1038/nature05255. PMID 17051161. S2CID 4350345.
- ^ abcd Wu Z, Yan N, Feng L, Oberstein A, Yan H, Baker RP, et al. (diciembre de 2006). "El análisis estructural de una proteasa intramembrana de la familia romboidal revela un mecanismo de activación de la entrada del sustrato". Nature Structural & Molecular Biology . 13 (12): 1084–91. doi :10.1038/nsmb1179. PMID 17099694. S2CID 8308111.
- ^ abc Ben-Shem A, Fass D, Bibi E (enero de 2007). "Base estructural de la proteólisis intramembrana por proteasas de serina romboides". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 104 (2): 462–6. Bibcode :2007PNAS..104..462B. doi : 10.1073/pnas.0609773104 . PMC 1766407 . PMID 17190827.
- ^ abc Lemieux MJ, Fischer SJ, Cherney MM, Bateman KS, James MN (enero de 2007). "La estructura cristalina de la peptidasa romboide de Haemophilus influenzae proporciona información sobre la proteólisis intramembrana". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 104 (3): 750–4. Bibcode :2007PNAS..104..750L. doi : 10.1073/pnas.0609981104 . PMC 1783385 . PMID 17210913.
- ^ abc Vinothkumar KR (marzo de 2011). "Estructura de la proteasa romboide en un entorno lipídico". Journal of Molecular Biology . 407 (2): 232–47. doi :10.1016/j.jmb.2011.01.029. PMC 3093617 . PMID 21256137.
- ^ Lemberg MK, Freeman M (diciembre de 2007). "Proteínas de corte dentro de las bicapas lipídicas: estructura y mecanismo romboidal". Molecular Cell . 28 (6): 930–40. doi : 10.1016/j.molcel.2007.12.003 . PMID 18158892.
- ^ ab Moin SM, Urban S (noviembre de 2012). "La inmersión en la membrana permite que las proteasas romboides logren especificidad mediante la lectura de la dinámica de los segmentos transmembrana". eLife . 1 : e00173. doi : 10.7554/eLife.00173 . PMC 3494066 . PMID 23150798.
- ^ ab Baker RP, Young K, Feng L, Shi Y, Urban S (mayo de 2007). "El análisis enzimático de una proteasa intramembrana romboide implica a la hélice transmembrana 5 como la puerta lateral del sustrato". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 104 (20): 8257–62. doi : 10.1073/pnas.0700814104 . PMC 1895938 . PMID 17463085.
- ^ Wang Y, Maegawa S, Akiyama Y, Ha Y (diciembre de 2007). "El papel del bucle L1 en el mecanismo de la proteasa intramembrana romboide GlpG". Journal of Molecular Biology . 374 (4): 1104–13. doi :10.1016/j.jmb.2007.10.014. PMC 2128867 . PMID 17976648.
- ^ Baker RP, Urban S (septiembre de 2012). "Principios arquitectónicos y termodinámicos subyacentes a la función de la proteasa intramembrana". Nature Chemical Biology . 8 (9): 759–68. doi :10.1038/nchembio.1021. PMC 4028635 . PMID 22797666.
- ^ abcd Zoll S, Stanchev S, Began J, Skerle J, Lepšík M, Peclinovská L, Majer P, Strisovsky K (octubre de 2014). "Unión al sustrato y especificidad de la proteasa intramembrana romboidal revelada por estructuras complejas sustrato-péptido". The EMBO Journal . 33 (20): 2408–21. doi :10.15252/embj.201489367. PMC 4253528 . PMID 25216680.
- ^ Xue Y, Ha Y (junio de 2013). "No se requiere un gran movimiento lateral de la hélice transmembrana S5 para el acceso del sustrato al sitio activo de la proteasa intramembrana romboide". The Journal of Biological Chemistry . 288 (23): 16645–54. doi : 10.1074/jbc.M112.438127 . PMC 3675599 . PMID 23609444.
- ^ abcd Strisovsky K, Sharpe HJ, Freeman M (diciembre de 2009). "Proteólisis intramembrana específica de secuencia: identificación de un motivo de reconocimiento en sustratos romboides". Molecular Cell . 36 (6): 1048–59. doi :10.1016/j.molcel.2009.11.006. PMC 2941825 . PMID 20064469.
- ^ "Informe genético FlyBase: Dmel \ rho". FlyBase . 2021-04-13 . Consultado el 8 de junio de 2021 . Larkin A, Marygold SJ, Antonazzo G, Attrill H, Dos Santos G, Garapati PV, et al. (enero de 2021). "FlyBase: actualizaciones de la base de conocimientos de Drosophila melanogaster". Investigación de ácidos nucleicos . 49 (D1): D899–D907. doi : 10.1093/nar/gkaa1026. PMC 7779046 . PMID 33219682.
- ^ Tsruya R, Wojtalla A, Carmon S, Yogev S, Reich A, Bibi E, et al. (marzo de 2007). "Rhomboid cliva a Star para regular los niveles de Spitz secretado". The EMBO Journal . 26 (5): 1211–20. doi :10.1038/sj.emboj.7601581. PMC 1817629 . PMID 17304216.
- ^ Fleig L, Bergbold N, Sahasrabudhe P, Geiger B, Kaltak L, Lemberg MK (agosto de 2012). "La proteasa romboide intramembrana dependiente de ubiquitina promueve la ERAD de las proteínas de membrana". Célula molecular . 47 (4): 558–69. doi : 10.1016/j.molcel.2012.06.008 . PMID 22795130.
- ^ Akiyama Y, Maegawa S (mayo de 2007). "Características de la secuencia de los sustratos necesarios para la escisión por GlpG, una proteasa romboide de Escherichia coli". Microbiología molecular . 64 (4): 1028–37. doi :10.1111/j.1365-2958.2007.05715.x. PMID 17501925. S2CID 33930463.
- ^ Dickey SW, Baker RP, Cho S, Urban S (diciembre de 2013). "La proteólisis dentro de la membrana es una reacción regida por la velocidad y no impulsada por la afinidad del sustrato". Cell . 155 (6): 1270–81. doi :10.1016/j.cell.2013.10.053. PMC 3917317 . PMID 24315097.
- ^ Langosch D, Scharnagl C, Steiner H, Lemberg MK (junio de 2015). "Comprensión de la proteólisis intramembrana: de la dinámica de proteínas a la cinética de la reacción". Tendencias en ciencias bioquímicas . 40 (6): 318–27. doi :10.1016/j.tibs.2015.04.001. PMID 25941170.
- ^ Strisovsky K (abril de 2013). "Principios estructurales y mecanísticos de la proteólisis intramembrana: lecciones de los romboides". The FEBS Journal . 280 (7): 1579–603. doi :10.1111/febs.12199. PMID 23432912. S2CID 6316872.
- ^ Haft DH, Varghese N (2011). "GlyGly-CTERM y rombosortasa: una señal de procesamiento de proteínas C-terminal en un emparejamiento de muchos a uno con una serina proteasa intramembrana de la familia romboidal". PLOS ONE . 6 (12): e28886. Bibcode :2011PLoSO...628886H. doi : 10.1371/journal.pone.0028886 . PMC 3237569 . PMID 22194940.
- ^ Pierrat OA, Strisovsky K, Christova Y, Large J, Ansell K, Bouloc N, Smiljanic E, Freeman M (abril de 2011). "Las β-lactáminas monocíclicas son inhibidores selectivos basados en mecanismos de las proteasas intramembrana romboides". ACS Chemical Biology . 6 (4): 325–35. doi :10.1021/cb100314y. PMC 3077804 . PMID 21175222.
- ^ Lemberg MK, Freeman M (noviembre de 2007). "Implicaciones funcionales y evolutivas del análisis genómico mejorado de las proteasas intramembrana romboides". Genome Research . 17 (11): 1634–46. doi :10.1101/gr.6425307. PMC 2045146 . PMID 17938163.
- ^ ab Zettl M, Adrain C, Strisovsky K, Lastun V, Freeman M (abril de 2011). "Las pseudoproteasas de la familia romboidal utilizan la maquinaria de control de calidad del RE para regular la señalización intercelular". Cell . 145 (1): 79–91. doi :10.1016/j.cell.2011.02.047. PMC 3149277 . PMID 21439629.
- ^ Adrain C, Zettl M, Christova Y, Taylor N, Freeman M (enero de 2012). "La señalización del factor de necrosis tumoral requiere que iRhom2 promueva el tráfico y la activación de TACE". Science . 335 (6065): 225–8. Bibcode :2012Sci...335..225A. doi :10.1126/science.1214400. PMC 3272371 . PMID 22246777.
- ^ McIlwain DR, Lang PA, Maretzky T, Hamada K, Ohishi K, Maney SK, et al. (enero de 2012). "La regulación de TACE por iRhom2 controla la protección mediada por TNF contra Listeria y las respuestas a LPS". Science . 335 (6065): 229–32. Bibcode :2012Sci...335..229M. doi :10.1126/science.1214448. PMC 4250273 . PMID 22246778.
- ^ Christova Y, Adrain C, Bambrough P, Ibrahim A, Freeman M (octubre de 2013). "Los iRhoms de mamíferos tienen funciones fisiológicas distintas, incluido un papel esencial en la regulación de TACE". EMBO Reports . 14 (10): 884–90. doi :10.1038/embor.2013.128. PMC 3807218 . PMID 23969955.
- ^ Li X, Maretzky T, Weskamp G, Monette S, Qing X, Issuree PD, et al. (mayo de 2015). "iRhoms 1 y 2 son reguladores esenciales de la señalización EGFR dependiente de ADAM17". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 112 (19): 6080–5. Bibcode :2015PNAS..112.6080L. doi : 10.1073/pnas.1505649112 . PMC 4434755 . PMID 25918388.
- ^ "Clan: tipo romboide (CL0207)". Pfam .
- ^ M Santos J, Graindorge A, Soldati-Favre D (2012). "Nuevos conocimientos sobre las proteasas romboides de los parásitos". Parasitología molecular y bioquímica . 182 (1–2). Elsevier : 27–36. doi :10.1016/j.molbiopara.2011.11.010. PMID 22173057.
- ^ Dogga SK, Soldati-Favre D (diciembre de 2016). "Biología de las proteasas romboides en enfermedades infecciosas". Seminarios en biología celular y del desarrollo . 60. Elsevier : 38–45. doi :10.1016/j.semcdb.2016.08.020. PMID 27567708. S2CID 34820332. pág. 41:
2.3.1
- ^ ab Harsman A, Schneider A (febrero de 2017). "Importación de proteínas mitocondriales en tripanosomas: esperar lo inesperado". Tráfico . 18 (2). Wiley-Blackwell : 96–109. doi : 10.1111/tra.12463 . PMID 27976830. S2CID 206334512.:103
Lectura adicional
Enlaces externos
- "Resumen para la familia S54 (familia romboidal)". MEROPS .
- "EC 3.4.21.105". Expasy . SIB Instituto Suizo de Bioinformática.
