Enzima

| Parte de una serie sobre |
| Bioquímica |
|---|
 |
Las enzimas ( / ˈɛnzaɪmz / ) son proteínas que actúan como catalizadores biológicos al acelerar las reacciones químicas . Las moléculas sobre las que pueden actuar las enzimas se denominan sustratos , y la enzima convierte los sustratos en diferentes moléculas conocidas como productos . Casi todos los procesos metabólicos en la célula necesitan catálisis enzimática para ocurrir a velocidades lo suficientemente rápidas para sostener la vida. [1] : 8.1 Las vías metabólicas dependen de las enzimas para catalizar los pasos individuales. El estudio de las enzimas se llama enzimología y el campo del análisis de pseudoenzimas reconoce que durante la evolución, algunas enzimas han perdido la capacidad de llevar a cabo catálisis biológica, lo que a menudo se refleja en sus secuencias de aminoácidos y propiedades "pseudocatalíticas" inusuales. [2] [3]
Se sabe que las enzimas catalizan más de 5.000 tipos de reacciones bioquímicas. [4]
Otros biocatalizadores son las moléculas catalíticas de ARN , también llamadas ribozimas . A veces se las describe como un tipo de enzima en lugar de como una enzima, pero incluso en las décadas transcurridas desde el descubrimiento de las ribozimas en 1980-1982, la palabra enzima sola a menudo se refiere específicamente al tipo de proteína (como se usa en este artículo).
La especificidad de una enzima proviene de su estructura tridimensional única .
Como todos los catalizadores, las enzimas aumentan la velocidad de reacción al disminuir su energía de activación . Algunas enzimas pueden hacer que su conversión de sustrato a producto ocurra muchos millones de veces más rápido. Un ejemplo extremo es la orotidina 5'-fosfato descarboxilasa , que permite que una reacción que de otro modo tardaría millones de años ocurra en milisegundos. [5] [6] Químicamente, las enzimas son como cualquier catalizador y no se consumen en reacciones químicas, ni alteran el equilibrio de una reacción. Las enzimas se diferencian de la mayoría de los demás catalizadores por ser mucho más específicas. La actividad enzimática puede verse afectada por otras moléculas: los inhibidores son moléculas que disminuyen la actividad enzimática y los activadores son moléculas que aumentan la actividad. Muchos fármacos terapéuticos y venenos son inhibidores de enzimas. La actividad de una enzima disminuye notablemente fuera de su temperatura y pH óptimos , y muchas enzimas se desnaturalizan (permanentemente) cuando se exponen a un calor excesivo, perdiendo su estructura y propiedades catalíticas.
Algunas enzimas se utilizan comercialmente, por ejemplo, en la síntesis de antibióticos . Algunos productos domésticos utilizan enzimas para acelerar las reacciones químicas: las enzimas de los detergentes biológicos descomponen las manchas de proteínas, almidón o grasa en la ropa, y las enzimas del ablandador de carne descomponen las proteínas en moléculas más pequeñas, lo que hace que la carne sea más fácil de masticar.
Etimología e historia

A finales del siglo XVII y principios del XVIII, se conocía la digestión de la carne mediante secreciones estomacales [7] y la conversión del almidón en azúcares mediante extractos de plantas y saliva , pero no se habían identificado los mecanismos por los cuales esto ocurría. [8]
El químico francés Anselme Payen fue el primero en descubrir una enzima, la diastasa , en 1833. [9] Unas décadas más tarde, al estudiar la fermentación del azúcar en alcohol por la levadura , Louis Pasteur concluyó que esta fermentación era causada por una fuerza vital contenida dentro de las células de levadura llamadas "fermentos", que se pensaba que funcionaban solo dentro de los organismos vivos. Escribió que "la fermentación alcohólica es un acto correlacionado con la vida y la organización de las células de levadura, no con la muerte o putrefacción de las células". [10]
En 1877, el fisiólogo alemán Wilhelm Kühne (1837-1900) utilizó por primera vez el término enzima , que proviene del griego antiguo ἔνζυμον (énzymon) ' leudado , en levadura', para describir este proceso. [11] La palabra enzima se utilizó más tarde para referirse a sustancias no vivas como la pepsina , y la palabra fermento se utilizó para referirse a la actividad química producida por organismos vivos. [12]
Eduard Buchner presentó su primer artículo sobre el estudio de extractos de levadura en 1897. En una serie de experimentos en la Universidad de Berlín , descubrió que el azúcar era fermentado por extractos de levadura incluso cuando no había células de levadura vivas en la mezcla. [13] Llamó a la enzima que provocaba la fermentación de la sacarosa " zimasa ". [14] En 1907, recibió el Premio Nobel de Química por "su descubrimiento de la fermentación sin células". Siguiendo el ejemplo de Buchner, las enzimas suelen nombrarse según la reacción que llevan a cabo: el sufijo -asa se combina con el nombre del sustrato (p. ej., la lactasa es la enzima que escinde la lactosa ) o con el tipo de reacción (p. ej., la ADN polimerasa forma polímeros de ADN). [15]
La identidad bioquímica de las enzimas era todavía desconocida a principios del siglo XX. Muchos científicos observaron que la actividad enzimática estaba asociada con las proteínas, pero otros (como el premio Nobel Richard Willstätter ) argumentaron que las proteínas eran simplemente portadoras de las enzimas verdaderas y que las proteínas per se eran incapaces de catálisis. [16] En 1926, James B. Sumner demostró que la enzima ureasa era una proteína pura y la cristalizó; hizo lo mismo con la enzima catalasa en 1937. La conclusión de que las proteínas puras pueden ser enzimas fue demostrada definitivamente por John Howard Northrop y Wendell Meredith Stanley , quienes trabajaron en las enzimas digestivas pepsina (1930), tripsina y quimotripsina . Estos tres científicos fueron galardonados con el Premio Nobel de Química de 1946. [17]
El descubrimiento de que las enzimas podían cristalizarse permitió finalmente que sus estructuras se resolvieran mediante cristalografía de rayos X. Esto se hizo por primera vez con la lisozima , una enzima que se encuentra en las lágrimas, la saliva y las claras de huevo y que digiere el recubrimiento de algunas bacterias; la estructura fue resuelta por un grupo dirigido por David Chilton Phillips y publicada en 1965. [18] Esta estructura de alta resolución de la lisozima marcó el comienzo del campo de la biología estructural y el esfuerzo por comprender cómo funcionan las enzimas a un nivel atómico de detalle. [19]
Clasificación y nomenclatura
Las enzimas se pueden clasificar según dos criterios principales: similitud de secuencia de aminoácidos (y, por tanto, relación evolutiva) o actividad enzimática.
Actividad enzimática . El nombre de una enzima suele derivar de su sustrato o de la reacción química que cataliza, y la palabra termina en -asa . [1] : 8.1.3 Algunos ejemplos son la lactasa , la alcohol deshidrogenasa y la ADN polimerasa . Las diferentes enzimas que catalizan la misma reacción química se denominan isoenzimas . [1] : 10.3
La Unión Internacional de Bioquímica y Biología Molecular ha desarrollado una nomenclatura para las enzimas, los números EC (por "Enzyme Commission") . Cada enzima se describe con "EC" seguido de una secuencia de cuatro números que representan la jerarquía de la actividad enzimática (de muy general a muy específica). Es decir, el primer número clasifica ampliamente la enzima en función de su mecanismo, mientras que los demás dígitos añaden más y más especificidad. [20]
La clasificación de nivel superior es:
- EC 1, Oxidorreductasas : catalizan reacciones de oxidación /reducción.
- EC 2, Transferasas : transfieren un grupo funcional ( por ejemplo, un grupo metilo o fosfato)
- EC 3, Hidrolasas : catalizan la hidrólisis de varios enlaces.
- EC 4, Liasas : rompen diversos enlaces por medios distintos a la hidrólisis y la oxidación.
- EC 5, Isomerasas : catalizan cambios de isomerización dentro de una sola molécula.
- EC 6, Ligasas : unen dos moléculas con enlaces covalentes .
- CE 7, Translocasas : catalizan el movimiento de iones o moléculas a través de las membranas, o su separación dentro de las membranas.
Estas secciones se subdividen según otras características, como el sustrato, los productos y el mecanismo químico . Una enzima se especifica completamente mediante cuatro designaciones numéricas. Por ejemplo, la hexoquinasa (EC 2.7.1.1) es una transferasa (EC 2) que añade un grupo fosfato (EC 2.7) a un azúcar hexosa, una molécula que contiene un grupo alcohol (EC 2.7.1). [21]
Similitud de secuencia . Las categorías de EC no reflejan la similitud de secuencia. Por ejemplo, dos ligasas del mismo número de EC que catalizan exactamente la misma reacción pueden tener secuencias completamente diferentes. Independientemente de su función, las enzimas, como cualquier otra proteína, se han clasificado por su similitud de secuencia en numerosas familias. Estas familias se han documentado en docenas de bases de datos de proteínas y familias de proteínas diferentes, como Pfam . [22]
Enzimas isofuncionales no homólogas . Las enzimas no relacionadas que tienen la misma actividad enzimática se han denominado enzimas isofuncionales no homólogas . [23] La transferencia horizontal de genes puede propagar estos genes a especies no relacionadas, especialmente bacterias, donde pueden reemplazar genes endógenos de la misma función, lo que conduce al desplazamiento de genes homólogos.
Estructura

Las enzimas son generalmente proteínas globulares , que actúan solas o en complejos más grandes . La secuencia de los aminoácidos especifica la estructura que a su vez determina la actividad catalítica de la enzima. [24] Aunque la estructura determina la función, una nueva actividad enzimática aún no se puede predecir solo a partir de la estructura. [25] Las estructuras enzimáticas se despliegan ( se desnaturalizan ) cuando se calientan o se exponen a desnaturalizantes químicos y esta alteración de la estructura generalmente causa una pérdida de actividad. [26] La desnaturalización enzimática normalmente está vinculada a temperaturas superiores al nivel normal de una especie; como resultado, las enzimas de las bacterias que viven en entornos volcánicos como las aguas termales son apreciadas por los usuarios industriales por su capacidad de funcionar a altas temperaturas, lo que permite que las reacciones catalizadas por enzimas se realicen a una velocidad muy alta.
Las enzimas suelen ser mucho más grandes que sus sustratos. Los tamaños varían desde solo 62 residuos de aminoácidos, para el monómero de la 4-oxalocrotonato tautomerasa , [27] hasta más de 2500 residuos en la sintasa de ácidos grasos animales . [28] Solo una pequeña parte de su estructura (alrededor de 2-4 aminoácidos) está directamente involucrada en la catálisis: el sitio catalítico. [29] Este sitio catalítico está ubicado junto a uno o más sitios de unión donde los residuos orientan los sustratos. El sitio catalítico y el sitio de unión juntos componen el sitio activo de la enzima . La mayoría restante de la estructura de la enzima sirve para mantener la orientación y dinámica precisas del sitio activo. [30]
En algunas enzimas, ningún aminoácido está directamente involucrado en la catálisis; en cambio, la enzima contiene sitios para unir y orientar cofactores catalíticos . [30] Las estructuras enzimáticas también pueden contener sitios alostéricos donde la unión de una molécula pequeña causa un cambio conformacional que aumenta o disminuye la actividad. [31]
Existe una pequeña cantidad de catalizadores biológicos basados en ARN , llamados ribozimas , que pueden actuar solos o en combinación con proteínas. El más común de ellos es el ribosoma , que es un complejo de proteínas y componentes catalíticos de ARN. [1] : 2.2
Mecanismo

Unión del sustrato
Las enzimas deben unirse a sus sustratos antes de poder catalizar cualquier reacción química. Las enzimas suelen ser muy específicas en cuanto a los sustratos a los que se unen y luego la reacción química que catalizan. La especificidad se logra mediante la unión de bolsas con forma, carga y características hidrofílicas / hidrofóbicas complementarias a los sustratos. Por lo tanto, las enzimas pueden distinguir entre moléculas de sustrato muy similares para ser quimioselectivas , regioselectivas y estereoespecíficas . [32]
Algunas de las enzimas que muestran la mayor especificidad y precisión están involucradas en la copia y expresión del genoma . Algunas de estas enzimas tienen mecanismos de " corrección de pruebas ". Aquí, una enzima como la ADN polimerasa cataliza una reacción en un primer paso y luego verifica que el producto sea correcto en un segundo paso. [33] Este proceso de dos pasos da como resultado tasas de error promedio de menos de 1 error en 100 millones de reacciones en polimerasas de mamíferos de alta fidelidad. [1] : 5.3.1 También se encuentran mecanismos de corrección de pruebas similares en la ARN polimerasa , [34] las aminoacil ARNt sintetasas [35] y los ribosomas . [36]
Por el contrario, algunas enzimas muestran promiscuidad enzimática , tienen una amplia especificidad y actúan sobre una variedad de sustratos fisiológicamente relevantes. Muchas enzimas poseen pequeñas actividades secundarias que surgieron de manera fortuita (es decir, de manera neutral ), lo que puede ser el punto de partida para la selección evolutiva de una nueva función. [37] [38]

Modelo "cerradura y llave"
Para explicar la especificidad observada de las enzimas, en 1894 Emil Fischer propuso que tanto la enzima como el sustrato poseen formas geométricas complementarias específicas que encajan exactamente entre sí. [39] Esto se conoce a menudo como el modelo de "cerradura y llave". [1] : 8.3.2 Este modelo temprano explica la especificidad de las enzimas, pero no explica la estabilización del estado de transición que alcanzan las enzimas. [40]
Modelo de ajuste inducido
En 1958, Daniel Koshland sugirió una modificación al modelo de llave y cerradura: dado que las enzimas son estructuras bastante flexibles, el sitio activo se remodela continuamente por interacciones con el sustrato a medida que el sustrato interactúa con la enzima. [41] Como resultado, el sustrato no se une simplemente a un sitio activo rígido; las cadenas laterales de aminoácidos que forman el sitio activo se moldean en las posiciones precisas que permiten que la enzima realice su función catalítica. En algunos casos, como las glicosidasas , la molécula de sustrato también cambia de forma ligeramente al entrar en el sitio activo. [42] El sitio activo continúa cambiando hasta que el sustrato está completamente unido, momento en el que se determina la forma final y la distribución de carga. [43] El ajuste inducido puede mejorar la fidelidad del reconocimiento molecular en presencia de competencia y ruido a través del mecanismo de corrección conformacional . [44]
Catálisis
Las enzimas pueden acelerar las reacciones de varias maneras, todas las cuales reducen la energía de activación (ΔG ‡ , energía libre de Gibbs ) [45]
- Al estabilizar el estado de transición:
- Creación de un entorno con una distribución de carga complementaria a la del estado de transición para reducir su energía [46]
- Al proporcionar una vía de reacción alternativa:
- Reaccionando temporalmente con el sustrato, formando un intermedio covalente para proporcionar un estado de transición de energía más baja [47]
- Al desestabilizar el estado fundamental del sustrato:
- Distorsionar el sustrato o los sustratos unidos en su forma de estado de transición para reducir la energía necesaria para alcanzar el estado de transición [48]
- Orientando los sustratos en una disposición productiva para reducir el cambio de entropía de la reacción [49] (la contribución de este mecanismo a la catálisis es relativamente pequeña) [50]
Las enzimas pueden utilizar varios de estos mecanismos simultáneamente. Por ejemplo, las proteasas como la tripsina realizan catálisis covalente utilizando una tríada catalítica , estabilizan la acumulación de carga en los estados de transición utilizando un agujero de oxianión y completan la hidrólisis utilizando un sustrato de agua orientada. [51]
Dinámica
Las enzimas no son estructuras estáticas y rígidas, sino que tienen movimientos dinámicos internos complejos, es decir, movimientos de partes de la estructura de la enzima, como residuos de aminoácidos individuales, grupos de residuos que forman un bucle de proteína o una unidad de estructura secundaria , o incluso un dominio proteico completo . Estos movimientos dan lugar a un conjunto conformacional de estructuras ligeramente diferentes que se interconvierten entre sí en equilibrio . Diferentes estados dentro de este conjunto pueden estar asociados con diferentes aspectos de la función de una enzima. Por ejemplo, diferentes conformaciones de la enzima dihidrofolato reductasa están asociadas con la unión del sustrato, la catálisis, la liberación del cofactor y los pasos de liberación del producto del ciclo catalítico, [52] consistente con la teoría de resonancia catalítica .
Presentación del sustrato
La presentación del sustrato es un proceso en el que la enzima se secuestra lejos de su sustrato. Las enzimas pueden secuestrarse a la membrana plasmática lejos de un sustrato en el núcleo o el citosol. [53] O dentro de la membrana, una enzima puede ser secuestrada en balsas lipídicas lejos de su sustrato en la región desordenada. Cuando la enzima se libera, se mezcla con su sustrato. Alternativamente, la enzima puede ser secuestrada cerca de su sustrato para activarla. Por ejemplo, la enzima puede ser soluble y, al activarse, unirse a un lípido en la membrana plasmática y luego actuar sobre las moléculas en la membrana plasmática. [54]
Modulación alostérica
Los sitios alostéricos son cavidades en la enzima, distintas del sitio activo, que se unen a moléculas en el entorno celular. Estas moléculas luego causan un cambio en la conformación o dinámica de la enzima que se transduce al sitio activo y, por lo tanto, afecta la velocidad de reacción de la enzima. [55] De esta manera, las interacciones alostéricas pueden inhibir o activar las enzimas. Las interacciones alostéricas con metabolitos aguas arriba o aguas abajo en la vía metabólica de una enzima causan una regulación por retroalimentación , alterando la actividad de la enzima de acuerdo con el flujo a través del resto de la vía. [56]
Cofactores

Algunas enzimas no necesitan componentes adicionales para mostrar una actividad completa. Otras requieren que moléculas no proteicas llamadas cofactores estén unidas para la actividad. [57] Los cofactores pueden ser inorgánicos (p. ej., iones metálicos y grupos de hierro-azufre ) u compuestos orgánicos (p. ej., flavina y hemo ). Estos cofactores sirven para muchos propósitos; por ejemplo, los iones metálicos pueden ayudar a estabilizar las especies nucleofílicas dentro del sitio activo. [58] Los cofactores orgánicos pueden ser coenzimas , que se liberan del sitio activo de la enzima durante la reacción, o grupos prostéticos , que están fuertemente unidos a una enzima. Los grupos prostéticos orgánicos pueden estar unidos covalentemente (p. ej., biotina en enzimas como la piruvato carboxilasa ). [59]
Un ejemplo de una enzima que contiene un cofactor es la anhidrasa carbónica , que utiliza un cofactor de zinc unido como parte de su sitio activo. [60] Estos iones o moléculas fuertemente unidos se encuentran generalmente en el sitio activo y están involucrados en la catálisis. [1] : 8.1.1 Por ejemplo, los cofactores flavina y hemo a menudo están involucrados en reacciones redox . [1] : 17
Las enzimas que requieren un cofactor pero no tienen un enlace se denominan apoenzimas o apoproteínas . Una enzima junto con el cofactor o los cofactores necesarios para la actividad se denomina holoenzima (o haloenzima). El término holoenzima también se puede aplicar a las enzimas que contienen múltiples subunidades proteicas, como las ADN polimerasas ; en este caso, la holoenzima es el complejo completo que contiene todas las subunidades necesarias para la actividad. [1] : 8.1.1
Coenzimas
Las coenzimas son pequeñas moléculas orgánicas que pueden estar unidas de forma débil o fuerte a una enzima. Las coenzimas transportan grupos químicos de una enzima a otra. [61] Algunos ejemplos son NADH , NADPH y trifosfato de adenosina (ATP). Algunas coenzimas, como el mononucleótido de flavina (FMN), el dinucleótido de flavina y adenina (FAD), el pirofosfato de tiamina (TPP) y el tetrahidrofolato (THF), se derivan de las vitaminas . Estas coenzimas no pueden ser sintetizadas por el cuerpo de novo y los compuestos estrechamente relacionados (vitaminas) deben adquirirse a través de la dieta. Los grupos químicos transportados incluyen:
- el ion hidruro (H − ), transportado por NAD o NADP +
- El grupo fosfato, transportado por el trifosfato de adenosina.
- El grupo acetilo, transportado por la coenzima A
- grupos formilo, metenilo o metilo, transportados por el ácido fólico y
- el grupo metilo, transportado por la S-adenosilmetionina [61]
Dado que las coenzimas se modifican químicamente como consecuencia de la acción enzimática, es útil considerarlas una clase especial de sustratos, o segundos sustratos, que son comunes a muchas enzimas diferentes. Por ejemplo, se sabe que alrededor de 1000 enzimas utilizan la coenzima NADH. [62]
Las coenzimas se regeneran continuamente y sus concentraciones se mantienen a un nivel constante dentro de la célula. Por ejemplo, el NADPH se regenera a través de la vía de las pentosas fosfato y la S -adenosilmetionina por la metionina adenosiltransferasa . Esta regeneración continua significa que se pueden utilizar pequeñas cantidades de coenzimas de forma muy intensiva. Por ejemplo, el cuerpo humano renueva su propio peso en ATP cada día. [63]
Termodinámica

Al igual que todos los catalizadores, las enzimas no alteran la posición del equilibrio químico de la reacción. En presencia de una enzima, la reacción se desarrolla en la misma dirección que sin la enzima, sólo que más rápidamente. [1] : 8.2.3 Por ejemplo, la anhidrasa carbónica cataliza su reacción en cualquier dirección dependiendo de la concentración de sus reactivos: [64]
| (en los tejidos ; alta concentración de CO2 ) | ( 1 ) |
| (en los pulmones ; baja concentración de CO2 ) | ( 2 ) |
La velocidad de una reacción depende de la energía de activación necesaria para formar el estado de transición que luego se desintegra en productos. Las enzimas aumentan la velocidad de reacción al reducir la energía del estado de transición. En primer lugar, la unión forma un complejo enzima-sustrato (ES) de baja energía. En segundo lugar, la enzima estabiliza el estado de transición de modo que requiere menos energía para alcanzarlo en comparación con la reacción no catalizada (ES ‡ ). Finalmente, el complejo enzima-producto (EP) se disocia para liberar los productos. [1] : 8.3
Las enzimas pueden acoplar dos o más reacciones, de modo que una reacción termodinámicamente favorable puede utilizarse para "impulsar" una reacción termodinámicamente desfavorable, de modo que la energía combinada de los productos sea menor que la de los sustratos. Por ejemplo, la hidrólisis del ATP se utiliza a menudo para impulsar otras reacciones químicas. [65]
Cinética
La cinética enzimática es la investigación de cómo las enzimas se unen a los sustratos y los convierten en productos. [66] Los datos de velocidad utilizados en los análisis cinéticos se obtienen comúnmente de ensayos enzimáticos . En 1913, Leonor Michaelis y Maud Leonora Menten propusieron una teoría cuantitativa de la cinética enzimática, a la que se conoce como cinética de Michaelis-Menten . [67] La principal contribución de Michaelis y Menten fue pensar en las reacciones enzimáticas en dos etapas. En la primera, el sustrato se une reversiblemente a la enzima, formando el complejo enzima-sustrato. Esto a veces se llama complejo Michaelis-Menten en su honor. Luego, la enzima cataliza el paso químico en la reacción y libera el producto. Este trabajo fue desarrollado aún más por G. E. Briggs y J. B. S. Haldane , quienes derivaron ecuaciones cinéticas que todavía se usan ampliamente en la actualidad. [68]
Las velocidades de las enzimas dependen de las condiciones de la solución y de la concentración del sustrato . Para encontrar la velocidad máxima de una reacción enzimática, se aumenta la concentración del sustrato hasta que se observa una velocidad constante de formación del producto. Esto se muestra en la curva de saturación de la derecha. La saturación se produce porque, a medida que aumenta la concentración del sustrato, cada vez más enzima libre se convierte en el complejo ES unido al sustrato. A la velocidad máxima de reacción ( Vmax ) de la enzima, todos los sitios activos de la enzima están unidos al sustrato y la cantidad de complejo ES es la misma que la cantidad total de enzima. [1] : 8.4
Vmax es solo uno de varios parámetros cinéticos importantes. La cantidad de sustrato necesaria para alcanzar una velocidad de reacción determinada también es importante. Esto se da por la constante de Michaelis-Menten ( Km ) , que es la concentración de sustrato necesaria para que una enzima alcance la mitad de su velocidad de reacción máxima; generalmente, cada enzima tiene una Km característica para un sustrato determinado. Otra constante útil es kcat , también llamada número de recambio , que es el número de moléculas de sustrato manejadas por un sitio activo por segundo. [1] : 8.4
La eficiencia de una enzima se puede expresar en términos de k cat / K m . Esto también se llama constante de especificidad e incorpora las constantes de velocidad para todos los pasos de la reacción hasta e incluyendo el primer paso irreversible. Debido a que la constante de especificidad refleja tanto la afinidad como la capacidad catalítica, es útil para comparar diferentes enzimas entre sí, o la misma enzima con diferentes sustratos. El máximo teórico para la constante de especificidad se llama límite de difusión y es de aproximadamente 10 8 a 10 9 (M −1 s −1 ). En este punto, cada colisión de la enzima con su sustrato dará como resultado la catálisis, y la velocidad de formación del producto no está limitada por la velocidad de reacción sino por la velocidad de difusión. Las enzimas con esta propiedad se denominan catalíticamente perfectas o cinéticamente perfectas . Ejemplos de tales enzimas son la triosa-fosfato isomerasa , la anhidrasa carbónica , la acetilcolinesterasa , la catalasa , la fumarasa , la β-lactamasa y la superóxido dismutasa . [1] : 8.4.2 El recambio de tales enzimas puede alcanzar varios millones de reacciones por segundo. [1] : 9.2 Pero la mayoría de las enzimas están lejos de ser perfectas: los valores promedio de y son aproximadamente y , respectivamente. [69]
La cinética de Michaelis-Menten se basa en la ley de acción de masas , que se deriva de los supuestos de difusión libre y colisión aleatoria impulsada termodinámicamente. Muchos procesos bioquímicos o celulares se desvían significativamente de estas condiciones, debido al hacinamiento macromolecular y al movimiento molecular restringido. [70] Extensiones más recientes y complejas del modelo intentan corregir estos efectos. [71]
Inhibición
Las tasas de reacción enzimática se pueden reducir mediante varios tipos de inhibidores enzimáticos. [72] : 73–74
Tipos de inhibición
Competitivo
Un inhibidor competitivo y un sustrato no pueden unirse a la enzima al mismo tiempo. [73] A menudo, los inhibidores competitivos se parecen mucho al sustrato real de la enzima. Por ejemplo, el fármaco metotrexato es un inhibidor competitivo de la enzima dihidrofolato reductasa , que cataliza la reducción de dihidrofolato a tetrahidrofolato. [74] La similitud entre las estructuras del dihidrofolato y este fármaco se muestra en la figura adjunta. Este tipo de inhibición se puede superar con una alta concentración de sustrato. En algunos casos, el inhibidor puede unirse a un sitio distinto al sitio de unión del sustrato habitual y ejercer un efecto alostérico para cambiar la forma del sitio de unión habitual. [75]
No competitivo
Un inhibidor no competitivo se une a un sitio distinto al que se une el sustrato. El sustrato sigue uniéndose con su afinidad habitual y, por lo tanto, la Km permanece igual. Sin embargo, el inhibidor reduce la eficiencia catalítica de la enzima, de modo que la Vmax se reduce. A diferencia de la inhibición competitiva, la inhibición no competitiva no se puede superar con una concentración elevada de sustrato. [72] : 76–78
No competitivo
Un inhibidor no competitivo no puede unirse a la enzima libre, sino solo al complejo enzima-sustrato; por lo tanto, este tipo de inhibidores son más eficaces en concentraciones altas de sustrato. En presencia del inhibidor, el complejo enzima-sustrato está inactivo. [72] : 78 Este tipo de inhibición es poco común. [76]
Mezclado
Un inhibidor mixto se une a un sitio alostérico y la unión del sustrato y el inhibidor se afectan mutuamente. La función de la enzima se reduce pero no se elimina cuando se une al inhibidor. Este tipo de inhibidor no sigue la ecuación de Michaelis-Menten. [72] : 76–78
Irreversible
Un inhibidor irreversible inactiva permanentemente la enzima, generalmente formando un enlace covalente con la proteína. [77] La penicilina [78] y la aspirina [79] son medicamentos comunes que actúan de esta manera.
Funciones de los inhibidores
En muchos organismos, los inhibidores pueden actuar como parte de un mecanismo de retroalimentación . Si una enzima produce demasiada cantidad de una sustancia en el organismo, esa sustancia puede actuar como inhibidor de la enzima al comienzo de la vía que la produce, lo que hace que la producción de la sustancia se ralentice o se detenga cuando haya una cantidad suficiente. Esta es una forma de retroalimentación negativa . Las principales vías metabólicas, como el ciclo del ácido cítrico, utilizan este mecanismo. [1] : 17.2.2
Dado que los inhibidores modulan la función de las enzimas, a menudo se utilizan como fármacos. Muchos de estos fármacos son inhibidores competitivos reversibles que se asemejan al sustrato nativo de la enzima, similar al metotrexato mencionado anteriormente; otros ejemplos bien conocidos incluyen las estatinas utilizadas para tratar el colesterol alto , [80] y los inhibidores de la proteasa utilizados para tratar infecciones retrovirales como el VIH . [81] Un ejemplo común de un inhibidor irreversible que se utiliza como fármaco es la aspirina , que inhibe las enzimas COX-1 y COX-2 que producen el mensajero inflamatorio prostaglandina . [79] Otros inhibidores de enzimas son venenos. Por ejemplo, el veneno cianuro es un inhibidor enzimático irreversible que se combina con el cobre y el hierro en el sitio activo de la enzima citocromo c oxidasa y bloquea la respiración celular . [82]
Factores que afectan la actividad enzimática
Como las enzimas están formadas por proteínas, sus acciones son sensibles a cambios en muchos factores fisicoquímicos como el pH, la temperatura, la concentración de sustrato, etc.
La siguiente tabla muestra los valores óptimos de pH para varias enzimas. [83]
| Enzima | pH óptimo | Descripción del pH |
|---|---|---|
| Pepsina | 1,5–1,6 | Altamente ácido |
| Invertasa | 4.5 | Ácido |
| Lipasa (estómago) | 4.0–5.0 | Ácido |
| Lipasa (aceite de ricino) | 4.7 | Ácido |
| Lipasa (páncreas) | 8.0 | Alcalino |
| Amilasa (malta) | 4.6–5.2 | Ácido |
| Amilasa (páncreas) | 6,7–7,0 | Ácido-neutro |
| Celobiosa | 5.0 | Ácido |
| Maltasa | 6.1–6.8 | Ácido |
| Sacarasa | 6.2 | Ácido |
| Catalasa | 7.0 | Neutral |
| Ureasa | 7.0 | Neutral |
| Colinesterasa | 7.0 | Neutral |
| Ribonucleasa | 7,0–7,5 | Neutral |
| Fumarasa | 7.8 | Alcalino |
| Tripsina | 7.8–8.7 | Alcalino |
| Trifosfato de adenosina | 9.0 | Alcalino |
| Arginasa | 10.0 | Altamente alcalino |
Función biológica
Las enzimas cumplen una amplia variedad de funciones dentro de los organismos vivos. Son indispensables para la transducción de señales y la regulación celular, a menudo a través de quinasas y fosfatasas . [84] También generan movimiento, con la miosina hidrolizando el trifosfato de adenosina (ATP) para generar la contracción muscular , y también transportan carga alrededor de la célula como parte del citoesqueleto . [85] Otras ATPasas en la membrana celular son bombas de iones involucradas en el transporte activo . Las enzimas también están involucradas en funciones más exóticas, como la luciferasa que genera luz en las luciérnagas . [86] Los virus también pueden contener enzimas para infectar células, como la integrasa y la transcriptasa inversa del VIH , o para la liberación viral de las células, como la neuraminidasa del virus de la influenza . [87]
Una función importante de las enzimas está en los sistemas digestivos de los animales. Las enzimas como las amilasas y las proteasas descomponen moléculas grandes ( almidón o proteínas , respectivamente) en otras más pequeñas, para que puedan ser absorbidas por los intestinos. Las moléculas de almidón, por ejemplo, son demasiado grandes para ser absorbidas desde el intestino, pero las enzimas hidrolizan las cadenas de almidón en moléculas más pequeñas como la maltosa y, finalmente, la glucosa , que luego pueden absorberse. Diferentes enzimas digieren diferentes sustancias alimenticias. En los rumiantes , que tienen dietas herbívoras , los microorganismos en el intestino producen otra enzima, la celulasa , para descomponer las paredes celulares de celulosa de la fibra vegetal. [88]
Metabolismo
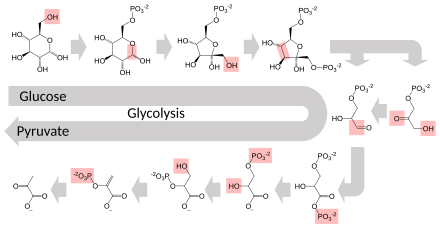
Varias enzimas pueden trabajar juntas en un orden específico, creando vías metabólicas . [1] : 30.1 En una vía metabólica, una enzima toma el producto de otra enzima como sustrato. Después de la reacción catalítica, el producto pasa a otra enzima. A veces más de una enzima puede catalizar la misma reacción en paralelo; esto puede permitir una regulación más compleja: con, por ejemplo, una actividad constante baja proporcionada por una enzima pero una actividad alta inducible de una segunda enzima. [89]
Las enzimas determinan qué pasos se dan en estas vías. Sin enzimas, el metabolismo no seguiría los mismos pasos y no podría regularse para satisfacer las necesidades de la célula. La mayoría de las vías metabólicas centrales se regulan en unos pocos pasos clave, normalmente a través de enzimas cuya actividad implica la hidrólisis del ATP. Debido a que esta reacción libera tanta energía, otras reacciones que son termodinámicamente desfavorables pueden acoplarse a la hidrólisis del ATP, impulsando la serie general de reacciones metabólicas vinculadas. [1] : 30.1
Control de actividad
Hay cinco formas principales en que se controla la actividad enzimática en la célula. [1] : 30.1.1
Regulación
Las enzimas pueden ser activadas o inhibidas por otras moléculas. Por ejemplo, los productos finales de una vía metabólica suelen ser inhibidores de una de las primeras enzimas de la vía (normalmente el primer paso irreversible, llamado paso comprometido), regulando así la cantidad de producto final producido por las vías. Un mecanismo regulador de este tipo se denomina mecanismo de retroalimentación negativa , porque la cantidad de producto final producido está regulada por su propia concentración. [90] : 141–48 El mecanismo de retroalimentación negativa puede ajustar eficazmente la tasa de síntesis de metabolitos intermedios según las demandas de las células. Esto ayuda a la asignación eficaz de materiales y a la economía energética, y evita la fabricación excesiva de productos finales. Al igual que otros dispositivos homeostáticos , el control de la acción enzimática ayuda a mantener un entorno interno estable en los organismos vivos. [90] : 141
Modificación postraduccional
Ejemplos de modificación postraduccional incluyen fosforilación , miristoilación y glicosilación . [90] : 149–69 Por ejemplo, en la respuesta a la insulina , la fosforilación de múltiples enzimas, incluyendo la glucógeno sintasa , ayuda a controlar la síntesis o degradación del glucógeno y permite que la célula responda a los cambios en el azúcar en sangre . [91] Otro ejemplo de modificación postraduccional es la escisión de la cadena polipeptídica. La quimotripsina , una proteasa digestiva, se produce en forma inactiva como quimotripsinógeno en el páncreas y se transporta en esta forma al estómago donde se activa. Esto impide que la enzima digiera el páncreas u otros tejidos antes de entrar en el intestino. Este tipo de precursor inactivo de una enzima se conoce como zimógeno [90] : 149–53 o proenzima.
Cantidad
La producción de enzimas ( transcripción y traducción de genes enzimáticos) puede ser mejorada o disminuida por una célula en respuesta a cambios en el entorno celular. Esta forma de regulación genética se llama inducción enzimática . Por ejemplo, las bacterias pueden volverse resistentes a antibióticos como la penicilina porque se inducen enzimas llamadas betalactamasas que hidrolizan el anillo crucial de betalactama dentro de la molécula de penicilina. [92] Otro ejemplo proviene de las enzimas en el hígado llamadas citocromo P450 oxidasas , que son importantes en el metabolismo de los fármacos . La inducción o inhibición de estas enzimas puede causar interacciones farmacológicas . [93] Los niveles de enzimas también pueden regularse cambiando la tasa de degradación enzimática . [1] : 30.1.1 Lo opuesto a la inducción enzimática es la represión enzimática .
Distribución subcelular
Las enzimas pueden compartimentarse, con diferentes vías metabólicas que ocurren en diferentes compartimentos celulares . Por ejemplo, los ácidos grasos son sintetizados por un conjunto de enzimas en el citosol , retículo endoplasmático y Golgi y utilizados por un conjunto diferente de enzimas como fuente de energía en la mitocondria , a través de la β-oxidación . [94] Además, el tráfico de la enzima a diferentes compartimentos puede cambiar el grado de protonación (p. ej., el citoplasma neutro y el lisosoma ácido ) o el estado oxidativo (p. ej., periplasma oxidante o citoplasma reductor ) que a su vez afecta la actividad enzimática. [95] A diferencia de la partición en orgánulos unidos a la membrana, la localización subcelular de la enzima también puede alterarse a través de la polimerización de enzimas en filamentos citoplasmáticos macromoleculares. [96] [97]
Especialización de órganos
En los eucariotas multicelulares , las células de diferentes órganos y tejidos tienen diferentes patrones de expresión genética y, por lo tanto, tienen diferentes conjuntos de enzimas (conocidas como isoenzimas ) disponibles para las reacciones metabólicas. Esto proporciona un mecanismo para regular el metabolismo general del organismo. Por ejemplo, la hexoquinasa , la primera enzima en la vía de la glucólisis , tiene una forma especializada llamada glucoquinasa expresada en el hígado y el páncreas que tiene una menor afinidad por la glucosa pero es más sensible a la concentración de glucosa. [98] Esta enzima está involucrada en la detección de azúcar en sangre y la regulación de la producción de insulina. [99]
Implicación en la enfermedad


Dado que el control estricto de la actividad enzimática es esencial para la homeostasis , cualquier mal funcionamiento (mutación, sobreproducción, subproducción o eliminación) de una sola enzima crítica puede conducir a una enfermedad genética. El mal funcionamiento de un solo tipo de enzima de los miles de tipos presentes en el cuerpo humano puede ser fatal. Un ejemplo de una enfermedad genética fatal debido a la insuficiencia enzimática es la enfermedad de Tay-Sachs , en la que los pacientes carecen de la enzima hexosaminidasa . [100] [101]
Un ejemplo de deficiencia enzimática es el tipo más común de fenilcetonuria . Muchas mutaciones diferentes de un solo aminoácido en la enzima fenilalanina hidroxilasa , que cataliza el primer paso en la degradación de la fenilalanina , dan como resultado la acumulación de fenilalanina y productos relacionados. Algunas mutaciones están en el sitio activo, interrumpiendo directamente la unión y la catálisis, pero muchas están lejos del sitio activo y reducen la actividad al desestabilizar la estructura de la proteína o afectar la oligomerización correcta. [102] [103] Esto puede conducir a una discapacidad intelectual si la enfermedad no se trata. [104] Otro ejemplo es la deficiencia de pseudocolinesterasa , en la que se altera la capacidad del cuerpo para descomponer los fármacos de ésteres de colina. [105] La administración oral de enzimas se puede utilizar para tratar algunas deficiencias enzimáticas funcionales, como la insuficiencia pancreática [106] y la intolerancia a la lactosa . [107]
Otra forma en que el mal funcionamiento de las enzimas puede causar enfermedades proviene de mutaciones de la línea germinal en los genes que codifican las enzimas reparadoras del ADN . Los defectos en estas enzimas causan cáncer porque las células son menos capaces de reparar las mutaciones en sus genomas . Esto provoca una acumulación lenta de mutaciones y da como resultado el desarrollo de cánceres . Un ejemplo de un síndrome de cáncer hereditario de este tipo es el xeroderma pigmentoso , que causa el desarrollo de cánceres de piel en respuesta a una exposición incluso mínima a la luz ultravioleta . [108] [109]
Evolución
Al igual que cualquier otra proteína, las enzimas cambian con el tiempo a través de mutaciones y divergencias de secuencia. Dado su papel central en el metabolismo , la evolución de las enzimas desempeña un papel crítico en la adaptación . Por lo tanto, una pregunta clave es si las enzimas pueden cambiar sus actividades enzimáticas al mismo tiempo y cómo. En general, se acepta que muchas actividades enzimáticas nuevas han evolucionado a través de la duplicación de genes y la mutación de las copias duplicadas, aunque la evolución también puede ocurrir sin duplicación. Un ejemplo de una enzima que ha cambiado su actividad es el antecesor de la metionil aminopeptidasa (MAP) y la creatina amidinohidrolasa ( creatinasa ), que son claramente homólogas pero catalizan reacciones muy diferentes (la MAP elimina la metionina amino-terminal en nuevas proteínas mientras que la creatinasa hidroliza la creatina a sarcosina y urea ). Además, la MAP depende de iones metálicos mientras que la creatinasa no, por lo tanto, esta propiedad también se perdió con el tiempo. [110] Los pequeños cambios de actividad enzimática son extremadamente comunes entre las enzimas. En particular, la especificidad de unión al sustrato (ver arriba) puede cambiar fácil y rápidamente con cambios de un solo aminoácido en sus bolsillos de unión al sustrato. Esto se observa con frecuencia en las principales clases de enzimas, como las quinasas . [111]
En la actualidad, la evolución artificial (in vitro) se utiliza comúnmente para modificar la actividad o especificidad de una enzima para aplicaciones industriales (ver más abajo).
Aplicaciones industriales
Las enzimas se utilizan en la industria química y en otras aplicaciones industriales cuando se requieren catalizadores extremadamente específicos. Las enzimas en general están limitadas por el número de reacciones que han evolucionado para catalizar y también por su falta de estabilidad en solventes orgánicos y a altas temperaturas. Como consecuencia, la ingeniería de proteínas es un área activa de investigación e implica intentos de crear nuevas enzimas con propiedades novedosas, ya sea mediante diseño racional o evolución in vitro . [112] [113] Estos esfuerzos han comenzado a dar resultados, y ahora se han diseñado algunas enzimas "desde cero" para catalizar reacciones que no ocurren en la naturaleza. [114]
| Solicitud | Enzimas utilizadas | Usos |
|---|---|---|
| Industria de biocombustibles | Celulasas | Descomponer la celulosa en azúcares que pueden fermentarse para producir etanol celulósico . [115] |
| Ligninasas | Pretratamiento de biomasa para la producción de biocombustibles. [115] | |
| Detergente biológico | Proteasas , amilasas , lipasas | Eliminar manchas de proteínas, almidón, grasa o aceite de la ropa y la vajilla. [116] |
| Mananasas | Elimine las manchas de comida con el aditivo alimentario común goma guar . [116] | |
| Industria cervecera | Amilasa , glucanasas , proteasas | Polisacáridos y proteínas divididos en la malta . [117] : 150–9 |
| Betaglucanasas | Mejorar las características de filtración del mosto y de la cerveza. [117] : 545 | |
| Amiloglucosidasa y pululanasas | Elaborar cerveza baja en calorías y ajustar la fermentabilidad. [117] : 575 | |
| Acetolactato descarboxilasa (ALDC) | Aumentar la eficiencia de la fermentación reduciendo la formación de diacetilo . [118] | |
| Usos culinarios | Papaína | Ablandar la carne para cocinarla. [119] |
| Industria láctea | Renina | Hidrolizar proteínas en la fabricación de queso . [120] |
| Lipasas | Produce queso Camembert y quesos azules como el Roquefort . [121] | |
| Procesamiento de alimentos | Amilasas | Producir azúcares a partir de almidón , como en la elaboración de jarabe de maíz con alto contenido de fructosa . [122] |
| Proteasas | Reducir el nivel de proteínas de la harina , como en la elaboración de galletas . [123] | |
| Tripsina | Fabricar alimentos hipoalergénicos para bebés. [123] | |
| Celulasas , pectinasas | Clarificar jugos de frutas . [124] | |
| Biología molecular | Nucleasas , ADN ligasa y polimerasas | Utilice la digestión por restricción y la reacción en cadena de la polimerasa para crear ADN recombinante . [1] : 6.2 |
| Industria del papel | Xilanasas , hemicelulasas y lignina peroxidasas | Eliminar la lignina de la pulpa kraft . [125] |
| Cuidado personal | Proteasas | Eliminar las proteínas de las lentes de contacto para prevenir infecciones. [126] |
| Industria del almidón | Amilasas | Convierte el almidón en glucosa y diversos jarabes . [127] |
Véase también
Bases de datos de enzimas
Referencias
- ^ abcdefghijklmnopqrstu Stryer L, Berg JM, Tymoczko JL (2002). Bioquímica (5ª ed.). San Francisco: WH Freeman. ISBN 0-7167-4955-6.

- ^ Murphy JM, Farhan H, Eyers PA (abril de 2017). "Bio-Zombie: el auge de las pseudoenzimas en biología". Biochemical Society Transactions . 45 (2): 537–544. doi :10.1042/bst20160400. PMID 28408493.
- ^ Murphy JM, Zhang Q, Young SN, Reese ML, Bailey FP, Eyers PA, et al. (enero de 2014). "Una metodología robusta para subclasificar pseudoquinasas en función de sus propiedades de unión a nucleótidos". The Biochemical Journal . 457 (2): 323–334. doi :10.1042/BJ20131174. PMC 5679212 . PMID 24107129.
- ^ Schomburg I, Chang A, Placzek S, Söhngen C, Rother M, Lang M, et al. (enero de 2013). "BRENDA en 2013: reacciones integradas, datos cinéticos, datos de función enzimática, clasificación mejorada de enfermedades: nuevas opciones y contenidos en BRENDA". Nucleic Acids Research . 41 (número de base de datos): D764–D772. doi :10.1093/nar/gks1049. PMC 3531171 . PMID 23203881.
- ^ Radzicka A, Wolfenden R (enero de 1995). "Una enzima competente". Science . 267 (5194): 90–93. Bibcode :1995Sci...267...90R. doi :10.1126/science.7809611. PMID 7809611. S2CID 8145198.
- ^ Callahan BP, Miller BG (diciembre de 2007). "OMP descarboxilasa: un enigma que persiste". Química bioorgánica . 35 (6): 465–469. doi :10.1016/j.bioorg.2007.07.004. PMID 17889251.
- ^ de Réaumur RA (1752). "Observaciones sobre la digestión de los peces". Histoire de l'Académie Royale des Sciences (en francés). 1752 : 266, 461.
- ^ Williams HS (1904). Una historia de la ciencia: en cinco volúmenes. Volumen IV: Desarrollo moderno de las ciencias químicas y biológicas. Harper and Brothers.
- ^ Payen A, Persoz JF (1833). "Mémoire sur la diastase, les principaux produits de ses réactions et leurs apps aux arts industriels" [Memoria sobre la diastasa, los principales productos de sus reacciones y sus aplicaciones a las artes industriales]. Annales de chimie et de physique . 2do (en francés). 53 : 73–92.
- ^ Manchester KL (diciembre de 1995). "Louis Pasteur (1822–1895): el azar y la mente preparada". Tendencias en biotecnología . 13 (12): 511–515. doi :10.1016/S0167-7799(00)89014-9. PMID 8595136.
- ^ Kühne acuñó la palabra "enzima" en: Kühne W (1877). "Über das Verhalten verschiedener organisirter und sog. ungeformter Fermente" [Sobre el comportamiento de diversos fermentos organizados y los llamados informes]. Verhandlungen des Naturhistorisch-medicinischen Vereins zu Heidelberg . nueva serie (en alemán). 1 (3): 190-193.Pasaje relevante en la página 190: "Um Missverständnissen vorzubeugen und lästige Umschreibungen zu vermeiden schlägt Vortragender vor, die ungeformten oder nicht organisirten Fermente, deren Wirkung ohne Anwesenheit von Organismen und ausserhalb derselben erfolgen kann, als Enzyme zu bezeichnen." (Traducción: Para evitar malentendidos y evitar perífrasis engorrosas, [el autor, profesor universitario] sugiere designar como "enzimas" los fermentos informes o no organizados, cuya acción puede ocurrir sin la presencia de organismos y fuera de los mismos.)
- ^ Holmes FL (2003). "Enzimas". En Heilbron JL (ed.). The Oxford Companion to the History of Modern Science . Oxford: Oxford University Press. pág. 270. ISBN 9780199743766.
- ^ "Eduard Buchner". Biografía del premio Nobel . Nobelprize.org . Consultado el 23 de febrero de 2015 .
- ^ "Eduard Buchner – Conferencia Nobel: Fermentación sin células". Nobelprize.org . 1907 . Consultado el 23 de febrero de 2015 .
- ^ La denominación de las enzimas mediante la adición del sufijo "-asa" al sustrato sobre el que actúa la enzima se remonta al científico francés Émile Duclaux (1840-1904), quien pretendió honrar a los descubridores de la diastasa (la primera enzima que se aisló) introduciendo esta práctica en su libro Duclaux E (1899). Traité de microbiologie: Diastases, toxines et venins [ Tratado de microbiología: diástasis, toxinas y venenos ] (en francés). París, Francia: Masson and Co.Véase el Capítulo 1, especialmente la página 9.
- ^ Willstätter R (1927). "Conferencia Faraday. Problemas y métodos en la investigación enzimática". Journal of the Chemical Society (Resumen) : 1359–1381. doi :10.1039/JR9270001359.citado en Blow D (abril de 2000). "Entonces, ¿entendemos cómo funcionan las enzimas?". Structure . 8 (4): R77–R81. doi : 10.1016/S0969-2126(00)00125-8 . PMID 10801479.
- ^ "Premios Nobel y laureados: El Premio Nobel de Química 1946". Nobelprize.org . Consultado el 23 de febrero de 2015 .
- ^ Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR (mayo de 1965). "Estructura de la lisozima de clara de huevo de gallina. Una síntesis de Fourier tridimensional con una resolución de 2 angstroms". Nature . 206 (4986): 757–761. Código Bibliográfico :1965Natur.206..757B. doi :10.1038/206757a0. PMID 5891407. S2CID 4161467.
- ^ Johnson LN, Petsko GA (julio de 1999). "David Phillips y el origen de la enzimología estructural". Tendencias en ciencias bioquímicas . 24 (7): 287–289. doi :10.1016/S0968-0004(99)01423-1. PMID 10390620.
- ^ Moss GP. «Recomendaciones del Comité de Nomenclatura de la Unión Internacional de Bioquímica y Biología Molecular sobre la nomenclatura y clasificación de las enzimas según las reacciones que catalizan». Unión Internacional de Bioquímica y Biología Molecular . Consultado el 28 de agosto de 2021 .
- ^ Comité de Nomenclatura. «EC 2.7.1.1». Unión Internacional de Bioquímica y Biología Molecular (NC-IUBMB) . Facultad de Ciencias Biológicas y Químicas, Queen Mary, Universidad de Londres. Archivado desde el original el 1 de diciembre de 2014. Consultado el 6 de marzo de 2015 .
- ^ Mulder NJ (28 de septiembre de 2007). "Bases de datos de familias de proteínas". eLS . Chichester, Reino Unido: John Wiley & Sons, Ltd. pp. a0003058.pub2. doi :10.1002/9780470015902.a0003058.pub2. ISBN 978-0-470-01617-6.
- ^ Omelchenko MV, Galperin MY, Wolf YI, Koonin EV (abril de 2010). "Enzimas isofuncionales no homólogas: un análisis sistemático de soluciones alternativas en la evolución de enzimas". Biology Direct . 5 (1): 31. doi : 10.1186/1745-6150-5-31 . PMC 2876114 . PMID 20433725.
- ^ Anfinsen CB (julio de 1973). "Principios que gobiernan el plegamiento de las cadenas proteínicas". Science . 181 (4096): 223–230. Bibcode :1973Sci...181..223A. doi :10.1126/science.181.4096.223. PMID 4124164.
- ^ Dunaway-Mariano D (noviembre de 2008). "Descubrimiento de la función enzimática". Structure . 16 (11): 1599–1600. doi : 10.1016/j.str.2008.10.001 . PMID 19000810.
- ^ Petsko GA, Ringe D (2003). "Capítulo 1: De la secuencia a la estructura". Estructura y función de las proteínas . Londres: New Science. pág. 27. ISBN 978-1405119221.
- ^ Chen LH, Kenyon GL, Curtin F, Harayama S, Bembenek ME, Hajipour G, et al. (septiembre de 1992). "4-Oxalocrotonato tautomerasa, una enzima compuesta de 62 residuos de aminoácidos por monómero". The Journal of Biological Chemistry . 267 (25): 17716–17721. doi : 10.1016/S0021-9258(19)37101-7 . PMID 1339435.
- ^ Smith S (diciembre de 1994). "La sintetasa de ácidos grasos animales: un gen, un polipéptido, siete enzimas". FASEB Journal . 8 (15): 1248–1259. doi : 10.1096/fasebj.8.15.8001737 . PMID 8001737. S2CID 22853095.
- ^ "Atlas de sitios catalíticos". Instituto Europeo de Bioinformática. Archivado desde el original el 27 de septiembre de 2018. Consultado el 4 de abril de 2007 .
- ^ ab Suzuki H (2015). "Capítulo 7: Estructura del sitio activo". Cómo funcionan las enzimas: de la estructura a la función . Boca Raton, FL: CRC Press. págs. 117–140. ISBN 978-981-4463-92-8.
- ^ Krauss G (2003). "La regulación de la actividad enzimática". Bioquímica de la transducción y regulación de señales (3.ª ed.). Weinheim: Wiley-VCH. págs. 89-114. ISBN 9783527605767.
- ^ Jaeger KE, Eggert T (agosto de 2004). "Biocatálisis enantioselectiva optimizada mediante evolución dirigida". Current Opinion in Biotechnology . 15 (4): 305–313. doi :10.1016/j.copbio.2004.06.007. PMID 15358000.
- ^ Shevelev IV, Hübscher U (mayo de 2002). "Las exonucleasas 3' 5'". Nature Reviews. Biología celular molecular . 3 (5): 364–376. doi :10.1038/nrm804. PMID 11988770. S2CID 31605786.
- ^ Zenkin N, Yuzenkova Y, Severinov K (julio de 2006). "Corrección de transcripción asistida por transcripción". Science . 313 (5786): 518–520. Bibcode :2006Sci...313..518Z. doi :10.1126/science.1127422. PMID 16873663. S2CID 40772789.
- ^ Ibba M, Soll D (2000). "Síntesis de aminoacil-ARNt". Revisión anual de bioquímica . 69 : 617–650. doi :10.1146/annurev.biochem.69.1.617. PMID 10966471.
- ^ Rodnina MV, Wintermeyer W (2001). "Fidelidad de la selección de aminoacil-ARNt en el ribosoma: mecanismos cinéticos y estructurales". Revisión anual de bioquímica . 70 : 415–435. doi :10.1146/annurev.biochem.70.1.415. PMID 11395413.
- ^ Khersonsky O, Tawfik DS (2010). "Promiscuidad enzimática: una perspectiva mecanicista y evolutiva". Revisión anual de bioquímica . 79 : 471–505. doi :10.1146/annurev-biochem-030409-143718. PMID 20235827.
- ^ O'Brien PJ, Herschlag D (abril de 1999). "Promiscuidad catalítica y evolución de nuevas actividades enzimáticas". Química y biología . 6 (4): R91–R105. doi : 10.1016/S1074-5521(99)80033-7 . PMID 10099128.
- ^ Fischer E (1894). "Einfluss der Configuration auf die Wirkung der Enzyme" [Influencia de la configuración en la acción de las enzimas]. Berichte der Deutschen Chemischen Gesellschaft zu Berlin (en alemán). 27 (3): 2985–93. doi :10.1002/cber.18940270364.De la página 2992: "Um ein Bild zu gebrauchen, will ich sagen, dass Enzym und Glucosid wie Schloss und Schlüssel zu einander passen müssen, um eine chemische Wirkung auf einander ausüben zu können". (Para usar una imagen, diré que una enzima y un glucósido [es decir, un derivado de la glucosa] deben encajar como una cerradura y una llave para poder ejercer un efecto químico entre sí).
- ^ Cooper GM (2000). "Capítulo 2.2: El papel central de las enzimas como catalizadores biológicos". La célula: un enfoque molecular (2.ª ed.). Washington (DC): ASM Press. ISBN 0-87893-106-6.
- ^ Koshland DE (febrero de 1958). "Aplicación de una teoría de la especificidad enzimática a la síntesis de proteínas". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 44 (2): 98–104. Bibcode :1958PNAS...44...98K. doi : 10.1073/pnas.44.2.98 . PMC 335371 . PMID 16590179.
- ^ Vasella A, Davies GJ, Böhm M (octubre de 2002). "Mecanismos de la glucosidasa". Current Opinion in Chemical Biology . 6 (5): 619–629. doi :10.1016/S1367-5931(02)00380-0. PMID 12413546.
- ^ Boyer R (2002). "Capítulo 6: Enzimas I, reacciones, cinética e inhibición". Conceptos de bioquímica (2.ª ed.). Nueva York, Chichester, Weinheim, Brisbane, Singapur, Toronto.: John Wiley & Sons, Inc., págs. 137-8. ISBN 0-470-00379-0.OCLC 51720783 .
- ^ Savir Y, Tlusty T (mayo de 2007). Scalas E (ed.). "Corrección conformacional: el impacto de los cambios conformacionales en la especificidad del reconocimiento molecular". PLOS ONE . 2 (5): e468. Bibcode :2007PLoSO...2..468S. doi : 10.1371/journal.pone.0000468 . PMC 1868595 . PMID 17520027.
- ^ Fersht A (1985). Estructura y mecanismo de las enzimas . San Francisco: WH Freeman. págs. 50-2. ISBN 978-0-7167-1615-0.
- ^ Warshel A, Sharma PK, Kato M, Xiang Y, Liu H, Olsson MH (agosto de 2006). "Base electrostática para la catálisis enzimática". Chemical Reviews . 106 (8): 3210–3235. doi :10.1021/cr0503106. PMID 16895325.
- ^ Cox MM, Nelson DL (2013). "Capítulo 6.2: Cómo funcionan las enzimas". Principios de bioquímica de Lehninger (6.ª ed.). Nueva York, NY: WH Freeman. pág. 195. ISBN 978-1464109621.
- ^ Benkovic SJ, Hammes-Schiffer S (agosto de 2003). "Una perspectiva sobre la catálisis enzimática". Science . 301 (5637): 1196–1202. Bibcode :2003Sci...301.1196B. doi :10.1126/science.1085515. PMID 12947189. S2CID 7899320.
- ^ Jencks WP (1987). Catálisis en Química y Enzimología . Mineola, Nueva York: Dover. ISBN 978-0-486-65460-7.
- ^ Villa J, Strajbl M, Glennon TM, Sham YY, Chu ZT, Warshel A (octubre de 2000). "¿Qué importancia tienen las contribuciones entrópicas a la catálisis enzimática?". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 97 (22): 11899–11904. Bibcode :2000PNAS...9711899V. doi : 10.1073/pnas.97.22.11899 . PMC 17266 . PMID 11050223.
- ^ Polgár L (octubre de 2005). "La tríada catalítica de las serina peptidasas". Ciencias de la vida celular y molecular . 62 (19–20): 2161–2172. doi :10.1007/s00018-005-5160-x. PMC 11139141 . PMID 16003488. S2CID 3343824.
- ^ Ramanathan A, Savol A, Burger V, Chennubhotla CS, Agarwal PK (enero de 2014). "Poblaciones conformacionales de proteínas y subestados funcionalmente relevantes". Accounts of Chemical Research . 47 (1): 149–156. doi :10.1021/ar400084s. OSTI 1565147. PMID 23988159.
- ^ Agrawal D, Budakoti M, Kumar V (septiembre de 2023). "Estrategias y herramientas para la valorización biotecnológica del glicerol a 1,3-propanodiol: desafíos, avances recientes y perspectivas futuras". Avances en biotecnología . 66 : 108177. doi :10.1016/j.biotechadv.2023.108177. PMID 37209955.
- ^ Selvy PE, Lavieri RR, Lindsley CW, Brown HA (octubre de 2011). "Fosfolipasa D: enzimología, funcionalidad y modulación química". Chemical Reviews . 111 (10): 6064–6119. doi :10.1021/cr200296t. PMC 3233269 . PMID 21936578.
- ^ Tsai CJ, Del Sol A, Nussinov R (marzo de 2009). "Alosteria de proteínas, transmisión de señales y dinámica: un esquema de clasificación de mecanismos alostéricos". Molecular BioSystems . 5 (3): 207–216. doi :10.1039/b819720b. PMC 2898650 . PMID 19225609.
- ^ Changeux JP, Edelstein SJ (junio de 2005). "Mecanismos alostéricos de la transducción de señales". Science . 308 (5727): 1424–1428. Bibcode :2005Sci...308.1424C. doi :10.1126/science.1108595. PMID 15933191. S2CID 10621930.
- ^ de Bolster MW (1997). «Glosario de términos utilizados en química bioinorgánica: cofactor». Unión Internacional de Química Pura y Aplicada. Archivado desde el original el 21 de enero de 2017. Consultado el 30 de octubre de 2007 .
- ^ Voet D, Voet J, Pratt C (2016). Fundamentos de bioquímica . Hoboken, Nueva Jersey: John Wiley & Sons, Inc., pág. 336. ISBN 978-1-118-91840-1.
- ^ Chapman-Smith A, Cronan JE (septiembre de 1999). "La biotinilación enzimática de proteínas: una modificación postraduccional de especificidad excepcional". Tendencias en ciencias bioquímicas . 24 (9): 359–363. doi :10.1016/s0968-0004(99)01438-3. PMID 10470036.
- ^ Fisher Z, Hernandez Prada JA, Tu C, Duda D, Yoshioka C, An H, et al. (febrero de 2005). "Caracterización estructural y cinética de la histidina del sitio activo como lanzadera de protones en catálisis por la anhidrasa carbónica II humana". Bioquímica . 44 (4): 1097–1105. doi :10.1021/bi0480279. PMID 15667203.
- ^ ab Wagner AL (1975). Vitaminas y Coenzimas . Krieger Pub Co. ISBN 0-88275-258-8.
- ^ "BRENDA El sistema integral de información enzimática". Universidad Técnica de Braunschweig . Consultado el 23 de febrero de 2015 .
- ^ Törnroth-Horsefield S, Neutze R (diciembre de 2008). "Apertura y cierre de la compuerta de los metabolitos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 105 (50): 19565–19566. Bibcode :2008PNAS..10519565T. doi : 10.1073/pnas.0810654106 . PMC 2604989 . PMID 19073922.
- ^ McArdle WD, Katch F, Katch VL (2006). "Capítulo 9: El sistema pulmonar y el ejercicio". Fundamentos de fisiología del ejercicio (3.ª ed.). Baltimore, Maryland: Lippincott Williams & Wilkins. págs. 312-3. ISBN 978-0781749916.
- ^ Ferguson SJ, Nicholls D, Ferguson S (2002). Bioenergética 3 (3ª ed.). San Diego: Académico. ISBN 0-12-518121-3.
- ^ Bisswanger H (2017). Cinética enzimática: principios y métodos (tercera edición, ampliada y mejorada). Weinheim, Alemania: Wiley-VCH. ISBN 9783527806461.OCLC 992976641 .
- ^ Michaelis L, Menten M (1913). "Die Kinetik der Invertinwirkung" [La cinética de la acción de la invertasa]. Biochem. Z. (en alemán). 49 : 333–369.; Michaelis L, Menten ML, Johnson KA, Goody RS (octubre de 2011). "La constante original de Michaelis: traducción del artículo de Michaelis-Menten de 1913". Bioquímica . 50 (39): 8264–8269. doi :10.1021/bi201284u. PMC 3381512 . PMID 21888353.
- ^ Briggs GE, Haldane JB (1925). "Una nota sobre la cinética de la acción enzimática". The Biochemical Journal . 19 (2): 338–339. doi :10.1042/bj0190338. PMC 1259181 . PMID 16743508.
- ^ Bar-Even A, Noor E, Savir Y, Liebermeister W, Davidi D, Tawfik DS, et al. (mayo de 2011). "La enzima moderadamente eficiente: tendencias evolutivas y fisicoquímicas que configuran los parámetros enzimáticos". Bioquímica . 50 (21): 4402–4410. doi :10.1021/bi2002289. PMID 21506553.
- ^ Ellis RJ (octubre de 2001). "Amontonamiento de macromoléculas: obvio pero poco apreciado". Tendencias en ciencias bioquímicas . 26 (10): 597–604. doi :10.1016/S0968-0004(01)01938-7. PMID 11590012.
- ^ Kopelman R (septiembre de 1988). "Cinética de reacciones fractales". Science . 241 (4873): 1620–1626. Bibcode :1988Sci...241.1620K. doi :10.1126/science.241.4873.1620. PMID 17820893. S2CID 23465446.
- ^ abcd Cornish-Bowden A (2004). Fundamentos de la cinética enzimática (3.ª ed.). Londres: Portland Press. ISBN 1-85578-158-1.
- ^ Price NC (1979). "¿Qué se entiende por 'inhibición competitiva'?". Tendencias en Ciencias Bioquímicas . 4 (11): N272–N273. doi :10.1016/0968-0004(79)90205-6.
- ^ Goodsell DS (1 de agosto de 1999). "La perspectiva molecular: metotrexato". The Oncologist . 4 (4): 340–341. doi : 10.1634/theoncologist.4-4-340 . PMID 10476546.
- ^ Wu P, Clausen MH, Nielsen TE (diciembre de 2015). "Inhibidores alostéricos de moléculas pequeñas de quinasas" (PDF) . Farmacología y terapéutica . 156 : 59–68. doi :10.1016/j.pharmthera.2015.10.002. PMID 26478442. S2CID 1550698.
- ^ Cornish-Bowden A (julio de 1986). "¿Por qué la inhibición no competitiva es tan rara? Una posible explicación, con implicaciones para el diseño de fármacos y pesticidas". FEBS Letters . 203 (1): 3–6. doi :10.1016/0014-5793(86)81424-7. PMID 3720956. S2CID 45356060.
- ^ Strelow JM (enero de 2017). "Una perspectiva sobre la cinética de la inhibición covalente e irreversible". SLAS Discovery . 22 (1): 3–20. doi : 10.1177/1087057116671509 . PMID 27703080.
- ^ Fisher JF, Meroueh SO, Mobashery S (febrero de 2005). "Resistencia bacteriana a los antibióticos betalactámicos: oportunismo convincente, oportunidad convincente". Chemical Reviews . 105 (2): 395–424. doi :10.1021/cr030102i. PMID 15700950.
- ^ ab Johnson DS, Weerapana E, Cravatt BF (junio de 2010). "Estrategias para descubrir y reducir el riesgo de inhibidores enzimáticos covalentes e irreversibles". Future Medicinal Chemistry . 2 (6): 949–964. doi :10.4155/fmc.10.21. PMC 2904065 . PMID 20640225.
- ^ Endo A (noviembre de 1992). "El descubrimiento y desarrollo de inhibidores de la HMG-CoA reductasa". Journal of Lipid Research . 33 (11): 1569–1582. doi : 10.1016/S0022-2275(20)41379-3 . PMID 1464741.
- ^ Wlodawer A, Vondrasek J (1998). "Inhibidores de la proteasa del VIH-1: un gran éxito del diseño de fármacos asistido por estructura". Revisión anual de biofísica y estructura biomolecular . 27 : 249–284. doi :10.1146/annurev.biophys.27.1.249. PMID 9646869. S2CID 10205781.
- ^ Yoshikawa S, Caughey WS (mayo de 1990). "Evidencia infrarroja de unión de cianuro a sitios de hierro y cobre en la citocromo c oxidasa del corazón bovino. Implicaciones con respecto a la reducción de oxígeno". The Journal of Biological Chemistry . 265 (14): 7945–7958. doi : 10.1016/S0021-9258(19)39023-4 . PMID 2159465.
- ^ Jain JL (mayo de 1999). Fundamentos de bioquímica . Nueva Delhi: S. Chand and Co. ISBN 8121903432.OCLC 818809626 .
- ^ Hunter T (enero de 1995). "Proteínas quinasas y fosfatasas: el yin y el yang de la fosforilación y señalización de proteínas". Cell . 80 (2): 225–236. doi : 10.1016/0092-8674(95)90405-0 . PMID 7834742. S2CID 13999125.
- ^ Berg JS, Powell BC, Cheney RE (abril de 2001). "Un censo milenario de miosina". Biología molecular de la célula . 12 (4): 780–794. doi :10.1091/mbc.12.4.780. PMC 32266 . PMID 11294886.
- ^ Meighen EA (marzo de 1991). "Biología molecular de la bioluminiscencia bacteriana". Microbiological Reviews . 55 (1): 123–142. doi :10.1128/MMBR.55.1.123-142.1991. PMC 372803 . PMID 2030669.
- ^ De Clercq E (abril de 2002). "Aspectos destacados en el desarrollo de nuevos agentes antivirales". Mini Reviews in Medicinal Chemistry . 2 (2): 163–175. doi :10.2174/1389557024605474. PMID 12370077.
- ^ Mackie RI, White BA (octubre de 1990). "Avances recientes en la ecología y el metabolismo microbianos del rumen: impacto potencial en la producción de nutrientes". Journal of Dairy Science . 73 (10): 2971–2995. doi : 10.3168/jds.S0022-0302(90)78986-2 . PMID 2178174.
- ^ Rouzer CA, Marnett LJ (abril de 2009). "Ciclooxigenasas: perspectivas estructurales y funcionales". Journal of Lipid Research . 50 (Supl): S29–S34. doi : 10.1194/jlr.R800042-JLR200 . PMC 2674713 . PMID 18952571.
- ^ abcd Suzuki H (2015). "Capítulo 8: Control de la actividad enzimática". Cómo funcionan las enzimas: de la estructura a la función . Boca Raton, FL: CRC Press. pp. 141–69. ISBN 978-981-4463-92-8.
- ^ Doble BW, Woodgett JR (abril de 2003). "GSK-3: trucos del oficio para una quinasa multitarea". Journal of Cell Science . 116 (Pt 7): 1175–1186. doi :10.1242/jcs.00384. PMC 3006448 . PMID 12615961.
- ^ Bennett PM, Chopra I (febrero de 1993). "Base molecular de la inducción de beta-lactamasa en bacterias". Agentes antimicrobianos y quimioterapia . 37 (2): 153–158. doi :10.1128/aac.37.2.153. PMC 187630. PMID 8452343 .
- ^ Skett P, Gibson GG (2001). "Capítulo 3: Inducción e inhibición del metabolismo de fármacos". Introducción al metabolismo de fármacos (3.ª ed.). Cheltenham, Reino Unido: Nelson Thornes Publishers. págs. 87-118. ISBN 978-0748760114.
- ^ Faergeman NJ, Knudsen J (abril de 1997). "Función de los ésteres de acil-CoA grasos de cadena larga en la regulación del metabolismo y en la señalización celular". The Biochemical Journal . 323 (Pt 1): 1–12. doi :10.1042/bj3230001. PMC 1218279 . PMID 9173866.
- ^ Suzuki H (2015). "Capítulo 4: Efecto del pH, la temperatura y la alta presión en la actividad enzimática". Cómo funcionan las enzimas: de la estructura a la función . Boca Raton, FL: CRC Press. págs. 53–74. ISBN 978-981-4463-92-8.
- ^ Noree C, Sato BK, Broyer RM, Wilhelm JE (agosto de 2010). "Identificación de nuevas proteínas formadoras de filamentos en Saccharomyces cerevisiae y Drosophila melanogaster". The Journal of Cell Biology . 190 (4): 541–551. doi :10.1083/jcb.201003001. PMC 2928026 . PMID 20713603.
- ^ Aughey GN, Liu JL (2015). "Regulación metabólica a través de la filamentación enzimática". Critical Reviews in Biochemistry and Molecular Biology . 51 (4): 282–293. doi :10.3109/10409238.2016.1172555. PMC 4915340 . PMID 27098510.
- ^ Kamata K, Mitsuya M, Nishimura T, Eiki J, Nagata Y (marzo de 2004). "Base estructural para la regulación alostérica de la enzima alostérica monomérica glucoquinasa humana". Estructura . 12 (3): 429–438. doi : 10.1016/j.str.2004.02.005 . PMID 15016359.
- ^ Froguel P, Zouali H, Vionnet N, Velho G, Vaxillaire M, Sun F, et al. (marzo de 1993). "Hiperglucemia familiar debida a mutaciones en la glucoquinasa. Definición de un subtipo de diabetes mellitus". The New England Journal of Medicine . 328 (10): 697–702. doi : 10.1056/NEJM199303113281005 . PMID 8433729.
- ^ Okada S, O'Brien JS (agosto de 1969). "Enfermedad de Tay-Sachs: ausencia generalizada de un componente beta-DN-acetilhexosaminidasa". Science . 165 (3894): 698–700. Bibcode :1969Sci...165..698O. doi :10.1126/science.165.3894.698. PMID 5793973. S2CID 8473726.
- ^ "Aprender sobre la enfermedad de Tay-Sachs". Instituto Nacional de Investigación del Genoma Humano de Estados Unidos . Consultado el 1 de marzo de 2015 .
- ^ Erlandsen H, Stevens RC (octubre de 1999). "La base estructural de la fenilcetonuria". Genética molecular y metabolismo . 68 (2): 103–125. doi :10.1006/mgme.1999.2922. PMID 10527663.
- ^ Flatmark T, Stevens RC (agosto de 1999). "Información estructural sobre las hidroxilasas de aminoácidos aromáticos y sus formas mutantes relacionadas con enfermedades". Chemical Reviews . 99 (8): 2137–2160. doi :10.1021/cr980450y. PMID 11849022.
- ^ "Fenilcetonuria". Genes y enfermedades [Internet] . Bethesda (MD): Centro Nacional de Información Biotecnológica (EE. UU.). 1998–2015.
- ^ "Deficiencia de pseudocolinesterasa". Biblioteca Nacional de Medicina de EE. UU . . Consultado el 5 de septiembre de 2013 .
- ^ Fieker A, Philpott J, Armand M (2011). "Terapia de reemplazo enzimático para la insuficiencia pancreática: presente y futuro". Clinical and Experimental Gastroenterology . 4 : 55–73. doi : 10.2147/CEG.S17634 . PMC 3132852 . PMID 21753892.
- ^ Misselwitz B, Pohl D, Frühauf H, Fried M, Vavricka SR, Fox M (junio de 2013). "Malabsorción e intolerancia a la lactosa: patogenia, diagnóstico y tratamiento". United European Gastroenterology Journal . 1 (3): 151–159. doi :10.1177/2050640613484463. PMC 4040760 . PMID 24917953.
- ^ Cleaver JE (mayo de 1968). "Replicación de reparación defectuosa del ADN en xeroderma pigmentosum". Nature . 218 (5142): 652–656. Bibcode :1968Natur.218..652C. doi :10.1038/218652a0. PMID 5655953. S2CID 4171859.
- ^ James WD, Elston D, Berger TG (2011). Enfermedades de la piel de Andrews: dermatología clínica (11.ª ed.). Londres: Saunders/ Elsevier. pág. 567. ISBN 978-1437703146.
- ^ Murzin AG (noviembre de 1993). "¿Pueden las proteínas homólogas desarrollar diferentes actividades enzimáticas?". Tendencias en ciencias bioquímicas . 18 (11): 403–405. doi :10.1016/0968-0004(93)90132-7. PMID 8291080.
- ^ Ochoa D, Bradley D, Beltrao P (febrero de 2018). "Evolución, dinámica y desregulación de la señalización de las quinasas". Current Opinion in Structural Biology . 48 : 133–140. doi :10.1016/j.sbi.2017.12.008. PMID 29316484.
- ^ Renugopalakrishnan V, Garduño-Juárez R, Narasimhan G, Verma CS, Wei X, Li P (noviembre de 2005). "Diseño racional de proteínas térmicamente estables: relevancia para la bionanotecnología". Revista de nanociencia y nanotecnología . 5 (11): 1759–1767. doi :10.1166/jnn.2005.441. PMID 16433409.
- ^ Hult K, Berglund P (agosto de 2003). "Enzimas diseñadas para mejorar la síntesis orgánica". Current Opinion in Biotechnology . 14 (4): 395–400. doi :10.1016/S0958-1669(03)00095-8. PMID 12943848.
- ^ Jiang L, Althoff EA, Clemente FR, Doyle L, Röthlisberger D, Zanghellini A, et al. (Marzo de 2008). "Diseño computacional de novo de enzimas retro-aldólicas". Ciencia . 319 (5868): 1387-1391. Código bibliográfico : 2008 Ciencia... 319.1387J. doi : 10.1126/ciencia.1152692. PMC 3431203 . PMID 18323453.
- ^ ab Sun Y, Cheng J (mayo de 2002). "Hidrolisis de materiales lignocelulósicos para la producción de etanol: una revisión". Bioresource Technology . 83 (1): 1–11. Bibcode :2002BiTec..83....1S. doi :10.1016/S0960-8524(01)00212-7. PMID 12058826.
- ^ ab Kirk O, Borchert TV, Fuglsang CC (agosto de 2002). "Aplicaciones de enzimas industriales". Current Opinion in Biotechnology . 13 (4): 345–351. doi :10.1016/S0958-1669(02)00328-2. PMID 12323357.
- ^ abc Briggs DE (1998). Maltas y malteado (1.ª ed.). Londres: Blackie Academic. ISBN 978-0412298004.
- ^ Dulieu C, Moll M, Boudrant J, Poncelet D (2000). "Mejoras en el rendimiento y el control de la fermentación de la cerveza mediante el uso de la alfa-acetolactato descarboxilasa encapsulada y modelado". Biotechnology Progress . 16 (6): 958–965. doi : 10.1021/bp000128k . PMID 11101321. S2CID 25674881.
- ^ Tarté R (2008). Propiedades, funcionalidad y aplicaciones de los ingredientes de los productos cárnicos . Nueva York: Springer. p. 177. ISBN 978-0-387-71327-4.
- ^ "Chymosin – GMO Database". GMO Compass . Unión Europea. 10 de julio de 2010. Archivado desde el original el 26 de marzo de 2015 . Consultado el 1 de marzo de 2015 .
- ^ Molimard P, Spinnler HE (febrero de 1996). "Revisión: compuestos implicados en el sabor de los quesos madurados en la superficie por moho: orígenes y propiedades". Journal of Dairy Science . 79 (2): 169–184. doi : 10.3168/jds.S0022-0302(96)76348-8 .
- ^ Guzmán-Maldonado H, Paredes-López O (septiembre de 1995). "Enzimas amilolíticas y productos derivados del almidón: una revisión". Critical Reviews in Food Science and Nutrition . 35 (5): 373–403. doi :10.1080/10408399509527706. PMID 8573280.
- ^ ab "Proteasa – Base de datos de OGM". GMO Compass . Unión Europea. 10 de julio de 2010. Archivado desde el original el 24 de febrero de 2015 . Consultado el 28 de febrero de 2015 .
- ^ Alkorta I, Garbisu C, Llama MJ, Serra JL (enero de 1998). "Aplicaciones industriales de enzimas pécticas: una revisión". Process Biochemistry . 33 (1): 21–28. doi :10.1016/S0032-9592(97)00046-0.
- ^ Bajpai P (marzo de 1999). "Aplicación de enzimas en la industria de pulpa y papel". Biotechnology Progress . 15 (2): 147–157. doi :10.1021/bp990013k. PMID 10194388. S2CID 26080240.
- ^ Begley CG, Paragina S, Sporn A (marzo de 1990). "Análisis de limpiadores enzimáticos para lentes de contacto". Revista de la Asociación Estadounidense de Optometría . 61 (3): 190–194. PMID 2186082.
- ^ Farris PL (2009). "Crecimiento económico y organización de la industria del almidón en Estados Unidos". En BeMiller JN, Whistler RL (eds.). Química y tecnología del almidón (3.ª ed.). Londres: Academic. ISBN 9780080926551.
Lectura adicional
|
|

![{\displaystyle {\ce {CO2{}+H2O->[{\text{Anhidrasa carbónica}}]H2CO3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb4c8837b26e96fe552c17d863f93e0618cd998b)
![{\displaystyle {\ce {CO2{}+H2O<-[{\text{Anhidrasa carbónica}}]H2CO3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/618e95485aa1c3c44a29c557ac448ae5b544ff07)







