Aminoacil ARNt sintetasa
| Dominio de unión al anticodón del ARNt | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Leucil-ARNt sintetasa de Thermus thermophilus complejada con un análogo de sustrato de edición posterior a la transferencia | |||||||||
| Identificadores | |||||||||
| Símbolo | Anticodón_2 | ||||||||
| Pfam | PF08264 | ||||||||
| Interprofesional | IPR013155 | ||||||||
| SCOP2 | 1ivs / ALCANCE / SUPFAM | ||||||||
| |||||||||
| Dominio 1 de unión del anticodón DALR | |||||||||
|---|---|---|---|---|---|---|---|---|---|
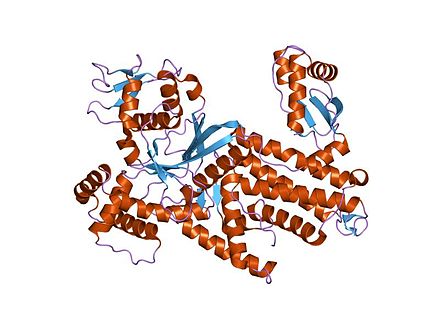 Arginil-trna sintetasa de Thermus thermophilus | |||||||||
| Identificadores | |||||||||
| Símbolo | DALR_1 | ||||||||
| Pfam | PF05746 | ||||||||
| Clan Pfam | CL0258 | ||||||||
| Interprofesional | IPR008909 | ||||||||
| SCOP2 | 1bs2 / ALCANCE / SUPFAM | ||||||||
| |||||||||
| Dominio 2 de unión del anticodón DALR | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estructura cristalina del complejo binario de la cisteinil-ARNt sintetasa con el ARNt Cys | |||||||||
| Identificadores | |||||||||
| Símbolo | DALR_2 | ||||||||
| Pfam | PF09190 | ||||||||
| Clan Pfam | CL0258 | ||||||||
| Interprofesional | IPR015273 | ||||||||
| |||||||||
Una aminoacil-ARNt sintetasa ( aaRS o ARS ), también llamada ARNt-ligasa, es una enzima que une el aminoácido apropiado a su ARNt correspondiente . Lo hace catalizando la transesterificación de un aminoácido cognado específico o su precursor a uno de todos sus ARNt cognados compatibles para formar un aminoacil-ARNt . En los humanos, los 20 tipos diferentes de aa-ARNt son producidos por las 20 aminoacil-ARNt sintetasas diferentes, una para cada aminoácido del código genético .
A esto a veces se le llama "cargar" o "cargar" el ARNt con un aminoácido. Una vez que el ARNt está cargado, un ribosoma puede transferir el aminoácido del ARNt a un péptido en crecimiento , de acuerdo con el código genético. Por lo tanto, el ARNt aminoacil desempeña un papel importante en la traducción del ARN , la expresión de genes para crear proteínas.
Mecanismo
La sintetasa primero une el ATP y el aminoácido correspondiente (o su precursor ) para formar un aminoacilo-adenilato, liberando pirofosfato inorgánico (PPi). Luego, el complejo adenilato-aaRS se une al brazo D de la molécula de ARNt correspondiente y el aminoácido se transfiere desde el aa-AMP al 2' o al 3'-OH del último nucleótido de ARNt (A76) en el extremo 3' .
El mecanismo se puede resumir en la siguiente serie de reacciones:
Sumando las reacciones, la reacción global altamente exergónica es la siguiente:
- Aminoácido + ARNt + ATP → Aminoacil-ARNt + AMP + PPi
Algunas sintetasas también median una reacción de edición para garantizar una alta fidelidad de la carga del ARNt. Si se añade el ARNt incorrecto (es decir, se descubre que el ARNt está cargado incorrectamente), el enlace aminoacilo-ARNt se hidroliza . Esto puede suceder cuando dos aminoácidos tienen propiedades diferentes incluso si tienen formas similares, como es el caso de la valina y la treonina .
La precisión de la aminoacil-ARNt sintetasa es tan alta que a menudo se la asocia con la palabra "superespecificidad" cuando se la compara con otras enzimas que intervienen en el metabolismo. Aunque no todas las sintetasas tienen un dominio con el único propósito de editar, lo compensan al tener una unión y activación específicas de sus aminoácidos afiliados. Otra contribución a la precisión de estas sintetasas es la relación de concentraciones de aminoacil-ARNt sintetasa y su ARNt cognado. Dado que la ARNt sintetasa acila incorrectamente el ARNt cuando se produce en exceso, debe existir un límite en los niveles de aaRS y ARNt in vivo. [1] [2]
Clases
Hay dos clases de aminoacil ARNt sintetasa, cada una compuesta por diez enzimas: [3] [4]
- La clase I tiene dos motivos de secuencia altamente conservados. Se aminoacila en el 2'-OH de un nucleótido de adenosina terminal en el ARNt y suele ser monomérico o dimérico (una o dos subunidades, respectivamente).
- La clase II tiene tres motivos de secuencia altamente conservados. Se aminoacila en el 3'-OH de una adenosina terminal en el ARNt y suele ser dimérica o tetramérica (dos o cuatro subunidades, respectivamente). Aunque la fenilalanina-ARNt sintetasa es de clase II, se aminoacila en el 2'-OH.
Los aminoácidos se unen al grupo hidroxilo (-OH) de la adenosina a través del grupo carboxilo (-COOH).
Independientemente de dónde se una inicialmente el aminoacilo al nucleótido, el 2'- O -aminoacil-ARNt finalmente migrará a la posición 3' a través de la transesterificación .
Las sintetasas de aminoacil-ARNt bacterianas se pueden agrupar de la siguiente manera: [5]
| Clase | Aminoácidos |
|---|---|
| I | Arg, Cys, Gln, Glu, Ile, Leu, Met, Trp, Tyr, Val |
| II | Ala, Asn, Asp, Gly, His, Lys, Pro, Phe, Ser, Thr |
Los aminoácidos que utilizan aaRS de clase II parecen ser evolutivamente más antiguos. [6]


Estructuras
Ambas clases de aminoacil-ARNt sintetasas son proteínas multidominio . En un escenario típico, una aaRS consta de un dominio catalítico (donde tienen lugar ambas reacciones anteriores) y un dominio de unión al anticodón (que interactúa principalmente con la región anticodón del ARNt). Los ARN de transferencia para diferentes aminoácidos difieren no solo en su anticodón sino también en otros puntos, lo que les da configuraciones generales ligeramente diferentes. Las aminoacil-ARNt sintetasas reconocen los ARNt correctos principalmente a través de su configuración general, no solo a través de su anticodón. [7] Además, algunas aaRS tienen dominios de unión al ARN adicionales y dominios de edición [8] que escinden moléculas de aminoacil-ARNt emparejadas incorrectamente.
Se ha descubierto que los dominios catalíticos de todas las aaRS de una clase dada son homólogos entre sí, mientras que las aaRS de clase I y clase II no están relacionadas entre sí. Las aaRS de clase I presentan un pliegue de Rossmann similar al de la citidiltransferasa que se observa en proteínas como la glicerol-3-fosfato citidiltransferasa, la nicotinamida nucleótido adenililtransferasa y la FAD sintasa arqueal, mientras que las aaRS de clase II tienen un pliegue único relacionado con las ligasas de biotina y lipoato.
El dominio de unión del anticodón helicoidal alfa de las sintetasas de ARNt arginil-, glicil- y cisteinil- se conoce como dominio DALR en honor a los aminoácidos conservados característicos . [9]
Se han estudiado cinéticamente las sintetasas de aminoacil-ARNt, demostrando que los iones Mg2 + desempeñan un papel catalítico activo y, por lo tanto, los aaR tienen un grado de dependencia del magnesio. El aumento de la concentración de Mg2 + conduce a un aumento de las constantes de equilibrio para las reacciones de las sintetasas de aminoacil-ARNt. Aunque esta tendencia se observó tanto en las sintetasas de clase I como de clase II, la dependencia del magnesio para las dos clases es muy distinta. Las sintetasas de clase II tienen dos o (más frecuentemente) tres iones Mg2 + , mientras que la clase I solo requiere un ion Mg2 + . [10] [11]
Además de la falta de similitud general en la secuencia y la estructura, las sintetasas de clase I y clase II presentan diferentes mecanismos de reconocimiento de ATP. Mientras que la clase I se une a través de interacciones mediadas por enlaces de hidrógeno de la cadena principal, la clase II utiliza un par de residuos de arginina para establecer puentes salinos con su ligando de ATP. Esta implementación opositora se manifiesta en dos motivos estructurales, los soportes de la cadena principal y las pinzas de arginina, que se observan en todas las estructuras de clase I y clase II, respectivamente. La alta conservación estructural de estos motivos sugiere que deben haber estado presentes desde tiempos antiguos. [12]
Evolución
La mayoría de las aaRS de una determinada especificidad están evolutivamente más próximas entre sí que con las aaRS de otra especificidad. Sin embargo, AsnRS y GlnRS se agrupan dentro de AspRS y GluRS, respectivamente. La mayoría de las aaRS de una determinada especificidad también pertenecen a una única clase. Sin embargo, existen dos versiones distintas de LysRS: una que pertenece a la familia de la clase I y la otra a la de la clase II. [ cita requerida ]
Las filogenias moleculares de las aaRS a menudo no son consistentes con las filogenias organismales aceptadas . Es decir, violan el llamado patrón filogenético canónico mostrado por la mayoría de las otras enzimas para los tres dominios de la vida: Archaea , Bacteria y Eukarya . Además, las filogenias inferidas para las aaRS de diferentes aminoácidos a menudo no concuerdan entre sí. Además, los parálogos de aaRS dentro de la misma especie muestran un alto grado de divergencia entre ellos. Estas son indicaciones claras de que la transferencia horizontal ha ocurrido varias veces durante la historia evolutiva de las aaRS. [13]
La creencia generalizada en la estabilidad evolutiva de esta superfamilia, es decir, que cada organismo posee todos los aaRS para sus aminoácidos correspondientes, es errónea. Un análisis genómico a gran escala de ~2500 genomas procariotas mostró que muchos de ellos carecen de uno o más genes aaRS, mientras que muchos genomas tienen uno o más parálogos. [14] AlaRS, GlyRS, LeuRS, IleRS y ValRS son los miembros más estables evolutivamente de la familia. GluRS, LysRS y CysRS a menudo tienen parálogos, mientras que AsnRS, GlnRS, PylRS y SepRS a menudo están ausentes de muchos genomas.
Con la excepción de AlaRS, se ha descubierto que 19 de las 20 aaRS humanas han añadido al menos un nuevo dominio o motivo. [15] Estos nuevos dominios y motivos varían en función y se observan en varias formas de vida. Una función novedosa común dentro de las aaRS humanas es proporcionar una regulación adicional de los procesos biológicos. Existe una teoría de que el creciente número de aaRS que añaden dominios se debe a la evolución continua de organismos superiores con bloques de construcción y mecanismos biológicos más complejos y eficientes. Una pieza clave de evidencia de esta teoría es que después de que se añade un nuevo dominio a una aaRS, el dominio se integra completamente. La funcionalidad de este nuevo dominio se conserva a partir de ese momento. [16]
A medida que la eficiencia genética evolucionó en organismos superiores, se agregaron 13 nuevos dominios sin una asociación obvia con la actividad catalítica de los genes aaRSs.
Aplicación en biotecnología
En algunas de las aminoacilas ARNt sintetasas, la cavidad que contiene el aminoácido puede ser mutada y modificada para transportar aminoácidos artificiales sintetizados en el laboratorio y unirlos a ARNt específicos. Esto amplía el código genético, más allá de los veinte aminoácidos canónicos que se encuentran en la naturaleza, para incluir también un aminoácido artificial. El aminoácido artificial está codificado por un triplete sin sentido (TAG, TGA, TAA), un codón cuádruple o, en algunos casos, un codón raro redundante. El organismo que expresa la sintetasa mutante puede entonces ser programado genéticamente para incorporar el aminoácido artificial en cualquier posición deseada en cualquier proteína de interés, lo que permite a los bioquímicos o biólogos estructurales investigar o cambiar la función de la proteína. Por ejemplo, uno puede comenzar con el gen de una proteína que se une a una determinada secuencia de ADN y, al dirigir un aminoácido no natural con una cadena lateral reactiva al sitio de unión, crear una nueva proteína que corta el ADN en la secuencia objetivo, en lugar de unirse a él.
Al mutar las sintetasas de ARNt de aminoacil, los químicos han ampliado los códigos genéticos de varios organismos para incluir aminoácidos sintetizados en laboratorio con todo tipo de propiedades útiles: fotorreactivos, quelantes de metales, quelantes de xenón, reticulantes, resonantes de espín, fluorescentes, biotinilados y redox-activos. [17] Otro uso es la introducción de aminoácidos que portan grupos funcionales reactivos para modificar químicamente la proteína objetivo.
Se ha correlacionado la causa de ciertas enfermedades (como patologías neuronales, cáncer, trastornos metabólicos y trastornos autoinmunes) con mutaciones específicas de las aminoacil-ARNt sintetasas. La enfermedad de Charcot-Marie-Tooth (CMT) es el trastorno hereditario más frecuente del sistema nervioso periférico (una enfermedad neuronal) y está causada por una mutación hereditaria en el glicol-ARNt y el tirosil-ARNt. [18] La diabetes, una enfermedad metabólica, induce estrés oxidativo, que desencadena una acumulación de mutaciones mitocondriales del ARNt. También se ha descubierto que las sintetasas del ARNt pueden estar parcialmente implicadas en la etiología del cáncer. [19] Se ha observado un alto nivel de expresión o modificación de aaRS en una variedad de cánceres. Un resultado común de las mutaciones de aaRS es una alteración de la forma/formación del dímero que tiene una relación directa con su función. Estas correlaciones entre las aaRS y ciertas enfermedades han abierto una nueva puerta a la síntesis de terapias. [20]
Dominios no catalíticos
Las nuevas adiciones de dominios a los genes aaRS son acumulativas y progresivas en el Árbol de la Vida . [21] [22] [23] La fuerte presión evolutiva para estos pequeños dominios proteicos no catalíticos sugirió su importancia. [24] Los hallazgos que comenzaron en 1999 y más tarde revelaron una capa previamente no reconocida de la biología: estas proteínas controlan la expresión genética dentro de la célula de origen, y cuando se liberan ejercen un control homeostático y del desarrollo en tipos de células, tejidos y órganos humanos específicos durante el desarrollo adulto o fetal o ambos, incluidas las vías asociadas con la angiogénesis , la inflamación , la respuesta inmune , la señalización del objetivo mecanicista de la rapamicina (mTOR), la apoptosis , la tumorigénesis y la señalización del interferón gamma (IFN - γ ) y p53 . [25] [26] [27] [28] [29] [30] [31] [32] [33]
Agotamiento del sustrato
En 2022, se descubrió que las aminoacil-ARNt sintetasas pueden incorporar aminoácidos alternativos durante la escasez de sus precursores. En particular, la triptofanil -ARNt sintetasa ( WARS1 ) incorporará fenilalanina durante el agotamiento del triptófano, lo que inducirá esencialmente una reasignación del codón W>F . [34] El agotamiento del otro sustrato de las aminoacil-ARNt sintetasas, el ARNt cognado, puede ser relevante para ciertas enfermedades, por ejemplo, la enfermedad de Charcot-Marie-Tooth . Se demostró que las variantes de la glicil-ARNt sintetasa mutante en CMT todavía pueden unirse al ARNt-gly pero no lo liberan, lo que lleva al agotamiento del grupo celular de glicil-ARNt-gly, lo que a su vez resulta en el estancamiento del ribosoma en los codones de glicina durante la traducción del ARNm. [35]
Clínico
Las mutaciones en la enzima mitocondrial se han asociado con una serie de trastornos genéticos, incluidos el síndrome de Leigh , el síndrome de West y el CAGSSS ( cataratas , deficiencia de la hormona del crecimiento , neuropatía sensorial , pérdida auditiva neurosensorial y síndrome de displasia esquelética). [36]
Servidores de predicción
- ICAARS: B. Pawar y GPS Raghava (2010) Predicción y clasificación de aminoacil ARNt sintetasas utilizando dominios PROSITE. BMC Genomics 2010, 11:507
- MARSpred: Panwar B, Raghava GP (mayo de 2012). "Predicción de la localización subcelular de las sintetasas de ARNt a partir de sus estructuras primarias". Aminoácidos . 42 (5): 1703–13. doi :10.1007/s00726-011-0872-8. PMID 21400228. S2CID 2996097.
- Base de datos AARS de procariotas: Chaliotis, et al. (febrero de 2017). "La compleja historia evolutiva de las aminoacil-ARNt sintetasas". Nucleic Acids Res . 45 (3): 1059–1068. doi :10.1093/nar/gkw1182. PMC 5388404 . PMID 28180287.
Véase también
Referencias
- ^ McClain WH (noviembre de 1993). "Reglas que gobiernan la identidad del ARNt en la síntesis de proteínas". Journal of Molecular Biology . 234 (2): 257–80. doi :10.1006/jmbi.1993.1582. PMID 8230212.
- ^ Swanson R, Hoben P, Sumner-Smith M, Uemura H, Watson L, Söll D (diciembre de 1988). "La precisión de la aminoacilación in vivo requiere un equilibrio adecuado de ARNt y aminoacil-ARNt sintetasa". Science . 242 (4885): 1548–51. Bibcode :1988Sci...242.1548S. doi :10.1126/science.3144042. PMID 3144042.
- ^ "Sintetasas de ARNt". Archivado desde el original el 4 de agosto de 2012. Consultado el 18 de agosto de 2007 .
- ^ Delarue, M (1995). "Sintetasas de aminoacil-ARNt". Biología estructural . 5 (1): 48–55. doi :10.1016/0959-440x(95)80008-o. PMID 7773747.
- ^ Voet, Donald; Voet, Judith G. (2011). Bioquímica (4ª ed.). Hoboken, Nueva Jersey: Wiley. ISBN 978-0-470-57095-1.
- ^ Trifonov, E. N (30 de diciembre de 2000). "Orden temporal de consenso de aminoácidos y evolución del código de tripletes". Gene . Artículos presentados en el Taller Anton Dohrn. 261 (1): 139–151. doi :10.1016/S0378-1119(00)00476-5. ISSN 0378-1119. PMID 11164045.
- ^ Schimmel P, Giegé R, Moras D, Yokoyama S (octubre de 1993). "Un código de ARN operativo para aminoácidos y posible relación con el código genético". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 90 (19): 8763–8. Bibcode :1993PNAS...90.8763S. doi : 10.1073/pnas.90.19.8763 . PMC 47440 . PMID 7692438.
- ^ "Molécula del mes: Aminoacil-ARNt sintetasas de alta fidelidad". Archivado desde el original el 20 de octubre de 2013. Consultado el 4 de agosto de 2013 .
- ^ Wolf YI, Aravind L, Grishin NV, Koonin EV (agosto de 1999). "Evolución de las aminoacil-ARNt sintetasas: el análisis de arquitecturas de dominios únicos y árboles filogenéticos revela una historia compleja de eventos de transferencia horizontal de genes". Genome Research . 9 (8): 689–710. doi : 10.1101/gr.9.8.689 . PMID 10447505.
- ^ Airas RK (diciembre de 2007). "Dependencia del magnesio de las constantes de equilibrio medidas de las aminoacil-ARNt sintetasas". Química biofísica . 131 (1–3): 29–35. doi :10.1016/j.bpc.2007.08.006. PMID 17889423.
- ^ Francklyn C, Musier-Forsyth K, Martinis SA (septiembre de 1997). "Aminoacil-ARNt sintetasas en biología y enfermedad: nueva evidencia de diversidad estructural y funcional en una antigua familia de enzimas". ARN . 3 (9): 954–60. PMC 1369542 . PMID 9292495.
- ^ Kaiser F, Bittrich S, Salentin S, Leberecht C, Haupt VJ, Krautwurst S, Schroeder M, Labudde D (abril de 2018). "Los soportes de la estructura principal y las pinzas de arginina delimitan las sintetasas de ARNt aminoacilado de clase I y clase II". PLOS Computational Biology . 14 (4): e1006101. Bibcode :2018PLSCB..14E6101K. doi : 10.1371/journal.pcbi.1006101 . PMC 5919687 . PMID 29659563.
- ^ Woese CR, Olsen GJ, Ibba M, Söll D (marzo de 2000). "Aminoacil-ARNt sintetasas, el código genético y el proceso evolutivo". Microbiology and Molecular Biology Reviews . 64 (1): 202–36. doi :10.1128/MMBR.64.1.202-236.2000. PMC 98992 . PMID 10704480.
- ^ Chaliotis A, Vlastaridis P, Mossialos D, Ibba M, Becker HD, Stathopoulos C, Amoutzias GD (febrero de 2017). "La compleja historia evolutiva de las aminoacil-ARNt sintetasas". Nucleic Acids Research . 45 (3): 1059–1068. doi :10.1093/nar/gkw1182. PMC 5388404 . PMID 28180287.
- ^ Guo M, Yang XL, Schimmel P (septiembre de 2010). "Nuevas funciones de las aminoacil-ARNt sintetasas más allá de la traducción". Nature Reviews Molecular Cell Biology . 11 (9): 668–74. doi :10.1038/nrm2956. PMC 3042954 . PMID 20700144.
- ^ Lee SW, Cho BH, Park SG, Kim S (agosto de 2004). "Complejos de aminoacil-ARNt sintetasa: más allá de la traducción". Journal of Cell Science . 117 (Pt 17): 3725–34. doi : 10.1242/jcs.01342 . PMID 15286174. S2CID 29447608.
- ^ Peter G. Schultz , Ampliando el código genético
- ^ Xie W, Schimmel P, Yang XL (diciembre de 2006). "Cristalización y análisis preliminar de rayos X de una ARNt sintetasa humana nativa cuyas variantes alélicas están asociadas con la enfermedad de Charcot-Marie-Tooth". Acta Crystallographica Sección F. 62 ( Pt 12): 1243–6. doi :10.1107/S1744309106046434. PMC 2225372. PMID 17142907 .
- ^ Kwon NH, Kang T, Lee JY, Kim HH, Kim HR, Hong J, Oh YS, Han JM, Ku MJ, Lee SY, Kim S (diciembre de 2011). "Función dual de la metionil-ARNt sintetasa en la regulación de la traducción y la actividad supresora tumoral de la proteína-3 multifuncional que interactúa con la aminoacil-ARNt sintetasa". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 108 (49): 19635–40. Bibcode :2011PNAS..10819635K. doi : 10.1073/pnas.1103922108 . PMC 3241768 . PMID 22106287.
- ^ Park SG, Schimmel P, Kim S (agosto de 2008). "Aminoacil ARNt sintetasas y sus conexiones con la enfermedad". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 105 (32): 11043–9. Bibcode :2008PNAS..10511043P. doi : 10.1073/pnas.0802862105 . PMC 2516211 . PMID 18682559.
- ^ Ludmerer SW, Schimmel P (agosto de 1987). "Construcción y análisis de deleciones en la extensión amino-terminal de la glutamina ARNt sintetasa de Saccharomyces cerevisiae". The Journal of Biological Chemistry . 262 (22): 10807–13. doi : 10.1016/S0021-9258(18)61035-X . PMID 3301842.
- ^ Eriani G, Delarue M, Poch O, Gangloff J, Moras D (septiembre de 1990). "Partition of tRNA synthetases into two classes based on mutually exclusion sets of sequence patterns" (Partición de las sintetasas de ARNt en dos clases basadas en conjuntos mutuamente excluyentes de motivos de secuencia). Nature . 347 (6289): 203–6. Bibcode :1990Natur.347..203E. doi :10.1038/347203a0. PMID 2203971. S2CID 4324290.
- ^ Cusack S (diciembre de 1997). "Sintetasas de aminoacil-ARNt". Current Opinion in Structural Biology . 7 (6): 881–9. doi :10.1016/s0959-440x(97)80161-3. PMID 9434910.
- ^ Lo WS, Gardiner E, Xu Z, Lau CF, Wang F, Zhou JJ, Mendlein JD, Nangle LA, Chiang KP, Yang XL, Au KF, Wong WH, Guo M, Zhang M, Schimmel P (julio de 2014). "Nulos catalíticos de la ARNt sintetasa humana con diversas funciones". Science . 345 (6194): 328–32. Bibcode :2014Sci...345..328L. doi :10.1126/science.1252943. PMC 4188629 . PMID 25035493.
- ^ Wakasugi K, Schimmel P (abril de 1999). "Two distinct cytokines released from a human aminoacil-tRNA synthetase" (Dos citocinas distintas liberadas de una aminoacil-ARNt sintetasa humana). Science . 284 (5411): 147–51. Bibcode :1999Sci...284..147W. doi :10.1126/science.284.5411.147. PMID 10102815.
- ^ Lareau LF, Green RE, Bhatnagar RS, Brenner SE (junio de 2004). "Los roles evolutivos del empalme alternativo". Current Opinion in Structural Biology . 14 (3): 273–82. doi :10.1016/j.sbi.2004.05.002. PMID 15193306.
- ^ Wakasugi K, Slike BM, Hood J, Otani A, Ewalt KL, Friedlander M, Cheresh DA, Schimmel P (enero de 2002). "Una aminoacil-ARNt sintetasa humana como regulador de la angiogénesis". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 99 (1): 173–7. Bibcode :2002PNAS...99..173W. doi : 10.1073/pnas.012602099 . PMC 117534 . PMID 11773626.
- ^ Tzima E, Reader JS, Irani-Tehrani M, Ewalt KL, Schwartz MA, Schimmel P (enero de 2005). "VE-cadherin vincula la citocina de la ARNt sintetasa a la función antiangiogénica". The Journal of Biological Chemistry . 280 (4): 2405–8. doi : 10.1074/jbc.C400431200 . PMID 15579907. S2CID 6943506.
- ^ Kawahara A, Stainier DY (agosto de 2009). "Actividad no canónica de la ARN sintetasa de transferencia de seril y desarrollo vascular". Tendencias en medicina cardiovascular . 19 (6): 179–82. doi :10.1016/j.tcm.2009.11.001. PMC 2846333 . PMID 20211432.
- ^ Zhou Q, Kapoor M, Guo M, Belani R, Xu X, Kiosses WB, Hanan M, Park C, Armour E, Do MH, Nangle LA, Schimmel P, Yang XL (enero de 2010). "Uso ortogonal de un sitio activo de la ARNt sintetasa humana para lograr multifuncionalidad". Nature Structural & Molecular Biology . 17 (1): 57–61. doi :10.1038/nsmb.1706. PMC 3042952 . PMID 20010843.
- ^ Park SG, Kim HJ, Min YH, Choi EC, Shin YK, Park BJ, Lee SW, Kim S (mayo de 2005). "La sintetasa de lisil-ARNt humana se secreta para desencadenar una respuesta proinflamatoria". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 102 (18): 6356–61. doi : 10.1073/pnas.0500226102 . PMC 1088368 . PMID 15851690.
- ^ Arif A, Jia J, Moodt RA, DiCorleto PE, Fox PL (enero de 2011). "La fosforilación de la glutamil-prolil ARNt sintetasa por la quinasa dependiente de ciclina 5 dicta el control de la traducción selectiva de la transcripción". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 108 (4): 1415–20. Bibcode :2011PNAS..108.1415A. doi : 10.1073/pnas.1011275108 . PMC 3029695 . PMID 21220307.
- ^ Guo M, Schimmel P (marzo de 2013). "Funciones no traduccionales esenciales de las sintetasas de ARNt". Nature Chemical Biology . 9 (3): 145–53. doi :10.1038/nchembio.1158. PMC 3773598 . PMID 23416400.
- ^ Pataskar, Abhijeet; Champagne, Julien; Nagel, Remco; Kenski, Juliana; Laos, Maarja; Michaux, Justine; Pak, Hui Song; Bleijerveld, Onno B.; Mordente, Kelly; Navarro, Jasmine Montenegro; Blommaert, Naomi (9 de marzo de 2022). "El agotamiento del triptófano da como resultado sustituyentes de triptófano a fenilalanina". Nature . 603 (7902): 721–727. Bibcode :2022Natur.603..721P. doi :10.1038/s41586-022-04499-2. ISSN 1476-4687. PMC 8942854 . PMID 35264796.
- ^ Zuko, Amila; Mallik, Moushami; Thompson, Robin; Spaulding, Emily L.; Wienand, Anne R.; Estado, Marije; Tadenev, Abigail LD; van Bakel, Nick; Sijlmans, Céline; Santos, Leonardo A.; Bussmann, Julia; Catinozzi, Marica; Das, Sarada; Kulshrestha, Divita; Burgess, Robert W.; Ignatova, Zoya; Storkebaum, Erik (3 de septiembre de 2021). "La sobreexpresión de ARNt rescata la neuropatía periférica causada por mutaciones en la ARNt sintetasa". Ciencia . 373 (6559): 1161–1166. Código Bib : 2021 Ciencia... 373.1161Z. doi : 10.1126/ciencia.abb3356. ISSN 1095-9203. Número de modelo : PMID 34516840 .
- ^ Vona B, Maroofian R, Bellacchio E, Najafi M, Thompson K, Alahmad A, He L, Ahangari N, Rad A, Shahrokhzadeh S, Bahena P, Mittag F, Traub F, Movaffagh J, Amiri N, Doosti M, Boostani R, Shirzadeh E, Haaf T, Diodato D, Schmidts M, Taylor RW, Karimiani EG (2018). "Ampliando el fenotipo clínico de la enfermedad mitocondrial relacionada con IARS2". BMC Med Genet . 19 (1): 196. doi : 10.1186/s12881-018-0709-3 . PMC 6233262 . PMID 30419932.
Enlaces externos
- Amino+Acyl-tRNA+Synthetases en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Ubicación de genes humanos AARS en el navegador de genoma de la UCSC .
- Detalles de los genes humanos de AARS en el navegador de genoma de la UCSC .
