Fenilalanina
 Fórmula esquelética de la L -fenilalanina | |||
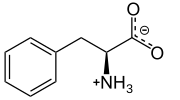 L -Fenilalanina a pH fisiológico | |||
| |||
| Nombres | |||
|---|---|---|---|
| Pronunciación | EE.UU .: / ˌ f ɛ n əl ˈ æ l ə n iː n / ; Reino Unido : / ˌ f iː n aɪ l -/ | ||
| Nombre IUPAC Fenilalanina | |||
| Nombre sistemático de la IUPAC Ácido ( S )-2-amino-3-fenilpropanoico | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Banco de medicamentos | |||
| Tarjeta informativa de la ECHA | 100.000.517 | ||
| |||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C9H11NO2 | |||
| Masa molar | 165,192 g·mol −1 | ||
| 9,97 g/L a 0 °C 14,11 g/L a 25 °C | |||
| Acidez (p K a ) | 1,83 (carboxilo), 9,13 (amino) [2] | ||
| Peligros | |||
| NFPA 704 (rombo cortafuegos) | |||
| Página de datos complementarios | |||
| Fenilalanina (página de datos) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
La fenilalanina (símbolo Phe o F ) [3] es un α- aminoácido esencial con la fórmula C
9yo
11NO
2. Puede verse como un grupo bencilo sustituido por el grupo metilo de la alanina , o un grupo fenilo en lugar de un hidrógeno terminal de la alanina. Este aminoácido esencial se clasifica como neutro y no polar debido a la naturaleza inerte e hidrófoba de la cadena lateral bencilo . El isómero L se utiliza para formar bioquímicamente proteínas codificadas por el ADN . La fenilalanina es un precursor de la tirosina , los neurotransmisores monoamínicos dopamina , norepinefrina (noradrenalina) y epinefrina (adrenalina), y el pigmento biológico melanina . Está codificada por los codones de ARN mensajero UUU y UUC.
La fenilalanina se encuentra de forma natural en la leche de los mamíferos . Se utiliza en la fabricación de alimentos y bebidas y se vende como suplemento nutricional, ya que es un precursor directo del neuromodulador fenetilamina . Como aminoácido esencial, la fenilalanina no se sintetiza de novo en los seres humanos y otros animales, que deben ingerir fenilalanina o proteínas que la contengan.
El símbolo de una letra F se asignó a la fenilalanina por su similitud fonética. [4]
Historia
La primera descripción de la fenilalanina se realizó en 1879, cuando Schulze y Barbieri identificaron un compuesto con la fórmula empírica , C 9 H 11 NO 2 , en plántulas de lupino amarillo ( Lupinus luteus ). En 1882, Erlenmeyer y Lipp sintetizaron por primera vez la fenilalanina a partir de fenilacetaldehído , cianuro de hidrógeno y amoníaco . [5] [6]
El codón genético de la fenilalanina fue descubierto por primera vez por J. Heinrich Matthaei y Marshall W. Nirenberg en 1961. Demostraron que al utilizar ARNm para insertar múltiples repeticiones de uracilo en el genoma de la bacteria E. coli , podían hacer que la bacteria produjera un polipéptido que consistiera únicamente en aminoácidos repetidos de fenilalanina. Este descubrimiento ayudó a establecer la naturaleza de la relación de codificación que vincula la información almacenada en el ácido nucleico genómico con la expresión de proteínas en la célula viva.
Fuentes dietéticas
Las buenas fuentes de fenilalanina son los huevos, el pollo, el hígado, la carne de res, la leche y la soja. [7] Otra fuente común de fenilalanina es cualquier cosa endulzada con el edulcorante artificial aspartamo , como las bebidas dietéticas , los alimentos dietéticos y los medicamentos; el metabolismo del aspartamo produce fenilalanina como uno de los metabolitos del compuesto . [8]
Recomendaciones dietéticas
En 2002, la Junta de Alimentos y Nutrición (FNB) del Instituto de Medicina de los Estados Unidos estableció las Ingestas Dietéticas Recomendadas (IDR) para los aminoácidos esenciales . Para la fenilalanina más tirosina, para adultos de 19 años o más, 33 mg/kg de peso corporal/día. [9] En 2005, la IDR se estableció en 27 mg/kg por día (sin tirosina), la recomendación de la FAO / OMS / UNU de 2007 es de 25 mg/kg por día (sin tirosina). [10]
Otras funciones biológicas
La L -fenilalanina se convierte biológicamente en L - tirosina , otro de los aminoácidos codificados por el ADN. La L -tirosina, a su vez, se convierte en L -DOPA , que a su vez se convierte en dopamina , noradrenalina y epinefrina . Las tres últimas se conocen como catecolaminas .
La fenilalanina utiliza el mismo canal de transporte activo que el triptófano para cruzar la barrera hematoencefálica . En cantidades excesivas, la suplementación puede interferir con la producción de serotonina y otros aminoácidos aromáticos [11], así como de óxido nítrico debido al uso excesivo (eventualmente, disponibilidad limitada) de los cofactores asociados, hierro o tetrahidrobiopterina . [ cita requerida ] Las enzimas correspondientes para esos compuestos son la familia de las hidroxilasas de aminoácidos aromáticos y la óxido nítrico sintasa .
En las plantas
La fenilalanina es el compuesto de partida utilizado en la síntesis de flavonoides . El lignano se deriva de la fenilalanina y de la tirosina . La fenilalanina se convierte en ácido cinámico por acción de la enzima fenilalanina amoniaco-liasa . [15]
Biosíntesis
La fenilalanina se biosintetiza a través de la vía del shikimato .
Fenilcetonuria
El trastorno genético fenilcetonuria (PKU) es la incapacidad de metabolizar la fenilalanina debido a la falta de la enzima fenilalanina hidroxilasa . Las personas con este trastorno se conocen como "fenilcetonúricos" y deben regular su ingesta de fenilalanina. Los fenilcetonúricos suelen utilizar análisis de sangre para controlar la cantidad de fenilalanina en su sangre. Los resultados de laboratorio pueden informar los niveles de fenilalanina utilizando mg/dl y μmol/l. Un mg/dl de fenilalanina equivale aproximadamente a 60 μmol/l.
Una "variante" (rara) de la fenilcetonuria llamada hiperfenilalaninemia es causada por la incapacidad de sintetizar un cofactor llamado tetrahidrobiopterina , que puede suplementarse. Las mujeres embarazadas con hiperfenilalaninemia pueden mostrar síntomas similares al trastorno (niveles altos de fenilalanina en sangre), pero estos indicadores generalmente desaparecerán al final de la gestación. Las mujeres embarazadas con PKU deben controlar sus niveles de fenilalanina en sangre incluso si el feto es heterocigoto para el gen defectuoso porque el feto podría verse afectado negativamente debido a la inmadurez hepática. [ cita médica necesaria ]
Una fuente no alimentaria de fenilalanina es el edulcorante artificial aspartamo . Este compuesto es metabolizado por el cuerpo en varios subproductos químicos, incluida la fenilalanina. Los problemas de descomposición que tienen los fenilcetonúricos con la acumulación de fenilalanina en el cuerpo también ocurren con la ingestión de aspartamo, aunque en menor grado. En consecuencia, todos los productos en Australia, los EE. UU. y Canadá que contienen aspartamo deben estar etiquetados: "Fenilcetonúricos: contiene fenilalanina". En el Reino Unido, los alimentos que contienen aspartamo deben llevar paneles de ingredientes que hagan referencia a la presencia de "aspartamo o E951" [16] y deben estar etiquetados con una advertencia "Contiene una fuente de fenilalanina". En Brasil, la etiqueta "Contém Fenilalanina" (en portugués, "Contiene fenilalanina") también es obligatoria en los productos que lo contienen. Estas advertencias se colocan para ayudar a las personas a evitar dichos alimentos.
D-,yo- yDESCARGAR-fenilalanina
El estereoisómero D -fenilalanina (DPA) se puede producir mediante síntesis orgánica convencional, ya sea como un enantiómero único o como un componente de la mezcla racémica . No participa en la biosíntesis de proteínas , aunque se encuentra en proteínas en pequeñas cantidades, particularmente proteínas envejecidas y proteínas de alimentos que han sido procesadas . Las funciones biológicas de los D -aminoácidos siguen sin estar claras, aunque la D -fenilalanina tiene actividad farmacológica en el receptor 2 de niacina . [17]
La DL -fenilalanina (DLPA) se comercializa como un suplemento nutricional por sus supuestas actividades analgésicas y antidepresivas , que han sido respaldadas por ensayos clínicos. [18] [19] [20] La DL -fenilalanina es una mezcla de D -fenilalanina y L -fenilalanina. La supuesta actividad analgésica de la DL -fenilalanina puede explicarse por el posible bloqueo por parte de la D -fenilalanina de la degradación de encefalinas por la enzima carboxipeptidasa A. [ 21] [22] Las encefalinas actúan como agonistas de los receptores opioides mu y delta , y se sabe que los agonistas de estos receptores producen efectos antidepresivos. [23] El mecanismo de la supuesta actividad antidepresiva de la DL -fenilalanina también puede explicarse en parte por el papel precursor de la L -fenilalanina en la síntesis de los neurotransmisores noradrenalina y dopamina , aunque los ensayos clínicos no han encontrado un efecto antidepresivo de la L -fenilalanina sola. [18] Se cree que los niveles elevados de noradrenalina y dopamina en el cerebro tienen un efecto antidepresivo. La D -fenilalanina se absorbe en el intestino delgado y se transporta al hígado a través de la circulación portal . Una pequeña cantidad de D -fenilalanina parece convertirse en L -fenilalanina. La D -fenilalanina se distribuye a los diversos tejidos del cuerpo a través de la circulación sistémica . Parece atravesar la barrera hematoencefálica con menor eficiencia que la L -fenilalanina, por lo que una pequeña cantidad de una dosis ingerida de D -fenilalanina se excreta en la orina sin penetrar en el sistema nervioso central. [24]
La L -fenilalanina es un antagonista de los canales de calcio Ca 2+ α 2 δ con una Ki de 980 nM. [25]
En el cerebro, la L -fenilalanina es un antagonista competitivo en el sitio de unión de la glicina del receptor NMDA [26] y en el sitio de unión del glutamato del receptor AMPA . [27] En el sitio de unión de la glicina del receptor NMDA, la L -fenilalanina tiene una constante de disociación de equilibrio aparente (K B ) de 573 μM estimada por regresión de Schild [28] que es considerablemente menor que la concentración cerebral de L -fenilalanina observada en la fenilcetonuria humana no tratada . [29] La L -fenilalanina también inhibe la liberación de neurotransmisores en las sinapsis glutamatérgicas en el hipocampo y la corteza con CI 50 de 980 μM, una concentración cerebral observada en la fenilcetonuria clásica , mientras que la D -fenilalanina tiene un efecto significativamente menor. [27]
Síntesis comercial
La L -fenilalanina se produce para aplicaciones médicas, alimentarias y nutricionales, como el aspartamo , en grandes cantidades utilizando la bacteria Escherichia coli , que produce naturalmente aminoácidos aromáticos como la fenilalanina. La cantidad de L -fenilalanina producida comercialmente se ha incrementado mediante ingeniería genética de E. coli , por ejemplo alterando los promotores reguladores o amplificando el número de genes que controlan las enzimas responsables de la síntesis del aminoácido. [30]
Derivados
La boronofenilalanina (BPA) es un derivado dihidroxiborílico de la fenilalanina, utilizado en la terapia de captura de neutrones .
La 4-azido- L -fenilalanina es un aminoácido no natural incorporado a la proteína que se utiliza como herramienta para la bioconjugación en el campo de la biología química .
Referencias
- ^ ab Ihlefeldt FS, Pettersen FB, von Bonin A, Zawadzka M, Görbitz PC (2014). "Los polimorfos de L-fenilalanina". Angélica. Química. Int. Ed. 53 (49): 13600–13604. doi :10.1002/anie.201406886. PMID 25336255.
- ^ Dawson RM, et al. (1959). Datos para la investigación bioquímica . Oxford: Clarendon Press.
- ^ "Nomenclatura y simbolismo de aminoácidos y péptidos". Comisión Conjunta IUPAC-IUB sobre Nomenclatura Bioquímica. 1983. Archivado desde el original el 9 de octubre de 2008. Consultado el 5 de marzo de 2018 .
- ^ "Comisión IUPAC-IUB sobre nomenclatura bioquímica: una notación de una letra para secuencias de aminoácidos". Journal of Biological Chemistry . 243 (13): 3557–3559. 10 de julio de 1968. doi : 10.1016/S0021-9258(19)34176-6 .
- ^ Thorpe TE (1913). Diccionario de química aplicada. Longmans, Green y Co., págs. 191-193 . Consultado el 4 de junio de 2012 .
- ^ Plimmer RH (1912) [1908]. Plimmer RH, Hopkins FG (eds.). La composición química de las proteínas. Monografías sobre bioquímica. Vol. Parte I. Análisis (2.ª ed.). Londres: Longmans, Green and Co. pp. 93–97 . Consultado el 4 de junio de 2012 .
- ^ Ross HM, Roth J (1 de abril de 1991). La dieta para el control del estado de ánimo: 21 días para vencer la depresión y la fatiga. Simon & Schuster. pág. 59. ISBN 978-0-13-590449-7.
- ^ Zeratsky K. "Fenilalanina en refrescos dietéticos: ¿es dañina?". Mayo Clinic . Consultado el 30 de abril de 2019 .
- ^ Instituto de Medicina (2002). "Proteínas y aminoácidos". Ingestas dietéticas de referencia para energía, carbohidratos, fibra, grasas, ácidos grasos, colesterol, proteínas y aminoácidos . Washington, DC: The National Academies Press. págs. 589–768. doi :10.17226/10490. ISBN. 978-0-309-08525-0.
- ^ Elango R, Ball RO, Pencharz PB (agosto de 2012). "Avances recientes en la determinación de los requerimientos de proteínas y aminoácidos en humanos". British Journal of Nutrition . 108 (S2): S22–S30. doi : 10.1017/S0007114512002504 . ISSN 0007-1145. PMID 23107531.
- ^ Eriksson JG, Guzzardi MA, Iozzo P, Kajantie E, Kautiainen H, Salonen MK (1 de enero de 2017). "Una concentración más alta de fenilalanina sérica se asocia con un acortamiento más rápido de los telómeros en los hombres". The American Journal of Clinical Nutrition . 105 (1): 144–150. doi : 10.3945/ajcn.116.130468 . ISSN 0002-9165. PMID 27881392.
- ^ Broadley KJ (marzo de 2010). "Los efectos vasculares de las trazas de aminas y anfetaminas". Farmacología y terapéutica . 125 (3): 363–375. doi :10.1016/j.pharmthera.2009.11.005. PMID 19948186.
- ^ Lindemann L, Hoener MC (mayo de 2005). "Un renacimiento de las aminas traza inspirado en una nueva familia de GPCR". Tendencias en ciencias farmacológicas . 26 (5): 274–281. doi :10.1016/j.tips.2005.03.007. PMID 15860375.
- ^ Wang X, Li J, Dong G, Yue J (febrero de 2014). "Los sustratos endógenos del CYP2D cerebral". Revista Europea de Farmacología . 724 : 211–218. doi :10.1016/j.ejphar.2013.12.025. PMID 24374199.
- ^ Nelson DL, Cox MM (2000). Lehninger, Principios de bioquímica (3.ª ed.). Nueva York: Worth Publishing. ISBN 1-57259-153-6.
- ^ "Aspartamo". Reino Unido: Agencia de Normas Alimentarias. Archivado desde el original el 21 de febrero de 2012. Consultado el 19 de junio de 2007 .
- ^ "D-Fenilalanina: Actividad biológica". Guía de FARMACOLOGÍA de la IUPHAR/BPS . Consultado el 27 de diciembre de 2018 .
- ^ ab Wood DR, Reimherr FW, Wender PH (1985). "Tratamiento del trastorno por déficit de atención con DL-fenilalanina". Investigación en psiquiatría . 16 (1). Elsevier BV: 21–26. doi :10.1016/0165-1781(85)90024-1. ISSN 0165-1781. PMID 3903813. S2CID 3077060.
- ^ Beckmann H, Strauss MA, Ludolph E (1977). "DL-fenilalanina en pacientes deprimidos: un estudio abierto". Revista de transmisión neuronal . 41 (2–3). Springer Science and Business Media LLC: 123–134. doi :10.1007/bf01670277. ISSN 0300-9564. PMID 335027. S2CID 5849451.
- ^ Beckmann H, Atenas D, Olteanu M, Zimmer R (1979). "DL-fenilalanina versus imipramina: un estudio controlado doble ciego". Archiv für Psychiatrie und Nervenkrankheiten . 227 (1). Springer Science y Business Media LLC: 49–58. doi :10.1007/bf00585677. ISSN 0003-9373. PMID 387000. S2CID 23531579.
- ^ "D-fenilalanina: datos clínicos". Guía de farmacología de la IUPHAR/BPS . Consultado el 27 de diciembre de 2018 .
- ^ Christianson DW , Mangani S, Shoham G, Lipscomb WN (agosto de 1989). "Unión de D-fenilalanina y D-tirosina a la carboxipeptidasa A" (PDF) . The Journal of Biological Chemistry . 264 (22): 12849–12853. doi : 10.1016/S0021-9258(18)51564-7 . PMID 2568989.
- ^ Jelen LA, Stone JM, Young AH, Mehta MA (2022). "El sistema opioide en la depresión". Neuroscience & Biobehavioral Reviews . 140 . Elsevier BV: 104800. doi : 10.1016/j.neubiorev.2022.104800 . ISSN 0149-7634. PMC 10166717 . PMID 35914624. S2CID 251163234.
- ^ Lehmann WD, Theobald N, Fischer R, Heinrich HC (14 de marzo de 1983). "Estereoespecificidad de la cinética plasmática de la fenilalanina y la hidroxilación en el hombre tras la aplicación oral de una mezcla pseudoracémica marcada con isótopos estables de L- y D-fenilalanina". Clinica Chimica Acta; Revista internacional de química clínica . 128 (2–3): 181–198. doi :10.1016/0009-8981(83)90319-4. ISSN 0009-8981. PMID 6851137.
- ^ Mortell KH, Anderson DJ, Lynch JJ, Nelson SL, Sarris K, McDonald H, et al. (marzo de 2006). "Relaciones estructura-actividad de los ligandos de alfa-aminoácidos para la subunidad alfa2delta de los canales de calcio dependientes de voltaje". Bioorganic & Medicinal Chemistry Letters . 16 (5): 1138–4111. doi :10.1016/j.bmcl.2005.11.108. PMID 16380257.
- ^ Glushakov AV, Dennis DM, Morey TE, Sumners C, Cucchiara RF, Seubert CN, et al. (2002). "Inhibición específica de la función del receptor de N-metil-D-aspartato en neuronas del hipocampo de ratas por L-fenilalanina en concentraciones observadas durante la fenilcetonuria". Molecular Psychiatry . 7 (4): 359–367. doi : 10.1038/sj.mp.4000976 . PMID 11986979.
- ^ ab Glushakov AV, Dennis DM, Sumners C, Seubert CN, Martynyuk AE (abril de 2003). "La L-fenilalanina deprime selectivamente las corrientes en las sinapsis excitatorias glutamatérgicas". Journal of Neuroscience Research . 72 (1): 116–124. doi :10.1002/jnr.10569. PMID 12645085. S2CID 42087834.
- ^ Glushakov AV, Glushakova O, Varshney M, Bajpai LK, Sumners C, Laipis PJ, et al. (febrero de 2005). "Cambios a largo plazo en la transmisión sináptica glutamatérgica en la fenilcetonuria". Brain . 128 (Pt 2): 300–307. doi : 10.1093/brain/awh354 . PMID 15634735.
- ^ Möller HE, Weglage J, Bick U, Wiedermann D, Feldmann R, Ullrich K (diciembre de 2003). "Imágenes cerebrales y espectroscopia de resonancia magnética de protones en pacientes con fenilcetonuria". Pediatría . 112 (6 Pt 2): 1580–1583. doi :10.1542/peds.112.S4.1580. hdl : 11858/00-001M-0000-0010-A24A-C . PMID 14654669. S2CID 2198040.
- ^ Sprenger GA (2007). "Aminoácidos aromáticos". Biosíntesis de aminoácidos: vías, regulación e ingeniería metabólica (1.ª ed.). Springer. págs. 106-113. ISBN 978-3-540-48595-7.
Enlaces externos
- Espectro de masas de fenilalanina
- Fenilalanina en ChemSynthesis