Doxorrubicina
 | |
 | |
| Datos clínicos | |
|---|---|
| Pronunciación | / ˌdɒksəˈruːbɪsɪn / |
| Nombres comerciales | Adriamicina, Caelyx, [1] Myocet, [2] otros |
| Biosimilares | Liposomal pegilado con zolsketil, [3] Liposomal pegilado con celdoxoma [4] |
| AHFS / Drogas.com | Monografía |
| MedlinePlus | a682221 |
| Datos de licencia | |
Categoría de embarazo |
|
| Vías de administración | intravenoso , intravesical |
| Código ATC |
|
| Estatus legal | |
| Estatus legal | |
| Datos farmacocinéticos | |
| Biodisponibilidad | 5% (por vía oral) |
| Unión de proteínas | 75% [8] |
| Metabolismo | Hígado |
| Vida media de eliminación | Trifásica; 12 minutos, 3,3 horas, 30 horas. Media: 1–3 horas [8] [9] |
| Excreción | Orina (5–12%), heces (40–50%) [8] |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Unión Internacional para la Investigación y el Desarrollo (IUPHAR)/BPS |
|
| Banco de medicamentos | |
| Araña química | |
| UNIVERSIDAD |
|
| BARRIL | |
| EBICh | |
| Química biológica | |
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.041.344 |
| Datos químicos y físicos | |
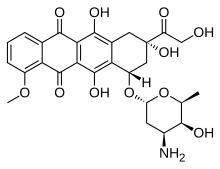
| Fórmula | C27H29NO11 |
| Masa molar | 543,525 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
 norte norte Y (¿que es esto?) (verificar) Y (¿que es esto?) (verificar) | |
La doxorrubicina , que se vende bajo la marca Adriamycin, entre otras, es un medicamento de quimioterapia que se usa para tratar el cáncer . [10] Esto incluye el cáncer de mama , el cáncer de vejiga , el sarcoma de Kaposi , el linfoma y la leucemia linfocítica aguda . [10] A menudo se usa junto con otros agentes de quimioterapia . [10] La doxorrubicina se administra mediante inyección en una vena . [10]
Los efectos secundarios comunes incluyen pérdida de cabello , supresión de la médula ósea , vómitos , sarpullido e inflamación de la boca . [10] Otros efectos secundarios graves pueden incluir reacciones alérgicas como anafilaxia , daño cardíaco , daño tisular en el lugar de la inyección, recuerdo de la radiación y leucemia relacionada con el tratamiento . [10] Las personas a menudo experimentan una decoloración roja de la orina durante unos días. [10] La doxorrubicina pertenece a la familia de medicamentos antibióticos antitumorales y antraciclinas . [10] Funciona en parte interfiriendo con la función del ADN . [11]
La doxorrubicina fue aprobada para uso médico en los Estados Unidos en 1974. [10] Está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud . [12] [13] También hay versiones pegiladas y en liposomas ; sin embargo, son más caras. [13] La doxorrubicina se fabricó originalmente a partir de la bacteria Streptomyces peucetius . [14]
Usos médicos
En la UE, la doxorrubicina liposomal pegilada (como Caelyx) está indicada para tratar el cáncer de mama, el cáncer de ovario y el sarcoma de Kaposi relacionado con el SIDA. Está indicada para tratar el mieloma múltiple en combinación con bortezomib . [1] La doxorrubicina hidrocloruro (como Myocet liposomal) está indicada para tratar el cáncer de mama en combinación con ciclofosfamida . [2]
La doxorrubicina se usa comúnmente para tratar algunas leucemias y linfomas , así como cánceres de vejiga , mama , estómago , pulmón , ovarios , tiroides , sarcoma de tejidos blandos , así como fibromatosis agresiva (tumor desmoide), mieloma múltiple y otros. [9] [15] [16] Los regímenes que contienen doxorrubicina comúnmente utilizados son AC (adriamicina, ciclofosfamida ), TAC ( taxotere , AC), ABVD (adriamicina, bleomicina , vinblastina , dacarbazina ), BEACOPP , CHOP (ciclofosfamida, hidroxidaunorrubicina, vincristina , prednisona ) y FAC ( 5-fluorouracilo , adriamicina, ciclofosfamida). [9] Su actividad es inhibida por ciertos extractos de plantas antioxidantes, por ejemplo, extracto acuoso de Tragia volubilis . [17]
Doxil (ver más abajo) se utiliza principalmente para el tratamiento del cáncer de ovario cuando la enfermedad ha progresado o reaparecido después de una quimioterapia basada en platino , o para el tratamiento del sarcoma de Kaposi relacionado con el SIDA . [18]
Efectos secundarios
Cardiotoxicidad
El efecto secundario más peligroso de la doxorrubicina es la miocardiopatía dilatada , que conduce a insuficiencia cardíaca congestiva . La tasa de miocardiopatía depende de su dosis acumulada, con una incidencia de alrededor del 4% cuando la dosis de doxorrubicina es de 500-550 mg/m 2 , del 18% cuando la dosis es de 551-600 mg/m 2 y del 36% cuando la dosis supera los 600 mg/m 2 . [19] Hay varias formas en las que se cree que la doxorrubicina causa miocardiopatía, incluido el estrés oxidativo , la regulación negativa de los genes de las proteínas contráctiles y la apoptosis mediada por p53 . [19]
La miocardiopatía inducida por doxorrubicina generalmente produce una miocardiopatía dilatada, con agrandamiento de las cuatro cámaras cardíacas. [20] Esto produce disfunción sistólica y diastólica. [20] Finalmente, puede producirse insuficiencia cardíaca, que conlleva una tasa de mortalidad del 50%. [20] Hasta 2010, no existía ningún tratamiento eficaz contra la miocardiopatía establecida causada por el fármaco. [20] El fármaco dexrazoxano puede utilizarse para disminuir el riesgo de cardiotoxicidad por doxorrubicina en ciertos casos. [21]
Otro
Otra complicación común y potencialmente fatal de la doxorrubicina es la tiflitis , una inflamación aguda del intestino que pone en peligro la vida. [22] Además, algunas personas pueden desarrollar eritrodisestesia palmoplantar (EPP), caracterizada por erupciones cutáneas en las palmas de las manos o las plantas de los pies, hinchazón, dolor y eritema . [18] Debido a estos efectos secundarios y a su color rojo, la doxorrubicina se ha ganado el apodo de "diablo rojo" [23] [24] o "muerte roja". [25]
La quimioterapia puede provocar la reactivación de la hepatitis B , y los regímenes que contienen doxorrubicina no son una excepción. [26] [27]
La doxorrubicina y varios fármacos quimioterapéuticos (incluida la ciclofosfamida) pueden provocar una pérdida de la pigmentación de la piel . [28]
Formulaciones liposomales
Existe una forma de doxorrubicina encapsulada en liposomas (recubierta con polietilenglicol) pegilada , desarrollada para tratar el sarcoma de Kaposi . El recubrimiento de polietilenglicol da como resultado una concentración preferencial de doxorrubicina en la piel. Sin embargo, esto también produce un efecto secundario llamado eritrodisestesia palmoplantar (EPP), más comúnmente conocida como síndrome mano-pie.
Tras la administración de esta forma de doxorrubicina, pequeñas cantidades del fármaco pueden filtrarse de los capilares de las palmas de las manos y las plantas de los pies. El resultado de esta filtración es enrojecimiento, sensibilidad y descamación de la piel que puede resultar incómoda e incluso dolorosa. En pruebas clínicas con una dosis de 50 mg/m2 cada cuatro semanas, la mitad de las personas desarrollaron el síndrome mano-pie. La tasa de este efecto secundario limita la dosis de esta formulación que se puede administrar en comparación con la doxorrubicina simple en el mismo régimen de tratamiento, lo que limita la posible sustitución. La sustitución sería deseable porque la doxorrubicina encapsulada en liposomas es menos cardiotóxica que la doxorrubicina no encapsulada. Esta forma encapsulada en liposomas también está aprobada por la FDA para el tratamiento del cáncer de ovario y el mieloma múltiple. [29] [30]
Una doxorrubicina liposomal no pegilada, llamada Myocet, está aprobada en la Unión Europea y en Canadá para el tratamiento del cáncer de mama metastásico en combinación con ciclofosfamida [2] , pero no ha sido aprobada por la FDA para su uso en los Estados Unidos. A diferencia de Doxil, el liposoma Myocet no tiene un recubrimiento de polietilenglicol y, por lo tanto, no da como resultado la misma tasa de EPP. La minimización de este efecto secundario puede permitir la sustitución uno por uno (1:1) con doxorrubicina en el mismo régimen de tratamiento, mejorando así la seguridad sin pérdida de eficacia. Al igual que Doxil, la encapsulación liposomal de la doxorrubicina limita la cardiotoxicidad. En teoría, al limitar la cardiotoxicidad de la doxorrubicina a través de la encapsulación liposomal, se puede utilizar de forma segura en combinación concurrente con otros fármacos de quimioterapia cardiotóxicos, como trastuzumab . La FDA ha emitido una advertencia de recuadro negro que indica que el trastuzumab no se puede utilizar en combinación concurrente con doxorrubicina, sino solo en combinación secuencial. Aunque la combinación concurrente de trastuzumab y doxorrubicina en estudios clínicos demostró una respuesta tumoral superior, la combinación produjo cardiotoxicidad inaceptable, incluido el riesgo de insuficiencia cardíaca que se manifiesta como insuficiencia cardíaca congestiva (ICC). Los resultados publicados del estudio de fase II han demostrado que Myocet, trastuzumab y paclitaxel se pueden utilizar de forma concurrente de forma segura sin riesgo cardíaco, medido por la reducción de la función de la fracción de eyección del ventrículo izquierdo (FEVI) , al tiempo que se logra una respuesta tumoral superior. Este hallazgo es la base del ensayo de fase III en curso para la aprobación de la FDA. [29]
Biosíntesis
La doxorrubicina (DXR) es una versión 14- hidroxilada de la daunorrubicina , el precursor inmediato de la DXR en su vía biosintética .
La daunorrubicina se encuentra más abundantemente como un producto natural porque es producida por varias cepas de tipo salvaje diferentes de Streptomyces . Por el contrario, inicialmente solo se descubrió que una especie no salvaje conocida , Streptomyces peucetius subespecie cesius ATCC 27952, era capaz de producir la doxorrubicina más ampliamente utilizada. [31] Esta cepa fue creada por Arcamone et al. en 1969 mutando una cepa que producía daunorrubicina, pero no DXR, al menos en cantidades detectables. [32] Posteriormente, el grupo de Hutchinson demostró que en condiciones ambientales especiales, o mediante la introducción de modificaciones genéticas , otras cepas de Streptomyces pueden producir doxorrubicina. [33] Su grupo también clonó muchos de los genes necesarios para la producción de DXR, aunque no todos ellos han sido completamente caracterizados. En 1996, el grupo de Strohl descubrió, aisló y caracterizó el dox A, el gen que codifica la enzima que convierte la daunorrubicina en DXR. [34]
En 1999, produjeron dox A recombinante, una oxidasa del citocromo P450 , y descubrieron que cataliza múltiples pasos en la biosíntesis de DXR , incluidos los pasos que conducen a la daunorrubicina. [35] Esto fue significativo porque quedó claro que todas las cepas productoras de daunorrubicina tienen los genes necesarios para producir DXR, el mucho más importante terapéuticamente de los dos. El grupo de Hutchinson continuó desarrollando métodos para mejorar el rendimiento de DXR, a partir del proceso de fermentación utilizado en su producción comercial, no solo introduciendo plásmidos codificadores de dox A , sino también introduciendo mutaciones para desactivar enzimas que desvían los precursores de DXR a productos menos útiles, por ejemplo, glicósidos similares a la baumicina . [31] Algunos mutantes triples, que también sobreexpresaron dox A, pudieron duplicar el rendimiento de DXR. Esto tiene un interés más que académico, porque en ese momento el DXR costaba alrededor de 1,37 millones de dólares por kg y la producción actual en 1999 era de 225 kg por año. [36]
Las técnicas de producción más eficientes han reducido el precio a 1,1 millones de dólares por kg para la formulación no liposomal . Aunque el DXR se puede producir de forma semisintética a partir de daunorrubicina, el proceso implica bromación electrofílica y múltiples pasos, y el rendimiento es bajo. [37] Dado que la daunorrubicina se produce por fermentación , sería ideal que las bacterias pudieran completar la síntesis de DXR de forma más eficaz.
Mecanismo de acción

La doxorrubicina interactúa con el ADN por intercalación e inhibición de la biosíntesis macromolecular . [11] [39] [40] Esto inhibe la progresión de la topoisomerasa II , una enzima que relaja las superenrollaciones en el ADN para la transcripción . [41] La doxorrubicina estabiliza el complejo de la topoisomerasa II después de que ha roto la cadena de ADN para la replicación, evitando que se libere la doble hélice del ADN y deteniendo así el proceso de replicación . [11] También puede aumentar la producción de radicales libres de tipo quinona, contribuyendo así a su citotoxicidad. [15]
La porción cromófora aromática plana de la molécula se intercala entre dos pares de bases del ADN, mientras que el azúcar daunosamina de seis miembros se ubica en el surco menor e interactúa con los pares de bases flanqueantes inmediatamente adyacentes al sitio de intercalación, como lo evidencian varias estructuras cristalinas. [38] [42]
Por intercalación , la doxorrubicina también puede inducir la expulsión de histonas de la cromatina transcripcionalmente activa . [43] [44] Como resultado, la respuesta al daño del ADN , el epigenoma y el transcriptoma se desregulan en las células expuestas a la doxorrubicina. [43]
Historia

En la década de 1950, una empresa de investigación italiana, Farmitalia Research Laboratories, inició un esfuerzo organizado para encontrar compuestos anticancerígenos a partir de microbios del suelo. Se aisló una muestra de suelo del área que rodea el Castel del Monte , un castillo del siglo XIII. Se aisló una nueva cepa de Streptomyces peucetius , que producía un pigmento rojo, y un antibiótico de esta bacteria fue eficaz contra los tumores en ratones. Dado que un grupo de investigadores franceses descubrió el mismo compuesto aproximadamente al mismo tiempo, los dos equipos llamaron al compuesto daunorrubicina , combinando el nombre Dauni , una tribu prerromana que ocupaba el área de Italia donde se aisló el compuesto, con la palabra francesa para rubí , rubis , que describe el color. [45] [46] [47] Los ensayos clínicos comenzaron en la década de 1960 y el fármaco tuvo éxito en el tratamiento de la leucemia aguda y el linfoma. Sin embargo, en 1967, se reconoció que la daunorrubicina podía provocar una toxicidad cardíaca mortal. [48]
Los investigadores de Farmitalia pronto descubrieron que se podían realizar cambios en la actividad biológica mediante cambios menores en la estructura del compuesto. Se mutó una cepa de Streptomyces utilizando N -nitroso- N -metil uretano, y esta nueva cepa produjo un antibiótico diferente, de color rojo. Llamaron a este nuevo compuesto Adriamicina, en honor al mar Adriático , y el nombre se cambió más tarde a doxorrubicina para ajustarse a la convención de nomenclatura establecida. [32] La doxorrubicina mostró una mejor actividad que la daunorrubicina contra los tumores de ratón, y especialmente los tumores sólidos. También mostró un índice terapéutico más alto , pero la cardiotoxicidad permaneció. [49]
La doxorrubicina y la daunorrubicina juntas pueden considerarse compuestos prototipo para las antraciclinas . Investigaciones posteriores han dado lugar a muchos otros antibióticos antraciclínicos o análogos, y ahora hay más de 2000 análogos conocidos de la doxorrubicina. En 1991, 553 de ellos habían sido evaluados en el programa de detección del Instituto Nacional del Cáncer (NCI). [45] En 2016, la FDA de EE. UU. le otorgó al GPX-150 la designación de medicamento huérfano . [50]
Sociedad y cultura
Estatus legal
El 24 de marzo de 2022, el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA) adoptó un dictamen positivo, recomendando la concesión de una autorización de comercialización para el medicamento Zolsketil pegylated liposomal, destinado al tratamiento del cáncer de mama metastásico, el cáncer de ovario avanzado, el mieloma múltiple progresivo y el sarcoma de Kaposi relacionado con el sida. [51] El solicitante de este medicamento es Accord Healthcare SLU [51] Zolsketil pegylated liposomal es un medicamento híbrido de Adriamycin. [51] Contiene el mismo principio activo que Adriamycin, pero está disponible en una formulación liposomal pegilada. [51] Zolsketil pegylated liposomal fue aprobado para uso médico en la Unión Europea en mayo de 2022. [3] [52]
El 21 de julio de 2022, el CHMP adoptó un dictamen positivo, recomendando la concesión de una autorización de comercialización para el medicamento Celdoxome pegylated liposomal, destinado al tratamiento del cáncer de mama metastásico, el cáncer de ovario avanzado, el mieloma múltiple progresivo y el sarcoma de Kaposi relacionado con el sida. [53] El solicitante de este medicamento es YES Pharmaceutical Development Services GmbH. [53] Celdoxome pegylated liposomal es un medicamento híbrido de Adriamycin que está autorizado en la UE desde el 24 de octubre de 1979. [53] Celdoxome pegylated liposomal contiene el mismo principio activo que Adriamycin, pero está disponible en una formulación de liposomal pegilado. [53] Celdoxome pegylated liposomal fue aprobado para uso médico en la Unión Europea en septiembre de 2022. [4]
Nombres
También se conoce como hidroxidaunorrubicina e hidroxidaunomicina. [54]
Se vende bajo varias marcas diferentes, incluidas Adriamycin PFS, Adriamycin RDF o Rubex. [9]
Formulaciones
La doxorrubicina es fotosensible y los envases suelen estar cubiertos por una bolsa de aluminio y/o papel encerado marrón para evitar que la luz la afecte. [9] La doxorrubicina también está disponible en formas encapsuladas en liposomas como Doxil (forma pegilada ), Myocet (forma no pegilada) y Caelyx, [1] que también se administran mediante inyección intravenosa. [9]
La FDA aprobó la primera versión genérica de Doxil, fabricada por Sun, en febrero de 2013. [55]
Investigación
Los experimentos de terapia combinada con sirolimus (rapamicina) y doxorrubicina han demostrado ser prometedores en el tratamiento de linfomas Akt -positivos en ratones. [56]
Además, la liberación de adriamicina fotoactivada con la ayuda de una antena óptica nanoporosa tuvo como resultado un efecto anticancerígeno significativo en las células de cáncer de mama MCF-7. [57] En 2006, una investigación con animales que combinó un anticuerpo monoclonal murino con doxorrubicina creó un inmunoconjugado que pudo eliminar la infección por VIH-1 en ratones. [58] [59]
Actividad antipalúdica
Existen algunas evidencias de la actividad antipalúdica de la doxorrubicina y compuestos similares. En 2009, se descubrió que un compuesto de estructura similar a la doxorrubicina inhibe la plasmepsina II, una enzima exclusiva del parásito de la malaria Plasmodium falciparum . [60] La compañía farmacéutica GlaxoSmithKline (GSK) identificó posteriormente la doxorrubicina en un conjunto de compuestos que inhiben el crecimiento del parásito. [61]
Fluorescencia
También se sabe que la doxorrubicina es fluorescente, lo que se ha utilizado a menudo para caracterizar las concentraciones de doxorrubicina y ha abierto la posibilidad de utilizar la molécula como agente teranóstico . Sin embargo, existen limitaciones significativas, ya que se sabe que el espectro de fluorescencia de la doxorrubicina depende de una variedad de factores, incluido el pH del entorno, la constante dieléctrica del disolvente y otros. La fluorescencia de la doxorrubicina se extingue mediante la unión al ADN y se protege mediante la encapsulación micelar. También se sabe que se autoextingue en altas concentraciones. Por el contrario, la unión a histonas amplifica la fluorescencia. [62] [63]
Referencias
- ^ abcd «Caelyx pegylated liposomal EPAR». Agencia Europea de Medicamentos (EPAR) . 17 de septiembre de 2018. Archivado desde el original el 21 de junio de 2022. Consultado el 20 de junio de 2022 .
- ^ abcd «Myocet liposomal EPAR». Agencia Europea de Medicamentos . 17 de septiembre de 2018. Archivado desde el original el 25 de febrero de 2022. Consultado el 20 de junio de 2022 .El texto se ha copiado de esta fuente, cuyos derechos de autor pertenecen a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
- ^ abc «Zolsketil pegylated liposomal EPAR». Agencia Europea de Medicamentos (EMA) . 24 de enero de 2022. Archivado desde el original el 21 de junio de 2022. Consultado el 20 de junio de 2022 .El texto se ha copiado de esta fuente, cuyos derechos de autor pertenecen a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
- ^ abc «Celdoxome pegylated liposomal EPAR». Agencia Europea de Medicamentos (EMA) . 20 de junio de 2022. Consultado el 31 de enero de 2023 .El texto se ha copiado de esta fuente, cuyos derechos de autor pertenecen a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
- ^ "Información del producto Caelyx". Health Canada . 25 de abril de 2012. Archivado desde el original el 21 de junio de 2022. Consultado el 20 de junio de 2022 .
- ^ "Información del producto Myocet". Health Canada . 25 de abril de 2012 . Consultado el 20 de junio de 2022 .
- ^ "Información sobre el producto liposomal de taro-doxorrubicina". Health Canada . 25 de abril de 2012. Archivado desde el original el 14 de mayo de 2021. Consultado el 20 de junio de 2022 .
- ^ abc "(doxorubicina) dosificación, indicaciones, interacciones, efectos adversos y más". Referencia de Medscape . WebMD. Archivado desde el original el 16 de abril de 2014 . Consultado el 15 de abril de 2014 .
- ^ abcdef Brayfield A, ed. (19 de diciembre de 2013). "Doxorubicina". Martindale: The Complete Drug Reference . Prensa farmacéutica. Archivado desde el original el 28 de agosto de 2021. Consultado el 15 de abril de 2014 .
- ^ abcdefghi «Clorhidrato de doxorrubicina». Sociedad Estadounidense de Farmacéuticos de Sistemas de Salud. Archivado desde el original el 11 de octubre de 2016. Consultado el 12 de enero de 2017 .
- ^ abc Tacar O, Sriamornsak P, Dass CR (febrero de 2013). "Doxorubicina: una actualización sobre la acción molecular anticancerígena, la toxicidad y los nuevos sistemas de administración de fármacos". The Journal of Pharmacy and Pharmacology . 65 (2): 157–170. doi : 10.1111/j.2042-7158.2012.01567.x . PMID 23278683. S2CID 34737360.
- ^ Organización Mundial de la Salud (2019). Lista modelo de medicamentos esenciales de la Organización Mundial de la Salud: 21.ª lista , 2019. Ginebra: Organización Mundial de la Salud. hdl : 10665/325771 . OMS/MVP/EMP/IAU/2019.06. Licencia: CC BY-NC-SA 3.0 IGO.
- ^ Formulario nacional británico: BNF 69 (69.ª ed.). Asociación Médica Británica. 2015. pág. 583. ISBN 9780857111562.
- ^ Ravina E (2011). La evolución del descubrimiento de fármacos: de las medicinas tradicionales a los fármacos modernos. John Wiley & Sons. pág. 291. ISBN 9783527326693Archivado desde el original el 18 de septiembre de 2017.
- ^ ab Rossi S, ed. (2013). Manual de medicamentos australianos (edición de 2013). Adelaida: The Australian Medicines Handbook Unit Trust. ISBN 978-0-9805790-9-3.
- ^ Alman B, Attia S, Baumgarten C, Benson C, Blay JY, Bonvalot S, et al. (Grupo de trabajo sobre tumores desmoides) (marzo de 2020). "El tratamiento de los tumores desmoides: un enfoque conjunto basado en directrices de consenso global para pacientes adultos y pediátricos". Revista Europea del Cáncer . 127 : 96–107. doi : 10.1016/j.ejca.2019.11.013 . hdl : 2318/1793788 . PMID 32004793. S2CID 210998595.
- ^ Bailon-Moscoso N, Coronel-Hidalgo J, Duarte-Casar R, Guamán-Ortiz LM, Figueroa JG, Romero-Benavides JC (noviembre de 2023). "Explorando el potencial antioxidante de Tragia volubilis L.: mitigando los efectos quimioterapéuticos de la doxorrubicina en las células tumorales". Antioxidantes . 12 (11): 2003. doi : 10.3390/antiox12112003 . ISSN 2076-3921. PMC 10669231 . PMID 38001856.
- ^ ab " "Información del producto DOXIL" (PDF) . Archivado desde el original (PDF) el 21 de septiembre de 2007 . Consultado el 19 de abril de 2007 .
- ^ ab Chatterjee K, Zhang J, Honbo N, Karliner JS (enero de 2010). "Miocardiopatía por doxorrubicina". Cardiología . 115 (2): 155–162. doi :10.1159/000265166. PMC 2848530 . PMID 20016174.
- ^ abcd Chatterjee K, Zhang J, Honbo N, Karliner JS (2010). "Miocardiopatía por doxorrubicina". Cardiología . 115 (2): 155–162. doi :10.1159/000265166. PMC 2848530 . PMID 20016174.
- ^ "Monografía de clorhidrato de dexrazoxano para profesionales - Drugs.com". Drugs.com . Sociedad Estadounidense de Farmacéuticos del Sistema de Salud. Archivado desde el original el 1 de agosto de 2018 . Consultado el 1 de agosto de 2018 .
- ^ Kaczmarek A, Brinkman BM, Heyndrickx L, Vandenabeele P, Krysko DV (marzo de 2012). "La gravedad de la mucositis del intestino delgado inducida por doxorrubicina está regulada por las vías TLR-2 y TLR-9". The Journal of Pathology . 226 (4): 598–608. doi :10.1002/path.3009. PMID 21960132. S2CID 206325412.[ enlace muerto permanente ]
- ^ "Serie de medicamentos para oncología ambulatoria: la doxorrubicina es el infame diablo rojo". Archivado desde el original el 21 de abril de 2018. Consultado el 21 de abril de 2018 .
- ^ Bloch R, Bloch A. "25 preguntas más frecuentes". Lucha contra el cáncer . Fundación contra el cáncer RA Bloch. Archivado desde el original el 26 de junio de 2007. Consultado el 28 de junio de 2007 .
- ^ Groopman JE (2007). Cómo piensan los médicos . Boston: Houghton Mifflin. pág. 49. ISBN 978-0-618-61003-7.
- ^ Yeo W, Lam KC, Zee B, Chan PS, Mo FK, Ho WM, et al. (noviembre de 2004). "Reactivación de la hepatitis B en pacientes con carcinoma hepatocelular sometidos a quimioterapia sistémica". Anales de Oncología . 15 (11): 1661–1666. doi : 10.1093/annonc/mdh430 . PMID 15520068.
- ^ Dillon R, Hirschfield GM, Allison ME, Rege KP (julio de 2008). "Reactivación fatal de la hepatitis B después de la quimioterapia para el linfoma". BMJ . 337 : a423. doi :10.1136/bmj.39490.680498.BE. PMID 18595895. S2CID 11661945.
- ^ "Desafío de imagen | NEJM". Archivado desde el original el 16 de marzo de 2013. Consultado el 1 de septiembre de 2011 .
- ^ ab "Doxorrubicina liposomal (Caelyx, Myocet)". Macmillan Cancer Support. 1 de abril de 2009. Archivado desde el original el 29 de noviembre de 2009. Consultado el 27 de noviembre de 2009 .
- ^ "Doxorubicina liposomal". Chemocare . Cleveland Clinic . Archivado desde el original el 2 de enero de 2010 . Consultado el 27 de noviembre de 2009 .
- ^ ab Lomovskaya N, Otten SL, Doi-Katayama Y, Fonstein L, Liu XC, Takatsu T, et al. (enero de 1999). "Sobreproducción de doxorrubicina en Streptomyces peucetius: clonación y caracterización de los genes dnrU ketoreductasa y dnrV y el gen doxA citocromo P-450 hidroxilasa". Journal of Bacteriology . 181 (1): 305–318. doi :10.1128/JB.181.1.305-318.1999. PMC 103563 . PMID 9864344.
- ^ ab Arcamone F, Cassinelli G, Fantini G, Grein A, Orezzi P, Pol C, Spalla C (noviembre de 1969). "Adriamicina, 14-hidroxidaunomicina, un nuevo antibiótico antitumoral de S. peucetius var. caesius". Biotecnología y bioingeniería . 11 (6): 1101–1110. doi :10.1002/bit.260110607. PMID 5365804. S2CID 21897153.
- ^ Grimm A, Madduri K, Ali A, Hutchinson CR (diciembre de 1994). "Caracterización de los genes ATCC 29050 de Streptomyces peucetius que codifican la doxorrubicina policétido sintasa". Gene . 151 (1–2): 1–10. doi : 10.1016/0378-1119(94)90625-4 . PMID 7828855.
- ^ Dickens ML, Strohl WR (junio de 1996). "Aislamiento y caracterización de un gen de la cepa C5 de Streptomyces sp. que confiere la capacidad de convertir daunomicina en doxorrubicina a Streptomyces lividans TK24". Journal of Bacteriology . 178 (11): 3389–3395. doi :10.1128/jb.178.11.3389-3395.1996. PMC 178102 . PMID 8655530.
- ^ Walczak RJ, Dickens ML, Priestley ND, Strohl WR (enero de 1999). "Purificación, propiedades y caracterización de la cepa C5 DoxA recombinante de Streptomyces sp., un citocromo P-450 que cataliza múltiples pasos en la biosíntesis de doxorrubicina". Journal of Bacteriology . 181 (1): 298–304. doi :10.1128/JB.181.1.298-304.1999. PMC 103562 . PMID 9864343.
- ^ Hutchinson CR, Colombo AL (julio de 1999). "Ingeniería genética de la producción de doxorrubicina en Streptomyces peucetius: una revisión". Journal of Industrial Microbiology & Biotechnology . 23 (1): 647–652. doi :10.1038/sj.jim.2900673. PMID 10455495. S2CID 27337697.
- ^ Lown JW (noviembre de 1993). "Agentes anticancerígenos antraciclinas y antraquinonas: estado actual y desarrollos recientes". Farmacología y terapéutica . 60 (2): 185–214. doi :10.1016/0163-7258(93)90006-Y. PMID 8022857.
- ^ ab Frederick CA, Williams LD, Ughetto G, van der Marel GA, van Boom JH, Rich A, Wang AH (marzo de 1990). "Comparación estructural de complejos de ADN y fármacos anticancerígenos: adriamicina y daunomicina". Bioquímica . 29 (10): 2538–2549. doi :10.1021/bi00462a016. PMID 2334681.La estructura cristalina está disponible para descargar como archivo PDB archivado el 14 de enero de 2008 en Wayback Machine .
- ^ Fornari FA, Randolph JK, Yalowich JC, Ritke MK, Gewirtz DA (abril de 1994). "Interferencia de la doxorrubicina con el desenrollado del ADN en células tumorales de mama MCF-7". Farmacología molecular . 45 (4): 649–656. PMID 8183243.
- ^ Momparler RL, Karon M, Siegel SE, Avila F (agosto de 1976). "Efecto de la adriamicina en la síntesis de ADN, ARN y proteínas en sistemas libres de células y células intactas". Cancer Research . 36 (8): 2891–2895. PMID 1277199. Archivado desde el original el 5 de febrero de 2009.
- ^ Pommier Y, Leo E, Zhang H, Marchand C (mayo de 2010). "Topoisomerasas de ADN y su envenenamiento por fármacos anticáncer y antibacterianos". Química y biología . 17 (5): 421–433. doi : 10.1016/j.chembiol.2010.04.012 . PMC 7316379 . PMID 20534341.
- ^ Pigram WJ, Fuller W, Hamilton LD (enero de 1972). "Estereoquímica de la intercalación: interacción de la daunomicina con el ADN". Nature . 235 (53): 17–19. doi :10.1038/newbio235017a0. PMID 4502404.
- ^ ab Pang B, Qiao X, Janssen L, Velds A, Groothuis T, Kerkhoven R, et al. (2013). "La expulsión de histonas inducida por fármacos de la cromatina abierta contribuye a los efectos quimioterapéuticos de la doxorrubicina". Nature Communications . 4 (5): 1908. Bibcode :2013NatCo...4.1908P. doi :10.1038/ncomms2921. PMC 3674280 . PMID 23715267.
- ^ Pang B, de Jong J, Qiao X, Wessels LF, Neefjes J (julio de 2015). "El perfil químico del genoma con fármacos contra el cáncer define las especificidades de los objetivos". Nature Chemical Biology . 11 (7): 472–480. doi :10.1038/nchembio.1811. PMID 25961671.
- ^ ab Weiss RB (diciembre de 1992). "Las antraciclinas: ¿encontraremos alguna vez una doxorrubicina mejor?". Seminarios en Oncología . 19 (6): 670–686. PMID 1462166.
- ^ Baruffa G (1966). "Ensayos clínicos en malaria por Plasmodium falciparum con una sulfonamida de acción prolongada". Transacciones de la Royal Society of Tropical Medicine and Hygiene . 60 (2): 222–224. doi :10.1016/0035-9203(66)90030-7. PMID 5332105.
- ^ Por cita anterior, la primera publicación: Camerino B, Palamidessi G (1960) Derivati della parazina II. Sulfonamdopir (en italiano). Gazz Chim Ital 90:1802–1815
- ^ Tan C, Tasaka H, Yu KP, Murphy ML, Karnofsky DA (marzo de 1967). "Daunomicina, un antibiótico antitumoral, en el tratamiento de la enfermedad neoplásica. Evaluación clínica con especial referencia a la leucemia infantil". Cáncer . 20 (3): 333–353. doi : 10.1002/1097-0142(1967)20:3<333::AID-CNCR2820200302>3.0.CO;2-K . PMID 4290058. S2CID 19272219.
- ^ Di Marco A, Gaetani M, Scarpinato B (febrero de 1969). "Adriamicina (NSC-123,127): un nuevo antibiótico con actividad antitumoral". Cancer Chemotherapy Reports . 53 (1): 33–37. PMID 5772652.
- ^ El fármaco en investigación contra el sarcoma GPX-150 obtiene la designación de medicamento huérfano. 2016 Archivado el 24 de enero de 2016 en Wayback Machine.
- ^ abcd «Zolsketil pegylated liposomal: pendiente de decisión de la CE». Agencia Europea de Medicamentos (EMA) . 24 de marzo de 2022. Archivado desde el original el 29 de marzo de 2022. Consultado el 29 de marzo de 2022 .El texto se ha copiado de esta fuente, cuyos derechos de autor pertenecen a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
- ^ "Información del producto Zolsketil". Registro de medicamentos de la Unión . Consultado el 3 de marzo de 2023 .
- ^ abcd «Liposoma pegilado de celdoxoma: pendiente de decisión de la CE». Agencia Europea de Medicamentos (EMA) . 22 de julio de 2022. Archivado desde el original el 28 de julio de 2022. Consultado el 30 de julio de 2022 .El texto se ha copiado de esta fuente, cuyos derechos de autor pertenecen a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
- ^ "Doxorubicina: información sobre medicamentos de MedlinePlus". medlineplus.gov . Archivado desde el original el 13 de julio de 2020 . Consultado el 12 de julio de 2020 .
- ^ "Se espera que la aprobación por parte de la FDA de la versión genérica del fármaco contra el cáncer Doxil ayude a resolver la escasez" (Comunicado de prensa). Administración de Alimentos y Medicamentos de Estados Unidos (FDA). 4 de febrero de 2013. Archivado desde el original el 28 de febrero de 2014 . Consultado el 22 de febrero de 2014 .
- ^ Wendel HG, De Stanchina E, Fridman JS, Malina A, Ray S, Kogan S, et al. (marzo de 2004). "Señalización de supervivencia por Akt y eIF4E en oncogénesis y terapia del cáncer". Nature . 428 (6980): 332–337. Bibcode :2004Natur.428..332W. doi :10.1038/nature02369. PMID 15029198. S2CID 4426215.
- ^ Saha T, Mondal J, Khiste S, Lusic H, Hu ZW, Jayabalan R, et al. (septiembre de 2021). "Enfoques nanoterapéuticos para superar distintas barreras de resistencia a fármacos en modelos de cáncer de mama". Nanophotonics . 10 (12): 3063–3073. Bibcode :2021Nanop..10..142S. doi : 10.1515/nanoph-2021-0142 . PMC 8478290 . PMID 34589378.
- ^ Johansson S, Goldenberg DM, Griffiths GL, Wahren B, Hinkula J (octubre de 2006). "Eliminación de la infección por VIH-1 mediante el tratamiento con un anticuerpo antienvoltura conjugado con doxorrubicina". SIDA . 20 (15): 1911–1915. doi : 10.1097/01.aids.0000247111.58961.60 . PMID 16988511. S2CID 42286690.
- ^ Mitsuyasu R (mayo de 2013). "Curar el VIH: lecciones de la terapia contra el cáncer". Current Opinion in HIV and AIDS . 8 (3): 224–229. doi :10.1097/COH.0b013e32835ef0a1. PMC 3789644 . PMID 23454863.
- ^ Friedman R, Caflisch A (agosto de 2009). "Descubrimiento de inhibidores de plasmepsina mediante acoplamiento basado en fragmentos y puntuación de consenso". ChemMedChem . 4 (8): 1317–1326. doi :10.1002/cmdc.200900078. PMID 19472268. S2CID 14642593. Archivado desde el original el 5 de enero de 2013 . Consultado el 28 de mayo de 2010 .
- ^ Gamo FJ, Sanz LM, Vidal J, de Cozar C, Alvarez E, Lavandera JL, et al. (mayo de 2010). "Miles de puntos de partida químicos para la identificación del plomo en antimaláricos". Nature . 465 (7296): 305–310. Bibcode :2010Natur.465..305G. doi :10.1038/nature09107. PMID 20485427. S2CID 1143258.
- ^ Karukstis KK, Thompson EH, Whiles JA, Rosenfeld RJ (julio de 1998). "Descifrando la firma de fluorescencia de la daunomicina y la doxorrubicina". Química biofísica . 73 (3): 249–263. doi :10.1016/s0301-4622(98)00150-1. PMID 9700924.
- ^ Mohan P, Rapoport N (diciembre de 2010). "Doxorubicina como agente nanoteranóstico molecular: efecto de la encapsulación de doxorubicina en micelas o nanoemulsiones sobre la administración intracelular mediada por ultrasonido y el tráfico nuclear". Molecular Pharmaceutics . 7 (6): 1959–1973. doi :10.1021/mp100269f. PMC 2997862 . PMID 20957997.

