Agua
 | |||
| |||
 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Agua | |||
| Nombre sistemático de la IUPAC Oxidano (no de uso común) [3] | |||
Otros nombres
| |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 3587155 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Banco de medicamentos |
| ||
| Tarjeta informativa de la ECHA | 100.028.902 | ||
| Número CE |
| ||
| 117 | |||
| BARRIL |
| ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| Propiedades | |||
| yo 2Oh | |||
| Masa molar | 18,01528(33) g/mol | ||
| Apariencia | Sólido cristalino casi incoloro o blanco, líquido casi incoloro, con un matiz azul , gas incoloro [4] | ||
| Olor | Inodoro | ||
| Densidad |
| ||
| Punto de fusión | 0,00 °C (32,00 °F; 273,15 K) [b] | ||
| Punto de ebullición | 99,98 °C (211,96 °F; 373,13 K) [17] [b] | ||
| Solubilidad | Poco soluble en haloalcanos , hidrocarburos alifáticos y aromáticos , éteres . [8] Solubilidad mejorada en carboxilatos , alcoholes , cetonas , aminas . Miscible con metanol , etanol , propanol , isopropanol , acetona , glicerol , 1,4-dioxano , tetrahidrofurano , sulfolano , acetaldehído , dimetilformamida , dimetoxietano , dimetilsulfóxido , acetonitrilo . Parcialmente miscible con éter dietílico , metiletilcetona , diclorometano , acetato de etilo , bromo . | ||
| Presión de vapor | 3,1690 kilopascales o 0,031276 atm a 25 °C [9] | ||
| Acidez (p K a ) | 13.995 [10] [11] [a] | ||
| Basicidad (p K b ) | 13.995 | ||
| Ácido conjugado | Hidronio H 3 O + (pK a = 0) | ||
| Base conjugada | Hidróxido OH – (pK b = 0) | ||
| Conductividad térmica | 0,6065 W/(m·K) [14] | ||
Índice de refracción ( n D ) | 1.3330 (20 °C) [15] | ||
| Viscosidad | 0,890 mPa·s (0,890 cP ) [16] | ||
| Estructura | |||
| Hexagonal | |||
| C2v | |||
| Doblado | |||
| 1.8546 D [18] | |||
| Termoquímica | |||
Capacidad calorífica ( C ) | 75,385 ± 0,05 J/(mol·K) [17] | ||
Entropía molar estándar ( S ⦵ 298 ) | 69,95 ± 0,03 J/(mol·K) [17] | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −285,83 ± 0,04 kJ/mol [8] [17] | ||
Energía libre de Gibbs (Δ f G ⦵ ) | −237,24 kJ/mol [8] | ||
| Peligros | |||
| Seguridad y salud en el trabajo (SST/OHS): | |||
Principales peligros | Avalancha por ahogamiento (como nieve) Intoxicación por agua | ||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | Ininflamable | ||
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad | ||
| Compuestos relacionados | |||
Otros aniones | |||
Disolventes relacionados | |||
| Página de datos complementarios | |||
| Agua (página de datos) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El agua es un compuesto inorgánico con la fórmula química H 2 O . Es una sustancia química transparente, insípida, inodora, [c] y casi incolora . Es el principal constituyente de la hidrosfera de la Tierra y de los fluidos de todos los organismos vivos conocidos (en los que actúa como disolvente [20] ). Es vital para todas las formas de vida conocidas , a pesar de no proporcionar energía alimentaria ni micronutrientes orgánicos . Su fórmula química, H 2 O , indica que cada una de sus moléculas contiene un átomo de oxígeno y dos de hidrógeno , conectados por enlaces covalentes . Los átomos de hidrógeno están unidos al átomo de oxígeno en un ángulo de 104,45°. [21] En forma líquida, el H 2 O también se llama "agua" a temperatura y presión estándar .
Debido a que el entorno de la Tierra está relativamente cerca del punto triple del agua , el agua existe en la Tierra como sólido , líquido y gas . [22] Forma precipitaciones en forma de lluvia y aerosoles en forma de niebla . Las nubes consisten en gotitas suspendidas de agua y hielo , su estado sólido. Cuando está finamente dividido, el hielo cristalino puede precipitar en forma de nieve . El estado gaseoso del agua es vapor o vapor de agua .
El agua cubre aproximadamente el 71% de la superficie de la Tierra, y los mares y océanos constituyen la mayor parte del volumen de agua (aproximadamente el 96,5%). [23] Pequeñas porciones de agua se encuentran como agua subterránea (1,7%), en los glaciares y los casquetes polares de la Antártida y Groenlandia (1,7%) y en el aire como vapor , nubes (que consisten en hielo y agua líquida suspendidas en el aire) y precipitación (0,001%). [24] [25] El agua se mueve continuamente a través del ciclo del agua de evaporación , transpiración ( evapotranspiración ), condensación , precipitación y escorrentía , y generalmente llega al mar.
El agua desempeña un papel importante en la economía mundial . Aproximadamente el 70% del agua dulce utilizada por los seres humanos se destina a la agricultura . [26] La pesca en cuerpos de agua salada y dulce ha sido, y sigue siendo, una fuente importante de alimentos para muchas partes del mundo, proporcionando el 6,5% de las proteínas mundiales. [27] Gran parte del comercio de larga distancia de productos básicos (como petróleo, gas natural y productos manufacturados) se transporta en barcos a través de mares, ríos, lagos y canales. Grandes cantidades de agua, hielo y vapor se utilizan para enfriar y calentar en la industria y los hogares. El agua es un excelente disolvente para una amplia variedad de sustancias, tanto minerales como orgánicas; como tal, se usa ampliamente en procesos industriales y en la cocina y el lavado. El agua, el hielo y la nieve también son fundamentales para muchos deportes y otras formas de entretenimiento, como la natación , la navegación de recreo, las carreras de barcos , el surf , la pesca deportiva , el buceo , el patinaje sobre hielo , el snowboard y el esquí .
Etimología
La palabra agua proviene del inglés antiguo wæter , del protogermánico * watar (fuente también del sajón antiguo watar , frisio antiguo wetir , holandés water , alto alemán antiguo wazzar , alemán Wasser , vatn , gótico 𐍅𐌰𐍄𐍉 ( wato )), del protoindoeuropeo * wod-or , forma sufijada de la raíz * wed- ( ' agua ' ; ' mojado ' ). [28] También cognado , a través de la raíz indoeuropea, con el griego ύδωρ ( ýdor ; del griego antiguo ὕδωρ ( hýdōr ), de donde el inglés ' hydro- ' ), el ruso вода́ ( vodá ), el irlandés uisce y el albanés ujë .
Historia
En la Tierra
Un factor a tener en cuenta para estimar cuándo apareció el agua en la Tierra es que el agua se pierde continuamente en el espacio. Las moléculas de H 2 O en la atmósfera se rompen por fotólisis , y los átomos de hidrógeno libres resultantes a veces pueden escapar de la atracción gravitatoria de la Tierra. Cuando la Tierra era más joven y menos masiva , el agua se habría perdido en el espacio más fácilmente. Se espera que los elementos más ligeros como el hidrógeno y el helio se escapen de la atmósfera continuamente, pero las proporciones isotópicas de los gases nobles más pesados en la atmósfera moderna sugieren que incluso los elementos más pesados en la atmósfera primitiva estaban sujetos a pérdidas significativas. [29] En particular, el xenón es útil para los cálculos de la pérdida de agua a lo largo del tiempo. No solo es un gas noble (y, por lo tanto, no se elimina de la atmósfera a través de reacciones químicas con otros elementos), sino que las comparaciones entre las abundancias de sus nueve isótopos estables en la atmósfera moderna revelan que la Tierra perdió al menos un océano de agua al principio de su historia, entre los eones Hádico y Arcaico . [30] [ aclaración necesaria ]
Cualquier agua en la Tierra durante la última parte de su acreción habría sido alterada por el impacto que formó la Luna (hace unos 4.500 millones de años), que probablemente vaporizó gran parte de la corteza terrestre y el manto superior y creó una atmósfera de vapor de roca alrededor del joven planeta. [31] [32] El vapor de roca se habría condensado en dos mil años, dejando atrás volátiles calientes que probablemente dieron lugar a una atmósfera mayoritariamente de dióxido de carbono con hidrógeno y vapor de agua . Después, es posible que hayan existido océanos de agua líquida a pesar de la temperatura superficial de 230 °C (446 °F) debido al aumento de la presión atmosférica de la atmósfera de CO 2 . A medida que continuó el enfriamiento, la mayor parte del CO 2 se eliminó de la atmósfera por subducción y disolución en el agua del océano, pero los niveles oscilaron enormemente a medida que aparecían nuevos ciclos de superficie y manto . [33]

La evidencia geológica también ayuda a limitar el marco temporal de la existencia de agua líquida en la Tierra. Una muestra de basalto almohadillado (un tipo de roca formada durante una erupción submarina) fue recuperada del Cinturón de Piedras Verdes de Isua y proporciona evidencia de que el agua existió en la Tierra hace 3.800 millones de años. [34] En el Cinturón de Piedras Verdes de Nuvvuagittuq , Quebec, Canadá, rocas datadas en 3.800 millones de años por un estudio [35] y 4.280 millones de años por otro [36] muestran evidencia de la presencia de agua en estas edades. [34] Si los océanos existieron antes de esto, aún no se ha descubierto ninguna evidencia geológica (lo que puede deberse a que dicha evidencia potencial ha sido destruida por procesos geológicos como el reciclaje de la corteza ). Más recientemente, en agosto de 2020, los investigadores informaron que es posible que siempre haya habido suficiente agua para llenar los océanos en la Tierra desde el comienzo de la formación del planeta . [37] [38] [39]
A diferencia de las rocas, los minerales llamados circones son altamente resistentes a la intemperie y a los procesos geológicos, por lo que se utilizan para comprender las condiciones en la Tierra primitiva. La evidencia mineralógica de los circones ha demostrado que el agua líquida y una atmósfera deben haber existido hace 4.404 ± 0.008 mil millones de años, muy poco después de la formación de la Tierra. [40] [41] [42] [43] Esto presenta una especie de paradoja, ya que la hipótesis de la Tierra primitiva fría sugiere que las temperaturas eran lo suficientemente frías como para congelar el agua hace entre unos 4.400 y 4.000 millones de años. Otros estudios de circones encontrados en la roca del Hádico australiano apuntan a la existencia de tectónica de placas hace ya 4.000 millones de años. Si es cierto, eso implica que, en lugar de una superficie caliente y fundida y una atmósfera llena de dióxido de carbono, la superficie de la Tierra primitiva era muy parecida a la de hoy (en términos de aislamiento térmico ). La acción de la tectónica de placas atrapa grandes cantidades de CO 2 , reduciendo así el efecto invernadero , lo que conduce a una temperatura superficial mucho más fría y a la formación de roca sólida y agua líquida. [44]Propiedades
El agua ( H2O ) es un compuesto inorgánico polar . A temperatura ambiente es un líquido insípido e inodoro , casi incoloro con un matiz azul . Es el calcogenuro de hidrógeno más simple , es con diferencia el compuesto químico más estudiado y a veces se le describe como el "disolvente universal" por su capacidad para disolver más sustancias que cualquier otro líquido, [45] [46] aunque es deficiente a la hora de disolver sustancias no polares. [47] Esto le permite ser el " disolvente de la vida": [48] de hecho, el agua tal como se encuentra en la naturaleza casi siempre incluye varias sustancias disueltas, y se requieren pasos especiales para obtener agua químicamente pura . El agua es la única sustancia común que existe como sólido , líquido y gas en condiciones terrestres normales. [49]
Estados

Junto con el oxidano , el agua es uno de los dos nombres oficiales del compuesto químico H
2O ; [50] también es la fase líquida de H
2O . [51] Los otros dos estados comunes de la materia del agua son la fase sólida, hielo , y la fase gaseosa, vapor de agua o vapor de agua . La adición o eliminación de calor puede causar transiciones de fase : congelación (agua a hielo), fusión (hielo a agua), vaporización (agua a vapor), condensación (vapor a agua), sublimación (hielo a vapor) y deposición (vapor a hielo). [52]
Densidad
El agua se diferencia de la mayoría de los líquidos en que se vuelve menos densa a medida que se congela. [d] A una presión de 1 atm, alcanza su densidad máxima de 999,972 kg/m3 ( 62,4262 lb/cu ft) a 3,98 °C (39,16 °F), o casi 1000 kg/m3 ( 62,43 lb/cu ft) a casi 4 °C (39 °F). [54] [55] La densidad del hielo es de 917 kg/m3 ( 57,25 lb/cu ft), una expansión del 9%. [56] [57] Esta expansión puede ejercer una enorme presión, haciendo estallar tuberías y agrietando rocas. [58]
En un lago o en un océano, el agua a 4 °C (39 °F) se hunde hasta el fondo y se forma hielo en la superficie, que flota sobre el agua líquida. Este hielo aísla el agua que se encuentra debajo, impidiendo que se congele. Sin esta protección, la mayoría de los organismos acuáticos que viven en lagos perecerían durante el invierno. [59]
Magnetismo
El agua es un material diamagnético . [60] Aunque la interacción es débil, con imanes superconductores puede alcanzar una interacción notable. [60]
Transiciones de fase
A una presión de una atmósfera (atm), el hielo se derrite o el agua se congela (solidifica) a 0 °C (32 °F) y el agua hierve o el vapor se condensa a 100 °C (212 °F). Sin embargo, incluso por debajo del punto de ebullición, el agua puede convertirse en vapor en su superficie por evaporación (la vaporización en todo el líquido se conoce como ebullición ). La sublimación y la deposición también ocurren en las superficies. [52] Por ejemplo, la escarcha se deposita en superficies frías mientras que los copos de nieve se forman por deposición en una partícula de aerosol o núcleo de hielo. [61] En el proceso de liofilización , un alimento se congela y luego se almacena a baja presión para que el hielo en su superficie se sublime. [62]
Los puntos de fusión y ebullición dependen de la presión. Una buena aproximación de la tasa de cambio de la temperatura de fusión con la presión se da mediante la relación de Clausius-Clapeyron :
donde y son los volúmenes molares de las fases líquida y sólida, y es el calor latente molar de fusión. En la mayoría de las sustancias, el volumen aumenta cuando se produce la fusión, por lo que la temperatura de fusión aumenta con la presión. Sin embargo, debido a que el hielo es menos denso que el agua, la temperatura de fusión disminuye. [53] En los glaciares, la fusión por presión puede ocurrir bajo volúmenes de hielo suficientemente gruesos, lo que da lugar a lagos subglaciales . [63] [64]
La relación de Clausius-Clapeyron también se aplica al punto de ebullición, pero con la transición de líquido a gas la fase de vapor tiene una densidad mucho menor que la fase líquida, por lo que el punto de ebullición aumenta con la presión. [65] El agua puede permanecer en estado líquido a altas temperaturas en las profundidades del océano o bajo tierra. Por ejemplo, las temperaturas superan los 205 °C (401 °F) en Old Faithful , un géiser en el Parque Nacional de Yellowstone . [66] En los respiraderos hidrotermales , la temperatura puede superar los 400 °C (752 °F). [67]
A nivel del mar , el punto de ebullición del agua es de 100 °C (212 °F). A medida que la presión atmosférica disminuye con la altitud, el punto de ebullición disminuye 1 °C cada 274 metros. Cocinar a gran altitud lleva más tiempo que cocinar a nivel del mar. Por ejemplo, a 1524 metros (5000 pies), el tiempo de cocción debe aumentarse en una cuarta parte para lograr el resultado deseado. [68] Por el contrario, se puede utilizar una olla a presión para reducir los tiempos de cocción elevando la temperatura de ebullición. [69] En el vacío, el agua hervirá a temperatura ambiente. [70]
Puntos triples y críticos
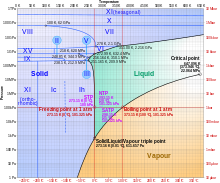
En un diagrama de fases de presión/temperatura (ver figura), hay curvas que separan el sólido del vapor, el vapor del líquido y el líquido del sólido. Estas se encuentran en un único punto llamado punto triple , donde las tres fases pueden coexistir. El punto triple está a una temperatura de 273,16 K (0,01 °C; 32,02 °F) y una presión de 611,657 pascales (0,00604 atm; 0,0887 psi); [71] es la presión más baja a la que puede existir agua líquida. Hasta 2019 , el punto triple se utilizaba para definir la escala de temperatura Kelvin . [72] [73]
La curva de la fase agua/vapor termina en 647,096 K (373,946 °C; 705,103 °F) y 22,064 megapascales (3200,1 psi; 217,75 atm). [74] Esto se conoce como el punto crítico . A temperaturas y presiones más altas, las fases líquida y de vapor forman una fase continua llamada fluido supercrítico . Puede comprimirse o expandirse gradualmente entre densidades similares a las de un gas y un líquido; sus propiedades (que son bastante diferentes de las del agua ambiental) son sensibles a la densidad. Por ejemplo, para presiones y temperaturas adecuadas, puede mezclarse libremente con compuestos no polares , incluidos la mayoría de los compuestos orgánicos . Esto lo hace útil en una variedad de aplicaciones, incluida la electroquímica de alta temperatura y como un disolvente o catalizador ecológicamente benigno en reacciones químicas que involucran compuestos orgánicos. En el manto de la Tierra, actúa como disolvente durante la formación, disolución y deposición de minerales. [75] [76]
Fases del hielo y el agua
La forma normal del hielo en la superficie de la Tierra es el hielo I h , una fase que forma cristales con simetría hexagonal . Otra con simetría cristalina cúbica , el hielo I c , puede darse en la atmósfera superior. [77] A medida que aumenta la presión, el hielo forma otras estructuras cristalinas . A partir de 2024, se han confirmado veinte experimentalmente y se predicen varias más teóricamente. [78] La decimoctava forma de hielo, el hielo XVIII , una fase de hielo superiónico cúbico centrado en las caras, se descubrió cuando una gota de agua se sometió a una onda de choque que elevó la presión del agua a millones de atmósferas y su temperatura a miles de grados, lo que resultó en una estructura de átomos de oxígeno rígidos en los que los átomos de hidrógeno fluían libremente. [79] [80] Cuando se intercala entre capas de grafeno , el hielo forma una red cuadrada. [81]
Los detalles de la naturaleza química del agua líquida no se comprenden bien; algunas teorías sugieren que su comportamiento inusual se debe a la existencia de dos estados líquidos. [55] [82] [83] [84]
Sabor y olor
El agua pura suele describirse como insípida e inodora, aunque los humanos tienen sensores específicos que pueden sentir la presencia de agua en la boca, [85] [86] y se sabe que las ranas pueden olerla. [87] Sin embargo, el agua de fuentes ordinarias (incluida el agua mineral ) suele tener muchas sustancias disueltas que pueden darle distintos sabores y olores. Los humanos y otros animales han desarrollado sentidos que les permiten evaluar la potabilidad del agua para evitar el agua demasiado salada o pútrida . [88]
Color y apariencia
El agua pura es visiblemente azul debido a la absorción de luz en la región de c. 600–800 nm. [89] El color se puede observar fácilmente en un vaso de agua del grifo colocado contra un fondo blanco puro, a la luz del día. Las principales bandas de absorción responsables del color son sobretonos de las vibraciones de estiramiento O–H . La intensidad aparente del color aumenta con la profundidad de la columna de agua, siguiendo la ley de Beer . Esto también se aplica, por ejemplo, a una piscina cuando la fuente de luz es la luz solar reflejada por las baldosas blancas de la piscina.
En la naturaleza, el color también puede modificarse de azul a verde debido a la presencia de sólidos suspendidos o algas.
En la industria, la espectroscopia de infrarrojo cercano se utiliza con soluciones acuosas, ya que la mayor intensidad de los matices más bajos del agua significa que se pueden emplear cubetas de vidrio con una longitud de trayectoria corta. Para observar el espectro de absorción de estiramiento fundamental del agua o de una solución acuosa en la región de alrededor de 3500 cm −1 (2,85 μm) [90] se necesita una longitud de trayectoria de aproximadamente 25 μm. Además, la cubeta debe ser transparente alrededor de 3500 cm −1 e insoluble en agua; el fluoruro de calcio es un material que se usa comúnmente para las ventanas de las cubetas con soluciones acuosas.
Las vibraciones fundamentales Raman-activas pueden observarse con, por ejemplo, una celda de muestra de 1 cm.
Las plantas acuáticas , las algas y otros organismos fotosintéticos pueden vivir en aguas de hasta cientos de metros de profundidad, porque la luz solar puede alcanzarlos. Prácticamente no llega luz solar a las partes de los océanos por debajo de los 1.000 metros (3.300 pies) de profundidad.
El índice de refracción del agua líquida (1,333 a 20 °C (68 °F)) es mucho más alto que el del aire (1,0), similar a los de los alcanos y el etanol , pero inferior a los del glicerol (1,473), el benceno (1,501), el disulfuro de carbono (1,627) y los tipos comunes de vidrio (1,4 a 1,6). El índice de refracción del hielo (1,31) es inferior al del agua líquida.
Polaridad molecular

En una molécula de agua, los átomos de hidrógeno forman un ángulo de 104,5° con el átomo de oxígeno. Los átomos de hidrógeno están cerca de dos esquinas de un tetraedro centrado en el oxígeno. En las otras dos esquinas hay pares solitarios de electrones de valencia que no participan en el enlace. En un tetraedro perfecto, los átomos formarían un ángulo de 109,5°, pero la repulsión entre los pares solitarios es mayor que la repulsión entre los átomos de hidrógeno. [91] [92] La longitud del enlace O–H es de aproximadamente 0,096 nm. [93]
Otras sustancias tienen una estructura molecular tetraédrica, por ejemplo el metano ( CH
4) y sulfuro de hidrógeno ( H
2S ). Sin embargo, el oxígeno es más electronegativo que la mayoría de los demás elementos, por lo que el átomo de oxígeno tiene una carga parcial negativa mientras que los átomos de hidrógeno tienen una carga parcialmente positiva. Junto con la estructura doblada, esto le da a la molécula un momento dipolar eléctrico y se clasifica como una molécula polar . [94]
El agua es un buen disolvente polar , que disuelve muchas sales y moléculas orgánicas hidrófilas , como azúcares y alcoholes simples como el etanol . El agua también disuelve muchos gases, como el oxígeno y el dióxido de carbono , este último que proporciona la efervescencia de las bebidas carbonatadas , los vinos espumosos y las cervezas. Además, muchas sustancias de los organismos vivos, como las proteínas , el ADN y los polisacáridos , se disuelven en agua. Las interacciones entre el agua y las subunidades de estas biomacromoléculas dan forma al plegamiento de proteínas , al apareamiento de bases del ADN y a otros fenómenos cruciales para la vida ( efecto hidrofóbico ).
Muchas sustancias orgánicas (como las grasas, los aceites y los alcanos ) son hidrófobas , es decir, insolubles en agua. Muchas sustancias inorgánicas también son insolubles, incluidos la mayoría de los óxidos metálicos , sulfuros y silicatos .
Enlace de hidrógeno

Debido a su polaridad, una molécula de agua en estado líquido o sólido puede formar hasta cuatro enlaces de hidrógeno con moléculas vecinas. Los enlaces de hidrógeno son aproximadamente diez veces más fuertes que la fuerza de Van der Waals que atrae a las moléculas entre sí en la mayoría de los líquidos. Esta es la razón por la que los puntos de fusión y ebullición del agua son mucho más altos que los de otros compuestos análogos como el sulfuro de hidrógeno. También explican su capacidad calorífica específica excepcionalmente alta (alrededor de 4,2 J / (g·K)), calor de fusión (alrededor de 333 J/g), calor de vaporización ( 2257 J/g ) y conductividad térmica (entre 0,561 y 0,679 W/(m·K)). Estas propiedades hacen que el agua sea más eficaz para moderar el clima de la Tierra , al almacenar calor y transportarlo entre los océanos y la atmósfera. Los enlaces de hidrógeno del agua son de alrededor de 23 kJ/mol (en comparación con un enlace OH covalente a 492 kJ/mol). De esto, se estima que el 90% es atribuible a la electrostática, mientras que el 10% restante es parcialmente covalente. [95]
Estos enlaces son la causa de la alta tensión superficial del agua [96] y de las fuerzas capilares. La acción capilar se refiere a la tendencia del agua a ascender por un tubo estrecho contra la fuerza de la gravedad . Esta propiedad es la que poseen todas las plantas vasculares , como los árboles. [ cita requerida ]

Autoionización
El agua es una solución débil de hidróxido de hidronio; existe un equilibrio 2H
2O ⇌ H
3Oh+
+ OH−
, en combinación con la solvatación de los iones hidronio e hidróxido resultantes .
Conductividad eléctrica y electrólisis
El agua pura tiene una conductividad eléctrica baja , que aumenta con la disolución de una pequeña cantidad de material iónico, como la sal común .
El agua líquida se puede dividir en los elementos hidrógeno y oxígeno al pasar una corriente eléctrica a través de ella, un proceso llamado electrólisis . La descomposición requiere un aporte de energía mayor que el calor liberado por el proceso inverso (285,8 kJ/ mol o 15,9 MJ/kg). [98]
Propiedades mecánicas
Se puede suponer que el agua líquida es incompresible para la mayoría de los propósitos: su compresibilidad varía de 4,4 a5,1 × 10 −10 Pa −1 en condiciones normales. [99] Incluso en océanos a 4 km de profundidad, donde la presión es de 400 atm, el agua sufre solo una disminución del 1,8% en su volumen. [100]
La viscosidad del agua es de aproximadamente 10 −3 Pa· s o 0,01 poise a 20 °C (68 °F), y la velocidad del sonido en agua líquida varía entre 1.400 y 1.540 metros por segundo (4.600 y 5.100 pies/s) dependiendo de la temperatura. El sonido viaja largas distancias en el agua con poca atenuación , especialmente a bajas frecuencias (aproximadamente 0,03 dB /km para 1 kHz ) , una propiedad que es explotada por los cetáceos y los humanos para la comunicación y la detección del entorno ( sónar ). [101]
Reactividad
Los elementos metálicos que son más electropositivos que el hidrógeno, en particular los metales alcalinos y alcalinotérreos como el litio , el sodio , el calcio , el potasio y el cesio, desplazan al hidrógeno del agua, formando hidróxidos y liberando hidrógeno. A altas temperaturas, el carbono reacciona con el vapor para formar monóxido de carbono e hidrógeno. [ cita requerida ]
En la Tierra
La hidrología es el estudio del movimiento, la distribución y la calidad del agua en toda la Tierra. El estudio de la distribución del agua se denomina hidrografía . El estudio de la distribución y el movimiento de las aguas subterráneas se denomina hidrogeología , el de los glaciares se denomina glaciología , el de las aguas continentales se denomina limnología y el de la distribución de los océanos se denomina oceanografía . Los procesos ecológicos relacionados con la hidrología son objeto de estudio de la ecohidrología .
La masa colectiva de agua que se encuentra sobre, debajo y encima de la superficie de un planeta se denomina hidrosfera . El volumen aproximado de agua de la Tierra (el suministro total de agua del mundo) es de 1.386 millones de kilómetros cúbicos (333 millones de millas cúbicas). [24]
El agua líquida se encuentra en cuerpos de agua , como océanos, mares, lagos, ríos, arroyos, canales , estanques o charcos . La mayor parte del agua de la Tierra es agua de mar . El agua también está presente en la atmósfera en estado sólido, líquido y vapor. También existe como agua subterránea en los acuíferos .
El agua es importante en muchos procesos geológicos. El agua subterránea está presente en la mayoría de las rocas y la presión de esta agua subterránea afecta los patrones de fallas . El agua en el manto es responsable del derretimiento que produce volcanes en las zonas de subducción . En la superficie de la Tierra, el agua es importante en los procesos de meteorización tanto químicos como físicos . El agua, y en menor medida, pero aún significativa, el hielo, también son responsables de una gran cantidad de transporte de sedimentos que ocurre en la superficie de la Tierra. La deposición de sedimentos transportados forma muchos tipos de rocas sedimentarias , que conforman el registro geológico de la historia de la Tierra .
Ciclo del agua

El ciclo del agua (conocido científicamente como ciclo hidrológico) es el intercambio continuo de agua dentro de la hidrosfera , entre la atmósfera , el agua del suelo , el agua superficial , el agua subterránea y las plantas.
El agua se mueve perpetuamente a través de cada una de estas regiones en el ciclo del agua que consiste en los siguientes procesos de transferencia:
- evaporación de los océanos y otros cuerpos de agua al aire y transpiración de las plantas y animales terrestres al aire.
- precipitación , proveniente del vapor de agua que se condensa del aire y cae a la tierra o al océano.
- escorrentía de la tierra que generalmente llega al mar.
La mayor parte del vapor de agua que se encuentra principalmente en el océano regresa a él, pero los vientos transportan el vapor de agua sobre la tierra al mismo ritmo que la escorrentía hacia el mar, alrededor de 47 Tt por año, mientras que la evaporación y la transpiración que ocurren en las masas terrestres también contribuyen con otras 72 Tt por año. La precipitación, a un ritmo de 119 Tt por año sobre la tierra, tiene varias formas: las más comunes son lluvia, nieve y granizo , con alguna contribución de la niebla y el rocío . [102] El rocío son pequeñas gotas de agua que se condensan cuando una alta densidad de vapor de agua se encuentra con una superficie fría. El rocío generalmente se forma por la mañana cuando la temperatura es más baja, justo antes del amanecer y cuando la temperatura de la superficie de la Tierra comienza a aumentar. [103] El agua condensada en el aire también puede refractar la luz solar para producir arcoíris .
El agua de escorrentía a menudo se acumula en las cuencas hidrográficas y desemboca en los ríos. A través de la erosión , la escorrentía moldea el medio ambiente creando valles fluviales y deltas que proporcionan un suelo rico y un terreno nivelado para el establecimiento de centros de población. Una inundación ocurre cuando una zona de tierra, generalmente baja, se cubre de agua, lo que ocurre cuando un río se desborda o se produce una marejada ciclónica. Por otro lado, la sequía es un período prolongado de meses o años en el que una región nota una deficiencia en su suministro de agua. Esto ocurre cuando una región recibe constantemente precipitaciones por debajo de la media, ya sea debido a su topografía o debido a su ubicación en términos de latitud .
Recursos hídricos
Los recursos hídricos son recursos naturales de agua que son potencialmente útiles para los seres humanos, [104] por ejemplo como fuente de suministro de agua potable o agua de riego . El agua se presenta tanto en forma de "reservas" como de "flujos". El agua puede almacenarse en forma de lagos, vapor de agua, agua subterránea o acuíferos, y hielo y nieve. Del volumen total de agua dulce mundial, se estima que el 69 por ciento está almacenado en glaciares y cubiertas de nieve permanente; el 30 por ciento está en aguas subterráneas; y el 1 por ciento restante en lagos, ríos, la atmósfera y la biota. [105] El tiempo que el agua permanece almacenada es muy variable: algunos acuíferos consisten en agua almacenada durante miles de años, pero los volúmenes de los lagos pueden fluctuar según la estación, disminuyendo durante los períodos secos y aumentando durante los húmedos. Una fracción sustancial del suministro de agua para algunas regiones consiste en agua extraída del agua almacenada en reservas, y cuando las extracciones exceden la recarga, las reservas disminuyen. Según algunas estimaciones, hasta un 30 por ciento del agua total utilizada para riego proviene de extracciones insostenibles de aguas subterráneas, lo que causa su agotamiento . [106]
Agua de mar y mareas
El agua de mar contiene en promedio alrededor de un 3,5% de cloruro de sodio , además de cantidades más pequeñas de otras sustancias. Las propiedades físicas del agua de mar difieren de las del agua dulce en algunos aspectos importantes. Se congela a una temperatura más baja (alrededor de -1,9 °C (28,6 °F)) y su densidad aumenta con la disminución de la temperatura hasta el punto de congelación, en lugar de alcanzar la densidad máxima a una temperatura por encima del punto de congelación. La salinidad del agua en los principales mares varía de aproximadamente el 0,7% en el mar Báltico al 4,0% en el mar Rojo . (El mar Muerto , conocido por sus niveles de salinidad ultraelevados de entre el 30 y el 40%, es en realidad un lago salado ).
Las mareas son el ascenso y descenso cíclico de los niveles locales del mar causados por las fuerzas de marea de la Luna y el Sol que actúan sobre los océanos. Las mareas causan cambios en la profundidad de los cuerpos de agua marinos y estuarinos y producen corrientes oscilantes conocidas como corrientes de marea. La marea cambiante producida en un lugar determinado es el resultado de las posiciones cambiantes de la Luna y el Sol en relación con la Tierra, junto con los efectos de la rotación de la Tierra y la batimetría local . La franja de costa que está sumergida durante la marea alta y expuesta durante la marea baja, la zona intermareal , es un producto ecológico importante de las mareas oceánicas.
Efectos sobre la vida

Desde un punto de vista biológico , el agua tiene muchas propiedades distintivas que son fundamentales para la proliferación de la vida. Lleva a cabo esta función al permitir que los compuestos orgánicos reaccionen de formas que, en última instancia, permiten la replicación . Todas las formas de vida conocidas dependen del agua. El agua es vital tanto como disolvente en el que se disuelven muchos de los solutos del cuerpo como parte esencial de muchos procesos metabólicos dentro del cuerpo. El metabolismo es la suma total del anabolismo y el catabolismo . En el anabolismo, el agua se elimina de las moléculas (a través de reacciones químicas enzimáticas que requieren energía) para hacer crecer moléculas más grandes (por ejemplo, almidones, triglicéridos y proteínas para el almacenamiento de combustibles e información). En el catabolismo, el agua se utiliza para romper enlaces con el fin de generar moléculas más pequeñas (por ejemplo, glucosa, ácidos grasos y aminoácidos para ser utilizados como combustibles para el uso energético u otros fines). Sin agua, estos procesos metabólicos particulares no podrían existir.
El agua es fundamental tanto para la fotosíntesis como para la respiración. Las células fotosintéticas utilizan la energía del sol para separar el hidrógeno del agua del oxígeno. [107] En presencia de la luz solar, el hidrógeno se combina con el CO
2(absorbida del aire o del agua) para formar glucosa y liberar oxígeno. [108] Todas las células vivas utilizan dichos combustibles y oxidan el hidrógeno y el carbono para capturar la energía del sol y reformar el agua y el CO.
2en el proceso (respiración celular).
El agua también es fundamental para la neutralidad ácido-base y la función enzimática. Un ácido, un ion hidrógeno ( H+
, es decir, un donante de protones, puede ser neutralizado por una base, un aceptor de protones como un ion hidróxido ( OH−
) para formar agua. Se considera que el agua es neutra, con un pH (el logaritmo negativo de la concentración de iones hidrógeno) de 7 en un estado ideal. Los ácidos tienen valores de pH inferiores a 7, mientras que las bases tienen valores superiores a 7.
Formas de vida acuática
Las aguas superficiales de la Tierra están llenas de vida. Las primeras formas de vida aparecieron en el agua; casi todos los peces viven exclusivamente en el agua, y hay muchos tipos de mamíferos marinos, como los delfines y las ballenas. Algunos tipos de animales, como los anfibios, pasan parte de su vida en el agua y parte en la tierra. Las plantas como las algas crecen en el agua y son la base de algunos ecosistemas submarinos. El plancton es, en general, la base de la cadena alimentaria oceánica .
Los vertebrados acuáticos deben obtener oxígeno para sobrevivir, y lo hacen de diversas formas. Los peces tienen branquias en lugar de pulmones , aunque algunas especies de peces, como el pez pulmonado , tienen ambos. Los mamíferos marinos , como los delfines, las ballenas, las nutrias y las focas , necesitan salir a la superficie periódicamente para respirar aire. Algunos anfibios pueden absorber oxígeno a través de su piel. Los invertebrados exhiben una amplia gama de modificaciones para sobrevivir en aguas poco oxigenadas, incluidos tubos respiratorios (ver sifones de insectos y moluscos ) y branquias ( Carcinus ). Sin embargo, como la vida de los invertebrados evolucionó en un hábitat acuático, la mayoría tiene poca o ninguna especialización para la respiración en el agua.
- Parte de la biodiversidad de un arrecife de coral
- Algunas diatomeas marinas : un grupo clave del fitoplancton
- Las langostas y los camarones Alvinocarididae del campo hidrotermal Von Damm sobreviven gracias a la química alterada del agua.
Efectos sobre la civilización humana
Esta sección necesita citas adicionales para su verificación . ( Mayo de 2018 ) |

Históricamente, la civilización ha florecido alrededor de ríos y vías fluviales importantes; Mesopotamia , una de las llamadas cunas de la civilización , estaba situada entre los grandes ríos Tigris y Éufrates ; la antigua sociedad de los egipcios dependía completamente del Nilo . La temprana civilización del valle del Indo ( c. 3300 a. C. - c. 1300 a. C. ) se desarrolló a lo largo del río Indo y los afluentes que fluían del Himalaya . Roma también se fundó en las orillas del río italiano Tíber . Grandes metrópolis como Róterdam , Londres , Montreal , París , Nueva York , Buenos Aires , Shanghái , Tokio , Chicago y Hong Kong deben su éxito en parte a su fácil acceso a través del agua y la consiguiente expansión del comercio. Las islas con puertos de agua segura, como Singapur , han florecido por la misma razón. En lugares como el norte de África y Oriente Medio, donde el agua es más escasa, el acceso al agua potable fue y es un factor importante para el desarrollo humano.
Salud y contaminación

El agua apta para el consumo humano se denomina agua potable. El agua que no es potable puede volverse potable mediante filtración o destilación , o mediante una variedad de otros métodos . Más de 660 millones de personas no tienen acceso a agua potable segura. [109] [110]
El agua que no es apta para beber pero que no es dañina para los humanos cuando se utiliza para nadar o bañarse recibe diversos nombres además de agua potable o agua potable, y a veces se la llama agua segura o "segura para bañarse". El cloro es un irritante de la piel y las membranas mucosas que se utiliza para que el agua sea segura para bañarse o beber. Su uso es altamente técnico y suele estar controlado por regulaciones gubernamentales (normalmente 1 parte por millón (ppm) para el agua potable y 1-2 ppm de cloro que aún no haya reaccionado con impurezas para el agua de baño). El agua para bañarse puede mantenerse en condiciones microbiológicas satisfactorias utilizando desinfectantes químicos como el cloro o el ozono o mediante el uso de luz ultravioleta .
La recuperación de agua es el proceso de convertir las aguas residuales (más comúnmente aguas residuales , también llamadas aguas residuales municipales) en agua que puede reutilizarse para otros fines. Hay 2.300 millones de personas que residen en países con escasez de agua, lo que significa que cada individuo recibe menos de 1.700 metros cúbicos (60.000 pies cúbicos) de agua al año. Cada año se producen a nivel mundial 380 mil millones de metros cúbicos (13 × 10 12 pies cúbicos) de aguas residuales municipales. [111] [112] [113]^
El agua dulce es un recurso renovable, que se recircula mediante el ciclo hidrológico natural , pero las presiones sobre el acceso a ella son resultado de la distribución naturalmente desigual en el espacio y el tiempo, las crecientes demandas económicas de la agricultura y la industria y el aumento de la población. En la actualidad, casi mil millones de personas en todo el mundo carecen de acceso a agua potable y asequible. En 2000, las Naciones Unidas establecieron los Objetivos de Desarrollo del Milenio para el agua a fin de reducir a la mitad para 2015 la proporción de personas en todo el mundo sin acceso a agua potable y saneamiento . El progreso hacia esa meta fue desigual, y en 2015 la ONU se comprometió con los Objetivos de Desarrollo Sostenible de lograr el acceso universal a agua potable y saneamiento asequible para 2030. La mala calidad del agua y el saneamiento deficiente son mortales; unos cinco millones de muertes al año son causadas por enfermedades relacionadas con el agua. La Organización Mundial de la Salud estima que el agua potable podría prevenir 1,4 millones de muertes infantiles por diarrea cada año. [114]
En los países en desarrollo, el 90% de todas las aguas residuales municipales todavía llegan sin tratamiento a los ríos y arroyos locales. [115] Unos 50 países, con aproximadamente un tercio de la población mundial, también sufren de escasez de agua media o alta y 17 de ellos extraen más agua anualmente de la que se recarga a través de sus ciclos hídricos naturales. [116] La presión no sólo afecta a los cuerpos de agua dulce superficiales como ríos y lagos, sino que también degrada los recursos de agua subterránea.
Usos humanos

Agricultura
El uso humano más importante del agua es la agricultura, incluida la agricultura de regadío, que representa entre el 80 y el 90 por ciento del consumo humano total de agua. [118] En los Estados Unidos, el 42% del agua dulce extraída para su uso se destina al riego, pero la gran mayoría del agua "consumida" (utilizada y no devuelta al medio ambiente) se destina a la agricultura. [119]
El acceso al agua potable suele darse por sentado, especialmente en los países desarrollados que han construido sofisticados sistemas de recolección, purificación y distribución de agua, y eliminación de aguas residuales. Pero las crecientes presiones económicas, demográficas y climáticas están aumentando las preocupaciones sobre los problemas del agua, lo que lleva a una mayor competencia por los recursos hídricos fijos, dando lugar al concepto de pico hídrico . [120] A medida que las poblaciones y las economías siguen creciendo, el consumo de carne sedienta de agua se expande y surgen nuevas demandas de biocombustibles o nuevas industrias que consumen mucha agua, es probable que surjan nuevos desafíos hídricos. [121]
En 2007, el Instituto Internacional de Gestión del Agua de Sri Lanka realizó una evaluación de la gestión del agua en la agricultura para ver si el mundo tenía agua suficiente para proporcionar alimentos a su creciente población. [122] Se evaluó la disponibilidad actual de agua para la agricultura a escala mundial y se trazaron mapas de las ubicaciones que sufren escasez de agua. Se encontró que una quinta parte de la población mundial, más de 1.200 millones, vive en zonas de escasez física de agua , donde no hay agua suficiente para satisfacer todas las demandas. Otros 1.600 millones de personas viven en zonas que experimentan escasez económica de agua , donde la falta de inversión en agua o la capacidad humana insuficiente hacen imposible que las autoridades satisfagan la demanda de agua. El informe concluyó que sería posible producir los alimentos necesarios en el futuro, pero que la continuación de la producción de alimentos y las tendencias ambientales actuales conducirían a crisis en muchas partes del mundo. Para evitar una crisis mundial del agua, los agricultores tendrán que esforzarse por aumentar la productividad para satisfacer las crecientes demandas de alimentos, mientras que las industrias y las ciudades encuentran formas de utilizar el agua de manera más eficiente. [123]
La escasez de agua también es causada por la producción de productos que requieren un uso intensivo de agua. Por ejemplo, el algodón : para producir 1 kg de algodón (equivalente a un par de jeans) se necesitan 10,9 metros cúbicos de agua. Si bien el algodón representa el 2,4% del uso mundial de agua, el agua se consume en regiones que ya corren el riesgo de sufrir escasez de agua. Se han causado daños ambientales significativos: por ejemplo, el desvío de agua por parte de la ex Unión Soviética de los ríos Amu Darya y Syr Darya para producir algodón fue en gran medida responsable de la desaparición del Mar de Aral . [124]
- Necesidad de agua por tonelada de producto alimenticio
- Distribución de agua en riego por goteo subterráneo
- Riego de cultivos extensivos
Como estándar científico
El 7 de abril de 1795, el gramo se definió en Francia como igual al «peso absoluto de un volumen de agua pura igual a un cubo de una centésima de metro, y a la temperatura de fusión del hielo». [125] Sin embargo, para fines prácticos, se requería un patrón de referencia metálico, mil veces más pesado que el kilogramo. Por lo tanto, se encargó un trabajo para determinar con precisión la masa de un litro de agua. A pesar de que la definición decretada del gramo especificaba agua a 0 °C (32 °F) —una temperatura altamente reproducible— , los científicos optaron por redefinir el patrón y realizar sus mediciones a la temperatura de mayor densidad del agua , que se medía en ese momento como 4 °C (39 °F). [126]
La escala de temperatura Kelvin del sistema SI se basaba en el punto triple del agua, definido exactamente como 273,16 K (0,01 °C; 32,02 °F), pero a partir de mayo de 2019 se basa en la constante de Boltzmann . La escala es una escala de temperatura absoluta con el mismo incremento que la escala de temperatura Celsius, que originalmente se definió de acuerdo con el punto de ebullición (establecido en 100 °C (212 °F)) y el punto de fusión (establecido en 0 °C (32 °F)) del agua.
El agua natural se compone principalmente de los isótopos hidrógeno-1 y oxígeno-16, pero también hay una pequeña cantidad de isótopos más pesados oxígeno-18, oxígeno-17 e hidrógeno-2 ( deuterio ). El porcentaje de los isótopos más pesados es muy pequeño, pero aún así afecta las propiedades del agua. El agua de los ríos y lagos tiende a contener menos isótopos pesados que el agua de mar. Por lo tanto, el agua estándar se define en la especificación de agua oceánica media estándar de Viena .
Para beber



El cuerpo humano contiene entre un 55% y un 78% de agua, dependiendo del tamaño corporal. [127] [ ¿ fuente generada por el usuario? ] Para funcionar correctamente, el cuerpo requiere entre uno y siete litros (0,22 y 1,54 imp gal; 0,26 y 1,85 US gal) [ cita requerida ] de agua por día para evitar la deshidratación ; la cantidad precisa depende del nivel de actividad, la temperatura, la humedad y otros factores. La mayor parte de esto se ingiere a través de alimentos o bebidas distintos al beber agua pura. No está claro cuánta ingesta de agua necesitan las personas sanas, aunque la Asociación Dietética Británica recomienda que 2,5 litros de agua total al día es el mínimo para mantener una hidratación adecuada, incluidos 1,8 litros (6 a 7 vasos) obtenidos directamente de las bebidas. [128] La literatura médica favorece un consumo menor, típicamente 1 litro de agua para un hombre promedio, excluyendo los requisitos adicionales debido a la pérdida de líquido por ejercicio o clima cálido. [129]
Los riñones sanos pueden excretar de 0,8 a 1 litro de agua por hora, pero el estrés, como el ejercicio, puede reducir esta cantidad. Las personas pueden beber mucha más agua de la necesaria mientras hacen ejercicio, lo que las pone en riesgo de intoxicación hídrica (hiperhidratación), que puede ser fatal. [130] [131] La afirmación popular de que "una persona debería consumir ocho vasos de agua al día" parece no tener una base científica real. [132] Los estudios han demostrado que la ingesta adicional de agua, especialmente hasta 500 mililitros (18 onzas líquidas imp; 17 onzas líquidas estadounidenses) a la hora de comer, se asoció con la pérdida de peso. [133] [134] [135] [136] [137] [138] La ingesta adecuada de líquidos es útil para prevenir el estreñimiento. [139]

Una recomendación original para la ingesta de agua en 1945 por parte del Consejo de Alimentos y Nutrición del Consejo Nacional de Investigación de los EE. UU. decía: "Un estándar ordinario para personas diversas es 1 mililitro por cada caloría de alimento. La mayor parte de esta cantidad está contenida en alimentos preparados". [140] El último informe de ingesta de referencia dietética por parte del Consejo Nacional de Investigación de los EE. UU. en general recomendaba, basándose en la ingesta total media de agua de los datos de la encuesta de los EE. UU. (incluyendo fuentes de alimentos): 3,7 litros (0,81 gal imp; 0,98 gal EE. UU.) para hombres y 2,7 litros (0,59 gal imp; 0,71 gal EE. UU.) de agua total para mujeres, señalando que el agua contenida en los alimentos proporcionó aproximadamente el 19% de la ingesta total de agua en la encuesta. [141]
En concreto, las mujeres embarazadas y lactantes necesitan líquidos adicionales para mantenerse hidratadas. El Instituto de Medicina de Estados Unidos recomienda que, de media, los hombres consuman 3 litros (0,66 gal imp; 0,79 gal EE.UU.) y las mujeres 2,2 litros (0,48 gal imp; 0,58 gal EE.UU.); las mujeres embarazadas deberían aumentar la ingesta a 2,4 litros (0,53 gal imp; 0,63 gal EE.UU.) y las mujeres lactantes deberían consumir 3 litros (12 tazas), ya que durante la lactancia se pierde una cantidad especialmente grande de líquido. [142] También se observa que normalmente, alrededor del 20% de la ingesta de agua procede de los alimentos, mientras que el resto procede del agua potable y de las bebidas ( incluidas las que contienen cafeína ). El agua se excreta del cuerpo de múltiples formas: a través de la orina y las heces , a través del sudor y por la exhalación de vapor de agua en el aliento. Con el esfuerzo físico y la exposición al calor, la pérdida de agua aumentará y también pueden aumentar las necesidades diarias de líquidos.
Los seres humanos necesitamos agua con pocas impurezas. Las impurezas más comunes son las sales y óxidos metálicos, como el cobre, el hierro, el calcio y el plomo [143] [ cita completa requerida ] y las bacterias nocivas, como Vibrio . Algunos solutos son aceptables e incluso deseables para mejorar el sabor y proporcionar los electrolitos necesarios [144] .
El mayor recurso de agua dulce (en términos de volumen) apto para beber es el lago Baikal en Siberia. [145]
Lavado

El lavado es un método de limpieza que se realiza habitualmente con agua y jabón o detergente . El lavado regular y posterior enjuague del cuerpo y la ropa es parte esencial de una buena higiene y salud. [146] [147] [148]
A menudo, las personas utilizan jabones y detergentes para ayudar a emulsionar los aceites y las partículas de suciedad y poder eliminarlas. El jabón se puede aplicar directamente, con la ayuda de una toallita o con la ayuda de esponjas o herramientas de limpieza similares .
En contextos sociales, el lavado se refiere al acto de bañarse o lavar diferentes partes del cuerpo, como las manos , el cabello o la cara . El lavado excesivo puede dañar el cabello, causando caspa, o causar piel áspera o lesiones cutáneas. [149] [150] Algunos lavados del cuerpo se realizan ritualmente en religiones como el cristianismo y el judaísmo, como un acto de purificación .
El lavado también puede referirse al lavado de objetos. Por ejemplo, lavar ropa u otros artículos de tela, como sábanas, o lavar platos o utensilios de cocina . Mantener limpios los objetos, especialmente si interactúan con los alimentos o la piel, puede ayudar con la higiene. Otros tipos de lavado se centran en mantener la limpieza y la durabilidad de los objetos que se ensucian, como lavar el coche , enjabonando el exterior con jabón para coches, o lavar las herramientas utilizadas en un proceso sucio.

Transporte
El transporte marítimo (o transporte oceánico) o, más generalmente, el transporte por agua, es el transporte de personas ( pasajeros ) o mercancías ( carga ) por vías navegables . El transporte de mercancías por mar se ha utilizado ampliamente a lo largo de la historia registrada . La llegada de la aviación ha disminuido la importancia de los viajes por mar para los pasajeros, aunque sigue siendo popular para viajes cortos y cruceros de placer . El transporte por agua es más barato que el transporte por aire o tierra, [151] pero significativamente más lento para distancias más largas. El transporte marítimo representa aproximadamente el 80% del comercio internacional , según la UNCTAD en 2020.
El transporte marítimo se puede realizar a cualquier distancia en barco, navío, velero o barcaza , sobre océanos y lagos, a través de canales o a lo largo de ríos. El envío puede ser para fines comerciales , recreativos o militares . Si bien el transporte interior extensivo es menos crítico hoy en día, las principales vías fluviales del mundo, incluidos muchos canales, siguen siendo muy importantes y son partes integrales de las economías mundiales . En particular, especialmente cualquier material puede transportarse por agua; sin embargo, el transporte por agua se vuelve poco práctico cuando la entrega de material es crítica en el tiempo, como varios tipos de productos perecederos . Aún así, el transporte por agua es muy rentable con cargas programadas regulares, como el envío transoceánico de productos de consumo, y especialmente para cargas pesadas o cargas a granel , como carbón , coque , minerales o granos . Podría decirse que la Revolución Industrial tuvo sus primeros impactos donde el transporte acuático barato por canal, las navegaciones o el envío por todo tipo de embarcaciones en vías fluviales naturales apoyaron el transporte a granel rentable .
La contenerización revolucionó el transporte marítimo a partir de la década de 1970. La "carga general" incluye mercancías embaladas en cajas, cajones, palés y barriles. Cuando una carga se transporta en más de un modo, se denomina intermodal o comodal .Usos químicos
El agua se utiliza ampliamente en reacciones químicas como disolvente o reactivo y, con menos frecuencia, como soluto o catalizador. En reacciones inorgánicas, el agua es un disolvente común, que disuelve muchos compuestos iónicos, así como otros compuestos polares como el amoniaco y compuestos estrechamente relacionados con el agua . En reacciones orgánicas, no se suele utilizar como disolvente de reacción, porque no disuelve bien los reactivos y es anfótero (ácido y básico) y nucleófilo . Sin embargo, estas propiedades a veces son deseables. Además, se ha observado la aceleración de las reacciones de Diels-Alder por el agua. El agua supercrítica ha sido recientemente un tema de investigación. El agua supercrítica saturada de oxígeno quema contaminantes orgánicos de manera eficiente.
Intercambio de calor
El agua y el vapor son un fluido común utilizado para el intercambio de calor , debido a su disponibilidad y alta capacidad térmica , tanto para enfriar como para calentar. El agua fría puede incluso estar disponible de forma natural en un lago o en el mar. Es especialmente eficaz para transportar calor a través de la vaporización y condensación del agua debido a su gran calor latente de vaporización . Una desventaja es que los metales que se encuentran comúnmente en industrias como el acero y el cobre se oxidan más rápido con agua y vapor sin tratar. En casi todas las centrales térmicas , el agua se utiliza como fluido de trabajo (se utiliza en un circuito cerrado entre la caldera, la turbina de vapor y el condensador) y como refrigerante (se utiliza para intercambiar el calor residual con un cuerpo de agua o llevarlo por evaporación en una torre de enfriamiento ). En los Estados Unidos, la refrigeración de las centrales eléctricas es el mayor uso de agua. [152]
En la industria de la energía nuclear , el agua también se puede utilizar como moderador de neutrones . En la mayoría de los reactores nucleares , el agua es tanto refrigerante como moderador. Esto proporciona una especie de medida de seguridad pasiva, ya que retirar el agua del reactor también ralentiza la reacción nuclear . Sin embargo, se prefieren otros métodos para detener una reacción y se prefiere mantener el núcleo nuclear cubierto con agua para garantizar una refrigeración adecuada.
Consideraciones sobre incendios

El agua tiene un alto calor de vaporización y es relativamente inerte, lo que la convierte en un buen líquido extintor de incendios . La evaporación del agua aleja el calor del fuego. Es peligroso utilizar agua en incendios que involucran aceites y solventes orgánicos porque muchos materiales orgánicos flotan en el agua y esta tiende a esparcir el líquido en llamas.
El uso de agua para combatir incendios también debe tener en cuenta los riesgos de una explosión de vapor , que puede ocurrir cuando se utiliza agua en incendios muy calientes en espacios confinados, y de una explosión de hidrógeno, cuando las sustancias que reaccionan con el agua, como ciertos metales o carbono caliente como el carbón, el carbón vegetal o el grafito de coque , descomponen el agua y producen gas de agua .
La potencia de tales explosiones se vio en el desastre de Chernóbil , aunque en este caso el agua involucrada no procedía de la extinción del incendio, sino del propio sistema de refrigeración por agua del reactor. La explosión de vapor se produjo cuando el sobrecalentamiento extremo del núcleo hizo que el agua se convirtiera en vapor. Es posible que se produjera una explosión de hidrógeno como resultado de una reacción entre el vapor y el circonio caliente .
Algunos óxidos metálicos, sobre todo los de metales alcalinos y alcalinotérreos , producen tanto calor en reacción con el agua que pueden provocar un incendio. El óxido alcalinotérreo cal viva , también conocido como óxido de calcio, es una sustancia producida en masa que suele transportarse en bolsas de papel. Si estas se empapan, pueden incendiarse al reaccionar su contenido con el agua. [153]
Recreación

Los seres humanos utilizan el agua para muchos fines recreativos, así como para hacer ejercicio y practicar deportes. Algunos de estos incluyen natación, esquí acuático , paseos en bote , surf y buceo . Además, algunos deportes, como el hockey sobre hielo y el patinaje sobre hielo , se practican sobre hielo. Las orillas de los lagos, las playas y los parques acuáticos son lugares populares para que la gente vaya a relajarse y disfrutar de la recreación. Muchos encuentran que el sonido y la apariencia del agua fluyendo son relajantes, y las fuentes y otras estructuras de agua fluyente son decoraciones populares. Algunos mantienen peces y otra flora y fauna dentro de acuarios o estanques para exhibición, diversión y compañía. Los seres humanos también utilizan el agua para deportes de nieve como esquí , trineo , motos de nieve o snowboard , que requieren que el agua esté a baja temperatura, ya sea como hielo o cristalizada en nieve .
Industria del agua
La industria del agua proporciona servicios de agua potable y de tratamiento de aguas residuales (incluido el tratamiento de aguas residuales ) a hogares e industrias. Las instalaciones de suministro de agua incluyen pozos de agua , cisternas para la recolección de agua de lluvia , redes de suministro de agua e instalaciones de purificación de agua , tanques de agua , torres de agua y tuberías de agua , incluidos acueductos antiguos . Se están desarrollando generadores de agua atmosféricos .
El agua potable se recoge a menudo en manantiales , se extrae de perforaciones artificiales (pozos) en el suelo o se bombea de lagos y ríos. Por lo tanto, la construcción de más pozos en lugares adecuados es una forma posible de producir más agua, suponiendo que los acuíferos puedan suministrar un flujo adecuado. Otras fuentes de agua incluyen la recolección de agua de lluvia. El agua puede requerir purificación para el consumo humano. Esto puede implicar la eliminación de sustancias no disueltas, sustancias disueltas y microbios dañinos . Los métodos populares son el filtrado con arena que solo elimina el material no disuelto, mientras que la cloración y la ebullición matan los microbios dañinos. La destilación realiza las tres funciones. Existen técnicas más avanzadas, como la ósmosis inversa . La desalinización de abundante agua de mar es una solución más cara utilizada en climas áridos costeros .
La distribución de agua potable se realiza a través de los sistemas municipales de agua , camiones cisterna o en forma de agua embotellada . Los gobiernos de muchos países tienen programas para distribuir agua a los necesitados sin costo alguno.
Otra opción es reducir el consumo de agua potable únicamente para consumo humano. En algunas ciudades, como Hong Kong, se utiliza ampliamente el agua de mar para las cisternas de los inodoros de toda la ciudad con el fin de conservar los recursos de agua dulce .
La contaminación del agua puede ser el mayor mal uso del agua; en la medida en que un contaminante limita otros usos del agua, se convierte en un desperdicio del recurso, independientemente de los beneficios para el contaminador. Al igual que otros tipos de contaminación, esto no entra en la contabilidad estándar de los costos de mercado, siendo concebido como externalidades que el mercado no puede tener en cuenta. Así, otras personas pagan el precio de la contaminación del agua, mientras que las ganancias de las empresas privadas no se redistribuyen a la población local, víctima de esta contaminación. Los productos farmacéuticos consumidos por los humanos a menudo terminan en los cursos de agua y pueden tener efectos perjudiciales para la vida acuática si se bioacumulan y si no son biodegradables .
Las aguas residuales industriales y municipales suelen tratarse en plantas de tratamiento de aguas residuales . La mitigación de la escorrentía superficial contaminada se aborda mediante una variedad de técnicas de prevención y tratamiento .
- Un portador de agua en la India, 1882. En muchos lugares donde no hay agua corriente disponible, el agua tiene que ser transportada por personas.
- Una bomba de agua manual en China
- Instalación de purificación de agua
Aplicaciones industriales
Muchos procesos industriales se basan en reacciones que utilizan sustancias químicas disueltas en agua, la suspensión de sólidos en lodos acuosos o el uso de agua para disolver y extraer sustancias, o para lavar productos o equipos de proceso. Procesos como la minería , la fabricación de pulpa química , el blanqueo de pulpa, la fabricación de papel , la producción textil, el teñido, la impresión y el enfriamiento de plantas de energía utilizan grandes cantidades de agua, lo que requiere una fuente de agua dedicada y, a menudo, causa una importante contaminación del agua.
El agua se utiliza para generar energía . La hidroelectricidad es la electricidad que se obtiene a partir de la energía hidroeléctrica . La energía hidroeléctrica proviene del agua que impulsa una turbina conectada a un generador. La hidroelectricidad es una fuente de energía renovable, no contaminante y de bajo costo. La energía se obtiene mediante el movimiento del agua. Por lo general, se construye una presa en un río, creando un lago artificial detrás de él. El agua que fluye fuera del lago pasa a través de turbinas que hacen girar generadores.
El agua a presión se utiliza en las máquinas de corte por chorro de agua y de chorro de agua . Las pistolas de agua a alta presión se utilizan para realizar cortes precisos. Funciona muy bien, es relativamente segura y no es perjudicial para el medio ambiente. También se utiliza para enfriar maquinaria para evitar el sobrecalentamiento o para evitar que las hojas de sierra se sobrecalienten.
El agua también se utiliza en muchos procesos y máquinas industriales, como la turbina de vapor y el intercambiador de calor , además de su uso como disolvente químico . El vertido de agua no tratada procedente de usos industriales es contaminación . La contaminación incluye solutos vertidos (contaminación química) y agua refrigerante vertida ( contaminación térmica ). La industria requiere agua pura para muchas aplicaciones y utiliza una variedad de técnicas de purificación tanto en el suministro como en el vertido de agua.
Procesamiento de alimentos


Hervir , cocinar al vapor y hervir a fuego lento son métodos de cocción populares que a menudo requieren sumergir los alimentos en agua o en su estado gaseoso, vapor. [154] El agua también se utiliza para lavar platos . El agua también desempeña muchas funciones críticas dentro del campo de la ciencia de los alimentos .
Los solutos, como las sales y los azúcares, que se encuentran en el agua afectan las propiedades físicas del agua. Los puntos de ebullición y congelación del agua se ven afectados por los solutos, así como por la presión del aire , que a su vez se ve afectada por la altitud. El agua hierve a temperaturas más bajas con la menor presión del aire que se produce a mayores altitudes. Un mol de sacarosa (azúcar) por kilogramo de agua eleva el punto de ebullición del agua en 0,51 °C (0,918 °F), y un mol de sal por kg eleva el punto de ebullición en 1,02 °C (1,836 °F); de manera similar, aumentar el número de partículas disueltas reduce el punto de congelación del agua. [155]
Los solutos en el agua también afectan la actividad del agua que afecta muchas reacciones químicas y el crecimiento de microbios en los alimentos. [156] La actividad del agua se puede describir como una relación entre la presión de vapor del agua en una solución y la presión de vapor del agua pura. [155] Los solutos en el agua reducen la actividad del agua; es importante saberlo porque la mayor parte del crecimiento bacteriano cesa en niveles bajos de actividad del agua. [156] El crecimiento microbiano no solo afecta la seguridad de los alimentos, sino también la conservación y la vida útil de los alimentos.
La dureza del agua también es un factor crítico en el procesamiento de alimentos y puede ser alterada o tratada mediante un sistema de intercambio iónico químico. Puede afectar drásticamente la calidad de un producto, además de desempeñar un papel en el saneamiento. La dureza del agua se clasifica en función de la concentración de carbonato de calcio que contiene. El agua se clasifica como blanda si contiene menos de 100 mg/L (Reino Unido) [157] o menos de 60 mg/L (EE. UU.) [158] .
Según un informe publicado por la organización Water Footprint en 2010, un solo kilogramo de carne de res requiere 15 mil litros (3,3 × 10 3 imp gal; 4,0 × 10 3 US gal) de agua; sin embargo, los autores también aclaran que se trata de un promedio mundial y que factores circunstanciales determinan la cantidad de agua utilizada en la producción de carne de res. [159]^^
Uso médico
El agua para inyección está en la lista de medicamentos esenciales de la Organización Mundial de la Salud . [160]
Distribución en la naturaleza
En el universo

Gran parte del agua del universo se produce como subproducto de la formación de estrellas . La formación de estrellas va acompañada de un fuerte viento de gas y polvo que sale hacia el exterior. Cuando este flujo de material finalmente impacta en el gas circundante, las ondas de choque que se crean comprimen y calientan el gas. El agua que se observa se produce rápidamente en este gas cálido y denso. [162]
El 22 de julio de 2011, un informe describía el descubrimiento de una gigantesca nube de vapor de agua que contenía "140 billones de veces más agua que todos los océanos de la Tierra juntos" alrededor de un cuásar situado a 12.000 millones de años luz de la Tierra. Según los investigadores, el "descubrimiento demuestra que el agua ha estado presente en el universo durante casi toda su existencia". [163] [164]
Se ha detectado agua en las nubes interestelares de la Vía Láctea . [165] Es probable que también exista agua en abundancia en otras galaxias, porque sus componentes, hidrógeno y oxígeno, se encuentran entre los elementos más abundantes del universo. Según los modelos de formación y evolución del Sistema Solar y de otros sistemas estelares, es probable que la mayoría de los demás sistemas planetarios tengan ingredientes similares.
Vapor de agua
El agua está presente en forma de vapor en:
- Atmósfera del Sol : en cantidades traza detectables [166]
- Atmósfera de Mercurio : 3,4% y grandes cantidades de agua en la exosfera de Mercurio [167]
- Atmósfera de Venus : 0,002% [168]
- Atmósfera de la Tierra : aproximadamente el 0,40 % de la atmósfera total, normalmente entre el 1 y el 4 % en la superficie; así como la de la Luna en cantidades traza [169]
- Atmósfera de Marte : 0,03% [170]
- Atmósfera de Ceres [171]
- Atmósfera de Júpiter : 0,0004% [172] – sólo en hielos ; y la de su luna Europa [173]
- Atmósfera de Saturno – sólo en hielos ; Encélado : 91% [174] y Dione (exosfera) [ cita requerida ]
- Atmósfera de Urano – en cantidades traza por debajo de 50 bar
- Atmósfera de Neptuno : se encuentra en las capas más profundas [175]
- Atmósferas de planetas extrasolares : incluidas las de HD 189733 b [176] y HD 209458 b , [177] Tau Boötis b , [178] HAT-P-11b , [179] [180] XO-1b , WASP-12b , WASP-17b y WASP-19b . [181]
- Atmósferas estelares : no se limitan a las estrellas más frías e incluso se detectan en estrellas calientes gigantes como Betelgeuse , Mu Cephei , Antares y Arcturus . [180] [182]
- Discos circunestelares : incluidos los de más de la mitad de las estrellas T Tauri , como AA Tauri [180] , así como TW Hydrae [183] [184] IRC +10216 [185] y APM 08279+5255 [ 163] [164] VY Canis Majoris y S Persei [182] .
Agua liquida
El agua líquida está presente en la Tierra, cubriendo el 71% de su superficie. [23] El agua líquida también está presente ocasionalmente en pequeñas cantidades en Marte . [186] Los científicos creen que el agua líquida está presente en las lunas saturnianas de Encélado , como un océano de 10 kilómetros de espesor aproximadamente a 30-40 kilómetros por debajo de la superficie polar sur de Encélado, [187] [188] y Titán , como una capa subsuperficial, posiblemente mezclada con amoníaco . [189] La luna Europa de Júpiter tiene características superficiales que sugieren un océano de agua líquida subsuperficial. [190] El agua líquida también puede existir en la luna de Júpiter, Ganímedes, como una capa intercalada entre hielo y roca a alta presión. [191]
Hielo de agua
El agua está presente en forma de hielo en:

- Marte : bajo el regolito y en los polos. [192] [193]
- Sistema Tierra-Luna: principalmente como capas de hielo en la Tierra y en cráteres lunares y rocas volcánicas [194] La NASA informó sobre la detección de moléculas de agua por el Moon Mineralogy Mapper de la NASA a bordo de la nave espacial Chandrayaan-1 de la Organización de Investigación Espacial de la India en septiembre de 2009. [195]
- Ceres [196] [197] [198]
- Las lunas de Júpiter: la superficie de Europa y también la de Ganímedes [199] y Calisto [200] [201]
- Saturno: en el sistema de anillos del planeta [202] y en la superficie y el manto de Titán [203] y Encélado [204]
- Sistema Plutón - Caronte [202]
- Cometas [205] [206] y otros objetos relacionados con el cinturón de Kuiper y la nube de Oort [207]
Y también es probable que esté presente en:
Formas exóticas
El agua y otros compuestos volátiles probablemente comprenden gran parte de las estructuras internas de Urano y Neptuno y el agua en las capas más profundas puede estar en forma de agua iónica en la que las moléculas se descomponen en una sopa de iones de hidrógeno y oxígeno, y aún más profunda como agua superiónica en la que el oxígeno cristaliza, pero los iones de hidrógeno flotan libremente dentro de la red de oxígeno. [210]
El agua y la habitabilidad planetaria
La existencia de agua líquida y, en menor medida, de sus formas gaseosas y sólidas en la Tierra es vital para la existencia de vida en la Tierra tal como la conocemos. La Tierra está situada en la zona habitable del Sistema Solar ; si estuviera ligeramente más cerca o más lejos del Sol (aproximadamente un 5%, o unos 8 millones de kilómetros), las condiciones que permiten que las tres formas estén presentes simultáneamente serían mucho menos probables de existir. [211] [212]
La gravedad de la Tierra le permite mantener una atmósfera . El vapor de agua y el dióxido de carbono en la atmósfera proporcionan un amortiguador de temperatura ( efecto invernadero ) que ayuda a mantener una temperatura superficial relativamente estable. Si la Tierra fuera más pequeña, una atmósfera más delgada permitiría temperaturas extremas, impidiendo así la acumulación de agua, excepto en los casquetes polares (como en Marte ). [ cita requerida ]
La temperatura de la superficie de la Tierra ha sido relativamente constante a lo largo del tiempo geológico a pesar de los distintos niveles de radiación solar entrante ( insolación ), lo que indica que un proceso dinámico rige la temperatura de la Tierra a través de una combinación de gases de efecto invernadero y el albedo superficial o atmosférico . Esta propuesta se conoce como la hipótesis de Gaia . [ cita requerida ]
El estado del agua en un planeta depende de la presión ambiental, que está determinada por la gravedad del planeta. Si un planeta es lo suficientemente masivo, el agua que contiene puede ser sólida incluso a altas temperaturas, debido a la alta presión causada por la gravedad, como se observó en los exoplanetas Gliese 436 b [213] y GJ 1214 b [214] .
Derecho, política y crisis
This section needs to be updated. (June 2022) |

La política del agua es la política afectada por el agua y los recursos hídricos . El agua, en particular el agua dulce, es un recurso estratégico en todo el mundo y un elemento importante en muchos conflictos políticos. Provoca impactos en la salud y daños a la biodiversidad.
El acceso al agua potable ha mejorado en las últimas décadas en casi todas las partes del mundo, pero aproximadamente mil millones de personas aún carecen de acceso a agua potable y más de 2.500 millones carecen de acceso a un saneamiento adecuado . [215] Sin embargo, algunos observadores han estimado que para 2025 más de la mitad de la población mundial se enfrentará a una vulnerabilidad basada en el agua. [216] Un informe, publicado en noviembre de 2009, sugiere que para 2030, en algunas regiones en desarrollo del mundo, la demanda de agua superará la oferta en un 50%. [217]
Desde 1990, 1.600 millones de personas han obtenido acceso a una fuente de agua potable. [218] Se calcula que la proporción de personas en los países en desarrollo con acceso a agua potable ha mejorado del 30% en 1970 [219] al 71% en 1990, al 79% en 2000 y al 84% en 2004. [215]
Un informe de las Naciones Unidas de 2006 afirmó que "hay suficiente agua para todos", pero que el acceso a ella se ve obstaculizado por la mala gestión y la corrupción. [220] Además, las iniciativas mundiales para mejorar la eficiencia de la prestación de la ayuda, como la Declaración de París sobre la Eficacia de la Ayuda , no han sido adoptadas por los donantes del sector del agua con tanta eficacia como lo han sido en el caso de la educación y la salud, lo que potencialmente deja a múltiples donantes trabajando en proyectos superpuestos y a los gobiernos receptores sin poder para actuar. [221]
Los autores de la Evaluación Integral de la Gestión del Agua en la Agricultura de 2007 citaron la mala gobernanza como una de las razones de algunas formas de escasez de agua. La gobernanza del agua es el conjunto de procesos formales e informales mediante los cuales se toman decisiones relacionadas con la gestión del agua. La buena gobernanza del agua consiste principalmente en saber qué procesos funcionan mejor en un contexto físico y socioeconómico particular. A veces se han cometido errores al intentar aplicar "modelos" que funcionan en el mundo desarrollado a lugares y contextos del mundo en desarrollo. El río Mekong es un ejemplo; un examen realizado por el Instituto Internacional de Gestión del Agua de las políticas de seis países que dependen del río Mekong para obtener agua concluyó que rara vez se realizaban análisis de costo-beneficio y evaluaciones de impacto ambiental exhaustivos y transparentes. También descubrieron que el proyecto de ley del agua de Camboya era mucho más complejo de lo que debía ser. [222]
En 2004, la organización benéfica británica WaterAid informó que un niño muere cada 15 segundos por enfermedades relacionadas con el agua que se pueden prevenir fácilmente y que a menudo están vinculadas a la falta de saneamiento adecuado. [223] [224]
Desde 2003, el Informe Mundial sobre el Desarrollo de los Recursos Hídricos de las Naciones Unidas , elaborado por el Programa Mundial de Evaluación de los Recursos Hídricos de la UNESCO , ha proporcionado a los responsables de la toma de decisiones herramientas para desarrollar políticas hídricas sostenibles . [225] El informe de 2023 afirma que dos mil millones de personas (el 26% de la población) no tienen acceso a agua potable y 3.600 millones (el 46%) carecen de acceso a servicios de saneamiento gestionados de forma segura. [226] Las personas que viven en zonas urbanas (2.400 millones) se enfrentarán a la escasez de agua en 2050. [225] La escasez de agua se ha descrito como endémica, debido al consumo excesivo y la contaminación . [227] El informe afirma que el 10% de la población mundial vive en países con estrés hídrico alto o crítico. Sin embargo, en los últimos 40 años, el consumo de agua ha aumentado alrededor de un 1% por año y se espera que crezca al mismo ritmo hasta 2050. Desde 2000, las inundaciones en los trópicos se han cuadriplicado, mientras que las inundaciones en las latitudes medias del norte se han multiplicado por 2,5. [228] El costo de estas inundaciones entre 2000 y 2019 fue de 100.000 muertes y 650 millones de dólares. [225]
Entre las organizaciones que se ocupan de la protección del agua se encuentran la Asociación Internacional del Agua (IWA), WaterAid, Water 1st y la Asociación Estadounidense de Recursos Hídricos. El Instituto Internacional de Gestión del Agua lleva a cabo proyectos cuyo objetivo es utilizar una gestión eficaz del agua para reducir la pobreza. Las convenciones relacionadas con el agua son la Convención de las Naciones Unidas de Lucha contra la Desertificación (CNULD), la Convención Internacional para la Prevención de la Contaminación por los Buques , la Convención de las Naciones Unidas sobre el Derecho del Mar y la Convención de Ramsar . El Día Mundial del Agua se celebra el 22 de marzo [229] y el Día Mundial de los Océanos el 8 de junio. [230]
En la cultura
Religión

El agua se considera un purificador en la mayoría de las religiones. Las religiones que incorporan el lavado ritual ( ablución ) incluyen el cristianismo , [231] el hinduismo , el islam , el judaísmo , el movimiento rastafari , el sintoísmo , el taoísmo y la wicca . La inmersión (o aspersión o afusión ) de una persona en agua es un sacramento central del cristianismo (donde se llama bautismo ); también es parte de la práctica de otras religiones, incluido el islam ( ghusl ), el judaísmo ( mikvah ) y el sijismo ( amrit sanskar ). Además, se realiza un baño ritual en agua pura para los muertos en muchas religiones, incluido el islam y el judaísmo. En el islam, las cinco oraciones diarias se pueden hacer en la mayoría de los casos después de lavar ciertas partes del cuerpo con agua limpia ( wudu ), a menos que no haya agua disponible (ver Tayammum ). En el sintoísmo, el agua se utiliza en casi todos los rituales para limpiar a una persona o un área (por ejemplo, en el ritual del misogi ).
En el cristianismo, el agua bendita es agua que ha sido santificada por un sacerdote con el propósito del bautismo , la bendición de personas, lugares y objetos, o como un medio para repeler el mal. [232] [233]
En el zoroastrismo , el agua ( āb ) es respetada como fuente de vida. [234]
Filosofía

El filósofo griego Empédocles consideraba que el agua era uno de los cuatro elementos clásicos (junto con el fuego, la tierra y el aire ) y la consideraba un ylem o sustancia básica del universo. Tales , a quien Aristóteles describió como un astrónomo e ingeniero, teorizó que la tierra, que es más densa que el agua, surgió del agua. Tales, un monista , creía además que todas las cosas están hechas de agua. Platón creía que la forma del agua es un icosaedro , que fluye fácilmente en comparación con la Tierra, que tiene forma de cubo. [235]
La teoría de los cuatro humores corporales asociaba el agua con la flema , por ser fría y húmeda. El elemento clásico del agua también era uno de los cinco elementos de la filosofía tradicional china (junto con la tierra , el fuego , la madera y el metal ).
Algunos sistemas filosóficos asiáticos tradicionales y populares toman el agua como modelo a seguir. La traducción del Dao De Jing de James Legge de 1891 afirma: "La excelencia más alta es como (la del) agua. La excelencia del agua se manifiesta en que beneficia a todas las cosas y en que ocupa, sin esforzarse (por lo contrario), el lugar bajo que a todos los hombres les desagrada. Por lo tanto (su camino) está cerca (del del) Tao " y "No hay nada en el mundo más blando y débil que el agua, y sin embargo, para atacar cosas que son firmes y fuertes no hay nada que pueda tener precedencia sobre ella, porque no hay nada (tan eficaz) por lo que pueda ser cambiada". [236] Guanzi en el capítulo "Shui di" 水地 profundiza más sobre el simbolismo del agua, proclamando que "el hombre es agua" y atribuyendo cualidades naturales de la gente de diferentes regiones chinas al carácter de los recursos hídricos locales. [237]
Folklore
El "agua viva" aparece en los cuentos populares germánicos y eslavos como un medio para devolver la vida a los muertos. Téngase en cuenta el cuento de hadas de los hermanos Grimm (" El agua de la vida ") y la dicotomía rusa de agua viva y muerta . La fuente de la juventud representa un concepto relacionado de aguas mágicas que supuestamente previenen el envejecimiento.
Arte y activismo
En la importante novela modernista Ulises (1922) del escritor irlandés James Joyce , el capítulo "Ítaca" toma la forma de un catecismo de 309 preguntas y respuestas, una de las cuales se conoce como el "himno del agua". [238] : 91 Según Richard E. Madtes, el himno no es simplemente una "cadena monótona de hechos", sino que sus frases, como su tema, "fluyen y refluyen, se elevan y se hinchan, se juntan y se rompen, hasta que se hunden en la tranquila quietud de los 'pantanos pestilentes, agua de flores marchitas, charcas estancadas en la luna menguante' finales". [ 238] : 79 El himno se considera uno de los pasajes más notables de Ítaca y, según el crítico literario Hugh Kenner , logra "la improbable hazaña de elevar a la poesía todo el desorden de información inútil que se ha acumulado en los libros escolares". [238] : 91 El motivo literario del agua representa el tema de la novela de "vida eterna y siempre cambiante", y el himno representa la culminación del motivo en la novela. [238] : 91 El siguiente es el himno citado en su totalidad. [239]
¿Qué admiraba en el agua Bloom, amante del agua, recogedor de agua, portador de agua que regresaba a la cordillera?
Su universalidad: su igualdad democrática y su constancia con su naturaleza en la búsqueda de su propio nivel: su vastedad en el océano de la proyección de Mercator: su profundidad insondable en la fosa Sundam del Pacífico que excede las 8.000 brazas: la inquietud de sus olas y partículas superficiales que visitan a su vez todos los puntos de su litoral: la independencia de sus unidades: la variabilidad de los estados del mar: su quietud hidrostática en calma: su turgencia hidrocinética en mareas muertas y vivas: su hundimiento después de la devastación: su esterilidad en los casquetes polares, árticos y antárticos: su importancia climática y comercial: su preponderancia de 3 a 1 sobre la tierra firme del globo: su hegemonía indiscutible que se extiende en leguas cuadradas sobre toda la región debajo del trópico subecuatorial de Capricornio: la estabilidad multisecular de su cuenca primigenia: su lecho lúteofulvioso: su capacidad para disolver y mantener en solución todas las sustancias solubles, incluyendo millones de toneladas de los metales más preciosos: su erosiones lentas de penínsulas y promontorios descendentes: sus depósitos aluviales: su peso, volumen y densidad: su imperturbabilidad en lagunas y estanques de tierras altas: su gradación de colores en las zonas tórridas, templadas y frías: sus ramificaciones vehiculares en corrientes continentales contenidas en lagos y ríos oceánicos confluentes con sus afluentes y corrientes transoceánicas: corriente del golfo, cursos ecuatoriales norte y sur: su violencia en maremotos, trombas marinas, pozos artesianos, erupciones, torrentes, remolinos, crecidas, marejadas, cuencas hidrográficas, divisorias de aguas, géiseres, cataratas, remolinos, vorágines, inundaciones, diluvios, aguaceros: su vasta curva ahorizontal circunterrestre: su secreto en manantiales y humedad latente, revelada por instrumentos rabdománticos o higrométricos y ejemplificada por el pozo junto al agujero en el muro de la puerta de Ashtown, la saturación del aire, la destilación del rocío: la simplicidad de su composición, dos partes constituyentes de hidrógeno con una parte constituyente de oxígeno: sus virtudes curativas: su flotabilidad en las aguas del Mar Muerto: su perseverante capacidad de penetración en canales, barrancos, presas inadecuadas, fugas a bordo: sus propiedades para limpiar, saciar la sed y el fuego, nutrir la vegetación: su infalibilidad como paradigma y modelo: sus metamorfosis como vapor, niebla, nube, lluvia, aguanieve, nieve, granizo: su fuerza en hidrantes rígidos: su variedad de formas en lagos y bahías y golfos y ensenadas y entrañas y lagunas y atolones y archipiélagos y estrechos y fiordos y minches y estuarios de marea y brazos de mar: su solidez en glaciares, icebergs, témpanos de hielo: su docilidad para hacer funcionar ruedas de molino hidráulicas, turbinas, dinamos, centrales eléctricas, blanquerías, tenerías, molinos de sable: su utilidad en canales, ríos, si son navegables, diques flotantes y de sepultura: su potencialidad derivable de las mareas aprovechadas o de los cursos de agua que caen de nivel en nivel: su fauna y flora submarina (anacústica, fotófoba) numéricamente,si no literalmente, los habitantes del globo: su ubicuidad al constituir el 90% del cuerpo humano: la nocividad de sus efluvios en pantanos lacustres, ciénagas pestilentes, agua de flores marchitas, charcas estancadas en la luna menguante.

La pintora y activista Fredericka Foster curó The Value of Water (El valor del agua) en la Catedral de San Juan el Divino de la ciudad de Nueva York, [240] que sirvió de base a una iniciativa de un año de la Catedral sobre nuestra dependencia del agua. [241] [242] La exposición más grande que se haya presentado jamás en la Catedral, [243] contó con la participación de más de cuarenta artistas, entre ellos Jenny Holzer , Robert Longo , Mark Rothko , William Kentridge , April Gornik , Kiki Smith , Pat Steir , Alice Dalton Brown , Teresita Fernández y Bill Viola . [244] [245] Foster creó Think About Water (Piensa en el agua), [246] [ cita completa requerida ] un colectivo ecológico de artistas que utilizan el agua como tema o medio. Los miembros incluyen a Basia Irland, [247] [ cita completa necesaria ] Aviva Rahmani , Betsy Damon , Diane Burko , Leila Daw , Stacy Levy , Charlotte Coté, [248] Meridel Rubenstein y Anna Macleod .
Para conmemorar el décimo aniversario de la declaración de la ONU sobre el acceso al agua y al saneamiento como un derecho humano, la organización benéfica WaterAid encargó a diez artistas visuales que mostraran el impacto del agua potable en la vida de las personas. [249] [250]
Parodia del monóxido de dihidrógeno
El "monóxido de dihidrógeno" es un nombre químico técnicamente correcto, pero poco utilizado , para el agua. Este nombre se ha utilizado en una serie de engaños y bromas que se burlan del analfabetismo científico . Esto comenzó en 1983, cuando apareció un artículo del Día de los Inocentes en un periódico de Durand, Michigan . La historia falsa consistía en preocupaciones sobre la seguridad de la sustancia. [251]
Música
La palabra "Agua" ha sido utilizada por muchos raperos de Florida como una especie de eslogan o improvisación. Los raperos que han hecho esto incluyen a BLP Kosher y Ski Mask the Slump God . [252] Para ir aún más lejos, algunos raperos han hecho canciones enteras dedicadas al agua en Florida, como la canción de Danny Towers de 2023 "Florida Water". [253] Otros han hecho canciones enteras dedicadas al agua en su conjunto, como XXXTentacion y Ski Mask the Slump God con su exitosa canción "H2O".
Véase también
- Esquema del agua : descripción general y guía temática sobre el agua
- Agua (página de datos) – La página de datos químicos del agua es una colección de las propiedades químicas y físicas del agua.
- Acuafobia : Miedo persistente y anormal al agua.
- Techo azul : Techo de un edificio que está diseñado para proporcionar almacenamiento temporal de agua.
- Catchwater – Dispositivo para captar o canalizar la escorrentía
- Derecho humano al agua y al saneamiento
- Hidroelectricidad – Electricidad generada por energía hidroeléctrica
- Energía de corrientes marinas : Extracción de energía de las corrientes oceánicas
- Energía marina – Energía disponible en los océanos
- Efecto Mpemba : fenómeno natural por el cual el agua caliente se congela más rápido que la fría
- Terapia de rehidratación oral : tipo de reemplazo de líquidos utilizado para prevenir y tratar la deshidratación.
- Energía osmótica : energía disponible a partir de la diferencia de concentración de sal entre el agua de mar y el agua del río.
- Oxihidrógeno – Mezcla explosiva de gases de hidrógeno y oxígeno.
- Propiedades del agua – Propiedades físicas y químicas del agua pura
- Tanque de agua de lluvia : contenedor utilizado para recoger agua de lluvia.Pages displaying wikidata descriptions as a fallback
- Sed : Deseo de beber líquidos que experimentan los animales.
- Energía maremotriz : tecnología para convertir la energía de las mareas en formas útiles de energía
- Análisis de consumo de agua : una técnica sistemática para reducir el consumo de agua y la generación de aguas residualesPages displaying wikidata descriptions as a fallback
- Energía de las olas : transporte de energía mediante las olas del viento y captura de esa energía para realizar un trabajo útil.
- Filtro de agua – Dispositivo que elimina las impurezas del agua.
- Reciclaje de calor del agua : uso de un intercambiador de calor para recuperar energía y reutilizar el calor del agua de drenaje
- Ducha de reciclaje de agua
- Diseño urbano sensible al agua : enfoque integrado del ciclo urbano del agua
Notas
- ^ Un valor comúnmente citado de 15,7, utilizado principalmente en química orgánica para el pKa del agua, es incorrecto. [12] [13]
- ^ El agua oceánica estándar de Viena (VSMOW), utilizada para la calibración, se funde a 273,1500089(10) K (0,000089(10) °C y hierve a 373,1339 K (99,9839 °C). Otras composiciones isotópicas se funden o hierven a temperaturas ligeramente diferentes.
- ^ ver la sección de sabor y olor
- ^ Otras sustancias con esta propiedad incluyen el bismuto , el silicio , el germanio y el galio . [53]
Referencias
- ^ "denominación de compuestos moleculares". www.iun.edu . Archivado desde el original el 24 de septiembre de 2018 . Consultado el 1 de octubre de 2018 .
A veces, estos compuestos tienen nombres genéricos o comunes (p. ej., H2O es "agua") y también tienen nombres sistemáticos (p. ej., H2O, monóxido de dihidrógeno).
- ^ "Definición de hidrol". Merriam-Webster . Archivado desde el original el 13 de agosto de 2017. Consultado el 21 de abril de 2019 .
- ^ Leigh, Favre y Metanomski 1998, pág. 99.
- ^ Braun CL, Smirnov SN (1 de agosto de 1993). "¿Por qué el agua es azul?" (PDF) . Journal of Chemical Education . 70 (8): 612. Bibcode :1993JChEd..70..612B. doi :10.1021/ed070p612. ISSN 0021-9584. Archivado (PDF) desde el original el 1 de diciembre de 2019. Consultado el 13 de septiembre de 2023 .
- ^ abc Tanaka M, Girard G, Davis R, Peuto A, Bignell N (agosto de 2001). "Tabla recomendada para la densidad del agua entre 0 C y 40 C basada en informes experimentales recientes". Metrologia . 38 (4): 301–309. doi :10.1088/0026-1394/38/4/3.
- ^ Lemmon EW, Bell IH, Huber ML, McLinden MO. "Propiedades termofísicas de los sistemas de fluidos". En Linstrom P, Mallard W (eds.). NIST Chemistry WebBook, base de datos de referencia estándar del NIST número 69. Instituto Nacional de Estándares y Tecnología. doi :10.18434/T4D303. Archivado desde el original el 23 de octubre de 2023. Consultado el 17 de octubre de 2023 .
- ^ Lide 2003, Propiedades del hielo y del agua superenfriada en la Sección 6.
- ^ abc Anatolievich KR. «Propiedades de la sustancia: agua». Archivado desde el original el 2 de junio de 2014. Consultado el 1 de junio de 2014 .
- ^ Lide 2003, Presión de vapor de agua de 0 a 370 °C en la Sec. 6.
- ^ Lide 2003, Capítulo 8: Constantes de disociación de ácidos y bases inorgánicos.
- ^ Weingärtner y col. 2016, pág. 13.
- ^ "¿Cuál es el pKa del agua?". Universidad de California, Davis . 9 de agosto de 2015. Archivado desde el original el 14 de febrero de 2016. Consultado el 9 de abril de 2016 .
- ^ Silverstein TP, Heller ST (17 de abril de 2017). "Valores de pKa en el currículo de pregrado: ¿cuál es el pKa real del agua?". Journal of Chemical Education . 94 (6): 690–695. Bibcode :2017JChEd..94..690S. doi :10.1021/acs.jchemed.6b00623.
- ^ Ramires ML, Castro CA, Nagasaka Y, Nagashima A, Assael MJ, Wakeham WA (1 de mayo de 1995). "Datos de referencia estándar para la conductividad térmica del agua". Revista de datos de referencia físicos y químicos . 24 (3): 1377–1381. Código Bib : 1995JPCRD..24.1377R. doi : 10.1063/1.555963. ISSN 0047-2689.
- ^ Lide 2003, 8—Propiedades de concentración de soluciones acuosas: densidad, índice de refracción, depresión del punto de congelación y viscosidad.
- ^ Lide 2003, 6.186.
- ^ abcd Agua en Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, Base de datos de referencia estándar del NIST número 69 , Instituto Nacional de Estándares y Tecnología, Gaithersburg (MD)
- ^ Lide 2003, 9—Momentos dipolares.
- ^ GHS: PubChem 962 Archivado el 28 de julio de 2023 en Wayback Machine.
- ^ "Preguntas y respuestas sobre el agua: ¿Por qué el agua es el "solvente universal"?". Escuela de Ciencias del Agua . Servicio Geológico de los Estados Unidos , Departamento del Interior de los Estados Unidos . 20 de junio de 2019. Archivado desde el original el 6 de febrero de 2021. Consultado el 15 de enero de 2021 .
- ^ "10.2: Orbitales híbridos en el agua". Chemistry LibreTexts . 18 de marzo de 2020. Archivado desde el original el 30 de julio de 2022 . Consultado el 11 de abril de 2021 .
- ^ Butler J. "La Tierra – Introducción – Meteorización". Universidad de Houston. Archivado desde el original el 30 de enero de 2023. Consultado el 30 de enero de 2023.
Nótese que el entorno de la Tierra está cerca del punto triple y que el agua, el vapor y el hielo pueden existir en la superficie.
- ^ ab "¿Cuánta agua hay en la Tierra?". Escuela de Ciencias del Agua . Servicio Geológico de los Estados Unidos , Departamento del Interior de los Estados Unidos . 13 de noviembre de 2019. Archivado desde el original el 9 de junio de 2022. Consultado el 8 de junio de 2022 .
- ^ ab Gleick, PH, ed. (1993). Water in Crisis: A Guide to the World's Freshwater Resources. Oxford University Press . p. 13, Tabla 2.1 "Reservas de agua en la Tierra". Archivado desde el original el 8 de abril de 2013.
- ^ Vapor de agua en el sistema climático Archivado el 20 de marzo de 2007 en Wayback Machine , Informe especial, [AGU], diciembre de 1995 (enlace 4/2007). Agua vital Archivado el 20 de febrero de 2008 en Wayback Machine PNUMA .
- ^ Baroni, L., Cenci, L., Tettamanti, M., Berati, M. (2007). "Evaluación del impacto ambiental de varios patrones dietéticos combinados con diferentes sistemas de producción de alimentos". Revista Europea de Nutrición Clínica . 61 (2): 279–286. doi : 10.1038/sj.ejcn.1602522 . ISSN 0954-3007. PMID 17035955.
- ^ Troell M, Naylor RL, Metian M, Beveridge M, Tyedmers PH, Folke C, et al. (16 de septiembre de 2014). "¿Agrega la acuicultura resiliencia al sistema alimentario global?". Actas de la Academia Nacional de Ciencias . 111 (37): 13257–13263. Bibcode :2014PNAS..11113257T. doi : 10.1073/pnas.1404067111 . ISSN 0027-8424. PMC 4169979 . PMID 25136111.
- ^ "Agua (v.)". www.etymonline.com . Diccionario Etimológico Online. Archivado desde el original el 2 de agosto de 2017 . Consultado el 20 de mayo de 2017 .
- ^ Pepin RO (julio de 1991). "Sobre el origen y la evolución temprana de las atmósferas de los planetas terrestres y los volátiles meteoríticos". Icarus . 92 (1): 2–79. Bibcode :1991Icar...92....2P. doi :10.1016/0019-1035(91)90036-s. ISSN 0019-1035.
- ^ Zahnle KJ, Gacesa M, Catling DC (enero de 2019). "Mensajero extraño: una nueva historia del hidrógeno en la Tierra, contada por Xenon". Geochimica et Cosmochimica Acta . 244 : 56–85. arXiv : 1809.06960 . Código Bibliográfico :2019GeCoA.244...56Z. doi :10.1016/j.gca.2018.09.017. ISSN 0016-7037. S2CID 119079927.
- ^ Canup RM , Asphaug E (agosto de 2001). "Origen de la Luna en un impacto gigante cerca del final de la formación de la Tierra". Nature . 412 (6848): 708–712. Bibcode :2001Natur.412..708C. doi :10.1038/35089010. ISSN 0028-0836. PMID 11507633. S2CID 4413525.
- ^ Cuk M, Stewart ST (17 de octubre de 2012). "Creación de la Luna a partir de una Tierra que gira rápidamente: un impacto gigante seguido de un desprendimiento resonante". Science . 338 (6110): 1047–1052. Bibcode :2012Sci...338.1047C. doi : 10.1126/science.1225542 . ISSN 0036-8075. PMID 23076099. S2CID 6909122.
- ^ Sleep NH, Zahnle K, Neuhoff PS (2001). "Inicio de condiciones de superficie clementes en la Tierra más temprana". Actas de la Academia Nacional de Ciencias . 98 (7): 3666–3672. Bibcode :2001PNAS...98.3666S. doi : 10.1073/pnas.071045698 . PMC 31109 . PMID 11259665.
- ^ ab Pinti DL, Arndt N (2014), "Océanos, origen de", Enciclopedia de Astrobiología , Springer Berlin Heidelberg, págs. 1–5, doi :10.1007/978-3-642-27833-4_1098-4, ISBN 978-3-642-27833-4
- ^ Cates N, Mojzsis S (marzo de 2007). "Rocas supracrustales anteriores a 3750 Ma del cinturón supracrustal de Nuvvuagittuq, norte de Quebec". Earth and Planetary Science Letters . 255 (1–2): 9–21. Bibcode :2007E&PSL.255....9C. doi :10.1016/j.epsl.2006.11.034. ISSN 0012-821X.
- ^ O'Neil J, Carlson RW, Paquette JL, Francis D (noviembre de 2012). "Edad de formación e historia metamórfica del Cinturón de Piedras Verdes de Nuvvuagittuq" (PDF) . Investigación precámbrica . 220–221: 23–44. Código Bibliográfico :2012PreR..220...23O. doi :10.1016/j.precamres.2012.07.009. ISSN 0301-9268.
- ^ Piani, Laurette (28 de agosto de 2020). «El agua de la Tierra puede haber sido heredada de material similar a los meteoritos de condrita de enstatita». Science . 369 (6507): 1110–1113. Bibcode :2020Sci...369.1110P. doi :10.1126/science.aba1948. PMID 32855337. S2CID 221342529 . Consultado el 28 de agosto de 2020 .
- ^ Washington University en St. Louis (27 de agosto de 2020). "Un estudio sobre meteoritos sugiere que la Tierra puede haber estado húmeda desde que se formó: los meteoritos de condrita de enstatita, que alguna vez se consideraron 'secos', contienen suficiente agua para llenar los océanos... y algo más". EurekAlert! . Consultado el 28 de agosto de 2020 .
- ^ Asociación Estadounidense para el Avance de la Ciencia (27 de agosto de 2020). «La abundancia inesperada de hidrógeno en meteoritos revela el origen del agua de la Tierra». EurekAlert! . Consultado el 28 de agosto de 2020 .
- ^ Wilde S, Valley J, Peck W, Graham C (2001). "Evidencias de circones detríticos de la existencia de corteza continental y océanos en la Tierra hace 4,4 nGyr" (PDF) . Nature . 409 (6817): 175–8. Bibcode :2001Natur.409..175W. doi :10.1038/35051550. PMID 11196637. S2CID 4319774.
- ^ "ANU - Escuela de Investigación de Ciencias de la Tierra - Facultad de Ciencias de la ANU - Harrison". Ses.anu.edu.au. Archivado desde el original el 21 de junio de 2006. Consultado el 20 de agosto de 2009 .
- ^ "ANU - OVC - MEDIOS - COMUNICADOS DE PRENSA - 2005 - NOVIEMBRE - 181105HARRISONCONTINENTS". Info.anu.edu.au . Consultado el 20 de agosto de 2009 .
- ^ "Una Tierra primitiva y fría". Geology.wisc.edu. Archivado desde el original el 16 de junio de 2013. Consultado el 20 de agosto de 2009 .
- ^ Chang K (2 de diciembre de 2008). "Una nueva imagen de la Tierra primitiva". The New York Times . Consultado el 20 de mayo de 2010 .
- ^ Greenwood NN , Earnshaw A (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 620. ISBN. 978-0-08-037941-8.
- ^ "El agua, el disolvente universal". USGS . Archivado desde el original el 9 de julio de 2017 . Consultado el 27 de junio de 2017 .
- ^ "Propiedades disolventes del agua". Khan Academy .
- ^ Reece JB (2013). Biología de Campbell (10.ª ed.). Pearson . pág. 48. ISBN 978-0-321-77565-8.
- ^ Reece JB (2013). Biología de Campbell (10.ª ed.). Pearson . pág. 44. ISBN 978-0-321-77565-8.
- ^ Leigh GJ, Favre HA, Metanomski WV (1998). Principios de nomenclatura química: una guía para las recomendaciones de la IUPAC (PDF) . Oxford: Blackwell Science. ISBN 978-0-86542-685-6. OCLC 37341352. Archivado desde el original (PDF) el 26 de julio de 2011.
- ^ PubChem. «Agua». Centro Nacional de Información Biotecnológica. Archivado desde el original el 3 de agosto de 2018. Consultado el 25 de marzo de 2020 .
- ^ ab Belnay L. "El ciclo del agua" (PDF) . Actividades de pensamiento crítico . Laboratorio de Investigación del Sistema Terrestre. Archivado (PDF) del original el 20 de septiembre de 2020. Consultado el 25 de marzo de 2020 .
- ^ ab Oliveira MJ (2017). Termodinámica del equilibrio. Springer. pp. 120–124. ISBN 978-3-662-53207-2Archivado del original el 8 de marzo de 2021 . Consultado el 26 de marzo de 2020 .
- ^ "¿Qué es la densidad?". Mettler Toledo . Archivado desde el original el 11 de noviembre de 2022. Consultado el 11 de noviembre de 2022 .
- ^ ab Ball P (2008). «El agua, un misterio perdurable». Nature . 452 (7185): 291–2. Bibcode :2008Natur.452..291B. doi : 10.1038/452291a . PMID 18354466. S2CID 4365814. Archivado desde el original el 17 de noviembre de 2016 . Consultado el 15 de noviembre de 2016 .
- ^ Kotz JC, Treichel P, Weaver GC (2005). Química y reactividad química . Thomson Brooks/Cole. ISBN 978-0-534-39597-1.
- ^ Ben-Naim A, Ben-Naim R, et al. (2011). Las aventuras de Alicia en el país del agua . doi :10.1142/8068. ISBN 978-981-4338-96-7.
- ^ Matsuoka N, Murton J (2008). "Meteorización por heladas: avances recientes y direcciones futuras". Procesos periglaciales y permafrost . 19 (2): 195–210. Bibcode :2008PPPr...19..195M. doi :10.1002/ppp.620. S2CID 131395533.
- ^ Wiltse B. "Una mirada bajo el hielo: ecología de los lagos invernales". Asociación del río Ausable . Archivado desde el original el 19 de junio de 2020. Consultado el 23 de abril de 2020 .
- ^ ab Chen Z (21 de abril de 2010). "Medición del diamagnetismo en el agua". hdl :11299/90865. Archivado desde el original el 8 de enero de 2022 . Consultado el 8 de enero de 2022 .
- ^ Wells S (21 de enero de 2017). «La belleza y la ciencia de los copos de nieve». Centro de Educación Científica del Instituto Smithsoniano . Archivado desde el original el 25 de marzo de 2020. Consultado el 25 de marzo de 2020 .
- ^ Fellows P (2017). "Liofilización y concentración por congelación". Tecnología de procesamiento de alimentos: principios y práctica (4.ª ed.). Kent: Woodhead Publishing/Elsevier Science. págs. 929–940. ISBN 978-0-08-100523-1.OCLC 960758611 .
- ^ Siegert MJ, Ellis-Evans JC, Tranter M, Mayer C, Petit JR, Salamatin A, et al. (diciembre de 2001). "Procesos físicos, químicos y biológicos en el lago Vostok y otros lagos subglaciales antárticos". Nature . 414 (6864): 603–609. Bibcode :2001Natur.414..603S. doi :10.1038/414603a. PMID 11740551. S2CID 4423510.
- ^ Davies B. «Lagos subglaciales antárticos». AntarcticGlaciers . Archivado desde el original el 3 de octubre de 2020. Consultado el 25 de marzo de 2020 .
- ^ Masterton WL, Hurley CN (2008). Química: principios y reacciones (6.ª ed.). Cengage Learning. pág. 230. ISBN 978-0-495-12671-3Archivado del original el 8 de marzo de 2021 . Consultado el 3 de abril de 2020 .
- ^ Peaco J. "Plan de lección de Yellowstone: cómo entran en erupción los géiseres de Yellowstone". Parque Nacional de Yellowstone: Servicio de Parques Nacionales de EE. UU. Archivado desde el original el 2 de marzo de 2020. Consultado el 5 de abril de 2020 .
- ^ Brahic C. «Se ha descubierto el agua más caliente de la Tierra». New Scientist . Archivado desde el original el 9 de mayo de 2020. Consultado el 5 de abril de 2020 .
- ^ Servicio de Inspección y Seguridad Alimentaria del USDA. «Cocina a gran altitud y seguridad alimentaria» (PDF) . Archivado desde el original (PDF) el 20 de enero de 2021. Consultado el 5 de abril de 2020 .
- ^ "Cocción a presión: ciencia de los alimentos". Exploratorium . 26 de septiembre de 2019. Archivado desde el original el 19 de junio de 2020 . Consultado el 21 de abril de 2020 .
- ^ Allain R (12 de septiembre de 2018). "Sí, puedes hervir agua a temperatura ambiente. Aquí te explicamos cómo". Wired . Archivado desde el original el 28 de septiembre de 2020. Consultado el 5 de abril de 2020 .
- ^ Murphy DM, Koop T (1 de abril de 2005). "Revisión de las presiones de vapor del hielo y el agua superenfriada para aplicaciones atmosféricas". Quarterly Journal of the Royal Meteorological Society . 131 (608): 1540. Bibcode :2005QJRMS.131.1539M. doi : 10.1256/qj.04.94 . S2CID 122365938. Archivado desde el original el 18 de agosto de 2020 . Consultado el 31 de agosto de 2020 .
- ^ Oficina Internacional de Pesas y Medidas (2006). El Sistema Internacional de Unidades (SI) (PDF) (8.ª ed.). Bureau International des Poids et Mesures. pág. 114. ISBN 92-822-2213-6. Archivado (PDF) del original el 14 de agosto de 2017.
- ^ "9.ª edición del folleto del SI". BIPM. 2019. Archivado desde el original el 19 de abril de 2021. Consultado el 20 de mayo de 2019 .
- ^ Wagner W, Pruß A (junio de 2002). "La formulación IAPWS 1995 para las propiedades termodinámicas de la sustancia agua ordinaria para uso general y científico". Journal of Physical and Chemical Reference Data . 31 (2): 398. doi :10.1063/1.1461829.
- ^ Weingärtner H, Franck UE (29 de abril de 2005). "Agua supercrítica como disolvente". Edición internacional Angewandte Chemie . 44 (18): 2672–2692. doi :10.1002/anie.200462468. PMID 15827975.
- ^ Adschiri T, Lee YW, Goto M, Takami S (2011). "Síntesis de materiales verdes con agua supercrítica". Química verde . 13 (6): 1380. doi :10.1039/c1gc15158d.
- ^ Murray BJ, Knopf DA, Bertram AK (2005). "La formación de hielo cúbico en condiciones relevantes para la atmósfera de la Tierra". Nature . 434 (7030): 202–205. Bibcode :2005Natur.434..202M. doi :10.1038/nature03403. PMID 15758996. S2CID 4427815.
- ^ Salzmann CG (14 de febrero de 2019). "Avances en la exploración experimental del diagrama de fases del agua". The Journal of Chemical Physics . 150 (6): 060901. arXiv : 1812.04333 . Bibcode :2019JChPh.150f0901S. doi : 10.1063/1.5085163 . PMID 30770019.
- ^ Sokol J (12 de mayo de 2019). «Una extraña forma de agua podría existir en todo el universo». Wired . Archivado desde el original el 12 de mayo de 2019. Consultado el 1 de septiembre de 2021 .
- ^ Millot M, Coppari F, Rygg JR, Barrios AC, Hamel S, Swift DC, et al. (2019). "Difracción de rayos X en nanosegundos de hielo de agua superiónico comprimido por choque". Nature . 569 (7755). Springer: 251–255. Código Bibliográfico :2019Natur.569..251M. doi :10.1038/s41586-019-1114-6. OSTI 1568026. PMID 31068720. S2CID 148571419. Archivado desde el original el 9 de julio de 2023 . Consultado el 5 de marzo de 2024 .
- ^ Peplow M (25 de marzo de 2015). "El sándwich de grafeno crea una nueva forma de hielo". Nature . doi :10.1038/nature.2015.17175. S2CID 138877465.
- ^ Maestro LM, Marqués MI, Camarillo E, Jaque D, Solé JG, Gonzalo JA, et al. (1 de enero de 2016). "Sobre la existencia de dos estados en el agua líquida: impacto en sistemas biológicos y nanoscópicos" (PDF) . Revista Internacional de Nanotecnología . 13 (8–9): 667–677. Bibcode :2016IJNT...13..667M. doi :10.1504/IJNT.2016.079670. S2CID 5995302. Archivado (PDF) desde el original el 15 de noviembre de 2023 . Consultado el 5 de marzo de 2024 .
- ^ Mallamace F, Corsaro C, Stanley HE (18 de diciembre de 2012). "Una temperatura termodinámicamente consistente singular en el origen del comportamiento anómalo del agua líquida". Scientific Reports . 2 (1): 993. doi :10.1038/srep00993. PMC 3524791 . PMID 23251779.
- ^ Perakis F, Amann-Winkel K, Lehmkühler F, Sprung M, Mariedahl D, Sellberg JA, et al. (26 de junio de 2017). "Dinámica difusiva durante la transición de alta a baja densidad en hielo amorfo". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 13 (8–9): 667–677. Bibcode :2017PNAS..114.8193P. doi : 10.1073/pnas.1705303114 . PMC 5547632 . PMID 28652327.
- ^ Zocchi D, Wennemuth G, Oka Y (julio de 2017). "El mecanismo celular para la detección de agua en el sistema gustativo de los mamíferos" (PDF) . Nature Neuroscience . 20 (7): 927–933. doi :10.1038/nn.4575. PMID 28553944. S2CID 13263401. Archivado desde el original el 5 de marzo de 2024 . Consultado el 27 de enero de 2024 .
- ^ Edmund T. Rolls (2005). La emoción explicada . Oxford University Press, Medical. ISBN 978-0198570035 .
- ^ R. Llinas, W. Precht (2012), Neurobiología de la rana: un manual . Springer Science & Business Media. ISBN 978-3642663161
- ^ Candau J (2004). "La experiencia olfativa: constantes y variables culturales". Ciencia y tecnología del agua . 49 (9): 11–17. Bibcode :2004WSTec..49...11C. doi :10.2166/wst.2004.0522. PMID 15237601. Archivado desde el original el 2 de octubre de 2016 . Consultado el 28 de septiembre de 2016 .
- ^ Braun CL, Sergei N. Smirnov (1993). "¿Por qué el agua es azul?" . Journal of Chemical Education . 70 (8): 612. Bibcode :1993JChEd..70..612B. doi :10.1021/ed070p612. Archivado desde el original el 20 de marzo de 2012. Consultado el 21 de abril de 2007 .
- ^ Nakamoto K (1997). Espectros infrarrojos y Raman de compuestos inorgánicos y de coordinación, parte A: teoría y aplicaciones en química inorgánica (5.ª ed.). Nueva York: Wiley. pág. 170. ISBN 0-471-16394-5.
- ^ Ball 2001, pág. 168
- ^ Franks 2007, pág. 10
- ^ "Química física del agua". Universidad Estatal de Michigan. Archivado desde el original el 20 de octubre de 2020. Consultado el 11 de septiembre de 2020 .
- ^ Ball 2001, pág. 169
- ^ Isaacs ED, Shukla A, Platzman PM, Hamann DR, Barbiellini B, Tulk CA (1 de marzo de 2000). "Evidencia de dispersión Compton para la covalencia del enlace de hidrógeno en el hielo". Revista de Física y Química de Sólidos . 61 (3): 403–406. Código Bibliográfico :2000JPCS...61..403I. doi :10.1016/S0022-3697(99)00325-X.
- ^ Campbell NA, Williamson B, Heyden RJ (2006). Biología: explorando la vida. Boston: Pearson Prentice Hall. ISBN 978-0-13-250882-7Archivado desde el original el 2 de noviembre de 2014 . Consultado el 11 de noviembre de 2008 .
- ^ "Capacidad calorífica del agua en línea". Desmos (en ruso). Archivado desde el original el 6 de junio de 2022. Consultado el 3 de junio de 2022 .
- ^ Ball P (14 de septiembre de 2007). "Burning water and other myths" (Agua quemada y otros mitos). News@nature . doi : 10.1038/news070910-13 . S2CID: 129704116. Archivado desde el original el 28 de febrero de 2009. Consultado el 14 de septiembre de 2007 .
- ^ Fine RA, Millero FJ (1973). "Compresibilidad del agua en función de la temperatura y la presión". Journal of Chemical Physics . 59 (10): 5529. Bibcode :1973JChPh..59.5529F. doi :10.1063/1.1679903.
- ^ Laboratorio Nacional de Física del Reino Unido, Cálculo de la absorción del sonido en el agua de mar Archivado el 3 de octubre de 2016 en Wayback Machine . Sitio en línea, último acceso el 28 de septiembre de 2016.
- ^ Gleick PH, ed. (1993). Water in Crisis: A Guide to the World's Freshwater Resources. Oxford University Press. pág. 15, cuadro 2.3. Archivado desde el original el 8 de abril de 2013.
- ^ Ben-Naim A, Ben-Naim R (2011). Alicia en el país del agua . World Scientific Publishing. pág. 31. doi :10.1142/8068. ISBN 978-981-4338-96-7.
- ^ "recurso hídrico". Encyclopædia Britannica . Archivado desde el original el 2 de octubre de 2022 . Consultado el 17 de mayo de 2022 .
- ^ Gleick PH (1993). El agua en crisis. Nueva York: Oxford University Press . p. 13. ISBN 0-19-507627-3.
- ^ Wada Y, Van Beek LP, Bierkens MF (2012). "Agua subterránea no sostenible que sustenta el riego: una evaluación global". Water Resources Research . 48 (6): W00L06. Bibcode :2012WRR....48.0L06W. doi : 10.1029/2011WR010562 .
- ^ "El catalizador ayuda a dividir el agua: Plantas". AskNature . Archivado desde el original el 28 de octubre de 2020 . Consultado el 10 de septiembre de 2020 .
- ^ Hall D (2001). Fotosíntesis, sexta edición. Universidad de Cambridge. ISBN 0-521-64497-6Archivado desde el original el 5 de octubre de 2023 . Consultado el 26 de agosto de 2023 .
- ^ "Sobre el agua". Banco Europeo de Inversiones . Archivado desde el original el 14 de octubre de 2020. Consultado el 13 de octubre de 2020 .
- ^ Jammi R (13 de marzo de 2018). "2.400 millones sin saneamiento adecuado. 600 millones sin agua potable. ¿Podemos solucionarlo para 2030?". Grupo del Banco Mundial. Archivado desde el original el 14 de octubre de 2020. Consultado el 13 de octubre de 2020 .
- ^ "La recuperación de los recursos de aguas residuales puede solucionar la inseguridad hídrica y reducir las emisiones de carbono". Banco Europeo de Inversiones . Archivado desde el original el 29 de agosto de 2022. Consultado el 29 de agosto de 2022 .
- ^ "Decenio Internacional para la Acción 'El agua, fuente de vida' 2005-2015. Áreas prioritarias: escasez de agua". Naciones Unidas. Archivado desde el original el 23 de mayo de 2020. Consultado el 29 de agosto de 2022 .
- ^ "El estado de los recursos de tierras y agua del mundo para la alimentación y la agricultura" (PDF) . Archivado (PDF) del original el 31 de agosto de 2022 . Consultado el 30 de agosto de 2022 .
- ^ "Organización Mundial de la Salud. Agua potable y salud mundial". Organización Mundial de la Salud. 25 de junio de 2008. Archivado desde el original el 24 de diciembre de 2010. Consultado el 25 de julio de 2010 .
- ^ PNUMA Medio Ambiente Internacional (2002). Tecnología ambientalmente racional para la gestión de aguas residuales y pluviales: un libro de consulta internacional . IWA. ISBN 978-1-84339-008-4.OCLC 49204666 .
- ^ Ravindranath NH, Sathaye JA (2002). Cambio climático y países en desarrollo . Saltador. ISBN 978-1-4020-0104-8.OCLC 231965991 .
- ^ "Extracción de agua per cápita". Nuestro mundo en datos . Archivado desde el original el 12 de marzo de 2020. Consultado el 6 de marzo de 2020 .
- ^ "Datos y tendencias sobre el agua del WBCSD". Archivado desde el original el 1 de marzo de 2012. Consultado el 25 de julio de 2010 .
- ^ Dieter CA, Maupin MA, Caldwell RR, Harris MA, Ivahnenko TI, Lovelace JK, et al. (2018). "Estimated use of water in the United States in 2015" (Uso estimado de agua en los Estados Unidos en 2015). Circular . Servicio Geológico de Estados Unidos. pág. 76. doi :10.3133/cir1441. Archivado desde el original el 28 de abril de 2019 . Consultado el 21 de mayo de 2019 .
- ^ Gleick PH, Palaniappan M (2010). "Peak Water" (PDF) . Actas de la Academia Nacional de Ciencias . 107 (125): 11155–11162. Código Bibliográfico :2010PNAS..10711155G. doi : 10.1073/pnas.1004812107 . PMC 2895062 . PMID 20498082. Archivado (PDF) desde el original el 8 de noviembre de 2011 . Consultado el 11 de octubre de 2011 .
- ^ Comunicado de prensa de las Naciones Unidas POP/952 (13 de marzo de 2007). «La población mundial aumentará en 2.500 millones para 2050». Archivado el 27 de julio de 2014 en Wayback Machine.
- ^ , Molden, D. (Ed). Agua para la alimentación, agua para la vida: una evaluación integral de la gestión del agua en la agricultura . Earthscan/IWMI, 2007.
- ^ Chartres, C. y Varma, S. (2010) Sin agua. De la abundancia a la escasez y cómo resolver los problemas hídricos del mundo . FT Press (EE. UU.).
- ^ Chapagain AK, Hoekstra AY, Savenije HH, Guatam R (septiembre de 2005). "La huella hídrica del consumo de algodón" (PDF) . IHE Delft Institute for Water Education . Archivado (PDF) del original el 26 de marzo de 2019. Consultado el 24 de octubre de 2019 .
- ^ "Décret relatif aux poids et aux mesures" [Decreto relativo a los pesos y las medidas] (en francés). 18 germinal an 3 (7 de abril de 1795). Archivado el 25 de febrero de 2013 en Wayback Machine . quartier-rural.org
- ↑ aquí "L'Histoire Du Mètre, La Détermination De L'Unité De Poids" Archivado el 25 de julio de 2013 en Wayback Machine . histoire.du.metre.free.fr
- ^ "Re: ¿Qué porcentaje del cuerpo humano está compuesto de agua?" Archivado el 25 de noviembre de 2007 en Wayback Machine Jeffrey Utz, MD, The MadSci Network
- ^ "Vivir con agua de forma saludable". BBC Health . Archivado desde el original el 1 de enero de 2007. Consultado el 1 de febrero de 2007 .
- ^ Rhoades RA, Tanner GA (2003). Fisiología médica (2.ª ed.). Baltimore: Lippincott Williams & Wilkins. ISBN 978-0-7817-1936-0.OCLC 50554808 .
- ^ Noakes TD, Goodwin N, Rayner BL, et al. (1985). "Intoxicación por agua: una posible complicación durante el ejercicio de resistencia". Medicina y ciencia en deportes y ejercicio . 17 (3): 370–375. doi : 10.1249/00005768-198506000-00012 . PMID 4021781.
- ^ Noakes TD, Goodwin N, Rayner BL, Branken T, Taylor RK (2005). "Intoxicación por agua: una posible complicación durante el ejercicio de resistencia, 1985". Medicina ambiental y de la naturaleza . 16 (4): 221–227. doi :10.1580/1080-6032(2005)16[221:WIAPCD]2.0.CO;2. PMID 16366205. S2CID 28370290.
- ^ Valtin H (2002). «Bebe al menos ocho vasos de agua al día». ¿En serio? ¿Existe evidencia científica de la regla «8 × 8»? (PDF) . American Journal of Physiology. Regulatory, Integrative and Comparative Physiology . 283 (5): R993–R1004. doi :10.1152/ajpregu.00365.2002. PMID 12376390. S2CID 2256436. Archivado desde el original (PDF) el 22 de febrero de 2019.
- ^ Stookey JD, Constant F, Popkin BM, Gardner CD (noviembre de 2008). "Beber agua está asociado con la pérdida de peso en mujeres con sobrepeso que hacen dieta, independientemente de la dieta y la actividad". Obesity . 16 (11): 2481–2488. doi :10.1038/oby.2008.409. PMID 18787524. S2CID 24899383.
- ^ "¿Beber agua para frenar el aumento de peso? Un ensayo clínico confirma la eficacia de un método sencillo para controlar el apetito". Science Daily . 23 de agosto de 2010. Archivado desde el original el 7 de julio de 2017 . Consultado el 14 de mayo de 2017 .
- ^ Dubnov-Raz G, Constantini NW, Yariv H, Nice S, Shapira N (octubre de 2011). "Influencia del consumo de agua en el gasto energético en reposo de niños con sobrepeso". Revista Internacional de Obesidad . 35 (10): 1295–1300. doi :10.1038/ijo.2011.130. PMID 21750519. S2CID 27561994.
- ^ Dennis EA, Dengo AL, Comber DL, et al. (febrero de 2010). "El consumo de agua aumenta la pérdida de peso durante una intervención de dieta hipocalórica en adultos de mediana edad y mayores". Obesidad . 18 (2): 300–307. doi :10.1038/oby.2009.235. PMC 2859815 . PMID 19661958.
- ^ Vij VA, Joshi AS (septiembre de 2013). "Efecto de la 'termogénesis inducida por agua' en el peso corporal, el índice de masa corporal y la composición corporal de sujetos con sobrepeso". Revista de investigación clínica y diagnóstica . 7 (9): 1894–1896. doi :10.7860/JCDR/2013/5862.3344. PMC 3809630 . PMID 24179891.
- ^ Muckelbauer R, Sarganas G, Grüneis A, Müller-Nordhorn J (agosto de 2013). "Asociación entre el consumo de agua y los resultados del peso corporal: una revisión sistemática". The American Journal of Clinical Nutrition . 98 (2): 282–299. doi : 10.3945/ajcn.112.055061 . PMID 23803882. S2CID 12265434.
- ^ "Agua, estreñimiento, deshidratación y otros líquidos". Archivado el 4 de marzo de 2015 en Wayback Machine . Science Daily . Consultado el 28 de septiembre de 2015.
- ^ Food and Nutrition Board, National Academy of Sciences. Recommended Dietary Allowances . Consejo Nacional de Investigación, Reprint and Circular Series, n.º 122. 1945. págs. 3-18.
- ^ Instituto de Medicina, Consejo de Nutrición Alimentaria, Comité Permanente sobre la Evaluación Científica de las Ingestas Dietéticas de Referencia, Panel sobre Ingestas Dietéticas de Referencia para Electrolitos y Agua (2005). 4 Agua | Ingestas Dietéticas de Referencia para Agua, Potasio, Sodio, Cloruro y Sulfato. The National Academies Press. doi :10.17226/10925. ISBN 978-0-309-09169-5Archivado desde el original el 13 de enero de 2017 . Consultado el 11 de enero de 2017 .
- ^ "Agua: ¿cuánta debería beber cada día?". Mayo Clinic. Archivado desde el original el 4 de diciembre de 2010. Consultado el 25 de julio de 2010 .
- ^ Conquistando la química (4.ª ed.), 2008
- ^ Maton A, Hopkins J, McLaughlin CW, Johnson S, Warner MQ, LaHart D, et al. (1993). Biología humana y salud. Englewood Cliffs, Nueva Jersey: Prentice Hall. ISBN 978-0-13-981176-0.OCLC 32308337 .
- ^ Unesco (2006). El agua: una responsabilidad compartida. Berghahn Books. pág. 125. ISBN 978-1-84545-177-6.
- ^ Bockmühl DP, Schages J, Rehberg L (2019). "Higiene de la ropa y los textiles en el ámbito sanitario y más allá". Microbial Cell . 6 (7): 299–306. doi :10.15698/mic2019.07.682. ISSN 2311-2638. PMC 6600116 . PMID 31294042.
- ^ Moyer MW (23 de octubre de 2023). "¿Realmente necesitas ducharte todos los días?". The New York Times . ISSN 0362-4331 . Consultado el 22 de abril de 2024 .
- ^ Hadaway A (2 de enero de 2020). "Lavado de manos: las manos limpias salvan vidas". Revista de salud del consumidor en Internet . 24 (1): 43–49. doi :10.1080/15398285.2019.1710981. ISSN 1539-8285.
- ^ Ettinger J (22 de octubre de 2018). "Probablemente te lavas el cabello demasiado (¡de verdad!)". Autoridad orgánica . Consultado el 22 de abril de 2024 .
- ^ Petersen EE (7 de diciembre de 2005). Infecciones en obstetricia y ginecología: libro de texto y atlas. Thieme. págs. 6-13. ISBN 978-3-13-161511-4.
- ^ Stopford M (1 de enero de 1997). Maritime Economics. Psychology Press. pág. 10. ISBN 9780415153102.
- ^ "Uso del agua en los Estados Unidos", Atlas Nacional . Archivado el 14 de agosto de 2009 en Wayback Machine.
- ^ "Hoja de datos de seguridad del material: cal viva" (PDF) . Lhoist North America. 6 de agosto de 2012. Archivado (PDF) del original el 5 de julio de 2016 . Consultado el 24 de octubre de 2019 .
- ^ Duff LB (1916). Un curso de artes domésticas: Parte I. Whitcomb & Barrows. Archivado desde el original el 14 de abril de 2021. Consultado el 3 de diciembre de 2017 .
- ^ de Vaclavik VA, Christian EW (2007). Fundamentos de la ciencia de los alimentos. Springer. ISBN 978-0-387-69939-4Archivado del original el 14 de abril de 2021 . Consultado el 31 de agosto de 2020 .
- ^ ab DeMan JM (1999). Principios de química de los alimentos. Springer. ISBN 978-0-8342-1234-3Archivado del original el 14 de abril de 2021 . Consultado el 31 de agosto de 2020 .
- ^ "Mapa que muestra la tasa de dureza en mg/L como carbonato de calcio en Inglaterra y Gales" (PDF) . DEFRA Drinking Water Inspectorate. 2009. Archivado (PDF) desde el original el 29 de mayo de 2015. Consultado el 18 de mayo de 2015 .
- ^ "Dureza del agua". Servicio Geológico de Estados Unidos. 8 de abril de 2014. Archivado desde el original el 18 de mayo de 2015. Consultado el 18 de mayo de 2015 .
- ^ Mekonnen MM, Hoekstra AY (diciembre de 2010). La huella hídrica verde, azul y gris de los animales de granja y los productos animales, Value of Water (PDF) (Informe). Serie de informes de investigación. Vol. 1. Instituto UNESCO-IHE para la Educación del Agua. Archivado (PDF) del original el 27 de mayo de 2014. Consultado el 30 de enero de 2014 .
- ^ "Lista Modelo de Medicamentos Esenciales de la OMS" (PDF) . Organización Mundial de la Salud . Octubre de 2013. Archivado (PDF) desde el original el 23 de abril de 2014 . Consultado el 22 de abril de 2014 .
- ^ «ALMA mejora considerablemente su capacidad para buscar agua en el universo». Archivado desde el original el 23 de julio de 2015 . Consultado el 20 de julio de 2015 .
- ^ Melnick, Gary, Centro Harvard-Smithsoniano de Astrofísica y Neufeld, David, Universidad Johns Hopkins citados en: "El descubrimiento de vapor de agua cerca de la nebulosa de Orión sugiere el posible origen del H20 en el sistema solar (sic)". The Harvard University Gazette . 23 de abril de 1998. Archivado desde el original el 16 de enero de 2000."Una nube espacial contiene suficiente agua para llenar los océanos de la Tierra un millón de veces". Headlines@Hopkins, JHU. 9 de abril de 1998. Archivado desde el original el 9 de noviembre de 2007. Consultado el 21 de abril de 2007 ."Agua, agua por todas partes: un radiotelescopio descubre que el agua es algo común en el universo". The Harvard University Gazette . 25 de febrero de 1999. Archivado desde el original el 19 de mayo de 2011. Consultado el 19 de septiembre de 2010 .(enlace de archivo)
- ^ ab Clavin W, Buis A (22 de julio de 2011). "Los astrónomos encuentran el depósito de agua más grande y distante". NASA . Archivado desde el original el 24 de julio de 2011 . Consultado el 25 de julio de 2011 .
- ^ ab Staff (22 de julio de 2011). «Los astrónomos encuentran la masa de agua más grande y antigua del universo». Space.com . Archivado desde el original el 29 de octubre de 2011. Consultado el 23 de julio de 2011 .
- ^ Bova B (2009). Ecos débiles, estrellas distantes: la ciencia y la política de encontrar vida más allá de la Tierra. Zondervan. ISBN 978-0-06-185448-4Archivado del original el 14 de abril de 2021 . Consultado el 31 de agosto de 2020 .
- ^ Solanki S, Livingston W, Ayres T (1994). "Nueva luz sobre el corazón de la oscuridad de la cromosfera solar" (PDF) . Science . 263 (5143): 64–66. Bibcode :1994Sci...263...64S. doi :10.1126/science.263.5143.64. PMID 17748350. S2CID 27696504. Archivado desde el original (PDF) el 7 de marzo de 2019.
- ^ "Los científicos de la sonda MESSENGER se quedan 'asombrados' al encontrar agua en la delgada atmósfera de Mercurio". Planetary Society. 3 de julio de 2008. Archivado desde el original el 6 de abril de 2010. Consultado el 5 de julio de 2008 .
- ^ Bertaux JL, Vandaele, Ann-Carine, Korablev O, Villard E, Fedorova A, Fussen D, et al. (2007). "Una capa cálida en la criosfera de Venus y mediciones a gran altitud de HF, HCl, H2O y HDO" (PDF) . Nature . 450 (7170): 646–649. Bibcode :2007Natur.450..646B. doi :10.1038/nature05974. hdl :2268/29200. PMID 18046397. S2CID 4421875. Archivado (PDF) desde el original el 7 de septiembre de 2022 . Consultado el 8 de octubre de 2022 .
- ^ Sridharan R, Ahmed S, Dasa TP, Sreelathaa P, Pradeepkumara P, Naika N, et al. (2010). "Evidencia 'directa' de agua (H2O) en el ambiente lunar iluminado por el sol de CHACE en MIP de Chandrayaan I". Planetary and Space Science . 58 (6): 947. Bibcode :2010P&SS...58..947S. doi :10.1016/j.pss.2010.02.013.
- ^ Rapp, Donald (2012). Uso de recursos extraterrestres para misiones espaciales tripuladas a la Luna o Marte. Springer. pág. 78. ISBN 978-3-642-32762-9Archivado desde el original el 15 de julio de 2016 . Consultado el 9 de febrero de 2016 .
- ^ Küppers M, O'Rourke L, Bockelée-Morvan D , Zakharov V, Lee S, Von Allmen P, et al. (23 de enero de 2014). "Fuentes localizadas de vapor de agua en el planeta enano (1) Ceres". Naturaleza . 505 (7484): 525–527. Código Bib :2014Natur.505..525K. doi : 10.1038/naturaleza12918. PMID 24451541. S2CID 4448395.
- ^ Atreya SK, Wong AS (2005). "Nubes acopladas y química de los planetas gigantes: un caso para las multiprobetas" (PDF) . Space Science Reviews . 116 (1–2): 121–136. Bibcode :2005SSRv..116..121A. doi :10.1007/s11214-005-1951-5. hdl : 2027.42/43766 . S2CID 31037195. Archivado (PDF) desde el original el 22 de julio de 2011 . Consultado el 1 de abril de 2014 .
- ^ Cook JR, Gutro R, Brown D, Harrington J, Fohn J (12 de diciembre de 2013). "Hubble ve evidencia de vapor de agua en la luna de Júpiter". NASA . Archivado desde el original el 15 de diciembre de 2013 . Consultado el 12 de diciembre de 2013 .
- ^ Hansen, CJ, Stewart AI, Colwell J, Hendrix A, Pryor W, et al. (2006). "Enceladus' Water Vapor Plume" (PDF) . Science . 311 (5766): 1422–1425. Bibcode :2006Sci...311.1422H. doi :10.1126/science.1121254. PMID 16527971. S2CID 2954801. Archivado desde el original (PDF) el 18 de febrero de 2020.
- ^ Hubbard W (1997). "La química profunda de Neptuno". Science . 275 (5304): 1279–1280. doi :10.1126/science.275.5304.1279. PMID 9064785. S2CID 36248590.
- ^ Encuentran agua en un planeta distante Archivado el 16 de julio de 2007 en Wayback Machine 12 de julio de 2007 Por Laura Blue, Time
- ^ Encuentran agua en la atmósfera de un planeta extrasolar Archivado el 30 de diciembre de 2010 en Wayback Machine – Space.com
- ^ Lockwood AC, Johnson JA, Bender CF, Carr JS, Barman T, Richert AJ, et al. (2014). "Detección directa de vapor de agua en Tau Boo B en infrarrojo cercano". The Astrophysical Journal . 783 (2): L29. arXiv : 1402.0846 . Código Bibliográfico :2014ApJ...783L..29L. doi :10.1088/2041-8205/783/2/L29. S2CID 8463125.
- ^ Clavin W, Chou F, Weaver D, Villard, Johnson M (24 de septiembre de 2014). «Los telescopios de la NASA encuentran cielos despejados y vapor de agua en un exoplaneta». NASA . Archivado desde el original el 14 de enero de 2017 . Consultado el 24 de septiembre de 2014 .
- ^ abc Arnold Hanslmeier (2010). El agua en el universo. Springer Science & Business Media. pp. 159–. ISBN 978-90-481-9984-6Archivado desde el original el 15 de julio de 2016 . Consultado el 9 de febrero de 2016 .
- ^ "Hubble rastrea señales sutiles de agua en mundos nebulosos". NASA . 3 de diciembre de 2013. Archivado desde el original el 6 de diciembre de 2013 . Consultado el 4 de diciembre de 2013 .
- ^ ab Andersson, Jonas (junio de 2012). Agua en atmósferas estelares "¿Es necesaria una nueva imagen para explicar el comportamiento atmosférico del agua en las estrellas gigantes rojas?" Archivado el 13 de febrero de 2015 en Wayback Machine Observatorio de Lund, Universidad de Lund, Suecia
- ^ Herschel encuentra océanos de agua en el disco de una estrella cercana Archivado el 19 de febrero de 2015 en Wayback Machine . Nasa.gov (20 de octubre de 2011). Consultado el 28 de septiembre de 2015.
- ^ "JPL". Laboratorio de Propulsión a Chorro (JPL) de la NASA . Archivado desde el original el 4 de junio de 2012.
- ^ Lloyd, Robin. "Water Vapor, Possible Comets, Found Orbiting Star" (Vapor de agua, posibles cometas, encontrados en órbita alrededor de una estrella) , 11 de julio de 2001, Space.com. Consultado el 15 de diciembre de 2006. Archivado el 23 de mayo de 2009 en Wayback Machine.
- ^ "La NASA confirma la evidencia de que en Marte hoy fluye agua líquida". NASA . 28 de septiembre de 2015. Archivado desde el original el 28 de septiembre de 2015 . Consultado el 22 de junio de 2020 .
- ^ Platt J, Bell B (3 de abril de 2014). «NASA Space Assets Detect Ocean inside Saturn Moon». NASA . Archivado desde el original el 3 de abril de 2014. Consultado el 3 de abril de 2014 .
- ^ Iess L, Stevenson DJ, Parisi M, Hemingway D, Jacobson R, Lunine JI, et al. (4 de abril de 2014). "El campo de gravedad y la estructura interior de Encélado" (PDF) . Science . 344 (6179): 78–80. Bibcode :2014Sci...344...78I. doi :10.1126/science.1250551. PMID 24700854. S2CID 28990283. Archivado (PDF) desde el original el 2 de diciembre de 2017 . Consultado el 14 de julio de 2019 .
- ^ Dunaeva, AN, Kronrod, VA, Kuskov, OL (2013). "Modelos numéricos del interior de Titán con océano subsuperficial" (PDF) . 44.ª Conferencia de Ciencia Lunar y Planetaria (2013) (1719): 2454. Código Bibliográfico :2013LPI....44.2454D. Archivado (PDF) desde el original el 23 de marzo de 2014. Consultado el 23 de marzo de 2014 .
- ^ Tritt CS (2002). "Posibilidad de vida en Europa". Escuela de Ingeniería de Milwaukee. Archivado desde el original el 9 de junio de 2007. Consultado el 10 de agosto de 2007 .
- ^ Dunham, Will. (3 de mayo de 2014) La luna de Júpiter, Ganímedes, podría tener capas de océano en forma de "sándwich" | Reuters Archivado el 3 de mayo de 2014 en Wayback Machine . In.reuters.com. Consultado el 28 de septiembre de 2015.
- ^ Carr M (1996). Agua en Marte . Nueva York: Oxford University Press. pág. 197.
- ^ Bibring JP, Langevin Y, Poulet F, Gendrin A, Gondet B, Berthé M, et al. (2004). "Hielo de agua perenne identificado en el casquete polar sur de Marte". Nature . 428 (6983): 627–630. Bibcode :2004Natur.428..627B. doi :10.1038/nature02461. PMID 15024393. S2CID 4373206.
- ^ Versteckt in Glasperlen: Auf dem Mond gibt es Wasser – Wissenschaft – Archivado el 10 de julio de 2008 en Wayback Machine Der Spiegel – Nachrichten
- ^ Moléculas de agua encontradas en la Luna Archivado el 27 de septiembre de 2009 en Wayback Machine , NASA, 24 de septiembre de 2009
- ^ McCord T, Sotin C (21 de mayo de 2005). «Ceres: evolución y estado actual» (PDF) . Journal of Geophysical Research: Planets . 110 (E5): E05009. Bibcode :2005JGRE..110.5009M. doi : 10.1029/2004JE002244 . Archivado (PDF) del original el 18 de julio de 2021. Consultado el 5 de marzo de 2024 .
- ^ Thomas P, Parker J, McFadden L (2005). «Diferenciación del asteroide Ceres según su forma». Nature . 437 (7056): 224–226. Bibcode :2005Natur.437..224T. doi :10.1038/nature03938. PMID 16148926. S2CID 17758979.
- ^ Carey B (7 de septiembre de 2005). «El asteroide más grande podría contener más agua dulce que la Tierra». SPACE.com. Archivado desde el original el 18 de diciembre de 2010. Consultado el 16 de agosto de 2006 .
- ^ Chang K (12 de marzo de 2015). «De repente, parece que el agua está en todas partes en el sistema solar». New York Times . Archivado desde el original el 12 de agosto de 2018. Consultado el 12 de marzo de 2015 .
- ^ Kuskov O, Kronrod, VA (2005). "Estructura interna de Europa y Calisto". Icarus . 177 (2): 550–369. Código Bibliográfico :2005Icar..177..550K. doi :10.1016/j.icarus.2005.04.014.
- ^ Showman AP, Malhotra R (1 de octubre de 1999). "Los satélites galileanos" (PDF) . Science . 286 (5437): 77–84. doi :10.1126/science.286.5437.77. PMID 10506564. S2CID 9492520. Archivado desde el original (PDF) el 12 de abril de 2020.
- ^ ab Sparrow G (2006). El sistema solar . Thunder Bay Press. ISBN 978-1-59223-579-7.
- ^ Tobie G, Grasset O, Lunine JI, Mocquet A, Sotin C (2005). "La estructura interna de Titán inferida a partir de un modelo térmico-orbital acoplado". Icarus . 175 (2): 496–502. Bibcode :2005Icar..175..496T. doi :10.1016/j.icarus.2004.12.007.
- ^ Verbiscer A, French R, Showalter M, Helfenstein P (9 de febrero de 2007). "Encelado: artista de graffiti cósmico atrapado en el acto". Science . 315 (5813): 815. Bibcode :2007Sci...315..815V. doi :10.1126/science.1134681. PMID 17289992. S2CID 21932253.(material de apoyo en línea, tabla S1)
- ^ Greenberg JM (1998). "Formación del núcleo de un cometa". Astronomía y Astrofísica . 330 : 375. Bibcode :1998A&A...330..375G.
- ^ "Bolas de nieve sucias en el espacio". Starryskies. Archivado desde el original el 29 de enero de 2013. Consultado el 15 de agosto de 2013 .
- ^ EL Gibb, MJ Mumma, N. Dello Russo, MA DiSanti, K. Magee-Sauer (2003). "Metano en cometas de la Nube de Oort". Icarus . 165 (2): 391–406. Código Bibliográfico :2003Icar..165..391G. doi :10.1016/S0019-1035(03)00201-X.
- ^ NASA, "MESSENGER encuentra nueva evidencia de hielo de agua en los polos de Mercurio Archivado el 30 de noviembre de 2012 en Wayback Machine ", NASA , 29 de noviembre de 2012.
- ^ Thomas P, Burns J, Helfenstein P, Squyres S, Veverka J, Porco C, et al. (octubre de 2007). «Formas de los satélites helados saturnianos y su significado» (PDF) . Icarus . 190 (2): 573–584. Bibcode :2007Icar..190..573T. doi :10.1016/j.icarus.2007.03.012. Archivado (PDF) desde el original el 27 de septiembre de 2011 . Consultado el 15 de diciembre de 2011 .
- ^ Agua extraña acecha en el interior de planetas gigantes Archivado el 15 de abril de 2015 en Wayback Machine , New Scientist , 1 de septiembre de 2010, número de revista 2776.
- ^ Ehlers, E., Krafft, T., eds. (2001). "JCI Dooge. "Gestión integrada de los recursos hídricos"". Comprensión del sistema terrestre: compartimentos, procesos e interacciones . Springer. pág. 116.
- ^ "Zona habitable". La enciclopedia de astrobiología, astronomía y vuelos espaciales . Archivado desde el original el 23 de mayo de 2007. Consultado el 26 de abril de 2007 .
- ^ Shiga D (6 de mayo de 2007). «Un extraño mundo alienígena hecho de «hielo caliente»». New Scientist . Archivado desde el original el 6 de julio de 2008. Consultado el 28 de marzo de 2010 .
- ^ Aguilar, David A. (16 de diciembre de 2009). "Astrónomos encuentran una supertierra usando tecnología amateur disponible en el mercado". Centro de Astrofísica Harvard-Smithsonian. Archivado desde el original el 7 de abril de 2012. Consultado el 28 de marzo de 2010 .
- ^ ab "Informe ODM 2008" (PDF) . Archivado (PDF) del original el 27 de agosto de 2010 . Consultado el 25 de julio de 2010 .
- ^ Kulshreshtha SN (1998). "Una perspectiva mundial de los recursos hídricos hasta el año 2025". Gestión de los recursos hídricos . 12 (3): 167–184. Bibcode :1998WatRM..12..167K. doi :10.1023/A:1007957229865. S2CID 152322295.
- ^ "Charting Our Water Future: Economic frameworks to inform decision-making" (PDF) . Archivado desde el original (PDF) el 5 de julio de 2010 . Consultado el 25 de julio de 2010 .
- ^ "Informe sobre los Objetivos de Desarrollo del Milenio". Archivado el 27 de agosto de 2010 en Wayback Machine , Naciones Unidas, 2008
- ^ Lomborg B (2001). El ambientalista escéptico (PDF) . Cambridge University Press . pág. 22. ISBN. 978-0-521-01068-9. Archivado desde el original (PDF) el 25 de julio de 2013.
- ^ UNESCO , (2006), "El agua, una responsabilidad compartida. Segundo Informe de las Naciones Unidas sobre el desarrollo de los recursos hídricos en el mundo". Archivado el 6 de enero de 2009 en Wayback Machine .
- ^ Welle, Katharina; Evans, Barbara; Tucker, Josephine; y Nicol, Alan (2008). "¿El agua se está quedando atrás en cuanto a eficacia de la ayuda?" Archivado el 27 de julio de 2011 en Wayback Machine.
- ^ "Resultados de la búsqueda". Instituto Internacional de Gestión del Agua (IWMI) . Archivado desde el original el 5 de junio de 2013. Consultado el 3 de marzo de 2016 .
- ^ Burrows G (24 de marzo de 2004). «Agua limpia para luchar contra la pobreza». The Guardian . Archivado desde el original el 16 de febrero de 2024. Consultado el 16 de febrero de 2024 .
- ^ Morris K (20 de marzo de 2004). «"Emergencia silenciosa" de agua y saneamiento deficientes» . Medicine and Health Policy . 363 (9413): 954. doi :10.1016/S0140-6736(04)15825-X. PMID 15046114. S2CID 29128993. Archivado desde el original el 22 de febrero de 2024. Consultado el 16 de febrero de 2024 .
- ^ abc «Inicio | Informe de las Naciones Unidas sobre el desarrollo de los recursos hídricos en el mundo 2023». www.unesco.org . Archivado desde el original el 5 de junio de 2023 . Consultado el 5 de junio de 2023 .
- ^ "Informe de las Naciones Unidas sobre el desarrollo de los recursos hídricos en el mundo 2023". www.rural21.com . 29 de marzo de 2023. Archivado desde el original el 5 de junio de 2023 . Consultado el 5 de junio de 2023 .
- ^ "La ONU advierte de que el uso "vampírico" del agua conduce a una crisis mundial "inminente". France 24 . 22 de marzo de 2023. Archivado desde el original el 5 de junio de 2023 . Consultado el 5 de junio de 2023 .
- ^ "Un nuevo informe de la ONU describe un panorama desolador sobre los enormes cambios que se necesitan para llevar agua potable a todas las personas". ABC News . 22 de marzo de 2023. Archivado desde el original el 5 de junio de 2023 . Consultado el 5 de junio de 2023 .
- ^ «Día Mundial del Agua». Naciones Unidas . Archivado desde el original el 9 de septiembre de 2020. Consultado el 10 de septiembre de 2020 .
- ^ "Acerca de". Portal en línea del Día Mundial de los Océanos . Archivado desde el original el 20 de septiembre de 2020. Consultado el 10 de septiembre de 2020 .
- ^ Z Wahrman M (2016). The Hand Book: Surviving in a Germ-Filled World [El manual: cómo sobrevivir en un mundo lleno de gérmenes] . University Press of New England. págs. 46–48. ISBN 978-1-61168-955-6El agua también
desempeña un papel en otros rituales cristianos. ... En los primeros tiempos del cristianismo, dos o tres siglos después de Cristo, el lavabo (del latín "me lavo"), un recipiente y cuenco para lavarse las manos, se introdujo como parte del servicio de la Iglesia.
- ^ Enciclopedia de Chambers , Lippincott & Co (1870). pág. 394.
- ^ Altman, Nathaniel (2002) Agua sagrada: la fuente espiritual de vida . págs. 130–133. ISBN 1-58768-013-0 .
- ^ "ĀB i. El concepto de agua en el antiguo Irán". www.iranicaonline.org . Enciclopedia Iranica . Archivado desde el original el 16 de mayo de 2018 . Consultado el 19 de septiembre de 2018 .
- ^ Lindberg, D. (2008). Los comienzos de la ciencia occidental: La tradición científica europea en un contexto filosófico, religioso e institucional, desde la prehistoria hasta el año 1450 d. C. (2.ª ed.). Chicago: University of Chicago Press.
- ^ Tao Te Ching. Archivado desde el original el 12 de julio de 2010. Consultado el 25 de julio de 2010 en Internet Sacred Text Archive Home.
- ^ "Guanzi: Shui Di". Proyecto de texto chino. Archivado el 6 de noviembre de 2014 en archive.today . Consultado el 28 de septiembre de 2015.
- ^ abcd Madtes RE (1983). El capítulo "Ítaca" del "Ulises" de Joyce . Ann Arbor, Michigan: UMI Research Press. ISBN 0835714608.
- ^ ab Joyce J (1933). Wegner C (ed.). Ulises . Vol. 2. Hamburgo: The Odyssey Press. págs. 668–670.
- ^ Vartanian H (3 de octubre de 2011). «La catedral de Manhattan explora el agua en el arte». Hiperalérgico. Archivado desde el original el 3 de febrero de 2021. Consultado el 14 de diciembre de 2020 .
- ^ Kowalski JA (6 de octubre de 2011). «La catedral de San Juan el Divino y el valor del agua». huffingtonpost.com . Huffington Post. Archivado desde el original el 6 de agosto de 2015 . Consultado el 14 de diciembre de 2020 .
- ^ Foster F. "El valor del agua en St John the Divine". vimeo.com . Sara Karl. Archivado desde el original el 1 de marzo de 2021 . Consultado el 14 de diciembre de 2020 .
- ^ Miller T. "Exposición El valor del agua". Centro de Arte y Ciencia de la UCLA. Archivado desde el original el 3 de febrero de 2021. Consultado el 14 de diciembre de 2020 .
- ^ Madel R (6 de diciembre de 2017). "A través del arte, el valor del agua expresado". Huffington Post. Archivado desde el original el 1 de diciembre de 2020. Consultado el 16 de diciembre de 2020 .
- ^ Cotter M (4 de octubre de 2011). «La catedral de Manhattan examina 'el valor del agua' en una nueva exposición de arte repleta de estrellas». Inhabitat . Archivado desde el original el 8 de julio de 2019 . Consultado el 14 de diciembre de 2020 .
- ^ "Piensa en el agua". Archivado desde el original el 26 de noviembre de 2020. Consultado el 15 de diciembre de 2020 .
- ^ "Basia Irland". Archivado desde el original el 14 de octubre de 2021. Consultado el 19 de agosto de 2021 .
- ^ "Figuras influyentes Dra. Charlotte Cote". Primera Nación Tseshaht [c̓išaaʔatḥ] . Archivado desde el original el 19 de agosto de 2021. Consultado el 19 de agosto de 2021 .
- ^ "10 años de los derechos humanos al agua y al saneamiento". Naciones Unidas. Noticias de la Familia del Agua de la ONU. 27 de febrero de 2020. Archivado desde el original el 19 de agosto de 2021. Consultado el 19 de agosto de 2021 .
- ^ "El agua es sagrada": 10 artistas visuales reflexionan sobre el derecho humano al agua". The Guardian . 4 de agosto de 2020. Archivado desde el original el 19 de agosto de 2021 . Consultado el 19 de agosto de 2021 .
- ^ "monóxido de dihidrógeno". Marzo de 2018. Archivado desde el original el 2 de mayo de 2018 . Consultado el 2 de mayo de 2018 .
- ^ "¿Qué significa agua en el rap? (EXPLICA)". Aprendamos jerga . 27 de diciembre de 2021. Archivado desde el original el 6 de agosto de 2023. Consultado el 6 de agosto de 2023 .
- ^ Danny Towers, DJ Scheme y Ski Mask the Slump God (con Luh Tyler) – Florida Water, archivado del original el 6 de agosto de 2023 , consultado el 6 de agosto de 2023
Obras citadas
- Ball P (2001). La matriz de la vida: una biografía del agua . Farrar, Straus y Giroux. ISBN 978-0-520-23008-8.
- Franks F (2007). El agua: una matriz de vida (2.ª ed.). Royal Society of Chemistry. ISBN 978-1-84755-234-1.
- Lide DR (2003). Manual de química y física del CRC. Manual del CRC (84.ª edición). CRC Press. ISBN 978-0-8493-0484-2Archivado desde el original el 4 de febrero de 2024 . Consultado el 14 de diciembre de 2023 .
- Weingärtner H, Teermann I, Borchers U, Balsaa P, Lutze HV, Schmidt TC, et al. (2016). "Agua, 1. Propiedades, análisis y ciclo hidrológico". Ullmann's Encyclopedia of Industrial Chemistry . Wiley-VCH Verlag GmbH & Co. KGaA. doi :10.1002/14356007.a28_001.pub3. ISBN 978-3-527-30673-2.
Lectura adicional
- Debenedetti, PG., y HE Stanley, "Supercooled and Glassy Water", Physics Today 56 (6), pp. 40–46 (2003). PDF descargable (1,9 MB) Archivado el 1 de noviembre de 2018 en Wayback Machine.
- Gleick, PH., (editor), El agua del mundo: Informe bienal sobre los recursos de agua dulce . Island Press, Washington, DC (publicado cada dos años, a partir de 1998). El agua del mundo, Island Press Archivado el 26 de febrero de 2009 en Wayback Machine.
- Jones OA, Lester JN, Voulvoulis N (2005). "Productos farmacéuticos: ¿una amenaza para el agua potable?". Tendencias en biotecnología . 23 (4): 163–167. doi :10.1016/j.tibtech.2005.02.001. PMID 15780706.
- Revista de investigación y educación contemporáneas sobre el agua Archivado el 3 de marzo de 2016 en Wayback Machine.
- Postel, S., El último oasis: cómo afrontar la escasez de agua . WW Norton and Company, Nueva York. 1992
- Reisner, M., Cadillac Desert: El Oeste americano y sus aguas en desaparición . Penguin Books, Nueva York. 1986.
- Informe de las Naciones Unidas sobre el desarrollo de los recursos hídricos en el mundo Archivado el 22 de febrero de 2009 en Wayback Machine . Se publica cada tres años.
- St. Fleur, Nicholas. El agua de tu vaso podría ser más antigua que el sol Archivado el 15 de enero de 2017 en Wayback Machine . "El agua que bebes es más antigua que el planeta en el que estás parado". The New York Times (15 de abril de 2016)
Enlaces externos
- La página de datos sobre el agua en el mundo
- Base de datos completa sobre el agua de la FAO, AQUASTAT
- Cronología de los conflictos por el agua: Base de datos de conflictos por el agua Archivado el 16 de enero de 2013 en Wayback Machine
- Escuela de ciencias del agua (USGS)
- Portal de la estrategia, el trabajo y las publicaciones asociadas del Banco Mundial sobre recursos hídricos
- Asociación Estadounidense de Recursos Hídricos Archivado el 24 de marzo de 2018 en Wayback Machine
- El agua en la red
- Estructura y ciencia del agua Archivado el 28 de diciembre de 2014 en Wayback Machine.
- "Por qué el agua es una de las cosas más extrañas del universo", Ideas , BBC , Vídeo, 3:16 minutos, 2019
- La química del agua Archivado el 19 de junio de 2020 en Wayback Machine . (Informe especial de la NSF)
- Asociación Internacional para las Propiedades del Agua y el Vapor
- H2O: La molécula que nos hizo, un documental de PBS de 2020

































