Cloruro de tionilo
 | |
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Cloruro de tionilo | |
Otros nombres
| |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.028.863 |
| Número CE |
|
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
| Número de la ONU | 1836 |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| SOCl2 | |
| Masa molar | 118,97 g/mol |
| Apariencia | Líquido incoloro (amarillenta con el paso del tiempo) |
| Olor | Picante y desagradable |
| Densidad | 1,638 g/cm3 , líquido |
| Punto de fusión | -104,5 °C (-156,1 °F; 168,7 K) |
| Punto de ebullición | 74,6 °C (166,3 °F; 347,8 K) |
| Reacciona | |
| Solubilidad | Soluble en la mayoría de los disolventes apróticos: tolueno , cloroformo , éter dietílico . Reacciona con disolventes próticos como los alcoholes. |
| Presión de vapor |
|
Índice de refracción ( n D ) | 1.517 (20 °C) [2] |
| Viscosidad | 0,6 cP |
| Estructura | |
| piramidal | |
| 1,44 D | |
| Termoquímica | |
Capacidad calorífica ( C ) | 121,0 J/mol (líquido) [3] |
Entropía molar estándar ( S ⦵ 298 ) | 309,8 kJ/mol (gas) [3] |
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −245,6 kJ/mol (líquido) [3] |
| Peligros | |
| Seguridad y salud en el trabajo (SST/OHS): | |
Principales peligros | Muy tóxico, corrosivo, libera HCl en contacto con el agua. |
| Etiquetado SGA : | |
   | |
| Peligro | |
| H302 , H314 , H331 | |
| P261 , P280 , P305+P351+P338 , P310 | |
| NFPA 704 (rombo cortafuegos) | |
| punto de inflamabilidad | Ininflamable |
| NIOSH (límites de exposición a la salud en EE. UU.): | |
PEL (Permisible) | Ninguno [4] |
REL (recomendado) | C 1 ppm (5 mg/m3 ) [ 4] |
IDLH (Peligro inmediato) | En Dakota del Norte [4] |
| Compuestos relacionados | |
Haluros de tionilo relacionados |
|
Compuestos relacionados | |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El cloruro de tionilo es un compuesto inorgánico con la fórmula química SOCl 2 . Es un líquido incoloro, moderadamente volátil , con un olor acre desagradable. El cloruro de tionilo se utiliza principalmente como reactivo de cloración , con una producción de aproximadamente 45.000 toneladas (50.000 toneladas cortas) por año a principios de la década de 1990, [5] pero ocasionalmente también se utiliza como disolvente. [6] [7] [8] Es tóxico, reacciona con el agua y también está incluido en la Convención sobre Armas Químicas , ya que puede utilizarse para la producción de armas químicas .
El cloruro de tionilo a veces se confunde con el cloruro de sulfurilo , SO2Cl2 , pero las propiedades de estos compuestos difieren significativamente. El cloruro de sulfurilo es una fuente de cloro , mientras que el cloruro de tionilo es una fuente de iones de cloruro .
Producción
La principal síntesis industrial implica la reacción del trióxido de azufre y el dicloruro de azufre . [9] Esta síntesis se puede adaptar al laboratorio calentando el óleum para destilar lentamente el trióxido de azufre en un matraz enfriado de dicloruro de azufre. [10]
- SO3 + SCl2 → SOCl2 + SO2
Otros métodos incluyen síntesis a partir de:
- SO 2 + PCl 5 → SOCl 2 + POCl 3
- SO2 + Cl2 + SCl2 → 2 SOCl2
- SO3 + Cl2 + 2SCl2 → 3 SOCl2
- Fosgeno :
- SO2 + COCl2 → SOCl2 + CO2
La segunda de las cinco reacciones anteriores también produce oxicloruro de fósforo (cloruro de fosforilo), que se parece al cloruro de tionilo en muchas de sus reacciones. Se pueden separar por destilación, ya que el cloruro de tionilo hierve a una temperatura mucho más baja que el cloruro de fosforilo. [ cita requerida ]
Propiedades y estructura
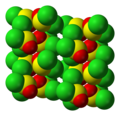 |
El SOCl2 adopta una geometría molecular piramidal trigonal con simetría molecular C s . Esta geometría se atribuye a los efectos del par solitario en el centro de azufre (IV) central.
En estado sólido, el SOCl2 forma cristales monoclínicos con el grupo espacial P2 1 /c. [11]
Estabilidad
El cloruro de tionilo tiene una larga vida útil, sin embargo, las muestras "envejecidas" desarrollan un tono amarillo, posiblemente debido a la formación de dicloruro de disulfuro . Se descompone lentamente en S 2 Cl 2 , SO 2 y Cl 2 justo por encima del punto de ebullición. [9] [12] El cloruro de tionilo es susceptible a la fotólisis , que se produce principalmente a través de un mecanismo radical. [13] Las muestras que muestran signos de envejecimiento se pueden purificar por destilación a presión reducida, para dar un líquido incoloro. [14]

Reacciones
El cloruro de tionilo se utiliza principalmente en la producción industrial de compuestos organoclorados , que suelen ser intermediarios en productos farmacéuticos y agroquímicos. Suele preferirse a otros reactivos, como el pentacloruro de fósforo , ya que sus subproductos (HCl y SO2 ) son gaseosos, lo que simplifica la purificación del producto.
Muchos de los productos del cloruro de tionilo son en sí mismos altamente reactivos y, como tal, están involucrados en una amplia gama de reacciones.
Con agua y alcoholes
El cloruro de tionilo reacciona exotérmicamente con agua para formar dióxido de azufre y ácido clorhídrico :
- SOCl2 + H2O → 2 HCl + SO2
Mediante un proceso similar, también reacciona con alcoholes para formar cloruros de alquilo . Si el alcohol es quiral, la reacción generalmente procede a través de un mecanismo S N i con retención de la estereoquímica; [15] sin embargo, dependiendo de las condiciones exactas empleadas, también se puede lograr la estereoinversión. Históricamente, el uso de SOCl 2 con piridina se llamaba halogenación de Darzens , pero los químicos modernos rara vez usan este nombre.

Las reacciones con un exceso de alcohol producen ésteres de sulfito , que pueden ser potentes reactivos de metilación , alquilación e hidroxialquilación. [16]
- SOCl2 + 2 R−OH → (R−O) 2SO + 2 HCl
Por ejemplo, la adición de SOCl 2 a aminoácidos en metanol produce selectivamente los ésteres metílicos correspondientes. [17]
Con ácidos carboxílicos
Clásicamente, convierte los ácidos carboxílicos en cloruros de acilo : [18] [19] [20]
- SOCl2 + R−COOH → R−COCl + SO2 + HCl
Se ha investigado el mecanismo de reacción: [21]
Con especies nitrogenadas
Con aminas primarias, el cloruro de tionilo produce derivados de sulfinilamina (RNSO), un ejemplo es la N - sulfinilanilina . El cloruro de tionilo reacciona con formamidas primarias para formar isocianuros [22] y con formamidas secundarias para producir iones de cloroiminio ; por lo tanto, una reacción con dimetilformamida formará el reactivo de Vilsmeier . [23]
Mediante un proceso análogo, las amidas primarias reaccionarán con cloruro de tionilo para formar cloruros de imidoilo , y las amidas secundarias también darán iones de cloroiminio . Estas especies son altamente reactivas y pueden usarse para catalizar la conversión de ácidos carboxílicos en cloruros de acilo; [24] también se explotan en la reacción de Bischler-Napieralski como un medio para formar isoquinolinas .
Las amidas primarias continuarán formando nitrilos si se calientan ( degradación de amida de Von Braun ). [25]
El cloruro de tionilo también se ha utilizado para promover la reordenación de Beckmann de oximas .
Con especies de azufre
- El cloruro de tionilo transformará los ácidos sulfínicos en cloruros de sulfinilo [26] [27]
- Los ácidos sulfónicos reaccionan con cloruro de tionilo para producir cloruros de sulfonilo . [28] [29] Los cloruros de sulfonilo también se han preparado a partir de la reacción directa de la sal de diazonio correspondiente con cloruro de tionilo. [30]
- El cloruro de tionilo se puede utilizar en variaciones del reordenamiento de Pummerer .
Con especies de fósforo
El cloruro de tionilo convierte los ácidos fosfónicos y los fosfonatos en cloruros de fosforilo . Es por este tipo de reacción que el cloruro de tionilo está catalogado como un compuesto de la Lista 3 , ya que puede utilizarse en el método "di-di" para producir agentes nerviosos de la serie G. Por ejemplo, el cloruro de tionilo convierte el metilfosfonato de dimetilo en dicloruro de ácido metilfosfónico , que puede utilizarse en la producción de sarín y somán .
Con metales
Como el SOCl 2 reacciona con el agua, se puede utilizar para deshidratar varios hidratos de cloruro metálico, como el cloruro de magnesio ( MgCl 2 ·6H 2 O ), el cloruro de aluminio ( AlCl 3 ·6H 2 O ) y el cloruro de hierro (III) ( FeCl 3 ·6H 2 O ). [9] Esta conversión implica un tratamiento con cloruro de tionilo a reflujo y sigue la siguiente ecuación general: [31]
- MCl n •xH 2 O + SOCl 2 → MCl n + x SO 2 + 2x HCl
Otras reacciones
- El cloruro de tionilo puede participar en una variedad de reacciones de adición electrofílica diferentes. Se agrega a los alquenos en presencia de AlCl 3 para formar un complejo de aluminio que se puede hidrolizar para formar un ácido sulfínico . Tanto los cloruros de aril sulfinilo como los sulfóxidos de diarilo se pueden preparar a partir de arenos mediante la reacción con cloruro de tionilo en ácido tríflico [32] o la presencia de catalizadores como BiCl 3 , Bi(OTf) 3 , LiClO 4 o NaClO 4 . [33] [34]
- En el laboratorio, se puede utilizar una reacción entre el cloruro de tionilo y un exceso de alcohol anhidro para producir soluciones alcohólicas anhidras de HCl .
- El cloruro de tionilo experimenta reacciones de intercambio de halógeno para dar otras especies de tionilo.
- Las reacciones con agentes fluorantes como el trifluoruro de antimonio dan fluoruro de tionilo :
- 3 SOCl2 + 2 SbF3 → 3 SOF2 + 2 SbCl3
- Una reacción con bromuro de hidrógeno produce bromuro de tionilo :
- SOCl 2 + 2 HBr → SOBr 2 + 2 HCl
- El yoduro de tionilo también se puede preparar mediante una reacción con yoduro de potasio, pero se informa que es altamente inestable. [35] [36]
Baterías

El cloruro de tionilo es un componente de las baterías de litio-cloruro de tionilo [37], donde actúa como electrodo positivo (en baterías: cátodo ) y el litio forma el electrodo negativo ( ánodo ); el electrolito es típicamente tetracloroaluminato de litio . La reacción de descarga general es la siguiente:
- 4 Li + 2 SOCl2 → 4 LiCl + 1 ⁄ 8 S8 + SO2
Estas baterías no recargables tienen ventajas sobre otras formas de baterías de litio, como una alta densidad energética, un amplio rango de temperaturas de funcionamiento y una larga vida útil de almacenamiento y funcionamiento. Sin embargo, su alto coste, su imposibilidad de recargarse y las preocupaciones por la seguridad han limitado su uso. El contenido de las baterías es altamente tóxico y requiere procedimientos especiales de eliminación; además, pueden explotar si se produce un cortocircuito. La tecnología se utilizó en el explorador marciano Sojourner de 1997.
Seguridad
El SOCl 2 es altamente reactivo y puede liberar violentamente ácido clorhídrico al entrar en contacto con agua y alcoholes. También es una sustancia controlada en virtud de la Convención sobre Armas Químicas , donde figura como sustancia de la Lista 3 , ya que se utiliza en la fabricación de agentes nerviosos de la serie G [ cita requerida ] y en los métodos Meyer y Meyer-Clarke para producir gases mostaza a base de azufre . [38]
Historia
En 1849, los químicos franceses Jean-François Persoz y Bloch, y el químico alemán Peter Kremers (1827–?), sintetizaron por primera vez de forma independiente el cloruro de tionilo mediante la reacción de pentacloruro de fósforo con dióxido de azufre . [39] [40] Sin embargo, sus productos eran impuros: tanto Persoz como Kremers afirmaron que el cloruro de tionilo contenía fósforo, [41] y Kremers registró su punto de ebullición como 100 °C (en lugar de 74,6 °C). En 1857, el químico germano-italiano Hugo Schiff sometió el cloruro de tionilo crudo a destilaciones fraccionadas repetidas y obtuvo un líquido que hervía a 82 °C y al que llamó cloruro de tionilo . [42] En 1859, el químico alemán Georg Ludwig Carius observó que el cloruro de tionilo podía utilizarse para fabricar anhídridos de ácido y cloruros de acilo a partir de ácidos carboxílicos y para fabricar cloruros de alquilo a partir de alcoholes . [43]
Véase también
Referencias
- ^ Cloruro de tionilo en Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69 , Instituto Nacional de Estándares y Tecnología, Gaithersburg (MD) (consultado el 11 de mayo de 2014)
- ^ Patnaik, Pradyot (2003). Manual de productos químicos inorgánicos. Nueva York, NY: McGraw-Hill. ISBN 0-07-049439-8.
- ^ abc Lide, David R.; et al., eds. (1996). Manual de química y física del CRC (76.ª edición). Boca Raton, FL: CRC Press. págs. 5-10. ISBN 0-8493-0476-8.
- ^ abc Guía de bolsillo del NIOSH sobre peligros químicos. "#0611". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Lauss, H.-D.; Steffens, W. "Haluros de azufre". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a25_623. ISBN . 978-3527306732.
- ^ Oka, Kitaro (1981). "Algunas aplicaciones del cloruro de tionilo en la química orgánica sintética". Síntesis . 1981 (9): 661–681. doi :10.1055/s-1981-29563. S2CID 94917739.
- ^ Calderazzo, Fausto; Dell'Amico, Daniela Belli (abril de 1981). "Síntesis de haluros de carbonilo de elementos de transición tardía en cloruro de tionilo como disolvente. Complejos carbonílicos de paladio(II)". Química inorgánica . 20 (4): 1310–1312. doi :10.1021/ic50218a072.
- ^ Garber, EB; Pease, LED; Luder, WF (20 de abril de 1953). "Titulación de ácidos apróticos en cloruro de tionilo". Química analítica . 25 (4): 581–583. doi :10.1021/ac60076a012.
- ^ abc Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 694. ISBN 978-0-08-037941-8.
- ^ Brauer, George (1963). Manual de química inorgánica preparativa . págs. 382–383. doi :10.1016/B978-0-12-395590-6.50015-6.
- ^ Mootz, D.; Merschenz-Quack, A. (15 de mayo de 1988). "Estructuras de haluros de tionilo: SOCl2 y SOBr2" (PDF) . Acta Crystallographica Sección C. 44 (5): 926–927. Código bibliográfico : 1988AcCrC..44..926M. doi :10.1107/S010827018800085X.
- ^ Brauer, Georg, ed. (1963). Manual de química inorgánica preparativa . Vol. 1. Traducido por Scripta Technica; Reed, F. (2.ª ed.). Nueva York, NY: Academic Press. p. 383. ISBN. 978-0121266011.
- ^ Donovan, RJ; Husain, D.; Jackson, PT (1969). "Estudios espectroscópicos y cinéticos del radical SO y la fotólisis del cloruro de tionilo". Transactions of the Faraday Society . 65 : 2930. doi :10.1039/TF9696502930.
- ^ Friedman, L.; Wetter, WP (1967). "Purificación del cloruro de tionilo". Journal of the Chemical Society A: Inorganic, Physical, Theoretical : 36. doi :10.1039/J19670000036.
- ^ Smith, Michael B.; March, Jerry (2007), Química orgánica avanzada: reacciones, mecanismos y estructura (6.ª ed.), Nueva York: Wiley-Interscience, pág. 469, ISBN 978-0-471-72091-1
- ^ Van Woerden, HF (1963). "Sulfitos orgánicos". Chemical Reviews . 63 (6): 557–571. doi :10.1021/cr60226a001.
- ^ Brenner, M.; Huber, W. (1953). "Herstellung von α-Aminosäureestern durch Alkoholyse der Mtilester" [Fabricación de ésteres de α-aminoácidos mediante alcoholisis de ésteres metílicos]. Helvetica Chimica Acta (en alemán). 36 (5): 1109-1115. doi :10.1002/hlca.19530360522.
- ^ Clayden, Jonathan ; Greeves, Nick; Warren, Stuart ; Wothers, Peter (2001). Química orgánica (1.ª ed.). Oxford University Press. pág. 295. ISBN 978-0-19-850346-0.
- ^ Allen, CFH; Byers, JR Jr; Humphlett, WJ (1963). "Cloruro de oleoilo". Síntesis orgánicas; Volúmenes recopilados , vol. 4, pág. 739.
- ^ Rutenberg, MW; Horning, EC (1963). "1-Metil-3-etiloxindol". Síntesis orgánicas; Volúmenes recopilados , vol. 4, pág. 620.
- ^ Clayden, Jonathan ; Greeves, Nick; Warren, Stuart ; Wothers, Peter (2001). Química orgánica (1.ª ed.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Niznik, GE; Morrison, WH, III; Walborsky, HM (1988). "1-d-Aldehídos a partir de reactivos organometálicos: 2-metilbutanal-1-d". Síntesis orgánicas
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ); Volúmenes recopilados , vol. 6, pág. 751. - ^ Arrieta, A.; Aizpurua, JM; Palomo, C. (1984). " Cloruro de N , N -dimetilclorosulfitometaniminio (SOCl2-DMF), un reactivo deshidratante versátil". Tetrahedron Letters . 25 (31): 3365–3368. doi :10.1016/S0040-4039(01)81386-1.
- ^ Clayden, J. (2001). Química orgánica . Oxford: Oxford University Press. págs. 276–296. ISBN. 0-19-850346-6.
- ^ Krynitsky, JA; Carhart, HW (1963). "2-Etilhexanonitrilo". Síntesis orgánicas; Volúmenes recopilados , vol. 4, pág. 436.
- ^ Hulce, M.; Mallomo, JP; Frye, LL; Kogan, TP; Posner, GH (1990). "(S)-(+)-2-(p-toluenosulfinil)-2-ciclopentenona: Precursor para la síntesis enantioselectiva de ciclopentanonas 3-sustituidas". Síntesis orgánicas; Volúmenes recopilados , vol. 7, pág. 495.
- ^ Kurzer, F. (1963). "Cloruro de p-toluenosulfonilo". Síntesis orgánicas; Volúmenes recopilados , vol. 4, pág. 937.
- ^ Weinreb, SM; Chase, CE; Wipf, P.; Venkatraman, S. (2004). "Cloruro de 2-trimetilsililetanosulfonilo (SES-Cl)". Síntesis orgánicas; Volúmenes recopilados , vol. 10, pág. 707.
- ^ Hazen, GG; Bollinger, FW; Roberts, FE; Russ, WK; Seman, JJ; Staskiewicz, S. (1998). "4-Dodecilbencenosulfonil azidas". Síntesis orgánicas; Volúmenes recopilados , vol. 9, pág. 400.
- ^ Hogan, PJ; Cox, BG (2009). "Química de procesos acuosos: la preparación de cloruros de arilsulfonilo". Investigación y desarrollo de procesos orgánicos . 13 (5): 875–879. doi :10.1021/op9000862.
- ^ Pray, AR; Heitmiller, RF; Strycker, S.; Aftandilian, VD; Muniyappan, T.; Choudhury, D.; Tamres, M. (1990). "Cloruros metálicos anhidros". Síntesis inorgánica . Vol. 28. págs. 321–323. doi :10.1002/9780470132593.ch80. ISBN . 978-0-470-13259-3.
- ^ Smith, Michael B.; March, Jerry (2007), Química orgánica avanzada: reacciones, mecanismos y estructura (6.ª ed.), Nueva York: Wiley-Interscience, pág. 697, ISBN 978-0-471-72091-1
- ^ Peyronneau, M.; Roques, N.; Mazières, S.; Le Roux, C. (2003). "Activación catalítica del cloruro de tionilo mediante ácido de Lewis: aplicación a la síntesis de cloruros de aril sulfinilo catalizados por sales de bismuto (III)". Synlett (5): 0631–0634. doi :10.1055/s-2003-38358.
- ^ Bandgar, BP; Makone, SS (2004). "Síntesis de sulfóxidos de diarilo simétricos catalizada por perclorato de litio/sodio". Synthetic Communications . 34 (4): 743–750. doi :10.1081/SCC-120027723. S2CID 96348273.
- ^ Rao, MR Aswathanarayana (marzo de 1940). "Yoduro de tionilo: Parte I. Formación de yoduro de tionilo". Actas de la Academia India de Ciencias - Sección A . 11 (3): 185–200. doi :10.1007/BF03046547. S2CID 104552644.
- ^ Rao, MR Aswathanarayana (marzo de 1940). "Yoduro de tionilo: Parte II. Tasa de descomposición y espectroscopia". Actas de la Academia India de Ciencias - Sección A . 11 (3): 201–205. doi :10.1007/BF03046548. S2CID 104752226.
- ^ Gangadharan, R.; Namboodiri, PNN; Prasad, KV; Viswanathan, R. (enero de 1979). "La batería de litio-cloruro de tionilo: una revisión". Journal of Power Sources . 4 (1): 1–9. Bibcode :1979JPS.....4....1G. doi :10.1016/0378-7753(79)80032-4.
- ^ Instituto de Medicina (1993). "Capítulo 5: Química del gas mostaza y la lewisita". Veteranos en riesgo: los efectos del gas mostaza y la lewisita sobre la salud. The National Academies Press. ISBN 0-309-04832-X.
- ^ Ver:
- Persoz; Bloch (1849). "Des composés binaires formés par les métalloïdes, et, en particulier, de l'action du cloro phosphorique sur les acides sulfureux, sulfurique, phosphorique, chromique, etc" [Compuestos binarios formados por metaloides y, en particular, por la acción del pentacloruro de fósforo sobre sulfurosos ácido, ácido sulfúrico, ácido fosfórico, ácido crómico, etc.]. Comptes rendus (en francés). 28 : 86–88.
- Persoz; Bloch (1849). "Addition à une Note précédente concernant les combinaisons du cloro fosforique avec les acides morphique, sulfurique et sulfureux" [Adición a una nota anterior relativa a los compuestos de pentacloruro de fósforo con ácido fosfórico, ácido sulfúrico y ácido sulfuroso]. Comptes rendus (en francés). 28 : 389.
- ^ Kremers, P. (1849). "Ueber schwefligsaures Phosphorchlorid" [Sobre el pentacloruro de fósforo sulfuroso]. Annalen der Chemie und Pharmacie (en alemán). 70 (3): 297–300. doi :10.1002/jlac.18490700311.
- ^ El químico alemán Georg Ludwig Carius observó que, cuando se destilaba la mezcla de reacción que producía cloruro de tionilo, la mezcla cruda liberaba inicialmente cantidades sustanciales de gas, de modo que el cloruro de fosforilo (POCl 3 ) era arrastrado al receptor. Carius, L. (1859). "Ueber die Chloride des Schwefels und deren Derivate" [Sobre el cloruro de azufre y sus derivados]. Annalen der Chemie und Pharmacie (en alemán). 111 : 93–113. doi :10.1002/jlac.18591110111.De la p. 94: "… sin embargo, se debe utilizar el principio, … y no se obtendrá ningún clortionilo puro." (… sin embargo, durante esa [es decir, la destilación fraccionada], se debe tener cuidado, [de modo que] se evite cuidadosamente una concentración de cloruro de hidrógeno o exceso de ácido sulfuroso en el líquido que se va a destilar, ya que de lo contrario, por la evolución de gas que ocurre al comienzo de la destilación, se transfiere mucho cloruro de fosforilo y nunca se obtiene cloruro de tionilo puro.)
- ^ Schiff, Hugo (1857). "Ueber die Einwirkung des Phosphorsuperchlorids auf einige anorganische Säuren" [Sobre la reacción del pentacloruro de fósforo con algunos ácidos inorgánicos]. Annalen der Chemie und Pharmacie (en alemán). 102 : 111-118. doi :10.1002/jlac.18571020116. El punto de ebullición del cloruro de tionilo observado por Schiff aparece en la página 112. El nombre cloruro de tionilo aparece en la página 113.
- ^ Cario, L. (1859). "Ueber die Chloride des Schwefels und deren Derivate" [Sobre el cloruro de azufre y sus derivados]. Annalen der Chemie und Pharmacie (en alemán). 111 : 93-113. doi :10.1002/jlac.18591110111. En la pág. 94, Carius señala que el cloruro de tionilo puede ser "... mit Vortheil zur Darstellung wasserfreier Säuren verwenden". (... usado ventajosamente para la preparación de anhídridos de ácido). También en la pág. 94, Carius muestra ecuaciones químicas en las que se usa cloruro de tionilo para transformar ácido benzoico (OC 7 H 5 OH) en cloruro de benzoilo (ClC 7 H 5 O) y para transformar benzoato de sodio en anhídrido benzoico . En la pág. 96, menciona que el cloruro de tionilo transformará el metanol en cloruro de metilo ( Clormetilo ). El cloruro de tionilo se comporta como el cloruro de fosforilo : de las págs. 94-95: "Die Einwirkung des Chlorthionyls... die Reaction des Chlorthionyls weit heftiger statt". (La reacción del cloruro de tionilo con sustancias [orgánicas] que contienen oxígeno se desarrolla en general en paralelo a la del cloruro de fosforilo; cuando este último ejerce un efecto, el cloruro de tionilo suele hacerlo también, sólo que en casi todos los casos la reacción ocurre mucho más vigorosamente.)






