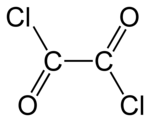
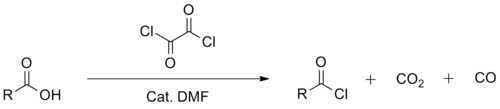Cloruro de oxalilo
 | |||
| |||
 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Dicloruro de oxalilo [1] | |||
| Nombre sistemático de la IUPAC Dicloruro de etanodioilo [1] | |||
Otros nombres
| |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.001.092 | ||
| Número CE |
| ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C2O2Cl2 | |||
| Masa molar | 126,92 g·mol −1 | ||
| Apariencia | Líquido incoloro | ||
| Olor | Similar al fosgeno [2] | ||
| Densidad | 1,4785 g/ml | ||
| Punto de fusión | -16 °C (3 °F; 257 K) | ||
| Punto de ebullición | 63 a 64 °C (145 a 147 °F; 336 a 337 K) a 1,017 bar | ||
| Reacciona | |||
Índice de refracción ( n D ) | 1.429 | ||
| Peligros | |||
| Seguridad y salud en el trabajo (SST/OHS): | |||
Principales peligros | Tóxico, corrosivo, lacrimógeno [3] | ||
| Etiquetado SGA : | |||
  [3] [3] | |||
| Peligro [3] | |||
| H314 , H331 [3] | |||
| P261 , P280 , P305+P351+P338 , P310 [3] | |||
| NFPA 704 (rombo cortafuegos) | |||
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad externa | ||
| Compuestos relacionados | |||
Cloruros de acilo relacionados | |||
Compuestos relacionados |
| ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El cloruro de oxalilo es un compuesto químico orgánico con la fórmula Cl−C(=O)−C(=O)−Cl . Este líquido incoloro y de olor fuerte, el cloruro de diacilo del ácido oxálico , es un reactivo útil en la síntesis orgánica . [4]
Preparación
El cloruro de oxalilo fue preparado por primera vez en 1892 por el químico francés Adrien Fauconnier, quien hizo reaccionar oxalato de dietilo con pentacloruro de fósforo. [5] También se puede preparar tratando ácido oxálico con pentacloruro de fósforo . [6]
El cloruro de oxalilo se produce comercialmente a partir de carbonato de etileno . La fotocloración produce carbonato de percloroetileno C 2 Cl 4 O 2 CO y cloruro de hidrógeno HCl, que posteriormente se degrada a cloruro de oxalilo y fosgeno COCl 2 : [7]
- C 2 H 4 O 2 CO + 4 Cl 2 → C 2 Cl 4 O 2 CO + 4 HCl
- C2Cl4O2CO → C2O2Cl2 + COCl2
Reacciones
El cloruro de oxalilo reacciona con el agua produciendo únicamente productos gaseosos: cloruro de hidrógeno (HCl), dióxido de carbono ( CO 2 ) y monóxido de carbono (CO).
- (COCl) 2 + H 2 O → 2 HCl + CO 2 + CO
En esto, es bastante diferente de otros cloruros de acilo que se hidrolizan con la formación de cloruro de hidrógeno y el ácido carboxílico original . [ cita requerida ]
Aplicaciones en síntesis orgánica
Oxidación de alcoholes
La adición de un alcohol primario o secundario a una solución de cloruro de oxalilo en DMSO , seguida de un enfriamiento con una base orgánica como la trietilamina, convierte los alcoholes en los aldehídos y cetonas correspondientes a través del proceso conocido como oxidación de Swern . [8] [9] [10]
Síntesis de cloruros de acilo
El cloruro de oxalilo se utiliza principalmente junto con un catalizador de N , N -dimetilformamida en síntesis orgánica para la preparación de cloruros de acilo a partir de los ácidos carboxílicos correspondientes . Al igual que el cloruro de tionilo , el reactivo se degrada en productos secundarios volátiles en esta aplicación, lo que simplifica el procesamiento. Uno de los subproductos menores de la reacción catalizada por N , N -dimetilformamida, el cloruro de dimetilcarbamoilo , es un potente carcinógeno, que se deriva de la descomposición de N , N -dimetilformamida. [11] [12] En relación con el cloruro de tionilo, el cloruro de oxalilo tiende a ser un reactivo más suave y selectivo . También es más caro que el cloruro de tionilo, por lo que tiende a usarse en menor escala.
Esta reacción implica la conversión de N , N -dimetilformamida en el derivado cloruro de imidoilo (ion clorometilen ( dimetil)amonio (CH3 ) 2N + = CHCl ), similar a la primera etapa de la reacción de Vilsmeier-Haack . El cloruro de imidoilo es el agente clorante activo.
Formilación de arenos
El cloruro de oxalilo reacciona con compuestos aromáticos en presencia de cloruro de aluminio para dar el cloruro de acilo correspondiente en un proceso conocido como acilación de Friedel-Crafts . [13] [14] El cloruro de acilo resultante se puede hidrolizar para formar el ácido carboxílico correspondiente .
Preparación de diésteres de oxalato
Al igual que otros cloruros de acilo, el cloruro de oxalilo reacciona con alcoholes para formar ésteres:
- 2R−CH2 − OH + Cl−C(=O)−C(=O)Cl → R−CH2 − O−C(=O)−C(=O)−O−CH2 − R + 2 HCl
Por lo general, estas reacciones se llevan a cabo en presencia de una base como la piridina . El diéster derivado del fenol , el éster de oxalato de fenilo , es Cyalume, el ingrediente activo de las barras luminosas . [ cita requerida ]
Otro
Se informa que el cloruro de oxalilo se utilizó en la primera síntesis de dioxano tetracetona ( C 4 O 6 ), un óxido de carbono . [15]
Precauciones
En marzo de 2000, un Airbus A330-300 de Malaysia Airlines sufrió daños irreparables después de que un cargamento de cloruro de oxalilo prohibido (declarado falsamente como hidroxiquinolina ) se filtrara en el compartimento de carga. [16] Es tóxico por inhalación, aunque es un orden de magnitud menos agudo que el compuesto relacionado fosgeno . [17]
Véase también
Referencias
- ^ ab Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 (Libro azul) . Cambridge: The Royal Society of Chemistry . 2014. pág. 797. doi :10.1039/9781849733069-FP001. ISBN . 978-0-85404-182-4.
- ^ Cloruro de oxalilo: olor
- ^ abcde Hoja de datos de seguridad del cloruro de oxalilo
- ^ Salmon, R. (2001). "Cloruro de oxalilo". Enciclopedia de reactivos para síntesis orgánica . Nueva York: John Wiley & Sons. doi :10.1002/047084289X.ro015. ISBN 0471936235.
- ^ Fauconnier, Adrien (1892). "Action du perchlorure de phosphorore sur l'oxalate d'éthyle" [La acción del pentacloruro de fósforo sobre el oxalato de dietilo]. Comptes rendus hebdomadaires des séances de l'Académie des Sciences (en francés). 114 : 122-123.
- ^ Patente DE 2840435, Vogel, A.; Steffan, G.; Mannes, K.; Trescher, V., "Proceso para la preparación de cloruro de oxalilo", expedida el 27 de marzo de 1980, asignada a Bayer
- ^ Pfoertner, Karl-Heinz (2000). "Fotoquímica". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a19_573. ISBN 3527306730.
- ^ Dondoni, A.; Perrone, D. (2004). "Síntesis de 1,1-dimetil etil-(S)-4-formil-2,2-dimetil-3-oxazolidinacarboxilato por oxidación del alcohol". Síntesis orgánicas; Volúmenes recopilados , vol. 10, pág. 320.
- ^ Bishop, R. (1998). "9-Tiabiciclo[3.3.1]nonano-2,6-diona". Síntesis orgánicas; Volúmenes recopilados , vol. 9, pág. 692.
- ^ Leopold, EJ (1990). "Hidroboración selectiva de un 1,3,7-trieno: homogeraniol". Síntesis orgánicas; Volúmenes recopilados , vol. 7, pág. 258.
- ^ Clayden, Jonathan (2005). Química orgánica (ed. reimpresa (con correcciones)). Oxford [ua]: Oxford Univ. Press. pp. 296. ISBN 978-0-19-850346-0.
- ^ Levin, D. (1997). "Posibles preocupaciones toxicológicas asociadas con la cloración del ácido carboxílico y otras reacciones". Investigación y desarrollo de procesos orgánicos . 1 (2). American Chemical Society : 182. doi :10.1021/op970206t.
- ^ Neubert, ME; Fishel, DL (1983). "Preparación de cloruros de 4-alquilo y 4-halobenzoilo: cloruro de 4-pentilbenzoilo". Organic Syntheses . 61 : 8; Volúmenes recopilados , vol. 7, pág. 420.
- ^ Sokol, PE (1964). "Ácido mesitoico". Síntesis orgánicas . 44 : 69; Volúmenes recopilados , vol. 5, pág. 706.
- ^ Strazzolini, P.; Gambi, A.; Giumanini, AG; Vancik, H. (1998). "La reacción entre dihaluros de etanodioilo (oxalilo) y Ag2C2O4 : una ruta hacia el elusivo anhídrido de ácido etanodioico (oxálico) de Staudinger". Journal of the Chemical Society, Perkin Transactions 1. 1998 ( 16): 2553–2558. doi :10.1039/a803430c .
- ^ "Se le ordena a una empresa pagar 65 millones de dólares por arruinar un avión". Reuters . 2007-12-06 . Consultado el 2007-12-06 .
- ^ Barbee, SJ; Stone, JJ; Hilaski, RJ (enero de 1995). "Toxicología por inhalación aguda del cloruro de oxalilo". Revista de la Asociación Estadounidense de Higiene Industrial . 56 (1): 74–76. doi :10.1080/15428119591017358. ISSN 0002-8894. PMID 7872205.