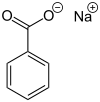
Benzoato de sodio
 | |
 | |
 Modelo de bolas y palos de parte de la estructura cristalina. | |
 Modelo de bolas y palos del empaquetamiento en la estructura cristalina | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Benzoato de sodio | |
Otros nombres
| |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.007.760 |
| Número E | E211 (conservantes) |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C7H5NaO2 | |
| Masa molar | 144,105 g·mol −1 |
| Apariencia | polvo cristalino blanco o incoloro |
| Olor | inodoro |
| Densidad | 1,497 g/ cm3 |
| Punto de fusión | 410 °C (770 °F; 683 K) |
| 62,65 g/100 ml (0 °C) 62,84 g/100 ml (15 °C) 62,87 g/100 ml (30 °C) 74,2 g/100 ml (100 °C) [1] | |
| Solubilidad | soluble en amoniaco líquido , piridina [1] |
| Solubilidad en metanol | 8,22 g/100 g (15 °C) 7,55 g/100 g (66,2 °C) [1] |
| Solubilidad en etanol | 2,3 g/100 g (25 °C) 8,3 g/100 g (78 °C) [1] |
| Solubilidad en 1,4-dioxano | 0,818 mg/kg (25 °C) [1] |
| Farmacología | |
| A16AX11 ( OMS ) | |
| Peligros | |
| Etiquetado SGA : | |
 [2] [2] | |
| Advertencia | |
| H319 [2] | |
| P305+P351+P338 [2] | |
| NFPA 704 (rombo cortafuegos) | |
| punto de inflamabilidad | 100 °C (212 °F; 373 K) |
| 500 °C (932 °F; 773 K) | |
| Dosis o concentración letal (LD, LC): | |
LD 50 ( dosis media ) | 4100 mg/kg (oral, rata) |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El benzoato de sodio, también conocido como benzoato de sodio , es la sal sódica del ácido benzoico , ampliamente utilizado como conservante de alimentos ( con un número E de E211 ) y como agente decapante . Se presenta como una sustancia química cristalina blanca con la fórmula C6H5COONa .
Producción
El benzoato de sodio se produce comúnmente mediante la neutralización del hidróxido de sodio (NaOH) con ácido benzoico (C 6 H 5 COOH), [3] que a su vez se produce comercialmente mediante la oxidación parcial del tolueno con oxígeno .
Reacciones
El benzoato de sodio se puede descarboxilar con una base fuerte y calor, produciendo benceno : [4]
Ocurrencia natural
El benzoato de sodio no es una sustancia que se encuentre en la naturaleza. Sin embargo, muchos alimentos son fuentes naturales de ácido benzoico, sus sales y sus ésteres . [5] Las frutas y verduras pueden ser fuentes ricas, en particular las bayas como el arándano rojo y el arándano azul . Otras fuentes incluyen mariscos , como los camarones , y productos lácteos . [ cita requerida ]
Usos
Como conservante
El benzoato de sodio puede actuar como conservante de alimentos. Se utiliza más ampliamente en alimentos ácidos como aderezos para ensaladas (por ejemplo, ácido acético en vinagre ), bebidas carbonatadas ( ácido carbónico ), mermeladas y jugos de frutas ( ácido cítrico ), encurtidos ( ácido acético ), condimentos y coberturas de yogur helado . También se utiliza como conservante en medicamentos y cosméticos. [6] [7] En estas condiciones, se convierte en ácido benzoico (E210), que es bacteriostático y fungistático . El ácido benzoico generalmente no se usa directamente debido a su baja solubilidad en agua. La concentración como conservante de alimentos está limitada por la FDA en los EE. UU. al 0,1% en peso. [8] El benzoato de sodio también está permitido como aditivo alimentario para animales hasta en un 0,1%, según la Asociación de Funcionarios de Control de Alimentos de los Estados Unidos. [9] El benzoato de sodio ha sido reemplazado por sorbato de potasio en la mayoría de los refrescos en el Reino Unido . [10]
En el siglo XIX, Harvey W. Wiley, con su "Escuadrón de venenos" como parte del Departamento de Agricultura de los Estados Unidos , investigó el benzoato de sodio como ingrediente alimentario . Esto condujo a la Ley de Alimentos y Medicamentos Puros de 1906 , un evento clave en la historia temprana de la regulación de los alimentos en los Estados Unidos .
En productos farmacéuticos
El benzoato de sodio se utiliza como tratamiento para los trastornos del ciclo de la urea debido a su capacidad para unirse a los aminoácidos. [11] [12] Esto conduce a la excreción de estos aminoácidos y a una disminución de los niveles de amoníaco. Investigaciones recientes muestran que el benzoato de sodio puede ser beneficioso como terapia complementaria (1 gramo/día) en la esquizofrenia . [13] [14] [15] Las puntuaciones totales de la Escala de síndrome positivo y negativo disminuyeron un 21 % en comparación con el placebo.
El benzoato de sodio, junto con el fenilbutirato , se utiliza para tratar la hiperamonemia . [16] [17]
El benzoato de sodio, junto con la cafeína , se utiliza para tratar el dolor de cabeza posterior a la punción dural , la depresión respiratoria asociada con la sobredosis de narcóticos , [18] [19] y con ergotamina para tratar el dolor de cabeza vascular . [20]
Otros usos
El benzoato de sodio también se utiliza en fuegos artificiales como combustible en una mezcla para silbidos , un polvo que emite un ruido silbante cuando se comprime en un tubo y se enciende. [21] [22]
Mecanismo de conservación de alimentos
El mecanismo comienza con la absorción de ácido benzoico en la célula. Si el pH intracelular cae a 5 o menos, la fermentación anaeróbica de la glucosa a través de la fosfofructoquinasa disminuye drásticamente, [23] lo que inhibe el crecimiento y la supervivencia de los microorganismos que causan el deterioro de los alimentos.
Salud y seguridad

En los Estados Unidos , el benzoato de sodio está designado como generalmente reconocido como seguro (GRAS) por la Administración de Alimentos y Medicamentos . [24] El Programa Internacional de Seguridad Química no encontró efectos adversos en humanos en dosis de 647–825 mg/kg de peso corporal por día. [25] [26]
Los gatos tienen una tolerancia significativamente menor al ácido benzoico y sus sales que las ratas y los ratones. [27]
El cuerpo humano elimina rápidamente el benzoato de sodio al combinarlo con glicina para formar ácido hipúrico , que luego se excreta. [26] La vía metabólica para esto comienza con la conversión del benzoato por la butirato-CoA ligasa en un producto intermedio, benzoil-CoA , [28] que luego es metabolizado por la glicina N -aciltransferasa en ácido hipúrico. [29]
Asociación con benceno en refrescos y salsas picantes
En combinación con el ácido ascórbico (vitamina C, E300), el benzoato de sodio y el benzoato de potasio pueden formar benceno . En 2006, la Administración de Alimentos y Medicamentos analizó 100 bebidas disponibles en los Estados Unidos que contenían tanto ácido ascórbico como benzoato. Cuatro tenían niveles de benceno superiores al Nivel Máximo de Contaminante de 5 ppb establecido por la Agencia de Protección Ambiental para el agua potable. [30] La mayoría de las bebidas que superaron el límite se han reformulado y, posteriormente, se analizaron por debajo del límite de seguridad. [30] El calor, la luz y la vida útil pueden aumentar la velocidad a la que se forma el benceno. Los pimientos picantes contienen vitamina C de forma natural ("casi tanta como una naranja" [31] ), por lo que la observación sobre las bebidas se aplica a las salsas de pimientos que contienen benzoato de sodio, como Texas Pete .
TDAH e hiperactividad
Una investigación publicada, incluso en 2007, por la Agencia de Normas Alimentarias del Reino Unido (FSA, por sus siglas en inglés) sugiere que ciertos colorantes artificiales , cuando se combinan con benzoato de sodio, pueden estar relacionados con el comportamiento hiperactivo y otros síntomas de TDAH. Los resultados fueron inconsistentes con respecto al benzoato de sodio, por lo que la FSA recomendó estudios adicionales. [32] [33] [34] La Agencia de Normas Alimentarias concluyó que los aumentos observados en el comportamiento hiperactivo, si eran reales, tenían más probabilidades de estar relacionados con los colorantes artificiales que con el benzoato de sodio. [34] El autor del informe, Jim Stevenson de la Universidad de Southampton , dijo: "Los resultados sugieren que el consumo de ciertas mezclas de colorantes alimentarios artificiales y conservantes de benzoato de sodio se asocian con aumentos en el comportamiento hiperactivo en los niños... Hay muchas otras influencias en juego, pero al menos esta es una que un niño puede evitar". [34]
Estado compendial
- Farmacopea Británica [35] [36] [37]
- Farmacopea Europea [35]
- Codex sobre sustancias químicas alimentarias [35]
- Farmacopea Japonesa [38]
- Farmacopea de los Estados Unidos [39]
Véase también
Referencias
- ^ abcde "benzoato de sodio". chemister.ru .
- ^ abc Sigma-Aldrich Co. , Benzoato de sodio. Consultado el 23 de mayo de 2014.
- ^ "Programa Internacional de Seguridad Química". Inchem.org . Consultado el 9 de febrero de 2022 .
- ^ Wertheim E (1942). Química orgánica introductoria con ciertos capítulos de bioquímica. The Blakistan Company. pág. 236.
- ^ del Olmo A, Calzada J, Nuñez M (20 de noviembre de 2015). "Ácido benzoico y sus derivados como compuestos naturales en alimentos y como aditivos: usos, exposición y controversia". Critical Reviews in Food Science and Nutrition . 57 (14): 3084–3103. doi :10.1080/10408398.2015.1087964. PMID 26587821. S2CID 205692543.
- ^ "Benzoato de sodio". PubChem .Biblioteca Nacional de Medicina
- ^ "Robitussin (guaifenesina)". Rxmed.com . Consultado el 14 de enero de 2013 .
- ^ "Código de Regulaciones Federales, Título 21". www.accessdata.fda.gov .
- ^ AAFCO (2004). "Publicación oficial": 262.
{{cite journal}}: Requiere citar revista|journal=( ayuda ) - ^ Saltmarsh M (15 de marzo de 2015). "Tendencias recientes en el uso de aditivos alimentarios en el Reino Unido". Journal of the Science of Food and Agriculture . 95 (4): 649–652. Bibcode :2015JSFA...95..649S. doi :10.1002/jsfa.6715. ISSN 1097-0010. PMID 24789520.
... el conservante utilizado en el estudio, el benzoato de sodio, ha sido reemplazado por sorbato de potasio en la mayoría de los refrescos.
- ^ Häberle J, Boddaert N, Burlina A, Chakrapani A, Dixon M, Huemer M, Karall D, Martinelli D, Crespo PS, Santer R, Servais A, Valayannopoulos V, Lindner M, Rubio V, Dionisi-Vici C (2012) . "Pautas sugeridas para el diagnóstico y tratamiento de los trastornos del ciclo de la urea". Revista Orphanet de Enfermedades Raras . 7 : 32. doi : 10.1186/1750-1172-7-32 . PMC 3488504 . PMID 22642880.
- ^ Wilcken B (2004). "Problemas en el tratamiento de los trastornos del ciclo de la urea". Genética molecular y metabolismo . 81 (Supl 1): S86–91. doi :10.1016/j.ymgme.2003.10.016. PMID 15050980.
- ^ Tratamiento complementario con benzoato para la esquizofrenia Un ensayo aleatorizado, doble ciego y controlado con placebo sobre un inhibidor de la d-aminoácido oxidasa Diciembre de 2013
- ^ "Digest of Neurology and Psychiatry". Instituto de Vida. 16 de abril de 2018 – vía Google Books.
- ^ Publicaciones del personal del Instituto de Investigación de Salud Mental, Universidad de Michigan. Instituto de Investigación de Salud Mental
- ^ "La canela podría ayudar a detener la progresión de la enfermedad de Parkinson - Comunicados de prensa - Rush University Medical Center".
- ^ FENILBUTIRATO, BENZOATO DE SODIO. Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales. 2012. PMID 31643176.
- ^ Yücel A, Ozyalçin S, Talu GK, Yücel EC, Erdine S (1999). "Administración intravenosa de benzoato de sodio y cafeína para la cefalea pospunción dural". Reg Anesth Pain Med . 24 (1): 51–4. doi :10.1097/00115550-199924010-00010. PMID 9952095.
- ^ mayoclinic.org, Cafeína y benzoato de sodio (vía inyectable)
- ^ ebi.ac.uk, CHEBI:32140 - benzoato de cafeína y sodio
- ^ Öztap S. "El silbato pirotécnico y sus aplicaciones" (PDF) . Pyrotechnica . 11 : 46–54.
- ^ Verbovytskyy Y, Juknelevicius D (2023). "Silbatos pirotécnicos: una descripción general". Propulsores, explosivos, pirotecnia . 48 (6): e202300044. doi :10.1002/prep.202300044. ISSN 0721-3115.
- ^ Krebs HA, Wiggins D., Stubbs M., Sols A., Bedoya F. (septiembre de 1983). "Estudios sobre el mecanismo de la acción antifúngica del benzoato". Revista bioquímica . 218 (3): 657–663. doi :10.1042/bj2140657. PMC 1152300 . PMID 6226283.
- ^ "CFR - Código de Reglamentos Federales, Título 21". www.accessdata.fda.gov .
- ^ "Documento de evaluación química internacional concisa n.º 26: Ácido benzoico y benzoato de sodio". Inchem.org . Consultado el 14 de enero de 2013 .
- ^ Panel de expertos en revisión de ingredientes cosméticos Bindu Nair (2001). "Informe final sobre la evaluación de seguridad del alcohol bencílico, el ácido benzoico y el benzoato de sodio". Int J Tox . 20 (Supl 3): 23–50. doi :10.1080/10915810152630729. PMID 11766131. S2CID 13639993.
- ^ Bedford PG, Clarke EG (enero de 1972). "Intoxicación experimental con ácido benzoico en gatos". Vet. Rec . 90 (3): 53–8. doi :10.1136/vr.90.3.53 (inactivo el 11 de septiembre de 2024). PMID 4672555. S2CID 2553612.
{{cite journal}}: CS1 maint: DOI inactivo a partir de septiembre de 2024 ( enlace ) - ^ "butirato-CoA ligasa". BRENDA . Universidad Técnica de Braunschweig . Consultado el 7 de mayo de 2014 .Sustrato/Producto
- ^ "glicina N-aciltransferasa". BRENDA . Universidad Técnica de Braunschweig . Consultado el 7 de mayo de 2014 .Sustrato/Producto
- ^ ab "Datos sobre benceno en refrescos y otras bebidas". Administración de Alimentos y Medicamentos de los Estados Unidos . 16 de mayo de 2007. Archivado desde el original el 12 de enero de 2017. Consultado el 7 de noviembre de 2013 .
- ^ "¿La salsa picante es buena para la salud?". 4 de noviembre de 2016.
- ^ La Agencia de Normas Alimentarias publica un asesoramiento revisado sobre determinados colorantes artificiales Archivado el 6 de diciembre de 2011 en Wayback Machine. 6 de septiembre de 2007
- ^ Colorantes alimentarios e hiperactividad Archivado el 20 de mayo de 2023 en Wayback Machine "Miomancia" 7 de septiembre de 2007
- ^ La Agencia revisa las recomendaciones sobre determinados colorantes artificiales Archivado el 12 de abril de 2012 en Wayback Machine , Agencia de Normas Alimentarias, 11 de septiembre de 2007
- ^ abc Sigma Aldrich . «Sodium benzoate» . Consultado el 17 de julio de 2009 .
- ^ Therapeutic Goods Administration . «Sustancias químicas» (PDF) . Archivado desde el original (PDF) el 15 de junio de 2009. Consultado el 17 de julio de 2009 .
- ^ Secretaría de la Comisión de la Farmacopea Británica. «Índice (BP)» (PDF) . Archivado desde el original (PDF) el 11 de abril de 2009. Consultado el 2 de marzo de 2010 .
- ^ "Farmacopea Japonesa 15.ª edición". Archivado desde el original el 28 de marzo de 2010. Consultado el 2 de marzo de 2010 .
- ^ Convención de la Farmacopea de los Estados Unidos . «Revisiones de la USP 29–NF 24». Archivado desde el original el 4 de abril de 2009. Consultado el 17 de julio de 2009 .
Enlaces externos
- Programa Internacional de Seguridad Química: Informe sobre el ácido benzoico y el benzoato de sodio
- Kubota K, Ishizaki T (1991). "Farmacocinética dependiente de la dosis del ácido benzoico tras la administración oral de benzoato de sodio a seres humanos". Eur. J. Clin. Pharmacol . 41 (4): 363–8. doi :10.1007/BF00314969. PMID 1804654. S2CID 8196430.
Aunque la tasa máxima de biotransformación del ácido benzoico en ácido hipúrico varió entre 17,2 y 28,8 mg.kg-1.h-1 entre los seis individuos, el valor medio (23,0 mg.kg-1.h-1) fue bastante cercano al proporcionado por la dosis máxima diaria (0,5 g.kg-1.día-1) recomendada en el tratamiento de la hiperamonemia en pacientes con errores innatos de la ureagénesis.
- Datos de seguridad del benzoato de sodio Archivado el 11 de diciembre de 2011 en Wayback Machine.
.





