Cloruro de hidrógeno
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Cloruro de hidrógeno [1] | |||
| Nombre sistemático de la IUPAC Clorano [2] | |||
| Otros nombres Gas de ácido clorhídrico Gas clorhídrico Clorhidrato | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 1098214 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.028.723 | ||
| Número CE |
| ||
| 322 | |||
| BARRIL | |||
| Malla | Ácido clorhídrico+ | ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 1050 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| Clorhidrato | |||
| Masa molar | 36,46 g/mol | ||
| Apariencia | Gas incoloro | ||
| Olor | picante; agudo y ardiente | ||
| Densidad | 1,49 g/L [3] | ||
| Punto de fusión | -114,22 °C (-173,60 °F; 158,93 K) | ||
| Punto de ebullición | -85,05 °C (-121,09 °F; 188,10 K) | ||
| 823 g/L (0 °C) 720 g/L (20 °C) 561 g/L (60 °C) | |||
| Solubilidad | soluble en metanol , etanol , éter y agua | ||
| Presión de vapor | 4352 kPa (a 21,1 °C) [4] | ||
| Acidez (p K a ) | −3,0; [5] −5,9 (±0,4) [6] | ||
| Basicidad (p K b ) | 17.0 | ||
| Ácido conjugado | Cloronio | ||
| Base conjugada | Cloruro | ||
Índice de refracción ( n D ) | 1.0004456 (gas) 1.254 (líquido) | ||
| Viscosidad | 0,311 cP (−100 °C) | ||
| Estructura | |||
| lineal | |||
| 1,05 D | |||
| Termoquímica | |||
Capacidad calorífica ( C ) | 0,7981 J/(K·g) | ||
Entropía molar estándar ( S ⦵ 298 ) | 186,902 J/(K·mol) | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −92,31 kJ/mol | ||
Entalpía estándar de combustión (Δ c H ⦵ 298 ) | −95,31 kJ/mol | ||
| Farmacología | |||
| A09AB03 ( OMS ) B05XA13 ( OMS ) | |||
| Peligros | |||
| Seguridad y salud en el trabajo (SST/OHS): | |||
Principales peligros | Tóxico, corrosivo | ||
| Etiquetado SGA : | |||
  | |||
| Peligro | |||
| H314 , H331 | |||
| P261 , P280 , P303+P361+P353 , P304+P340+P310 , P305+P351+P338 , P410+P403 | |||
| NFPA 704 (rombo cortafuegos) | |||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 238 mg/kg (rata, oral) | ||
LC 50 ( concentración media ) | 3124 ppm (rata, 1 h ) 1108 ppm (ratón, 1 h) [8] | ||
LC Lo ( valor más bajo publicado ) | 1300 ppm (humano, 30 min ) 4416 ppm (conejo, 30 min) 4416 ppm (conejillo de indias, 30 min) 3000 ppm (humano, 5 min) [8] | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | C 5 ppm (7 mg/m3 ) [ 7] | ||
REL (recomendado) | C 5 ppm (7 mg/m3 ) [ 7] | ||
IDLH (Peligro inmediato) | 50 ppm [7] | ||
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad del material de JT Baker | ||
| Compuestos relacionados | |||
Compuestos relacionados | Fluoruro de hidrógeno Bromuro de hidrógeno Yoduro de hidrógeno Astaturo de hidrógeno | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El compuesto cloruro de hidrógeno tiene la fórmula química HCl y, como tal, es un haluro de hidrógeno . A temperatura ambiente , es un gas incoloro que forma humos blancos de ácido clorhídrico al entrar en contacto con el vapor de agua atmosférico . El gas cloruro de hidrógeno y el ácido clorhídrico son importantes en la tecnología y la industria. El ácido clorhídrico, la solución acuosa de cloruro de hidrógeno, también suele recibir la fórmula HCl.
Reacciones

El cloruro de hidrógeno es una molécula diatómica , que consta de un átomo de hidrógeno H y un átomo de cloro Cl conectados por un enlace covalente polar . El átomo de cloro es mucho más electronegativo que el átomo de hidrógeno, lo que hace que este enlace sea polar. En consecuencia, la molécula tiene un gran momento dipolar con una carga parcial negativa (δ−) en el átomo de cloro y una carga parcial positiva (δ+) en el átomo de hidrógeno. [9] En parte debido a su alta polaridad, el HCl es muy soluble en agua (y en otros disolventes polares ).
Al entrar en contacto, el H 2 O y el HCl se combinan para formar cationes hidronio [H 3 O] + y aniones cloruro Cl − a través de una reacción química reversible :
- HCl + H2O → [H3O ] + + Cl −
La solución resultante se llama ácido clorhídrico y es un ácido fuerte . La constante de disociación o ionización ácida , K a , es grande, lo que significa que el HCl se disocia o ioniza prácticamente por completo en agua. Incluso en ausencia de agua, el cloruro de hidrógeno puede seguir actuando como ácido. Por ejemplo, el cloruro de hidrógeno puede disolverse en otros disolventes como el metanol :
- HCl + CH3OH → [ CH3OH2 ] + + Cl −
El cloruro de hidrógeno puede protonar moléculas o iones y también puede servir como catalizador ácido para reacciones químicas donde se desean condiciones anhidras (sin agua).
Debido a su naturaleza ácida, el cloruro de hidrógeno es una sustancia corrosiva , particularmente en presencia de humedad.
Estructura y propiedades
El HCl congelado experimenta una transición de fase a 98,4 K (−174,8 °C; −282,5 °F). La difracción de rayos X en polvo del material congelado muestra que el material cambia de una estructura ortorrómbica a una cúbica durante esta transición. En ambas estructuras, los átomos de cloro están en una disposición centrada en las caras . Sin embargo, no se pudieron localizar los átomos de hidrógeno. [10] El análisis de los datos espectroscópicos y dieléctricos, y la determinación de la estructura del DCl (cloruro de deuterio) indican que el HCl forma cadenas en zigzag en el sólido, al igual que el HF (véase la figura de la derecha). [11]
| Temperatura (°C) | 0 | 20 | 30 | 50 |
|---|---|---|---|---|
| Agua | 823 | 720 | 673 | 596 |
| Metanol | 513 | 470 | 430 | |
| Etanol | 454 | 410 | 381 | |
| Éter | 356 | 249 | 195 |


El espectro infrarrojo del cloruro de hidrógeno gaseoso, que se muestra a la izquierda, consta de una serie de líneas de absorción nítidas agrupadas alrededor de 2886 cm −1 (longitud de onda ~3,47 μm). A temperatura ambiente, casi todas las moléculas están en el estado vibracional fundamental v = 0. Si se incluye la anarmonicidad, la energía vibracional se puede escribir como:
Para promover una molécula de HCl del estado v = 0 al estado v = 1, esperaríamos ver una absorción infrarroja alrededor de ν o = ν e + 2 x e ν e = 2880 cm −1 . Sin embargo, esta absorción correspondiente a la rama Q no se observa debido a que está prohibida por simetría. En cambio, se ven dos conjuntos de señales (ramas P y R) debido a un cambio simultáneo en el estado rotacional de las moléculas. Debido a las reglas de selección mecánica cuántica, solo se permiten ciertas transiciones rotacionales. Los estados se caracterizan por el número cuántico rotacional J = 0, 1, 2, 3, ... Las reglas de selección establecen que Δ J solo puede tomar valores de ±1.
El valor de la constante rotacional B es mucho menor que el vibracional ν o , de modo que se requiere una cantidad mucho menor de energía para rotar la molécula; para una molécula típica, esto se encuentra dentro de la región de microondas. Sin embargo, la energía vibracional de la molécula de HCl coloca sus absorciones dentro de la región infrarroja, lo que permite que un espectro que muestra las transiciones rovibratorias de esta molécula se recopile fácilmente utilizando un espectrómetro infrarrojo con una celda de gas. Esta última incluso puede estar hecha de cuarzo, ya que la absorción del HCl se encuentra en una ventana de transparencia para este material.
El cloro, abundante en la naturaleza, consta de dos isótopos, 35 Cl y 37 Cl, en una proporción de aproximadamente 3:1. Si bien las constantes de resorte son casi idénticas, las masas reducidas dispares de H 35 Cl y H 37 Cl causan diferencias mensurables en la energía rotacional, por lo que se observan dobletes al inspeccionar de cerca cada línea de absorción, ponderados en la misma proporción de 3:1.
Producción
La mayor parte del cloruro de hidrógeno producido a escala industrial se utiliza para la producción de ácido clorhídrico . [13]
Rutas históricas
En el siglo XVII, Johann Rudolf Glauber de Karlstadt am Main, Alemania, utilizó sal de cloruro de sodio y ácido sulfúrico para la preparación de sulfato de sodio en el proceso de Mannheim , liberando cloruro de hidrógeno. Joseph Priestley de Leeds, Inglaterra, preparó cloruro de hidrógeno puro en 1772, [14] y en 1808 Humphry Davy de Penzance, Inglaterra, había demostrado que la composición química incluía hidrógeno y cloro . [15]
Síntesis directa
El cloruro de hidrógeno se produce combinando cloro e hidrógeno :
- Cl2 + H2 → 2 HCl
Como la reacción es exotérmica , la instalación se denomina horno de HCl o quemador de HCl. El gas de cloruro de hidrógeno resultante se absorbe en agua desionizada , lo que da lugar a ácido clorhídrico químicamente puro. Esta reacción puede dar lugar a un producto muy puro, por ejemplo, para su uso en la industria alimentaria.
La reacción también puede desencadenarse por la luz azul. [16]
Síntesis orgánica
La producción industrial de cloruro de hidrógeno suele estar integrada con la formación de compuestos orgánicos clorados y fluorados , por ejemplo, teflón , freón y otros CFC , así como ácido cloroacético y PVC . A menudo, esta producción de ácido clorhídrico se integra con su uso in situ. En las reacciones químicas , los átomos de hidrógeno del hidrocarburo se sustituyen por átomos de cloro, con lo que el átomo de hidrógeno liberado se recombina con el átomo sobrante de la molécula de cloro, formando cloruro de hidrógeno. La fluoración es una reacción posterior de sustitución del cloro, que produce de nuevo cloruro de hidrógeno:
- RH + Cl2 → RCl + HCl
- RCl + HF → RF + HCl
El cloruro de hidrógeno resultante se reutiliza directamente o se absorbe en agua, dando lugar a ácido clorhídrico de grado técnico o industrial.
Métodos de laboratorio
Se pueden generar pequeñas cantidades de cloruro de hidrógeno para uso en laboratorio en un generador de HCl deshidratando el ácido clorhídrico con ácido sulfúrico o cloruro de calcio anhidro . Alternativamente, el HCl se puede generar mediante la reacción del ácido sulfúrico con cloruro de sodio: [17]
Esta reacción se produce a temperatura ambiente. Si queda NaCl en el generador y se calienta por encima de los 200 °C, la reacción continúa:
- NaCl + NaHSO 4 → Na 2 SO 4 + HCl ↑
Para que estos generadores funcionen, los reactivos deben estar secos.
El cloruro de hidrógeno también se puede preparar mediante la hidrólisis de ciertos compuestos reactivos de cloruro, como los cloruros de fósforo , el cloruro de tionilo ( SOCl 2 ) y los cloruros de acilo . Por ejemplo, se puede verter agua fría gradualmente sobre pentacloruro de fósforo ( PCl 5 ) para obtener HCl:
- PCl 5 + H 2 O → POCl 3 + 2 HCl ↑
Aplicaciones
La mayor parte del cloruro de hidrógeno se consume en la producción de ácido clorhídrico. También se utiliza en la producción de cloruro de vinilo y muchos cloruros de alquilo . [13] El triclorosilano , un precursor del silicio ultrapuro, se produce mediante la reacción del cloruro de hidrógeno y el silicio a unos 300 °C. [18]
- Si + 3 HCl → HSiCl 3 + H 2
Historia
Alrededor de 900, los autores de los escritos árabes atribuidos a Jabir ibn Hayyan (latín: Geber) y el médico y alquimista persa Abu Bakr al-Razi (c. 865-925, latín: Rhazes) estaban experimentando con sal amoniacal ( cloruro de amonio ), que cuando se destilaba junto con vitriolo ( sulfatos hidratados de varios metales) producía cloruro de hidrógeno. [19] Es posible que en uno de sus experimentos, al-Razi se topara con un método primitivo para producir ácido clorhídrico . [20] Sin embargo, parece que en la mayoría de estos primeros experimentos con sales de cloruro , los productos gaseosos se descartaban, y es posible que el cloruro de hidrógeno se haya producido muchas veces antes de que se descubriera que se puede utilizar en productos químicos. [21]
Uno de los primeros usos de este tipo fue la síntesis de cloruro de mercurio (II) (sublimado corrosivo), cuya producción a partir del calentamiento del mercurio con alumbre y cloruro de amonio o con vitriolo y cloruro de sodio se describió por primera vez en De aluminibus et salibus ("Sobre alumbres y sales"), un texto árabe del siglo XI o XII falsamente atribuido a Abu Bakr al-Razi y traducido al latín por Gerardo de Cremona (1144-1187). [22]
Otro desarrollo importante fue el descubrimiento de pseudo-Geber (en De inventione veritatis , "Sobre el descubrimiento de la verdad", después de c. 1300) de que añadiendo cloruro de amonio al ácido nítrico , se podía producir un disolvente fuerte capaz de disolver el oro (es decir, agua regia ). [23]
Después del descubrimiento a finales del siglo XVI del proceso por el cual se puede preparar ácido clorhídrico sin mezclar, [24] se reconoció que este nuevo ácido (entonces conocido como espíritu de sal o acidum salis ) liberaba cloruro de hidrógeno vaporoso, que se llamó aire ácido marino . En el siglo XVII, Johann Rudolf Glauber utilizó sal ( cloruro de sodio ) y ácido sulfúrico para la preparación de sulfato de sodio , liberando gas de cloruro de hidrógeno (ver producción, arriba). En 1772, Carl Wilhelm Scheele también informó sobre esta reacción y a veces se le atribuye su descubrimiento. Joseph Priestley preparó cloruro de hidrógeno en 1772, y en 1810 Humphry Davy estableció que está compuesto de hidrógeno y cloro . [25]
Durante la Revolución Industrial , aumentó la demanda de sustancias alcalinas como el carbonato de sodio , y Nicolas Leblanc desarrolló un nuevo proceso a escala industrial para producir carbonato de sodio. En el proceso Leblanc , la sal se convertía en carbonato de sodio, utilizando ácido sulfúrico, piedra caliza y carbón, dando como subproducto cloruro de hidrógeno. Inicialmente, este gas se ventilaba al aire, pero la Ley de Álcalis de 1863 prohibía dicha liberación, por lo que los productores de carbonato de sodio absorbieron el gas residual de HCl en agua, produciendo ácido clorhídrico a escala industrial. Más tarde, se desarrolló el proceso Hargreaves, que es similar al proceso Leblanc excepto que se utilizan dióxido de azufre , agua y aire en lugar de ácido sulfúrico en una reacción que es exotérmica en general. A principios del siglo XX, el proceso Leblanc fue reemplazado efectivamente por el proceso Solvay , que no producía HCl. Sin embargo, la producción de cloruro de hidrógeno continuó como un paso en la producción de ácido clorhídrico.
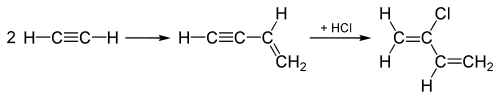
Los usos históricos del cloruro de hidrógeno en el siglo XX incluyen hidrocloraciones de alquinos para producir los monómeros clorados cloropreno y cloruro de vinilo , que posteriormente se polimerizan para producir policloropreno ( neopreno ) y cloruro de polivinilo (PVC), respectivamente. En la producción de cloruro de vinilo, el acetileno ( C 2 H 2 ) se hidroclora añadiendo el HCl a través del triple enlace de la molécula de C 2 H 2 , convirtiendo el triple enlace en un doble enlace , produciendo cloruro de vinilo.
El "proceso acetileno", utilizado hasta la década de 1960 para fabricar cloropreno , comienza uniendo dos moléculas de acetileno y luego agrega HCl al intermedio unido a través del triple enlace para convertirlo en cloropreno como se muestra aquí:
Este "proceso de acetileno" ha sido reemplazado por un proceso que agrega Cl2 al doble enlace del etileno y la eliminación posterior produce HCl en su lugar, así como cloropreno.
Seguridad
El cloruro de hidrógeno forma ácido clorhídrico corrosivo al entrar en contacto con el agua presente en los tejidos corporales. La inhalación de sus vapores puede provocar tos , asfixia , inflamación de la nariz, la garganta y las vías respiratorias superiores y, en casos graves, edema pulmonar , insuficiencia del sistema circulatorio y muerte. [26] El contacto con la piel puede provocar enrojecimiento, dolor y quemaduras químicas graves . El cloruro de hidrógeno puede provocar quemaduras graves en los ojos y daño ocular permanente.
La Administración de Seguridad y Salud Ocupacional de los Estados Unidos y el Instituto Nacional de Seguridad y Salud Ocupacional han establecido límites de exposición ocupacional para el cloruro de hidrógeno en un máximo de 5 ppm (7 mg/m 3 ), [27] y han recopilado amplia información sobre las preocupaciones de seguridad en el lugar de trabajo relacionadas con el cloruro de hidrógeno. [28]
Véase también
- Ácido gástrico , ácido clorhídrico secretado en el estómago para ayudar a la digestión de proteínas.
- Cloruro , sales de cloruro de hidrógeno.
- Bromuro de hidrógeno
- Clorhidrato , sales orgánicas del ácido clorhídrico.
- Hidrocloración , reacción de adición con alquenos.
Referencias
- ^ "cloruro de hidrógeno (CHEBI:17883)". Entidades químicas de interés biológico (ChEBI) . Reino Unido: Instituto Europeo de Bioinformática.
- ^ Favre, Henri A.; Powell, Warren H., eds. (2014). Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 . Cambridge: The Royal Society of Chemistry . pág. 131. ISBN 9781849733069.
- ^ Haynes, William M. (2010). Manual de química y física (91.ª ed.). Boca Raton, Florida, EE. UU.: CRC Press . pp. 4–67. ISBN 978-1-43982077-3.
- ^ Cloruro de hidrógeno. Enciclopedia de gases. Air Liquide
- ^ Tipping, E.(2002) [1] . Prensa de la Universidad de Cambridge, 2004.
- ^ Trummal, A.; Lipping, L.; Kaljurand, I.; Koppel, IA; Leito, I. "Acidez de ácidos fuertes en agua y dimetilsulfóxido" J. Phys. Chem. A. 2016 , 120 , 3663-3669. doi :10.1021/acs.jpca.6b02253
- ^ abc Guía de bolsillo del NIOSH sobre peligros químicos. "#0332". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ ab "Cloruro de hidrógeno". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Ouellette, Robert J.; Rawn, J. David (2015). Principios de química orgánica. Elsevier Science. pp. 6–. ISBN 978-0-12-802634-2.
- ^ Natta, G. (1933). "Estructura y polimorfismo degli acidi alogenidrici". Gazzetta Chimica Italiana (en italiano). 63 : 425–439.
- ^ Sándor, E.; Farrow, RFC (1967). "Estructura cristalina del cloruro de hidrógeno sólido y del cloruro de deuterio". Nature . 213 (5072): 171–172. Código Bibliográfico :1967Natur.213..171S. doi :10.1038/213171a0. S2CID 4161132.
- ^ Ácido clorhídrico: resumen de compuestos. Pubchem
- ^ de Austin, Severin; Glowacki, Arndt (2000). Ácido clorhídrico . doi :10.1002/14356007.a13_283. ISBN 3527306730.
- ^ Priestley J (1772). "Observaciones sobre diferentes tipos de aire [es decir, gases]". Philosophical Transactions of the Royal Society of London . 62 : 147–264 (234–244). doi :10.1098/rstl.1772.0021. S2CID 186210131.
- ^ Davy H (1808). "Investigaciones electroquímicas sobre la descomposición de las tierras; con observaciones sobre los metales obtenidos a partir de las tierras alcalinas y sobre la amalgama obtenida a partir del amoníaco". Philosophical Transactions of the Royal Society of London . 98 : 333–370. Bibcode :1808RSPT...98..333D. doi :10.1098/rstl.1808.0023. S2CID 96364168.
p. 343: Cuando se calentó potasio en gas de ácido muriático [es decir, cloruro de hidrógeno gaseoso], tan seco como se podía obtener por medios químicos comunes, se produjo una acción química violenta con ignición; y cuando el potasio estuvo en cantidad suficiente, el gas de ácido muriático desapareció por completo, y se desprendió de un tercio a un cuarto de su volumen de hidrógeno, y se formó muriato de potasa [es decir, cloruro de potasio]. (La reacción fue: 2HCl + 2K → 2KCl + H
2
)
- ^ Cramer, Chris . Cañón de cloruro de hidrógeno.
- ^ Francisco J. Arnsliz (1995). "Una forma conveniente de generar cloruro de hidrógeno en el laboratorio de primer año". J. Chem. Educ. 72 (12): 1139. Bibcode :1995JChEd..72.1139A. doi :10.1021/ed072p1139. Archivado desde el original el 24 de septiembre de 2009 . Consultado el 6 de mayo de 2009 .
- ^ Simmler, Walter (2000). "Compuestos de silicio inorgánicos". Ullmann's Encyclopedia of Industrial Chemistry . doi :10.1002/14356007.a24_001. ISBN 978-3-527-30385-4.
- ^ Kraus, Paul (1942-1943). Jâbir ibn Hayyân: Contribución a la historia de las ideas científicas en el Islam. I. Le corpus des écrits jâbiriens. II. Jâbir et la science grecque . El Cairo: Institut Français d'Archéologie Orientale . ISBN 9783487091150.OCLC 468740510 .vol. II, págs. 41–42; Multhauf, Robert P. (1966). Los orígenes de la química . Londres: Oldbourne.págs. 141-142.
- ^ Stapleton, Henry E .; Azo, RF; Hidayat Husain, M. (1927). "Química en Irak y Persia en el siglo X d. C." Memorias de la Sociedad Asiática de Bengala . VIII (6): 317–418. OCLC 706947607.p. 333. La receta pertinente dice lo siguiente: "Tome partes iguales de sal dulce, sal amarga, sal de Ṭabarzad , sal de Andarānī , sal india, sal de Al-Qilī y sal de orina. Después de agregar un peso igual de sal amoniacal bien cristalizada, disuelva con humedad y destile (la mezcla). Se destilará sobre un agua fuerte, que partirá la piedra ( sakhr ) instantáneamente". (p. 333) Para un glosario de los términos utilizados en esta receta, consulte la p. 322. Traducción alemana del mismo pasaje en Ruska, Julius (1937). Buch Geheimnis der Geheimnisse de Al-Rāzī. Mit Einleitung und Erläuterungen in deutscher Übersetzung . Quellen und Studien zur Geschichte der Naturwissenschaften und der Medizin. vol. VI. Berlín: Springer.p. 182, §5. Se puede encontrar una traducción al inglés de la traducción de Ruska 1937 en Taylor, Gail Marlow (2015). La alquimia de Al-Razi: una traducción del "Libro de los secretos" . CreateSpace Independent Publishing Platform. ISBN 9781507778791.págs. 139–140.
- ^ Multhauf 1966, pág. 142, nota 79.
- ^ Multhauf 1966, págs. 160-163.
- ^ Karpenko, Vladimír; Norris, John A. (2002). "Vitriolo en la Historia de la Química". Lista química . 96 (12): 997–1005.pág. 1002.
- ^ Multhauf 1966, pág. 208, nota 29; cf. pág. 142, nota 79.
- ^ Hartley, Harold (1960). "La conferencia Wilkins. Sir Humphry Davy, Bt., PRS 1778–1829". Actas de la Royal Society A . 255 (1281): 153–180. Código Bibliográfico :1960RSPSA.255..153H. doi :10.1098/rspa.1960.0060. S2CID 176370921.
- ^ Contaminantes, Comité del Consejo Nacional de Investigación (EE. UU.) sobre niveles de orientación de exposición continua y de emergencia para determinados contaminantes submarinos (2009), "Cloruro de hidrógeno", Niveles de orientación de exposición continua y de emergencia para determinados contaminantes submarinos: Volumen 3 , National Academies Press (EE. UU.) , consultado el 23 de abril de 2024
- ^ CDC – Guía de bolsillo de NIOSH sobre peligros químicos
- ^ "Cloruro de hidrógeno". Tema de salud y seguridad en el trabajo de los CDC y NIOSH . 5 de marzo de 2012. Consultado el 15 de julio de 2016 .
Enlaces externos
- Ficha internacional de seguridad química 0163
- Manual de experimentos de Thames & Kosmos Chem C2000