Paladio
El paladio es un elemento químico de símbolo Pd y número atómico 46. Es un metal blanco plateado brillante y raro descubierto en 1802 por el químico inglés William Hyde Wollaston . Lo bautizó en honor al asteroide Palas (formalmente 2 Palas), que a su vez recibió su nombre del epíteto de la diosa griega Atenea , que adquirió cuando mató a Palas . El paladio, el platino , el rodio , el rutenio , el iridio y el osmio forman un grupo de elementos denominados metales del grupo del platino (PGM). Tienen propiedades químicas similares, pero el paladio tiene el punto de fusión más bajo y es el menos denso de ellos.
Más de la mitad del suministro de paladio y su congénere platino se utiliza en convertidores catalíticos , que convierten hasta el 90% de los gases nocivos de los escapes de los automóviles ( hidrocarburos , monóxido de carbono y dióxido de nitrógeno ) en sustancias no tóxicas ( nitrógeno , dióxido de carbono y vapor de agua ). El paladio también se utiliza en electrónica, odontología , medicina , purificación de hidrógeno , aplicaciones químicas, tratamiento de aguas subterráneas y joyería. El paladio es un componente clave de las pilas de combustible , en las que el hidrógeno y el oxígeno reaccionan para producir electricidad, calor y agua.
Los yacimientos de paladio y otros metales del grupo del platino son escasos. Los yacimientos más extensos se han encontrado en el cinturón de norita del complejo ígneo Bushveld, que abarca la cuenca de Transvaal en Sudáfrica; el complejo Stillwater en Montana , Estados Unidos; la cuenca de Sudbury y el distrito de Thunder Bay en Ontario , Canadá; y el complejo Norilsk en Rusia. El reciclaje también es una fuente, principalmente a partir de convertidores catalíticos desechados. Las numerosas aplicaciones y las fuentes de suministro limitadas dan lugar a un considerable interés inversor .
Características
El paladio pertenece al grupo 10 de la tabla periódica, pero la configuración de los electrones más externos está de acuerdo con la regla de Hund . Los electrones que según la regla de Madelung se esperaría que ocuparan los orbitales 5 s en lugar de los 4 d , ya que es energéticamente más favorable tener una capa 4d 10 completamente llena en lugar de la configuración 5s 2 4d 8. [ aclaración necesaria ]
| O | Elemento | Número de electrones por capa |
|---|---|---|
| 28 | níquel | 2, 8, 16, 2 (o 2, 8, 17, 1) |
| 46 | paladio | 2, 8, 18, 18, 0 |
| 78 | platino | 2, 8, 18, 32, 17, 1 |
| 110 | darmstadtio | 2, 8, 18, 32, 32, 16, 2 (previsto) |
Esta configuración 5s 0 , única en el período 5 , hace que el paladio sea el elemento más pesado que tiene solo una capa electrónica incompleta , con todas las capas superiores vacías.
El paladio tiene la apariencia de un metal blando de color blanco plateado que se parece al platino. Es el menos denso y tiene el punto de fusión más bajo de los metales del grupo del platino. Es blando y dúctil cuando se recoce y aumenta considerablemente su resistencia y dureza cuando se trabaja en frío. El paladio se disuelve lentamente en ácido nítrico concentrado , en ácido sulfúrico concentrado caliente y, cuando se muele finamente, en ácido clorhídrico . [8] Se disuelve fácilmente a temperatura ambiente en agua regia .
El paladio no reacciona con el oxígeno a temperatura estándar (y por lo tanto no se empaña en contacto con el aire ). El paladio calentado a 800 °C producirá una capa de óxido de paladio (II) (PdO). Con el tiempo, puede desarrollar lentamente una ligera coloración amarronada, probablemente debido a la formación de una capa superficial de su monóxido.
Las películas de paladio con defectos producidos por el bombardeo de partículas alfa a baja temperatura exhiben superconductividad con T c = 3,2 K. [9]
Isótopos
El paladio natural se compone de siete isótopos , seis de los cuales son estables. Los radioisótopos más estables son el 107 Pd con una vida media de 6,5 millones de años (que se encuentra en la naturaleza), el 103 Pd con 17 días y el 100 Pd con 3,63 días. Se han caracterizado otros dieciocho radioisótopos con pesos atómicos que van desde 90,94948(64) u ( 91 Pd) hasta 122,93426(64) u ( 123 Pd). [10] Estos tienen vidas medias de menos de treinta minutos, excepto el 101 Pd (vida media: 8,47 horas), el 109 Pd (vida media: 13,7 horas) y el 112 Pd (vida media: 21 horas). [11]
En el caso de los isótopos con valores unitarios de masa atómica inferiores a los del isótopo estable más abundante, el 106 Pd, el modo de desintegración principal es la captura de electrones , siendo el rodio el principal producto de desintegración . El modo de desintegración principal de los isótopos de Pd con masa atómica superior a 106 es la desintegración beta , siendo la plata el principal producto de esta desintegración . [11]
El 107 Ag radiogénico es un producto de desintegración del 107 Pd y fue descubierto por primera vez en 1978 [12] en el meteorito Santa Clara [13] de 1976. Los descubridores sugieren que la coalescencia y diferenciación de los pequeños planetas con núcleo de hierro puede haber ocurrido 10 millones de años después de un evento nucleosintético . Las correlaciones 107 Pd versus Ag observadas en cuerpos que se han fundido desde la acreción del Sistema Solar deben reflejar la presencia de nucleidos de vida corta en el Sistema Solar temprano. [14] 107
El Pd también se produce como producto de fisión en la fisión espontánea o inducida de235
U. Como no es muy móvil en el medio ambiente y tiene una energía de desintegración relativamente baja ,107
El Pd suele considerarse uno de los productos de fisión de larga duración menos preocupantes .
Compuestos
Los compuestos de paladio existen principalmente en los estados de oxidación 0 y +2. También se reconocen otros estados menos comunes. En general, los compuestos de paladio son más similares a los del platino que a los de cualquier otro elemento.
- Estructura del α -PdCl 2
- Estructura del β -PdCl 2
Paladio (II)
El cloruro de paladio (II) es el principal material de partida para otros compuestos de paladio. Surge por la reacción del paladio con cloro. Se utiliza para preparar catalizadores de paladio heterogéneos como paladio sobre sulfato de bario, paladio sobre carbono y cloruro de paladio sobre carbono. [15] Las soluciones de PdCl 2 en ácido nítrico reaccionan con ácido acético para dar acetato de paladio (II) , también un reactivo versátil. El PdCl 2 reacciona con ligandos (L) para dar complejos planos cuadrados del tipo PdCl 2 L 2 . Un ejemplo de tales complejos es el derivado de benzonitrilo PdCl 2 (PhCN) 2 . [16] [17]
El complejo dicloruro de bis(trifenilfosfina)paladio(II) es un catalizador útil. [18]
2.jpg/440px-Pd(OAc)2.jpg)

_Johns-Manville_Reef,_Stillwater_Complex.jpg/440px-Sulfidic_serpentintite_(platinum-palladium_ore)_Johns-Manville_Reef,_Stillwater_Complex.jpg)
Paladio(0)
El paladio forma una serie de complejos de valencia cero con la fórmula PdL 4 , PdL 3 y PdL 2 . Por ejemplo, la reducción de una mezcla de PdCl 2 (PPh 3 ) 2 y PPh 3 da tetrakis(trifenilfosfina)paladio(0) : [19]
Otro complejo importante de paladio(0), el tris(dibencilidenoacetona)dipaladio(0) (Pd 2 (dba) 3 ), se prepara reduciendo el tetracloropaladato de sodio en presencia de dibencilidenoacetona . [20]
El paladio(0), así como el paladio(II), son catalizadores en reacciones de acoplamiento , como ha sido reconocido por el Premio Nobel de Química 2010 a Richard F. Heck , Ei-ichi Negishi y Akira Suzuki . Tales reacciones se practican ampliamente para la síntesis de productos químicos finos. Las reacciones de acoplamiento prominentes incluyen el acoplamiento de Heck , Suzuki , Sonogashira , las reacciones de Stille y el acoplamiento de Kumada . El acetato de paladio(II) , el tetrakis(trifenilfosfina)paladio(0) (Pd(PPh3 ) 4 ) y el tris(dibencilidenoacetona)dipaladio(0) (Pd2 ( dba) 3 ) sirven como catalizadores o precatalizadores. [21]
Otros estados de oxidación
Aunque los compuestos de Pd(IV) son comparativamente raros, un ejemplo es el hexacloropaladato de sodio(IV), Na2 [ PdCl6 ] . También se conocen algunos compuestos de paladio(III) . [22] En 2002 se afirmó que el paladio(VI) era un compuesto químico, [23] [24] pero posteriormente se desmintió. [25] [26]
Existen complejos de paladio con valencia mixta, por ejemplo, Pd 4 (CO) 4 (OAc) 4 Pd(acac) 2 forma una estructura de cadena de Pd infinita, con unidades Pd 4 (CO) 4 (OAc) 4 y Pd(acac) 2 interconectadas alternativamente . [27]
Cuando se alea con un elemento más electropositivo , el paladio puede adquirir una carga negativa. Dichos compuestos se conocen como paladuros, como el paladuro de galio . [28] Existen paladuros con la estequiometría RPd 3 donde R es escandio , itrio o cualquiera de los lantánidos . [29]
Aparición
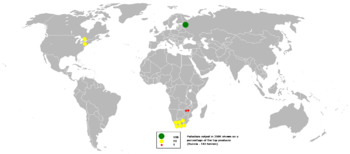
Como la producción minera total de paladio alcanzó los 210.000 kilogramos en 2022, Rusia fue el principal productor con 88.000 kilogramos, seguido de Sudáfrica, Canadá, Estados Unidos y Zimbabue. [30] La empresa rusa Norilsk Nickel ocupa el primer lugar entre los mayores productores de paladio a nivel mundial, representando el 39% de la producción mundial. [31]
El paladio se puede encontrar como un metal libre aleado con oro y otros metales del grupo del platino en depósitos de placer de los Montes Urales , Australia , Etiopía , América del Norte y del Sur . Para la producción de paladio, estos depósitos juegan solo un papel menor. Las fuentes comerciales más importantes son los depósitos de níquel y cobre que se encuentran en la cuenca de Sudbury , Ontario , y los depósitos de Norilsk-Talnakh en Siberia . El otro gran depósito es el depósito de metales del grupo del platino de Merensky Reef dentro del complejo ígneo Bushveld de Sudáfrica . El complejo ígneo Stillwater de Montana y el cuerpo mineral de la zona Roby del complejo ígneo Lac des Îles de Ontario son las otras dos fuentes de paladio en Canadá y los Estados Unidos. [32] [33] El paladio se encuentra en los minerales raros cooperita [34] y polarita . [35] Se conocen muchos más minerales de Pd, pero todos ellos son muy raros. [36]
El paladio también se produce en reactores de fisión nuclear y se puede extraer del combustible nuclear gastado (véase síntesis de metales preciosos ), aunque esta fuente de paladio no se utiliza. Ninguna de las instalaciones de reprocesamiento nuclear existentes está equipada para extraer paladio de los residuos de alta radiactividad . [37] Una complicación para la recuperación de paladio en el combustible gastado es la presencia de107
Pd , un producto de fisión de larga duración y ligeramente radiactivo . Según el uso final, la radiactividad aportada por el107
El Pd podría hacer que el paladio recuperado sea inutilizable sin un costoso paso de separación de isótopos .
Aplicaciones


El paladio se utiliza principalmente en convertidores catalíticos. [38] El paladio también se utiliza en joyería, odontología , [38] [39] relojería , tiras reactivas de azúcar en sangre, bujías de encendido para aviones , instrumentos quirúrgicos y contactos eléctricos . [40] El paladio también se utiliza para fabricar algunas flautas transversales profesionales (de concierto o clásicas) . [41] Como producto básico, el paladio en lingotes tiene códigos monetarios ISO de XPD y 964. El paladio es uno de los cuatro únicos metales que tienen dichos códigos, los otros son el oro , la plata y el platino. [42] Debido a que adsorbe hidrógeno, el paladio fue un componente clave de los controvertidos experimentos de fusión fría de finales de los años 1980. [43]
Catálisis
Cuando se divide finamente, como ocurre con el paladio sobre carbono , el paladio forma un catalizador versátil ; acelera procesos catalíticos heterogéneos como la hidrogenación , la deshidrogenación y el craqueo de petróleo . El paladio también es esencial para el catalizador de Lindlar , también llamado paladio de Lindlar. [44] Una gran cantidad de reacciones de enlace carbono-carbono en la química orgánica se ven facilitadas por los catalizadores de compuestos de paladio. Por ejemplo:
- Reacción al demonio
- Acoplamiento Suzuki
- Reacciones de Tsuji-Trost
- Proceso Wacker
- Reacción de Negishi
- Acoplamiento Stille
- Acoplamiento Sonogashira
Cuando se dispersa en materiales conductores, el paladio es un excelente electrocatalizador para la oxidación de alcoholes primarios en medios alcalinos. [45] El paladio también es un metal versátil para catálisis homogénea , utilizado en combinación con una amplia variedad de ligandos para transformaciones químicas altamente selectivas.
En 2010, el Premio Nobel de Química fue otorgado "por los acoplamientos cruzados catalizados por paladio en la síntesis orgánica" a Richard F. Heck , Ei-ichi Negishi y Akira Suzuki . Un estudio de 2008 demostró que el paladio es un catalizador eficaz para los enlaces carbono-flúor . [46]
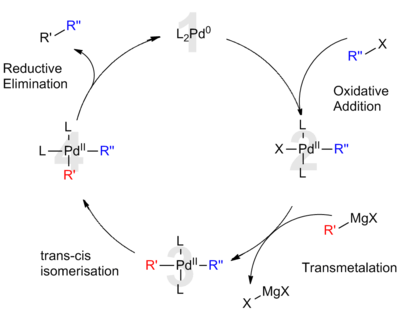
La catálisis de paladio se emplea principalmente en química orgánica y aplicaciones industriales, aunque su uso está creciendo como herramienta para la biología sintética ; en 2017, se demostró una actividad catalítica in vivo eficaz de las nanopartículas de paladio en mamíferos para tratar enfermedades. [47]
Electrónica
La principal aplicación del paladio en electrónica es en los condensadores cerámicos multicapa [48] en los que se utiliza paladio (y una aleación de paladio y plata) para los electrodos. [38] El paladio (a veces aleado con níquel) se utiliza o puede utilizarse para el recubrimiento de componentes y conectores en la electrónica de consumo [49] [50] y en materiales de soldadura. El sector electrónico consumió 33 toneladas (1,07 millones de onzas troy) de paladio en 2006, según un informe de Johnson Matthey . [51]
Tecnología
El hidrógeno se difunde fácilmente a través del paladio calentado [8] y se utilizan reactores de membrana con membranas de Pd en la producción de hidrógeno de alta pureza [52] . El paladio se utiliza en electrodos de paladio-hidrógeno en estudios electroquímicos. El cloruro de paladio (II) cataliza fácilmente el gas de monóxido de carbono a dióxido de carbono y es útil en detectores de monóxido de carbono [53] .
Almacenamiento de hidrógeno
El paladio adsorbe fácilmente hidrógeno a temperatura ambiente, formando hidruro de paladio PdH x con x menor que 1. [54] Si bien esta propiedad es común a muchos metales de transición, el paladio tiene una capacidad de absorción excepcionalmente alta y no pierde su ductilidad hasta que x se acerca a 1. [55] Esta propiedad se ha investigado para diseñar un medio de almacenamiento de combustible de hidrógeno eficiente y seguro, aunque el paladio en sí mismo es actualmente prohibitivamente caro para este propósito. [56] El contenido de hidrógeno en el paladio se puede vincular a la susceptibilidad magnética , que disminuye con el aumento de hidrógeno y se vuelve cero para PdH 0,62 . En cualquier proporción mayor, la solución sólida se vuelve diamagnética . [57]
El paladio se utiliza para la purificación de hidrógeno en un laboratorio [58] : 183–217 pero no a escala industrial. [59]
Odontología
El paladio se utiliza en pequeñas cantidades (alrededor del 0,5 %) en algunas aleaciones de amalgama dental para disminuir la corrosión y aumentar el brillo metálico de la restauración final. [60] [61]
Joyas
El paladio se ha utilizado como metal precioso en joyería desde 1939 como alternativa al platino en las aleaciones llamadas " oro blanco ", donde el color blanco natural del paladio no requiere un baño de rodio . El paladio, al ser mucho menos denso que el platino, es similar al oro en que se puede batir en láminas tan delgadas como 100 nm ( 1 ⁄ 250,000 in). [8] A diferencia del platino, el paladio puede decolorarse a temperaturas superiores a 400 °C (752 °F) [62] debido a la oxidación, lo que lo hace más frágil y, por lo tanto, menos adecuado para su uso en joyería; para evitar esto, el paladio destinado a la joyería se calienta en condiciones controladas. [63]
Antes de 2004, el principal uso del paladio en joyería era la fabricación de oro blanco. El paladio es uno de los tres metales de aleación más populares en el oro blanco ( también se pueden utilizar níquel y plata). [38] La combinación de paladio y oro es más cara que la de níquel y oro, pero rara vez provoca reacciones alérgicas (aunque pueden producirse ciertas alergias cruzadas con el níquel). [64]
Cuando el platino se convirtió en un recurso estratégico durante la Segunda Guerra Mundial, muchas bandas de joyería se hicieron de paladio. El paladio se usó poco en joyería debido a la dificultad técnica de la fundición . Con el problema de la fundición resuelto [65], el uso de paladio en joyería aumentó, originalmente porque el platino aumentó de precio mientras que el precio del paladio disminuyó. [66] A principios de 2004, cuando los precios del oro y el platino aumentaron abruptamente, China comenzó a fabricar volúmenes de joyería de paladio, consumiendo 37 toneladas en 2005. Los cambios posteriores en el precio relativo del platino redujeron la demanda de paladio a 17,4 toneladas en 2009. [67] [68] La demanda de paladio como catalizador ha aumentado el precio del paladio a aproximadamente un 50% más alto que el del platino en enero de 2019. [69]
En enero de 2010, las oficinas de análisis del Reino Unido introdujeron el sello distintivo para el paladio, y este se volvió obligatorio para todas las joyas que publicitaran paladio puro o aleado. Los artículos pueden marcarse como 500, 950 o 999 partes de paladio por mil de la aleación.
Las puntas de las estilográficas hechas de oro a veces se bañan con paladio cuando se desea una apariencia plateada (en lugar de dorada). Sheaffer ha utilizado el baño de paladio durante décadas, ya sea como un detalle en las puntas que de otro modo serían de oro o cubriendo el oro por completo.
El paladio también es utilizado por la marca de lujo Hermès como uno de los metales que recubren los herrajes de sus bolsos, siendo el más famoso de ellos el Birkin.
Fotografía
En el proceso de impresión con platinotipia , los fotógrafos realizan impresiones artísticas en blanco y negro utilizando sales de platino o paladio. El paladio, que suele utilizarse con el platino, ofrece una alternativa a la plata. [70]
Efectos sobre la salud
Toxicidad
| Peligros | |
|---|---|
| Etiquetado SGA : | |
 | |
| Advertencia | |
| H317 | |
| P261 , P273 , P280 , P302+P352 , P321 , P333+P313 , P363 , P501 [71] | |
| NFPA 704 (rombo cortafuegos) | |
El paladio es un metal con baja toxicidad según las mediciones convencionales (p. ej., LD 50 ). Investigaciones recientes sobre el mecanismo de toxicidad del paladio sugieren una alta toxicidad si se mide en un período de tiempo más largo y a nivel celular en el hígado y el riñón. [72] Las mitocondrias parecen tener un papel clave en la toxicidad del paladio a través del colapso del potencial de membrana mitocondrial y el agotamiento del nivel de glutatión (GSH) celular. Hasta ese trabajo reciente, se había pensado que el paladio era mal absorbido por el cuerpo humano cuando se ingería . Las plantas como el jacinto de agua mueren con niveles bajos de sales de paladio, pero la mayoría de las otras plantas lo toleran, aunque las pruebas muestran que, a niveles superiores al 0,0003%, el crecimiento se ve afectado. Las dosis altas de paladio podrían ser venenosas; las pruebas en roedores sugieren que puede ser cancerígeno , aunque hasta la reciente investigación citada anteriormente, ninguna evidencia clara indicaba que el elemento dañara a los humanos. [73]
Precauciones
Al igual que otros metales del grupo del platino , el Pd a granel es bastante inerte. Aunque se han descrito casos de dermatitis de contacto , los datos sobre los efectos son limitados. Se ha demostrado que las personas alérgicas al paladio también reaccionan al níquel, por lo que es recomendable evitar el uso de aleaciones dentales que contengan paladio en aquellas personas alérgicas. [74] [75] [76] [77] [78]
Los gases de escape de los automóviles con convertidores catalíticos emiten una cantidad de paladio que oscila entre 4 y 108 ng/km de partículas de paladio, mientras que se calcula que la absorción total a través de los alimentos es inferior a 2 μg por persona al día. La segunda fuente posible de paladio es la restauración dental, cuya absorción se calcula que es inferior a 15 μg por persona al día. Las personas que trabajan con paladio o sus compuestos podrían tener una absorción considerablemente mayor. En el caso de los compuestos solubles, como el cloruro de paladio , el 99 % se elimina del cuerpo en tres días. [74]
La dosis letal media ( DL50 ) de compuestos solubles de paladio en ratones es de 200 mg/kg para administración oral y de 5 mg/kg para administración intravenosa . [74]
Historia


William Hyde Wollaston anotó el descubrimiento de un nuevo metal noble en julio de 1802 en su libro de laboratorio y lo nombró paladio en agosto del mismo año. Nombró al elemento en honor al asteroide 2 Pallas , que había sido descubierto dos meses antes (y que anteriormente se consideraba un planeta ). [8] Wollaston purificó una cantidad del material y lo ofreció, sin nombrar al descubridor, en una pequeña tienda en Soho en abril de 1803. Después de las duras críticas de Richard Chenevix , quien afirmó que el paladio era una aleación de platino y mercurio, Wollaston ofreció anónimamente una recompensa de £ 20 por 20 granos de aleación sintética de paladio . [79] Chenevix recibió la Medalla Copley en 1803 después de publicar sus experimentos con el paladio. Wollaston publicó el descubrimiento del rodio en 1804 y menciona algunos de sus trabajos sobre el paladio. [80] [81] Reveló que fue el descubridor del paladio en una publicación en 1805. [79] [82]
Wollaston encontró paladio en mineral de platino crudo de América del Sur disolviendo el mineral en agua regia , neutralizando la solución con hidróxido de sodio y precipitando platino como cloroplatinato de amonio con cloruro de amonio . Añadió cianuro de mercurio para formar el compuesto cianuro de paladio (II) , que se calentó para extraer el metal paladio. [80]
En un tiempo, el cloruro de paladio se prescribía como tratamiento contra la tuberculosis a razón de 0,065 g por día (aproximadamente un miligramo por kilogramo de peso corporal). Este tratamiento tenía muchos efectos secundarios negativos y más tarde fue reemplazado por medicamentos más eficaces. [83]
La mayor parte del paladio se utiliza para los convertidores catalíticos de la industria del automóvil. [74] Los convertidores catalíticos son objetivos para los ladrones porque contienen paladio y otros metales raros. En el período previo al año 2000, el suministro ruso de paladio al mercado mundial se retrasó e interrumpió repetidamente; por razones políticas, la cuota de exportación no se concedió a tiempo. [84] El pánico del mercado resultante llevó el precio a un máximo histórico de $ 1.340 por onza troy ($ 43 / g ) en enero de 2001. [85] En esa época, la Ford Motor Company , temiendo que la producción de automóviles se viera interrumpida por una escasez de paladio, almacenó el metal. Cuando los precios cayeron a principios de 2001, Ford perdió casi US $ 1 mil millones. [86]
La demanda mundial de paladio aumentó de 100 toneladas en 1990 a casi 300 toneladas en 2000. La producción mundial de paladio de las minas fue de 222 toneladas en 2006 según el Servicio Geológico de los Estados Unidos . [32] Muchos estaban preocupados por un suministro constante de paladio a raíz de la anexión de Crimea por parte de Rusia , en parte porque las sanciones podrían obstaculizar las exportaciones rusas de paladio; cualquier restricción a las exportaciones rusas de paladio podría haber exacerbado lo que ya se esperaba que fuera un gran déficit de paladio en 2014. [87] Esas preocupaciones empujaron los precios del paladio a su nivel más alto desde 2001. [88] En septiembre de 2014 se dispararon por encima de la marca de $ 900 por onza. Sin embargo, en 2016 el paladio costó alrededor de $ 614 por onza, ya que Rusia logró mantener suministros estables. [89] En enero de 2019, los futuros del paladio superaron los 1.344 dólares la onza por primera vez desde que se tiene registro, debido principalmente a la fuerte demanda de la industria automotriz. [90] El paladio alcanzó los 2.024,64 dólares la onza troy (65,094 dólares/g) el 6 de enero de 2020, superando por primera vez los 2.000 dólares la onza troy. [91] El precio subió por encima de los 3.000 dólares la onza troy en mayo de 2021 y marzo de 2022. [92]
El paladio como inversión

Las ventas mundiales de paladio fueron de 8,84 millones de onzas troy (275 t) en 2017, [93] de las cuales el 86% se utilizó en la fabricación de convertidores catalíticos para automóviles, seguido de usos industriales, de joyería y de inversión. [94] Más del 75% del platino mundial y el 40% del paladio se extraen en Sudáfrica . La empresa minera rusa, Norilsk Nickel , produce otro 44% de paladio, y las minas con sede en EE. UU. y Canadá producen la mayor parte del resto.
El precio del paladio alcanzó un máximo histórico de 2.981,40 dólares la onza el 3 de mayo de 2021, [95] [96] impulsado principalmente por la especulación sobre la demanda de convertidores catalíticos de la industria automotriz . El paladio se comercializa en el mercado al contado con el código "XPD". Cuando se liquida en dólares estadounidenses, el código es "XPDUSD". Un excedente posterior del metal fue causado por la venta por parte del gobierno ruso de reservas de la era soviética , a un ritmo de aproximadamente 1,6 a 2 millones de onzas troy (50 a 62 t) al año. La cantidad y el estado de estas reservas son un secreto de estado .
Durante la guerra ruso-ucraniana de marzo de 2022, los precios del paladio aumentaron un 13% desde el 1 de marzo. Rusia es el principal proveedor de Europa y el país suministra el 37% de la producción mundial. [97]
Productores de paladio
Productos negociados en bolsa
WisdomTree Physical Palladium ( LSE : PHPD) está respaldado por lingotes de paladio asignados y fue el primer ETF de paladio del mundo . Cotiza en la Bolsa de Valores de Londres como PHPD, [98] Xetra Trading System , Euronext y Milan . ETFS Physical Palladium Shares ( NYSE : PALL) es un ETF que cotiza en la Bolsa de Valores de Nueva York .
Monedas y lingotes de oro
Una forma tradicional de invertir en paladio es comprar monedas y lingotes de paladio. Entre las monedas de paladio disponibles se encuentran la hoja de arce de paladio canadiense , el panda chino y el águila de paladio estadounidense . La liquidez de la inversión directa en lingotes de paladio es menor que la del oro y la plata porque hay poca circulación de monedas de paladio. [99]
Véase también
- El auge de las materias primas en la década de 2000
- Auge de las materias primas en la década de 2020
- Plata en lingotes
- Moneda de lingotes
- Cobertura contra la inflación
- Pseudopaladio
- Materiales raros como inversión :
Referencias
- ^ "Pesos atómicos estándar: paladio". CIAAW . 1979.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip JH; Gröning, Manfred; Holden, Norman E.; Meijer, Harro AJ (4 de mayo de 2022). "Pesos atómicos estándar de los elementos 2021 (Informe técnico de la IUPAC)". Química pura y aplicada . doi :10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ abc Arblaster, John W. (2018). Valores seleccionados de las propiedades cristalográficas de los elementos . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ Se ha identificado paladio(V) en complejos con compuestos de organosilicio que contienen paladio pentacoordinado; véase Shimada, Shigeru; Li, Yong-Hua; Choe, Yoong-Kee; Tanaka, Masato; Bao, Ming; Uchimaru, Tadafumi (2007). "Compuestos multinucleares de paladio que contienen centros de paladio ligados por cinco átomos de silicio". Actas de la Academia Nacional de Ciencias . 104 (19): 7758–7763. doi : 10.1073/pnas.0700450104 . PMC 1876520 . PMID 17470819.
- ^ Lide, DR, ed. (2005). "Susceptibilidad magnética de los elementos y compuestos inorgánicos". Manual de química y física del CRC (PDF) (86.ª ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Manual de química y física . Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN. 0-8493-0464-4.
- ^ Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). "La evaluación NUBASE2020 de las propiedades nucleares" (PDF) . Chinese Physics C . 45 (3): 030001. doi :10.1088/1674-1137/abddae.
- ^ abcd Hammond, CR (2004). "Los elementos" . Manual de química y física (81.ª edición). CRC press. ISBN 978-0-8493-0485-9.
- ^ B. Strizker, Phys. Rev. Lett., 42, 1769 (1979).
- ^ "Pesos atómicos y composiciones isotópicas del paladio (NIST)". NIST . 23 de agosto de 2009 . Consultado el 12 de noviembre de 2009 .
- ^ ab Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "La evaluación NUBASE de las propiedades nucleares y de desintegración", Nuclear Physics A , 729 : 3–128, Bibcode :2003NuPhA.729....3A, doi :10.1016/j.nuclphysa.2003.11. 001
- ^ Kelly, WR; Gounelle, GJ; Hutchison, R. (1978). "Evidencia de la existencia de 107 Pd en el sistema solar primitivo". Philosophical Transactions of the Royal Society of London, Serie A . 359 (1787): 1079–1082. Bibcode :2001RSPTA.359.1991R. doi :10.1098/rsta.2001.0893. S2CID 120355895.
- ^ "Meteoritos de México" (PDF) . mexicogemstones.com . Archivado desde el original (PDF) el 6 de mayo de 2006.
- ^ Chen, JH; Wasserburg, GJ (1990). "La composición isotópica de Ag en meteoritos y la presencia de 107 Pd en protoplanetas". Geochimica et Cosmochimica Acta . 54 (6): 1729–1743. Código Bibliográfico :1990GeCoA..54.1729C. doi :10.1016/0016-7037(90)90404-9.
- ^ Mozingo, Ralph (1955). "Catalizadores de paladio". Síntesis orgánicas; Volúmenes recopilados , vol. 3, pág. 685.
- ^ Anderson, Gordon K.; Lin, Minren; Sen, Ayusman; Gretz, Efi (1990). "Complejos de bis(benzonitrilo)dicloro de paladio y platino". Síntesis inorgánicas . Vol. 28. págs. 60–63. doi :10.1002/9780470132593.ch13. ISBN . 978-0-470-13259-3.
- ^ Zalevskaya, O. A; Vorob'eva, E. G; Dvornikova, I. A; Kuchin, A. V (2008). "Complejos de paladio basados en derivados terpénicos ópticamente activos de etilendiamina". Revista rusa de química de coordinación . 34 (11): 855–857. doi :10.1134/S1070328408110110. S2CID 95529734.
- ^ Miyaura, Norio y Suzuki, Akira (1993). "Reacción de 1-alquenilboronatos con haluros vinílicos catalizada por paladio: (1Z,3E)-1-fenil-1,3-octadieno". Síntesis orgánicas; Volúmenes recopilados , vol. 8, pág. 532.
- ^ Coulson, DR; Satek, LC; Grim, SO (1972). "Tetrakis(trifenilfosfina)paladio(0)". Síntesis inorgánicas . Vol. 13. págs. 121–124. doi :10.1002/9780470132449.ch23. ISBN . 978-0-470-13244-9.
{{cite book}}:|journal=ignorado ( ayuda ) - ^ Takahashi, Y; Ito, Ts; Sakai, S; Ishii, Y (1970). "Un nuevo complejo de paladio(0); bis(dibencilidenoacetona)paladio(0)". Journal of the Chemical Society D: Chemical Communications (17): 1065. doi :10.1039/C29700001065.
- ^ Crabtree, Robert H. (2009). "Aplicación a la síntesis orgánica". Química organometálica de los metales de transición . John Wiley and Sons. pág. 392. ISBN 978-0-470-25762-3.
- ^ Powers, David C; Ritter, Tobias (2011). "Paladio(III) en síntesis y catálisis". Química del platino y el organopaladio en estados de oxidación superiores . Temas de química organometálica. Vol. 35. págs. 129–156. doi :10.1007/978-3-642-17429-2_6. ISBN 978-3-642-17428-5. PMC 3066514 . PMID 21461129.
- ^ Chen, W; Shimada, S; Tanaka, M (2002). "Síntesis y estructura de complejos de paladio formalmente hexavalentes". Science . 295 (5553): 308–310. Bibcode :2002Sci...295..308C. doi :10.1126/science.1067027. PMID 11786638. S2CID 45249108.
- ^ Crabtree, R. H (2002). "QUÍMICA: ¿Un nuevo estado de oxidación para el Pd?". Science . 295 (5553): 288–289. doi :10.1126/science.1067921. PMID 11786632. S2CID 94579227.
- ^ Aullón, G; Lledós, A; Alvarez, S (2002). "Hexakis(silil)paladio(VI) o paladio(II con ligandos eta2-disilano?". Angewandte Chemie International Edition en inglés . 41 (11): 1956–9. doi :10.1002/1521-3773(20020603)41:11<1956::AID-ANIE1956>3.0.CO;2-#. PMID 19750645.
- ^ Sherer, E. C; Kinsinger, C. R; Kormos, B. L; Thompson, J. D; Cramer, C. J (2002). "Estructura electrónica y enlace en complejos de sililo-paladio hexacoordinados". Angewandte Chemie International Edition en inglés . 41 (11): 1953–6. doi :10.1002/1521-3773(20020603)41:11<1953::AID-ANIE1953>3.0.CO;2-H. PMID 19750644.
- ^ Yin, Xi; Warren, Steven A; Pan, Yung-Tin; Tsao, Kai-Chieh; Gray, Danielle L; Bertke, Jeffery; Yang, Hong (2014). "Un motivo para cables de átomos metálicos infinitos". Angewandte Chemie International Edition . 53 (51): 14087–14091. doi :10.1002/anie.201408461. PMID 25319757.
- ^ Armbrüster, Marc (31 de enero de 2020). "Compuestos intermetálicos en catálisis: una clase versátil de materiales que se enfrenta a desafíos interesantes". Ciencia y tecnología de materiales avanzados . 21 (1). Informa UK Limited: 303–322. Bibcode :2020STAdM..21..303A. doi :10.1080/14686996.2020.1758544. ISSN 1468-6996. PMC 7889166 . PMID 33628119.
- ^ Wang, Qiaoming; Collins, Gary S. (2013). "Interacciones cuadrupolo nucleares de átomos de soluto 111In/Cd en una serie de aleaciones de paladio de tierras raras". Interacciones hiperfinas . 221 (1–3): 85–98. arXiv : 1209.3822 . Código Bibliográfico :2013HyInt.221...85W. doi :10.1007/s10751-012-0686-4. ISSN 0304-3843. S2CID 98580013.
- ^ Servicio Geológico de Estados Unidos (2023). Resúmenes de productos minerales 2023 (Informe). pág. 210. doi : 10.3133/mcs2023 .
- ^ "El grupo "Norilsk Nickel" anuncia los resultados preliminares consolidados de producción del cuarto trimestre y de todo el año 2016, y las cifras de producción". Nornickel . Archivado desde el original el 29 de junio de 2018 . Consultado el 29 de enero de 2018 .
- ^ ab "Metales del grupo del platino" (PDF) . Resúmenes de productos minerales . Servicio Geológico de los Estados Unidos . Enero de 2007.
- ^ "Metales del grupo del platino" (PDF) . Anuario de minerales 2007. Servicio Geológico de los Estados Unidos . Enero de 2007.
- ^ Verryn, Sabine MC; Merkle, Roland KW (1994). "Variación composicional de cooperita, braggita y vysotskita del complejo Bushveld". Revista mineralógica . 58 (2): 223–234. Bibcode :1994MinM...58..223V. CiteSeerX 10.1.1.610.640 . doi :10.1180/minmag.1994.058.391.05. S2CID 53128786.
- ^ Genkin, AD; Evstigneeva, TL (1986). "Asociaciones de minerales del grupo del platino de los minerales de sulfuro de cobre y níquel de Norilsk". Economic Geology . 81 (5): 1203–1212. Bibcode :1986EcGeo..81.1203G. doi :10.2113/gsecongeo.81.5.1203.
- ^ "Mindat.org - Minas, minerales y más". www.mindat.org .
- ^ Kolarik, Zdenek; Renard, Edouard V. (2003). "Recuperación de platinoides de fisión valiosos a partir de combustible nuclear gastado. Parte I PARTE I: Consideraciones generales y química básica" (PDF) . Platinum Metals Review . 47 (2): 74–87. doi :10.1595/003214003X4727487.
- ^ abcd «Palladium». Conferencia de las Naciones Unidas sobre Comercio y Desarrollo . Archivado desde el original el 6 de diciembre de 2006. Consultado el 5 de febrero de 2007 .
- ^ Rushforth, Roy (2004). "Paladio en odontología restauradora: sus propiedades físicas superiores hacen del paladio un metal dental ideal". Platinum Metals Review . 48 (1). doi : 10.1595/003214004X4813031 .
- ^ Hesse, Rayner W. (2007). "Paladio". La fabricación de joyas a través de la historia: una enciclopedia . Greenwood Publishing Group. pág. 146. ISBN 978-0-313-33507-5.
- ^ Toff, Nancy (1996). El libro de la flauta: una guía completa para estudiantes e intérpretes. Oxford University Press. pág. 20. ISBN 978-0-19-510502-5.
- ^ Weithers, Timothy Martin (2006). "Metales preciosos". Divisas: una guía práctica para los mercados de divisas . Wiley. pág. 34. ISBN 978-0-471-73203-7.
- ^ Fleischmann, M ; Pons S; Hawkins M (1989). "Fusión nuclear de deuterio inducida electroquímicamente". J. Electroanal. Chem. 261 (2): 301. doi :10.1016/0022-0728(89)80006-3.
- ^ Brown, William Henry; Foote, Christopher S ; Iverson, Brent L (2009). "Reducción catalítica". Química orgánica . Cengage Learning . pág. 270. ISBN 978-0-495-38857-9.
- ^ Tsuji, Jiro (2004). Reactivos y catalizadores de paladio: nuevas perspectivas para el siglo XXI. John Wiley and Sons. pág. 90. ISBN 978-0-470-85032-9.
- ^ Drahl, Carmen (2008). "El talento oculto del paladio". Chemical & Engineering News . 86 (35): 53–56. doi :10.1021/cen-v086n035.p053.
- ^ Miller, Miles A; Askevold, Bjorn; Mikula, Hannes; Kohler, Rainer H; Pirovich, David; Weissleder, Ralph (2017). "El nanopaladio es un catalizador celular para la química in vivo". Nature Communications . 8 : 15906. Bibcode :2017NatCo...815906M. doi :10.1038/ncomms15906. PMC 5510178 . PMID 28699627.
- ^ Zogbi, Dennis (3 de febrero de 2003). "Cambios en la oferta y la demanda de paladio en los MLCC". TTI, Inc.
- ^ Mroczkowski, Robert S. (1998). Manual de conectores electrónicos: teoría y aplicaciones. McGraw-Hill Professional. pp. 3–. ISBN 978-0-07-041401-3.
- ^ Harper, Charles A. (1997). Manual de componentes electrónicos pasivos. McGraw-Hill Professional. pp. 580–. ISBN 978-0-07-026698-8.
- ^ Jollie, David (2007). «Platinum 2007» (PDF) . Johnson Matthey . Archivado desde el original (PDF) el 16 de febrero de 2008.
- ^ Shu, J.; Grandjean, BPA; Neste, A. Van; Kaliaguine, S. (1991). "Reactores de membrana catalíticos basados en paladio: una revisión". Revista canadiense de ingeniería química . 69 (5): 1036. doi :10.1002/cjce.5450690503.
- ^ Allen, TH; Root, WS (1955). "Un método mejorado de cloruro de paladio para la determinación de monóxido de carbono en sangre". The Journal of Biological Chemistry . 216 (1): 319–323. doi : 10.1016/S0021-9258(19)52308-0 . PMID 13252031.
- ^ Manchester, FD; San-Martin, A.; Pitre, JM (1994). "El sistema H-Pd (hidrógeno-paladio)". Journal of Phase Equilibria . 15 : 62–83. doi :10.1007/BF02667685. S2CID 95343702.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . págs. 1150–151. ISBN 978-0-08-037941-8.
- ^ Grochala, Wojciech; Edwards, Peter P. (2004). "Descomposición térmica de los hidruros no intersticiales para el almacenamiento y producción de hidrógeno". Chemical Reviews . 104 (3): 1283–316. doi :10.1021/cr030691s. PMID 15008624.
- ^ Mott, NF y Jones, H. (1958) La teoría de las propiedades de los metales y las aleaciones . Oxford University Press. ISBN 0-486-60456-X . pág. 200.
- ^ Manual de reactores de membrana, vol. 1, Ciencia fundamental de los materiales, diseño y optimización. Angelo Basile. Cambridge, Reino Unido: Woodhead Publishing. 2013. ISBN 978-0-85709-414-8.OCLC 870962388 .
{{cite book}}: Mantenimiento de CS1: otros ( enlace ) - ^ Häussinger, Peter; Lohmüller, Reiner; Watson, Allan M. (2011). "Hidrógeno, 3. Purificación". Ullmann's Encyclopedia of Industrial Chemistry . doi :10.1002/14356007.o13_o04. ISBN 978-3-527-30385-4.
- ^ Colon, Pierre; Pradelle-Plasse, Nelly; Galland, Jacques (2003). "Evaluación del comportamiento de corrosión a largo plazo de las amalgamas dentales: influencia de la adición de paladio y la morfología de las partículas". Materiales dentales . 19 (3): 232–9. doi :10.1016/S0109-5641(02)00035-0. PMID 12628436.
- ^ Sakaguchi, Ronald; Ferracane, Jack; Powers, John, eds. (1 de enero de 2019), "Capítulo 10 - Materiales restauradores: metales", Craig's Restorative Dental Materials (decimocuarta edición) , Filadelfia: Elsevier, págs. 171–208, doi :10.1016/B978-0-323-47821-2.00010-X, ISBN 978-0-323-47821-2, consultado el 11 de febrero de 2023
- ^ Gupta, Dinesh C.; Langer, Paul H.; Comité F-1 de ASTM sobre Electrónica (1987). Tecnología de semiconductores emergente: un simposio. ASTM International. págs. 273–. ISBN 978-0-8031-0459-4.
{{cite book}}: CS1 maint: nombres numéricos: lista de autores ( enlace ) - ^ Mann, Mark B. (2007). "Paladio 950: métodos de fabricación".
- ^ Hindsen, M.; Spiren, A.; Bruze, M. (2005). "Reactividad cruzada entre níquel y paladio demostrada por administración sistémica de níquel". Dermatitis de contacto . 53 (1): 2–8. doi :10.1111/j.0105-1873.2005.00577.x. PMID 15982224. S2CID 20927683.
- ^ Battaini, Paolo (2006). "Propiedades de trabajo para la fabricación de joyas utilizando nuevas aleaciones de paladio 950". DOCUMENTOS DEL SIMPOSIO DE SANTA FE .
- ^ Holmes, E. (13 de febrero de 2007). "El paladio, el hermano más barato del platino, apuesta por el amor". The Wall Street Journal (edición oriental). pp. B.1.
- ^ "Metales del grupo del platino" (PDF) . Anuario de minerales 2009. Servicio Geológico de los Estados Unidos . Enero de 2007.
- ^ "Metales del grupo del platino" (PDF) . Anuario de minerales 2006. Servicio Geológico de los Estados Unidos . Enero de 2007.
- ^ "Precios base de Johnson Matthey". 2019. Consultado el 7 de enero de 2019 .
- ^ Ware, Mike (2005). "Reseña del libro: Fotografía en platino y paladio". Platinum Metals Review . 49 (4): 190–195. doi : 10.1595/147106705X70291 .
- ^ Sigma-Aldrich Co. , SDS Paladio.
- ^ Hosseini y col., Metalomics, 2016, 8, 252–259; doi :10.1039/C5MT00249D
- ^ Emsley, John (2011). Los elementos básicos de la naturaleza: una guía de la A a la Z de los elementos . Oxford University Press. pp. 384, 387. ISBN 978-0-19-960563-7.
- ^ abcd Kielhorn, Janet; Melber, Christine; Keller, Detlef; Mangelsdorf, Inge (2002). "Paladio: una revisión de la exposición y los efectos para la salud humana". Revista Internacional de Higiene y Salud Ambiental . 205 (6): 417–32. Bibcode :2002IJHEH.205..417K. doi :10.1078/1438-4639-00180. PMID 12455264.
- ^ Zereini, Fathi; Alt, Friedrich (2006). "Potencial de riesgo para la salud del paladio". Emisiones de paladio en el medio ambiente: métodos analíticos, evaluación ambiental y efectos sobre la salud . Springer Science & Business. págs. 549–563. ISBN 978-3-540-29219-7.
- ^ Wataha, JC; Hanks, CT (1996). "Efectos biológicos del paladio y riesgo de su uso en aleaciones para colado dental". Journal of Oral Rehabilitation . 23 (5): 309–20. doi :10.1111/j.1365-2842.1996.tb00858.x. PMID 8736443.
- ^ Aberer, Werner; Holub, Henriette; Strohal, Robert; Slavicek, Rudolf (1993). "Paladio en aleaciones dentales: ¿es responsabilidad de los dermatólogos advertir?". Dermatitis de contacto . 28 (3): 163–5. doi :10.1111/j.1600-0536.1993.tb03379.x. PMID 8462294. S2CID 43020912.
- ^ Wataha, John C.; Shor, Kavita (2010). "Aleaciones de paladio para dispositivos biomédicos". Expert Review of Medical Devices . 7 (4): 489–501. doi :10.1586/erd.10.25. PMID 20583886. S2CID 41325428.
- ^ ab Usselman, Melvyn (1978). "La controversia Wollaston/Chenevix sobre la naturaleza elemental del paladio: un episodio curioso en la historia de la química". Anales de la ciencia . 35 (6): 551–579. doi :10.1080/00033797800200431.
- ^ ab Griffith, WP (2003). "Rodio y paladio: acontecimientos que rodearon su descubrimiento". Platinum Metals Review . 47 (4): 175–183. doi : 10.1595/003214003X474175183 .
- ^ Wollaston, WH (1804). "Sobre un nuevo metal, hallado en platino crudo". Philosophical Transactions of the Royal Society of London . 94 : 419–430. doi : 10.1098/rstl.1804.0019 .
- ^ Wollaston, WH (1805). "Sobre el descubrimiento del paladio; con observaciones sobre otras sustancias encontradas con platino". Philosophical Transactions of the Royal Society of London . 95 : 316–330. doi : 10.1098/rstl.1805.0024 .
- ^ Garrett, Christine E.; Prasad, Kapa (2004). "El arte de cumplir con las especificaciones de paladio en ingredientes farmacéuticos activos producidos por reacciones catalizadas con paladio". Advanced Synthesis & Catalysis . 346 (8): 889–900. doi :10.1002/adsc.200404071. S2CID 94929244.
- ^ Williamson, Alan. "Acciones de metales del grupo del platino de Rusia" (PDF) . Conferencia de metales preciosos de la LBMA de 2003. Asociación del mercado de metales preciosos de Londres. Archivado desde el original (PDF) el 21 de octubre de 2013. Consultado el 2 de octubre de 2010 .
- ^ "Precios históricos del paladio y gráfico de precios". InvestmentMine . Consultado el 27 de enero de 2015 .
- ^ "Ford teme su primera pérdida en una década". BBC News . 16 de enero de 2002 . Consultado el 19 de septiembre de 2008 .
- ^ Nat Rudarakanchana (27 de marzo de 2014). "Fondo de paladio se lanza en Sudáfrica, mientras la oferta rusa teme un aumento de los precios". International Business Times .
- ^ Rosenfeld, Everett (20 de agosto de 2014). "La otra mercancía que se está aprovechando de la guerra en Ucrania". CNBC . Consultado el 29 de enero de 2018 .
- ^ "El repunte del paladio no se limita a los automóviles". Bloomberg.com . 30 de agosto de 2017 . Consultado el 29 de enero de 2018 .
- ^ "No esperen que los precios del paladio se desplomen | OilPrice.com". OilPrice.com . Consultado el 29 de enero de 2018 .
- ^ "El oro se dispara mientras las tensiones en Oriente Medio generan una tormenta perfecta". Reuters . 6 de enero de 2020 . Consultado el 6 de enero de 2020 .
- ^ Patel, Brijesh (4 de marzo de 2022). "El paladio supera los 3.000 dólares la onza a medida que aumentan los temores por la oferta, el oro sube más del 1%". Reuters .
- ^ "Suministro total de paladio en todo el mundo en 2017 | Estadísticas". Statista . Consultado el 15 de octubre de 2018 .
- ^ "Distribución de la demanda mundial de paladio por aplicación 2016 | Estadística". Statista . Consultado el 15 de octubre de 2018 .
- ^ "Gráficos y datos históricos del paladio - London Fix".
- ^ "Calculadora de inflación del IPC". data.bls.gov . Consultado el 13 de agosto de 2018 .
- ^ Staff, Writer (OilPrice.com) (10 de marzo de 2022). "Los precios del paladio se disparan a medida que las sanciones rusas duelen". Yahoo! Finance . OilPrice.com . Consultado el 13 de marzo de 2022 .
- ^ "Precio del ETP ETFS METAL PAL (PHPD)". Bolsa de Londres.
- ^ "Tamaño del mercado del paladio | Sunshine Profits". www.sunshineprofits.com . Consultado el 11 de febrero de 2023 .
Enlaces externos
- Paladio en la Tabla Periódica de Vídeos (Universidad de Nottingham)
- Precio actual e histórico del paladio
- . Enciclopedia Británica . vol. 20 (11ª ed.). 1911, págs. 636–637.
.jpg/440px-Palladium_(46_Pd).jpg)







