Reacción de Suzuki
| Reacción de Suzuki | |
|---|---|
| Llamado en honor a | Suzuki Akira |
| Tipo de reacción | Reacción de acoplamiento |
| Identificadores | |
| Portal de química orgánica | acoplamiento suzuki |
| Identificación de ontología RSC | Número de receta: 0000140 |
La reacción de Suzuki o acoplamiento de Suzuki es una reacción orgánica que utiliza un catalizador de complejo de paladio para acoplar de forma cruzada un ácido borónico a un organohaluro . [1] [2] [3] Fue publicada por primera vez en 1979 por Akira Suzuki , y compartió el Premio Nobel de Química de 2010 con Richard F. Heck y Ei-ichi Negishi por su contribución al descubrimiento y desarrollo de la catálisis de metales nobles en la síntesis orgánica . [ 4] Esta reacción a veces se combina con la borilación de Miyaura relacionada ; la combinación es la reacción de Suzuki-Miyaura . Se usa ampliamente para sintetizar poliolefinas , estirenos y bifenilos sustituidos .
El esquema general de la reacción de Suzuki se muestra a continuación, donde se forma un enlace simple carbono-carbono mediante el acoplamiento de un haluro (R 1 -X) con una especie de organoboro (R 2 -BY 2 ) utilizando un catalizador de paladio y una base . La especie de organoboro se sintetiza habitualmente mediante hidroboración o carboboración , lo que permite una rápida generación de complejidad molecular.

Se han publicado varias revisiones que describen los avances y el desarrollo de la reacción de Suzuki. [5] [6] [7]
Mecanismo de reacción
El mecanismo de la reacción de Suzuki se ve mejor desde la perspectiva del catalizador de paladio. El ciclo catalítico se inicia con la formación de una especie catalítica activa de Pd 0 , A . Esta participa en la adición oxidativa de paladio al reactivo de haluro 1 para formar el intermedio de organopaladio B . La reacción ( metátesis ) con la base da el intermedio C , que a través de la transmetalación [8] con el complejo de boronato D (producido por la reacción del reactivo de ácido borónico 2 con la base) forma la especie transitoria de organopaladio E . El paso de eliminación reductora conduce a la formación del producto deseado 3 y restaura el catalizador de paladio original A que completa el ciclo catalítico .

El acoplamiento de Suzuki se lleva a cabo en presencia de una base y durante mucho tiempo no se comprendió por completo el papel de la base. Al principio se creyó que la base formaba un borato de trialquilo (R 3 B-OR), en el caso de una reacción de un trialquilborano (BR 3 ) y un alcóxido ( − OR); esta especie podría considerarse más nucleófila y, por lo tanto, más reactiva hacia el complejo de paladio presente en el paso de transmetalación. [9] [10] [11] Duc y colaboradores investigaron el papel de la base en el mecanismo de reacción para el acoplamiento de Suzuki y descubrieron que la base tiene tres funciones: formación del complejo de paladio [ArPd(OR)L 2 ], formación del borato de trialquilo y aceleración del paso de eliminación reductora mediante la reacción del alcóxido con el complejo de paladio. [9]
Adición oxidativa
En la mayoría de los casos, la adición oxidativa es el paso que determina la velocidad del ciclo catalítico. [12] Durante este paso, el catalizador de paladio se oxida de paladio(0) a paladio(II). La especie de paladio catalíticamente activa A se acopla con el sustrato de haluro de arilo 1 para producir un complejo de organopaladio B. Como se ve en el diagrama a continuación, el paso de adición oxidativa rompe el enlace carbono - halógeno donde el paladio ahora está unido tanto al halógeno (X) como al grupo R 1 .

La adición oxidativa procede con la retención de la estereoquímica con haluros de vinilo , mientras que da lugar a una inversión de la estereoquímica con haluros alílicos y bencílicos . [13] La adición oxidativa forma inicialmente el complejo cis -paladio, que rápidamente se isomeriza al complejo trans. [14]

El acoplamiento de Suzuki se produce con la retención de la configuración en los enlaces dobles tanto para el reactivo de organoboro como para el haluro. [15] Sin embargo, la configuración de ese enlace doble, cis o trans, está determinada por la isomerización cis a trans del complejo de paladio en el paso de adición oxidativa, donde el complejo de paladio trans es la forma predominante. Cuando el organoboro está unido a un enlace doble y está acoplado a un haluro de alquenilo, el producto es un dieno, como se muestra a continuación.

Transmetalación
La transmetalación es una reacción organometálica en la que los ligandos se transfieren de una especie a otra. En el caso del acoplamiento de Suzuki, los ligandos se transfieren de la especie de organoboro D al complejo de paladio (II) C, donde la base que se agregó en el paso anterior se intercambia con el sustituyente R 2 en la especie de organoboro para dar el nuevo complejo de paladio (II) E . El mecanismo exacto de transmetalación para el acoplamiento de Suzuki aún está por descubrir. Los compuestos de organoboro no experimentan transmetalación en ausencia de base y, por lo tanto, se cree ampliamente que el papel de la base es activar el compuesto de organoboro y facilitar la formación del intermedio R 1 -Pd ll -O t Bu ( C ) a partir del producto de adición oxidativa R 1 -Pd ll -X ( B ). [12]

Eliminación reductiva
El paso final es el paso de eliminación reductora donde el complejo de paladio(II) ( E ) elimina el producto ( 3 ) y regenera el catalizador de paladio(0) ( A ). Utilizando el marcaje con deuterio , Ridgway et al. han demostrado que la eliminación reductora se lleva a cabo con retención de la estereoquímica. [16]

El ligando juega un papel importante en la reacción de Suzuki. Normalmente, el ligando de fosfina se utiliza en la reacción de Suzuki. El ligando de fosfina aumenta la densidad electrónica en el centro metálico del complejo y, por lo tanto, ayuda en el paso de adición oxidativa. Además, la voluminosidad de la sustitución del ligando de fosfina ayuda en el paso de eliminación reductora. Sin embargo, los ligandos de carbeno N -heterocíclicos se han utilizado recientemente en este acoplamiento cruzado, debido a la inestabilidad del ligando de fosfina en las condiciones de la reacción de Suzuki. [17] Los carbenos N -heterocíclicos son más ricos en electrones y voluminosos que el ligando de fosfina. Por lo tanto, tanto los factores estéricos como los electrónicos del ligando de carbeno N -heterocíclico ayudan a estabilizar el catalizador Pd(0) activo. [18]
Ventajas
Las ventajas del acoplamiento de Suzuki sobre otras reacciones similares incluyen la disponibilidad de ácidos borónicos comunes, condiciones de reacción suaves y su naturaleza menos tóxica. Los ácidos borónicos son menos tóxicos y más seguros para el medio ambiente que los compuestos de organoestaño y organocinc . Es fácil eliminar los subproductos inorgánicos de la mezcla de reacción. Además, esta reacción es preferible porque utiliza reactivos relativamente baratos y fáciles de preparar. Poder usar agua como disolvente [19] hace que esta reacción sea más económica, ecológica y práctica de usar con una variedad de reactivos solubles en agua. Se puede utilizar una amplia variedad de reactivos para el acoplamiento de Suzuki, por ejemplo, ácidos borónicos de arilo o vinilo y haluros de arilo o vinilo . El trabajo también ha ampliado el alcance de la reacción para incorporar bromuros de alquilo. [20] Además de que son posibles muchos tipos diferentes de haluros para la reacción de acoplamiento de Suzuki, la reacción también funciona con pseudohaluros como triflatos (OTf), como reemplazos de haluros . La reactividad relativa para el socio de acoplamiento con el haluro o pseudohaluro es: R 2 –I > R 2 –OTf > R 2 –Br >> R 2 –Cl. Se pueden utilizar ésteres borónicos y sales de organotrifluoroborato en lugar de ácidos borónicos. El catalizador también puede ser un catalizador basado en nanomateriales de paladio . [21] Con un nuevo ligando de organofosfina ( SPhos ), se ha informado una carga de catalizador de hasta 0,001 mol %. [22] Estos avances y la flexibilidad general del proceso han hecho que el acoplamiento de Suzuki sea ampliamente aceptado para la síntesis química.
Aplicaciones
Aplicaciones industriales
La reacción de acoplamiento de Suzuki es escalable y rentable para su uso en la síntesis de intermediarios para productos farmacéuticos o químicos finos . [23] La reacción de Suzuki alguna vez estuvo limitada por los altos niveles de catalizador y la disponibilidad limitada de ácidos borónicos . También se encontraron reemplazos para haluros, aumentando también el número de socios de acoplamiento para el haluro o pseudohaluro. Se han llevado a cabo reacciones a mayor escala en la síntesis de varios compuestos biológicos importantes como CI-1034 que utilizó socios de acoplamiento de triflato y ácido borónico que se ejecutó en una escala de 80 kilogramos con un rendimiento del 95%. [24]
Otro ejemplo es el acoplamiento de 3-piridilborano y 1-bromo-3-(metilsulfonil)benceno, que formó un intermedio que se utilizó en la síntesis de un posible agente para el sistema nervioso central. La reacción de acoplamiento para formar el intermedio produjo 278 kilogramos con un rendimiento del 92,5 %. [15] [23]
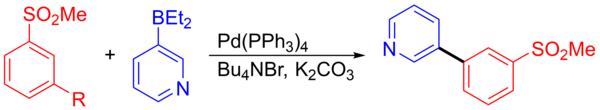
Se han hecho importantes esfuerzos en el desarrollo de catalizadores heterogéneos para la reacción Suzuki CC, motivados por las ganancias de rendimiento en el proceso industrial (eliminando la separación del catalizador del sustrato), y recientemente se ha demostrado que un catalizador heterogéneo de un solo átomo de Pd supera al catalizador homogéneo Pd(PPh 3 ) 4 predeterminado de la industria . [25]
Aplicaciones sintéticas
El acoplamiento de Suzuki se ha utilizado con frecuencia en síntesis de compuestos complejos. [26] [27] El acoplamiento de Suzuki se ha utilizado en un derivado de citronelal para la síntesis de caparratrieno, un producto natural que es muy activo contra la leucemia: [28]

Variaciones
Catalizador metálico
Se han desarrollado varios usos catalíticos de metales distintos del paladio (especialmente níquel). [29] La primera reacción de acoplamiento cruzado catalizada por níquel fue informada por Percec y colaboradores en 1995 utilizando mesilatos de arilo y ácidos borónicos. [30] Aunque se necesitó una mayor cantidad de catalizador de níquel para la reacción, alrededor del 5 % molar, el níquel no es un metal tan caro ni tan precioso como el paladio . La reacción de acoplamiento de Suzuki catalizada por níquel también permitió una serie de compuestos que no funcionaron o funcionaron peor para el sistema catalizado por paladio que el sistema catalizado por níquel. [29] El uso de catalizadores de níquel ha permitido electrófilos que resultaron desafiantes para el acoplamiento de Suzuki original utilizando paladio, incluidos sustratos como fenoles, éteres de arilo, ésteres, fosfatos y fluoruros. [29]

La investigación sobre el acoplamiento cruzado catalizado por níquel continuó y aumentó el alcance de la reacción después de que se mostraron estos primeros ejemplos y el interés por la investigación creció. Miyaura e Inada informaron en 2000 que se podía utilizar un catalizador de níquel más barato para el acoplamiento cruzado , utilizando trifenilfosfina (PPh3 ) en lugar de los ligandos más caros utilizados anteriormente. [31] Sin embargo, el acoplamiento cruzado catalizado por níquel todavía requería altas cargas de catalizador (3-10%), requería un exceso de ligando (1-5 equivalentes) y seguía siendo sensible al aire y la humedad. [29] Los avances de Han y sus colaboradores han tratado de abordar ese problema mediante el desarrollo de un método que utiliza bajas cantidades de catalizador de níquel (<1 mol%) y ningún equivalente adicional de ligando. [32]

En 2011, Wu y sus colaboradores también informaron que se podía utilizar un catalizador de níquel altamente activo para el acoplamiento cruzado de cloruros de arilo que solo requería entre un 0,01 y un 0,1 % molar de catalizador de níquel. También demostraron que el catalizador se podía reciclar hasta seis veces sin prácticamente ninguna pérdida de actividad catalítica. [33] El catalizador era reciclable porque era un catalizador de nanopartículas de níquel y fosfina (G 3 DenP-Ni) que se fabricaba a partir de dendrímeros .

Las reacciones de acoplamiento de Suzuki catalizadas por paladio y níquel tienen ventajas y desventajas. Además del sistema catalizador de Pd y Ni, se han utilizado fuentes de metales baratas y no tóxicas como el hierro y el cobre [34] en la reacción de acoplamiento de Suzuki. El grupo de investigación de Bedford [35] y el grupo de investigación de Nakamura [36] han trabajado extensamente en el desarrollo de la metodología de la reacción de acoplamiento de Suzuki catalizada por hierro. El rutenio es otra fuente de metal que se ha utilizado en la reacción de acoplamiento de Suzuki. [37]
Acoplamiento de amida
La catálisis de níquel puede construir enlaces CC a partir de amidas. A pesar de la naturaleza inherentemente inerte de las amidas como sintones, se puede utilizar la siguiente metodología para preparar enlaces CC. El procedimiento de acoplamiento es suave y tolerante con una gran variedad de grupos funcionales, entre ellos: aminas, cetonas, heterociclos y grupos con protones ácidos. Esta técnica también se puede utilizar para preparar moléculas bioactivas y unir heterociclos de forma controlada mediante acoplamientos cruzados secuenciales astutos. A continuación se ofrece una revisión general del esquema de reacción. [38]

La síntesis de un compuesto de unión a tubulina (agente antiproliferativo ) se llevó a cabo utilizando una trimetoxi benzamida y un socio de acoplamiento de indolil pinacol atoboro en una escala de gramos. [38]

Organoboranos
Los ácidos arilborónicos son comparativamente más baratos que otros organoboranos y hay una amplia variedad de ellos disponibles comercialmente. Por lo tanto, se han utilizado ampliamente en la reacción de Suzuki como un socio de organoborano. Las sales de ariltrifluoroborato son otra clase de organoboranos que se utilizan con frecuencia porque son menos propensas a la protodesboración en comparación con los ácidos arilborónicos . Son fáciles de sintetizar y se pueden purificar fácilmente. [39] Las sales de ariltrifluoroborato se pueden formar a partir de ácidos borónicos mediante el tratamiento con fluoruro de hidrógeno de potasio que luego se puede utilizar en la reacción de acoplamiento de Suzuki. [40]

Variaciones de disolventes
La reacción de acoplamiento de Suzuki es diferente de otras reacciones de acoplamiento en que se puede llevar a cabo en agua orgánica bifásica, [41] solo agua, [19] o sin disolvente. [42] Esto aumentó el alcance de las reacciones de acoplamiento, ya que se podría utilizar una variedad de bases solubles en agua, sistemas catalizadores y reactivos sin preocuparse por su solubilidad en disolventes orgánicos. El uso de agua como sistema disolvente también es atractivo debido a las ventajas económicas y de seguridad. Los sistemas disolventes utilizados con frecuencia para el acoplamiento de Suzuki son tolueno , [43] THF , [44] dioxano , [44] y DMF . [45] Las bases utilizadas con más frecuencia son K 2 CO 3 , [41] KO t Bu , [46] Cs 2 CO 3 , [47] K 3 PO 4 , [48] NaOH , [49] y NEt 3 . [50]
Véase también
- Acoplamiento Chan-Lam
- Reacción al demonio
- Acoplamiento Hiyama
- Acoplamiento Kumada
- Acoplamiento Negishi
- Reacción de petasis
- Acoplamiento Sonogashira
- Reacción de Stille
- Lista de reacciones orgánicas
Referencias
- ^ Miyaura, Norio; Yamada, Kinji; Suzuki, Akira (1979). "Un nuevo acoplamiento cruzado estereoespecífico mediante la reacción catalizada por paladio de 1-alquenilboranos con haluros de 1-alquenilo o 1-alquinilo". Tetrahedron Letters . 20 (36): 3437–3440. doi :10.1016/S0040-4039(01)95429-2. hdl : 2115/44006 .
- ^ Miyaura, Norio; Suzuki, Akira (1979). "Síntesis estereoselectiva de (E)-alquenos arilados mediante la reacción de alk-1-enilboranos con haluros de arilo en presencia de un catalizador de paladio". Chem. Comm. (19): 866–867. doi :10.1039/C39790000866.
- ^ Miyaura, Norio ; Suzuki, Akira (1995). "Reacciones de acoplamiento cruzado catalizadas por paladio de compuestos de organoboro". Chemical Reviews . 95 (7): 2457–2483. CiteSeerX 10.1.1.735.7660 . doi :10.1021/cr00039a007. S2CID 53050782.
- ^ Nobelprize.org. «El Premio Nobel de Química 2010». Fundación Premio Nobel . Consultado el 25 de octubre de 2013 .
- ^ Suzuki, Akira (1991). "Estudios sintéticos a través de la reacción de acoplamiento cruzado de derivados de organoboro con haluros orgánicos". Pure Appl. Chem . 63 (3): 419–422. doi : 10.1351/pac199163030419 .
- ^ Miyaura, Norio; Suzuki, Akira (1979). "Reacciones de acoplamiento cruzado catalizadas por paladio de compuestos de organoboro". Chemical Reviews . 95 (7): 2457–2483. CiteSeerX 10.1.1.735.7660 . doi :10.1021/cr00039a007. S2CID 53050782. (Revisar)
- ^ Suzuki, Akira (1999). "Avances recientes en las reacciones de acoplamiento cruzado de derivados de organoboro con electrófilos orgánicos, 1995-1998". Journal of Organometallic Chemistry . 576 (1–2): 147–168. doi : 10.1016/S0022-328X(98)01055-9 .
- ^ Matos, K.; Soderquist, JA (1998). "Alquilboranos en el acoplamiento Suzuki−Miyaura: estudios estereoquímicos y mecanísticos". J. Org. Chem. 63 (3): 461–470. doi :10.1021/jo971681s. PMID 11672034.
- ^ ab Amatore, Christian; Jutand, Anny; Le Duc, Gaëtan (18 de febrero de 2011). "Datos cinéticos de la eliminación reductiva/transmetalación en reacciones de Suzuki-Miyaura catalizadas por paladio: triple papel inesperado de los iones hidróxido utilizados como base". Química: una revista europea . 17 (8): 2492–2503. doi :10.1002/chem.201001911. PMID 21319240.
- ^ Smith, George B.; Dezeny, George C.; Hughes, David L.; King, Anthony O.; Verhoeven, Thomas R. (1 de diciembre de 1994). "Estudios mecanicistas de la reacción de acoplamiento cruzado de Suzuki". The Journal of Organic Chemistry . 59 (26): 8151–8156. doi :10.1021/jo00105a036.
- ^ Matos, Karl; Soderquist, John A. (1 de febrero de 1998). "Alquilboranos en el acoplamiento Suzuki−Miyaura: estudios estereoquímicos y mecanísticos". Revista de química orgánica . 63 (3): 461–470. doi :10.1021/jo971681s. PMID 11672034.
- ^ ab Kurti, Laszlo (2005). Aplicaciones estratégicas de reacciones con nombre en síntesis orgánica . Elsevier Academic Press. ISBN 978-0124297852.
- ^ Stille, John K.; Lau, Kreisler SY (1977). "Mecanismos de adición oxidativa de haluros orgánicos a complejos de metales de transición del Grupo 8". Accounts of Chemical Research . 10 (12): 434–442. doi :10.1021/ar50120a002.
- ^ Casado, Arturo L.; Espinet, Pablo (1998). "Sobre la configuración resultante de la adición oxidativa de RX a Pd(PPh3)4 y el mecanismo de isomerización cis-a-trans de complejos de \PdRX(PPh3)2] (R = arilo, X = haluro)†". Organometallics . 17 (5): 954–959. doi :10.1021/om9709502.
- ^ ab Química orgánica avanzada . Springer. 2007. págs. 739–747.
- ^ Ridgway, Brian H.; Woerpel, KA (1998). "La transmetalación de alquilboranos a paladio en la reacción de acoplamiento de Suzuki continúa con retención de la estereoquímica". Revista de química orgánica . 63 (3): 458–460. doi :10.1021/jo970803d. PMID 11672033.
- ^ "Ciencia de la síntesis: mejores métodos. Mejores resultados – Química de Thieme". science-of-synthesis.thieme.com . Consultado el 14 de abril de 2021 .
- ^ Hopkinson, Matthew N.; Richter, Christian; Schedler, Michael; Glorius, Frank (junio de 2014). "Una descripción general de los carbenos N-heterocíclicos". Nature . 510 (7506): 485–496. Bibcode :2014Natur.510..485H. doi :10.1038/nature13384. ISSN 1476-4687. PMID 24965649. S2CID 672379.
- ^ ab Casalnuovo, Albert L.; Calabrese (1990). "Alquilaciones catalizadas por paladio en medios acuosos". J. Am. Chem. Soc . 112 (11): 4324–4330. doi :10.1021/ja00167a032.
- ^ Kirchhoff, Jan H.; Netherton, Matthew R.; Hills, Ivory D.; Fu, Gregory C. (2002). "Ácidos borónicos: nuevos socios de acoplamiento en reacciones de Suzuki a temperatura ambiente de bromuros de alquilo. Caracterización cristalográfica de un aducto de adición oxidativa generado en condiciones notablemente suaves". Revista de la Sociedad Química Estadounidense . 124 (46): 13662–3. doi :10.1021/ja0283899. PMID 12431081.
- ^ Ohtaka, Atsushi (2013). "Catalizadores nanometálicos soportados en polímeros reciclables en agua". The Chemical Record . 13 (3): 274–285. doi :10.1002/tcr.201300001. PMID 23568378.
- ^ Martin, R.; Buchwald, SL (2008). "Reacciones de acoplamiento cruzado Suzuki−Miyaura catalizadas por paladio que emplean ligandos de fosfina de dialquilbiarilo". Accounts of Chemical Research . 41 (11): 1461–1473. doi :10.1021/ar800036s. PMC 2645945 . PMID 18620434.
- ^ ab Rouhi, A. Maureen (6 de septiembre de 2004). "Químicos finos". C&EN .
- ^ Jacks, Thomas E.; Belmont, Daniel T.; Briggs, Christopher A.; Horne, Nicole M.; Kanter, Gerald D.; Karrick, Greg L.; Krikke, James J.; McCabe, Richard J.; Mustakis; Nanninga, Thomas N. (1 de marzo de 2004). "Desarrollo de un proceso escalable para CI-1034, un antagonista de la endotelina". Organic Process Research & Development . 8 (2): 201–212. doi :10.1021/op034104g.
- ^ Chen, Zupeng; Vorobyeva, Evgeniya; Mitchell, Sharon; Fako, Edvin; Ortuño, Manuel A.; López, Nuria ; Collins, Sean M.; Midgley, Paul A.; Ricardo, Silvia; Vilé, Gianvito; Pérez-Ramírez, Javier (2018). "Un catalizador heterogéneo de paladio de un solo átomo que supera los sistemas homogéneos para el acoplamiento Suzuki" (PDF) . Nanotecnología de la naturaleza . 13 (8): 702–707. Código Bib : 2018NatNa..13..702C. doi :10.1038/s41565-018-0167-2. hdl :2072/359786. PMID 29941887. S2CID 49415437.
- ^ Balog, Aarón; Meng, Dongfang; Kamenecka, Ted; Bertinato, Pedro; Su, Dai-Shi; Sorensen, Erik J.; Danishefsky, Samuel J. (1996). "Síntesis total de (–) -epotilona A". Angewandte Chemie Edición Internacional en inglés . 35 (2324): 2801–2803. doi :10.1002/anie.199628011.
- ^ Liu, Junjia; Lotesta, Stephen D.; Sorensen, Erik J. (2011). "Una síntesis concisa de la estructura molecular de la pleuromutilina". Comunicaciones Químicas . 47 (5): 1500–2. doi :10.1039/C0CC04077K. PMC 3156455 . PMID 21079876.
- ^ Vyvyan, JR; Peterson, Emily A.; Stephan, Mari L. (1999). "Una síntesis total expeditiva de (+/−)-caparratrieno". Tetrahedron Letters . 40 (27): 4947–4949. doi :10.1016/S0040-4039(99)00865-5.
- ^ abcd Han, Fu-She (1 de enero de 2013). "Reacciones de acoplamiento cruzado de Suzuki-Miyaura catalizadas por metales de transición: un avance notable de los catalizadores de paladio a los de níquel". Chemical Society Reviews . 42 (12): 5270–98. doi :10.1039/c3cs35521g. PMID 23460083.
- ^ Percec, Virgil; Bae, Jin-Young; Hill, Dale (1995). "Mesilatos de arilo en reacciones de homoacoplamiento y acoplamiento cruzado catalizadas por metales. 2. Acoplamiento cruzado catalizado por níquel de tipo Suzuki de arenesulfonatos de arilo y mesilatos de arilo con ácidos arilborónicos". Journal of Organic Chemistry . 60 (4): 1060–1065. doi :10.1021/jo00109a044.
- ^ Inada, Kaoru; Norio Miyaura (2000). "Síntesis de biarilos mediante reacción de acoplamiento cruzado de ácidos arilborónicos con cloruros de arilo catalizada por complejos de NiCl2/trifenilfosfina". Tetrahedron . 56 (44): 8657–8660. doi :10.1016/S0040-4020(00)00814-0.
- ^ Zhao, Yu-Long; Li, You; Li, Shui-Ming; Zhou, Yi-Guo; Sun, Feng-Yi; Gao, Lian-Xun; Han, Fu-She (1 de junio de 2011). "Un catalizador de níquel altamente práctico y confiable para el acoplamiento Suzuki-Miyaura de haluros de arilo". Síntesis y catálisis avanzadas . 353 (9): 1543–1550. doi :10.1002/adsc.201100101.
- ^ Wu, Lei; Ling, Jie; Wu, Zong-Quan (1 de junio de 2011). "Un catalizador altamente activo y reciclable: nanopartículas de níquel estabilizadas con dendrímero de fosfina para la reacción de acoplamiento de Suzuki". Advanced Synthesis & Catalysis . 353 (9): 1452–1456. doi :10.1002/adsc.201100134.
- ^ Yang, CT; Zhang, Zhen-Qi; Liu, Yu-Chen; Liu, Lei (2011). "Reacción de acoplamiento cruzado catalizada por cobre de compuestos de organoboro con haluros de alquilo primarios y pseudohaluros". Angew. Chem. Int. Ed . 50 (17): 3904–3907. doi :10.1002/anie.201008007. PMID 21455914.
- ^ Bredford, RB; Hall, Mark A.; Hodges, George R.; Huwe, Michael; Wilkinson, Mark C. (2009). "Catalizadores simples mixtos de Fe-Zn para los acoplamientos de Suzuki de tetraarilboratos con haluros de bencilo y 2-halopiridinas". Química Común. (42): 6430–6432. doi :10.1039/B915945B. PMID 19841799. S2CID 40428708.
- ^ Nakamura, M; Hashimoto, Toru; Kathriarachchi, Kalum KADS; Zenmyo, Takeshi; Seike, Hirofumi; Nakamura, Masaharu (2012). "Acoplamiento alquil-alquilo Suzuki-Miyaura catalizado por hierro". Angélica. Química. Int. Ed . 51 (35): 8834–883. doi :10.1002/anie.201202797. PMID 22848024.
- ^ Na, Y; Park, Soyoung; Han, Soo Bong; Han, Hoon; Ko, Sangwon; Chang, Sukbok (2004). "Reacciones de acoplamiento de Suzuki y olefinación de tipo Heck catalizadas por rutenio: estudios sobre la naturaleza de las especies catalíticas". J. Am. Chem. Soc . 126 (1): 250–258. doi :10.1021/ja038742q. PMID 14709090.
- ^ ab Weires, Nicholas A.; Baker, Emma L.; Garg, Neil K. (2015). "Acoplamiento de amidas Suzuki-Miyaura catalizado por níquel". Nature Chemistry . 8 (1): 75–79. Bibcode :2016NatCh...8...75W. doi :10.1038/nchem.2388. PMID 26673267.
- ^ Molander, Gary A.; Biolatto, Betina (2003). "Reacciones de acoplamiento cruzado Suzuki−Miyaura catalizadas por paladio de aril- y heteroariltrifluoroboratos de potasio". J. Org. Chem . 68 (11): 4302–4314. doi :10.1021/jo0342368. PMID 12762730.
- ^ Bates, Roderick (2012). Síntesis orgánica con metales de transición . Wiley. ISBN 978-1119978930.
- ^ ab Dolliver, Debra; Bhattarai, Bijay T.; Pandey, Arjun; Lanier, Megan L.; Bordelón, Amber S.; Adhikari, Sarju; Dinser, Jordania A.; Flores, Patrick F.; Testamentos, Verónica S.; Schneider, Carolina L.; Shaughnessy, Kevin H.; Moore, Jane N.; Raders, Steven M.; Snowden, Timothy S.; McKim, Artie S.; Fronczek, Frank R. (2013). "Reacciones de acoplamiento estereoespecíficas de Suzuki, Sonogashira y Negishi de yoduros y bromuros de N-alcoxiimidoilo". J. Org. química . 78 (8): 3676–3687. doi :10.1021/jo400179u. PMID 23534335.
- ^ Asachenko, Andrey; Sorochkina, Kristina; Dzhevakov, Pavel; Topchiy, Maxim; Nechaev, Mikhail (2013). "Acoplamiento cruzado Suzuki-Miyaura en condiciones sin disolventes". Adv. Sintetizador. Catalán . 355 (18): 3553–3557. doi : 10.1002/adsc.201300741.
- ^ Pan, Changduo; Liu, Zhang; Wu, Huayue; Din, Jinchang; Cheng, Jiang (2008). "Reacción de acoplamiento cruzado de Suzuki sin ligando catalizada por paladio". Comunicaciones de Catálisis . 9 (4): 321–323. doi : 10.1016/j.catcom.2007.06.022.
- ^ ab Littke, Adam F.; Fu (2000). "Catalizadores versátiles para el acoplamiento Suzuki de ácidos arilborónicos con haluros de arilo y vinilo y triflatos en condiciones suaves". J. Am. Chem. Soc . 122 (17): 4020–4028. doi :10.1021/ja0002058.
- ^ Hu, Ming-Gang; Wei, Song; Jian, Ai-Ai (2007). "Reacción de acoplamiento de Suzuki catalizada por Pd/C de alta eficiencia de haluro de fenilo p-(no)sustituido con ácido borónico (fenilo p-sustituido)". Revista china de química . 25 (8): 1183–1186. doi :10.1002/cjoc.200790220.
- ^ Saito, B; Fu (2007). "Acoplamientos cruzados Suzuki alquilo-alquilo de haluros de alquilo secundarios no activados a temperatura ambiente". J. Am. Chem. Soc . 129 (31): 9602–9603. doi :10.1021/ja074008l. PMC 2569998. PMID 17628067 .
- ^ Kingston, JV; Verkade, John G. (2007). "Síntesis y caracterización de R2PNP(iBuNCH2CH2)3N: una nueva fosfina voluminosa rica en electrones para reacciones de acoplamiento cruzado Suzuki-Miyaura asistidas por Pd eficientes". J. Org. Chem . 72 (8): 2816–2822. doi :10.1021/jo062452l. PMID 17378611.
- ^ Baillie, C; Zhang, Lixin; Xiao, Jianliang (2004). "Ligandos de ferrocenil monofosfina: síntesis y aplicaciones en el acoplamiento Suzuki-Miyaura de cloruros de arilo". J. Org. Chem . 69 (22): 7779–7782. doi :10.1021/jo048963u. PMID 15498017.
- ^ Han, J; Liu, Y; Guo, R (2009). "Síntesis sencilla de nanopartículas de oro altamente estables y su inesperada y excelente actividad catalítica para la reacción de acoplamiento cruzado de Suzuki-Miyaura en agua". J. Am. Chem. Soc . 131 (6): 2060–2061. doi :10.1021/ja808935n. PMID 19170490.
- ^ Lipshutz, BH; Petersen, Tue B.; Abela, Alexander R. (2008). "Acoplamientos Suzuki−Miyaura a temperatura ambiente en agua facilitados por anfifilos no iónicos†". Org. Lett . 10 (7): 1333–1336. doi :10.1021/ol702714y. PMID 18335944.
Enlaces externos
- "Mecanismo en movimiento: Acoplamiento Suzuki". YouTube . 15 de diciembre de 2012.
- Acoplamiento Suzuki
- Un poco de boro y una pizca de paladio: una solución integral para la reacción de Suzuki