Enlace carbono-flúor
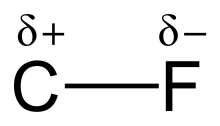
El enlace carbono-flúor es un enlace covalente polar entre el carbono y el flúor que es un componente de todos los compuestos organofluorados . Es uno de los enlaces simples más fuertes en química (después del enlace simple B-F , el enlace simple Si-F y el enlace simple H-F), y relativamente corto, debido a su carácter iónico parcial . El enlace también se fortalece y se acorta a medida que se agregan más flúor al mismo carbono en un compuesto químico . Como tal, los fluoroalcanos como el tetrafluorometano (tetrafluoruro de carbono) son algunos de los compuestos orgánicos menos reactivos .
Electronegatividad y fuerza de enlace
La alta electronegatividad del flúor (4,0 para el flúor frente a 2,5 para el carbono) proporciona al enlace carbono-flúor una polaridad o momento dipolar significativo . La densidad electrónica se concentra alrededor del flúor, lo que deja al carbono relativamente pobre en electrones. Esto introduce un carácter iónico al enlace a través de cargas parciales (C δ+ —F δ− ). Las cargas parciales del flúor y el carbono son atractivas, lo que contribuye a la inusual fuerza de enlace del enlace carbono-flúor. El enlace se etiqueta como "el más fuerte en química orgánica", [1] porque el flúor forma el enlace simple más fuerte con el carbono. Los enlaces carbono-flúor pueden tener una energía de disociación de enlace (BDE) de hasta 130 kcal/mol. [2] La BDE (fuerza del enlace) de C–F es mayor que otros enlaces carbono- halógeno y carbono- hidrógeno . Por ejemplo, los BDE del enlace C–X dentro de una molécula CH3 – X son 115, 104,9, 83,7, 72,1 y 57,6 kcal/mol para X = flúor, hidrógeno , cloro , bromo y yodo , respectivamente. [3]
Longitud del enlace
La longitud del enlace carbono-flúor es típicamente de alrededor de 1,35 ångström (1,39 Å en fluorometano ). [1] Es más corto que cualquier otro enlace carbono-halógeno, y más corto que los enlaces carbono- nitrógeno y carbono -oxígeno simples . La corta longitud del enlace también puede atribuirse al carácter iónico del enlace (las atracciones electrostáticas entre las cargas parciales en el carbono y el flúor). La longitud del enlace carbono-flúor varía en varias centésimas de ångstrom dependiendo de la hibridación del átomo de carbono y la presencia de otros sustituyentes en el carbono o incluso en átomos más alejados. Estas fluctuaciones pueden usarse como indicación de cambios sutiles de hibridación e interacciones estereoelectrónicas . La siguiente tabla muestra cómo varía la longitud de enlace promedio en diferentes entornos de enlace (los átomos de carbono están hibridados sp 3 a menos que se indique lo contrario para sp 2 o carbono aromático).
Vínculo Longitud media del enlace (Å) [4] CCH 2 F, C 2 CHF 1.399 C3CF 1.428 C2CF2 , H2CF2 , CCHF2 1.349 Marco común de cooperación 3 1.346 Número de FC 2 1.320 FCCF 1.371 C sp2F 1.340 Coche F 1.363 FC en C en F 1.340
La variabilidad en las longitudes de enlace y el acortamiento de los enlaces con flúor debido a su carácter iónico parcial también se observan para enlaces entre flúor y otros elementos, y han sido una fuente de dificultades con la selección de un valor apropiado para el radio covalente del flúor . Linus Pauling sugirió originalmente 64 pm , pero ese valor fue finalmente reemplazado por 72 pm, que es la mitad de la longitud del enlace flúor-flúor. Sin embargo, 72 pm es demasiado largo para ser representativo de las longitudes de los enlaces entre flúor y otros elementos, por lo que otros autores han sugerido valores entre 54 pm y 60 pm. [5] [6] [7] [8]
Efecto de la fuerza de enlace de los enlaces geminales
A medida que aumenta el número de átomos de flúor en el mismo carbono ( geminal ), los demás enlaces se vuelven más fuertes y más cortos. Esto se puede ver por los cambios en la longitud y fuerza de enlace (BDE) para la serie del fluorometano, como se muestra en la tabla siguiente; también, las cargas parciales ( q C y q F ) en los átomos cambian dentro de la serie. [2] La carga parcial en el carbono se vuelve más positiva a medida que se agregan flúor, lo que aumenta las interacciones electrostáticas y el carácter iónico entre los flúor y el carbono.
Compuesto Longitud del enlace CF (Å) BDE (kcal/mol) q C q F Canal 3 F 1.385 109,9 ± 1 0,01 -0,23 CH2F2 1.357 119,5 0,40 -0,23 3 francos suizos 1.332 127,5 0,56 -0,21 CF4 1.319 130,5 ± 3 0,72 -0,18
Efecto gauche

Cuando dos átomos de flúor están en carbonos vecinales (es decir, adyacentes), como en el 1,2-difluoroetano (H 2 FCCFH 2 ), el confórmero gauche es más estable que el confórmero anti; esto es lo opuesto a lo que normalmente se esperaría y a lo que se observa para la mayoría de los etanos 1,2-disustituidos; este fenómeno se conoce como el efecto gauche . [9] En el 1,2-difluoroetano, la conformación gauche es más estable que la conformación anti en 2,4 a 3,4 kJ/mol en la fase gaseosa. Sin embargo, este efecto no es exclusivo del flúor halógeno ; el efecto gauche también se observa para el 1,2-dimetoxietano . Un efecto relacionado es el efecto cis del alqueno . Por ejemplo, el isómero cis del 1,2-difluoroetileno es más estable que el isómero trans. [10]
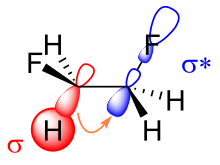
Existen dos explicaciones principales para el efecto gauche: hiperconjugación y enlaces doblados . En el modelo de hiperconjugación, la donación de densidad electrónica del orbital de enlace σ carbono-hidrógeno al orbital antienlazante σ * carbono-flúor se considera la fuente de estabilización en el isómero gauche. Debido a la mayor electronegatividad del flúor, el orbital σ carbono-hidrógeno es un mejor donante de electrones que el orbital σ carbono-flúor, mientras que el orbital σ * carbono-flúor es un mejor aceptor de electrones que el orbital σ * carbono-hidrógeno . Solo la conformación gauche permite una buena superposición entre el mejor donante y el mejor aceptor. [11]
La clave para explicar el efecto gauche en el difluoroetano es el aumento del carácter orbital p de ambos enlaces carbono-flúor debido a la gran electronegatividad del flúor. Como resultado, la densidad electrónica aumenta por encima y por debajo, a la izquierda y a la derecha del enlace carbono-carbono central. La superposición orbital reducida resultante se puede compensar parcialmente cuando se supone una conformación gauche, formando un enlace doblado. De estos dos modelos, la hiperconjugación se considera generalmente la causa principal detrás del efecto gauche en el difluoroetano. [1] [12]
Espectroscopia
El estiramiento del enlace carbono-flúor aparece en el espectro infrarrojo entre 1000 y 1360 cm −1 . El amplio rango se debe a la sensibilidad de la frecuencia de estiramiento a otros sustituyentes en la molécula. Los compuestos monofluorados tienen una banda fuerte entre 1000 y 1110 cm −1 ; con más de un átomo de flúor, la banda se divide en dos bandas, una para el modo simétrico y otra para el asimétrico. [13] Las bandas carbono-flúor son tan fuertes que pueden oscurecer cualquier banda carbono-hidrógeno que pueda estar presente. [14]
Los compuestos organofluorados también pueden caracterizarse mediante espectroscopia de RMN , utilizando carbono-13 , flúor-19 (el único isótopo natural del flúor) o hidrógeno-1 (si está presente). Los desplazamientos químicos en la RMN de 19 F aparecen en un rango muy amplio, dependiendo del grado de sustitución y del grupo funcional. La siguiente tabla muestra los rangos para algunas de las clases principales. [15]
Tipo de compuesto Rango de desplazamiento químico (ppm) relativo al CFCl 3 puro F–C=O −70 a −20 CF3 De +40 a +80 CF2 De +80 a +140 CF De +140 a +250 Arf De +80 a +170
Rompiendo enlaces C-F
La ruptura de enlaces C–F es de interés como una forma de descomponer y destruir los organofluorados " químicos para siempre " como el PFOA y los compuestos perfluorados (PFC). Los métodos candidatos incluyen catalizadores, como átomos de platino; [16] fotocatalizadores; UV, yoduro y sulfito, [17] radicales; etc.
Algunos complejos metálicos rompen enlaces CF. Estas reacciones son de interés desde la perspectiva de la síntesis orgánica y la remediación de sustancias xenoquímicas. [18] La activación del enlace CF se ha clasificado de la siguiente manera: "(i) adición oxidativa de fluorocarbono, (ii) formación de enlace M–C con eliminación de HF, (iii) formación de enlace M–C con eliminación de fluorosilano, (iv) hidrodesfluoración de fluorocarbono con formación de enlace M–F, (v) ataque nucleofílico al fluorocarbono y (vi) desfluoración de fluorocarbono". Una reacción ilustrativa de activación de CF mediada por metales es la desfluoración de fluorohexano por un dihidruro de zirconoceno :
- ( C5 ( CH3 ) 5 ) 2ZrH2 + FC6H13 → ( C5 ( CH3 ) 5 ) 2ZrH ( F ) + C6H14
Véase también
- Fluorocarbon
- Química de los organofluorados
- Enlace carbono-hidrógeno
- Enlace carbono-carbono
- Enlace carbono-nitrógeno
- Enlace carbono-oxígeno
Referencias
- ^ abc O'Hagan D (febrero de 2008). "Comprensión de la química de los organofluorados. Una introducción al enlace C–F". Chem Soc Rev . 37 (2): 308–19. doi :10.1039/b711844a. PMID 18197347.
- ^ ab Lemal, David M (2004). "Perspectiva sobre la química de los fluorocarbonos". J Org Chem . 69 (1): 1–11. doi :10.1021/jo0302556. PMID 14703372.
- ^ Blanksby SJ, Ellison GB (abril de 2003). "Energías de disociación de enlaces de moléculas orgánicas". Acc. Chem. Res . 36 (4): 255–63. CiteSeerX 10.1.1.616.3043 . doi :10.1021/ar020230d. PMID 12693923.
- ^ FH Allen, O. Kennard, DG Watson, L. Brammer, AG Orpen. Tablas de longitudes de enlace determinadas por difracción de rayos X y neutrones. Parte 1. Longitudes de enlace en compuestos orgánicos. J. Chem. Soc. Perkin Trans. II 1987 , S1–S19.
- ^ Gillespie Ronald; Robinson Edward (1992). "Longitudes de enlace en fluoruros covalentes. Un nuevo valor para el radio covalente del flúor". Química inorgánica . 31 (10): 1960–1963. doi :10.1021/ic00036a045.
- ^ Robinson Edward; Johnson Samuel; Tang Ting-Hua; Gillespie Ronald (1997). "Reinterpretación de las longitudes de los enlaces al flúor en términos de un modelo casi iónico". Química inorgánica . 36 (14): 3022–3030. doi :10.1021/ic961315b. PMID 11669953.
- ^ Cordero Beatriz; Gómez Verónica; Platero-Prats Ana E; Revés Marc; Echeverría Jorge; Cremades Eduard; Barragán Flavia; Álvarez Santiago (2008). "Radios covalentes revisados". Dalton Trans . 2008 (21): 2832–2838. doi :10.1039/b801115j. PMID 18478144. S2CID 244110.
- ^ Pyykkö P.; Atsumi M. (2009). "Radios covalentes de enlace simple molecular para los elementos 1-118". Química: una revista europea . 15 (1): 186–197. doi :10.1002/chem.200800987. PMID 19058281.
- ^ Craig, Norman C.; Chen, Anthony; Suh, Ki Hwan; Klee, Stefan; Mellau, Georg C.; Winnewisser, Brenda P.; Winnewisser, Manfred (1997). "Contribución al estudio del efecto Gauche. La estructura completa del antirrotámero de 1,2-difluoroetano". J. Am. Chem. Soc. 119 (20): 4789–4790. doi :10.1021/ja963819e.
- ^ Bingham, Richard C. (1976). "Las consecuencias estereoquímicas de la deslocalización de electrones en sistemas .pi. extendidos. Una interpretación del efecto cis exhibido por etilenos 1,2-disustituidos y fenómenos relacionados". J. Am. Chem. Soc. 98 (2): 535–540. doi :10.1021/ja00418a036.
- ^ Alabugin, IV Efectos estereoelectrónicos: el puente entre la estructura y la reactividad. John Wiley & Sons Ltd, Chichester, Reino Unido, 2016
- ^ Goodman, L.; Gu, H.; Pophristic, V (2005). "Efecto Gauche en 1,2-difluoroetano. Hiperconjugación, enlaces doblados, repulsión estérica". J. Phys. Chem. A . 109 (6): 1223–1229. Bibcode :2005JPCA..109.1223G. doi :10.1021/jp046290d. PMID 16833433.
- ^ George Socrates; Socrates (2001). Frecuencias de grupos característicos de infrarrojos y Raman: tablas y gráficos . John Wiley and Sons. pág. 198. ISBN 978-0-470-09307-8.
- ^ Barbara H. Stuart (2004). Espectroscopia infrarroja: fundamentos y aplicaciones . John Wiley and Sons. pág. 82. ISBN 978-0-470-85428-0.
- ^ "19F Chemical Shifts and Coupling Constants". 2 de abril de 1998. Archivado desde el original el 25 de junio de 2010. Consultado el 9 de noviembre de 2008 .
- ^ "Los átomos individuales rompen el enlace más fuerte del carbono". ScienceDaily .
- ^ "Tres ingredientes bastan para destruir rápidamente los PFAS, los 'químicos eternos' de uso generalizado". Noticias científicas . 3 de junio de 2022.
- ^ Perutz RN, Braun T (2007). "Activación del enlace C–F mediada por metales de transición". Química organometálica integral III . Vol. 1. págs. 725–758. doi :10.1016/B0-08-045047-4/00028-5. ISBN . 978-0-08-045047-6.