Reacción al demonio
| Reacción al demonio | |
|---|---|
| Llamado en honor a | Richard F. Heck |
| Tipo de reacción | Reacción de acoplamiento |
| Identificadores | |
| Portal de química orgánica | reacción de diablos |
| Identificación de ontología RSC | Número de receta: 0000024 |
La reacción de Heck (también llamada reacción de Mizoroki-Heck ) [1] es la reacción química de un haluro insaturado (o triflato ) con un alqueno en presencia de una base y un catalizador de paladio para formar un alqueno sustituido. Recibe su nombre en honor a Tsutomu Mizoroki y Richard F. Heck . Heck recibió el Premio Nobel de Química 2010 , que compartió con Ei-ichi Negishi y Akira Suzuki , por el descubrimiento y desarrollo de esta reacción. Esta reacción fue el primer ejemplo de una reacción de formación de enlaces carbono-carbono que siguió a un ciclo catalítico Pd(0)/Pd(II), el mismo ciclo catalítico que se observa en otras reacciones de acoplamiento cruzado catalizadas por Pd(0) . La reacción de Heck es una forma de sustituir alquenos. [2] [3] [4] [5]
 |
| La reacción de Heck |
|---|
Historia
La reacción original de Tsutomu Mizoroki (1971) describe el acoplamiento entre yodobenceno y estireno en metanol para formar estilbeno a 120 °C ( autoclave ) con base de acetato de potasio y catálisis de cloruro de paladio . Este trabajo fue una extensión del trabajo anterior de Fujiwara (1967) sobre el acoplamiento mediado por Pd(II) de arenos (Ar–H) y alquenos [6] [7] y del trabajo anterior de Heck (1969) sobre el acoplamiento de haluros arilmercúricos (ArHgCl) con alquenos utilizando una cantidad estequiométrica de una especie de paladio(II). [8]
 |
| Mizoroki 1971 |
|---|
En 1972, Heck reconoció la publicación de Mizoroki y detalló el trabajo que descubrió de forma independiente . Las condiciones de reacción de Heck difieren en términos del catalizador (acetato de paladio), la carga del catalizador (0,01 eq.), la base (amina impedida) y la ausencia de disolvente. [9] [10]
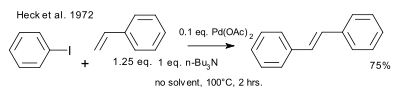 |
| Diablos, 1972 |
|---|
En 1974 Heck demostró que los ligandos de fosfina facilitaban la reacción. [11]
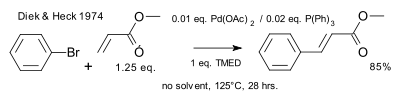 |
| Reacción de Heck 1974 fosfinas |
|---|
Catalizador y sustratos
La reacción está catalizada por complejos de paladio. Los catalizadores y precatalizadores típicos incluyen tetrakis(trifenilfosfina)paladio(0) , cloruro de paladio y acetato de paladio(II) . Los ligandos de soporte típicos son trifenilfosfina , PHOX y BINAP . Las bases típicas son trietilamina , carbonato de potasio y acetato de sodio .
El electrófilo arílico puede ser un haluro (Br, Cl) o un triflato, así como haluros de bencilo o vinilo . El alqueno debe contener al menos un enlace sp2 -CH. Los sustituyentes que atraen electrones mejoran la reacción, por lo que los acrilatos son ideales. [12]
Mecanismo de reacción
El mecanismo de esta vinilación implica intermediarios de organopaladio . El compuesto de paladio(0) requerido se genera a menudo in situ a partir de un precursor de paladio(II). [13] [14]
Por ejemplo, el acetato de paladio(II) se reduce mediante trifenilfosfina a bis(trifenilfosfina)paladio(0) ( 1 ) concomitante con la oxidación de trifenilfosfina a óxido de trifenilfosfina . El paso A es una adición oxidativa en la que el paladio se inserta en el enlace arilo-bromuro. El complejo de paladio(II) resultante se une entonces al alqueno ( 3 ). En el paso B, el alqueno se inserta en el enlace Pd-C en un paso de adición syn . El paso C implica una eliminación de beta-hidruro (aquí las flechas muestran lo opuesto) con la formación de un nuevo complejo π paladio-alqueno ( 5 ). Este complejo se destruye en el siguiente paso. El complejo Pd(0) se regenera mediante la eliminación reductora del compuesto de paladio(II) por carbonato de potasio en el paso final, D . En el transcurso de la reacción, el carbonato se consume estequiométricamente y el paladio es realmente un catalizador y se utiliza en cantidades catalíticas. En el proceso Wacker se observa un ciclo del paladio similar, pero con diferentes escenarios y actores .
 |
| Mecanismo de reacción del infierno |
|---|
Este ciclo no se limita a los compuestos vinílicos, en el acoplamiento de Sonogashira uno de los reactantes es un alquino y en el acoplamiento de Suzuki el alqueno es reemplazado por un ácido arilborónico y en la reacción de Stille por un aril estannano . El ciclo también se extiende al otro elemento del grupo 10, el níquel, por ejemplo en el acoplamiento de Negishi entre haluros de arilo y compuestos de organocinc. El platino forma enlaces fuertes con el carbono y no tiene actividad catalítica en este tipo de reacción.
Estereoselectividad
Esta reacción de acoplamiento es estereoselectiva con una propensión al acoplamiento trans a medida que el grupo haluro de paladio y el residuo orgánico voluminoso se alejan uno del otro en la secuencia de reacción en un paso de rotación. La reacción de Heck se aplica industrialmente en la producción de naproxeno y el componente de protección solar metoxicinamato de octilo . La síntesis de naproxeno incluye un acoplamiento entre un compuesto de naftaleno bromado con etileno : [15]
 |
| La reacción de Heck en la producción de naproxeno |
|---|
Variaciones
Reacción de Heck del líquido iónico
En presencia de un líquido iónico, se produce una reacción de Heck en ausencia de un ligando de fósforo. En una modificación, el acetato de paladio y el líquido iónico (bmim)PF6 se inmovilizan dentro de las cavidades de gel de sílice de fase inversa . [16] De esta manera, la reacción se produce en agua y el catalizador es reutilizable.
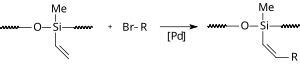 |
| Aplicación de siloxano |
|---|
¡Qué diablos es la oxiarilación!
En la modificación de oxiarilación de Heck, el sustituyente de paladio en el intermedio de adición sin es desplazado por un grupo hidroxilo y el producto de reacción contiene un anillo de dihidrofurano . [17]
 |
| ¡Qué diablos es la oxiarilación! |
|---|
Reacción de amino-heck
En la reacción de amino-Heck se forma un enlace nitrógeno - carbono . En un ejemplo, [18] una oxima con un grupo que atrae fuertemente electrones reacciona intramolecularmente con el extremo de un dieno para formar un compuesto de piridina . El catalizador es tetrakis(trifenilfosfina)paladio(0) y la base es trietilamina .
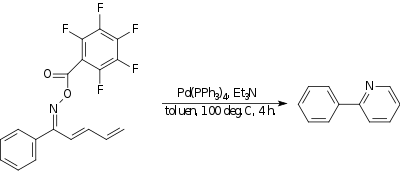 |
| Reacción de amino-heck |
|---|
Véase también
- Acoplamiento Hiyama
- Reacción de Stille
- Reacción de Suzuki
- Acoplamiento Sonogashira
- Reacción intramolecular de Heck
- Acoplamiento Negishi
Referencias
- ^ Drahl, Carmen (17 de mayo de 2010). "In Names, History And Legacy". Chem. Eng. News . 88 (22): 31–33. doi :10.1021/cen-v088n020.p031 . Consultado el 4 de junio de 2011 .
- ^ Heck, RF (1982). "Vinilación de haluros orgánicos catalizada por paladio". Org. React. 27 : 345–390. doi :10.1002/0471264180.or027.02. ISBN 978-0471264187.
- ^ de Meijere, A.; Meyer, FE (1994). "Las plumas finas hacen pájaros finos: la reacción de Heck en atuendo moderno". Angew. Chem. Int. Ed. Engl. 33 (2324): 2379–2411. doi :10.1002/anie.199423791.
- ^ Beletskaya, IP ; Cheprakov, AV (2000). "La reacción de Heck como piedra de afilar de la catálisis del paladio". Chem. Rev. 100 (8): 3009–3066. doi :10.1021/cr9903048. PMID 11749313.
- ^ Mc Cartney, Dennis; Guiry, Patrick J. (2011). "La reacción asimétrica de Heck y reacciones relacionadas". Chem. Soc. Rev. 40 (10): 5122–5150. doi :10.1039/C1CS15101K. PMID 21677934.
- ^ Moritani, Ichiro; Fujiwara, Yuzo (1967). "Sustitución aromática del complejo de cloruro de estireno-paladio". Tetrahedron Lett. 8 (12): 1119–1122. doi :10.1016/S0040-4039(00)90648-8.
- ^ Fujiwara, Yuzo; Noritani, Ichiro; Danno, Sadao; Asano, Ryuzo; Teranishi, Shiichiro (1969). "Sustitución aromática de olefinas. VI. Arilación de olefinas con acetato de paladio (II)". J. Am. Química. Soc. 91 (25): 7166–9. doi :10.1021/ja01053a047. PMID 27462934.
- ^ Richard F. Heck (1969). "Mecanismo de arilación y carbometoxilación de olefinas con compuestos de organopaladio". J. Am. Chem. Soc . 91 (24): 6707–6714. doi :10.1021/ja01052a029.
- ^ Heck, RF ; Nolley, JP (1972). "Reacciones de sustitución de hidrógeno vinílico catalizadas por paladio con haluros de arilo, bencilo y estirilo". J. Org. Chem. 37 (14): 2320–2322. doi :10.1021/jo00979a024.
- ^ Mizoroki, T.; Mori, K.; Ozaki, A. (1971). "Arilación de olefina con yoduro de arilo catalizada por paladio". Bull. Chem. Soc. Jpn. 44 (2): 581. doi :10.1246/bcsj.44.581.
- ^ Dieck, HA; Heck, RF (1974). "Complejos de organofosfinapaladio como catalizadores para reacciones de sustitución de hidrógeno vinílico". J. Am. Chem. Soc . 96 (4): 1133. doi :10.1021/ja00811a029.
- ^ Littke, AF; Fu, GC (2005). "Reacciones de Heck de cloruros de arilo catalizadas por paladio/tri-terc-butilfosfina: éster butílico del ácido (E)-2-metil-3-fenilacrílico y (E)-4-(2-feniletenil)benzonitrilo". Organic Syntheses . 81 : 63.
- ^ Ozawa, F.; Kubo, A.; Hayashi, T. (1992). "Generación de especies de Pd(0) coordinadas con fosfina terciaria a partir de Pd(OAc) 2 en la reacción catalítica de Heck". Chemistry Letters . 21 (11): 2177–2180. doi :10.1246/cl.1992.2177.
- ^ Bradshaw, Michael; Zou, Jianli; Byrne, Lindsay; Swaminathan Iyer, K.; Stewart, Scott G.; Raston, Colin L. (2011). "Esteras de nanofibras de quitosano conjugadas con Pd(II) para su aplicación en reacciones de acoplamiento cruzado de Heck". Química. 47 (45): 12292–12294. doi :10.1039/C1CC14717J. PMID 22011792.
- ^ De Vries; Johannes G. (2001). "La reacción de Heck en la producción de productos químicos finos". Can. J. Chem. 79 (5–6): 1086. doi :10.1139/cjc-79-5-6-1086.
- ^ Hagiwara, Hisahiro; Sugawara, Yoshitaka; Hoshi, Takashi; Suzuki, Toshio (2005). "Reacción sostenible de Mizoroki-Heck en agua: actividad notablemente alta de Pd(OAc) 2 inmovilizado en gel de sílice de fase inversa con la ayuda de un líquido iónico". Química Común. (23): 2942–2944. doi :10.1039/b502528a. PMID 15957033.
- ^ Lorand Kiss; Tibor Kurtan; Sandor Antus; Henri Brunner (2003). "Más información sobre el mecanismo de oxiarilación de Heck en presencia de ligandos quirales". Arkivoc : GB–653J.
- ^ Mitsuru Kitamura; Daisuke Kudo; Koichi Narasaka (2005). "Síntesis de piridinas catalizada por paladio(0) a partir de oximas de cetonas β-acetoxi-γ,δ-insaturadas". Arkivoc : JC–1563E.
Enlaces externos
- La reacción de Heck en organic-chemistry.org Artículo
