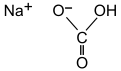
Bicarbonato de sodio
 | |||
| |||
 | |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC hidrogenocarbonato de sodio | |||
| Otros nombres Bicarbonato de sodio, bicarbonato (jerga de laboratorio), bicarbonato de sodio, nacolita , bicarbonato de sodio, natrón | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 4153970 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Banco de medicamentos | |||
| Tarjeta informativa de la ECHA | 100.005.122 | ||
| Número CE |
| ||
| Número E | E500(ii) (reguladores de acidez, ...) | ||
| |||
| BARRIL | |||
| Malla | Sodio+bicarbonato | ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| NaHCO 3 | |||
| Masa molar | 84,0066 g mol −1 | ||
| Apariencia | Cristales blancos | ||
| Olor | Inodoro | ||
| Densidad |
| ||
| Punto de fusión | (Se descompone en carbonato de sodio a partir de 50 °C [1] [6] ) | ||
| |||
| Solubilidad | 0,02 % en peso de acetona, 2,13 % en peso de metanol a 22 °C. [4] insoluble en etanol | ||
| registro P | -0,82 | ||
| Acidez (p K a ) |
| ||
Índice de refracción ( n D ) | nα = 1,377 nβ = 1,501 nγ = 1,583 | ||
| Estructura | |||
| Monoclínico | |||
| Termoquímica | |||
Capacidad calorífica ( C ) | 87,6 J/mol·K [7] | ||
Entropía molar estándar ( S ⦵ 298 ) | 101,7 J/mol·K [7] | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −950,8 kJ/mol [7] | ||
Energía libre de Gibbs (Δ f G ⦵ ) | −851,0 kJ/mol [7] | ||
| Farmacología | |||
| B05CB04 ( OMS ) B05XA02 ( OMS ), QG04BQ01 ( OMS ) | |||
| Intravenosa, oral | |||
| Peligros | |||
| Seguridad y salud en el trabajo (SST/OHS): | |||
Principales peligros | Provoca irritación ocular grave. | ||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | Incombustible | ||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 4220 mg/kg (rata, oral) [8] | ||
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad externa | ||
| Compuestos relacionados | |||
Otros aniones | Carbonato de sodio | ||
Otros cationes | |||
Compuestos relacionados | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||

El bicarbonato de sodio ( nombre IUPAC : bicarbonato de sodio [9] ), comúnmente conocido como bicarbonato de sodio o bicarbonato de sodio , es un compuesto químico con la fórmula NaHCO 3 . Es una sal compuesta por un catión sodio ( Na + ) y un anión bicarbonato ( HCO 3 − ). El bicarbonato de sodio es un sólido blanco que es cristalino pero que a menudo aparece como un polvo fino. Tiene un sabor ligeramente salado y alcalino parecido al de la soda de lavado ( carbonato de sodio ). La forma mineral natural es la nahcolita , aunque se encuentra más comúnmente como un componente del mineral trona . [10]
Como se sabe desde hace mucho tiempo y se utiliza ampliamente, la sal tiene muchos nombres diferentes, como bicarbonato de sodio, bicarbonato de sodio para pan, bicarbonato de sodio para cocinar, bicarbonato de sodio para preparar cerveza y bicarbonato de sodio, y a menudo se puede encontrar cerca del polvo para hornear en las tiendas. El término bicarbonato de sodio es más común en los Estados Unidos, mientras que bicarbonato de sodio es más común en Australia, el Reino Unido y Nueva Zelanda. [11] Las formas coloquiales abreviadas como bicarbonato de sodio , bicarbonato de sodio , bicarbonato y bicarbonato son comunes. [12]
El prefijo bi- en "bicarbonato" proviene de un sistema de nombres obsoleto que antecede al conocimiento molecular. Se basa en la observación de que hay el doble de carbonato (CO 3 −2 ) por sodio en el bicarbonato de sodio (NaHCO 3 ) que en el carbonato de sodio (Na 2 CO 3 ). [13] Las fórmulas químicas modernas de estos compuestos expresan ahora sus composiciones químicas precisas que eran desconocidas cuando se acuñó el nombre bicarbonato de potasa (véase también: bicarbonato ).
Usos
Cocinando
En la cocina, el bicarbonato de sodio se utiliza principalmente como agente leudante . Cuando reacciona con un ácido o se calienta, se libera dióxido de carbono, que provoca la expansión de la masa y forma la textura y el grano característicos de los pasteles, panes rápidos , pan de soda y otros alimentos horneados y fritos. Cuando se utiliza un ácido, la reacción ácido-base se puede representar de forma genérica de la siguiente manera: [14]
- NaHCO 3 + H + → Na + + H2CO3
Los materiales ácidos que inducen esta reacción incluyen fosfatos de hidrógeno , cremor tártaro , jugo de limón , yogur , suero de leche , cacao y vinagre . El bicarbonato de sodio se puede utilizar junto con masa madre , que es ácida, lo que da como resultado un producto más ligero con un sabor menos ácido. [15] Dado que la reacción ocurre lentamente a temperatura ambiente, las mezclas (masa de pastel, etc.) se pueden dejar reposar sin que suban hasta que se calienten en el horno. [ cita requerida ]
Un experimento científico conocido como "Volcán de bicarbonato de sodio y vinagre" utiliza la reacción con ácido de vinagre para imitar una erupción volcánica.
Si esta reacción se realiza dentro de un recipiente cerrado (como una botella) sin posibilidad de escape del gas, puede provocar una explosión si la presión es lo suficientemente alta.
El calor también puede por sí mismo hacer que el bicarbonato de sodio actúe como agente leudante en la cocción debido a la descomposición térmica , liberando dióxido de carbono a temperaturas superiores a 80 °C (180 °F), de la siguiente manera: [16]
- 2 NaHCO 3 → Na 2 CO 3 + H 2 O + CO 2
Cuando se utiliza de esta manera por sí solo, sin la presencia de un componente ácido (ya sea en la masa o mediante el uso de un polvo para hornear que contenga ácido), solo se libera la mitad del CO2 disponible (se forma una molécula de CO2 por cada dos equivalentes de NaHCO3 ) . Además, en ausencia de ácido, la descomposición térmica del bicarbonato de sodio también produce carbonato de sodio , que es fuertemente alcalino y le da al producto horneado un sabor amargo y jabonoso y un color amarillo.
Levadura en polvo
El polvo de hornear , que también se vende para cocinar, contiene alrededor de un 30% de bicarbonato y varios ingredientes ácidos que se activan con la adición de agua, sin necesidad de ácidos adicionales en el medio de cocción. [17] [18] [19] Muchas formas de polvo de hornear contienen bicarbonato de sodio combinado con fosfato ácido de calcio , fosfato de aluminio y sodio o crémor tártaro . [20] El bicarbonato de sodio es alcalino; el ácido utilizado en el polvo de hornear evita un sabor metálico cuando el cambio químico durante el horneado crea carbonato de sodio. [21]
Aditivo alimentario
A menudo se utiliza junto con otros aditivos alimentarios de agua embotellada para agregar sabor. [22] Su número E de la Unión Europea es E500. [23]
Pirotécnica
El bicarbonato de sodio es uno de los componentes principales de los fuegos artificiales conocidos como "serpiente negra" . El efecto es causado por la descomposición térmica, que produce dióxido de carbono gaseoso para producir una ceniza larga con forma de serpiente como producto de la combustión del otro componente principal, la sacarosa . [24] El bicarbonato de sodio también retrasa las reacciones de combustión mediante la liberación de dióxido de carbono y agua, ambos retardantes de llama, cuando se calienta.
Desinfectante suave
Tiene propiedades desinfectantes débiles [25] [26] y puede ser un fungicida eficaz contra algunos organismos. [27] Como el bicarbonato de sodio absorbe los olores a humedad, se ha convertido en un método confiable para los vendedores de libros usados para hacer que los libros sean menos malolientes. [28]
Extintor de incendios
El bicarbonato de sodio se puede utilizar para extinguir pequeños incendios de grasa o eléctricos arrojándolo sobre el fuego, ya que el calentamiento del bicarbonato de sodio libera dióxido de carbono. [29] Sin embargo, no se debe aplicar a incendios en freidoras ; la liberación repentina de gas puede hacer que la grasa salpique. [29] El bicarbonato de sodio se utiliza en extintores de incendios químicos secos BC como una alternativa al fosfato monoamónico más corrosivo en los extintores ABC. La naturaleza alcalina del bicarbonato de sodio lo convierte en el único agente químico seco, además de Purple-K , que se utilizó en sistemas de extinción de incendios a gran escala instalados en cocinas comerciales. [30]
El bicarbonato de sodio tiene varios mecanismos de extinción de incendios que actúan simultáneamente. Se descompone en agua y dióxido de carbono cuando se calienta, una reacción endotérmica que priva al fuego de calor. Además, forma intermediarios que pueden eliminar los radicales libres que son responsables de la propagación del fuego . [31] En el caso de los incendios de grasa , en particular, también tiene un efecto de saponificación suave , produciendo una espuma jabonosa que puede ayudar a sofocar el fuego. [30]
Neutralización de ácidos
El bicarbonato de sodio reacciona espontáneamente con los ácidos, liberando gas CO2 como producto de reacción. Se utiliza comúnmente para neutralizar soluciones ácidas no deseadas o derrames de ácidos en laboratorios químicos. [32] No es apropiado utilizar bicarbonato de sodio para neutralizar bases [33] a pesar de que es anfótero y reacciona tanto con ácidos como con bases. [34]
Suplemento deportivo
El bicarbonato de sodio se toma como suplemento deportivo para mejorar la resistencia muscular. [35] Estudios realizados principalmente en hombres han demostrado que el bicarbonato de sodio es más eficaz para mejorar el rendimiento en actividades de alta intensidad y de corta duración. [36]
Agricultura
El bicarbonato de sodio puede prevenir el crecimiento de hongos cuando se aplica sobre las hojas, aunque no los mata. Las cantidades excesivas de bicarbonato de sodio pueden causar decoloración de las frutas (solución al dos por ciento) y clorosis (solución al uno por ciento). [37]
Usos médicos y salud
El bicarbonato de sodio mezclado con agua se puede utilizar como antiácido para tratar la indigestión ácida y la acidez estomacal . [38] [39] Su reacción con el ácido del estómago produce sal , agua y dióxido de carbono :
- NaHCO 3 + HCl → NaCl + H 2 O + CO 2 (g)
Una mezcla de bicarbonato de sodio y polietilenglicol como PegLyte, [40] disuelta en agua y tomada por vía oral, es una preparación eficaz para el lavado gastrointestinal y un laxante antes de una cirugía gastrointestinal, gastroscopia , etc. [ cita requerida ]
El bicarbonato de sodio intravenoso en una solución acuosa se utiliza a veces para casos de acidosis , o cuando no hay suficientes iones de sodio o bicarbonato en la sangre. [41] En casos de acidosis respiratoria, el ion de bicarbonato infundido empuja el tampón de ácido carbónico/bicarbonato del plasma hacia la izquierda y, por lo tanto, aumenta el pH. Por esta razón, el bicarbonato de sodio se utiliza en la reanimación cardiopulmonar bajo supervisión médica . La infusión de bicarbonato está indicada solo cuando el pH de la sangre es notablemente bajo (< 7,1–7,0). [42]
El HCO 3 − se utiliza para el tratamiento de la hipercalemia , ya que hará que el K + vuelva a las células durante los períodos de acidosis. [43] Dado que el bicarbonato de sodio puede causar alcalosis , a veces se utiliza para tratar las sobredosis de aspirina. La aspirina requiere un entorno ácido para una absorción adecuada, y un entorno básico disminuirá la absorción de aspirina en casos de sobredosis. [44] El bicarbonato de sodio también se ha utilizado en el tratamiento de la sobredosis de antidepresivos tricíclicos . [45] También se puede aplicar tópicamente como una pasta, con tres partes de bicarbonato de sodio por una parte de agua, para aliviar algunos tipos de picaduras y mordeduras de insectos (así como la hinchazón que las acompaña). [46]
Algunos médicos alternativos, como Tullio Simoncini , han promovido el bicarbonato de sodio como cura para el cáncer, algo contra lo que la Sociedad Estadounidense del Cáncer ha advertido debido a su eficacia no probada y al peligro potencial de su uso. [47] Edzard Ernst ha calificado la promoción del bicarbonato de sodio como cura para el cáncer como "una de las estafas alternativas contra el cáncer más repugnantes que he visto en mucho tiempo". [48]
El bicarbonato de sodio se puede añadir a los anestésicos locales para acelerar la aparición de sus efectos y hacer que su inyección sea menos dolorosa. [49] También es un componente de la solución de Moffett , utilizada en cirugía nasal . [50]
Se ha propuesto que las dietas ácidas debilitan los huesos. [51] Un metaanálisis sistemático de la investigación no muestra tal efecto. [52] Otro también concluye que no hay evidencia de que las dietas alcalinas mejoren la salud ósea, pero sugiere que las dietas alcalinas "pueden tener algún valor" por otras razones. [53]
Los manifestantes han preparado y utilizado soluciones antiácidas (como bicarbonato de sodio) para aliviar los efectos de la exposición a los gases lacrimógenos durante las protestas. [ verificación fallida ] [54]
De manera similar a su uso en repostería, el bicarbonato de sodio se utiliza junto con un ácido suave como el ácido tartárico como excipiente en comprimidos efervescentes: cuando se vierte dicho comprimido en un vaso de agua, el carbonato abandona el medio de reacción en forma de gas dióxido de carbono (HCO 3 − + H + → H 2 O + CO 2 ↑ o, más precisamente, HCO 3 − + H 3 O + → 2 H 2 O + CO 2 ↑). Esto hace que el comprimido se desintegre, quedando el medicamento suspendido y/o disuelto en el agua junto con la sal resultante (en este ejemplo, tartrato de sodio ). [55]
Higiene personal
El bicarbonato de sodio también se utiliza como ingrediente en algunos enjuagues bucales. Tiene propiedades anticaries y abrasivas. [56] Funciona como un limpiador mecánico en los dientes y las encías, neutraliza la producción de ácido en la boca y también actúa como un antiséptico para ayudar a prevenir infecciones. [57] [58] El bicarbonato de sodio en combinación con otros ingredientes se puede utilizar para hacer un desodorante seco o húmedo . [59] [60] El bicarbonato de sodio se puede utilizar como un agente amortiguador , combinado con sal de mesa, al crear una solución para irrigación nasal . [61]
Se utiliza en la higiene ocular para tratar la blefaritis . Esto se hace añadiendo una cucharadita de bicarbonato de sodio a agua fría que se haya hervido recientemente y luego frotando suavemente la base de las pestañas con un hisopo de algodón humedecido en la solución. [62] [63]
Usos veterinarios
El bicarbonato de sodio se utiliza como suplemento alimenticio para el ganado, en particular como agente amortiguador para el rumen . [64]
Agente de limpieza
El bicarbonato de sodio se utiliza en un proceso para eliminar pintura y corrosión llamado chorro de arena con soda . Como medio de limpieza, el bicarbonato de sodio se utiliza para eliminar la contaminación de la superficie de sustratos más blandos y menos resistentes , como el aluminio, el cobre o la madera, que podrían resultar dañados por los medios abrasivos de arena de sílice. [65]
Un fabricante recomienda una pasta hecha de bicarbonato de sodio con un mínimo de agua como un polvo limpiador suave. [29] Esta pasta puede ser útil para eliminar el óxido de la superficie porque el óxido forma un compuesto soluble en agua cuando está en una solución alcalina concentrada. [66] Se debe utilizar agua fría, ya que las soluciones de agua caliente pueden corroer el acero. [67] El bicarbonato de sodio ataca la fina capa protectora de óxido que se forma en el aluminio, lo que lo hace inadecuado para limpiar este metal. [68] Una solución en agua tibia eliminará el deslustre de la plata cuando la plata está en contacto con un trozo de papel de aluminio . [68] [69] El bicarbonato de sodio se añade comúnmente a las lavadoras como sustituto del suavizante de agua y para eliminar los olores de la ropa. Cuando se diluye con agua tibia, también es casi tan eficaz para eliminar manchas fuertes de té y café de las tazas como el hidróxido de sodio .
Durante el Proyecto Manhattan para desarrollar la bomba nuclear a principios de la década de 1940, la toxicidad química del uranio fue un problema. Se descubrió que los óxidos de uranio se adhieren muy bien a la tela de algodón y no se eliminan con jabón o detergente para ropa . Sin embargo, el uranio se elimina con una solución al 2% de bicarbonato de sodio. La ropa puede contaminarse con polvo tóxico de uranio empobrecido (DU), que es muy denso, por lo que se utiliza para contrapesos en un contexto civil y en proyectiles perforantes. El DU no se elimina con un lavado normal; lavar con aproximadamente 6 onzas (170 g) de bicarbonato de sodio en 2 galones (7,5 L) de agua ayudará a eliminarlo. [70]
Control de olores
A menudo se afirma que el bicarbonato de sodio es un eliminador de olores eficaz [71] [ se necesita una mejor fuente ] y se recomienda mantener una caja abierta en el refrigerador para absorber el olor. [72] Esta idea fue promovida por la marca líder estadounidense de bicarbonato de sodio, Arm & Hammer , en una campaña publicitaria que comenzó en 1972. [73] Aunque esta campaña se considera un clásico del marketing, que llevó en un año a que más de la mitad de los refrigeradores estadounidenses contuvieran una caja de bicarbonato de sodio, [74] [75] hay poca evidencia de que sea eficaz en esta aplicación. [76] [77]
Química

El bicarbonato de sodio es un compuesto anfótero . [34] Las soluciones acuosas son ligeramente alcalinas debido a la formación de ácido carbónico e iones hidróxido : [34]
- OHC−
3+ H2O → H
2CO
3+ OH-
El bicarbonato de sodio a veces se puede utilizar como un agente de neutralización suave y una alternativa más segura a las bases fuertes como el hidróxido de sodio . [78] La reacción del bicarbonato de sodio y un ácido produce una sal y ácido carbónico, que se descompone fácilmente en dióxido de carbono y agua: [78]
- NaHCO3 + HCl → NaCl + H2O + CO2
- H2CO3 → H2O + CO2 ( g )
El bicarbonato de sodio reacciona con el ácido acético (que se encuentra en el vinagre), produciendo acetato de sodio , agua y dióxido de carbono :
- NaHCO 3 + CH 3 COOH → CH 3 COONa + H 2 O + CO 2 (g)
El bicarbonato de sodio reacciona con bases como el hidróxido de sodio para formar carbonatos:
- NaHCO 3 + NaOH → Na 2 CO 3 + H 2 O
Descomposición térmica
A temperaturas de 80 a 100 °C (176 a 212 °F), el bicarbonato de sodio se descompone gradualmente en carbonato de sodio , agua y dióxido de carbono. La conversión es más rápida a 200 °C (392 °F): [79]
- 2 NaHCO 3 → Na 2 CO 3 + H 2 O + CO 2
La mayoría de los bicarbonatos sufren esta reacción de deshidratación . Un calentamiento posterior convierte el carbonato en óxido (por encima de los 850 °C/1560 °F): [79]
- Na2CO3 → Na2O + CO2
La generación de dióxido de carbono y agua explica parcialmente las propiedades extintoras de incendios del NaHCO 3 , [30] aunque otros factores como la absorción de calor y la eliminación de radicales son más significativos. [31]
Ocurrencia natural
En la naturaleza, el bicarbonato de sodio se presenta casi exclusivamente como nahcolita o trona . La trona es más común, ya que la nahcolita es más soluble en agua y el equilibrio químico entre los dos minerales favorece a la trona. [10] Los depósitos importantes de nahcolita se encuentran en los Estados Unidos, Botsuana y Kenia, Uganda, Turquía y México. [80] Los depósitos de trona más grandes se encuentran en la cuenca del río Green en Wyoming. [81]
La nacolita se encuentra a veces como un componente de la pizarra bituminosa . [82]
Estabilidad y vida útil
Si se mantiene fresco ( temperatura ambiente ) y seco (se recomienda un recipiente hermético para evitar la entrada de aire húmedo), el bicarbonato de sodio se puede conservar sin una cantidad significativa de descomposición durante al menos dos o tres años. [83] [84] [85] [86]
Historia
La palabra natrón se ha utilizado en muchos idiomas a lo largo de los tiempos modernos (en las formas de anatron , natrum y natron ) y se originó (como el español , francés e inglés natron así como ' sodio ') a través del árabe naṭrūn (o anatrūn ; cf. el Bajo Egipto “Natrontal” Wadi El Natrun , donde se utilizó una mezcla de carbonato de sodio e hidrogenocarbonato de sodio para la deshidratación de momias [87] ) del griego nítron (νίτρον) (Heródoto; ático lítron (λίτρον) ), que se remonta al antiguo egipcio ntr . El griego nítron (soda, salitre) también se utilizó en latín (sal) nitrum y en alemán Salniter (la fuente de nitrógeno , nitrato , etc.). [88] [89] La palabra saleratus , del latín sal æratus (que significa "sal aireada"), fue ampliamente utilizada en el siglo XIX tanto para el bicarbonato de sodio como para el bicarbonato de potasio . [90]
En 1791, el químico francés Nicolas Leblanc produjo carbonato de sodio (también conocido como carbonato de sodio). Al farmacéutico Valentin Rose el Joven se le atribuye el descubrimiento del bicarbonato de sodio en 1801 en Berlín. En 1846, dos panaderos estadounidenses, John Dwight y Austin Church , establecieron la primera fábrica en los Estados Unidos para producir bicarbonato de sodio a partir de carbonato de sodio y dióxido de carbono . [91]
El saleratus , bicarbonato de potasio o sodio, se menciona en la novela Capitanes Intrépidos de Rudyard Kipling como un producto ampliamente utilizado en la pesca comercial en el siglo XIX para evitar que el pescado recién capturado se estropeara. [92]
En 1919, el senador estadounidense Lee Overman declaró que el bicarbonato de sodio podía curar la gripe española . En medio del debate del 26 de enero de 1919, interrumpió la discusión para anunciar el descubrimiento de una cura. "Quiero decir, para beneficio de quienes están haciendo esta investigación", informó, "que un juez de un tribunal superior en la región montañosa de Carolina del Norte me dijo que habían descubierto un remedio para esta enfermedad". La supuesta cura implicaba una crítica de la ciencia moderna y una apreciación de la sabiduría sencilla de la gente sencilla. "Dicen que el bicarbonato de sodio común curará la enfermedad", continuó, "que la han curado con él, que no hay muertes allí en absoluto; usan bicarbonato de sodio común, que cura la enfermedad". [93]
Producción
El bicarbonato de sodio se produce industrialmente a partir de carbonato de sodio : [94]
- Na 2 CO 3 + CO 2 + H 2 O → 2 NaHCO 3
Se produce en una escala de aproximadamente 100.000 toneladas/año (a partir de 2001) [ dudoso – discutir ] [95] con una capacidad de producción mundial de 2,4 millones de toneladas por año (a partir de 2002). [96] También se producen cantidades comerciales de bicarbonato de sodio mediante un método similar: el carbonato de sodio, extraído en forma de mineral trona , se disuelve en agua y se trata con dióxido de carbono. El bicarbonato de sodio precipita como un sólido a partir de esta solución. [ cita requerida ]
En el proceso Solvay , el bicarbonato de sodio es un intermediario en la reacción del cloruro de sodio , el amoníaco y el dióxido de carbono . Sin embargo, el producto muestra una baja pureza (75 %). [ cita requerida ]
Aunque no tiene valor práctico, el NaHCO 3 se puede obtener mediante la reacción del dióxido de carbono con una solución acuosa de hidróxido de sodio: [ cita requerida ]
- CO2 + NaOH → NaHCO3
Minería
Los depósitos naturales de nahcolita (NaHCO 3 ) se encuentran en la Formación Green River de la era del Eoceno (55,8–33,9 millones de años) en la cuenca de Piceance , en Colorado . La nahcolita se depositó en forma de lechos durante períodos de alta evaporación en la cuenca. Se extrae comercialmente utilizando técnicas comunes de minería subterránea, como la minería de perforación, de tambor y de tajo largo, de una manera muy similar a la minería de carbón. [ cita requerida ]
También se produce mediante minería de solución, bombeando agua caliente a través de lechos de nacolita y cristalizando la nacolita disuelta mediante un proceso de cristalización por enfriamiento.
Dado que la nacolita a veces se encuentra en la pizarra , se puede producir como un coproducto de la extracción de petróleo de esquisto , donde se recupera mediante minería de solución. [82]
En la cultura popular
El bicarbonato de sodio, como "bicarbonato de sodio", fue una fuente frecuente de frases ingeniosas para Groucho Marx en las películas de los Hermanos Marx . En Sopa de ganso , Marx interpreta al líder de una nación en guerra. En una escena, recibe un mensaje del campo de batalla de que su general está informando de un ataque con gas, y Groucho le dice a su ayudante: "Dígale que tome una cucharadita de bicarbonato de sodio y medio vaso de agua". [97] En Una noche en la ópera , el personaje de Groucho se dirige a la multitud de la noche de apertura de una ópera diciendo del tenor principal: "El signor Lassparri proviene de una familia muy famosa. Su madre era una conocida cantante de bajo. Su padre fue el primer hombre en rellenar espaguetis con bicarbonato de sodio, causando y curando así la indigestión al mismo tiempo". [98]
En el clásico de Joseph L. Mankewicz All About Eve , el personaje de Max Fabian ( Gregory Ratoff ) tiene una escena extensa con Margo Channing ( Bette Davis ) en la que, sufriendo acidez de estómago, pide y luego bebe bicarbonato de sodio, lo que le provoca un eructo prominente. Channing promete tener siempre una caja de bicarbonato con el nombre de Max.
Véase también
Referencias
- ^ de Haynes, pág. 4.90
- ^ abc Haynes, pág. 5.194
- ^ abc «Bicarbonato de sodio» (PDF) . Programa de las Naciones Unidas para el Medio Ambiente . Archivado desde el original (PDF) el 16 de mayo de 2011.
- ^ Ellingboe JL, Runnels JH (1966). "Solubilidades del carbonato de sodio y bicarbonato de sodio en mezclas de acetona-agua y metanol-agua". J. Chem. Eng. Data . 11 (3): 323–324. doi :10.1021/je60030a009.
- ^ de Haynes, pág. 7.23
- ^ Pasquali I, Bettini R, Giordano F (2007). "Comportamiento térmico de composiciones de diclofenaco, diclofenaco sódico y bicarbonato de sodio". Revista de análisis térmico y calorimetría . 90 (3): 903–907. doi :10.1007/s10973-006-8182-1. S2CID 95695262.
- ^ abcd Haynes, pág. 5.19
- ^ Griffith JF (1964). "Variaciones interlaboratorio en la determinación de la DL50 oral aguda". Toxicología y farmacología aplicada . 6 (6): 726–730. doi :10.1016/0041-008X(64)90124-3. PMID 14235840.
- ^ Nomenclatura de la química inorgánica Recomendaciones de la IUPAC 2005 (PDF) , IUPAC, p. 137, archivado (PDF) desde el original el 18 de mayo de 2017
- ^ ab Gärtner RS, Witkamp GJ (agosto de 2007). "Recristalización reactiva con disolventes mixtos de trona (sesquicarbonato de sodio) en soda (carbonato de sodio anhidro)". Hidrometalurgia . 88 (1–4): 75–91. Código Bibliográfico :2007HydMe..88...75G. doi :10.1016/j.hydromet.2007.03.006.
- ^ "¿Polvo para hornear, bicarbonato de sodio o bicarbonato de sodio?". Reader's Digest Australia . Consultado el 2 de junio de 2024 .
- ^ PubChem. «Bicarbonato de sodio». pubchem.ncbi.nlm.nih.gov . Consultado el 25 de enero de 2021 .
- ^ Wollaston WH (enero de 1814). "I. Una escala sinóptica de equivalentes químicos". Philosophical Transactions of the Royal Society of London . 104 : 1–22. doi :10.1098/rstl.1814.0001. S2CID 96774986.
- ^ Bent AJ, ed. (1997). La tecnología de la elaboración de pasteles (6.ª ed.). Springer. pág. 102. ISBN 9780751403497. Consultado el 12 de agosto de 2009 .
- ^ Cascio J. "Sourdough" (PDF) . Servicio de Extensión Cooperativa de la Universidad de Alaska Fairbanks . FNH-00061. Archivado desde el original (PDF) el 27 de marzo de 2016 . Consultado el 2 de mayo de 2017 .
- ^ "Los múltiples usos prácticos del bicarbonato de sodio en la cocina". About.com Food . Archivado desde el original el 2 de febrero de 2017. Consultado el 22 de enero de 2017 .
- ^ Czernohorsky JH, Hooker R. "La química de la repostería" (PDF) . Instituto de Química de Nueva Zelanda. Archivado desde el original (PDF) el 27 de noviembre de 2016. Consultado el 22 de enero de 2017 .
- ^ "Bicarbonato de sodio y polvo para hornear". FineCooking.com . Archivado desde el original el 2 de febrero de 2017. Consultado el 22 de enero de 2017 .
- ^ "Preguntas frecuentes sobre el bicarbonato de sodio". Arm & Hammer Multi-Brand . Church & Dwight Company. ¿Cuál es la diferencia entre el bicarbonato de sodio y el polvo para hornear? Archivado desde el original el 27 de junio de 2017. Consultado el 20 de julio de 2017 .
- ^ "Glosario de ingredientes". Cooking.com. Archivado desde el original el 15 de septiembre de 2008.
- ^ "Bicarbonato de sodio". BRP Adhikary . 11 de julio de 2016 . Consultado el 25 de enero de 2021 .
- ^ Stanek B (24 de julio de 2014). "Por qué el agua embotellada contiene cuatro ingredientes diferentes". TIME .
- ^ "Aditivos aprobados y números E". Agencia de Normas Alimentarias . Consultado el 7 de diciembre de 2020 .
- ^ "Serpiente de azúcar". MEL Science . MEL Science 2015–2019. Archivado desde el original el 6 de octubre de 2019 . Consultado el 28 de octubre de 2019 .
- ^ Malik YS, Goyal SM (mayo de 2006). "Eficacia virucida del bicarbonato de sodio en una superficie de contacto con alimentos contra el calicivirus felino, un sustituto del norovirus". Revista internacional de microbiología de los alimentos . 109 (1–2): 160–3. doi :10.1016/j.ijfoodmicro.2005.08.033. PMID 16540196.
- ^ Rutala WA, Barbee SL, Aguiar NC, Sobsey MD, Weber DJ (enero de 2000). "Actividad antimicrobiana de desinfectantes domésticos y productos naturales contra posibles patógenos humanos". Control de infecciones y epidemiología hospitalaria . 21 (1): 33–8. doi :10.1086/501694. PMID 10656352. S2CID 34461187.
- ^ Zamani M, Sharifi Tehrani A, Ali Abadi AA (2007). "Evaluación de la actividad antifúngica de las sales de carbonato y bicarbonato solas o en combinación con agentes de biocontrol para el control del moho verde de los cítricos". Communications in Agricultural and Applied Biological Sciences . 72 (4): 773–7. PMID 18396809.
- ^ Altman G (22 de mayo de 2006). "Reparación de libros para BookThinkers: Cómo eliminar olores de los libros". The BookThinker (69).
- ^ abc "Arm & Hammer Baking Soda – Basics – The Magic of Arm & Hammer Baking Soda". armandhammer.com . Archivado desde el original el 31 de agosto de 2009. Consultado el 30 de julio de 2009 .
- ^ abc Voelkert JC (2015). "Fuego y extinción de incendios: una breve guía sobre la química del fuego y la teoría de la extinción para técnicos de servicio de equipos contra incendios" (PDF) . pp. 14–15. Archivado desde el original (PDF) el 31 de mayo de 2024. Consultado el 22 de septiembre de 2023 .
- ^ ab Liu Y, Zhang Y, Meng X, Yan K, Wang Z, Liu J, Wang Z, Yang P, Dai W, Li F (abril de 2022). "Investigación sobre la propagación de la llama y la sobrepresión de la explosión de polvo de esquisto bituminoso mediante supresión de explosiones con NaHCO3". Fuel . 314 : 122778. Bibcode :2022Fuel..31422778L. doi :10.1016/j.fuel.2021.122778.
- ^ "Prepárese para emergencias ante peligros no controlados". Sociedad Química Estadounidense.
- ^ Hurum D. "Seguridad en el laboratorio" (PDF) . Ingeniería civil . Universidad Northwestern.
- ^ abc Davidson D (noviembre de 1955). "Moléculas, iones y sales anfóteras". Journal of Chemical Education . 32 (11): 550. Bibcode :1955JChEd..32..550D. doi :10.1021/ed032p550. ISSN 0021-9584.
- ^ Grgic J, Rodriguez RF, Garofolini A, Saunders B, Bishop DJ, Schoenfeld BJ, Pedisic Z (julio de 2020). "Efectos de la suplementación con bicarbonato de sodio en la fuerza y la resistencia muscular: una revisión sistemática y un metanálisis". Medicina deportiva . 50 (7): 1361–1375. doi :10.1007/s40279-020-01275-y. PMID 32096113. S2CID 211254185.
- ^ Grgic J, Grgic I, Pedisic Z (2021). "Efectos de la suplementación con bicarbonato de sodio en el rendimiento deportivo: una revisión general". Revista de la Sociedad Internacional de Nutrición Deportiva . 18 (1): 71. doi : 10.1186/s12970-021-00469-7 . PMC 8600864 . PMID 34794476.
- ^ "Mitos de la horticultura". Departamento de Ciencias Vegetales y del Suelo de la Extensión de la Universidad de Vermont . Archivado desde el original el 7 de agosto de 2019. Consultado el 18 de octubre de 2021 .
- ^ "Bicarbonato de sodio". Jackson Siegelbaum Gastroenterology. 1998. Archivado desde el original el 5 de octubre de 2016 . Consultado el 4 de octubre de 2016 .
- ^ "Efectos secundarios del bicarbonato de sodio (vía oral, vía intravenosa, vía subcutánea) - Mayo Clinic" www.mayoclinic.org . Consultado el 5 de mayo de 2023 .
- ^ "PegLyte". Pendo Phama .
- ^ "Infusión intravenosa de bicarbonato de sodio" (PDF) . Información sobre medicamentos para el consumidor . Better Health Channel. 13 de julio de 2004. Archivado desde el original (PDF) el 22 de agosto de 2008.
- ^ "Acidosis respiratoria: tratamiento y medicación". emedicine. 26 de marzo de 2020.
- ^ Dart RC (2004). Toxicología médica. Lippincott Williams & Wilkins. pp. 910–. ISBN 978-0-7817-2845-4.
- ^ Pañales de tela. Donald C. Cooper PhD. págs. 46–.
- ^ [ necesita actualización ] Knudsen K, Abrahamsson J (abril de 1997). "La epinefrina y el bicarbonato de sodio aumentan de forma independiente y aditiva la supervivencia en casos de intoxicación experimental por amitriptilina". Medicina de cuidados críticos . 25 (4): 669–74. doi :10.1097/00003246-199704000-00019. PMID 9142034.
- ^ "Picaduras y mordeduras de insectos: primeros auxilios". Clínica Mayo. 15 de enero de 2008.
- ^ "Bicarbonato de sodio". Sociedad Estadounidense del Cáncer . 28 de noviembre de 2008. Archivado desde el original el 19 de febrero de 2013. Consultado el 19 de febrero de 2013 .
{{cite web}}: CS1 maint: URL no apta ( enlace ) - ^ Ernst E (3 de febrero de 2017). "Esta debe ser la estafa más repugnante que he visto en mucho tiempo".
- ^ Edgcombe H, Hocking G (6 de octubre de 2006). "Farmacología de anestésicos locales". Anaesthesia UK . Archivado desde el original el 22 de diciembre de 2015.
- ^ Benjamin E, Wong D, Choa D (2004). "La solución de 'Moffett': una revisión de la evidencia y la base científica para la preparación tópica de la nariz". Otorrinolaringología clínica y ciencias afines . 29 (6): 582–587. doi : 10.1111/j.1365-2273.2004.00894.x . PMID 15533141.
- ^ Fox D (15 de diciembre de 2001). «Queso duro». New Scientist . Consultado el 20 de julio de 2017 .
- ^ Fenton TR, Tough SC, Lyon AW, Eliasziw M, Hanley DA (2011). "Evaluación causal de la carga ácida de la dieta y la enfermedad ósea: una revisión sistemática y un metanálisis aplicando los criterios epidemiológicos de Hill para la causalidad". Nutrition Journal . 10 : 41. doi : 10.1186/1475-2891-10-41 . PMC 3114717 . PMID 21529374.
- ^ Schwalfenberg GK (2012). "La dieta alcalina: ¿Existe evidencia de que una dieta con pH alcalino beneficia la salud?". Journal of Environmental and Public Health . 2012 : 1–7. doi : 10.1155/2012/727630 . PMC 3195546 . PMID 22013455.
- ^ "Información médica de Praga 2000". Archivado desde el original el 18 de octubre de 2014.
- ^ Shirsand SB, Suresh S, Jodhana LS, Swamy PV (2010). "Diseño de formulación y optimización de comprimidos de lorazepam de rápida desintegración mediante el método efervescente". Revista india de ciencias farmacéuticas . 72 (4): 431–436. doi : 10.4103/0250-474X.73911 . ISSN 0250-474X. PMC 3013557 . PMID 21218052.
- ^ Storehagen S, Ose N, Midha S. "Ingredientes de dentífricos y enjuagues bucales y su uso" (PDF) . Instituto de Odontología Clínica . Universitetet i Oslo.
- ^ US 4132770A, Barth J, "Producto oral", publicado en 1979
- ^ Iqbal K, Asmat M, Jawed S, Mushtaque A, Mohsin F, Hanif S, et al. (julio de 2011). "El papel de los diferentes ingredientes de las pastas dentales y los enjuagues bucales en la salud bucal" (PDF) . Revista de la Asociación Dental de Pakistán . 20 (3): 163–70.
- ^ Lamb JH (1946). "Bicarbonato de sodio: un excelente desodorante". The Journal of Investigative Dermatology . 7 (3): 131–133. doi : 10.1038/jid.1946.13 .
- ^ "Bicarbonato de sodio: desodorante corporal natural". sustainableecho.com. 10 de marzo de 2009.
- ^ Metson RB (2005). Guía de la Facultad de Medicina de Harvard para curar los senos nasales . McGraw Hill. pág. 68. ISBN 9780071444699.
- ^ "Blefaritis: prospecto informativo para pacientes" (PDF) . Ouh.nhs.uk . Consultado el 28 de febrero de 2022 .
- ^ "Blefaritis. Tratamiento y causas. Inflamación de párpados | Paciente". Paciente . Archivado desde el original el 5 de diciembre de 2015. Consultado el 31 de mayo de 2016 .
- ^ Paton LJ, Beauchemin KA, Veira DM, von Keyserlingk MA (2006). "Uso de bicarbonato de sodio, ofrecido a libre elección o mezclado en la ración, para reducir el riesgo de acidosis ruminal en el ganado". Revista Canadiense de Ciencia Animal . 86 (3): 429–437. doi : 10.4141/A06-014 .
- ^ "Elimina la suciedad con bicarbonato de sodio". Popular Mechanics. 5 de agosto de 2013. Consultado el 2 de agosto de 2020 .
- ^ Housecroft CE, Sharpe AG (2008). "Capítulo 22: Química de los metales del bloque d : los elementos de la primera fila". Química inorgánica, 3.ª edición . Pearson. pág. 716. ISBN 978-0-13-175553-6.
- ^ "Science Lab.com". MSDS- Carbonato de sodio . sciencelab.com. Archivado desde el original el 5 de septiembre de 2012.
- ^ ab "Técnicas de acabado en metalistería". Museo de Arte de Filadelfia.
- ^ "Dale brillo". scifun.chem.wisc.edu. Archivado desde el original el 31 de julio de 2012. Consultado el 6 de marzo de 2011 .
- ^ Orcutt JA. "Uranio empobrecido y salud: hechos y sugerencias útiles". Farmacología y toxicología de los compuestos de uranio . McGraw-Hill. Archivado desde el original el 17 de enero de 2013. Consultado el 21 de marzo de 2012 .
- ^ Raymond J (10 de junio de 2016). "Velas, productos y trucos para eliminar olores de la cocina". cravedujour.com . Archivado desde el original el 7 de agosto de 2020. Consultado el 29 de junio de 2016 .
- ^ Vicki Lansky, Martha Campbell, Bicarbonato de sodio: más de 500 usos fabulosos, divertidos y económicos en los que probablemente nunca haya pensado , 2009, ISBN 1931863733 , pág. 28
- ^ "Una solución confiable durante más de 170 años. Pura y simple". Página "Acerca de nosotros" de Arm & Hammer
- ^ Keith Sawyer, Group Genius: The Creative Power of Collaboration , 2017, ISBN 0465093582 , "mantenga la comida con un sabor fresco"
- ^ Clayton M. Christensen, Scott Cook, Taddy Hall, Mala praxis en marketing: la causa y la cura , Harvard Business Review , diciembre de 2005, [1]
- ^ "Mito nº 100: Una caja abierta de bicarbonato de sodio en el frigorífico absorbe los olores", Bruce Weinstein, Mark Scarbrough, Las langostas gritan cuando las hierves; y otros 100 mitos sobre la comida y la cocina , 2011, ISBN 1439195382 , pág. 312
- ^ "Bicarbonato de sodio como absorbente de olores | Cook's Illustrated". Cooksillustrated.com . Consultado el 28 de febrero de 2022 .
- ^ ab Papuga A, Polańczyk A (6 de diciembre de 2023). "Análisis de las últimas directrices para la neutralización de ácidos seleccionados, incluidas las recomendaciones para los servicios de emergencia". Zeszyty Naukowe SGSP . 1 (88): 75–95. doi : 10.5604/01.3001.0054.1220 . ISSN 0239-5223.
- ^ ab "Descomposición de carbonatos". Química general en línea. Archivado desde el original el 2 de octubre de 1999. Consultado el 16 de marzo de 2010 .
- ^ "Nahcolite". Enciclopedia Británica . 2012. Consultado el 2 de junio de 2024 .
- ^ Bolen WP (enero de 2024). Carbonato de sodio (PDF) . Servicio Geológico de Estados Unidos . Archivado desde el original (PDF) el 4 de marzo de 2024.
- ^ ab Johnson RC, Mercier TJ, Brownfield ME, Pantea MP, Self (2020). Una evaluación de los recursos de esquisto bituminoso in situ en la Formación Green River, Cuenca Piceance, Colorado . Servicio Geológico de Estados Unidos .
- ^ PubChem. «Bicarbonato de sodio». pubchem.ncbi.nlm.nih.gov . Consultado el 16 de mayo de 2021 .
- ^ "Declaración de numeración de lotes y vida útil del bicarbonato de sodio (S300) - Solvay Chemicals, Inc" (PDF) . 31 de enero de 2019.
- ^ "Re: Vida útil del bicarbonato de sodio (todos los grados) - Tronox Alkali Corporation" (PDF) . 1 de abril de 2015.
- ^ "¿El bicarbonato de sodio se echa a perder? Cómo saber si todavía está bueno". The Spruce Eats . Consultado el 16 de mayo de 2021 .
- ^ Renate Gerner: Instrumentos y sustancias utilizadas en la momificación. En: Renate Gerner, Rosemarie Drenkhahn (ed.): Mumie und Computer. Un proyecto de investigación multidisciplinario en Hannover. Exposición especial del Museo Kestner de Hannover del 26 de septiembre de 1991 al 19 de enero de 1992. Museo Kestner, Hannover 1991, ISBN 3-924029-17-2 , p. 28 y sig.
- ^ Franz Dornseiff: "Las palabras griegas en alemán". Walter de Gruyter & Co, Berlín 1950, p. 44.
- ^ Friedrich Kluge , Alfred Götze (filólogo): Diccionario etimológico de la lengua alemana . 20.ª edición, ed. por Walther Mitzka, De Gruyter, Berlín/Nueva York 1967; Reimpresión (“21.ª edición sin cambios”) ibid 1975, ISBN 3-11-005709-3 , pág. 504.
- ^ "Definición de SALERATUS". www.merriam-webster.com . Consultado el 6 de diciembre de 2020 .
- ^ "Historia de la empresa". Church & Dwight Co. Archivado desde el original el 16 de octubre de 2011.
- ^ Kipling R (1897). Capitanes valientes . pág. 25.
- ^ Bristow NK (2012), Pandemia estadounidense: los mundos perdidos de la epidemia de gripe de 1918 , Oxford University Press, pág. 178, ISBN 978-0199811342
- ^ Thieme C (2000). "Carbonatos de sodio". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a24_299. ISBN . 3527306730.
- ^ Holleman AF, Wiberg E (2001). Química inorgánica . San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Página 45, sección 3.6.2.1 del "Documento de referencia sobre las mejores prácticas de proceso (BREF) para el carbonato de sodio", informe elaborado por la Asociación Europea de Productores de Carbonato de Sodio, archivado el 3 de octubre de 2006 en Wayback Machine , marzo de 2004.
- ^ "Sopa de ganso (1933)". IMDb . Consultado el 4 de agosto de 2015 .
- ^ "Una noche en la ópera (1935)". IMDb . Consultado el 4 de agosto de 2015 .
Bibliografía
- Haynes WM, ed. (2011). Manual de química y física del CRC (92.ª edición). CRC Press . ISBN 978-1439855119.
Enlaces externos
- Ficha internacional de seguridad química 1044