Estrógeno (medicamento)
| Estrógeno (medicamento) | |
|---|---|
| Clase de droga | |
 Estradiol , la principal hormona sexual estrógeno en los seres humanos y un medicamento ampliamente utilizado. | |
| Identificadores de clase | |
| Usar | Anticoncepción , menopausia , hipogonadismo , mujeres transgénero , cáncer de próstata , cáncer de mama , otros |
| Código ATC | G03C |
| Objetivo biológico | Receptores de estrógeno ( ERα , ERβ , mER (p. ej., GPER , otros)) |
| Enlaces externos | |
| Malla | D004967 |
| Estatus legal | |
| En Wikidata | |
Un estrógeno ( E ) es un tipo de medicamento que se usa más comúnmente en el control de la natalidad hormonal y la terapia hormonal menopáusica , y como parte de la terapia hormonal feminizante para mujeres transgénero . [1] También se pueden usar en el tratamiento de cánceres sensibles a las hormonas como el cáncer de mama y el cáncer de próstata y para varias otras indicaciones. Los estrógenos se usan solos o en combinación con progestágenos . [1] Están disponibles en una amplia variedad de formulaciones y para su uso por muchas vías de administración diferentes . [1] Los ejemplos de estrógenos incluyen estradiol bioidéntico , estrógenos conjugados naturales , estrógenos esteroides sintéticos como el etinilestradiol y estrógenos no esteroides sintéticos como el dietilestilbestrol . [1] Los estrógenos son uno de los tres tipos de agonistas de las hormonas sexuales , los otros son los andrógenos / esteroides anabólicos como la testosterona y los progestágenos como la progesterona .
Los efectos secundarios de los estrógenos incluyen sensibilidad en los senos , agrandamiento de los senos , dolor de cabeza , náuseas y edema , entre otros. [1] Otros efectos secundarios de los estrógenos incluyen un mayor riesgo de coágulos sanguíneos , enfermedades cardiovasculares y, cuando se combinan con la mayoría de los progestágenos, cáncer de mama . [1] En los hombres, los estrógenos pueden causar desarrollo de los senos , feminización , infertilidad , niveles bajos de testosterona y disfunción sexual , entre otros.
Los estrógenos son agonistas de los receptores de estrógeno , los objetivos biológicos de los estrógenos endógenos como el estradiol . Tienen efectos importantes en muchos tejidos del cuerpo, incluido el sistema reproductor femenino ( útero , vagina y ovarios ), los senos , los huesos , la grasa , el hígado y el cerebro , entre otros. [1] A diferencia de otros medicamentos como las progestinas y los esteroides anabólicos, los estrógenos no tienen otras actividades hormonales. [1] Los estrógenos también tienen efectos antigonadotrópicos y en dosis suficientemente altas pueden suprimir fuertemente la producción de hormonas sexuales . [1] Los estrógenos median sus efectos anticonceptivos en combinación con las progestinas inhibiendo la ovulación .
Los estrógenos se introdujeron por primera vez para uso médico a principios de la década de 1930. Comenzaron a usarse en el control de la natalidad en combinación con progestinas en la década de 1950. [2] Se han comercializado una variedad de estrógenos diferentes para uso clínico en humanos o uso en medicina veterinaria , aunque solo un puñado de estos son ampliamente utilizados. [3] [4] [5] [6] [7] Estos medicamentos se pueden agrupar en diferentes tipos según el origen y la estructura química . [1] Los estrógenos están ampliamente disponibles en todo el mundo y se utilizan en la mayoría de las formas de control de la natalidad hormonal y en todos los regímenes de terapia hormonal para la menopausia. [3] [4] [6] [5] [1]
Usos médicos
Control de la natalidad
Los estrógenos tienen efectos anticonceptivos y se utilizan en combinación con progestinas ( progestágenos sintéticos ) en el control de la natalidad para prevenir el embarazo en las mujeres. Esto se conoce como anticoncepción hormonal combinada . Los efectos anticonceptivos de los estrógenos están mediados por sus efectos antigonadotrópicos y, por lo tanto, por la inhibición de la ovulación . La mayoría de los anticonceptivos orales combinados contienen etinilestradiol o su profármaco mestranol como componente estrogénico, pero algunos contienen estradiol o valerato de estradiol. El etinilestradiol se usa generalmente en anticonceptivos orales en lugar del estradiol porque tiene una farmacocinética oral superior (mayor biodisponibilidad y menor variabilidad interindividual ) y controla el sangrado vaginal de manera más efectiva. Esto se debe a su naturaleza sintética y su resistencia al metabolismo en ciertos tejidos como los intestinos , el hígado y el útero en relación con el estradiol. Además de los anticonceptivos orales, otras formas de anticoncepción hormonal combinada incluyen parches anticonceptivos , anillos vaginales anticonceptivos y anticonceptivos inyectables combinados . Los parches anticonceptivos y los anillos vaginales contienen etinilestradiol como componente de estrógeno, mientras que los anticonceptivos inyectables combinados contienen estradiol o, más típicamente, un éster de estradiol .
Terapia hormonal
Menopausia

A las mujeres posmenopáusicas se les administran estrógenos y otras hormonas para prevenir la osteoporosis y tratar los síntomas de la menopausia, como sofocos, sequedad vaginal, incontinencia urinaria de esfuerzo, sensación de frío, mareos, fatiga, irritabilidad y sudoración. Las fracturas de columna, muñeca y cadera disminuyen entre un 50 y un 70 % y la densidad ósea espinal aumenta aproximadamente un 5 % en aquellas mujeres tratadas con estrógenos dentro de los 3 años posteriores al inicio de la menopausia y durante los 5 a 10 años posteriores.
Antes de que se comprendieran bien los peligros específicos de los estrógenos conjugados, la terapia estándar consistía en 0,625 mg/día de estrógenos conjugados (como Premarin). Sin embargo, existen riesgos asociados con la terapia con estrógenos conjugados. Entre las mujeres posmenopáusicas mayores estudiadas como parte de la Iniciativa de Salud de la Mujer (WHI), se descubrió que un suplemento de estrógeno conjugado administrado por vía oral estaba asociado con un mayor riesgo de coágulos sanguíneos peligrosos . Los estudios de la WHI utilizaron un tipo de suplemento de estrógeno, una dosis oral alta de estrógenos conjugados (Premarin solo y con acetato de medroxiprogesterona como Prempro ). [10]
En un estudio del NIH no se ha demostrado que los estrógenos esterificados supongan los mismos riesgos para la salud que los estrógenos conjugados. La terapia hormonal menopáusica tiene efectos favorables sobre los niveles séricos de colesterol y, cuando se inicia inmediatamente después de la menopausia, puede reducir la incidencia de enfermedades cardiovasculares, aunque esta hipótesis aún debe comprobarse en ensayos aleatorios. El estrógeno parece tener un efecto protector sobre la aterosclerosis: reduce los niveles de LDL y triglicéridos, aumenta los niveles de HDL y tiene propiedades de vasodilatación endotelial además de un componente antiinflamatorio.
Se están realizando investigaciones para determinar si los riesgos del uso de suplementos de estrógeno son los mismos para todos los métodos de administración. En particular, el estrógeno aplicado tópicamente puede tener un espectro diferente de efectos secundarios que cuando se administra por vía oral [11] , y los estrógenos transdérmicos no afectan la coagulación ya que se absorben directamente en la circulación sistémica, evitando el metabolismo de primer paso en el hígado. Por lo tanto, esta vía de administración es la preferida en mujeres con antecedentes de enfermedad tromboembólica .
Los estrógenos también se utilizan en el tratamiento de la atrofia vaginal, el hipoestrogenismo (como resultado de hipogonadismo, ooforectomía o insuficiencia ovárica primaria), la amenorrea, la dismenorrea y la oligomenorrea. Los estrógenos también se pueden utilizar para suprimir la lactancia después del parto.
Los estrógenos sintéticos , como los estrógenos 17α-sustituidos como el etinilestradiol y sus ésteres y éteres C3 mestranol , quinestrol y sulfonato de etinilestradiol , y los estrógenos no esteroides como los estilbestroles dietilestilbestrol , hexestrol y dienestrol , ya no se utilizan en la terapia hormonal menopáusica debido a sus efectos desproporcionados sobre la síntesis de proteínas hepáticas y los riesgos asociados para la salud. [12]
| Ruta/forma | Estrógeno | Bajo | Estándar | Alto | |||
|---|---|---|---|---|---|---|---|
| Oral | Estradiol | 0,5–1 mg/día | 1–2 mg/día | 2–4 mg/día | |||
| Valerato de estradiol | 0,5–1 mg/día | 1–2 mg/día | 2–4 mg/día | ||||
| Acetato de estradiol | 0,45–0,9 mg/día | 0,9–1,8 mg/día | 1,8–3,6 mg/día | ||||
| Estrógenos conjugados | 0,3–0,45 mg/día | 0,625 mg/día | 0,9–1,25 mg/día | ||||
| Estrógenos esterificados | 0,3–0,45 mg/día | 0,625 mg/día | 0,9–1,25 mg/día | ||||
| Estropipato | 0,75 mg/día | 1,5 mg/día | 3 mg/día | ||||
| Estriol | 1–2 mg/día | 2–4 mg/día | 4–8 mg/día | ||||
| Etinilestradiol a | 2,5–10 μg/día | 5–20 μg/día | – | ||||
| Aerosol nasal | Estradiol | 150 μg/día | 300 μg/día | 600 μg/día | |||
| Parche transdérmico | Estradiol | 25 μg/día b | 50 μg/día b | 100 μg/día b | |||
| Gel transdérmico | Estradiol | 0,5 mg/día | 1–1,5 mg/día | 2–3 mg/día | |||
| Vaginal | Estradiol | 25 μg/día | – | – | |||
| Estriol | 30 μg/día | 0,5 mg 2 veces por semana | 0,5 mg/día | ||||
| SOYInformación sobre herramientas intramuscularo inyección subcutánea | Valerato de estradiol | – | – | 4 mg 1 vez/4 semanas | |||
| Cipionato de estradiol | 1 mg 1 vez/3–4 semanas | 3 mg 1 vez/3–4 semanas | 5 mg 1 vez/3–4 semanas | ||||
| Benzoato de estradiol | 0,5 mg 1 vez por semana | 1 mg 1 vez por semana | 1,5 mg 1 vez por semana | ||||
| Implante SC | Estradiol | 25 mg 1 vez cada 6 meses | 50 mg 1 vez cada 6 meses | 100 mg 1 vez cada 6 meses | |||
| Notas al pie: a = Ya no se utiliza ni se recomienda debido a problemas de salud. b = Como parche único aplicado una o dos veces por semana (durante 3 o 4 días o 7 días), según la fórmula. Nota: Las dosis no son necesariamente equivalentes. Fuentes: Ver plantilla. | |||||||
Hipogonadismo
Los estrógenos se utilizan junto con los progestágenos para tratar el hipogonadismo y el retraso de la pubertad en las mujeres.
Mujeres transgénero
Los estrógenos se utilizan junto con antiandrógenos y progestágenos como un componente de la terapia hormonal feminizante para mujeres transgénero y otras personas transfemeninas . [13] [14] [15]
Cáncer hormonal
Cáncer de próstata
La terapia con estrógenos en dosis altas con una variedad de estrógenos como dietilestilbestrol , etinilestradiol , fosfato de poliestradiol , undecilato de estradiol , valerato de estradiol y estradiol se ha utilizado para tratar el cáncer de próstata en hombres. [16] Es eficaz porque los estrógenos son antiandrógenos funcionales , capaces de suprimir los niveles de testosterona a concentraciones de castración y disminuir los niveles de testosterona libre al aumentar la producción de globulina transportadora de hormonas sexuales (SHBG). La terapia con estrógenos en dosis altas se asocia con una mala tolerabilidad y seguridad, a saber, ginecomastia y complicaciones cardiovasculares como trombosis . [ cita(s) adicional(es) necesaria(s ) ] Por esta razón, ha sido reemplazado en gran medida por antiandrógenos más nuevos, como análogos de la hormona liberadora de gonadotropina y antiandrógenos no esteroides . Sin embargo, todavía se utiliza a veces en el tratamiento del cáncer de próstata [16] y se están estudiando estrógenos más nuevos con perfiles atípicos, como GTx-758 , que tienen perfiles de tolerabilidad mejorados, para su posible aplicación en el cáncer de próstata.
| Ruta/forma | Estrógeno | Dosificación | |
|---|---|---|---|
| Oral | Estradiol | 1–2 mg 3 veces al día | |
| Estrógenos conjugados | 1,25–2,5 mg 3 veces al día | ||
| Etinilestradiol | 0,15–3 mg/día | ||
| Sulfonato de etinilestradiol | 1–2 mg 1 vez por semana | ||
| Dietilestilbestrol | 1–3 mg/día | ||
| Dienestrol | 5 mg/día | ||
| Hexestrol | 5 mg/día | ||
| Fosfestrol | 100–480 mg 1–3 veces al día | ||
| Clorotrianiseno | 12–48 mg/día | ||
| Cuadrosilano | 900 mg/día | ||
| Fosfato de estramustina | 140–1400 mg/día | ||
| Parche transdérmico | Estradiol | 2–6x 100 μg/día Escrotal: 1x 100 μg/día | |
| SOYInformación sobre herramientas intramuscularo inyección subcutánea | Benzoato de estradiol | 1,66 mg 3 veces por semana | |
| Dipropionato de estradiol | 5 mg 1 vez por semana | ||
| Valerato de estradiol | 10–40 mg 1 vez/1–2 semanas | ||
| Undecilato de estradiol | 100 mg 1 vez/4 semanas | ||
| Fosfato de poliestradiol | Solo: 160–320 mg 1x/4 semanas Con EE oral : 40–80 mg 1x/4 semanas | ||
| Estrona | 2–4 mg 2–3 veces por semana | ||
| Inyección intravenosa | Fosfestrol | 300–1200 mg 1–7 veces por semana | |
| Fosfato de estramustina | 240–450 mg/día | ||
| Nota: Las dosis no son necesariamente equivalentes. Fuentes: Ver plantilla. | |||
Cáncer de mama
La terapia con estrógenos en dosis altas con potentes estrógenos sintéticos como el dietilestilbestrol y el etinilestradiol se utilizó en el pasado en el tratamiento paliativo del cáncer de mama . [17] Su eficacia es aproximadamente equivalente a la de la terapia antiestrógeno con moduladores selectivos del receptor de estrógeno (SERM) como el tamoxifeno y los inhibidores de la aromatasa como el anastrozol . [17] El uso de la terapia con estrógenos en dosis altas en el cáncer de mama ha sido reemplazado en su mayoría por la terapia antiestrógeno debido al perfil de seguridad mejorado de esta última. [17] La terapia con estrógenos en dosis altas fue el estándar de atención para el tratamiento paliativo del cáncer de mama en mujeres hasta fines de la década de 1970 o principios de la de 1980. [18]
| Ruta/forma | Estrógeno | Dosificación | Referencia(s) |
|---|---|---|---|
| Oral | Estradiol | 10 mg 3x/día IA -resistentes: 2 mg 1–3x/día | [19] [20] [19] [21] |
| Valerato de estradiol | Resistente a IA : 2 mg 1–3 veces al día | [19] [21] | |
| Estrógenos conjugados | 10 mg 3 veces al día | [22] [23] [24] [25] | |
| Etinilestradiol | 0,5–1 mg 3 veces al día | [23] [19] [26] [25] | |
| Dietilestilbestrol | 5 mg 3 veces al día | [23] [27] [28] | |
| Dienestrol | 5 mg 3 veces al día | [26] [25] [28] | |
| Dimestrol | 30 mg/día | [22] [25] [28] | |
| Clorotrianiseno | 24 mg/día | [22] [28] | |
| SOYInformación sobre herramientas intramuscularo inyección subcutánea | Benzoato de estradiol | 5 mg 2–3 veces por semana | [26] [29] [27] [30] |
| Dipropionato de estradiol | 5 mg 2–3 veces por semana | [26] [27] [31] [30] | |
| Valerato de estradiol | 30 mg 1x/2 semanas | [29] | |
| Fosfato de poliestradiol | 40–80 mg 1 vez cada 4 semanas | [32] [33] | |
| Estrona | 5 mg ≥3x/semana | [34] | |
| Notas: (1) Sólo en mujeres que hayan pasado al menos 5 años desde la menopausia . [19] (2) Las dosis no son necesariamente equivalentes. | |||
Otros usos
Esterilidad
Los estrógenos pueden utilizarse en el tratamiento de la infertilidad en mujeres cuando existe la necesidad de desarrollar un moco cervical favorable para los espermatozoides o un revestimiento uterino apropiado . [35] [36]
Apoyo durante el embarazo
Los estrógenos como el dietilestilbestrol se usaban anteriormente en dosis altas para ayudar a favorecer el embarazo . [37] Sin embargo, investigaciones posteriores demostraron que el dietilestilbestrol era ineficaz y perjudicial. [37]
Supresión de la lactancia
Los estrógenos se pueden utilizar para suprimir la lactancia , por ejemplo en el tratamiento de la congestión mamaria o galactorrea . [38] Sin embargo, se necesitan dosis altas, la eficacia es incierta y las dosis altas de estrógenos en el período posparto pueden aumentar el riesgo de coágulos sanguíneos . [39]
Estatura alta
Se ha utilizado estrógeno para inducir la atenuación del crecimiento en niñas altas. [40]
La atenuación del crecimiento inducida por estrógeno se utilizó como parte del controvertido Tratamiento Ashley para evitar que una niña con discapacidad del desarrollo creciera hasta alcanzar el tamaño adulto. [41]
Acromegalia
Los estrógenos se han utilizado para tratar la acromegalia . [42] [43] [44] Esto se debe a que suprimen la producción del factor de crecimiento similar a la insulina 1 (IGF-1) inducida por la hormona del crecimiento en el hígado . [42] [43] [44]
Desviación sexual
La terapia con estrógenos en dosis altas se ha utilizado con éxito en el tratamiento de la desviación sexual , como las parafilias en los hombres. [45] [46] Sin embargo, se ha descubierto que produce muchos efectos secundarios (por ejemplo, ginecomastia , feminización , enfermedad cardiovascular , coágulos de sangre ), por lo que ya no se recomienda para tales fines. [45] La terapia con estrógenos en dosis altas funciona suprimiendo los niveles de testosterona, de manera similar a la terapia con progestágenos en dosis altas y la terapia moduladora de la hormona liberadora de gonadotropina (GnRH) . [45] También se han utilizado dosis más bajas de estrógenos en combinación con la terapia con progestágenos en dosis altas en el tratamiento de la desviación sexual en los hombres. [45] De manera similar, se ha asociado una alta incidencia de disfunción sexual con la terapia con estrógenos en dosis altas en hombres tratados con ella para el cáncer de próstata . [47]
Aumento de senos
Los estrógenos intervienen en el desarrollo de los senos y pueden utilizarse como una forma de mejora hormonal de los senos para aumentar el tamaño de los mismos . [48] [49] [50] [51] [52] Sin embargo, el agrandamiento agudo o temporal de los senos es un efecto secundario bien conocido de los estrógenos, y los aumentos en el tamaño de los senos tienden a retroceder tras la interrupción del tratamiento. [48] [50] [51] Aparte de aquellos sin desarrollo mamario establecido previo, faltan pruebas de un aumento sostenido del tamaño de los senos con estrógenos. [48] [50] [51]
Depresión
Las pautas publicadas en 2019 y 2020 de la North American Menopause Society (NAMS) y la European Menopause and Andropause Society (EMAS) han revisado el tema de la terapia con estrógenos para los síntomas depresivos en la peri y posmenopausia . [53] [54] Existe cierta evidencia de que los estrógenos son efectivos en el tratamiento de la depresión en mujeres perimenopáusicas. [53] [ 54] [55] [ 56 ] [57] [58] [59] [60] [61] [62] [63] La magnitud del beneficio parece ser similar a la de los antidepresivos clásicos . [53] [54] También existe cierta evidencia de que los estrógenos pueden mejorar el estado de ánimo y el bienestar en mujeres perimenopáusicas no deprimidas. [53] [54] [58] [56] Los estrógenos no parecen ser efectivos en el tratamiento de la depresión en mujeres posmenopáusicas . [53] [54] Esto sugiere que existe una ventana de oportunidad para el tratamiento efectivo de los síntomas depresivos con estrógenos. [53] La investigación sobre la terapia combinada de estrógeno y progestágeno para los síntomas depresivos en la peri- y posmenopausia es escasa y no concluyente. [53] [54] Los estrógenos pueden aumentar los beneficios del estado de ánimo de los antidepresivos en mujeres de mediana edad y mayores. [53] [54] La terapia hormonal menopáusica no está aprobada actualmente para el tratamiento de los síntomas depresivos en la peri- o posmenopausia en los Estados Unidos o el Reino Unido debido a la evidencia insuficiente de efectividad. [53] [54] [58] Se necesita más investigación sobre el tema de la terapia con estrógenos para los síntomas depresivos asociados con la menopausia . [61] [59]
Esquizofrenia
Los estrógenos parecen ser útiles en el tratamiento de la esquizofrenia tanto en mujeres como en hombres. [64] [65] [66] [67]
Acné
La terapia sistémica con estrógenos en dosis adecuadas es eficaz y se ha utilizado en el tratamiento del acné tanto en mujeres como en hombres, pero provoca efectos secundarios importantes como feminización y ginecomastia en los hombres. [68] [69] [70] [71] [72] [73] [74] [75]
Formularios disponibles
| Nombre genérico | Clase | Nombre de marca | Ruta | Intr. |
|---|---|---|---|---|
| Estrógenos conjugados | S/éster [a] | Premarin | PO, IM , TD , V | 1941 |
| Dienestrol [b] | Nueva Zelanda | Sinestrol [c] | correos | 1947 |
| Dietilestilbestrol [b] | Nueva Zelanda | Estilbestrol [c] | PO, TD, V | 1939 |
| Estrógenos esterificados | NS/éster [a] | Estratab | correos | 1970 |
| Estetrol [d] | S | Donesta [c] | correos | N / A |
| Estradiol | S | Estrace [c] | PO, IM, SC , SL , TD, V | 1935 |
| Acetato de estradiol | S/éster | Anillo de fem [c] | PO, V | 2001 |
| Benzoato de estradiol | S/éster | Progynon B | SOY | 1933 |
| Cipionato de estradiol | S/éster | Depo-estradiol | SOY | 1952 |
| Enantato de estradiol | S/éster | Deladroxato [c] | SOY | Década de 1970 |
| Valerato de estradiol | S/éster | Depósito de Progynon [c] | Correo electrónico, mensaje instantáneo | 1954 |
| Fosfato de estramustina [e] | S/éster | Emcyt [c] | correos | Década de 1970 |
| Estriol | S | Teelol [c] | PO, V | 1930 |
| Estropipato [b] | S/éster | Ogen | correos | 1968 |
| Etinilestradiol | S/ alquilo | Estinilo [c] | PO, TD, V | 1943 |
| Fosfestrol [b] | NS/éster | Honvan [c] | SOY | 1947 |
| Hexestrol [b] | Nueva Zelanda | Sinestrol [c] | Correo electrónico, mensaje instantáneo | Década de 1940 |
| Mestranol [b] | S/alquilo/éter | Enovidio [c] | correos | 1957 |
| Metilestradiol [b] | S/alquilo | Ginecósido [c] | correos | 1955 |
| Fosfato de poliestradiol [b] | S/éster | Estradurina | SOY | 1957 |
| Prasterona [f] | Prohormona | Intrarrosa [c] | PO, IM, V | Década de 1970 |
| Zeranol [g] | Nueva Zelanda | Ralgro [c] | correos | Década de 1970 |
| ||||
Los estrógenos que se han comercializado vienen en dos tipos principales: estrógenos esteroides y estrógenos no esteroides . [1] [76]
Estrógenos esteroides
El estradiol , la estrona y el estriol han sido aprobados como fármacos y se utilizan con fines médicos. [1] El estetrol se encuentra actualmente en desarrollo para indicaciones médicas, pero aún no ha sido aprobado en ningún país. [77] Una variedad de ésteres de estrógeno sintéticos , como el valerato de estradiol , el cipionato de estradiol , el acetato de estradiol , el benzoato de estradiol , el undecilato de estradiol y el fosfato de poliestradiol , se utilizan clínicamente. [1] Los compuestos antes mencionados se comportan como profármacos del estradiol y son mucho más duraderos en comparación cuando se administran por inyección intramuscular o subcutánea. [1] También existen ésteres de estrona y estriol y se utilizan o se han utilizado en medicina clínica, por ejemplo, el sulfato de estrona (p. ej., como estropipato ), el succinato de estriol y el glucurónido de estriol (como Emmenin y Progynon ). [1]
El etinilestradiol es un análogo sintético más potente del estradiol que se utiliza ampliamente en los anticonceptivos hormonales . [1] Otros derivados sintéticos del estradiol relacionados con el etinilestradiol que se utilizan clínicamente incluyen mestranol , quinestrol , sulfonato de etinilestradiol , moxestrol y metilestradiol . Los estrógenos conjugados (nombre comercial Premarin), un producto de estrógeno fabricado a partir de la orina de yeguas preñadas y comúnmente utilizado en la terapia hormonal menopáusica, es una mezcla de estrógenos naturales que incluyen sulfato de estrona y estrógenos equinos como el sulfato de equilina y el sulfato de 17β-dihidroequilina . [1] Un producto relacionado y muy similar a los estrógenos conjugados, que difiere de él solo en la composición, son los estrógenos esterificados . [1]
La testosterona , la prasterona (dehidroepiandrosterona; DHEA), la boldenona (δ 1 -testosterona) y la nandrolona (19-nortestosterona) son andrógenos / esteroides anabólicos (AAS) naturales que forman estradiol como metabolito activo en pequeñas cantidades y pueden producir efectos estrogénicos, sobre todo ginecomastia en hombres en dosis suficientemente altas. [78] De forma similar, varios AAS sintéticos, entre ellos la metiltestosterona , la metandienona , la normetandrona y la noretandrolona , producen metilestradiol o etilestradiol como metabolito activo en pequeñas cantidades y también pueden producir efectos estrogénicos. [78] Algunas progestinas, específicamente los derivados de 19-nortestosterona noretisterona , noretinodrel y tibolona , se metabolizan en estrógenos (por ejemplo, etinilestradiol) y también pueden producir efectos estrogénicos. [1] [79]
Estrógenos no esteroides
El dietilestilbestrol es un estrógeno no esteroide que ya no se utiliza en medicina. Es un miembro del grupo de los estilbestrol . Otros estrógenos de estilbestrol que se han utilizado clínicamente incluyen benzestrol , dienestrol , acetato de dienestrol , dipropionato de dietilestilbestrol , fosfestrol , hexestrol y dipropionato de metestrol . El clorotrianiseno , el metalenestril y el doisinoestrol son estrógenos no esteroides estructuralmente distintos de los estilbestrol que también se han utilizado clínicamente. Si bien se utilizaron ampliamente en el pasado, los estrógenos no esteroides en su mayoría se han descontinuado y ahora rara vez se usan con fines médicos.
Contraindicaciones
Los estrógenos tienen varias contraindicaciones . [80] [81] [82] [83] Un ejemplo es el historial de tromboembolia (coágulos de sangre). [80] [81] [82] [83]
Efectos secundarios
Los efectos secundarios más comunes de los estrógenos en general incluyen sensibilidad en los senos , agrandamiento de los senos , dolor de cabeza , náuseas , retención de líquidos y edema . En las mujeres, los estrógenos también pueden causar sangrado vaginal , flujo vaginal y anovulación , mientras que en los hombres, los estrógenos también pueden causar ginecomastia ( crecimiento de los senos masculinos ), feminización , desmasculinización , disfunción sexual ( disminución de la libido y disfunción eréctil ), hipogonadismo , atrofia testicular e infertilidad .
Los estrógenos pueden o pueden aumentar el riesgo de problemas poco comunes o raros pero potencialmente graves, incluyendo hiperplasia endometrial , cáncer de endometrio , complicaciones cardiovasculares (p. ej., coágulos sanguíneos , accidente cerebrovascular , ataque cardíaco ), hepatotoxicidad colestásica , enfermedad de la vesícula biliar (p. ej., cálculos biliares ), hiperprolactinemia , prolactinoma y demencia . Estos efectos adversos se moderan por el uso concomitante de un progestágeno , el tipo de progestágeno utilizado y la dosis y vía de administración del estrógeno utilizado.
Alrededor de la mitad de las mujeres con epilepsia que menstrúan tienen un umbral convulsivo más bajo en torno a la ovulación , probablemente debido a los niveles elevados de estrógeno en ese momento. Esto da como resultado un mayor riesgo de convulsiones en estas mujeres.
Las dosis altas de estrógenos sintéticos como el etinilestradiol y el dietilestilbestrol pueden producir efectos secundarios adversos importantes como náuseas , vómitos , dolor de cabeza , malestar y mareos , entre otros. [84] [85] [86] Por el contrario, los estrógenos naturales como el estradiol y los estrógenos conjugados rara vez se asocian con tales efectos. [84] [85] [86] Los efectos secundarios anteriores de los estrógenos sintéticos no parecen ocurrir en mujeres embarazadas , que ya tienen niveles muy altos de estrógeno. [84] Esto sugiere que estos efectos se deben a la actividad estrogénica. [84] Los estrógenos sintéticos tienen efectos marcadamente más fuertes en el hígado y la síntesis de proteínas hepáticas que los estrógenos naturales. [1] [87] [88] [86 ] [89] Esto está relacionado con el hecho de que los estrógenos sintéticos como el etinilestradiol son mucho más resistentes al metabolismo en el hígado que los estrógenos naturales. [1] [90] [89]
| Evento adverso grave | EstradiolInformación sobre herramientas Estradiol_(medicamento)6 mg/día (n = 34) | EstradiolInformación sobre herramientas Estradiol_(medicamento)30 mg/día (n = 32) | ||
|---|---|---|---|---|
| norte | % | norte | % | |
| Náuseas / vómitos | 0 | 0.0 | 5 | 15.6 |
| Hiponatremia | 1 | 2.9 | 5 | 15.6 |
| Derrame pleural | 0 | 0.0 | 4 | 12.5 |
| Dolor | 6 | 17.6 | 4 | 12.5 |
| Trombosis / embolia | 1 | 2.9 | 1 | 3.1 |
| Isquemia cerebral | 1 | 2.9 | 0 | 0.0 |
| Infección | 2 | 5.9 | 3 | 9.4 |
| Hipercalcemia | 0 | 0.0 | 2 | 6.3 |
| Otro | 6 | 17.6 | 10 | 31.3 |
| Resumen: Efectos secundarios en un pequeño estudio de fase 2 de mujeres con cáncer de mama metastásico asignadas al azar para recibir 6 o 30 mg/día de estradiol oralDescripción de herramienta Farmacocinética del estradiol#Administración oralcomo terapia. "La tasa de eventos adversos (≥grado 3) en el grupo de 30 mg (11/32 [34%]; intervalo de confianza del 95% [IC], 23%-47%) fue mayor que en el grupo de 6 mg (4/34 [18%]; IC del 95%, 5%-22%; p=0,03). Las tasas de beneficio clínico fueron 9 de 32 (28%; IC del 95%, 18%-41%) en el grupo de 30 mg y 10 de 34 (29%; IC del 95%, 19%-42%) en el grupo de 6 mg". Fuentes: Ver plantilla. | ||||
Efectos a largo plazo
Hiperplasia y cáncer endometrial
La terapia con estrógenos sin oposición estimula el crecimiento del endometrio y se asocia con un riesgo drásticamente mayor de hiperplasia endometrial y cáncer de endometrio en mujeres posmenopáusicas. [91] El riesgo de hiperplasia endometrial aumenta considerablemente a los 6 meses de tratamiento ( OProporción de probabilidades de la información sobre herramientas= 5,4) y aumentó aún más después de 36 meses de tratamiento ( OR = 16,0). [91] Esto puede eventualmente progresar a cáncer de endometrio, y el riesgo de cáncer de endometrio aumenta de manera similar con la duración del tratamiento (menos de un año, RRInformación sobre herramientas sobre riesgo relativo= 1,4; muchos años (p. ej., más de 10 años), RR = 15,0). [91] El riesgo de cáncer de endometrio también permanece significativamente elevado muchos años después de suspender la terapia con estrógenos sin oposición, incluso después de 15 años o más ( RR = 5,8). [91]
Los progestágenos previenen los efectos de los estrógenos en el endometrio. [91] Como resultado, pueden bloquear completamente el aumento del riesgo de hiperplasia endometrial causado por la terapia con estrógenos en mujeres posmenopáusicas, e incluso pueden disminuirlo por debajo del valor inicial ( OR = 0,3 con terapia continua con estrógeno-progestágeno). [91] La terapia continua con estrógeno-progestágeno es más protectora que la terapia secuencial, y una mayor duración del tratamiento con terapia continua también es más protectora. [91] El aumento del riesgo de cáncer de endometrio se reduce de manera similar con la terapia continua con estrógeno-progestágeno ( RR = 0,2-0,7). [91] Por estas razones, los progestágenos siempre se utilizan junto con los estrógenos en mujeres que tienen úteros intactos. [91]
Eventos cardiovasculares
Los estrógenos afectan la síntesis de proteínas del hígado y, por lo tanto, influyen en el sistema cardiovascular . [1] Se ha descubierto que afectan la producción de una variedad de factores de coagulación y fibrinolíticos , incluido el aumento del factor IX , el factor de von Willebrand , el complejo trombina-antitrombina (TAT), el fragmento 1+2 y el dímero D , y la disminución del fibrinógeno , el factor VII , la antitrombina , la proteína S , la proteína C , el activador tisular del plasminógeno (t-PA) y el inhibidor del activador del plasminógeno-1 (PAI-1). [1] Aunque esto es cierto para el estrógeno oral, se ha descubierto que el estradiol transdérmico solo reduce el PAI-1 y la proteína S, y en menor medida que el estrógeno oral. [1] Debido a sus efectos sobre la síntesis de proteínas hepáticas, el estrógeno oral es procoagulante y se ha descubierto que aumenta el riesgo de tromboembolia venosa (TEV), incluyendo tanto la trombosis venosa profunda (TVP) como la embolia pulmonar (EP). [1] Por el contrario, los anticonceptivos orales modernos no están asociados con un aumento del riesgo de accidente cerebrovascular e infarto de miocardio (ataque cardíaco) en mujeres premenopáusicas sanas, no fumadoras , de cualquier edad, excepto en aquellas con hipertensión (presión arterial alta). [92] [93] Sin embargo, se ha encontrado un aumento pequeño pero significativo en el riesgo de accidente cerebrovascular, aunque no de infarto de miocardio, en mujeres menopáusicas que toman terapia de reemplazo hormonal. [94] Un aumento en el riesgo de accidente cerebrovascular también se ha asociado con anticonceptivos orales de dosis alta más antiguos que ya no se utilizan. [ 95]
La terapia hormonal menopáusica con dosis de reemplazo de estrógenos y progestágenos se ha asociado con un riesgo significativamente mayor de eventos cardiovasculares como TEV. [96] [97] Sin embargo, se ha encontrado que dichos riesgos varían dependiendo del tipo de estrógeno y la vía de administración. [96] [97] El riesgo de TEV aumenta aproximadamente dos veces en mujeres que toman estrógeno oral para la terapia hormonal menopáusica. [96] [97] Sin embargo, la investigación clínica hasta la fecha generalmente no ha distinguido entre estrógenos conjugados y estradiol. [97] Esto es importante porque se ha encontrado que los estrógenos conjugados son más resistentes al metabolismo hepático que el estradiol y aumentan los factores de coagulación en mayor medida. [1] Solo unos pocos estudios clínicos han comparado los estrógenos conjugados orales y el estradiol oral. [97] Se ha encontrado que los estrógenos conjugados orales poseen un riesgo significativamente mayor de complicaciones tromboembólicas y cardiovasculares que el estradiol oral ( ORInformación sobre herramientas Ratio de probabilidades= 2,08) y estrógenos esterificados orales ( ORInformación sobre herramientas Ratio de probabilidades= 1,78). [97] [98] [99] Sin embargo, en otro estudio, se encontró que el aumento del riesgo de TEV con 0,625 mg/día de estrógenos conjugados orales más acetato de medroxiprogesterona y 1 o 2 mg/día de estradiol oral más acetato de noretisterona era equivalente ( RRInformación sobre herramientas Riesgo relativo= 4,0 y 3,9, respectivamente). [100] [101] Otros estudios han encontrado que el estradiol oral se asocia de manera similar con un aumento del riesgo de TEV ( RRInformación sobre herramientas Riesgo relativo= 3,5 en uno, OProporción de probabilidades de la información sobre herramientas= 3,54 en el primer año de uso en otro). [97] [102] Hasta el momento, no existen ensayos controlados aleatorios que comparen los estrógenos conjugados orales y el estradiol oral en términos de riesgos tromboembólicos y cardiovasculares que permitan sacar conclusiones inequívocas, y se necesita investigación adicional para aclarar esta cuestión. [97] [96] A diferencia de los estrógenos orales como grupo, no se ha encontrado que el estradiol transdérmico en dosis típicas de reemplazo menopáusico aumente el riesgo de TEV u otros eventos cardiovasculares. [96] [94] [97]
Tanto las píldoras anticonceptivas combinadas (que contienen etinilestradiol y una progestina) como el embarazo se asocian con un aumento de aproximadamente 4 veces en el riesgo de TEV, con un aumento del riesgo ligeramente mayor con este último ( OR = 4,03 y 4,24, respectivamente). [103] El riesgo de TEV durante el período posparto es 5 veces mayor que durante el embarazo. [103] Otras investigaciones han encontrado que la tasa de TEV es de 1 a 5 en 10.000 mujeres-año en mujeres que no están embarazadas o que toman una píldora anticonceptiva, de 3 a 9 en 10.000 mujeres-año en mujeres que toman una píldora anticonceptiva, de 5 a 20 en 10.000 mujeres-año en mujeres embarazadas y de 40 a 65 en 10.000 mujeres-año en mujeres en posparto. [104] En el caso de las píldoras anticonceptivas, se ha informado que el riesgo de TEV con dosis altas de etinilestradiol (>50 μg, p. ej., 100 a 150 μg) es aproximadamente el doble que el de las dosis bajas de etinilestradiol (p. ej., 20 a 50 μg). [92] Por ello, ya no se utilizan dosis altas de etinilestradiol en los anticonceptivos orales combinados, y todos los anticonceptivos orales combinados modernos contienen 50 μg de etinilestradiol o menos. [105] [106] El riesgo absoluto de TEV durante el embarazo es de aproximadamente 0,5 a 2 en 1000 (0,125 %). [107]
Además del tipo de estrógeno y la vía de administración, el riesgo de TEV con estrógeno oral también está moderado por otros factores, incluido el uso concomitante de un progestágeno, la dosis, la edad y el tabaquismo . [108] [101] Se ha descubierto que la combinación de estrógeno oral y un progestágeno duplica el riesgo de TEV en relación con el estrógeno oral solo ( RRInformación sobre herramientas Riesgo relativo= 2,05 para la monoterapia con estrógenos y RRInformación sobre herramientas sobre riesgo relativo= 2,02 para la terapia combinada de estrógeno-progestágeno en comparación). [108] Sin embargo, si bien esto es cierto para la mayoría de los progestágenos, no parece haber un aumento en el riesgo de TEV en relación con el estrógeno oral solo con la adición de progesterona oral o la progestina atípica didrogesterona . [108] [109] [110] La dosis de estrógeno oral parece ser importante para el riesgo de TEV, ya que 1 mg/día de estradiol oral aumentó la incidencia de TEV en 2,2 veces, mientras que 2 mg/día de estradiol oral aumentó la incidencia de TEV en 4,5 veces (ambos en combinación con acetato de noretisterona). [101] El riesgo de TEV y otras complicaciones cardiovasculares con la terapia oral de estrógeno-progestágeno aumenta drásticamente con la edad. [108] En el grupo de estrógenos conjugados orales y acetato de medroxiprogesterona del WHI, los riesgos de TEV estratificados por edad fueron los siguientes: de 50 a 59 años, RR = 2,27; de 60 a 69 años, RR = 4,28; y de 70 a 79 años, RR = 7,46. [108] Por el contrario, en el grupo de monoterapia con estrógenos conjugados orales del WHI, el riesgo de TEV aumentó con la edad de manera similar, pero fue mucho menor: de 50 a 59 años, RR = 1,22; de 60 a 69 años, RR = 1,3; y de 70 a 79 años, RR = 1,44. [108] Además de la terapia hormonal menopáusica, se ha descubierto que la mortalidad cardiovascular aumenta considerablemente con la edad en mujeres que toman anticonceptivos orales combinados que contienen etinilestradiol y en mujeres embarazadas. [111] [112] Además, se ha descubierto que fumar aumenta exponencialmente la mortalidad cardiovascular en conjunción con el uso de anticonceptivos orales combinados y la edad avanzada. [111] [112] Mientras que el riesgo de muerte cardiovascular es de 0,06 por 100.000 en mujeres de 15 a 34 años que toman un anticonceptivo oral combinado y no fuman, este riesgo aumenta 50 veces a 3,0 por 100.000 en mujeres de 35 a 44 años que toman un anticonceptivo oral combinado y no fuman. [111] [112] Además, en las mujeres que fuman, el riesgo de muerte cardiovascular en estos dos grupos aumenta a 1,73 por 100.000 (29 veces más alto en relación con las no fumadoras) y 19,4 por 100.000 (6,5 veces más alto en relación con las no fumadoras), respectivamente. [111] [112]
Aunque los estrógenos influyen en la producción hepática de factores coagulantes y fibrinolíticos y aumentan el riesgo de TEV y, a veces, de accidente cerebrovascular, también influyen en la síntesis hepática de lípidos sanguíneos y pueden tener efectos beneficiosos sobre el sistema cardiovascular. [1] Con el estradiol oral, hay aumentos en los triglicéridos circulantes , colesterol HDL , apolipoproteína A1 y apolipoproteína A2 , y disminuciones en el colesterol total , colesterol LDL , apolipoproteína B y lipoproteína (a) . [1] El estradiol transdérmico tiene efectos menos pronunciados sobre estas proteínas y, en contraste con el estradiol oral, reduce los triglicéridos. [1] A través de estos efectos, los estrógenos orales y transdérmicos pueden proteger contra la aterosclerosis y la enfermedad cardíaca coronaria en mujeres menopáusicas con endotelio arterial intacto que no tiene lesiones graves . [1]
Aproximadamente el 95% del estradiol ingerido por vía oral se inactiva durante el metabolismo de primer paso. [93] No obstante, los niveles de estradiol en el hígado con la administración oral son suprafisiológicos y aproximadamente 4 a 5 veces más altos que en la circulación debido al primer paso. [1] [113] Esto no ocurre con las vías parenterales de estradiol, como la transdérmica, la vaginal o la inyección. [1] A diferencia del estradiol, el etinilestradiol es mucho más resistente al metabolismo hepático, con una biodisponibilidad oral media de aproximadamente el 45%, [114] y la vía transdérmica tiene un impacto similar en la síntesis de proteínas hepáticas que la vía oral. [115] Los estrógenos conjugados también son más resistentes al metabolismo hepático que el estradiol y muestran efectos desproporcionados en la producción de proteínas hepáticas también, aunque no en la misma magnitud que el etinilestradiol. [1] Se considera que estas diferencias son responsables del mayor riesgo de eventos cardiovasculares con etinilestradiol y estrógenos conjugados en relación con el estradiol. [1]
Los estrógenos sintéticos orales en dosis altas, como el dietilestilbestrol y el etinilestradiol, se asocian con tasas bastante altas de complicaciones cardiovasculares graves. [116] [117] El dietilestilbestrol se ha asociado con un riesgo de hasta el 35 % de toxicidad cardiovascular y muerte y una incidencia del 15 % de TEV en hombres tratados con él para el cáncer de próstata. [116] [117] A diferencia de los estrógenos sintéticos orales, no se ha encontrado que el fosfato de poliestradiol en dosis altas y el estradiol transdérmico aumenten el riesgo de mortalidad cardiovascular o tromboembolia en hombres con cáncer de próstata, aunque se ha observado una morbilidad cardiovascular significativamente mayor (debido principalmente a un aumento de eventos cardíacos isquémicos no fatales y descompensación cardíaca ) con el fosfato de poliestradiol. [117] [118] [119]
Los niveles de globulina transportadora de hormonas sexuales (SHBG) indican exposición estrogénica hepática y pueden ser un marcador sustituto de riesgo de coagulación y TEV con terapia con estrógenos, aunque este tema ha sido debatido. [120] [121] [122] Los niveles de SHBG con píldoras anticonceptivas que contienen diferentes progestinas aumentan de 1,5 a 2 veces con levonorgestrel , de 2,5 a 4 veces con desogestrel y gestodeno , de 3,5 a 4 veces con drospirenona y dienogest , y de 4 a 5 veces con acetato de ciproterona . [120] También se ha descubierto que los anillos vaginales anticonceptivos y los parches anticonceptivos aumentan los niveles de SHBG en 2,5 y 3,5 veces, respectivamente. [120] Las píldoras anticonceptivas que contienen altas dosis de etinilestradiol (>50 μg) pueden aumentar los niveles de SHBG de 5 a 10 veces, lo que es similar al aumento que ocurre durante el embarazo. [123] Por el contrario, los aumentos en los niveles de SHBG son mucho menores con estradiol, especialmente cuando se usa por vía parenteral. [124] [125] [126] [127] [128] Se ha descubierto que la terapia con fosfato de poliestradiol parenteral en dosis altas aumenta los niveles de SHBG aproximadamente 1,5 veces. [127]
| Tipo | Ruta | Medicamentos | Razón de probabilidades ( IC del 95 %)Intervalo de confianza de la información sobre herramientas) |
|---|---|---|---|
| Terapia hormonal para la menopausia | Oral | Estradiol solo ≤1 mg/día >1 mg/día | 1,27 (1,16–1,39)* 1,22 (1,09–1,37)* 1,35 (1,18–1,55)* |
| Estrógenos conjugados solos ≤0,625 mg/día >0,625 mg/día | 1,49 (1,39–1,60)* 1,40 (1,28–1,53)* 1,71 (1,51–1,93)* | ||
| Acetato de estradiol/medroxiprogesterona | 1,44 (1,09–1,89)* | ||
| Estradiol/didrogesterona ≤1 mg/día E2 >1 mg/día E2 | 1,18 (0,98–1,42) 1,12 (0,90–1,40) 1,34 (0,94–1,90) | ||
| Estradiol/noretisterona ≤1 mg/día E2 >1 mg/día E2 | 1,68 (1,57–1,80)* 1,38 (1,23–1,56)* 1,84 (1,69–2,00)* | ||
| Estradiol/norgestrel o estradiol/drospirenona | 1,42 (1,00–2,03) | ||
| Estrógenos conjugados/acetato de medroxiprogesterona | 2,10 (1,92–2,31)* | ||
| Estrógenos conjugados/norgestrel ≤0,625 mg/día de CEE >0,625 mg/día de CEE | 1,73 (1,57–1,91)* 1,53 (1,36–1,72)* 2,38 (1,99–2,85)* | ||
| Tibolona sola | 1,02 (0,90–1,15) | ||
| Raloxifeno solo | 1,49 (1,24–1,79)* | ||
| Transdérmico | Estradiol solo ≤50 μg/día >50 μg/día | 0,96 (0,88–1,04) 0,94 (0,85–1,03) 1,05 (0,88–1,24) | |
| Estradiol / progestágeno | 0,88 (0,73–1,01) | ||
| Vaginal | Estradiol solo | 0,84 (0,73–0,97) | |
| Estrógenos conjugados solos | 1,04 (0,76–1,43) | ||
| Anticoncepción combinada | Oral | Etinilestradiol/noretisterona | 2,56 (2,15–3,06)* |
| Etinilestradiol/levonorgestrel | 2,38 (2,18–2,59)* | ||
| Etinilestradiol/norgestimato | 2,53 (2,17–2,96)* | ||
| Etinilestradiol/desogestrel | 4,28 (3,66–5,01)* | ||
| Etinilestradiol/gestodeno | 3,64 (3,00–4,43)* | ||
| Etinilestradiol/drospirenona | 4,12 (3,43–4,96)* | ||
| Acetato de etinilestradiol/ciproterona | 4,27 (3,57–5,11)* | ||
| Notas: (1) Estudios de casos y controles anidados (2015, 2019) basados en datos de las bases de datos QResearch y Clinical Practice Research Datalink (CPRD). (2) No se incluyó la progesterona bioidéntica , pero se sabe que no se asocia con ningún riesgo adicional en relación con el estrógeno solo. Notas al pie: * = Estadísticamente significativo ( p < 0,01). Fuentes : Ver plantilla. | |||
| Incidencia absoluta de primera TEV por 10.000 personas-año durante el embarazo y el período posparto | ||||||||
|---|---|---|---|---|---|---|---|---|
| Datos suecos A | Datos suecos B | Datos en inglés | Datos daneses | |||||
| Periodo de tiempo | norte | Tasa (IC del 95%) | norte | Tasa (IC del 95%) | norte | Tasa (IC del 95%) | norte | Tasa (IC del 95%) |
| Embarazo fuera del horario laboral | 1105 | 4.2 (4.0–4.4) | 1015 | 3.8 (?) | 1480 | 3.2 (3.0–3.3) | 2895 | 3.6 (3.4–3.7) |
| Anteparto | 995 | 20,5 (19,2–21,8) | 690 | 14.2 (13.2–15.3) | 156 | 9,9 (8,5–11,6) | 491 | 10,7 (9,7–11,6) |
| Trimestre 1 | 207 | 13,6 (11,8–15,5) | 172 | 11.3 (9.7–13.1) | 23 | 4.6 (3.1–7.0) | 61 | 4.1 (3.2–5.2) |
| Trimestre 2 | 275 | 17,4 (15,4–19,6) | 178 | 11,2 (9,7–13,0) | 30 | 5.8 (4.1–8.3) | 75 | 5.7 (4.6–7.2) |
| Trimestre 3 | 513 | 29,2 (26,8–31,9) | 340 | 19,4 (17,4–21,6) | 103 | 18,2 (15,0–22,1) | 355 | 19,7 (17,7–21,9) |
| Alrededor de la entrega | 115 | 154,6 (128,8–185,6) | 79 | 106,1 (85,1–132,3) | 34 | 142,8 (102,0–199,8) | – | |
| Posparto | 649 | 42,3 (39,2–45,7) | 509 | 33,1 (30,4–36,1) | 135 | 27,4 (23,1–32,4) | 218 | 17,5 (15,3–20,0) |
| Posparto temprano | 584 | 75,4 (69,6–81,8) | 460 | 59,3 (54,1–65,0) | 177 | 46,8 (39,1–56,1) | 199 | 30,4 (26,4–35,0) |
| Posparto tardío | 65 | 8,5 (7,0–10,9) | 49 | 6,4 (4,9–8,5) | 18 | 7.3 (4.6–11.6) | 319 | 3.2 (1.9–5.0) |
| Razones de tasas de incidencia (IRR) de la primera TEV durante el embarazo y el período posparto | ||||||||
| Datos suecos A | Datos suecos B | Datos en inglés | Datos daneses | |||||
| Periodo de tiempo | TIR* (IC del 95%) | TIR* (IC del 95%) | TIR (IC del 95 %)† | TIR (IC del 95 %)† | ||||
| Embarazo fuera del horario laboral | Referencia (es decir, 1,00) | |||||||
| Anteparto | 5.08 (4.66–5.54) | 3,80 (3,44–4,19) | 3.10 (2.63–3.66) | 2,95 (2,68–3,25) | ||||
| Trimestre 1 | 3,42 (2,95–3,98) | 3,04 (2,58–3,56) | 1,46 (0,96–2,20) | 1,12 (0,86–1,45) | ||||
| Trimestre 2 | 4,31 (3,78–4,93) | 3.01 (2.56–3.53) | 1,82 (1,27–2,62) | 1,58 (1,24–1,99) | ||||
| Trimestre 3 | 7,14 (6,43–7,94) | 5.12 (4.53–5.80) | 5,69 (4,66–6,95) | 5,48 (4,89–6,12) | ||||
| Alrededor de la entrega | 37,5 (30,9–44,45) | 27,97 (22,24–35,17) | 44,5 (31,68–62,54) | – | ||||
| Posparto | 10.21 (9.27–11.25) | 8,72 (7,83–9,70) | 8.54 (7.16–10.19) | 4,85 (4,21–5,57) | ||||
| Posparto temprano | 19.27 (16.53–20.21) | 15,62 (14,00–17,45) | 14.61 (12.10–17.67) | 8,44 (7,27–9,75) | ||||
| Posparto tardío | 2,06 (1,60–2,64) | 1,69 (1,26–2,25) | 2,29 (1,44–3,65) | 0,89 (0,53–1,39) | ||||
| Notas: Datos suecos A = Uso de cualquier código para TEV independientemente de la confirmación. Datos suecos B = Uso solo de TEV confirmada por algoritmo. Posparto temprano = Primeras 6 semanas después del parto. Posparto tardío = Más de 6 semanas después del parto. * = Ajustado por edad y año calendario. † = Razón no ajustada calculada en base a los datos proporcionados. Fuente: [129] | ||||||||
Cáncer de mama
Los estrógenos son responsables del desarrollo de los senos y, en relación con esto, están fuertemente implicados en el desarrollo del cáncer de mama . [130] [131] Además, los estrógenos estimulan el crecimiento y aceleran la progresión del cáncer de mama ER-positivo . [132] [133] De acuerdo con esto, los antiestrógenos como el modulador selectivo del receptor de estrógeno (SERM) tamoxifeno , el antagonista de ER fulvestrant y los inhibidores de la aromatasa (IA) anastrozol y exemestano son todos efectivos en el tratamiento del cáncer de mama ER-positivo. [134] [135] [136] Los antiestrógenos también son efectivos en la prevención del cáncer de mama. [137] [138] [139] Paradójicamente, la terapia con estrógenos en dosis altas también es efectiva en el tratamiento del cáncer de mama y tiene aproximadamente el mismo grado de efectividad que la terapia antiestrógeno, aunque se usa mucho menos comúnmente debido a los efectos adversos. [140] [141] La utilidad de la terapia con estrógenos en dosis altas en el tratamiento del cáncer de mama con ER positivo se atribuye a un efecto bimodal en el que altas concentraciones de estrógenos envían señales a las células del cáncer de mama para que experimenten apoptosis , en contraste con concentraciones más bajas de estrógenos que estimulan su crecimiento. [140] [141]
Una revisión sistemática y un metanálisis de 14 estudios de 2017 evaluaron el riesgo de cáncer de mama en mujeres perimenopáusicas y posmenopáusicas tratadas con estrógenos para los síntomas de la menopausia. [142] Encontraron que el tratamiento con estradiol solo no está asociado con un mayor riesgo de cáncer de mama ( ORProporción de probabilidades de la información sobre herramientas= 0,90 en RCTInformación sobre herramientas sobre ensayos controlados aleatoriosy OR = 1,11 en estudios observacionales ). [142] Esto estuvo de acuerdo con un análisis previo del tratamiento con solo estrógenos con estradiol o estrógenos conjugados que de manera similar no encontró un aumento del riesgo ( RR = 0,99). [142] Además, otro estudio encontró que el riesgo de cáncer de mama con estradiol y estrógenos conjugados no fue significativamente diferente ( RR = 1,15 para estrógenos conjugados versus estradiol). [142] Estos hallazgos son paradójicos porque la ooforectomía en mujeres premenopáusicas y la terapia antiestrógeno en mujeres posmenopáusicas están bien establecidas como una reducción considerable del riesgo de cáncer de mama ( RR = 0,208 a 0,708 para la quimioprevención con antiestrógenos en mujeres posmenopáusicas). [137] [138] [139] Sin embargo, hay indicios de que puede haber un efecto techo tal que más allá de un cierto umbral de concentración baja (por ejemplo, aproximadamente 10,2 pg/ml para el estradiol), los estrógenos adicionales por sí solos pueden no aumentar aún más el riesgo de cáncer de mama en mujeres posmenopáusicas. [143] También hay indicios de que las fluctuaciones en los niveles de estrógeno a lo largo del ciclo menstrual normal en mujeres premenopáusicas pueden ser importantes para el riesgo de cáncer de mama. [144]
A diferencia de la terapia con solo estrógenos, el tratamiento combinado de estrógenos y progestágenos, aunque depende del progestágeno utilizado, se asocia con un mayor riesgo de cáncer de mama. [142] [145] El aumento del riesgo depende de la duración del tratamiento, con más de cinco años ( OR = 2,43) teniendo un riesgo significativamente mayor que menos de cinco años ( OR = 1,49). [142] Además, el tratamiento secuencial de estrógenos y progestágenos ( OR = 1,76) se asocia con un menor aumento del riesgo que el tratamiento continuo ( OR = 2,90), que tiene un riesgo comparativamente mucho mayor. [142] El aumento del riesgo también difiere según el progestágeno específico utilizado. [142] El tratamiento con estradiol más acetato de medroxiprogesterona ( OR = 1,19), acetato de noretisterona ( OR = 1,44), levonorgestrel ( OR = 1,47) o un subgrupo de progestágenos mixtos ( OR = 1,99) se asociaron con un mayor riesgo. [142] En una revisión anterior, se encontró que el aumento del riesgo de cáncer de mama no era significativamente diferente entre estos tres progestágenos. [142] Por el contrario, no hay un aumento significativo del riesgo de cáncer de mama con progesterona bioidéntica ( OR = 1,00) o con la progestina atípica didrogesterona ( OR = 1,10). [142] De acuerdo con esto, otro estudio encontró de manera similar que el riesgo de cáncer de mama no aumentó significativamente con estrógeno-progesterona ( RRInformación sobre herramientas sobre riesgo relativo= 1,00) o estrógeno-didrogesterona ( RR = 1,16) pero aumentó para el estrógeno combinado con otras progestinas ( RR = 1,69). [91] Estas progestinas incluían acetato de clormadinona , acetato de ciproterona , medrogestona , acetato de medroxiprogesterona , acetato de nomegestrol , acetato de noretisterona y promegestona , y las asociaciones para el riesgo de cáncer de mama no diferían significativamente entre las diferentes progestinas en este grupo. [91]
A diferencia de las mujeres cisgénero, el cáncer de mama es extremadamente raro en hombres y mujeres transgénero tratados con estrógenos y/o progestágenos, y la ginecomastia o el desarrollo de las mamas en dichos individuos no parece estar asociado con un mayor riesgo de cáncer de mama. [146] [147] [148] [149] Asimismo, nunca se ha informado de cáncer de mama en mujeres con síndrome de insensibilidad completa a los andrógenos , que de manera similar tienen un genotipo masculino (46,XY), a pesar del hecho de que estas mujeres tienen mamas bien desarrolladas. [150] [151] Se desconocen las razones de estas diferencias. Sin embargo, el riesgo drásticamente mayor de cáncer de mama (de 20 a 58 veces) en hombres con síndrome de Klinefelter , que tienen algo así como un híbrido de un genotipo masculino y femenino (47,XXY), sugiere que puede tener que ver con los cromosomas sexuales . [149] [152] [153]
| Terapia | <5 años | 5–14 años | 15+ años | |||
|---|---|---|---|---|---|---|
| Casos | RRInformación sobre herramientas Riesgo relativo ajustado( IC del 95%)Intervalo de confianza de la información sobre herramientas) | Casos | RRInformación sobre herramientas Riesgo relativo ajustado( IC del 95%)Intervalo de confianza de la información sobre herramientas) | Casos | RRInformación sobre herramientas Riesgo relativo ajustado( IC del 95%)Intervalo de confianza de la información sobre herramientas) | |
| Estrógeno solo | 1259 | 1.18 (1.10–1.26) | 4869 | 1,33 (1,28–1,37) | 2183 | 1,58 (1,51–1,67) |
| Por estrógeno | ||||||
| Estrógenos conjugados | 481 | 1,22 (1,09–1,35) | 1910 | 1,32 (1,25–1,39) | 1179 | 1,68 (1,57–1,80) |
| Estradiol | 346 | 1,20 (1,05–1,36) | 1580 | 1,38 (1,30–1,46) | 435 | 1,78 (1,58–1,99) |
| Estropipato (sulfato de estrona) | 9 | 1,45 (0,67–3,15) | 50 | 1,09 (0,79–1,51) | 28 | 1,53 (1,01–2,33) |
| Estriol | 15 | 1,21 (0,68–2,14) | 44 | 1,24 (0,89–1,73) | 9 | 1,41 (0,67–2,93) |
| Otros estrógenos | 15 | 0,98 (0,46–2,09) | 21 | 0,98 (0,58–1,66) | 5 | 0,77 (0,27–2,21) |
| Por ruta | ||||||
| Estrógenos orales | – | – | 3633 | 1,33 (1,27–1,38) | – | – |
| Estrógenos transdérmicos | – | – | 919 | 1,35 (1,25–1,46) | – | – |
| Estrógenos vaginales | – | – | 437 | 1,09 (0,97–1,23) | – | – |
| Estrógeno y progestágeno | 2419 | 1,58 (1,51–1,67) | 8319 | 2.08 (2.02–2.15) | 1424 | 2,51 (2,34–2,68) |
| Por progestágeno | ||||||
| (Levo)norgestrel | 343 | 1,70 (1,49–1,94) | 1735 | 2.12 (1.99–2.25) | 219 | 2,69 (2,27–3,18) |
| Acetato de noretisterona | 650 | 1,61 (1,46–1,77) | 2642 | 2.20 (2.09–2.32) | 420 | 2,97 (2,60–3,39) |
| Acetato de medroxiprogesterona | 714 | 1,64 (1,50–1,79) | 2012 | 2,07 (1,96–2,19) | 411 | 2,71 (2,39–3,07) |
| didrogesterona | 65 | 1,21 (0,90–1,61) | 162 | 1,41 (1,17–1,71) | 26 | 2,23 (1,32–3,76) |
| Progesterona | 11 | 0,91 (0,47–1,78) | 38 | 2,05 (1,38–3,06) | 1 | – |
| Promegstone | 12 | 1,68 (0,85–3,31) | 19 | 2,06 (1,19–3,56) | 0 | – |
| Acetato de nomegestrol | 8 | 1,60 (0,70–3,64) | 14 | 1,38 (0,75–2,53) | 0 | – |
| Otros progestágenos | 12 | 1,70 (0,86–3,38) | 19 | 1,79 (1,05–3,05) | 0 | – |
| Por frecuencia de progestágeno | ||||||
| Continuo | – | – | 3948 | 2.30 (2.21–2.40) | – | – |
| Intermitente | – | – | 3467 | 1,93 (1,84–2,01) | – | – |
| Progestágeno solo | 98 | 1,37 (1,08–1,74) | 107 | 1,39 (1,11–1,75) | 30 | 2.10 (1.35–3.27) |
| Por progestágeno | ||||||
| Acetato de medroxiprogesterona | 28 | 1,68 (1,06–2,66) | 18 | 1,16 (0,68–1,98) | 7 | 3.42 (1.26–9.30) |
| Acetato de noretisterona | 13 | 1,58 (0,77–3,24) | 24 | 1,55 (0,88–2,74) | 6 | 3,33 (0,81–13,8) |
| didrogesterona | 3 | 2,30 (0,49–10,9) | 11 | 3,31 (1,39–7,84) | 0 | – |
| Otros progestágenos | 8 | 2,83 (1,04–7,68) | 5 | 1,47 (0,47–4,56) | 1 | – |
| Misceláneas | ||||||
| Tibolona | – | – | 680 | 1,57 (1,43–1,72) | – | – |
| Notas: Metaanálisis de la evidencia epidemiológica mundial sobre la terapia hormonal menopáusica y el riesgo de cáncer de mama realizado por el Grupo Colaborativo sobre Factores Hormonales en el Cáncer de Mama (CGHFBC). Riesgos relativos totalmente ajustados para usuarias actuales y no usuarias de terapia hormonal menopáusica. Fuente : Ver plantilla. | ||||||
| Estudiar | Terapia | Cociente de riesgo ( IC del 95%)Intervalo de confianza de la información sobre herramientas) |
|---|---|---|
| E3N-EPIC: Fournier y otros (2005) | Estrógeno solo | 1,1 (0,8–1,6) |
| Estrógeno más progesterona Estrógeno transdérmico Estrógeno oral | 0,9 (0,7–1,2) 0,9 (0,7–1,2) Sin eventos | |
| Estrógeno más progestina Estrógeno transdérmico Estrógeno oral | 1,4 (1,2–1,7) 1,4 (1,2–1,7) 1,5 (1,1–1,9) | |
| E3N-EPIC: Fournier y otros (2008) | Estrógeno oral solo | 1,32 (0,76–2,29) |
| Estrógeno oral más progestágeno Progesterona Didrogesterona Medrogestona Acetato de clormadinona Acetato de ciproterona Promegstone Acetato de nomegestrol Acetato de noretisterona Acetato de medroxiprogesterona | No analizado a 0,77 (0,36–1,62) 2,74 (1,42–5,29) 2,02 (1,00–4,06) 2,57 (1,81–3,65) 1,62 (0,94–2,82) 1,10 (0,55–2,21) 2,11 (1,56–2,86) 1,48 (1,02–2,16) | |
| Estrógeno transdérmico solo | 1,28 (0,98–1,69) | |
| Estrógeno más progestágeno transdérmico Progesterona Didrogesterona Medrogestona Acetato de clormadinona Acetato de ciproterona Promegstone Acetato de nomegestrol Acetato de noretisterona Acetato de medroxiprogesterona | 1,08 (0,89–1,31) 1,18 (0,95–1,48) 2,03 (1,39–2,97) 1,48 (1,05–2,09) No analizado a 1,52 (1,19–1,96) 1,60 (1,28–2,01) No analizado a No analizado a | |
| E3N-EPIC: Fournier y otros (2014) | Estrógeno solo | 1,17 (0,99–1,38) |
| Estrógeno más progesterona o didrogesterona | 1.22 (1.11–1.35) | |
| Estrógeno más progestina | 1,87 (1,71–2,04) | |
| CECILE: Cordina-Duverger et al. (2013) | Estrógeno solo | 1,19 (0,69–2,04) |
| Estrógeno más progestágeno Progesterona Progestinas Derivados de la progesterona Derivados de la testosterona | 1,33 (0,92–1,92) 0,80 (0,44–1,43) 1,72 (1,11–2,65) 1,57 (0,99–2,49) 3,35 (1,07–10,4) | |
| Notas a pie de página: a = No analizado, menos de 5 casos. Fuentes : Ver plantilla. | ||
| Estudiar | Terapia | Cociente de riesgo ( IC del 95%)Intervalo de confianza de la información sobre herramientas) |
|---|---|---|
| E3N-EPIC: Fournier y otros (2005) a | Estrógeno transdérmico más progesterona <2 años 2–4 años ≥4 años | 0,9 (0,6–1,4) 0,7 (0,4–1,2) 1,2 (0,7–2,0) |
| Estrógeno transdérmico más progestina <2 años 2–4 años ≥4 años | 1,6 (1,3–2,0) 1,4 (1,0–1,8) 1,2 (0,8–1,7) | |
| Estrógeno oral más progestina <2 años 2–4 años ≥4 años | 1,2 (0,9–1,8) 1,6 (1,1–2,3) 1,9 (1,2–3,2) | |
| E3N-EPIC: Fournier y otros (2008) | Estrógeno más progesterona <2 años 2–4 años 4–6 años ≥6 años | 0,71 (0,44–1,14) 0,95 (0,67–1,36) 1,26 (0,87–1,82) 1,22 (0,89–1,67) |
| Estrógeno más didrogesterona <2 años 2–4 años 4–6 años ≥6 años | 0,84 (0,51–1,38) 1,16 (0,79–1,71) 1,28 (0,83–1,99) 1,32 (0,93–1,86) | |
| Estrógeno más otros progestágenos <2 años 2–4 años 4–6 años ≥6 años | 1,36 (1,07–1,72) 1,59 (1,30–1,94) 1,79 (1,44–2,23) 1,95 (1,62–2,35) | |
| E3N-EPIC: Fournier y otros (2014) | Estrógenos más progesterona o didrogesterona <5 años ≥5 años | 1,13 (0,99–1,29) 1,31 (1,15–1,48) |
| Estrógeno más otros progestágenos <5 años ≥5 años | 1,70 (1,50–1,91) 2,02 (1,81–2,26) | |
| Notas al pie: a = No se analizó la terapia oral con estrógenos más progesterona porque hubo un bajo número de mujeres que utilizaron esta terapia. Fuentes : Ver plantilla. | ||
Hepatotoxicidad colestásica
Los estrógenos, junto con la progesterona, rara vez pueden causar hepatotoxicidad colestásica , particularmente en concentraciones muy altas. [154] [155] [156] Esto se observa en la colestasis intrahepática del embarazo , que ocurre en el 0,4 al 15% de los embarazos (muy variable según el país). [157] [158] [159] [160]
Enfermedad de la vesícula biliar
La terapia con estrógenos se ha asociado con la enfermedad de la vesícula biliar , incluido el riesgo de formación de cálculos biliares . [161] [162] [163] [164] Una revisión sistemática y un metanálisis de 2017 encontraron que la terapia hormonal menopáusica aumentó significativamente el riesgo de cálculos biliares ( RR = 1,79) mientras que los anticonceptivos orales no aumentaron significativamente el riesgo ( RR = 1,19). [164] El lodo biliar aparece en el 5 al 30% de las mujeres durante el embarazo, y los cálculos biliares definitivos que persisten después del parto se establecen en aproximadamente el 5%. [165]
Sobredosis
Los estrógenos son relativamente seguros en caso de sobredosis y los síntomas se manifiestan principalmente como feminización reversible.
Interacciones
Los inductores de las enzimas del citocromo P450 , como la carbamazepina y la fenitoína, pueden acelerar el metabolismo de los estrógenos y, por lo tanto, disminuir su biodisponibilidad y sus niveles circulantes. Los inhibidores de dichas enzimas pueden tener el efecto opuesto y pueden aumentar los niveles de estrógenos y su biodisponibilidad.
Farmacología
Farmacodinamia
Los estrógenos actúan como agonistas selectivos de los receptores de estrógeno (RE), el ERα y el ERβ . También pueden unirse y activar los receptores de estrógeno de membrana (REm), como el GPER . Los estrógenos no tienen actividad fuera del objetivo en otros receptores de hormonas esteroides , como los receptores de andrógenos , progesterona , glucocorticoides o mineralocorticoides , ni tienen actividad neuroesteroide al interactuar con los receptores de neurotransmisores , a diferencia de varios progestágenos y algunos otros esteroides. Administrado por inyección subcutánea en ratones, el estradiol es aproximadamente 10 veces más potente que la estrona y aproximadamente 100 veces más potente que el estriol. [166]
Los estrógenos tienen efectos antigonadotrópicos en concentraciones suficientemente altas a través de la activación del RE y, por lo tanto, pueden suprimir el eje hipotálamo-hipofisario-gonadal . Esto es causado por retroalimentación negativa , lo que resulta en una supresión de la secreción y una disminución de los niveles circulantes de la hormona folículo estimulante (FSH) y la hormona luteinizante (LH). Los efectos antigonadotrópicos de los estrógenos interfieren con la fertilidad y la producción de hormonas sexuales gonadales . Son responsables de los efectos anticonceptivos hormonales de los estrógenos. Además, permiten que los estrógenos actúen como antiandrógenos funcionales al suprimir la producción de testosterona gonadal. En dosis suficientemente altas, los estrógenos pueden suprimir los niveles de testosterona en el rango de castración en los hombres. [167]
Los estrógenos difieren significativamente en sus propiedades farmacológicas. [1] [168] [169] Por ejemplo, debido a las diferencias estructurales y las diferencias que las acompañan en el metabolismo , los estrógenos difieren entre sí en su selectividad tisular ; los estrógenos sintéticos como el etinilestradiol y el dietilestilbestrol no se inactivan tan eficientemente como el estradiol en tejidos como el hígado y el útero y, como resultado, tienen efectos desproporcionados en estos tejidos. [1] Esto puede resultar en problemas como un riesgo relativamente mayor de tromboembolia . [1]
In vitrofarmacodinamia
| Ligando | Otros nombres | Afinidades de unión relativas (RBA, %) a | Afinidades de unión absolutas (K i , nM) a | Acción | ||
|---|---|---|---|---|---|---|
| ERα | ERβ | ERα | ERβ | |||
| Estradiol | E2; 17β-estradiol | 100 | 100 | 0,115 (0,04–0,24) | 0,15 (0,10–2,08) | Estrógeno |
| Estrona | E1; 17-cetoestradiol | 16,39 (0,7–60) | 6.5 (1.36–52) | 0,445 (0,3–1,01) | 1,75 (0,35–9,24) | Estrógeno |
| Estriol | E3; 16α-OH-17β-E2 | 12,65 (4,03–56) | 26 (14,0–44,6) | 0,45 (0,35–1,4) | 0,7 (0,63–0,7) | Estrógeno |
| Estetrol | E4; 15α,16α-Di-OH-17β-E2 | 4.0 | 3.0 | 4.9 | 19 | Estrógeno |
| Alfatradiol | 17α-estradiol | 20,5 (7–80,1) | 8.195 (2–42) | 0,2–0,52 | 0,43–1,2 | Metabolito |
| 16-Epiestrol | 16β-Hidroxi-17β-estradiol | 7.795 (4.94–63) | 50 | ? | ? | Metabolito |
| 17-Epiestrol | 16α-Hidroxi-17α-estradiol | 55,45 (29–103) | 79–80 | ? | ? | Metabolito |
| 16,17-Epiestrol | 16β-Hidroxi-17α-estradiol | 1.0 | 13 | ? | ? | Metabolito |
| 2-Hidroxiestradiol | 2-OH-E2 | 22 (7–81) | 11–35 | 2.5 | 1.3 | Metabolito |
| 2-Metoxiestradiol | 2-MeO-E2 | 0,0027–2,0 | 1.0 | ? | ? | Metabolito |
| 4-Hidroxiestradiol | 4-OH-E2 | 13 (8–70) | 7–56 | 1.0 | 1.9 | Metabolito |
| 4-Metoxiestradiol | 4-MeO-E2 | 2.0 | 1.0 | ? | ? | Metabolito |
| 2-Hidroxiestrona | 2-OH-E1 | 2.0–4.0 | 0,2–0,4 | ? | ? | Metabolito |
| 2-Metoxiestrona | 2-MeO-E1 | <0,001–<1 | <1 | ? | ? | Metabolito |
| 4-Hidroxiestrona | 4-OH-E1 | 1.0–2.0 | 1.0 | ? | ? | Metabolito |
| 4-Metoxiestrona | 4-MeO-E1 | <1 | <1 | ? | ? | Metabolito |
| 16α-Hidroxiestrona | 16α-OH-E1; 17-cetoestriol | 2,0–6,5 | 35 | ? | ? | Metabolito |
| 2-Hidroxiestriol | 2-OH-E3 | 2.0 | 1.0 | ? | ? | Metabolito |
| 4-Metoxiestriol | 4-MeO-E3 | 1.0 | 1.0 | ? | ? | Metabolito |
| Sulfato de estradiol | E2S; 3-sulfato de estradiol | <1 | <1 | ? | ? | Metabolito |
| Disulfato de estradiol | 3,17β-disulfato de estradiol | 0,0004 | ? | ? | ? | Metabolito |
| 3-glucurónido de estradiol | E2-3G | 0,0079 | ? | ? | ? | Metabolito |
| 17β-glucurónido de estradiol | E2-17G | 0,0015 | ? | ? | ? | Metabolito |
| 3-glucosa 17β-sulfato de estradiol | E2-3G-17S | 0,0001 | ? | ? | ? | Metabolito |
| Sulfato de estrona | E1S; 3-sulfato de estrona | <1 | <1 | >10 | >10 | Metabolito |
| Benzoato de estradiol | EB; 3-benzoato de estradiol | 10 | ? | ? | ? | Estrógeno |
| 17β-benzoato de estradiol | E2-17B | 11.3 | 32.6 | ? | ? | Estrógeno |
| Éter metílico de estrona | Éter 3-metílico de estrona | 0,145 | ? | ? | ? | Estrógeno |
| ent -Estradiol | 1-Estradiol | 1.31–12.34 | 9,44–80,07 | ? | ? | Estrógeno |
| Equilina | 7-Dehidroestrona | 13 (4,0–28,9) | 13.0–49 | 0,79 | 0,36 | Estrógeno |
| Equilenina | 6,8-Didehidroestrona | 2.0–15 | 7.0–20 | 0,64 | 0,62 | Estrógeno |
| 17β-Dihidroequilina | 7-Dehidro-17β-estradiol | 7.9–113 | 7.9–108 | 0,09 | 0,17 | Estrógeno |
| 17α-Dihidroequilina | 7-Dehidro-17α-estradiol | 18.6 (18–41) | 14–32 | 0,24 | 0,57 | Estrógeno |
| 17β-Dihidroequilenina | 6,8-Didehidro-17β-estradiol | 35–68 | 90–100 | 0,15 | 0,20 | Estrógeno |
| 17α-Dihidroequilenina | 6,8-Didehidro-17α-estradiol | 20 | 49 | 0,50 | 0,37 | Estrógeno |
| Δ8 - estradiol | 8,9-Dehidro-17β-estradiol | 68 | 72 | 0,15 | 0,25 | Estrógeno |
| Δ 8 -Estrona | 8,9-Dehidroestrona | 19 | 32 | 0,52 | 0,57 | Estrógeno |
| Etinilestradiol | EE; 17α-Etinil-17β-E2 | 120,9 (68,8–480) | 44,4 (2,0–144) | 0,02–0,05 | 0,29–0,81 | Estrógeno |
| Mestranol | EE 3-metil éter | ? | 2.5 | ? | ? | Estrógeno |
| Moxestrol | RU-2858; 11β-Metoxi-EE | 35–43 | 5–20 | 0,5 | 2.6 | Estrógeno |
| Metilestradiol | 17α-Metil-17β-estradiol | 70 | 44 | ? | ? | Estrógeno |
| Dietilestilbestrol | DES; Estilbestrol | 129,5 (89,1–468) | 219,63 (61,2–295) | 0,04 | 0,05 | Estrógeno |
| Hexestrol | Dihidrodietilestilbestrol | 153.6 (31–302) | 60–234 | 0,06 | 0,06 | Estrógeno |
| Dienestrol | Dehidrostilbestrol | 37 (20.4–223) | 56–404 | 0,05 | 0,03 | Estrógeno |
| Benzestrol (B2) | – | 114 | ? | ? | ? | Estrógeno |
| Clorotrianiseno | TACE | 1,74 | ? | 15.30 | ? | Estrógeno |
| Trifeniletileno | TPE | 0,074 | ? | ? | ? | Estrógeno |
| Trifenilbromoetileno | TPBE | 2.69 | ? | ? | ? | Estrógeno |
| Tamoxifeno | ICI-46,474 | 3 (0,1–47) | 3,33 (0,28–6) | 3,4–9,69 | 2.5 | SERM |
| Afimoxifeno | 4-Hidroxitamoxifeno; 4-OHT | 100.1 (1.7–257) | 10 (0,98–339) | 2,3 (0,1–3,61) | 0,04–4,8 | SERM |
| Toremifeno | 4-Clorotamoxifeno; 4-CT | ? | ? | 7.14–20.3 | 15.4 | SERM |
| Clomifeno | LMR-41 | 25 (19.2–37.2) | 12 | 0.9 | 1.2 | SERM |
| Ciclofenil | F-6066; Sexovid | 151–152 | 243 | ? | ? | SERM |
| Nafoxidina | U-11.000A | 30.9–44 | 16 | 0.3 | 0,8 | SERM |
| Raloxifeno | – | 41.2 (7.8–69) | 5,34 (0,54–16) | 0,188–0,52 | 20.2 | SERM |
| Arzoxifeno | LY-353,381 | ? | ? | 0,179 | ? | SERM |
| Lasofoxifeno | CP-336,156 | 10.2–166 | 19.0 | 0,229 | ? | SERM |
| Ormeloxifeno | Centcromante | ? | ? | 0,313 | ? | SERM |
| Levormeloxifeno | 6720-CDRI; NNC-460,020 | 1,55 | 1,88 | ? | ? | SERM |
| Ospemifeno | Desaminohidroxitoremifeno | 0,82–2,63 | 0,59–1,22 | ? | ? | SERM |
| Bazedoxifeno | – | ? | ? | 0,053 | ? | SERM |
| Etacstil | GW-5638 | 4.30 | 11.5 | ? | ? | SERM |
| ICI-164,384 | – | 63,5 (3,70–97,7) | 166 | 0,2 | 0,08 | Antiestrógeno |
| Fulvestrant | ICI-182,780 | 43,5 (9,4–325) | 21,65 (2,05–40,5) | 0,42 | 1.3 | Antiestrógeno |
| Propilpirazoltriol | Presentación en PowerPoint | 49 (10,0–89,1) | 0,12 | 0,40 | 92.8 | Agonista de ERα |
| 16α-LE2 | 16α-Lactona-17β-estradiol | 14.6–57 | 0,089 | 0,27 | 131 | Agonista de ERα |
| 16α-Yodo-E2 | 16α-Yodo-17β-estradiol | 30.2 | 2.30 | ? | ? | Agonista de ERα |
| Metilpiperidinopirazol | Miembro del Parlamento | 11 | 0,05 | ? | ? | Antagonista de ERα |
| Diarilpropionitrilo | DP | 0,12–0,25 | 6.6–18 | 32.4 | 1.7 | Agonista de ERβ |
| 8β-VE2 | 8β-vinil-17β-estradiol | 0,35 | 22.0–83 | 12.9 | 0,50 | Agonista de ERβ |
| Prinaberel | ERB-041; VÍA-202,041 | 0,27 | 67–72 | ? | ? | Agonista de ERβ |
| ERB-196 | VÍA-202,196 | ? | 180 | ? | ? | Agonista de ERβ |
| Erteberel | SERBA-1; LY-500,307 | ? | ? | 2.68 | 0,19 | Agonista de ERβ |
| SERBA-2 | – | ? | ? | 14.5 | 1.54 | Agonista de ERβ |
| Cumestrol | – | 9,225 (0,0117–94) | 64,125 (0,41–185) | 0,14–80,0 | 0,07–27,0 | Xenoestrógeno |
| Genisteína | – | 0,445 (0,0012–16) | 33,42 (0,86–87) | 2.6–126 | 0,3–12,8 | Xenoestrógeno |
| Equol | – | 0,2–0,287 | 0,85 (0,10–2,85) | ? | ? | Xenoestrógeno |
| Daidzeína | – | 0,07 (0,0018–9,3) | 0,7865 (0,04–17,1) | 2.0 | 85.3 | Xenoestrógeno |
| Biocanina A | – | 0,04 (0,022–0,15) | 0,6225 (0,010–1,2) | 174 | 8.9 | Xenoestrógeno |
| Kaempferol | – | 0,07 (0,029–0,10) | 2,2 (0,002–3,00) | ? | ? | Xenoestrógeno |
| Naringenina | – | 0,0054 (<0,001–0,01) | 0,15 (0,11–0,33) | ? | ? | Xenoestrógeno |
| 8-Prenilnaringenina | 8-PN | 4.4 | ? | ? | ? | Xenoestrógeno |
| Quercetina | – | <0,001–0,01 | 0,002–0,040 | ? | ? | Xenoestrógeno |
| Ipriflavona | – | <0,01 | <0,01 | ? | ? | Xenoestrógeno |
| Miroestrol | – | 0,39 | ? | ? | ? | Xenoestrógeno |
| Desoximiroestrol | – | 2.0 | ? | ? | ? | Xenoestrógeno |
| β-sitosterol | – | <0,001–0,0875 | <0,001–0,016 | ? | ? | Xenoestrógeno |
| Resveratrol | – | <0,001–0,0032 | ? | ? | ? | Xenoestrógeno |
| α-zearalenol | – | 48 (13–52,5) | ? | ? | ? | Xenoestrógeno |
| β-Zearalenol | – | 0,6 (0,032–13) | ? | ? | ? | Xenoestrógeno |
| Zeranol | α-Zearalanol | 48–111 | ? | ? | ? | Xenoestrógeno |
| Taleranol | β-Zearalanol | 16 (13–17.8) | 14 | 0,8 | 0.9 | Xenoestrógeno |
| Zearalenona | ZEN | 7,68 (2,04–28) | 9.45 (2.43–31.5) | ? | ? | Xenoestrógeno |
| Zearalanona | ZAN | 0,51 | ? | ? | ? | Xenoestrógeno |
| Bisfenol A | BPA | 0,0315 (0,008–1,0) | 0,135 (0,002–4,23) | 195 | 35 | Xenoestrógeno |
| Endosulfán | EDS | <0,001–<0,01 | <0,01 | ? | ? | Xenoestrógeno |
| Kepone | Clordecona | 0,0069–0,2 | ? | ? | ? | Xenoestrógeno |
| o,p'- DDT | – | 0,0073–0,4 | ? | ? | ? | Xenoestrógeno |
| p,p'- DDT | – | 0,03 | ? | ? | ? | Xenoestrógeno |
| Metoxicloro | p,p'- Dimetoxi-DDT | 0,01 (<0,001–0,02) | 0,01–0,13 | ? | ? | Xenoestrógeno |
| HPTE | Hidroxicloro; p,p' -OH-DDT | 1.2–1.7 | ? | ? | ? | Xenoestrógeno |
| Testosterona | T; 4-Androstenolona | <0,0001–<0,01 | <0,002–0,040 | >5000 | >5000 | Andrógino |
| Dihidrotestosterona | DHT; 5α-Androstanolona | 0,01 (<0,001–0,05) | 0,0059–0,17 | 221–>5000 | 73–1688 | Andrógino |
| Nandrolona | 19-Nortestosterona; 19-NT | 0,01 | 0,23 | 765 | 53 | Andrógino |
| Dehidroepiandrosterona | DHEA; Prasterona | 0,038 (<0,001–0,04) | 0,019–0,07 | 245–1053 | 163–515 | Andrógino |
| 5-Androstenediol | A5; Androstenediol | 6 | 17 | 3.6 | 0.9 | Andrógino |
| 4-Androstenediol | – | 0,5 | 0.6 | 23 | 19 | Andrógino |
| 4-Androstenediona | A4; Androstenediona | <0,01 | <0,01 | >10000 | >10000 | Andrógino |
| 3α-Androstanodiol | 3α-Adiol | 0,07 | 0.3 | 260 | 48 | Andrógino |
| 3β-Androstanodiol | 3β-Adiol | 3 | 7 | 6 | 2 | Andrógino |
| Androstanediona | 5α-Androstanediona | <0,01 | <0,01 | >10000 | >10000 | Andrógino |
| Etiocolandiona | 5β-Androstanediona | <0,01 | <0,01 | >10000 | >10000 | Andrógino |
| Metiltestosterona | 17α-Metiltestosterona | <0,0001 | ? | ? | ? | Andrógino |
| Etinilestradiol-3α-androstanodiol | 17α-Etinil-3α-adiol | 4.0 | <0,07 | ? | ? | Estrógeno |
| Etinilestradiol-3β-androstano | 17α-Etinil-3β-adiol | 50 | 5.6 | ? | ? | Estrógeno |
| Progesterona | P4; 4-Pregnenediona | <0,001–0,6 | <0,001–0,010 | ? | ? | Progestágeno |
| Noretisterona | NET; 17α-Etinil-19-NT | 0,085 (0,0015–<0,1) | 0,1 (0,01–0,3) | 152 | 1084 | Progestágeno |
| Noretinodrel | 5(10)-Noretisterona | 0,5 (0,3–0,7) | <0,1–0,22 | 14 | 53 | Progestágeno |
| Tibolona | 7α-Metilnoretinodrel | 0,5 (0,45–2,0) | 0,2–0,076 | ? | ? | Progestágeno |
| Δ 4 -Tibolona | 7α-Metilnoretisterona | 0,069–<0,1 | 0,027–<0,1 | ? | ? | Progestágeno |
| 3α-Hidroxitibolona | – | 2,5 (1,06–5,0) | 0,6–0,8 | ? | ? | Progestágeno |
| 3β-Hidroxitibolona | – | 1,6 (0,75–1,9) | 0,070–0,1 | ? | ? | Progestágeno |
| Notas al pie: a = (1) Los valores de afinidad de unión tienen el formato "mediana (rango)" (# (#–#)), "rango" (#–#) o "valor" (#) según los valores disponibles. Los conjuntos completos de valores dentro de los rangos se pueden encontrar en el código Wiki. (2) Las afinidades de unión se determinaron mediante estudios de desplazamiento en una variedad de sistemas in vitro con estradiol marcado y proteínas ERα y ERβ humanas (excepto los valores ERβ de Kuiper et al. (1997), que son ERβ de rata). Fuentes: Ver página de plantilla. | ||||||
| Estrógeno | Afinidades de unión relativas (%) | ||||||
|---|---|---|---|---|---|---|---|
| ESReceptor de estrógeno | ArkansasReceptor de andrógenos | Relaciones públicasInformación sobre herramientas Receptor de progesterona | GRAMOInformación sobre herramientas Receptor de glucocorticoides | SEÑORInformación sobre herramientas Receptor de mineralocorticoides | SHBGInformación sobre herramientas Globulina transportadora de hormonas sexuales | CBGGlobulina transportadora de corticosteroides | |
| Estradiol | 100 | 7.9 | 2.6 | 0.6 | 0,13 | 8.7–12 | <0,1 |
| Benzoato de estradiol | ? | ? | ? | ? | ? | <0,1–0,16 | <0,1 |
| Valerato de estradiol | 2 | ? | ? | ? | ? | ? | ? |
| Estrona | 11–35 | <1 | <1 | <1 | <1 | 2.7 | <0,1 |
| Sulfato de estrona | 2 | 2 | ? | ? | ? | ? | ? |
| Estriol | 10–15 | <1 | <1 | <1 | <1 | <0,1 | <0,1 |
| Equilina | 40 | ? | ? | ? | ? | ? | 0 |
| Alfatradiol | 15 | <1 | <1 | <1 | <1 | ? | ? |
| Epiestrol | 20 | <1 | <1 | <1 | <1 | ? | ? |
| Etinilestradiol | 100–112 | 1–3 | 15–25 | 1–3 | <1 | 0,18 | <0,1 |
| Mestranol | 1 | ? | ? | ? | ? | <0,1 | <0,1 |
| Metilestradiol | 67 | 1–3 | 3–25 | 1–3 | <1 | ? | ? |
| Moxestrol | 12 | <0,1 | 0,8 | 3.2 | <0,1 | <0,2 | <0,1 |
| Dietilestilbestrol | ? | ? | ? | ? | ? | <0,1 | <0,1 |
| Notas: Los ligandos de referencia (100%) fueron progesterona para el PR.Información sobre herramientas sobre el receptor de progesterona, testosterona para la ARReceptor de andrógenos con información sobre herramientas, estradiol para el ERReceptor de estrógeno con información sobre herramientas, dexametasona para el GRReceptor de glucocorticoides con información sobre herramientas, aldosterona para el MRInformación sobre herramientas sobre el receptor de mineralocorticoides, dihidrotestosterona para SHBGInformación sobre herramientas sobre la globulina transportadora de hormonas sexuales, y cortisol para CBGGlobulina transportadora de corticosteroides. Fuentes: Ver plantilla. | |||||||
| Estrógeno | Otros nombres | Banco de Reserva de AustraliaInformación sobre herramientas Afinidad de enlace relativa(%) a | REP (%) b | |||
|---|---|---|---|---|---|---|
| ES | ERα | ERβ | ||||
| Estradiol | E2 | 100 | 100 | 100 | ||
| 3-sulfato de estradiol | E2S; E2-3S | ? | 0,02 | 0,04 | ||
| 3-glucurónido de estradiol | E2-3G | ? | 0,02 | 0,09 | ||
| 17β-glucurónido de estradiol | E2-17G | ? | 0,002 | 0,0002 | ||
| Benzoato de estradiol | EB; 3-benzoato de estradiol | 10 | 1.1 | 0,52 | ||
| 17β-acetato de estradiol | E2-17A | 31–45 | 24 | ? | ||
| Diacetato de estradiol | EDA; 3,17β-diacetato de estradiol | ? | 0,79 | ? | ||
| Propionato de estradiol | EP; 17β-propionato de estradiol | 19–26 | 2.6 | ? | ||
| Valerato de estradiol | EV; 17β-valerato de estradiol | 2–11 | 0,04–21 | ? | ||
| Cipionato de estradiol | CE; 17β-cipionato de estradiol | ? c | 4.0 | ? | ||
| Palmitato de estradiol | 17β-palmitato de estradiol | 0 | ? | ? | ||
| Estearato de estradiol | 17β-estearato de estradiol | 0 | ? | ? | ||
| Estrona | E1; 17-cetoestradiol | 11 | 5.3–38 | 14 | ||
| Sulfato de estrona | E1S; 3-sulfato de estrona | 2 | 0,004 | 0,002 | ||
| Glucurónido de estrona | E1G; 3-glucurónido de estrona | ? | <0,001 | 0,0006 | ||
| Etinilestradiol | EE; 17α-etinilestradiol | 100 | 17–150 | 129 | ||
| Mestranol | EE 3-metil éter | 1 | 1.3–8.2 | 0,16 | ||
| Quinestrol | EE 3-ciclopentil éter | ? | 0,37 | ? | ||
| Notas al pie: a = Las afinidades de unión relativas (RBA) se determinaron a través del desplazamiento in vitro del estradiol marcado de los receptores de estrógeno (RE) generalmente del citosol uterino de roedores . Los ésteres de estrógeno se hidrolizan de forma variable en estrógenos en estos sistemas (longitud de cadena de éster más corta -> mayor tasa de hidrólisis) y las RBA de ER de los ésteres disminuyen fuertemente cuando se previene la hidrólisis. b = Las potencias estrogénicas relativas (REP) se calcularon a partir de concentraciones efectivas medias máximas (CE 50 ) que se determinaron a través de ensayos de producción de β-galactosidasa (β-gal) y proteína fluorescente verde (GFP) in vitro en levaduras que expresan ERα humano y ERβ humano . Tanto las células de mamíferos como las levaduras tienen la capacidad de hidrolizar los ésteres de estrógeno. c = Las afinidades del cipionato de estradiol por los receptores de estrógeno son similares a las del valerato de estradiol y el benzoato de estradiol ( figura ). Fuentes: Ver página de plantilla. | ||||||
In vivofarmacodinamia
| Estrógeno | ESReceptor de estrógeno Banco de Reserva de AustraliaInformación sobre herramientas sobre afinidad de enlace relativa(%) | Peso uterino (%) | Uterotrofia | LHInformación sobre herramientas Hormona luteinizanteniveles (%) | SHBGInformación sobre herramientas Globulina transportadora de hormonas sexuales Banco de Reserva de AustraliaInformación sobre herramientas sobre afinidad de enlace relativa(%) |
|---|---|---|---|---|---|
| Control | – | 100 | – | 100 | – |
| Estradiol (E2) | 100 | 506 ± 20 | +++ | 12–19 | 100 |
| Estrona (E1) | 11 ± 8 | 490 ± 22 | +++ | ? | 20 |
| Estriol (E3) | 10 ± 4 | 468 ± 30 | +++ | 8–18 | 3 |
| Estetrol (E4) | 0,5 ± 0,2 | ? | Inactivo | ? | 1 |
| 17α-estradiol | 4,2 ± 0,8 | ? | ? | ? | ? |
| 2-Hidroxiestradiol | 24 ± 7 | 285 ± 8 | + b | 31–61 | 28 |
| 2-Metoxiestradiol | 0,05 ± 0,04 | 101 | Inactivo | ? | 130 |
| 4-Hidroxiestradiol | 45 ± 12 | ? | ? | ? | ? |
| 4-Metoxiestradiol | 1,3 ± 0,2 | 260 | ++ | ? | 9 |
| 4-Fluoroestradiol a | 180 ± 43 | ? | +++ | ? | ? |
| 2-Hidroxiestrona | 1,9 ± 0,8 | 130 ± 9 | Inactivo | 110–142 | 8 |
| 2-Metoxiestrona | 0,01 ± 0,00 | 103 ± 7 | Inactivo | 95–100 | 120 |
| 4-Hidroxiestrona | 11 ± 4 | 351 | ++ | 21–50 | 35 |
| 4-Metoxiestrona | 0,13 ± 0,04 | 338 | ++ | 65–92 | 12 |
| 16α-Hidroxiestrona | 2,8 ± 1,0 | 552 ± 42 | +++ | 7–24 | <0,5 |
| 2-Hidroxiestriol | 0,9 ± 0,3 | 302 | + b | ? | ? |
| 2-Metoxiestriol | 0,01 ± 0,00 | ? | Inactivo | ? | 4 |
| Notas: Los valores son media ± DE o rango. ER RBA = Afinidad de unión relativa a los receptores de estrógeno del citosol uterino de la rata . Peso uterino = Cambio porcentual en el peso húmedo uterino de ratas ovariectomizadas después de 72 horas con la administración continua de 1 μg/hora a través de bombas osmóticas implantadas subcutáneamente . Niveles de LH = Niveles de hormona luteinizante en relación con el valor inicial de ratas ovariectomizadas después de 24 a 72 horas de administración continua a través de implante subcutáneo. Notas al pie: a = Sintético (es decir, no endógeno ). b = Efecto uterotrófico atípico que se estabiliza en 48 horas (la uterotrofia del estradiol continúa linealmente hasta 72 horas). Fuentes: Ver plantilla. | |||||
| Compuesto | Dosis para usos específicos (mg habitualmente) [a] | ||||||
|---|---|---|---|---|---|---|---|
| ETD [b] | Declaración de protección ambiental [b] | Enfermedad de Alzheimer [b] | Enfermedad de Alzheimer [c] | Identificador único [c] | TSD [c] | ||
| Estradiol (no micronizado) | 30 | ≥120–300 | 120 | 6 | - | - | |
| Estradiol (micronizado) | 6–12 | 60–80 | 14–42 | 1–2 | >5 | >8 | |
| Valerato de estradiol | 6–12 | 60–80 | 14–42 | 1–2 | - | >8 | |
| Benzoato de estradiol | - | 60–140 | - | - | - | - | |
| Estriol | ≥20 | 120–150 [día] | 28–126 | 1–6 | >5 | - | |
| Succinato de estriol | - | 140–150 [día] | 28–126 | 2–6 | - | - | |
| Sulfato de estrona | 12 | 60 | 42 | 2 | - | - | |
| Estrógenos conjugados | 5–12 | 60–80 | 8.4–25 | 0,625–1,25 | >3,75 | 7.5 | |
| Etinilestradiol | 200 μg | 1–2 | 280 μg | 20–40 μg | 100 μg | 100 μg | |
| Mestranol | 300 μg | 1,5–3,0 | 300–600 μg | 25–30 μg | >80 μg | - | |
| Quinestrol | 300 μg | 2–4 | 500 μg | 25–50 μg | - | - | |
| Metilestradiol | - | 2 | - | - | - | - | |
| Dietilestilbestrol | 2.5 | 20–30 | 11 | 0,5–2,0 | >5 | 3 | |
| Dipropionato de DES | - | 15–30 | - | - | - | - | |
| Dienestrol | 5 | 30–40 | 42 | 0,5–4,0 | - | - | |
| Diacetato de dienestrol | 3–5 | 30–60 | - | - | - | - | |
| Hexestrol | - | 70–110 | - | - | - | - | |
| Clorotrianiseno | - | >100 | - | - | >48 | - | |
| Metalenestril | - | 400 | - | - | - | - | |
Fuentes y notas a pie de página:
| |||||||
| Estrógeno | alta frecuenciaInformación sobre herramientas Sofocos | VOYInformación sobre herramientas Epitelio vaginal | Universidad de California en CaliforniaInformación sobre herramientas Calcio urinario | hormona foliculoestimulanteInformación sobre herramientas Hormona folículo estimulante | LHInformación sobre herramientas Hormona luteinizante | HDLInformación sobre herramientas Lipoproteína de alta densidad- CInformación sobre herramientas sobre colesterol | SHBGInformación sobre herramientas Globulina transportadora de hormonas sexuales | CBGGlobulina transportadora de corticosteroides | AGTInformación sobre herramientas Angiotensinógeno | Hígado |
|---|---|---|---|---|---|---|---|---|---|---|
| Estradiol | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 |
| Estrona | ? | ? | ? | 0.3 | 0.3 | ? | ? | ? | ? | ? |
| Estriol | 0.3 | 0.3 | 0,1 | 0.3 | 0.3 | 0,2 | ? | ? | ? | 0,67 |
| Sulfato de estrona | ? | 0.9 | 0.9 | 0,8–0,9 | 0.9 | 0,5 | 0.9 | 0,5–0,7 | 1.4–1.5 | 0,56–1,7 |
| Estrógenos conjugados | 1.2 | 1.5 | 2.0 | 1.1–1.3 | 1.0 | 1.5 | 3.0–3.2 | 1.3–1.5 | 5.0 | 1.3–4.5 |
| Sulfato de equilina | ? | ? | 1.0 | ? | ? | 6.0 | 7.5 | 6.0 | 7.5 | ? |
| Etinilestradiol | 120 | 150 | 400 | 60–150 | 100 | 400 | 500–600 | 500–600 | 350 | 2,9–5,0 |
| Dietilestilbestrol | ? | ? | ? | 2.9–3.4 | ? | ? | 26–28 | 25–37 | 20 | 5,7–7,5 |
Fuentes y notas a pie de página Notas: Los valores son proporciones, con el estradiol como estándar (es decir, 1,0). Abreviaturas: HF = Alivio clínico de los sofocos . VE = Aumento de la proliferación del epitelio vaginal . UCa = Disminución de UCa.Información sobre el calcio urinario. FSH = Supresión de FSHInformación sobre herramientas sobre la hormona folículo estimulanteniveles. LH = Supresión de LHInformación sobre herramientas sobre la hormona luteinizanteniveles. HDL - C , SHBG , CBG y AGT = Aumento de los niveles séricos de estas proteínas hepáticas . Hígado = Relación entre los efectos estrogénicos hepáticos y los efectos estrogénicos generales/sistémicos (sofocos/ gonadotropinas ). Fuentes: Ver plantilla. | ||||||||||
| Estrógeno | Forma | Dosis (mg) | Duración por dosis (mg) | ||
|---|---|---|---|---|---|
| Declaración de protección ambiental (EPD) | CICD | ||||
| Estradiol | Solución acuosa. | ? | – | <1 día | |
| Solución de aceite. | 40–60 | – | 1–2 ≈ 1–2 días | ||
| Susp. acuosa | ? | 3.5 | 0,5–2 ≈ 2–7 días; 3,5 ≈ >5 días | ||
| Microsf. | ? | – | 1 ≈ 30 días | ||
| Benzoato de estradiol | Solución de aceite. | 25–35 | – | 1,66 ≈ 2–3 días; 5 ≈ 3–6 días | |
| Susp. acuosa | 20 | – | 10 ≈ 16–21 días | ||
| Emulsión | ? | – | 10 ≈ 14–21 días | ||
| Dipropionato de estradiol | Solución de aceite. | 25–30 | – | 5 ≈ 5–8 días | |
| Valerato de estradiol | Solución de aceite. | 20–30 | 5 | 5 ≈ 7–8 días; 10 ≈ 10–14 días; 40 ≈ 14–21 días; 100 ≈ 21–28 días | |
| Benzobutirato de estradiol | Solución de aceite. | ? | 10 | 10 ≈ 21 días | |
| Cipionato de estradiol | Solución de aceite. | 20–30 | – | 5 ≈ 11–14 días | |
| Susp. acuosa | ? | 5 | 5 ≈ 14–24 días | ||
| Enantato de estradiol | Solución de aceite. | ? | 5–10 | 10 ≈ 20–30 días | |
| Dienantato de estradiol | Solución de aceite. | ? | – | 7,5 ≈ >40 días | |
| Undecilato de estradiol | Solución de aceite. | ? | – | 10–20 ≈ 40–60 días; 25–50 ≈ 60–120 días | |
| Fosfato de poliestradiol | Solución acuosa. | 40–60 | – | 40 ≈ 30 días; 80 ≈ 60 días; 160 ≈ 120 días | |
| Estrona | Solución de aceite. | ? | – | 1–2 ≈ 2–3 días | |
| Susp. acuosa | ? | – | 0,1–2 ≈ 2–7 días | ||
| Estriol | Solución de aceite. | ? | – | 1–2 ≈ 1–4 días | |
| Fosfato de poliestriol | Solución acuosa. | ? | – | 50 ≈ 30 días; 80 ≈ 60 días | |
Notas y fuentes Notas: Todas las suspensiones acuosas tienen un tamaño de partícula microcristalina . La producción de estradiol durante el ciclo menstrual es de 30 a 640 µg/día (6,4 a 8,6 mg en total por mes o ciclo). Se ha informado que la dosis de maduración del epitelio vaginal de benzoato de estradiol o valerato de estradiol es de 5 a 7 mg/semana. Una dosis eficaz de undecilato de estradiol para inhibir la ovulación es de 20 a 30 mg/mes. Fuentes: Ver plantilla. | |||||
| Estrógeno | Forma | Marca(s) principal(es) | EPD (14 días) | Duración | |
|---|---|---|---|---|---|
| Dietilestilbestrol (DES) | Solución de aceite | Metestrol | 20 mg | 1 mg ≈ 2–3 días; 3 mg ≈ 3 días | |
| Dipropionato de dietilestilbestrol | Solución de aceite | Ciren B | 12,5–15 mg | 2,5 mg ≈ 5 días | |
| Suspensión acuosa | ? | 5 mg | ? mg = 21–28 días | ||
| Dimestrol ( éter dimetílico de DES ) | Solución de aceite | Depósito-Cyren, Depósito-Oestromon, Retalon Retard | 20–40 mg | ? | |
| Fosfestrol ( difosfato DES ) un | Solución acuosa | Honvan | ? | <1 día | |
| Diacetato de dienestrol | Suspensión acuosa | Farmacyrol-Suspensión de cristales | 50 mg | ? | |
| Dipropionato de hexestrol | Solución de aceite | Hormoestrol, Retalon Oleosum | 25 mg | ? | |
| Difosfato de hexestrol a | Solución acuosa | Citostesina, Farmestrina, Retalon Aquosum | ? | Muy corto | |
| Nota: Todas las inyecciones se realizan por vía intramuscular, a menos que se indique lo contrario. Notas al pie: a = Por inyección intravenosa . Fuentes: Ver plantilla. | |||||
| Clase | Ejemplos | Retención del complejo RE | Perfil farmacodinámico | Efectos uterinos |
|---|---|---|---|---|
| De acción corta (también conocida como "débil" o "impedida") | Estriol • 16-Epiestriol • 17α-Estradiol • ent -Estradiol • 16-Cetoestradiol • Dimetilestilbestrol • meso- Butestrol | Corto (1–4 horas) | Inyecciones únicas o una vez al día: agonista o antagonista parcial | Las primeras respuestas a |
| Implante o inyecciones múltiples por día: agonista completo | Respuestas tempranas y tardías b | |||
| De acción prolongada | A. Estradiol • Estrona • Etinilestradiol • Dietilestilbestrol • Hexestrol | Intermedio (6–24 horas) | Inyecciones únicas o una vez al día: agonista completo | Respuestas tempranas y tardías |
| B. Clomifeno • Nafoxidina • Nitromifeno • Tamoxifeno | Largo (>24–48 horas) | Inyección única: agonista Inyecciones repetidas: antagonista | Respuestas tempranas y tardías | |
| Notas al pie: a = Las respuestas tempranas ocurren después de 0 a 6 horas e incluyen imbibición de agua , hiperemia , captación de aminoácidos y nucleótidos , activación de las ARN polimerasas I y II y estimulación de la proteína inducida , entre otras. b = Las respuestas tardías ocurren después de 6 a 48 horas e incluyen hipertrofia e hiperplasia celular y actividad sostenida de las ARN polimerasas I y II, entre otras. Fuentes: [189] [190] [191] [192] [193] [194] [195] | ||||
Farmacocinética
Los estrógenos se pueden administrar a través de una variedad de vías , incluyendo por vía oral , sublingual , transdérmica / tópica ( gel , parche ), vaginal (gel, tableta, anillo ), rectal , intramuscular , subcutánea , intravenosa e implante subcutáneo . Los estrógenos naturales generalmente tienen baja biodisponibilidad oral , mientras que los estrógenos sintéticos tienen mayor biodisponibilidad. Las vías parenterales tienen mayor biodisponibilidad. Los estrógenos generalmente se unen a la albúmina y/o a la globulina transportadora de hormonas sexuales en la circulación. Se metabolizan en el hígado por hidroxilación (a través de las enzimas del citocromo P450 ), deshidrogenación (a través de la 17β-hidroxiesteroide deshidrogenasa ) y conjugación (a través de sulfatación y glucuronidación ). Las semividas de eliminación de los estrógenos varían según el estrógeno y la vía de administración. Los estrógenos se eliminan principalmente por los riñones a través de la orina como conjugados.
| Compuesto | Banco de Reserva de AustraliaInformación sobre herramientas Afinidad de enlace relativaA SHBGInformación sobre herramientas sobre la globulina transportadora de hormonas sexuales(%) | Unido a SHBG (%) | Unido a albúmina (%) | Límite total (%) | MCRTasa de aclaramiento metabólico (L/día/ m2 ) |
|---|---|---|---|---|---|
| 17β-estradiol | 50 | 37 | 61 | 98 | 580 |
| Estrona | 12 | 16 | 80 | 96 | 1050 |
| Estriol | 0.3 | 1 | 91 | 92 | 1110 |
| Sulfato de estrona | 0 | 0 | 99 | 99 | 80 |
| 17β-Dihidroequilina | 30 | ? | ? | ? | 1250 |
| Equilina | 8 | 26 | 13 | ? | 2640 |
| Sulfato de 17β-dihidroequilina | 0 | ? | ? | ? | 375 |
| Sulfato de equilina | 0 | ? | ? | ? | 175 |
| Δ 8 -Estrona | ? | ? | ? | ? | 1710 |
| Notas: El RBA para SHBG (%) se compara con el 100 % para testosterona . Fuentes: Ver plantilla. | |||||
Metabolismo de los estrógenos en humanos no identificado no identificado Descripción: Vías metabólicas implicadas en el metabolismo del estradiol y otros estrógenos naturales (p. ej., estrona , estriol ) en los seres humanos. Además de las transformaciones metabólicas que se muestran en el diagrama, se produce conjugación (p. ej., sulfatación y glucuronidación ) en el caso del estradiol y los metabolitos del estradiol que tienen uno o más grupos hidroxilo (–OH) disponibles . Fuentes: Ver página de plantilla. |
Química
Los estrógenos se pueden agrupar como esteroides o no esteroides. Los estrógenos esteroides son estranos e incluyen estradiol y sus análogos , como etinilestradiol y estrógenos conjugados como el sulfato de equilina . Los estrógenos no esteroides pertenecen predominantemente al grupo de compuestos del estilbestrol e incluyen dietilestilbestrol y hexestrol , entre otros.
Los ésteres de estrógeno son ésteres y profármacos de los estrógenos originales correspondientes. Algunos ejemplos son el valerato de estradiol y el dipropionato de dietilestilbestrol , que son profármacos del estradiol y el dietilestilbestrol, respectivamente. Los ésteres de estrógeno con ésteres de ácidos grasos tienen una mayor lipofilicidad y una duración de acción prolongada cuando se administran por inyección intramuscular o subcutánea. Algunos ésteres de estrógeno, como el fosfato de poliestradiol , el fosfato de poliestriol y el fosfato de polidietilestilbestrol , se encuentran en forma de polímeros .
| Estrógeno | Estructura | Ester(es) | Peso molecular relativo | Contenido relativo de E2 b | registro P c | ||||
|---|---|---|---|---|---|---|---|---|---|
| Puesto(s) | La mitad(es) | Tipo | Longitud a | ||||||
| Estradiol | 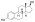 | – | – | – | – | 1.00 | 1.00 | 4.0 | |
| Acetato de estradiol |  | C3 | Ácido etanoico | Ácido graso de cadena lineal | 2 | 1.15 | 0,87 | 4.2 | |
| Benzoato de estradiol |  | C3 | Ácido benzoico | Ácido graso aromático | – (~4–5) | 1.38 | 0,72 | 4.7 | |
| Dipropionato de estradiol |  | C3, C17β | Ácido propanoico (×2) | Ácido graso de cadena lineal | 3 (×2) | 1.41 | 0,71 | 4.9 | |
| Valerato de estradiol |  | C17β | Ácido pentanoico | Ácido graso de cadena lineal | 5 | 1.31 | 0,76 | 5.6–6.3 | |
| Benzoato butirato de estradiol |  | C3, C17β | Ácido benzoico , ácido butírico | Ácido graso mixto | – (~6, 2) | 1.64 | 0,61 | 6.3 | |
| Cipionato de estradiol |  | C17β | Ácido ciclopentilpropanoico | Ácido graso cíclico | – (~6) | 1.46 | 0,69 | 6.9 | |
| Enantato de estradiol |  | C17β | Ácido heptanoico | Ácido graso de cadena lineal | 7 | 1.41 | 0,71 | 6.7–7.3 | |
| Dienantato de estradiol |  | C3, C17β | Ácido heptanoico (×2) | Ácido graso de cadena lineal | 7 (×2) | 1.82 | 0,55 | 8.1–10.4 | |
| Undecilato de estradiol |  | C17β | Ácido undecanoico | Ácido graso de cadena lineal | 11 | 1.62 | 0,62 | 9.2–9.8 | |
| Estearato de estradiol |  | C17β | Ácido octadecanoico | Ácido graso de cadena lineal | 18 | 1,98 | 0,51 | 12.2–12.4 | |
| Diestearato de estradiol |  | C3, C17β | Ácido octadecanoico (×2) | Ácido graso de cadena lineal | 18 (×2) | 2,96 | 0,34 | 20.2 | |
| Sulfato de estradiol |  | C3 | Ácido sulfúrico | Conjugado soluble en agua | – | 1.29 | 0,77 | 0,3–3,8 | |
| Glucurónido de estradiol |  | C17β | Ácido glucurónico | Conjugado soluble en agua | – | 1,65 | 0,61 | 2.1–2.7 | |
| Fosfato de estramustina d |  | C3, C17β | Normustina , ácido fosfórico | Conjugado soluble en agua | – | 1.91 | 0,52 | 2,9–5,0 | |
| Fosfato de poliestradiol e |  | C3–C17β | Ácido fosfórico | Conjugado soluble en agua | – | 1,23 f | 0,81 f | 2,9 gramos | |
| Notas al pie: a = Longitud del éster en átomos de carbono para ácidos grasos de cadena lineal o longitud aproximada del éster en átomos de carbono para ácidos grasos aromáticos o cíclicos . b = Contenido relativo de estradiol en peso (es decir, exposición estrogénica relativa). c = Coeficiente de reparto octanol/agua experimental o previsto (es decir, lipofilia / hidrofobicidad ). Obtenido de PubChem , ChemSpider y DrugBank . d = También conocido como fosfato de normustina de estradiol . e = Polímero de fosfato de estradiol (~13 unidades repetidas ). f = Peso molecular relativo o contenido de estradiol por unidad repetida. g = log P de la unidad repetida (es decir, fosfato de estradiol). Fuentes: Ver artículos individuales. | |||||||||
Historia
| Nombre genérico | Clase | Nombre de marca | Ruta | Intr. |
|---|---|---|---|---|
| Clorotrianiseno | Nueva Zelanda | Tace [a] | correos | 1952 |
| Estriol conjugado | S /éster | Emmenina [a] | correos | 1930 |
| Dipropionato de dietilestilbestrol | NS/éster | Sinestrina [a] | SOY | Década de 1940 |
| Dipropionato de estradiol | S/éster | Agofolina [a] | SOY | 1939 |
| Sustancias estrogénicas | S | Amniotina [a] | PO, IM, TD, V | 1929 |
| Estrona | S | Teelin [a] | SOY | 1929 |
| Sulfonato de etinilestradiol | S/alquilo/éster | Depósito [a] | correos | 1978 |
| Metalenestril | NS/éter | Vallestril | correos | Década de 1950 |
| Moxestrol | S/alquilo | Surestryl | correos | Década de 1970 |
| Fosfato de poliestriol | S/éster | Triodurina [a] | SOY | 1968 |
| Quinestrol | S/alquilo/éter | Estrovis | correos | Década de 1960 |
| ||||
Los extractos de ovario estaban disponibles a fines del siglo XIX y principios del siglo XX, pero eran inertes o tenían una actividad estrogénica extremadamente baja y se consideraban ineficaces. [196] [197] [198] En 1927, Selmar y Aschheim descubrieron que había grandes cantidades de estrógenos presentes en la orina de mujeres embarazadas . [197] [199] [200] Esta rica fuente de estrógenos, producida por la placenta , permitió el desarrollo de potentes formulaciones estrogénicas para uso científico y clínico . [197] [200] [201] El primer producto farmacéutico de estrógeno fue un estriol conjugado llamado Progynon , un extracto placentario , y fue introducido para uso médico por la compañía farmacéutica alemana Schering en 1928. [202] [203] [204] [205] [206] [207] [208] [209] En 1929, Adolf Butenandt y Edward Adelbert Doisy aislaron y purificaron independientemente la estrona , el primer estrógeno en ser descubierto. [210] Las preparaciones de estrógeno Amniotin (Squibb), Progynon (Schering) y Theelin (Parke-Davis) estaban todas en el mercado en 1929, [196] y varias preparaciones adicionales como Emmenin , Folliculin , Menformon , Oestroform y Progynon B , que contenían estrógenos purificados o mezclas de estrógenos, estaban en el mercado en 1934. [197] [211] [212] Los estrógenos se conocían originalmente bajo una variedad de nombres diferentes, incluidos estrógenos , estrinas , hormonas foliculares , foliculinas , ginecogénicos , foliculoides y hormonas sexuales femeninas , entre otros. [213] [211]
Se dice que Searle comercializó un parche de estrógeno en 1928, [214] [215] y en 1929 se estudió un aerosol nasal de estrógeno. [216]
En 1938, científicos británicos obtuvieron una patente para un estrógeno no esteroide de nueva formulación, el dietilestilbestrol (DES), que era más barato y más potente que los estrógenos fabricados anteriormente. Poco después, las revistas científicas plantearon inquietudes sobre los efectos secundarios del DES, mientras que los fabricantes de medicamentos se unieron para presionar para obtener la aprobación gubernamental del DES. No fue hasta 1941 cuando la Administración de Alimentos y Medicamentos (FDA) finalmente aprobó la terapia con estrógenos para el tratamiento de los síntomas de la menopausia. [217] Los estrógenos conjugados (nombre comercial Premarin) se introdujeron en 1941 y sucedieron a Emmenin, cuyas ventas habían comenzado a caer después de 1940 debido a la competencia del DES. [218] El etinilestradiol fue sintetizado en 1938 por Hans Herloff Inhoffen y Walter Hohlweg en Schering AG en Berlín [219] [220] [221] [222] [223] y fue aprobado por la FDA.Información sobre herramientas de la Administración de Alimentos y MedicamentosEn los Estados UnidosInformación sobre herramientas Estados Unidosel 25 de junio de 1943 y comercializado por Schering como Estinyl. [224]
El estradiol micronizado, por vía oral, se evaluó por primera vez en 1972, [225] y a esto le siguió la evaluación del estradiol micronizado vaginal e intranasal en 1977. [226] El estradiol micronizado oral se aprobó por primera vez en los Estados Unidos bajo la marca Estrace en 1975. [227]
Sociedad y cultura
Disponibilidad
Los estrógenos están ampliamente disponibles en todo el mundo. [4]
Investigación
Control de la natalidad masculino
La terapia con estrógenos en dosis altas es eficaz para suprimir la espermatogénesis y la fertilidad en los hombres y, por lo tanto, como anticonceptivo masculino . [228] [229] Funciona tanto suprimiendo fuertemente la secreción de gonadotropina y la producción de testosterona gonadal como a través de efectos directos sobre los testículos . [229] [230] Después de un curso suficiente de terapia, solo las células de Sertoli y las espermatogonias permanecen en los túbulos seminíferos de los testículos, con una variedad de otras anomalías testiculares observables. [228] [229] El uso de estrógenos para la anticoncepción en hombres está impedido por efectos secundarios importantes como disfunción sexual , feminización , ginecomastia y cambios metabólicos . [228] Además, existe evidencia de que con la terapia a largo plazo, la fertilidad y la producción de hormonas sexuales gonadales en los hombres pueden no regresar después de la interrupción de la terapia con estrógenos en dosis altas. [230]
Trastornos alimentarios
El estrógeno se ha utilizado como tratamiento para las mujeres con bulimia nerviosa , además de la terapia cognitivo conductual , que es el estándar establecido para el tratamiento en casos de bulimia. La investigación sobre el estrógeno plantea la hipótesis de que la enfermedad puede estar relacionada con un desequilibrio hormonal en el cerebro. [231]
Misceláneas
Los estrógenos se han utilizado en estudios que indican que pueden ser eficaces en el tratamiento de lesiones hepáticas traumáticas . [232]
En humanos y ratones, los estrógenos promueven la cicatrización de heridas . [233]
Se ha propuesto la terapia con estrógenos como un posible tratamiento para el autismo, pero se necesitan estudios clínicos. [234]
Referencias
- ^ abcdefghijklmnopqrstu vwxyz aa ab ac ad ae af ag ah ai aj ak al Kuhl H (2005). "Farmacología de los estrógenos y progestágenos: influencia de diferentes vías de administración" (PDF) . Climaterio . 8 (Supl. 1): 3–63. doi :10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ Kuhl H (2011). "Farmacología de los progestágenos" (PDF) . J Reproduktionsmed Endokrinol . 8 (1): 157–177.
- ^ ab "Productos IBM Watson Health: Inicie sesión".
- ^ abc Sweetman, Sean C., ed. (2009). "Hormonas sexuales y sus moduladores". Martindale: The Complete Drug Reference (36.ª ed.). Londres: Pharmaceutical Press. ISBN 978-0-85369-840-1.
- ^ ab "Lista de estrógenos".
- ^ ab Index Nominum 2000: Directorio internacional de medicamentos. Taylor & Francis. Enero de 2000. ISBN 978-3-88763-075-1.
- ^ J. Elks (14 de noviembre de 2014). Diccionario de fármacos: datos químicos: datos químicos, estructuras y bibliografías. Springer. ISBN 978-1-4757-2085-3.
- ^ Notelovitz M, Lenihan JP, McDermott M, Kerber IJ, Nanavati N, Arce J (mayo de 2000). "Dosis inicial de 17beta-estradiol para el tratamiento de los síntomas vasomotores". Obstet Gynecol . 95 (5): 726–31. doi :10.1016/s0029-7844(99)00643-2. PMID 10775738. S2CID 42621608.
- ^ Wiegratz I, Kuhl H (2007). "Praxis der Hormontherapie in der Peri- und Postmenopause" [Práctica de la terapia hormonal peri y posmenopáusica]. Gynäkologische Endokrinologie . 5 (3): 141-149. doi :10.1007/s10304-007-0194-9. ISSN 1610-2894. S2CID 27130717.
- ^ "NIH – Información sobre la terapia hormonal para la menopausia". Institutos Nacionales de Salud. 27 de agosto de 2007. Consultado el 4 de marzo de 2008 .
- ^ Menon DV, Vongpatanasin W (2006). "Efectos de la terapia de reemplazo de estrógeno transdérmico sobre los factores de riesgo cardiovascular". Treat Endocrinol . 5 (1): 37–51. doi :10.2165/00024677-200605010-00005. PMID 16396517. S2CID 24041216.
- ^ Alfred S. Wolf, HPG Schneider (12 de marzo de 2013). Ostrogeno en Diagnostik und Therapie. Springer-Verlag. págs. 77–. ISBN 978-3-642-75101-1.
- ^ Wesp LM, Deutsch MB (marzo de 2017). "Opciones de tratamiento hormonal y quirúrgico para mujeres transgénero y personas del espectro transfemenino". Psychiatr. Clin. North Am . 40 (1): 99–111. doi :10.1016/j.psc.2016.10.006. PMID 28159148.
- ^ Unger CA (diciembre de 2016). "Terapia hormonal para pacientes transgénero". Transl Androl Urol . 5 (6): 877–884. doi : 10.21037/tau.2016.09.04 . PMC 5182227 . PMID 28078219.
- ^ Tangpricha V, den Heijer M (abril de 2017). "Terapia con estrógenos y antiandrógenos para mujeres transgénero". Lancet Diabetes Endocrinol . 5 (4): 291–300. doi :10.1016/S2213-8587(16)30319-9. PMC 5366074 . PMID 27916515.
- ^ ab Oh WK (2002). "El papel evolutivo de la terapia con estrógenos en el cáncer de próstata". Clin Genitourinary Cancer . 1 (2): 81–9. doi :10.3816/CGC.2002.n.009. PMID 15046698.
- ^ abc William R. Miller, James N. Ingle (8 de marzo de 2002). Terapia endocrina en el cáncer de mama. CRC Press. pp. 49–. ISBN 978-0-203-90983-6.
- ^ Maximov PY, McDaniel RE, Jordan VC (2013). "Descubrimiento y farmacología de los estrógenos y antiestrógenos no esteroideos". Tamoxifen . Hitos en la farmacoterapia. págs. 1–30. doi :10.1007/978-3-0348-0664-0_1. ISBN 978-3-0348-0663-3. ISSN 2296-6056.
- ^ abcde Coelingh Bennink HJ, Verhoeven C, Dutman AE, Thijssen J (enero de 2017). "El uso de estrógenos en dosis altas para el tratamiento del cáncer de mama". Maturitas . 95 : 11-23. doi :10.1016/j.maturitas.2016.10.010. PMID 27889048.
- ^ "TABLETAS ESTRACE® (tabletas de estradiol, USP) Etiqueta de la FDA" (PDF) . 2005.
- ^ ab Palmieri C, Patten DK, Januszewski A, Zucchini G, Howell SJ (enero de 2014). "Cáncer de mama: terapias endocrinas actuales y futuras". Mol. Cell. Endocrinol . 382 (1): 695–723. doi :10.1016/j.mce.2013.08.001. PMID 23933149.
- ^ abc Green RB, Sethi RS, Lindner HH (julio de 1964). "Tratamiento del carcinoma avanzado de mama: progreso en la terapia durante la última década". Am. J. Surg . 108 : 107–21. doi :10.1016/0002-9610(64)90094-7. PMID 14182428.
- ^ abc Thomas JA, Keenan EJ (6 de diciembre de 1986). "Estrógenos y fármacos antiestrogénicos". Principios de farmacología endocrina. Springer Science & Business Media. págs. 135-165. doi :10.1007/978-1-4684-5036-1_7. ISBN 978-1-4684-5036-1.
- ^ "Etiqueta de la FDA de Premarin® (comprimidos de estrógenos conjugados, USP)" (PDF) . 2003.
- ^ abcd Van Winkle W (1949). "Consejo de Farmacia y Química. Estrógenos y andrógenos en el cáncer de mama". JAMA: Revista de la Asociación Médica Estadounidense . 140 (15): 1214. doi :10.1001/jama.1949.02900500022007. ISSN 0098-7484.
- ^ abcd Kahr E (1966). "Die Allgemeinbehandlung" [Tratamiento general]. Der Inoperable Krebskranke: Möglichkeiten der Therapie in Klinik und Praxis [ El paciente con cáncer inoperable: posibilidades de terapia en la clínica y la práctica ]. Springer-Verlag. págs. 104-155. doi :10.1007/978-3-642-86140-6_4. ISBN 978-3-642-86140-6.
- ^ abc Dao TL (1975). "Farmacología y utilidad clínica de las hormonas en neoplasias relacionadas con las hormonas". En Alan C. Sartorelli, David G. Johns (eds.). Agentes antineoplásicos e inmunosupresores. págs. 170-192. doi :10.1007/978-3-642-65806-8_11. ISBN 978-3-642-65806-8.
- ^ abcd Nathanson IT, Kelley RM (enero de 1952). "Tratamiento hormonal del cáncer". N. Engl. J. Med . 246 (5): 180–9, concl. doi :10.1056/NEJM195201312460505. PMID 14890833.
- ^ ab Dobson L (agosto de 1962). "El tratamiento del cáncer de mama metastásico". Surg. Clin. North Am . 42 : 861–76. doi :10.1016/S0039-6109(16)36728-7. PMID 13886800.
- ^ ab Martz G (13 de marzo de 2013). Die hormonale Therapie maligner Tumoren: Endokrine Behandlungsmethoden des metastasierenden Mamma-, Prostata- und Uterus-Corpuscarcinoms. Springer-Verlag. págs.39–. ISBN 978-3-642-86282-3.
- ^ Comité de Investigación, AMA (1960). "Andrógenos y estrógenos en el tratamiento del carcinoma mamario diseminado. Estudio retrospectivo de novecientos cuarenta y cuatro pacientes". Revista de la Asociación Médica Estadounidense . 172 (12): 1271. doi :10.1001/jama.1960.03020120049010. ISSN 0002-9955.
- ^ "Información y etiquetas de Estradurin® (fosfato de poliestradiol)". Pharmanovia .
- ^ Ostrowski MJ, Jackson AW (1979). "Fosfato de poliestradiol: una evaluación preliminar de su efecto sobre el carcinoma de mama". Cancer Treat Rep . 63 (11–12): 1803–7. PMID 393380.
- ^ "Revisión de la FDA sobre la suspensión de estrona" (PDF) . 1979.
- ^ J. Aiman (6 de diciembre de 2012). Infertilidad: diagnóstico y tratamiento. Springer Science & Business Media. pp. 133–134. ISBN 978-1-4613-8265-2.
- ^ Glenn L. Schattman, Sandro Esteves, Ashok Agarwal (12 de mayo de 2015). Infertilidad inexplicada: fisiopatología, evaluación y tratamiento. Springer. pp. 266–. ISBN 978-1-4939-2140-9.
- ^ ab Bamigboye AA, Morris J (2003). "Suplementación con estrógenos, principalmente dietilestilbestrol, para prevenir abortos espontáneos y otros resultados adversos del embarazo". Cochrane Database Syst Rev. 2010 ( 3): CD004353. doi :10.1002/14651858.CD004353. PMC 9039959. PMID 12918007 .
- ^ JB Josimovich (11 de noviembre de 2013). Endocrinología ginecológica. Springer Science & Business Media. pp. 482–. ISBN 978-1-4613-2157-6.
- ^ Marshall S. Shapo (30 de diciembre de 2008). Experimentando con el consumidor: las pruebas masivas de productos riesgosos en el público estadounidense: las pruebas masivas de productos riesgosos en el público estadounidense. ABC-CLIO. pp. 137–. ISBN 978-0-313-36529-4.
- ^ Lee JM, Howell JD (2006). "Chicas altas: la conformación social de una terapia médica". Arch Pediatr Adolesc Med . 160 (10): 1077–8. doi : 10.1001/archpedi.160.10.1035 . PMID 17018462.
- ^ Gunther DF, Diekema DS (2006). "Atenuación del crecimiento en niños con discapacidad profunda del desarrollo: un nuevo enfoque para un viejo dilema". Arch Pediatr Adolesc Med . 160 (10): 1013–7. doi :10.1001/archpedi.160.10.1013. PMID 17018459.
- ^ ab Duarte FH, Jallad RS, Bronstein MD (noviembre de 2016). "Estrógenos y moduladores selectivos del receptor de estrógeno en la acromegalia". Endocrine . 54 (2): 306–314. doi :10.1007/s12020-016-1118-z. PMID 27704479. S2CID 10136018.
- ^ ab Stone JC, Clark J, Cuneo R, Russell AW, Doi SA (junio de 2014). "Estrógenos y moduladores selectivos de los receptores de estrógenos (SERM) para el tratamiento de la acromegalia: un metaanálisis de estudios observacionales publicados". Pituitary . 17 (3): 284–95. doi :10.1007/s11102-013-0504-2. PMID 23925896. S2CID 30697394.
- ^ ab Shimon I, Barkan A (diciembre de 2012). "Tratamiento con estrógenos para la acromegalia". Pituitary . 15 (4): 601–7. doi :10.1007/s11102-012-0426-4. PMID 22933045. S2CID 1917058.
- ^ abcd Thibaut F, De La Barra F, Gordon H, Cosyns P, Bradford JM (2010). "Directrices de la Federación Mundial de Sociedades de Psiquiatría Biológica (WFSBP) para el tratamiento biológico de las parafilias". World J. Biol. Psychiatry . 11 (4): 604–55. doi :10.3109/15622971003671628. PMID 20459370. S2CID 14949511.
- ^ Bradford JM (1990). "El tratamiento antiandrogénico y hormonal de los delincuentes sexuales". Manual de agresión sexual . Springer US. págs. 297–310. doi :10.1007/978-1-4899-0915-2_17. ISBN 978-1-4899-0917-6.
- ^ Brogden RN, Clissold SP (agosto de 1989). "Flutamida. Una revisión preliminar de sus propiedades farmacodinámicas y farmacocinéticas, y eficacia terapéutica en el cáncer de próstata avanzado". Drugs . 38 (2): 185–203. doi :10.2165/00003495-198938020-00003. PMID 2670515. S2CID 262018256.
Una característica favorable de la terapia con flutamida ha sido su menor efecto sobre la libido y la potencia sexual; menos del 20% de los pacientes tratados con flutamida sola informaron tales cambios. En contraste, casi todos los pacientes tratados con estrógenos o fosfato de estramustina informaron pérdida de potencia sexual. [...] En ensayos terapéuticos comparativos, se ha producido pérdida de potencia en todos los pacientes tratados con estilbestrol o fosfato de estramustina, en comparación con el 0 al 20% de los que recibieron flutamida sola (Johansson et al. 1987; Lund y Rasmussen 1988).
- ^ abc Gunther Göretzlehner, Christian Lauritzen, Thomas Römer, Winfried Rossmanith (1 de enero de 2012). Praktische Hormontherapie in der Gynäkologie. Walter de Gruyter. págs. 385–. ISBN 978-3-11-024568-4.
- ^ RE Mansel, Oystein Fodstad, Wen G. Jiang (14 de junio de 2007). Metástasis del cáncer de mama. Medios de ciencia y negocios de Springer. págs. 217–. ISBN 978-1-4020-5866-0.
- ^ abc Hartmann BW, Laml T, Kirchengast S, Albrecht AE, Huber JC (1998). "Aumento hormonal de mama: relevancia pronóstica del factor de crecimiento similar a la insulina-I". Gynecol. Endocrinol . 12 (2): 123–7. doi :10.3109/09513599809024960. PMID 9610425.
- ^ abc Lauritzen C (1980). "Hormonkur kann hipoplastischer Mamma aufhelfen" [La terapia hormonal puede ayudar a los senos hipoplásicos]. Selecta (en alemán). 22 (43). Planegg: Selecta-Verlag: 3798–3801. ISSN 0582-4877. OCLC 643821347.
- ^ Kaiser R, Leidenberger FA (1991). Hormonbehandlung in der gynäkologischen Praxis (6 ed.). Stuttgart, Nueva York: Georg Thieme Verlag. págs. 138-139. ISBN 978-3-13-357407-5.
- ^ abcdefghi Maki PM, Kornstein SG, Joffe H, Bromberger JT, Freeman EW, Athappilly G, Bobo WV, Rubin LH, Koleva HK, Cohen LS, Soares CN (febrero de 2019). "Pautas para la evaluación y tratamiento de la depresión perimenopáusica: resumen y recomendaciones". J Salud de la Mujer (Larchmt) . 28 (2): 117-134. doi : 10.1089/jwh.2018.27099.mensocrec . PMID 30182804.
- ^ abcdefgh Stute P, Spyropoulou A, Karageorgiou V, Cano A, Bitzer J, Ceausu I, Chedraui P, Durmusoglu F, Erkkola R, Goulis DG, Lindén Hirschberg A, Kiesel L, Lopes P, Pines A, Rees M, van Trotsenburg M, Zervas I, Lambrinoudaki I (enero de 2020). "Manejo de los síntomas depresivos en mujeres peri y posmenopáusicas: declaración de posición del EMAS". Maturitas . 131 : 91-101. doi : 10.1016/j.maturitas.2019.11.002 . PMID 31740049.
- ^ Raglan GB, Schulkin J, Micks E (2020). "Depresión durante la perimenopausia: el papel del obstetra-ginecólogo". Arch Womens Ment Health . 23 (1): 1–10. doi :10.1007/s00737-019-0950-6. PMID 30758732. S2CID 61155969.
- ^ ab Gava G, Orsili I, Alvisi S, Mancini I, Seracchioli R, Meriggiola MC (octubre de 2019). "Cognición, estado de ánimo y sueño en la transición menopáusica: el papel de la terapia hormonal para la menopausia". Medicina . 55 (10): 668. doi : 10.3390/medicina55100668 . PMC 6843314 . PMID 31581598.
- ^ Toffol E, Heikinheimo O, Partonen T (mayo de 2015). "Terapia hormonal y estado de ánimo en mujeres perimenopáusicas y posmenopáusicas: una revisión narrativa". Menopausia . 22 (5): 564–78. doi :10.1097/GME.0000000000000323. PMID 25203891. S2CID 5830652.
- ^ abc Garay RP, Charpeaud T, Logan S, Hannaert P, Garay RG, Llorca PM, Shorey S (octubre de 2019). "Enfoques farmacoterapéuticos para el tratamiento de la depresión durante la perimenopausia". Expert Opin Pharmacother . 20 (15): 1837–1845. doi :10.1080/14656566.2019.1645122. PMID 31355688. S2CID 198967172.
- ^ ab Rubinow DR, Johnson SL, Schmidt PJ, Girdler S, Gaynes B (agosto de 2015). "Eficacia del estradiol en la depresión perimenopáusica: muchas promesas y muy pocas respuestas". Depress Anxiety . 32 (8): 539–49. doi :10.1002/da.22391. PMC 6309886 . PMID 26130315.
- ^ Zweifel JE, O'Brien WH (abril de 1997). "Un metaanálisis del efecto de la terapia de reemplazo hormonal sobre el estado de ánimo depresivo". Psiconeuroendocrinología . 22 (3): 189–212. doi :10.1016/s0306-4530(96)00034-0. PMID 9203229. S2CID 44630030.
- ^ ab Rubinow DR, Schmidt PJ (septiembre de 2018). "¿Existe un papel para los esteroides reproductivos en la etiología y el tratamiento de los trastornos afectivos?". Dialogues Clin Neurosci . 20 (3): 187–196. doi :10.31887/DCNS.2018.20.3/drubinow. PMC 6296393 . PMID 30581288.
- ^ Myoraku A, Robakis T, Rasgon N (2018). "Terapia hormonal basada en estrógenos para la depresión relacionada con eventos reproductivos". Opciones de tratamiento actuales en psiquiatría . 5 (4): 416–424. doi :10.1007/s40501-018-0156-y. ISSN 2196-3061. S2CID 81770543.
- ^ Cheng YS, Tseng PT, Tu YK, Wu YC, Su KP, Wu CK, Li DJ, Chen TY, Stubbs B, Carvalho AF, Solmi M, Thompson T, Caruso MG, Matsuoka YJ, Chen YW, Lin PY, Wu MK, Sun CK (19 de septiembre de 2019), Intervenciones hormonales y farmacológicas para los síntomas depresivos en mujeres peri y posmenopáusicas: un metaanálisis en red de ensayos controlados aleatorizados , doi : 10.2139/ssrn.3457416, S2CID 216575787, SSRN 3457416
- ^ Begemann MJ, Dekker CF, van Lunenburg M, Sommer IE (noviembre de 2012). "Aumento de estrógenos en la esquizofrenia: una revisión cuantitativa de la evidencia actual". Schizophr. Res . 141 (2–3): 179–84. doi :10.1016/j.schres.2012.08.016. PMID 22998932. S2CID 40584474.
- ^ Brzezinski A, Brzezinski-Sinai NA, Seeman MV (mayo de 2017). "Tratamiento de la esquizofrenia durante la menopausia". Menopausia . 24 (5): 582–588. doi :10.1097/GME.0000000000000772. PMID 27824682. S2CID 3452898.
- ^ McGregor C, Riordan A, Thornton J (octubre de 2017). "Estrógenos y síntomas cognitivos de la esquizofrenia: posibles mecanismos neuroprotectores". Front Neuroendocrinol . 47 : 19–33. doi :10.1016/j.yfrne.2017.06.003. PMID 28673758. S2CID 43291520.
- ^ Owens SJ, Murphy CE, Purves-Tyson TD, Weickert TW, Shannon Weickert C (febrero de 2018). "Considerando el papel de los esteroides sexuales adolescentes en la esquizofrenia". J. Neuroendocrinol . 30 (2): e12538. doi :10.1111/jne.12538. hdl : 1959.4/unsworks_49994 . PMID 28941299. S2CID 3391650.
- ^ Clayton RW, Göbel K, Niessen CM, Paus R, van Steensel MAM, Lim X (octubre de 2019). "Homeostasis de la glándula sebácea y mecanismos de patogénesis del acné". Br. J. Dermatol . 181 (4): 677–690. doi :10.1111/bjd.17981. PMID 31056753. S2CID 145822633.
- ^ Andrews GC, Domonkos AN, Post CF (julio de 1951). "Tratamiento del acné vulgar". J Am Med Assoc . 146 (12): 1107–13. doi :10.1001/jama.1951.03670120017005. PMID 14841085.
- ^ White CB, Lehmann CF (mayo de 1952). "Terapia con dietilestilbestrol en hombres jóvenes con acné; correlación con los 17-cetosteroides urinarios". AMA Arch Dermatol Syphilol . 65 (5): 601–8. doi :10.1001/archderm.1952.01530240093012. PMID 14914180.
- ^ Welsh AL (abril de 1954). "Uso de la sustancia estrogénica sintética clorotrianiseno (TACE) en el tratamiento del acné". AMA Arch Dermatol Syphilol . 69 (4): 418–27. doi :10.1001/archderm.1954.01540160020004. PMID 13147544.
- ^ Becker FT (febrero de 1953). "El problema del acné". AMA Arch Dermatol Syphilol . 67 (2): 173–83. doi :10.1001/archderm.1953.01540020051010. PMID 13029903.
- ^ Day RL, Anderson NP (julio de 1952). "El tratamiento del acné vulgar". Postgrad Med . 12 (1): 34–40. doi :10.1080/00325481.1952.11708046. PMID 14957675.
- ^ Mullins JF, McCash WB, Lamar JK (enero de 1960). "Acné, estrógenos y espermatozoides". Arch Dermatol . 81 : 53–8. doi :10.1001/archderm.1960.03730010057006. PMID 14425194.
- ^ Pochi PE, Strauss JS (agosto de 1973). "Supresión de las glándulas sebáceas con etinilestradiol y dietilestilbestrol". Arch Dermatol . 108 (2): 210–4. doi :10.1001/archderm.1973.01620230010003. PMID 4269283.
- ^ Hermkens PH, Kamp S, Lusher S, Veeneman GH (julio de 2006). "Moduladores de los receptores de esteroides no esteroides". IDrugs . 9 (7): 488–94. doi :10.2174/0929867053764671. PMID 16821162.
- ^ "Drospirenona/Estetrol - Mithra Pharmaceuticals - AdisInsight".
- ^ de Llewellyn W (2011). Anabólicos. Molecular Nutrition Llc. págs. 9-10, 294-297, 385-394, 402-412, 444-454, 460-467, 483-490, 575-583. ISBN 978-0-9828280-1-4.
- ^ Paulsen CA, Leach RB, Lanman J, Goldston N, Maddock WO, Heller CG (1962). "Estrogenicidad inherente de la noretindrona y el noretinodrel: comparación con otras progestinas sintéticas y progesterona". J. Clin. Endocrinol. Metab . 22 (10): 1033–9. doi :10.1210/jcem-22-10-1033. PMID 13942007.
- ^ ab Lauritzen C (septiembre de 1990). "Uso clínico de estrógenos y progestágenos". Maturitas . 12 (3): 199–214. doi :10.1016/0378-5122(90)90004-P. PMID 2215269.
- ^ de Christian Lauritzen, John WW Studd (22 de junio de 2005). Current Management of the Menopause [Tratamiento actual de la menopausia]. CRC Press. pp. 95–98, 488. ISBN 978-0-203-48612-2.
- ^ ab Laurtizen C (2001). "Sustitución hormonal antes, durante y después de la menopausia" (PDF) . En Fisch FH (ed.). Menopausia – Andropausia: terapia de reemplazo hormonal a través de los tiempos . Krause & Pachernegg: Gablitz. págs. 67–88. ISBN 978-3-901299-34-6.
- ^ ab Midwinter A (1976). "Contraindicaciones para la terapia con estrógenos y manejo del síndrome menopáusico en estos casos". En Campbell S (ed.). El manejo de la menopausia y los años posmenopáusicos: las actas del simposio internacional celebrado en Londres del 24 al 26 de noviembre de 1975. Organizado por el Instituto de Obstetricia y Ginecología de la Universidad de Londres . MTP Press Limited. págs. 377–382. doi :10.1007/978-94-011-6165-7_33. ISBN 978-94-011-6167-1.
- ^ abcd Jeffcoate TN, Lister UM (noviembre de 1948). "Etinilestradiol". Br Med J . 2 (4583): 809–12. doi :10.1136/bmj.2.4583.809. PMC 2091954 . PMID 18890306.
- ^ ab Lebech PE (1976). "Efectos y efectos secundarios de la terapia con estrógenos". Consenso sobre la investigación de la menopausia . Springer Netherlands. págs. 44-47. doi :10.1007/978-94-011-7179-3_10. ISBN 978-94-011-7181-6.
- ^ abc Hammond CB, Maxson WS (junio de 1986). "Terapia de reemplazo de estrógeno". Clin Obstet Gynecol . 29 (2): 407–30. doi :10.1097/00003081-198606000-00022. PMID 3522011. S2CID 31166713.
- ^ Coelingh Bennink HJ (abril de 2004). "¿Son todos los estrógenos iguales?". Maturitas . 47 (4): 269–75. doi :10.1016/j.maturitas.2003.11.009. PMID 15063479.
- ^ Cust MP, Gangar KF, Hillard TC, Whitehead MI (1990). "Una evaluación de riesgo-beneficio de la terapia con estrógenos en mujeres posmenopáusicas". Drug Saf . 5 (5): 345–58. doi :10.2165/00002018-199005050-00004. PMID 2222868. S2CID 29182738.
- ^ ab Whitehead M (enero de 1982). "Estrógenos: potencias relativas y efectos hepáticos después de diferentes vías de administración". Revista de obstetricia y ginecología . 3 (sup1): S11–S16. doi :10.3109/01443618209083065. eISSN 1364-6893. ISSN 0144-3615.
- ^ Mattison DR, Karyakina N, Goodman M, LaKind JS (septiembre de 2014). "Farmacocinética y toxicocinética de estrógenos exógenos y endógenos seleccionados: una revisión de los datos e identificación de lagunas de conocimiento". Crit Rev Toxicol . 44 (8): 696–724. doi :10.3109/10408444.2014.930813. PMID 25099693. S2CID 11212469.
- ^ abcdefghijk Sturdee DW (2013). "¿Son realmente necesarias las progestinas como parte de un régimen combinado de terapia de reemplazo hormonal?". Climaterio . 16 (Supl. 1): 79–84. doi :10.3109/13697137.2013.803311. PMID 23651281. S2CID 21894200.
- ^ ab Gialeraki A, Valsami S, Pittaras T, Panayiotakopoulos G, Politou M (2018). "Los anticonceptivos orales y la TRH riesgo de trombosis". Clínico. Aplica. Trombo. Hemost . 24 (2): 217–225. doi :10.1177/1076029616683802. PMC 6714678 . PMID 28049361.
- ^ ab De Leo V, Musacchio MC, Cappelli V, Piomboni P, Morgante G (2016). "Anticonceptivos hormonales: farmacología adaptada a la salud de la mujer". Hum. Reprod. Actualización . 22 (5): 634–46. doi : 10.1093/humupd/dmw016 . PMID: 27307386.
- ^ ab Mohammed K, Abu Dabrh AM, Benkhadra K, Al Nofal A, Carranza Leon BG, Prokop LJ, Montori VM, Faubion SS, Murad MH (2015). "Terapia de estrógenos oral vs. transdérmica y eventos vasculares: una revisión sistemática y un metanálisis". J. Clin. Endocrinol. Metab . 100 (11): 4012–20. doi : 10.1210/jc.2015-2237 . PMID 26544651.
- ^ Gregory YH Lip, John E. Hall (28 de junio de 2007). Libro electrónico completo sobre hipertensión. Elsevier Health Sciences. pp. 865–. ISBN 978-0-323-07067-6.
- ^ abcde Scarabin PY (2014). "Hormonas y tromboembolia venosa en mujeres posmenopáusicas". Climaterio . 17 (Supl 2): 34–7. doi :10.3109/13697137.2014.956717. PMID 25223916. S2CID 5084606.
- ^ abcdefghi Bińkowska M (octubre de 2014). "Terapia hormonal menopáusica y tromboembolia venosa". Prz Menopauzalny . 13 (5): 267–72. doi :10.5114/pm.2014.46468. PMC 4520375 . PMID 26327865.
- ^ Smith NL, Blondon M, Wiggins KL, Harrington LB, van Hylckama Vlieg A, Floyd JS, Hwang M, Bis JC, McKnight B, Rice KM, Lumley T, Rosendaal FR, Heckbert SR, Psaty BM (enero de 2014). "Menor riesgo de eventos cardiovasculares en mujeres posmenopáusicas que toman estradiol oral en comparación con estrógenos equinos conjugados orales". JAMA Intern Med . 174 (1): 25–31. doi :10.1001/jamainternmed.2013.11074. PMC 4636198 . PMID 24081194.
- ^ Smith NL, Heckbert SR, Lemaitre RN, Reiner AP, Lumley T, Weiss NS, Larson EB, Rosendaal FR, Psaty BM (octubre de 2004). "Estrógenos esterificados y estrógenos equinos conjugados y el riesgo de trombosis venosa". JAMA . 292 (13): 1581–7. doi : 10.1001/jama.292.13.1581 . hdl : 1887/5083 . PMID 15467060.
- ^ Lekovic D, Miljic P, Dmitrovic A, Thachil J (mayo de 2017). "¿Cómo se decide sobre la terapia de reemplazo hormonal en mujeres con riesgo de tromboembolia venosa?". Blood Rev. 31 ( 3): 151–157. doi :10.1016/j.blre.2016.12.001. PMID 27998619.
- ^ abc Roach RE, Lijfering WM, Helmerhorst FM, Cannegieter SC, Rosendaal FR, van Hylckama Vlieg A (enero de 2013). "El riesgo de trombosis venosa en mujeres mayores de 50 años que utilizan anticonceptivos orales o terapia hormonal posmenopáusica". J. Thromb. Haemost . 11 (1): 124–31. doi : 10.1111/jth.12060 . PMID 23136837. S2CID 22306721.
- ^ Høibraaten E, Abdelnoor M, Sandset PM (octubre de 1999). "Terapia de reemplazo hormonal con estradiol y riesgo de tromboembolismo venoso: un estudio de casos y controles basado en la población". Trombosis. Haemost . 82 (4): 1218–21. doi :10.1055/s-0037-1614363. PMID 10544901. S2CID 37238717.
- ^ ab Heit JA, Spencer FA, White RH (2016). "La epidemiología de la tromboembolia venosa". J. Thromb. Thrombolysis . 41 (1): 3–14. doi :10.1007/s11239-015-1311-6. PMC 4715842 . PMID 26780736.
- ^ "Comunicado de la FDA sobre la seguridad de los medicamentos: Información actualizada sobre el riesgo de coágulos sanguíneos en mujeres que toman píldoras anticonceptivas que contienen drospirenona". Administración de Alimentos y Medicamentos . Archivado desde el original el 27 de abril de 2019.
- ^ Pramilla Senanayake, Malcolm Potts (14 de abril de 2008). Atlas de anticoncepción, segunda edición. CRC Press. pp. 44–. ISBN 978-0-203-34732-4.
- ^ Shlomo Melmed (2016). Williams Textbook of Endocrinology. Elsevier Health Sciences. págs. 665–. ISBN 978-0-323-29738-7.
- ^ Ralli E, Zezza L, Caserta D (2014). «Embarazo y tromboembolismo venoso» . actual. Opinión. Obstet. Ginecol . 26 (6): 469–75. doi :10.1097/GCO.0000000000000115. PMID 25304605. S2CID 30535761.
- ^ abcdef Davey DA (marzo de 2018). "Terapia hormonal para la menopausia: un futuro mejor y más seguro". Climaterio . 21 (5): 454–461. doi :10.1080/13697137.2018.1439915. PMID 29526116. S2CID 3850275.
- ^ Stevenson JC, Panay N, Pexman-Fieth C (septiembre de 2013). "Terapia de combinación oral de estradiol y didrogesterona en mujeres posmenopáusicas: revisión de eficacia y seguridad". Maturitas . 76 (1): 10–21. doi :10.1016/j.maturitas.2013.05.018. PMID 23835005.
La didrogesterona no aumentó el riesgo de TEV asociado con el estrógeno oral (odds ratio [OR] 0,9; IC del 95 % 0,4–2,3). Se encontró que otros progestágenos (OR 3,9; IC del 95 % 1,5–10,0) aumentaron aún más el riesgo de TEV asociado con el estrógeno oral (OR 4,2; IC del 95 % 1,5–11,6).
- ^ Schneider C, Jick SS, Meier CR (octubre de 2009). "Riesgo de resultados cardiovasculares en usuarias de estradiol/didrogesterona u otras preparaciones de THS". Climacteric . 12 (5): 445–53. doi :10.1080/13697130902780853. PMID 19565370. S2CID 45890629.
El riesgo relativo ajustado de desarrollar un TEV tendió a ser menor para las usuarias de E/D (OR 0,84; IC del 95% 0,37–1,92) que para las usuarias de otra THS (OR 1,42; IC del 95% 1,10–1,82), en comparación con las no usuarias.
- ^ abcd Schwingl PJ, Ory HW, Visness CM (enero de 1999). "Estimaciones del riesgo de muerte cardiovascular atribuible a anticonceptivos orales de dosis baja en los Estados Unidos". Am. J. Obstet. Gynecol . 180 (1 Pt 1): 241–9. doi :10.1016/S0002-9378(99)70182-1. PMID 9914611.
- ^ abcd Kenneth L. Becker (2001). Principios y práctica de endocrinología y metabolismo. Lippincott Williams & Wilkins. pp. 1027–. ISBN 978-0-7817-1750-2.
- ^ Marc A. Fritz, Leon Speroff (28 de marzo de 2012). Endocrinología ginecológica clínica e infertilidad. Lippincott Williams & Wilkins. pp. 753–. ISBN 978-1-4511-4847-3.
- ^ Stanczyk FZ, Archer DF, Bhavnani BR (2013). "Etinilestradiol y 17β-estradiol en anticonceptivos orales combinados: farmacocinética, farmacodinamia y evaluación de riesgos". Anticoncepción . 87 (6): 706–27. doi :10.1016/j.contraception.2012.12.011. PMID 23375353.
- ^ Rogerio A. Lobo (5 de junio de 2007). Tratamiento de la mujer posmenopáusica: aspectos básicos y clínicos. Academic Press. pp. 177, 770–771. ISBN 978-0-08-055309-2.
- ^ ab Turo R, Smolski M, Esler R, Kujawa ML, Bromage SJ, Oakley N, Adeyoju A, Brown SC, Brough R, Sinclair A, Collins GN (febrero de 2014). "Dietilestilbestrol para el tratamiento del cáncer de próstata: pasado, presente y futuro". Scand J Urol . 48 (1): 4–14. doi :10.3109/21681805.2013.861508. PMID 24256023. S2CID 34563641.
- ^ abc Phillips I, Shah SI, Duong T, Abel P, Langley RE (2014). "Terapia de privación de andrógenos y el resurgimiento del estrógeno parenteral en el cáncer de próstata". Oncol Hematol Rev . 10 (1): 42–47. doi :10.17925/ohr.2014.10.1.42. PMC 4052190 . PMID 24932461.
- ^ Waun Ki Hong, James F. Holland (2010). Medicina del cáncer Holland-Frei 8. PMPH-USA. págs. 753–. ISBN 978-1-60795-014-1.
- ^ Russell N, Cheung A, Grossmann M (agosto de 2017). "Estradiol para la mitigación de los efectos adversos de la terapia de privación de andrógenos". Endocr. Relat. Cancer . 24 (8): R297–R313. doi : 10.1530/ERC-17-0153 . PMID 28667081.
- ^ abc Odlind V, Milsom I, Persson I, Victor A (junio de 2002). "¿Pueden los cambios en la globulina transportadora de hormonas sexuales predecir el riesgo de tromboembolia venosa con píldoras anticonceptivas orales combinadas?". Acta Obstet Gynecol Scand . 81 (6): 482–90. doi : 10.1034/j.1600-0412.2002.810603.x . PMID 12047300. S2CID 26054257.
- ^ Raps M, Helmerhorst F, Fleischer K, Thomassen S, Rosendaal F, Rosing J, Ballieux B, VAN Vliet H (junio de 2012). "Globulina transportadora de hormonas sexuales como marcador del riesgo trombótico de los anticonceptivos hormonales". J. Thromb. Haemost . 10 (6): 992–7. doi : 10.1111/j.1538-7836.2012.04720.x . PMID 22469296. S2CID 20803995.
- ^ Stanczyk FZ, Grimes DA (septiembre de 2008). "Globulina transportadora de hormonas sexuales: no es un marcador sustituto de tromboembolia venosa en mujeres que usan anticonceptivos orales". Anticoncepción . 78 (3): 201–3. doi :10.1016/j.contraception.2008.04.004. PMID 18692609.
- ^ Stephen J. Winters, Ilpo T. Huhtaniemi (25 de abril de 2017). Hipogonadismo masculino: principios básicos, clínicos y terapéuticos. Humana Press. pp. 307–. ISBN 978-3-319-53298-1.
- ^ Notelovitz M (marzo de 2006). "Opinión clínica: principios biológicos y farmacológicos de la terapia con estrógenos para la menopausia sintomática". MedGenMed . 8 (1): 85. PMC 1682006 . PMID 16915215.
- ^ Goodman MP (febrero de 2012). "¿Todos los estrógenos son iguales? Una revisión de la terapia oral frente a la transdérmica". J Womens Health (Larchmt) . 21 (2): 161–9. doi :10.1089/jwh.2011.2839. PMID 22011208.
- ^ Stege R, Carlström K, Collste L, Eriksson A, Henriksson P, Pousette A (1988). "Terapia con fosfato de poliestradiol como fármaco único en el cáncer de próstata". Am. J. Clin. Oncol . 11 (Supl. 2): S101–3. doi :10.1097/00000421-198801102-00024. PMID 3242384. S2CID 32650111.
- ^ ab von Schoultz B, Carlström K, Collste L, Eriksson A, Henriksson P, Pousette A, Stege R (1989). "Terapia con estrógenos y función hepática: efectos metabólicos de la administración oral y parenteral". Próstata . 14 (4): 389–95. doi :10.1002/pros.2990140410. PMID 2664738. S2CID 21510744.
- ^ Ottosson UB, Carlström K, Johansson BG, von Schoultz B (1986). "Inducción de estrógenos de proteínas hepáticas y colesterol de lipoproteínas de alta densidad: comparación entre valerato de estradiol y etinilestradiol". Gynecol. Obstet. Invest . 22 (4): 198–205. doi :10.1159/000298914. PMID 3817605.
- ^ Abdul Sultan A, West J, Stephansson O, Grainge MJ, Tata LJ, Fleming KM, Humes D, Ludvigsson JF (noviembre de 2015). "Definición de tromboembolia venosa y medición de su incidencia mediante registros sanitarios suecos: un estudio de cohorte de embarazos a nivel nacional". BMJ Open . 5 (11): e008864. doi :10.1136/bmjopen-2015-008864. PMC 4654387 . PMID 26560059.
- ^ Russo J, Russo IH (2006). "El papel del estrógeno en la iniciación del cáncer de mama". J. Steroid Biochem. Mol. Biol . 102 (1–5): 89–96. doi :10.1016/j.jsbmb.2006.09.004. PMC 1832080. PMID 17113977 .
- ^ Germain D (2011). "Carcinogénesis por estrógenos en el cáncer de mama". Endocrinol. Metab. Clin. North Am . 40 (3): 473–84, vii. doi :10.1016/j.ecl.2011.05.009. PMID 21889715.
- ^ Jameera Begam A, Jubie S, Nanjan MJ (2017). "Agonistas/antagonistas de los receptores de estrógeno en la terapia del cáncer de mama: una revisión crítica". Bioorg. Chem . 71 : 257–274. doi :10.1016/j.bioorg.2017.02.011. PMID 28274582.
- ^ Yip CH, Rhodes A (2014). "Receptores de estrógeno y progesterona en el cáncer de mama". Future Oncol . 10 (14): 2293–301. doi :10.2217/fon.14.110. PMID 25471040. S2CID 22988559.
- ^ Schiavon G, Smith IE (2013). "Terapia endocrina para el cáncer de mama avanzado/metastásico". Hematol. Oncol. Clin. North Am . 27 (4): 715–36, viii. doi :10.1016/j.hoc.2013.05.004. PMID 23915741.
- ^ Lumachi F, Santeufemia DA, Basso SM (2015). "Tratamiento médico actual del cáncer de mama con receptores de estrógeno positivos". World J Biol Chem . 6 (3): 231–9. doi : 10.4331/wjbc.v6.i3.231 . PMC 4549764 . PMID 26322178.
- ^ Lee CI, Goodwin A, Wilcken N (2017). "Fulvestrant para el cáncer de mama metastásico sensible a las hormonas". Cochrane Database Syst Rev. 1 ( 1): CD011093. doi :10.1002/14651858.CD011093.pub2. PMC 6464820. PMID 28043088 .
- ^ ab Mallick S, Benson R, Julka PK (2016). "Prevención del cáncer de mama con antiestrógenos: revisión de la evidencia actual y direcciones futuras". Cáncer de mama . 23 (2): 170–7. doi :10.1007/s12282-015-0647-2. PMID 26439380. S2CID 37377540.
- ^ ab Li F, Dou J, Wei L, Li S, Liu J (2016). "Moduladores selectivos del receptor de estrógeno en la prevención del cáncer de mama". Cancer Chemother. Pharmacol . 77 (5): 895–903. doi :10.1007/s00280-016-2959-0. PMID 26787504. S2CID 24240700.
- ^ ab Mocellin S, Pilati P, Briarava M, Nitti D (2016). "Quimioprevención del cáncer de mama: un metaanálisis en red de ensayos controlados aleatorizados". J. Natl. Cancer Inst . 108 (2): djv318. doi : 10.1093/jnci/djv318 . PMID 26582062.
- ^ ab Coelingh Bennink HJ, Verhoeven C, Dutman AE, Thijssen J (enero de 2017). "El uso de estrógenos en dosis altas para el tratamiento del cáncer de mama". Maturitas . 95 : 11-23. doi : 10.1016/j.maturitas.2016.10.010 . PMID 27889048.
- ^ ab Jordan VC (2015). "La nueva biología de la apoptosis inducida por estrógenos aplicada al tratamiento y prevención del cáncer de mama". Endocr. Relat. Cancer . 22 (1): R1–31. doi :10.1530/ERC-14-0448. PMC 4494663 . PMID 25339261.
- ^ abcdefghijk Yang Z, Hu Y, Zhang J, Xu L, Zeng R, Kang D (2017). "Terapia con estradiol y riesgo de cáncer de mama en mujeres perimenopáusicas y posmenopáusicas: una revisión sistemática y metanálisis". Gynecol. Endocrinol . 33 (2): 87–92. doi :10.1080/09513590.2016.1248932. PMID 27898258. S2CID 205631264.
- ^ Pike MC, Wu AH, Spicer DV, Lee S, Pearce CL (2007). "Estrógenos, progestinas y riesgo de cáncer de mama". Actas del Simposio de la Fundación Ernst Schering. 2007/1 (1): 127–50. doi :10.1007/2789_2007_059. ISBN 978-3-540-73492-5. Número de identificación personal 18540571.
- ^ Atashgaran V, Wrin J, Barry SC, Dasari P, Ingman WV (2016). "Disección de la biología del riesgo de cáncer de mama asociado al ciclo menstrual". Front Oncol . 6 : 267. doi : 10.3389/fonc.2016.00267 . PMC 5183603 . PMID 28083513.
- ^ Lambrinoudaki I (2014). "Progestágenos en la terapia hormonal posmenopáusica y el riesgo de cáncer de mama". Maturitas . 77 (4): 311–7. doi :10.1016/j.maturitas.2014.01.001. PMID 24485796.
- ^ Hembree WC, Cohen-Kettenis P, Delemarre-van de Waal HA, Gooren LJ, Meyer WJ, Spack NP, Tangpricha V, Montori VM (2009). "Tratamiento endocrino de personas transexuales: una guía de práctica clínica de la Endocrine Society". J.Clin. Endocrinol. Metab . 94 (9): 3132–54. doi : 10.1210/jc.2009-0345 . PMID 19509099. S2CID 20486653.
- ^ Gooren LJ, van Trotsenburg MA, Giltay EJ, van Diest PJ (2013). "Desarrollo del cáncer de mama en sujetos transexuales que reciben tratamiento con hormonas cruzadas". J Sex Med . 10 (12): 3129–34. doi :10.1111/jsm.12319. PMID 24010586.
- ^ Brown GR, Jones KT (2015). "Incidencia de cáncer de mama en una cohorte de 5135 veteranos transgénero". Breast Cancer Res. Treat . 149 (1): 191–8. doi :10.1007/s10549-014-3213-2. PMID 25428790. S2CID 10935304.
- ^ ab Cuhaci N, Polat SB, Evranos B, Ersoy R, Cakir B (2014). "Ginecomastia: evaluación clínica y tratamiento". Indian J Endocrinol Metab . 18 (2): 150–8. doi : 10.4103/2230-8210.129104 . PMC 3987263 . PMID 24741509.
- ^ Shlomo Melmed, Kenneth S. Polonsky, P. Reed Larsen, Henry M. Kronenberg (30 de noviembre de 2015). Williams Textbook of Endocrinology. Elsevier Health Sciences. pp. 934–. ISBN 978-0-323-29738-7.
- ^ Hughes IA, Werner R, Bunch T, Hiort O (2012). "Síndrome de insensibilidad a los andrógenos". Semin. Reprod. Med . 30 (5): 432–42. doi :10.1055/s-0032-1324728. PMID 23044881. S2CID 33580939.
- ^ Niewoehner CB, Schorer AE (2008). "Ginecomastia y cáncer de mama en hombres". BMJ . 336 (7646): 709–13. doi :10.1136/bmj.39511.493391.BE. PMC 2276281 . PMID 18369226.
- ^ Christopher Li (11 de noviembre de 2009). Epidemiología del cáncer de mama. Springer Science & Business Media. pp. 266–. ISBN 978-1-4419-0685-4.
- ^ Chen J, Zhao KN, Liu GB (2013). "Colestasis inducida por estrógenos: patogénesis e implicaciones terapéuticas". Hepatogastroenterology . 60 (126): 1289–96. doi :10.5754/hge121061 (inactivo el 29 de marzo de 2024). ISSN 0172-6390. PMID 23933920.
{{cite journal}}: CS1 maint: DOI inactive as of March 2024 (link) - ^ Chitturi S, Farrell GC (2001). "Colestasis inducida por fármacos". Semin. Gastrointest. Dis . 12 (2): 113–24. PMID 11352118.
- ^ Velayudham LS, Farrell GC (2003). "Colestasis inducida por fármacos". Expert Opin Drug Saf . 2 (3): 287–304. doi :10.1517/eods.2.3.287.21377. PMID 12904107.
- ^ Arrese M, Reyes H (2006). "Colestasis intrahepática del embarazo: un enigma pasado y presente". Ann Hepatol . 5 (3): 202–5. doi : 10.1016/S1665-2681(19)32012-5 . PMID 17060884.
- ^ Pusl T, Beuers U (2007). "Colestasis intrahepática del embarazo". Orphanet J Rare Dis . 2 : 26. doi : 10.1186/1750-1172-2-26 . PMC 1891276 . PMID 17535422.
- ^ Arrese M, Macias RI, Briz O, Perez MJ, Marin JJ (2008). "Patogénesis molecular de la colestasis intrahepática del embarazo". Expert Rev Mol Med . 10 : e9. doi :10.1017/S1462399408000628. PMID 18371245. S2CID 39759941.
- ^ Pauli-Magnus C, Meier PJ, Stieger B (2010). "Determinantes genéticos de la colestasis inducida por fármacos y la colestasis intrahepática del embarazo" (PDF) . Semin. Liver Dis . 30 (2): 147–59. doi :10.1055/s-0030-1253224. PMID 20422497. S2CID 260312828. Archivado desde el original (PDF) el 15 de mayo de 2022 . Consultado el 4 de noviembre de 2018 .
- ^ Uhler ML, Marks JW, Judd HL (2000). "Terapia de reemplazo de estrógeno y enfermedad de la vesícula biliar en mujeres posmenopáusicas". Menopausia . 7 (3): 162–7. doi :10.1097/00042192-200007030-00006. PMID 10810961. S2CID 37022601.
- ^ Dhiman RK, Chawla YK (2006). "¿Existe un vínculo entre la terapia con estrógenos y la enfermedad de la vesícula biliar?". Expert Opin Drug Saf . 5 (1): 117–29. doi :10.1517/14740338.5.1.117. PMID 16370961. S2CID 2173767.
- ^ Wang HH, Liu M, Clegg DJ, Portincasa P, Wang DQ (2009). "Nuevos conocimientos sobre los mecanismos moleculares que subyacen a los efectos del estrógeno en la formación de cálculos biliares de colesterol". Biochim. Biophys. Acta . 1791 (11): 1037–47. doi :10.1016/j.bbalip.2009.06.006. PMC 2756670. PMID 19589396 .
- ^ ab Wang S, Wang Y, Xu J, Chen Y (2017). "¿El anticonceptivo oral o la terapia de reemplazo hormonal son un factor de riesgo para la colelitiasis?: una revisión sistemática y un metanálisis". Medicine (Baltimore) . 96 (14): e6556. doi :10.1097/MD.0000000000006556. PMC 5411213. PMID 28383429 .
- ^ Stinton LM, Shaffer EA (2012). "Epidemiología de la enfermedad de la vesícula biliar: colelitiasis y cáncer". Gut Liver . 6 (2): 172–87. doi :10.5009/gnl.2012.6.2.172. PMC 3343155 . PMID 22570746.
- ^ A. Labhart (6 de diciembre de 2012). Endocrinología clínica: teoría y práctica. Springer Science & Business Media. pp. 548–. ISBN 978-3-642-96158-8.
- ^ Scott WW, Menon M, Walsh PC (abril de 1980). "Terapia hormonal del cáncer de próstata". Cancer . 45 (Supl 7): 1929–1936. doi : 10.1002/cncr.1980.45.s7.1929 . PMID 29603164. S2CID 4492779.
- ^ Ansbacher R (febrero de 2001). "La farmacocinética y la eficacia de diferentes estrógenos no son equivalentes". Am. J. Obstet. Gynecol . 184 (3): 255–63. doi :10.1067/mob.2001.109656. PMID 11228470.
- ^ Bennink HJ (2008). "Reimpresión de ¿Son todos los estrógenos iguales?". Maturitas . 61 (1–2): 195–201. doi :10.1016/j.maturitas.2008.11.015. PMID 19434891.
- ^ Lauritzen C (septiembre de 1990). "Uso clínico de estrógenos y progestágenos". Maturitas . 12 (3): 199–214. doi :10.1016/0378-5122(90)90004-P. PMID 2215269.
- ^ Lauritzen C (junio de 1977). "[Terapia de estrógenos en la práctica. 3. Preparaciones de estrógenos y preparaciones combinadas]" [Terapia de estrógenos en la práctica. 3. Preparaciones de estrógenos y preparaciones combinadas]. Fortschritte Der Medizin (en alemán). 95 (21): 1388–92. PMID 559617.
- ^ Wolf AS, Schneider HP (12 de marzo de 2013). Ostrogeno en Diagnostik und Therapie. Springer-Verlag. págs. 78–. ISBN 978-3-642-75101-1.
- ^ Göretzlehner G, Lauritzen C, Römer T, Rossmanith W (1 de enero de 2012). Praktische Hormontherapie in der Gynäkologie. Walter de Gruyter. págs.44–. ISBN 978-3-11-024568-4.
- ^ Knörr K, Beller FK, Lauritzen C (17 de abril de 2013). Lehrbuch der Gynäkologie. Springer-Verlag. págs. 212-213. ISBN 978-3-662-00942-0.
- ^ Horský J, Presl J (1981). "Tratamiento hormonal de los trastornos del ciclo menstrual". En Horsky J, Presl J (eds.). Función ovárica y sus trastornos: diagnóstico y terapia . Springer Science & Business Media. págs. 309–332. doi :10.1007/978-94-009-8195-9_11. ISBN 978-94-009-8195-9.
- ^ Pschyrembel W (1968). Praktische Gynäkologie: für Studierende und Ärzte. Walter de Gruyter. págs. 598–599. ISBN 978-3-11-150424-7.
- ^ Lauritzen CH (enero de 1976). "El síndrome climatérico femenino: significado, problemas, tratamiento". Acta Obstetricia Et Gynecologica Scandinavica. Suplemento . 51 : 47–61. doi :10.3109/00016347509156433. PMID 779393.
- ^ Lauritzen C (1975). "El síndrome climatérico femenino: significado, problemas, tratamiento". Acta Obstetricia et Gynecologica Scandinavica . 54 (s51): 48–61. doi :10.3109/00016347509156433. ISSN 0001-6349.
- ^ Kopera H (1991). "Hormona der Gonaden". Terapia hormonal para la mujer . Kliniktaschenbucher. págs. 59-124. doi :10.1007/978-3-642-95670-6_6. ISBN 978-3-540-54554-5. ISSN 0172-777X.
- ^ Scott WW, Menon M, Walsh PC (abril de 1980). "Terapia hormonal del cáncer de próstata". Cancer . 45 (Supl. 7): 1929–1936. doi :10.1002/cncr.1980.45.s7.1929. PMID 29603164.
- ^ Leinung MC, Feustel PJ, Joseph J (2018). "Tratamiento hormonal de mujeres transgénero con estradiol oral". Salud transgénero . 3 (1): 74–81. doi :10.1089/trgh.2017.0035. PMC 5944393 . PMID 29756046.
- ^ Ryden AB (1950). "Sustancias estrogénicas naturales y sintéticas; su eficacia relativa cuando se administran por vía oral". Acta Endocrinologica . 4 (2): 121–39. doi :10.1530/acta.0.0040121. PMID 15432047.
- ^ Ryden AB (1951). "La eficacia de las sustancias estrogénicas naturales y sintéticas en las mujeres". Acta Endocrinologica . 8 (2): 175–91. doi :10.1530/acta.0.0080175. PMID 14902290.
- ^ Kottmeier HL (1947). "Ueber blutungen in der menopause: Speziell der klinischen bedeutung eines endometriums mit zeichen hormonaler beeinflussung: Part I". Acta Obstetricia et Gynecologica Scandinavica . 27 (s6): 1–121. doi :10.3109/00016344709154486. ISSN 0001-6349.
No hay duda de que la conversión del endometrio con inyecciones de preparaciones de hormonas estrogénicas tanto sintéticas como nativas tiene éxito, pero la opinión sobre si las preparaciones nativas administradas por vía oral pueden producir una proliferación de la mucosa varía según los autores. PEDERSEN-BJERGAARD (1939) pudo demostrar que el 90% de la foliculina captada en la sangre de la vena portae se inactiva en el hígado. Ni KAUFMANN (1933, 1935), ni RAUSCHER (1939, 1942) ni HERRNBERGER (1941) lograron que un endometrio de castración proliferara utilizando grandes dosis de preparaciones de estrona o estradiol administradas por vía oral. NEUSTAEDTER (1939), LAUTERWEIN (1940) y FERIN (1941) informaron sobre otros resultados; lograron convertir un endometrio de castración atrófico en una mucosa proliferante inequívoca con 120-300 de estradiol o con 380 de estrona.
- ^ Rietbrock N, Staib AH, Loew D (11 de marzo de 2013). Farmacología clínica: Arzneitherapie. Springer-Verlag. págs. 426–. ISBN 978-3-642-57636-2.
- ^ Martinez-Manautou J, Rudel HW (1966). "Actividad antiovulatoria de varios estrógenos sintéticos y naturales". En Robert Benjamin Greenblatt (ed.). Ovulación: estimulación, supresión y detección. Lippincott. págs. 243–253.
- ^ Herr F, Revesz C, Manson AJ, Jewell JB (1970). "Propiedades biológicas de los sulfatos de estrógeno". Aspectos químicos y biológicos de la conjugación de esteroides . págs. 368–408. doi :10.1007/978-3-642-49793-3_8. ISBN . 978-3-642-49506-9.
- ^ Duncan CJ, Kistner RW, Mansell H (octubre de 1956). "Supresión de la ovulación mediante tripanisilcloroetileno (TACE)". Obstetricia y ginecología . 8 (4): 399–407. PMID 13370006.
- ^ Clark JH, Paszko Z, Peck EJ (enero de 1977). "Unión nuclear y retención del complejo receptor de estrógeno: relación con las propiedades agonistas y antagonistas del estriol". Endocrinología . 100 (1): 91–96. doi :10.1210/endo-100-1-91. PMID 830547.
- ^ Clark JH, Hardin JW, McCormack SA (1979). "Mecanismo de acción de los agonistas y antagonistas de estrógenos". Journal of Animal Science . 49 Suppl 2: 46–65. doi :10.1093/ansci/49.supplement_ii.46. PMID 400777.
- ^ Lunan CB, Klopper A (septiembre de 1975). "Antiestrógenos. Una revisión". Endocrinología clínica . 4 (5): 551–572. doi :10.1111/j.1365-2265.1975.tb01568.x. PMID 170029. S2CID 9628572.
- ^ Rabe T, Runnebaum B, Kellermeier-Wittlinger S (1994). "Hormontherapie" [Terapia hormonal]. En Runnebaum B, Rabe T (eds.). Gynäkologische Endokrinologie und Fortpflanzungsmedizin: Banda 1: Gynäkologische Endokrinologie [ Endocrinología ginecológica y medicina reproductiva: Volumen 1: Endocrinología ginecológica ]. págs. 63-147. doi :10.1007/978-3-662-07635-4_3. ISBN 978-3-662-07635-4.
- ^ Clark JH, Markaverich BM (1983). "Los efectos agonistas y antagonistas de los estrógenos de acción corta: una revisión". Farmacología y terapéutica . 21 (3): 429–453. doi :10.1016/0163-7258(83)90063-3. PMID 6356176.
- ^ Clark JH, Markaverich BM (abril de 1984). "Las acciones agonistas y antagonistas del estriol". Journal of Steroid Biochemistry . 20 (4B): 1005–1013. doi :10.1016/0022-4731(84)90011-6. PMID 6202959.
- ^ Terenius L, Ljungkvist I (1972). "Aspectos sobre el modo de acción de los antiestrógenos y antiprogestágenos". Gynecologic Investigation . 3 (1): 96–107. doi :10.1159/000301746. PMID 4347201.
- ^ ab Wallach EE, Hammond CB, Maxson WS (1982). "Estado actual de la terapia con estrógenos para la menopausia". Fertilidad y esterilidad . 37 (1): 5–25. doi :10.1016/S0015-0282(16)45970-4. ISSN 0015-0282. PMID 6277697.
- ^ abcd Santen RJ, Simpson E (marzo de 2019). "Historia del estrógeno: su purificación, estructura, síntesis, acciones biológicas e implicaciones clínicas". Endocrinología . 160 (3): 605–625. doi : 10.1210/en.2018-00529 . PMID 30566601.
- ^ Fluhmann CF (noviembre de 1938). "Hormonas estrogénicas: su uso clínico". Cal West Med . 49 (5): 362–6. PMC 1659459 . PMID 18744783.
- ^ JB Josimovich (11 de noviembre de 2013). Endocrinología ginecológica. Springer Science & Business Media. pp. 8–. ISBN 978-1-4613-2157-6.
- ^ ab Enrique Ravina (18 de abril de 2011). La evolución del descubrimiento de fármacos: de las medicinas tradicionales a los fármacos modernos. John Wiley & Sons. pp. 174–175. ISBN 978-3-527-32669-3.
- ^ Vern L. Bullough (19 de mayo de 1995). La ciencia en el dormitorio: una historia de la investigación sexual. Basic Books. pp. 128–. ISBN 978-0-465-07259-0.
Cuando Allen y Doisy oyeron hablar de la [prueba de Ascheim-Zondek para el diagnóstico del embarazo], se dieron cuenta de que había una fuente rica y fácil de manejar de hormonas en la orina a partir de la cual podían desarrollar un potente extracto. [...] La investigación de Allen y Doisy fue patrocinada por el comité, mientras que la de su principal rival, Adolt Butenandt (nacido en 1903) de la Universidad de Gottingen fue patrocinada por una empresa farmacéutica alemana. En 1929, ambos términos anunciaron el aislamiento de una hormona sexual femenina cristalina pura, la estrona, en 1929, aunque Doisy y Allen lo hicieron dos meses antes que Butenandt.27 En 1931, la estrona estaba siendo producida comercialmente por Parke Davis en este país y Schering-Kahlbaum en Alemania. Curiosamente, cuando Butenandt (que compartió el Premio Nobel de Química en 1939) aisló la estrona y analizó su estructura, descubrió que era un esteroide, la primera hormona clasificada en esta familia molecular.
[ enlace muerto permanente ] - ^ Vera Regitz-Zagrosek (2 de octubre de 2012). Diferencias de sexo y género en farmacología. Springer Science & Business Media. pp. 549–. ISBN 978-3-642-30725-6El
primer esteroide sexual utilizado como agente farmacológico fue Progynon, vendido por primera vez por Schering AG en 1928. [...]
- ^ Barbara Seaman (4 de enero de 2011). El mayor experimento jamás realizado con mujeres: desmontando el mito del estrógeno. Seven Stories Press. pp. 22–. ISBN 978-1-60980-062-8.
- ^ Thom Rooke (1 de enero de 2012). La búsqueda de cortisona. MSU Press. pp. 54–. ISBN 978-1-60917-326-5.
- ^ Doisy EA, Thayer S, Veler CD (1930). "La preparación de la hormona ovárica folicular cristalina: Theelin". Journal of Biological Chemistry . 87 (2): 357–371. doi : 10.1016/S0021-9258(18)76871-3 .
- ^ Christopher Kobrak (7 de octubre de 2002). Culturas nacionales y competencia internacional: la experiencia de Schering AG, 1851-1950. Cambridge University Press. pp. 119–. ISBN 978-0-521-81481-2.
- ^ Streck A (1928). ""Progynon" -Schering, ein Neues Zyklus-Hormonpräparat". Klinische Wochenschrift . 7 (25): 1172–1178. doi :10.1007/BF01738283. ISSN 0023-2173. S2CID 35945534.
- ^ Batisweiler, J. (1928). Placentaextrakt Progynon (Schering-Kahlbaum) bei Menstruationsstörungen und Kastrationsfolgen. Zbl. Gynäk, 2227-2232. chicago
- ^ Stanley Alstead (22 de octubre de 2013). Poulsson's Text-Book of Pharmacology and Therapeutics. Elsevier. pp. 195–. ISBN 978-1-4832-2584-5.
- ^ Tata JR (2005). "Cien años de hormonas". EMBO Reports . 6 (6): 490–6. doi :10.1038/sj.embor.7400444. PMC 1369102 . PMID 15940278.
- ^ ab "La nomenclatura de los productos glandulares". JAMA: Revista de la Asociación Médica Estadounidense . 103 (15): 1152. 1934. doi :10.1001/jama.1934.02750410042012. ISSN 0098-7484.
- ^ Buschbeck H (2009). "Neue Wege der Hormontherapie in der Gynäkologie1". Deutsche Medizinische Wochenschrift . 60 (11): 389–393. doi :10.1055/s-0028-1129842. ISSN 0012-0472. S2CID 72668930.
- ^ Reifenstein EC (1944). "Endocrinología: una sinopsis de la fisiología normal y patológica, procedimientos de diagnóstico y terapia". Clínicas médicas de Norteamérica . 28 (5): 1232–1276. doi :10.1016/S0025-7125(16)36180-6. ISSN 0025-7125.
- ^ Stefanick ML (diciembre de 2005). "Estrógenos y progestinas: antecedentes e historia, tendencias en el uso y pautas y regímenes aprobados por la Administración de Alimentos y Medicamentos de los Estados Unidos". Am. J. Med . 118 (Supl. 12B): 64–73. doi : 10.1016/j.amjmed.2005.09.059 . PMID 16414329.
- ^ Barrett-Connor E (septiembre de 2003). "Revisión clínica 162: endocrinología cardiovascular 3: un epidemiólogo analiza las hormonas y las enfermedades cardíacas en mujeres". J. Clin. Endocrinol. Metab . 88 (9): 4031–42. doi : 10.1210/jc.2003-030876 . PMID 12970259.
- ^ Novak E (1935). "El uso terapéutico de sustancias estrogénicas". JAMA: Revista de la Asociación Médica Estadounidense . 104 (20): 1815. doi :10.1001/jama.1935.92760200002012. ISSN 0098-7484.
- ^ Rothenberg, Carla J. (25 de abril de 2005). "El ascenso y la caída de la terapia con estrógenos: la historia de la terapia de reemplazo hormonal" (PDF) . Archivado desde el original (PDF) el 5 de septiembre de 2006. Consultado el 27 de octubre de 2006 .
- ^ Alison Li (27 de octubre de 2003). JB Collip y el desarrollo de la investigación médica en Canadá: extractos y emprendimiento. McGill-Queen's Press — MQUP. pp. 115–. ISBN 978-0-7735-7145-7.
- ^ Inhoffen HH, Hohlweg W (1938). "Neue per os-wirksame weibliche Keimdrüsenhormon-Derivate: 17-Aethinyl-oestradiol und Pregnen-in-on-3-ol-17 (Nuevos derivados glandulares femeninos activos por vía oral: 17α-etinilestradiol y pregnen-in-on-3 -ol-17)". Naturwissenschaften . 26 (6): 96. Código bibliográfico : 1938NW.....26...96I. doi :10.1007/BF01681040. S2CID 46648877.
- ^ Maisel, Albert Q. (1965). La búsqueda de hormonas . Nueva York: Random House. OCLC 543168.
- ^ Petrow V (diciembre de 1970). "Los progestágenos anticonceptivos". Chem Rev . 70 (6): 713–26. doi :10.1021/cr60268a004. PMID 4098492.
- ^ Sneader, Walter (2005). "Análogos hormonales". Descubrimiento de fármacos: una historia . Hoboken, NJ: John Wiley & Sons. pp. 188–225. ISBN 0-471-89980-1.
- ^ Djerassi C (enero de 2006). "Nacimiento químico de la píldora". American Journal of Obstetrics and Gynecology . 194 (1): 290–8. doi :10.1016/j.ajog.2005.06.010. PMID 16389046.
- ^ FDA (2007). "Historial de aprobación: Estinyl (etinilestradiol) NDA 005292".búsqueda: Estinyl
- ^ Martin PL, Burnier AM, Greaney MO (1972). "Terapia oral para la menopausia con estradiol 17-micronizado. Un estudio preliminar de eficacia, tolerancia y preferencia de las pacientes". Obstet Gynecol . 39 (5): 771–4. PMID 5023261.
- ^ Rigg LA, Milanes B, Villanueva B, Yen SS (1977). "Eficacia de la administración intravaginal e intranasal de estradiol-17beta micronizado". J. Clin. Endocrinol. Metab . 45 (6): 1261–4. doi : 10.1210/jcem-45-6-1261 . PMID 591620.
- ^ "Drugs@FDA: Medicamentos aprobados por la FDA".
- ^ abc Michael Oettel, Ekkehard Schillinger (6 de diciembre de 2012). Estrógenos y antiestrógenos II: farmacología y aplicación clínica de estrógenos y antiestrógenos. Springer Science & Business Media. pp. 542–. ISBN 978-3-642-60107-1.
- ^ abc Payne AH, Hardy MP (28 de octubre de 2007). La célula de Leydig en la salud y la enfermedad. Springer Science & Business Media. pp. 422–431. ISBN 978-1-59745-453-7
Los estrógenos son inhibidores muy eficaces del eje hipotálamo-hipofisario-testicular (212-214). Además de su acción de retroalimentación negativa a nivel del hipotálamo y la hipófisis, es probable que tengan efectos inhibidores directos sobre el testículo (215,216). [...] La histología de los testículos [con tratamiento estrogénico] mostró desorganización de los túbulos seminíferos, vacuolización y ausencia de luz, y compartimentación de la espermatogénesis
. - ^ ab Salam MA (2003). Principios y práctica de la urología: un texto completo. Universal-Publishers. pp. 684–. ISBN 978-1-58112-412-5Los estrógenos
actúan principalmente a través de una retroalimentación negativa a nivel hipotálamo-hipofisario para reducir la secreción de LH y la síntesis de andrógenos testiculares. [...] Curiosamente, si se interrumpe el tratamiento con estrógenos después de 3 años de exposición ininterrumpida, la testosterona sérica puede permanecer en niveles de castración hasta otros 3 años. Se cree que esta supresión prolongada es resultado de un efecto directo de los estrógenos sobre las células de Leydig.
- ^ Andersson G (9 de enero de 2007). "La bulimia puede ser consecuencia de un desequilibrio hormonal". Instituto Karolinska. Archivado desde el original el 20 de febrero de 2012. Consultado el 4 de marzo de 2008 .
- ^ Hsieh YC, Yu HP, Frink M, Suzuki T, Choudhry MA, Schwacha MG, Chaudry IH (2007). "La vía de la proteína quinasa A dependiente del receptor 30 acoplado a proteína G es fundamental en los efectos no genómicos del estrógeno en la atenuación de la lesión hepática después de un traumatismo hemorrágico". Am. J. Pathol . 170 (4): 1210–8. doi :10.2353/ajpath.2007.060883. PMC 1829455. PMID 17392161 .
- ^ Oh DM, Phillips, TJ (2006). "Hormonas sexuales y cicatrización de heridas". Heridas . 18 (1): 8–18.
- ^ Crider A, Pillai A (enero de 2017). "Señalización de estrógenos como objetivo terapéutico en trastornos del desarrollo neurológico". J Pharmacol Exp Ther . 360 (1): 48–58. doi :10.1124/jpet.116.237412. PMC 5193073 . PMID 27789681.
Lectura adicional
- Alfred S. Wolf, HPG Schneider (12 de marzo de 2013). Ostrogeno en Diagnostik und Therapie. Springer-Verlag. págs.1–. ISBN 978-3-642-75101-1.
- O'Connell MB (septiembre de 1995). "Variación farmacocinética y farmacológica entre diferentes productos de estrógeno". J Clin Pharmacol . 35 (9S): 18S–24S. doi :10.1002/j.1552-4604.1995.tb04143.x. PMID 8530713. S2CID 10159196.
- Michael Oettel, Ekkehard Schillinger (1999). Estrógenos y antiestrógenos I: fisiología y mecanismos de acción de los estrógenos y antiestrógenos. Springer Science & Business Media. ISBN 978-3-642-58616-3.
- Michael Oettel, Ekkehard Schillinger (1999). Estrógenos y antiestrógenos II: farmacología y aplicación clínica de estrógenos y antiestrógenos. Springer Science & Business Media. ISBN 978-3-642-60107-1.
- Ruggiero RJ, Likis FE (2002). "Estrógeno: fisiología, farmacología y formulaciones para terapia de reemplazo". J Midwifery Womens Health . 47 (3): 130–8. doi :10.1016/S1526-9523(02)00233-7. PMID 12071379.
- Kuhl H (2005). "Farmacología de los estrógenos y progestágenos: influencia de diferentes vías de administración" (PDF) . Climaterio . 8 (Supl. 1): 3–63. doi :10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
Enlaces externos
- MedlinePlus Información sobre medicamentos medmaster-a682922


