Célula madre hematopoyética
Este artículo puede resultar demasiado técnico para la mayoría de los lectores . ( Agosto de 2015 ) |
| Célula madre hematopoyética | |
|---|---|
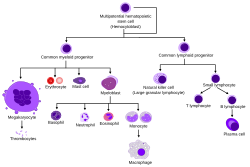 Descripción general de la hematopoyesis humana normal | |
| Detalles | |
| Precursor | Hemangioblast |
| Sistema | Sistema hematopoyético |
| Ubicación | Médula ósea |
| Función | Células madre que dan origen a otras células sanguíneas |
| Identificadores | |
| latín | célula hematopoyética previa |
| Acrónimo(s) | Escuela secundaria superior |
| Malla | D006412 |
| EL | H2.00.01.0.00006 |
| Términos anatómicos de microanatomía [editar en Wikidata] | |
Las células madre hematopoyéticas ( HSC ) son las células madre [1] que dan lugar a otras células sanguíneas . Este proceso se denomina hematopoyesis . [2] En los vertebrados , las primeras HSC definitivas surgen de la pared endotelial ventral de la aorta embrionaria dentro de la región aorta-gónada-mesonefros (a mitad de la gestación) , a través de un proceso conocido como transición endotelial a hematopoyética. [3] [4] En los adultos, la hematopoyesis ocurre en la médula ósea roja , en el núcleo de la mayoría de los huesos. La médula ósea roja se deriva de la capa del embrión llamada mesodermo .
La hematopoyesis es el proceso mediante el cual se producen todas las células sanguíneas maduras. Debe equilibrar las enormes necesidades de producción (una persona promedio produce más de 500 mil millones de células sanguíneas por día) con la necesidad de regular la cantidad de cada tipo de célula sanguínea en la circulación. En los vertebrados, la gran mayoría de la hematopoyesis ocurre en la médula ósea y se deriva de un número limitado de células madre hematopoyéticas que son multipotentes y capaces de una amplia autorrenovación .
Las células madre hematopoyéticas dan lugar a diferentes tipos de células sanguíneas, en líneas llamadas mieloides y linfoides . Tanto los linajes mieloides como los linfoides están involucrados en la formación de células dendríticas . Las células mieloides incluyen monocitos , macrófagos , neutrófilos , basófilos , eosinófilos , eritrocitos y megacariocitos hasta las plaquetas . Las células linfoides incluyen células T , células B , células asesinas naturales y células linfoides innatas .
La definición de célula madre hematopoyética ha evolucionado desde que se descubrió por primera vez en 1961. [5] El tejido hematopoyético contiene células con capacidades de regeneración a largo y corto plazo y progenitores multipotentes , oligopotentes y unipotentes comprometidos . Las células madre hematopoyéticas constituyen 1:10 000 de las células del tejido mieloide .
Los trasplantes de células madre hematopoyéticas se utilizan en el tratamiento de cánceres y otros trastornos del sistema inmunológico [6] debido a sus propiedades regenerativas. [7]
Estructura
Son células redondas, no adherentes, con núcleo redondeado y baja relación citoplasma-núcleo. En su forma, las células madre hematopoyéticas se parecen a los linfocitos .
Ubicación
Las primeras células madre hematopoyéticas durante el desarrollo embrionario (en ratones y humanos) se encuentran en la región aorta-gónada-mesonefros y en las arterias vitelina y umbilical. [8] [9] [10] Un poco más tarde, las HSC también se encuentran en la placenta, el saco vitelino, la cabeza embrionaria y el hígado fetal. [3] [11]
Las células madre y progenitoras se pueden extraer de la pelvis, en la cresta ilíaca, utilizando una aguja y una jeringa. [12] Las células se pueden extraer en forma líquida (para realizar un frotis y observar la morfología celular) o se pueden extraer mediante una biopsia por punción (para mantener la arquitectura o la relación de las células entre sí y con el hueso). [ cita requerida ]
Subtipos
Una unidad formadora de colonias es un subtipo de HSC. (Este sentido del término es diferente al de unidades formadoras de colonias de microbios, que es una unidad de recuento de células ). Existen varios tipos de unidades formadoras de colonias de HSC:
- Unidad formadora de colonias: granulocito , eritrocito , monocito y megacariocito ( UFC-GEMM )
- Unidad formadora de colonias – linfocito ( UFC-L )
- Unidad formadora de colonias – eritrocito ( UFC-E )
- Unidad formadora de colonias – granulocitos – macrófagos ( UFC-GM )
- Unidad formadora de colonias – megacariocito ( UFC-Meg )
- Unidad formadora de colonias – basófilo ( UFC-Baso )
- Unidad formadora de colonias: eosinófilos ( UFC-Eos )
Las UFC anteriores se basan en el linaje. Otra UFC, la unidad formadora de colonias-bazo (UFC-S), fue la base de una formación de colonias clonales in vivo , que depende de la capacidad de las células de la médula ósea infundidas para dar lugar a clones de células hematopoyéticas maduras en los bazos de ratones irradiados después de 8 a 12 días. Se utilizó ampliamente en los primeros estudios, pero ahora se considera que mide células progenitoras o amplificadoras de tránsito más maduras en lugar de células madre [ cita requerida ] .
Aislamiento de células madre
Dado que las células madre hematopoyéticas no se pueden aislar como una población pura, no es posible identificarlas en un microscopio. [ cita requerida ] Las células madre hematopoyéticas se pueden identificar o aislar mediante el uso de citometría de flujo , donde se utiliza la combinación de varios marcadores de superficie celular diferentes (en particular CD34 ) para separar las raras células madre hematopoyéticas de las células sanguíneas circundantes. Las células madre hematopoyéticas carecen de expresión de marcadores de células sanguíneas maduras y, por lo tanto, se denominan Lin-. La falta de expresión de marcadores de linaje se utiliza en combinación con la detección de varios marcadores de superficie celular positivos para aislar células madre hematopoyéticas. Además, las células madre hematopoyéticas se caracterizan por su pequeño tamaño y baja tinción con colorantes vitales como la rodamina 123 (rodamina lo ) o Hoechst 33342 (población lateral).
Función

Hematopoyesis
Las células madre hematopoyéticas son esenciales para la hematopoyesis, la formación de las células dentro de la sangre. Las células madre hematopoyéticas pueden reponer todos los tipos de células sanguíneas (es decir, son multipotentes ) y autorenovarse. Una pequeña cantidad de células madre hematopoyéticas puede expandirse para generar una gran cantidad de células madre hematopoyéticas hijas. Este fenómeno se utiliza en el trasplante de médula ósea , [13] cuando una pequeña cantidad de células madre hematopoyéticas reconstituyen el sistema hematopoyético. Este proceso indica que, después del trasplante de médula ósea, deben ocurrir divisiones celulares simétricas en dos células madre hematopoyéticas hijas.
Se cree que la autorrenovación de las células madre ocurre en el nicho de células madre en la médula ósea, y es razonable suponer que las señales clave presentes en este nicho serán importantes en la autorrenovación. [2] Existe mucho interés en los requisitos ambientales y moleculares para la autorrenovación de las HSC, ya que comprender la capacidad de las HSC para reponerse eventualmente permitirá la generación de poblaciones expandidas de HSC in vitro que se pueden usar terapéuticamente.
Quietud
Las células madre hematopoyéticas, como todas las células madre adultas , en su mayoría existen en un estado de quiescencia o detención reversible del crecimiento. El metabolismo alterado de las HSC quiescentes ayuda a las células a sobrevivir durante períodos prolongados de tiempo en el entorno hipóxico de la médula ósea. [14] Cuando son provocadas por la muerte o daño celular, las células madre hematopoyéticas salen de la quiescencia y comienzan a dividirse activamente de nuevo. La transición de la latencia a la propagación y viceversa está regulada por la vía MEK/ERK y la vía PI3K/AKT/mTOR . [15] La desregulación de estas transiciones puede conducir al agotamiento de las células madre o a la pérdida gradual de células madre hematopoyéticas activas en el sistema sanguíneo. [15]
Movilidad
Las células madre hematopoyéticas tienen un potencial mayor que otras células sanguíneas inmaduras para atravesar la barrera de la médula ósea y, por lo tanto, pueden viajar en la sangre desde la médula ósea de un hueso a otro. Si se asientan en el timo , pueden convertirse en células T. En el caso de los fetos y otras hematopoyesis extramedulares , las células madre hematopoyéticas también pueden asentarse en el hígado o el bazo y desarrollarse.
Esto permite extraer células madre hematopoyéticas directamente de la sangre.
Importancia clínica
Trasplante
El trasplante de células madre hematopoyéticas (TCMH) es el trasplante de células madre hematopoyéticas multipotentes , generalmente derivadas de médula ósea, sangre periférica o sangre del cordón umbilical. [16] [17] [13] Puede ser autólogo (se utilizan las propias células madre del paciente), alogénico (las células madre provienen de un donante) o singénico (de un gemelo idéntico). [16] [17]
Se realiza con mayor frecuencia en pacientes con ciertos tipos de cáncer de la sangre o de la médula ósea , como el mieloma múltiple o la leucemia . [17] En estos casos, el sistema inmunológico del receptor suele destruirse con radiación o quimioterapia antes del trasplante. La infección y la enfermedad de injerto contra huésped son complicaciones importantes del TPH alogénico . [17]
Para recolectar células madre de la sangre periférica circulante, a los donantes de sangre se les inyecta una citocina , como el factor estimulante de colonias de granulocitos (G-CSF), que induce a las células a abandonar la médula ósea y circular en los vasos sanguíneos. [18] En la embriología de los mamíferos, las primeras células madre hematopoyéticas definitivas se detectan en la AGM ( aorta-gónada-mesonefros ), y luego se expanden masivamente en el hígado fetal antes de colonizar la médula ósea antes del nacimiento. [11]
El trasplante de células madre hematopoyéticas sigue siendo un procedimiento peligroso con muchas posibles complicaciones; se reserva para pacientes con enfermedades potencialmente mortales. A medida que ha aumentado la supervivencia después del procedimiento, su uso se ha ampliado más allá del cáncer a enfermedades autoinmunes [19] [20] y displasias esqueléticas hereditarias ; en particular, osteopetrosis infantil maligna [21] [22] y mucopolisacaridosis [23] .
Las células madre se pueden utilizar para regenerar distintos tipos de tejidos. El trasplante de células madre se ha establecido como una terapia para la leucemia mieloide crónica, la leucemia linfática aguda, la anemia aplásica y las hemoglobinopatías, además de la leucemia mieloide aguda y las deficiencias inmunitarias primarias. La regeneración del sistema hematopoyético se logra normalmente en un plazo de 2 a 4 semanas después de la quimioterapia o la radioterapia y el trasplante de células madre. Las células madre hematopoyéticas se están probando clínicamente para su uso en la regeneración de tejidos no hematopoyéticos. [24]
Envejecimiento de las células madre hematopoyéticas
Daño del ADN
Las roturas de cadenas de ADN se acumulan en las células madre hematopoyéticas a largo plazo durante el envejecimiento. [25] Esta acumulación está asociada con una amplia atenuación de las vías de reparación y respuesta del ADN que depende de la quiescencia de las HSC. [25] La unión de extremos no homólogos (NHEJ) es una vía que repara las roturas de doble cadena en el ADN. La NHEJ se conoce como "no homóloga" porque los extremos rotos se ligan directamente sin la necesidad de una plantilla homóloga. La vía NHEJ depende de varias proteínas, incluidas la ligasa 4 , la ADN polimerasa mu y el factor NHEJ 1 (NHEJ1, también conocido como Cernunnos o XLF).
La ligasa 4 del ADN (Lig4) tiene un papel muy específico en la reparación de roturas de doble cadena por NHEJ. La deficiencia de lig4 en el ratón provoca una pérdida progresiva de células madre hematopoyéticas durante el envejecimiento. [26] La deficiencia de lig4 en células madre pluripotentes da lugar a la acumulación de roturas de doble cadena del ADN y a una mayor apoptosis. [27]
En ratones mutantes de la polimerasa mu, el desarrollo de células hematopoyéticas es defectuoso en varias poblaciones de células periféricas y de la médula ósea, con una disminución de alrededor del 40 % en el número de células de la médula ósea que incluye varios linajes hematopoyéticos. [28] El potencial de expansión de las células progenitoras hematopoyéticas también está reducido. Estas características se correlacionan con una capacidad reducida para reparar roturas de doble cadena en el tejido hematopoyético.
La deficiencia del factor 1 de NHEJ en ratones conduce a un envejecimiento prematuro de las células madre hematopoyéticas, como lo indican varias líneas de evidencia, incluida la evidencia de que la repoblación a largo plazo es defectuosa y empeora con el tiempo. [29] Utilizando un modelo de células madre pluripotentes inducidas humanas con deficiencia de NHEJ1, se demostró que NHEJ1 tiene un papel importante en la promoción de la supervivencia de los progenitores hematopoyéticos primitivos. [30] Estas células deficientes en NHEJ1 poseen una capacidad de reparación mediada por NHEJ1 débil que aparentemente es incapaz de hacer frente a los daños del ADN inducidos por el estrés fisiológico, el metabolismo normal y la radiación ionizante. [30]
La sensibilidad de las células madre hematopoyéticas a la deficiencia de Lig4, ADN polimerasa mu y NHEJ1 sugiere que NHEJ es un determinante clave de la capacidad de las células madre para mantenerse frente al estrés fisiológico a lo largo del tiempo. [26] Rossi et al. [31] encontraron que el daño endógeno del ADN se acumula con la edad incluso en células madre hematopoyéticas de tipo salvaje, y sugirieron que la acumulación de daño del ADN puede ser un mecanismo fisiológico importante del envejecimiento de las células madre.
Pérdida de diversidad clonal
Un estudio muestra que la diversidad clonal de las células madre hematopoyéticas se reduce drásticamente alrededor de los 70 años a unas pocas de crecimiento más rápido , lo que confirma una nueva teoría del envejecimiento que podría permitir un envejecimiento saludable . [32] [33] Cabe destacar que el cambio en la diversidad clonal durante el envejecimiento fue informado previamente en 2008 [34] para el sistema murino por el laboratorio de Christa Muller-Sieburg en San Diego, California.
Investigación
El comportamiento en la cultura
Un ensayo de células formadoras de área en adoquín (CAFC) es un ensayo empírico basado en cultivo celular. Cuando se colocan en una placa de cultivo confluente de capa alimentadora estromal, [35] una fracción de células madre hematopoyéticas se deslizan entre los espacios (aunque las células estromales se toquen entre sí) y finalmente se asientan entre las células estromales y el sustrato (aquí la superficie de la placa) o quedan atrapadas en los procesos celulares entre las células estromales. La emperipolesis es el fenómeno in vivo en el que una célula es completamente envuelta en otra (por ejemplo, los timocitos en células nodrizas tímicas ); por otro lado, cuando in vitro , las células del linaje linfoide se deslizan debajo de las células nodrizas, el proceso se llama pseudoemperipolesis. Este fenómeno similar es más comúnmente conocido en el campo de las HSC por la terminología de cultivo celular células formadoras de área de adoquín (CAFC) , lo que significa que las áreas o grupos de células se ven opacas como adoquines bajo microscopía de contraste de fase, en comparación con las otras células madre hematopoyéticas, que son refráctiles. Esto sucede porque las células que flotan libremente sobre las células del estroma son esféricas y, por lo tanto, refráctiles. Sin embargo, las células que se arrastran debajo de las células del estroma son aplanadas y, por lo tanto, no refráctiles. El mecanismo de pseudoemperipolesis solo recientemente ha salido a la luz. Puede estar mediado por la interacción a través de CXCR4 (CD184), el receptor para las quimiocinas CXC (p. ej., SDF1 ) y las integrinas α4β1 . [36]
Cinética de repoblación
Las células madre hematopoyéticas (CMH) no se pueden observar directamente con facilidad y, por lo tanto, su comportamiento debe inferirse indirectamente. Los estudios clonales son probablemente la técnica más cercana para los estudios in vivo de células individuales de CMH. En este caso, se utilizan métodos estadísticos y experimentales sofisticados para determinar que, con una alta probabilidad, una sola CMH está contenida en un trasplante administrado a un huésped letalmente irradiado. La expansión clonal de esta célula madre se puede observar a lo largo del tiempo monitoreando el porcentaje de células del tipo del donante en la sangre a medida que se reconstituye el huésped. La serie temporal resultante se define como la cinética de repoblación de las CMH.
Las cinéticas de reconstitución son muy heterogéneas. Sin embargo, utilizando dinámicas simbólicas , se puede demostrar que caen en un número limitado de clases. [37] Para probar esto, varios cientos de cinéticas de repoblación experimentales de Thy-1 lo SCA-1 + lin − (B220, CD4, CD8, Gr-1, Mac-1 y Ter-119) [38] c-kit + HSC clonales se tradujeron en secuencias simbólicas asignando los símbolos "+", "-", "~" siempre que dos mediciones sucesivas del porcentaje de células de tipo donante tengan una pendiente positiva, negativa o sin cambios, respectivamente. Al utilizar la distancia de Hamming , los patrones de repoblación se sometieron a un análisis de conglomerados que produjo 16 grupos distintos de cinética. Para finalizar la prueba empírica, se utilizó el enfoque de adición de uno de Laplace para determinar que la probabilidad de encontrar cinéticas no contenidas en estos 16 grupos es muy pequeña. Como corolario, este resultado muestra que el compartimento de células madre hematopoyéticas también es heterogéneo según criterios dinámicos.
Originalmente se creía que todas las células madre hematopoyéticas eran iguales en sus capacidades de autorrenovación y diferenciación. Esta visión fue cuestionada por primera vez por el descubrimiento de 2002 por el grupo Muller-Sieburg en San Diego, quienes ilustraron que diferentes células madre pueden mostrar patrones de repoblación distintos que son propiedades intrínsecas predeterminadas epigenéticamente de las HSC clonales Thy-1 lo Sca-1 + lin − c-kit + . [39] [40] [41] Los resultados de estos estudios clonales llevaron a la noción de sesgo de linaje . Usando la proporción de células linfoides (L) a mieloides (M) en la sangre como un marcador cuantitativo, el compartimento de células madre se puede dividir en tres categorías de HSC. Las células madre hematopoyéticas equilibradas (Bala) repoblaron los glóbulos blancos periféricos en la misma proporción de células mieloides a linfoides que se observó en ratones no manipulados (en promedio, alrededor del 15 % de células mieloides y el 85 % de células linfoides, o 3 ≤ ρ ≤ 10). Las células madre hematopoyéticas con sesgo mieloide (My-bi) dan lugar a muy pocos linfocitos, lo que resulta en proporciones 0 < ρ < 3, mientras que las células madre hematopoyéticas con sesgo linfoide (Ly-bi) generan muy pocas células mieloides, lo que resulta en proporciones linfoides a mieloides de ρ > 10. Los tres tipos son tipos normales de HSC y no representan etapas de diferenciación. Más bien, se trata de tres clases de HSC, cada una con un programa de diferenciación fijado epigenéticamente. Estos estudios también demostraron que el sesgo de linaje no está regulado estocásticamente ni depende de diferencias en la influencia ambiental. Las células madre hematopoyéticas My-bi se autorenuevan durante más tiempo que las células madre hematopoyéticas Ly-bi equilibradas. El sesgo mieloide resulta de una menor capacidad de respuesta a la interleucina 7 (IL-7) de la linfopoyetina. [40]
Posteriormente, otros grupos confirmaron y destacaron los hallazgos originales. [42] Por ejemplo, el grupo Eaves confirmó en 2007 que la cinética de repoblación, la capacidad de autorrenovación a largo plazo y My-bi y Ly-bi son propiedades intrínsecas de las HSC heredadas de forma estable. [43] En 2010, el grupo Goodell proporcionó información adicional sobre la base molecular del sesgo de linaje en la población lateral (SP) SCA-1 + lin − c-kit + HSC. [44] Como se mostró anteriormente para la señalización de IL-7, se encontró que un miembro de la familia del factor de crecimiento transformante (TGF-beta) induce e inhibe la proliferación de HSC My-bi y Ly-bi, respectivamente.
Etimología
Del griego haimato- , forma combinada de haima 'sangre', y de la forma latinizada del griego poietikos 'capaz de hacer, creativo, productivo', de poiein 'hacer, crear'. [45]
Véase también
- Nicho de células madre hematopoyéticas
- Lista de los distintos tipos de células del cuerpo humano adulto
Referencias
- ^ Monga I, Kaur K, Dhanda S (marzo de 2022). "Revisitando la hematopoyesis: aplicaciones de la transcriptómica de células individuales y en masa que analizan la heterogeneidad transcripcional en células madre hematopoyéticas". Briefings in Functional Genomics . 21 (3): 159–176. doi :10.1093/bfgp/elac002. PMID 35265979.
- ^ ab Birbrair A, Frenette PS (abril de 2016). "Heterogeneidad de nicho en la médula ósea". Anales de la Academia de Ciencias de Nueva York . 1370 (1): 82–96. Bibcode :2016NYASA1370...82B. doi :10.1111/nyas.13016. PMC 4938003 . PMID 27015419.
- ^ ab Dzierzak E, Bigas A (mayo de 2018). "Desarrollo sanguíneo: dependencia e independencia de las células madre hematopoyéticas". Cell Stem Cell . 22 (5): 639–651. doi :10.1016/j.stem.2018.04.015. hdl : 10230/36965 . PMID 29727679.
- ^ Ottersbach K (abril de 2019). "Transición endotelial a hematopoyética: una actualización sobre el proceso de formación de sangre". Biochemical Society Transactions . 47 (2): 591–601. doi :10.1042/BST20180320. PMC 6490701 . PMID 30902922.
- ^ Till JE, McCULLOCH EA (febrero de 1961). "Una medición directa de la sensibilidad a la radiación de células normales de médula ósea de ratón". Investigación sobre radiación . 14 (2): 213–22. Bibcode :1961RadR...14..213T. doi :10.2307/3570892. hdl : 1807/2781 . JSTOR 3570892. PMID 13776896.
- ^ "5. Células madre hematopoyéticas". Información sobre células madre . Institutos Nacionales de Salud, Departamento de Salud y Servicios Humanos de los Estados Unidos. 17 de junio de 2011. Archivado desde el original el 29 de septiembre de 2015.
- ^ Müller, Albrecht M.; Huppertz, Sascha; Henschler, Reinhard (julio de 2016). "Células madre hematopoyéticas en medicina regenerativa: ¿por mal camino o en el camino correcto?". Medicina transfusional y hemoterapia . 43 (4): 247–254. doi :10.1159/000447748. ISSN 1660-3796. PMC 5040947. PMID 27721700 .
- ^ de Bruijn MF, Speck NA, Peeters MC, Dzierzak E (junio de 2000). "Las células madre hematopoyéticas definitivas se desarrollan primero dentro de las principales regiones arteriales del embrión de ratón". The EMBO Journal . 19 (11): 2465–2474. doi :10.1093/emboj/19.11.2465. PMC 212758 . PMID 10835345.
- ^ Medvinsky A, Dzierzak E (septiembre de 1996). "La hematopoyesis definitiva es iniciada de forma autónoma por la región AGM". Cell . 86 (6): 897–906. doi :10.1016/s0092-8674(00)80165-8. hdl : 1765/57137 . PMID 8808625. S2CID 3330712.
- ^ Ivanovs A, Rybtsov S, Welch L, Anderson RA, Turner ML, Medvinsky A (noviembre de 2011). "Las células madre hematopoyéticas humanas altamente potentes emergen por primera vez en la región intraembrionaria aorta-gónada-mesonefros". The Journal of Experimental Medicine . 208 (12): 2417–2427. doi :10.1084/jem.20111688. PMC 3256972 . PMID 22042975.
- ^ ab Dzierzak E, Speck NA (febrero de 2008). "De linaje y legado: el desarrollo de células madre hematopoyéticas de mamíferos". Nature Immunology . 9 (2): 129–136. doi :10.1038/ni1560. PMC 2696344 . PMID 18204427.
- ^ "Proceso de trasplante de médula ósea". Mayo Clinic . Consultado el 18 de marzo de 2015 .
- ^ ab Mahla RS (2016). "Aplicaciones de células madre en medicina regenerativa y terapias de enfermedades". Revista internacional de biología celular . 2016 (7): 6940283. doi : 10.1155/2016/6940283 . PMC 4969512. PMID 27516776 .
- ^ Srikanth L, Sunitha MM, Venkatesh K, Kumar PS, Chandrasekhar C, Vengamma B, Sarma PV (2015). "La glucólisis anaeróbica y la expresión de HIF1α en células madre hematopoyéticas explican su naturaleza inactiva". Journal of Stem Cells . 10 (2): 97–106. PMID 27125138.
- ^ ab Baumgartner C, Toifl S, Farlik M, Halbritter F, Scheicher R, Fischer I, et al. (junio de 2018). "Un mecanismo de retroalimentación dependiente de ERK previene el agotamiento de las células madre hematopoyéticas". Cell Stem Cell . 22 (6): 879–892.e6. doi :10.1016/j.stem.2018.05.003. PMC 5988582 . PMID 29804890.
- ^ ab Felfly H, Haddad GG (2014). "Células madre hematopoyéticas: nuevas aplicaciones potenciales para la medicina traslacional". Journal of Stem Cells . 9 (3): 163–197. PMID 25157450.
- ^ abcd Park B, Yoo KH, Kim C (diciembre de 2015). "Expansión y generación de células madre hematopoyéticas: las formas de lograr un avance". Blood Research . 50 (4): 194–203. doi :10.5045/br.2015.50.4.194. PMC 4705045 . PMID 26770947.
- ^ "5. Células madre hematopoyéticas – stemcells.nih.gov". stemcells.nih.gov . Archivado desde el original el 2021-05-01 . Consultado el 2018-01-18 .
- ^ Tyndall A, Fassas A, Passweg J, Ruiz de Elvira C, Attal M, Brooks P, et al. (octubre de 1999). "Trasplantes autólogos de células madre hematopoyéticas para enfermedades autoinmunes: viabilidad y mortalidad relacionada con el trasplante. Grupos de trabajo sobre enfermedades autoinmunes y linfomas del Grupo europeo de trasplante de sangre y médula ósea, la Liga Europea contra el Reumatismo y el Proyecto internacional de células madre para enfermedades autoinmunes". Trasplante de médula ósea . 24 (7): 729–734. doi : 10.1038/sj.bmt.1701987 . PMID 10516675.
- ^ Burt RK, Loh Y, Pearce W, Beohar N, Barr WG, Craig R, et al. (febrero de 2008). "Aplicaciones clínicas de células madre derivadas de la sangre y de la médula ósea para enfermedades no malignas". JAMA . 299 (8): 925–936. doi : 10.1001/jama.299.8.925 . PMID 18314435.
- ^ El-Sobky TA, El-Haddad A, Elsobky E, Elsayed SM, Sakr HM (marzo de 2017). "Reversión de la patología radiográfica esquelética en un caso de osteopetrosis infantil maligna después del trasplante de células madre hematopoyéticas". The Egyptian Journal of Radiology and Nuclear Medicine . 48 (1): 237–243. doi : 10.1016/j.ejrnm.2016.12.013 .
- ^ Hashemi Taheri AP, Radmard AR, Kooraki S, Behfar M, Pak N, Hamidieh AA, Ghavamzadeh A (septiembre de 2015). "Resolución radiológica de los cambios esqueléticos de la osteopetrosis infantil maligna después del trasplante de células madre hematopoyéticas". Pediatric Blood & Cancer . 62 (9): 1645–1649. doi :10.1002/pbc.25524. PMID 25820806. S2CID 11287381.
- ^ Langereis EJ, den Os MM, Breen C, Jones SA, Knaven OC, Mercer J, et al. (marzo de 2016). "Progresión de la displasia de cadera en la mucopolisacaridosis tipo I de Hurler después de un trasplante exitoso de células madre hematopoyéticas". The Journal of Bone and Joint Surgery. American Volumen . 98 (5): 386–395. doi :10.2106/JBJS.O.00601. PMID 26935461.
- ^ Müller, Albrecht M.; Huppertz, Sascha; Henschler, Reinhard (26 de julio de 2016). "Células madre hematopoyéticas en medicina regenerativa: ¿por mal camino o en el camino correcto?". Medicina transfusional y hemoterapia . 43 (4): 247–254. doi :10.1159/000447748. ISSN 1660-3796. PMC 5040947. PMID 27721700 .
- ^ ab Beerman I, Seita J, Inlay MA, Weissman IL, Rossi DJ (julio de 2014). "Las células madre hematopoyéticas quiescentes acumulan daño en el ADN durante el envejecimiento que se repara al entrar en el ciclo celular". Cell Stem Cell . 15 (1): 37–50. doi :10.1016/j.stem.2014.04.016. PMC 4082747 . PMID 24813857.
- ^ ab Nijnik A, Woodbine L, Marchetti C, Dawson S, Lambe T, Liu C, et al. (junio de 2007). "La reparación del ADN es limitante para las células madre hematopoyéticas durante el envejecimiento". Nature . 447 (7145): 686–690. Bibcode :2007Natur.447..686N. doi :10.1038/nature05875. PMID 17554302. S2CID 4332976.
- ^ Tilgner K, Neganova I, Moreno-Gimeno I, Al-Aama JY, Burks D, Yung S, et al. (agosto de 2013). "Un modelo de iPSC humano de deficiencia de Ligasa IV revela un papel importante para la reparación de DSB mediada por NHEJ en la supervivencia y estabilidad genómica de células madre pluripotentes inducidas y progenitores hematopoyéticos emergentes". Muerte celular y diferenciación . 20 (8): 1089–1100. doi :10.1038/cdd.2013.44. PMC 3705601 . PMID 23722522.
- ^ Lucas D, Escudero B, Ligos JM, Segovia JC, Estrada JC, Terrados G, et al. (febrero de 2009). "La hematopoyesis alterada en ratones que carecen de la ADN polimerasa mu se debe a una reparación ineficiente de roturas de doble cadena". PLOS Genetics . 5 (2): e1000389. doi : 10.1371/journal.pgen.1000389 . PMC 2638008 . PMID 19229323.
- ^ Avagyan S, Churchill M, Yamamoto K, Crowe JL, Li C, Lee BJ, et al. (septiembre de 2014). "La disfunción de las células madre hematopoyéticas subyace a la linfocitopenia progresiva en la deficiencia de XLF/Cernunnos". Blood . 124 (10): 1622–1625. doi :10.1182/blood-2014-05-574863. PMC 4155271 . PMID 25075129.
- ^ ab Tilgner K, Neganova I, Singhapol C, Saretzki G, Al-Aama JY, Evans J, et al. (septiembre de 2013). "Informe breve: un modelo de células madre pluripotentes inducidas humanas de deficiencia de cernunnos revela un papel importante para XLF en la supervivencia de los progenitores hematopoyéticos primitivos". Células madre . 31 (9): 2015–2023. doi : 10.1002/stem.1456 . PMID 23818183. S2CID 3623309.
- ^ Rossi DJ, Bryder D, Seita J, Nussenzweig A, Hoeijmakers J, Weissman IL (junio de 2007). "Las deficiencias en la reparación del daño del ADN limitan la función de las células madre hematopoyéticas con la edad". Nature . 447 (7145): 725–729. Bibcode :2007Natur.447..725R. doi :10.1038/nature05862. PMID 17554309. S2CID 4416445.
- ^ "Una investigación podría revelar por qué las personas pueden volverse frágiles repentinamente a los 70 años". The Guardian . 1 de junio de 2022 . Consultado el 18 de julio de 2022 .
- ^ Mitchell, Emily; Spencer Chapman, Michael; Williams, Nicholas; Dawson, Kevin J.; Mende, Nicole; Calderbank, Emily F.; Jung, Hyunchul; Mitchell, Thomas; Coorens, Tim HH; Spencer, David H.; Machado, Heather; Lee-Six, Henry; Davies, Megan; Hayler, Daniel; Fabre, Margarete A.; Mahbubani, Krishnaa; Abascal, Federico; Cagan, Alex; Vassiliou, George S.; Baxter, Joanna; Martincorena, Inigo; Stratton, Michael R.; Kent, David G.; Chatterjee, Krishna; Parsy, Kourosh Saeb; Green, Anthony R.; Nangalia, Jyoti; Laurenti, Elisa; Campbell, Peter J. (junio de 2022). "Dinámica clonal de la hematopoyesis a lo largo de la vida humana". Naturaleza . 606 (7913): 343–350. Código Bibliográfico :2022Natur.606..343M. doi :10.1038/s41586-022-04786-y. ISSN 1476-4687. PMC 9177428 . PMID 35650442.
- ^ Cho, Rebecca H; Sieburg, Hans B; Muller-Sieburg, Christa E (2008). "Un nuevo mecanismo para el envejecimiento de las células madre hematopoyéticas: el envejecimiento cambia la composición clonal del compartimento de células madre pero no las células madre individuales". Blood . 111 (12): 5553–5561. doi :10.1182/blood-2007-11-123547. PMC 2424153 . PMID 18413859.
- ^ Llamas, Sara; García-Pérez, Eva; Meana, Álvaro; Larcher, Fernando; del Río, Marcela (2015). "Acciones y aplicaciones de las células de la capa alimentadora". Tissue Eng Parte B Rev. 21 (4): 345–353. doi :10.1089/ten.teb.2014.0547. PMC 4533020 . PMID 25659081.
- ^ Burger JA, Spoo A, Dwenger A, Burger M, Behringer D (agosto de 2003). "Los receptores de quimiocina CXCR4 (CD184) y las integrinas alfa4beta1 median la migración espontánea de progenitores humanos CD34+ y células de leucemia mieloide aguda debajo de las células del estroma de la médula ósea (pseudoemperipolesis)". British Journal of Haematology . 122 (4): 579–89. doi : 10.1046/j.1365-2141.2003.04466.x . PMID 12899713. S2CID 8764752.
- ^ Sieburg HB, Müller-Sieburg CE (2004). "Clasificación de cinéticas cortas por forma". In Silico Biology . 4 (2): 209–17. PMID 15107024.
- ^ Challen, Grant A.; Boles, Nathan; Lin, Kuan-Yin K.; Goodell, Margaret A. (enero de 2009). "Identificación y análisis de células madre hematopoyéticas de ratón". Cytometry Part A . 75A (1): 14–24. doi :10.1002/cyto.a.20674. PMC 2640229 . PMID 19023891.
- ^ Müller-Sieburg CE, Cho RH, Thoman M, Adkins B, Sieburg HB (agosto de 2002). "Regulación determinista de la autorrenovación y diferenciación de células madre hematopoyéticas". Blood . 100 (4): 1302–9. doi : 10.1182/blood.V100.4.1302.h81602001302_1302_1309 . PMID 12149211.
- ^ ab Muller-Sieburg CE, Cho RH, Karlsson L, Huang JF, Sieburg HB (junio de 2004). "Las células madre hematopoyéticas con sesgo mieloide tienen una amplia capacidad de autorrenovación pero generan una progenie linfoide disminuida con una respuesta a IL-7 deteriorada". Blood . 103 (11): 4111–8. doi : 10.1182/blood-2003-10-3448 . PMID 14976059.
- ^ Sieburg HB, Cho RH, Dykstra B, Uchida N, Eaves CJ, Muller-Sieburg CE (marzo de 2006). "El compartimento de células madre hematopoyéticas consta de un número limitado de subconjuntos discretos de células madre". Blood . 107 (6): 2311–6. doi :10.1182/blood-2005-07-2970. PMC 1456063 . PMID 16291588.
- ^ Schroeder T (marzo de 2010). "Heterogeneidad de células madre hematopoyéticas: subtipos, no comportamiento impredecible". Cell Stem Cell . 6 (3): 203–7. doi : 10.1016/j.stem.2010.02.006 . PMID 20207223.
- ^ Dykstra B, Kent D, Bowie M, McCaffrey L, Hamilton M, Lyons K, et al. (agosto de 2007). "Propagación a largo plazo de distintos programas de diferenciación hematopoyética in vivo". Cell Stem Cell . 1 (2): 218–29. doi : 10.1016/j.stem.2007.05.015 . PMID 18371352.
- ^ Challen GA, Boles NC, Chambers SM, Goodell MA (marzo de 2010). "Los distintos subtipos de células madre hematopoyéticas están regulados de forma diferencial por TGF-beta1". Cell Stem Cell . 6 (3): 265–78. doi :10.1016/j.stem.2010.02.002. PMC 2837284 . PMID 20207229.
- ^ Flexner SB, Hauck LC, eds. (1993). Random House Unabridged Dictionary (2.ª ed.). Nueva York: Random House. pág. 890. ISBN 0-679-42917-4.
Enlaces externos
- Hoja informativa sobre las células madre sanguíneas en EuroStemCell

