Axón
| Axón | |
|---|---|
 Un axón de una neurona multipolar | |
| Identificadores | |
| Malla | D001369 |
| FMA | 67308 |
| Terminología anatómica [editar en Wikidata] | |
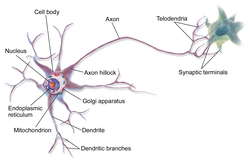
Un axón (del griego ἄξων áxōn , eje) o fibra nerviosa (o fibra nerviosa : ver diferencias ortográficas ) es una proyección larga y delgada de una célula nerviosa, o neurona , en vertebrados , que típicamente conduce impulsos eléctricos conocidos como potenciales de acción fuera del cuerpo de la célula nerviosa . La función del axón es transmitir información a diferentes neuronas, músculos y glándulas. En ciertas neuronas sensoriales ( neuronas pseudounipolares ), como las del tacto y el calor, los axones se denominan fibras nerviosas aferentes y el impulso eléctrico viaja a lo largo de ellas desde la periferia hasta el cuerpo celular y desde el cuerpo celular hasta la médula espinal a lo largo de otra rama del mismo axón. La disfunción axonal puede ser la causa de muchos trastornos neurológicos hereditarios y adquiridos que afectan tanto a las neuronas periféricas como a las centrales . Las fibras nerviosas se clasifican en tres tipos: fibras nerviosas del grupo A , fibras nerviosas del grupo B y fibras nerviosas del grupo C. Los grupos A y B son mielinizados , y el grupo C no lo es. Estos grupos incluyen tanto fibras sensoriales como fibras motoras. Otra clasificación agrupa solo las fibras sensoriales como Tipo I, Tipo II, Tipo III y Tipo IV.
Un axón es uno de los dos tipos de protuberancias citoplasmáticas del cuerpo celular de una neurona; el otro tipo es una dendrita . Los axones se distinguen de las dendritas por varias características, incluida la forma (las dendritas a menudo se estrechan mientras que los axones generalmente mantienen un radio constante), la longitud (las dendritas están restringidas a una pequeña región alrededor del cuerpo celular mientras que los axones pueden ser mucho más largos) y la función (las dendritas reciben señales mientras que los axones las transmiten). Algunos tipos de neuronas no tienen axón y transmiten señales desde sus dendritas. En algunas especies, los axones pueden emanar de dendritas conocidas como dendritas portadoras de axones. [1] Ninguna neurona tiene más de un axón; sin embargo, en invertebrados como los insectos o las sanguijuelas, el axón a veces consta de varias regiones que funcionan más o menos independientemente unas de otras. [2]
Los axones están cubiertos por una membrana conocida como axolema ; el citoplasma de un axón se llama axoplasma . La mayoría de los axones se ramifican, en algunos casos muy profusamente. Las ramas finales de un axón se llaman telodendrias . El extremo hinchado de un telodendro se conoce como terminal axónica o pie terminal, que se une a la dendrita o cuerpo celular de otra neurona formando una conexión sináptica . Los axones generalmente hacen contacto con otras neuronas en uniones llamadas sinapsis , pero también pueden hacer contacto con células musculares o glandulares. En algunas circunstancias, el axón de una neurona puede formar una sinapsis con las dendritas de la misma neurona, lo que resulta en una autapsis . En una sinapsis, la membrana del axón se une estrechamente a la membrana de la célula diana, y estructuras moleculares especiales sirven para transmitir señales eléctricas o electroquímicas a través del espacio. Algunas uniones sinápticas aparecen a lo largo de un axón a medida que se extiende; Estos se llaman botones en passant ("botones de paso") y pueden estar en cientos o incluso miles a lo largo de un axón. [3] Otras sinapsis aparecen como terminales en los extremos de las ramas axónicas.
Un único axón, con todas sus ramificaciones juntas, puede dirigirse a varias partes del cerebro y generar miles de terminales sinápticas. Un haz de axones forma un tracto nervioso en el sistema nervioso central [ 4] y un fascículo en el sistema nervioso periférico . En los mamíferos placentarios, el tracto de materia blanca más grande del cerebro es el cuerpo calloso , formado por unos 200 millones de axones en el cerebro humano [4] .
Anatomía

Los axones son las líneas de transmisión primarias del sistema nervioso y, como haces, forman nervios . Algunos axones pueden extenderse hasta un metro o más, mientras que otros se extienden tan solo un milímetro. Los axones más largos del cuerpo humano son los del nervio ciático , que van desde la base de la médula espinal hasta el dedo gordo de cada pie. El diámetro de los axones también es variable. La mayoría de los axones individuales tienen un diámetro microscópico (normalmente alrededor de un micrómetro (μm) de ancho). Los axones de mamíferos más grandes pueden alcanzar un diámetro de hasta 20 μm. El axón gigante del calamar , que está especializado en conducir señales muy rápidamente, tiene cerca de 1 milímetro de diámetro, el tamaño de una mina de lápiz pequeña. La cantidad de telodendrias axónicas (las estructuras ramificadas en el extremo del axón) también puede diferir de una fibra nerviosa a la siguiente. Los axones del sistema nervioso central (SNC) suelen presentar múltiples telodendrias, con muchos puntos terminales sinápticos. En comparación, el axón de la célula granular cerebelosa se caracteriza por un único nodo de ramificación en forma de T desde el que se extienden dos fibras paralelas . La elaborada ramificación permite la transmisión simultánea de mensajes a una gran cantidad de neuronas objetivo dentro de una única región del cerebro.
Existen dos tipos de axones en el sistema nervioso: axones mielinizados y amielinizados . [5] La mielina es una capa de una sustancia grasa aislante, que está formada por dos tipos de células gliales : células de Schwann y oligodendrocitos . En el sistema nervioso periférico, las células de Schwann forman la vaina de mielina de un axón mielinizado. Los oligodendrocitos forman la mielina aislante en el SNC. A lo largo de las fibras nerviosas mielinizadas, se producen huecos en la vaina de mielina conocidos como nódulos de Ranvier a intervalos uniformemente espaciados. La mielinización permite un modo especialmente rápido de propagación del impulso eléctrico llamado conducción saltatoria .
Los axones mielinizados de las neuronas corticales forman la mayor parte del tejido neuronal llamado materia blanca en el cerebro. La mielina le da el aspecto blanco al tejido en contraste con la materia gris de la corteza cerebral que contiene los cuerpos celulares neuronales. Una disposición similar se ve en el cerebelo . Los haces de axones mielinizados forman los tractos nerviosos en el SNC. Donde estos tractos cruzan la línea media del cerebro para conectar regiones opuestas se llaman comisuras . El más grande de ellos es el cuerpo calloso que conecta los dos hemisferios cerebrales , y tiene alrededor de 20 millones de axones. [4]
Se considera que la estructura de una neurona consta de dos regiones o compartimentos funcionales separados: el cuerpo celular junto con las dendritas como una región y la región axonal como la otra.
Región axonal
La región o compartimento axonal incluye el cono axónico, el segmento inicial, el resto del axón, las telodendrias y las terminales axónicas. También incluye la vaina de mielina. Los cuerpos de Nissl que producen las proteínas neuronales están ausentes en la región axonal. [3] Las proteínas necesarias para el crecimiento del axón y la eliminación de materiales de desecho necesitan un marco para el transporte. Este transporte axonal se realiza en el axoplasma mediante disposiciones de microtúbulos y filamentos intermedios de tipo IV conocidos como neurofilamentos .
Cono axónico

El cono axónico es la zona que se forma a partir del cuerpo celular de la neurona a medida que se extiende hasta convertirse en el axón. Precede al segmento inicial. Los potenciales de acción recibidos que se suman en la neurona se transmiten al cono axónico para la generación de un potencial de acción a partir del segmento inicial.
Segmento inicial axonal
El segmento inicial axonal (SIA) es un microdominio estructural y funcionalmente separado del axón. [6] [7] Una función del segmento inicial es separar la parte principal de un axón del resto de la neurona; otra función es ayudar a iniciar potenciales de acción. [8] Ambas funciones respaldan la polaridad celular neuronal , en la que las dendritas (y, en algunos casos, el soma ) de una neurona reciben señales de entrada en la región basal, y en la región apical el axón de la neurona proporciona señales de salida. [9]
El segmento inicial del axón no está mielinizado y contiene un complejo especializado de proteínas. Tiene una longitud de entre 20 y 60 μm y funciona como el sitio de inicio del potencial de acción. [10] [11] Tanto la posición en el axón como la longitud del AIS pueden cambiar, lo que muestra un grado de plasticidad que puede ajustar la salida neuronal. [10] [12] Un AIS más largo se asocia con una mayor excitabilidad. [12] La plasticidad también se observa en la capacidad del AIS de cambiar su distribución y mantener la actividad de los circuitos neuronales a un nivel constante. [13]
El AIS está altamente especializado para la conducción rápida de impulsos nerviosos . Esto se logra mediante una alta concentración de canales de sodio dependientes de voltaje en el segmento inicial donde se inicia el potencial de acción. [13] Los canales iónicos están acompañados por una gran cantidad de moléculas de adhesión celular y proteínas de andamiaje que los anclan al citoesqueleto. [10] Las interacciones con anquirina-G son importantes ya que es el principal organizador en el AIS. [10]
Transporte axonal
El axoplasma es el equivalente del citoplasma en la célula. Los microtúbulos se forman en el axoplasma en el cono axónico. Están dispuestos a lo largo de la longitud del axón, en secciones superpuestas, y todos apuntan en la misma dirección: hacia las terminales del axón. [14] Esto se nota por las terminaciones positivas de los microtúbulos. Esta disposición superpuesta proporciona las rutas para el transporte de diferentes materiales desde el cuerpo celular. [14] Los estudios sobre el axoplasma han demostrado el movimiento de numerosas vesículas de todos los tamaños a lo largo de los filamentos del citoesqueleto (los microtúbulos y los neurofilamentos ) en ambas direcciones entre el axón y sus terminales y el cuerpo celular.
El transporte anterógrado saliente desde el cuerpo celular a lo largo del axón lleva mitocondrias y proteínas de membrana necesarias para el crecimiento hasta la terminal del axón. El transporte retrógrado entrante lleva materiales de desecho celular desde la terminal del axón hasta el cuerpo celular. [15] Las vías de entrada y salida utilizan diferentes conjuntos de proteínas motoras . [14] El transporte saliente lo proporciona la kinesina y el tráfico de retorno entrante lo proporciona la dineína . La dineína está dirigida al extremo negativo. [15] Hay muchas formas de proteínas motoras de kinesina y dineína, y se cree que cada una lleva una carga diferente. [14] Los estudios sobre el transporte en el axón llevaron al nombre de la kinesina. [14]
Mielinización


En el sistema nervioso, los axones pueden ser mielinizados o no mielinizados. Esto se debe a que poseen una capa aislante, llamada vaina de mielina. La membrana de mielina es única por su proporción relativamente alta de lípidos a proteínas. [16]
En el sistema nervioso periférico, los axones están mielinizados por células gliales conocidas como células de Schwann . En el sistema nervioso central, la vaina de mielina está proporcionada por otro tipo de célula glial, el oligodendrocito . Las células de Schwann mielinizan un solo axón. Un oligodendrocito puede mielinizar hasta 50 axones. [17]
La composición de la mielina es diferente en ambos tipos. En el SNC, la proteína principal de la mielina es la proteína proteolipídica , y en el SNP es la proteína básica de la mielina .
Nodos de Ranvier
Los nódulos de Ranvier (también conocidos como huecos de la vaina de mielina ) son segmentos cortos no mielinizados de un axón mielinizado , que se encuentran periódicamente intercalados entre segmentos de la vaina de mielina. Por lo tanto, en el punto del nódulo de Ranvier, el axón se reduce en diámetro. [18] Estos nódulos son áreas donde se pueden generar potenciales de acción. En la conducción saltatoria , las corrientes eléctricas producidas en cada nódulo de Ranvier se conducen con poca atenuación al siguiente nódulo en la línea, donde permanecen lo suficientemente fuertes como para generar otro potencial de acción. Por lo tanto, en un axón mielinizado, los potenciales de acción efectivamente "saltan" de nódulo a nódulo, evitando los tramos mielinizados intermedios, lo que resulta en una velocidad de propagación mucho más rápida que incluso la que puede sostener el axón no mielinizado más rápido.
Terminales axónicas
Un axón puede dividirse en muchas ramas llamadas telodendrias (del griego "extremo del árbol"). Al final de cada telodendro hay una terminal axónica (también llamada botón terminal o botón sináptico, o pie terminal). [19] Las terminales axónicas contienen vesículas sinápticas que almacenan el neurotransmisor para su liberación en la sinapsis . Esto hace posible múltiples conexiones sinápticas con otras neuronas. A veces, el axón de una neurona puede hacer sinapsis con las dendritas de la misma neurona, cuando se conoce como autapsis . Algunas uniones sinápticas aparecen a lo largo de la longitud de un axón a medida que se extiende; estas se llaman botones en passant ("botones de paso") y pueden estar en los cientos o incluso los miles a lo largo de un axón. [3]
Varicosidades axónicas
En el cerebro normalmente desarrollado, a lo largo del eje de algunos axones se encuentran botones presinápticos también conocidos como varicosidades axónicas y se han encontrado en regiones del hipocampo que funcionan en la liberación de neurotransmisores. [20] Sin embargo, las varicosidades axónicas también están presentes en enfermedades neurodegenerativas donde interfieren con la conducción de un potencial de acción. Las varicosidades axónicas también son el sello distintivo de las lesiones cerebrales traumáticas . [20] [21] El daño axonal generalmente se produce en el citoesqueleto del axón, lo que interrumpe el transporte. Como consecuencia, las acumulaciones de proteínas, como la proteína precursora beta amiloide, pueden acumularse en una hinchazón que da como resultado una serie de varicosidades a lo largo del axón. [20] [21]
Potenciales de acción


La mayoría de los axones transmiten señales en forma de potenciales de acción, que son impulsos electroquímicos discretos que viajan rápidamente a lo largo de un axón, comenzando en el cuerpo celular y terminando en puntos donde el axón hace contacto sináptico con las células diana. La característica definitoria de un potencial de acción es que es "todo o nada": cada potencial de acción que genera un axón tiene esencialmente el mismo tamaño y forma. Esta característica de todo o nada permite que los potenciales de acción se transmitan de un extremo de un axón largo al otro sin ninguna reducción de tamaño. Sin embargo, existen algunos tipos de neuronas con axones cortos que transmiten señales electroquímicas graduadas, de amplitud variable.
Cuando un potencial de acción alcanza una terminal presináptica, activa el proceso de transmisión sináptica. El primer paso es la apertura rápida de los canales de iones de calcio en la membrana del axón, lo que permite que los iones de calcio fluyan hacia el interior a través de la membrana. El aumento resultante en la concentración intracelular de calcio hace que las vesículas sinápticas (pequeños contenedores encerrados por una membrana lipídica) llenas de una sustancia química neurotransmisora se fusionen con la membrana del axón y vacíen su contenido en el espacio extracelular. El neurotransmisor se libera del nervio presináptico a través de la exocitosis . A continuación, la sustancia química neurotransmisora se difunde a través de los receptores ubicados en la membrana de la célula diana. El neurotransmisor se une a estos receptores y los activa. Dependiendo del tipo de receptores que se activan, el efecto sobre la célula diana puede ser excitarla, inhibirla o alterar su metabolismo de alguna manera. Esta secuencia completa de eventos a menudo tiene lugar en menos de una milésima de segundo. Posteriormente, dentro de la terminal presináptica, un nuevo conjunto de vesículas se desplaza a su posición junto a la membrana, listas para ser liberadas cuando llegue el siguiente potencial de acción. El potencial de acción es el paso eléctrico final en la integración de los mensajes sinápticos a escala de la neurona. [5]
Se han demostrado registros extracelulares de propagación de potenciales de acción en axones en animales que se mueven libremente. Si bien los potenciales de acción somáticos extracelulares se han utilizado para estudiar la actividad celular en animales que se mueven libremente, como las células de lugar , también se puede registrar la actividad axonal en la materia blanca y gris . Los registros extracelulares de propagación de potenciales de acción axónica se diferencian de los potenciales de acción somáticos de tres maneras: 1. La señal tiene una duración pico-valle más corta (~150 μs) que la de las células piramidales (~500 μs) o las interneuronas (~250 μs). 2. El cambio de voltaje es trifásico. 3. La actividad registrada en un tetrodo se ve solo en uno de los cuatro cables de registro. En registros de ratas que se mueven libremente, se han aislado señales axónicas en tractos de materia blanca, incluidos los alvéolos y el cuerpo calloso, así como la materia gris del hipocampo. [22]
De hecho, la generación de potenciales de acción in vivo es de naturaleza secuencial, y estos picos secuenciales constituyen los códigos digitales en las neuronas. Aunque estudios previos indican un origen axonal de un único pico evocado por pulsos de corta duración, las señales fisiológicas in vivo desencadenan la iniciación de picos secuenciales en los cuerpos celulares de las neuronas. [23] [24]
Además de propagar potenciales de acción a las terminales axónicas, el axón es capaz de amplificar los potenciales de acción, lo que garantiza una propagación segura de potenciales de acción secuenciales hacia la terminal axónica. En términos de mecanismos moleculares, los canales de sodio dependientes del voltaje en los axones poseen un umbral más bajo y un período refractario más corto en respuesta a pulsos de corta duración. [25]
Desarrollo y crecimiento
Desarrollo
El desarrollo del axón hasta su objetivo es una de las seis etapas principales del desarrollo general del sistema nervioso . [26] Los estudios realizados en neuronas hipocampales cultivadas sugieren que las neuronas producen inicialmente múltiples neuritas que son equivalentes, pero solo una de estas neuritas está destinada a convertirse en el axón. [27] No está claro si la especificación del axón precede a la elongación del axón o viceversa, [28] aunque la evidencia reciente apunta a esto último. Si se corta un axón que no está completamente desarrollado, la polaridad puede cambiar y otras neuritas pueden potencialmente convertirse en el axón. Esta alteración de la polaridad solo ocurre cuando el axón se corta al menos 10 μm más corto que las otras neuritas. Después de realizar la incisión, la neurita más larga se convertirá en el futuro axón y todas las demás neuritas, incluido el axón original, se convertirán en dendritas. [29] Imponer una fuerza externa sobre una neurita, provocando su alargue, hará que se convierta en un axón. [30] No obstante, el desarrollo axonal se logra a través de una interacción compleja entre la señalización extracelular, la señalización intracelular y la dinámica del citoesqueleto .
Señalización extracelular
Las señales extracelulares que se propagan a través de la matriz extracelular que rodea a las neuronas desempeñan un papel destacado en el desarrollo axonal. [31] Estas moléculas de señalización incluyen proteínas, factores neurotróficos y moléculas de adhesión y de la matriz extracelular. La netrina (también conocida como UNC-6), una proteína secretada, funciona en la formación de axones. Cuando el receptor de netrina UNC-5 está mutado, varias neuritas se proyectan irregularmente fuera de las neuronas y finalmente un solo axón se extiende anteriormente. [32] [33] [34] [35] Los factores neurotróficos: factor de crecimiento nervioso (NGF), factor neurotrófico derivado del cerebro (BDNF) y neurotrofina-3 (NTF3) también están involucrados en el desarrollo de axones y se unen a los receptores Trk . [36]
La enzima convertidora de gangliósidos gangliósido de membrana plasmática sialidasa (PMGS), que está involucrada en la activación de TrkA en la punta de los neutritos, es necesaria para la elongación de los axones. PMGS se distribuye asimétricamente hacia la punta de la neurita que está destinada a convertirse en el futuro axón. [37]
Señalización intracelular
Durante el desarrollo axonal, la actividad de PI3K aumenta en la punta del axón de destino. La interrupción de la actividad de PI3K inhibe el desarrollo axonal. La activación de PI3K da como resultado la producción de fosfatidilinositol (3,4,5)-trifosfato (PtdIns), que puede causar una elongación significativa de una neurita, convirtiéndola en un axón. Como tal, la sobreexpresión de las fosfatasas que desfosforilan PtdIns conduce a la falla de la polarización. [31]
Dinámica del citoesqueleto
La neurita con el menor contenido de filamentos de actina se convertirá en el axón. La concentración de PGMS y el contenido de f-actina están inversamente correlacionados; cuando el PGMS se enriquece en la punta de una neurita, su contenido de f-actina disminuye sustancialmente. [37] Además, la exposición a fármacos despolimerizantes de actina y a la toxina B (que inactiva la señalización Rho ) provoca la formación de múltiples axones. En consecuencia, la interrupción de la red de actina en un cono de crecimiento promoverá que su neurita se convierta en el axón. [38]
Crecimiento

Los axones en crecimiento se mueven a través de su entorno a través del cono de crecimiento , que se encuentra en la punta del axón. El cono de crecimiento tiene una amplia extensión similar a una lámina llamada lamelipodio que contiene protuberancias llamadas filopodios . Los filopodios son el mecanismo por el cual todo el proceso se adhiere a las superficies y explora el entorno circundante. La actina juega un papel importante en la movilidad de este sistema. Los entornos con altos niveles de moléculas de adhesión celular (CAM) crean un entorno ideal para el crecimiento axonal. Esto parece proporcionar una superficie "pegajosa" para que los axones crezcan a lo largo. Los ejemplos de CAM específicos de los sistemas neuronales incluyen N-CAM , TAG-1 , una glucoproteína axonal [39] , y MAG , todas las cuales son parte de la superfamilia de inmunoglobulinas . Otro conjunto de moléculas llamadas moléculas de adhesión a la matriz extracelular también proporcionan un sustrato pegajoso para que los axones crezcan a lo largo. Ejemplos de estas moléculas incluyen laminina , fibronectina , tenascina y perlecano . Algunos de ellos se unen a la superficie de las células y, por lo tanto, actúan como atrayentes o repelentes de corto alcance. Otros son ligandos difundibles y, por lo tanto, pueden tener efectos de largo alcance.
Las células llamadas células guía ayudan a guiar el crecimiento del axón neuronal. Estas células que ayudan a guiar el axón suelen ser otras neuronas que a veces son inmaduras. Cuando el axón ha completado su crecimiento en su conexión con el objetivo, el diámetro del axón puede aumentar hasta cinco veces, dependiendo de la velocidad de conducción requerida. [40]
También se ha descubierto mediante investigaciones que si los axones de una neurona estuvieran dañados, siempre que el soma (el cuerpo celular de una neurona) no esté dañado, los axones se regenerarían y rehacerían las conexiones sinápticas con las neuronas con la ayuda de células guía . Esto también se conoce como neuroregeneración . [41]
Nogo-A es un tipo de componente inhibidor del crecimiento de neuritas que está presente en las membranas de mielina del sistema nervioso central (que se encuentran en los axones). Tiene un papel crucial en la restricción de la regeneración axonal en el sistema nervioso central de los mamíferos adultos. En estudios recientes, si se bloquea y neutraliza Nogo-A, es posible inducir la regeneración axonal a larga distancia, lo que conduce a una mejora de la recuperación funcional en la médula espinal de ratas y ratones. Esto aún no se ha hecho en humanos. [42] Un estudio reciente también ha descubierto que los macrófagos activados a través de una vía inflamatoria específica activada por el receptor Dectin-1 son capaces de promover la recuperación axonal, pero también causan neurotoxicidad en la neurona. [43]
Regulación de longitud
Los axones varían en gran medida en longitud desde unos pocos micrómetros hasta metros en algunos animales. Esto enfatiza que debe haber un mecanismo de regulación de longitud celular que permita a las neuronas detectar la longitud de sus axones y controlar su crecimiento en consecuencia. Se descubrió que las proteínas motoras juegan un papel importante en la regulación de la longitud de los axones. [44] Basándose en esta observación, los investigadores desarrollaron un modelo explícito para el crecimiento axonal que describe cómo las proteínas motoras podrían afectar la longitud del axón a nivel molecular. [45] [46] [47] [48] Estos estudios sugieren que las proteínas motoras transportan moléculas de señalización desde el soma hasta el cono de crecimiento y viceversa, cuya concentración oscila en el tiempo con una frecuencia dependiente de la longitud.
Clasificación
Los axones de las neuronas del sistema nervioso periférico humano pueden clasificarse en función de sus características físicas y propiedades de conducción de señales. Se sabía que los axones tenían diferentes grosores (de 0,1 a 20 μm) [3] y se pensaba que estas diferencias estaban relacionadas con la velocidad a la que un potencial de acción podía viajar a lo largo del axón: su velocidad de conductancia . Erlanger y Gasser demostraron esta hipótesis e identificaron varios tipos de fibras nerviosas, estableciendo una relación entre el diámetro de un axón y su velocidad de conducción nerviosa. Publicaron sus hallazgos en 1941 y dieron la primera clasificación de los axones.
Los axones se clasifican en dos sistemas. El primero introducido por Erlanger y Gasser, agrupó las fibras en tres grupos principales utilizando las letras A, B y C. Estos grupos, grupo A , grupo B y grupo C incluyen tanto las fibras sensoriales ( aferentes ) como las fibras motoras ( eferentes ). El primer grupo A, se subdividió en fibras alfa, beta, gamma y delta: Aα, Aβ, Aγ y Aδ. Las neuronas motoras de las diferentes fibras motoras fueron las neuronas motoras inferiores : neurona motora alfa , neurona motora beta y neurona motora gamma que tienen las fibras nerviosas Aα, Aβ y Aγ, respectivamente.
Los hallazgos posteriores de otros investigadores identificaron dos grupos de fibras Aa que eran fibras sensoriales. Luego, se introdujeron en un sistema (clasificación de Lloyd) que solo incluía fibras sensoriales (aunque algunas de ellas eran nervios mixtos y también fibras motoras). Este sistema se refiere a los grupos sensoriales como Tipos y utiliza números romanos: Tipo Ia, Tipo Ib, Tipo II, Tipo III y Tipo IV.
Motor
Las neuronas motoras inferiores tienen dos tipos de fibras:
| Tipo | Clasificación Erlanger-Gasser | Diámetro (μm) | Mielina | Velocidad de conducción (metros/segundo) | Fibras musculares asociadas |
|---|---|---|---|---|---|
| Neurona motora alfa (α) | Aα | 13–20 | Sí | 80–120 | Fibras musculares extrafusales |
| Neurona motora beta (β) | Aβ | ||||
| Neurona motora gamma (γ) | Aγ | 5-8 | Sí | 4–24 [49] [50] | Fibras musculares intrafusales |
Sensorio
Diferentes receptores sensoriales inervan distintos tipos de fibras nerviosas. Los propioceptores están inervados por fibras sensoriales de tipo Ia, Ib y II, los mecanorreceptores por fibras sensoriales de tipo II y III y los nociceptores y termorreceptores por fibras sensoriales de tipo III y IV.
| Tipo | Clasificación Erlanger-Gasser | Diámetro (μm) | Mielina | Velocidad de conducción (m/s) | Receptores sensoriales asociados | Propioceptores | Mecanoceptores | Nociceptores y termorreceptores |
|---|---|---|---|---|---|---|---|---|
| Iowa | Aα | 13–20 | Sí | 80–120 | Receptores primarios del huso muscular (terminación anuloespiral) | ✔ | ||
| yo | Aα | 13–20 | Sí | 80–120 | Órgano tendinoso de Golgi | |||
| II | Aβ | 6–12 | Sí | 33–75 | Receptores secundarios del huso muscular (terminación en espray de flores). Todos los mecanorreceptores cutáneos | ✔ | ||
| III | Aδ | 1–5 | Delgado | 3–30 | Terminaciones nerviosas libres del tacto y la presión Nociceptores del tracto espinotalámico lateral Termorreceptores del frío | ✔ | ||
| IV | do | 0,2–1,5 | No | 0,5–2,0 | Nociceptores del tracto espinotalámico anterior Receptores de calor |
Autonómico
El sistema nervioso autónomo tiene dos tipos de fibras periféricas:
| Tipo | Clasificación Erlanger-Gasser | Diámetro (μm) | Mielina [51] | Velocidad de conducción (m/s) |
|---|---|---|---|---|
| fibras preganglionares | B | 1–5 | Sí | 3–15 |
| fibras posganglionares | do | 0,2–1,5 | No | 0,5–2,0 |
Importancia clínica
En orden de gravedad, la lesión de un nervio en el sistema nervioso periférico puede describirse como neurapraxia , axonotmesis o neurotmesis . La conmoción cerebral se considera una forma leve de lesión axonal difusa . [52] La lesión axonal también puede causar cromatólisis central . La disfunción de los axones en el sistema nervioso es una de las principales causas de muchos trastornos neurológicos hereditarios y adquiridos que afectan tanto a las neuronas periféricas como a las centrales. [5]
Cuando se aplasta un axón, se produce un proceso activo de degeneración axonal en la parte del axón más alejada del cuerpo celular. Esta degeneración se produce rápidamente después de la lesión, y la parte del axón que queda sellada en las membranas es descompuesta por los macrófagos. Esto se conoce como degeneración walleriana . [53] La muerte de un axón también puede tener lugar en muchas enfermedades neurodegenerativas , en particular cuando el transporte axonal está alterado, lo que se conoce como degeneración similar a la walleriana. [54] Los estudios sugieren que la degeneración se produce como resultado de que la proteína axonal NMNAT2 no pueda llegar a todo el axón. [55]
La desmielinización de los axones provoca la multitud de síntomas neurológicos que se encuentran en la enfermedad esclerosis múltiple .
La dismielinización es la formación anormal de la vaina de mielina. Está implicada en varias leucodistrofias y también en la esquizofrenia . [56] [57] [58]
Una lesión cerebral traumática grave puede provocar lesiones generalizadas en los tractos nerviosos que dañan los axones en una afección conocida como lesión axonal difusa . Esto puede conducir a un estado vegetativo persistente . [59] Se ha demostrado en estudios con ratas que el daño axonal causado por una única lesión cerebral traumática leve puede dejar una susceptibilidad a sufrir más daños después de repetidas lesiones cerebrales traumáticas leves. [60]
Un conducto guía nervioso es un medio artificial para guiar el crecimiento de los axones para permitir la neurorregeneración y es uno de los muchos tratamientos utilizados para diferentes tipos de lesiones nerviosas .
Terminología
Algunos diccionarios generales definen "fibra nerviosa" como cualquier proceso neuronal , incluidos tanto los axones como las dendritas . [61] [62] Sin embargo, las fuentes médicas generalmente usan "fibra nerviosa" para referirse solo al axón. [63] [64]
Historia
Al anatomista alemán Otto Friedrich Karl Deiters se le atribuye generalmente el descubrimiento del axón al distinguirlo de las dendritas. [5] El suizo Rüdolf Albert von Kölliker y el alemán Robert Remak fueron los primeros en identificar y caracterizar el segmento inicial del axón. Kölliker nombró al axón en 1896. [65] Louis-Antoine Ranvier fue el primero en describir los huecos o nodos que se encuentran en los axones y por esta contribución estas características axónicas ahora se conocen comúnmente como los nodos de Ranvier . Santiago Ramón y Cajal , un anatomista español, propuso que los axones eran los componentes de salida de las neuronas, describiendo su funcionalidad. [5] Joseph Erlanger y Herbert Gasser desarrollaron anteriormente el sistema de clasificación para las fibras nerviosas periféricas, [66] basándose en la velocidad de conducción axonal, la mielinización , el tamaño de la fibra, etc. Alan Hodgkin y Andrew Huxley también emplearon el axón gigante del calamar (1939) y en 1952 habían obtenido una descripción cuantitativa completa de la base iónica del potencial de acción, lo que llevó a la formulación del modelo de Hodgkin-Huxley . Hodgkin y Huxley recibieron conjuntamente el Premio Nobel por este trabajo en 1963. Las fórmulas que detallan la conductancia axonal se extendieron a los vertebrados en las ecuaciones de Frankenhaeuser-Huxley. La comprensión de la base bioquímica para la propagación del potencial de acción ha avanzado aún más e incluye muchos detalles sobre los canales iónicos individuales .
Otros animales
Los axones de los invertebrados han sido ampliamente estudiados. El calamar costero de aleta larga , que a menudo se utiliza como organismo modelo, tiene el axón más largo conocido. [67] El calamar gigante tiene el axón más grande conocido. Su tamaño varía de 0,5 (típicamente) a 1 mm de diámetro y se utiliza para controlar su sistema de propulsión a chorro . La velocidad de conducción más rápida registrada, de 210 m/s, se encuentra en los axones envainados de algunos camarones peneidos pelágicos [68] y el rango habitual es de entre 90 y 200 metros/s [69] ( cf 100–120 m/s para el axón mielinizado más rápido de los vertebrados).
En otros casos, como se ha visto en estudios con ratas, un axón se origina de una dendrita; se dice que estos axones tienen "origen dendrítico". Algunos axones con origen dendrítico tienen de manera similar un segmento inicial "proximal" que comienza directamente en el origen del axón, mientras que otros tienen un segmento inicial "distal", claramente separado del origen del axón. [70] En muchas especies, algunas de las neuronas tienen axones que emanan de la dendrita y no del cuerpo celular, y se conocen como dendritas portadoras de axones. [1] En muchos casos, un axón se origina en un montículo axónico en el soma; se dice que estos axones tienen "origen somático". Algunos axones con origen somático tienen un segmento inicial "proximal" adyacente al montículo axónico, mientras que otros tienen un segmento inicial "distal", separado del soma por un montículo axónico extendido. [70]
Imágenes adicionales
- Registros en el hipocampo de diferentes tipos de células y axones
Véase también
- Electrofisiología
- Eminencia ganglionar
- Neuropatía axonal gigante
- Rastreo neuronal
- Axón pionero
- Grabación de una sola unidad
Referencias
- ^ ab Triarhou LC (2014). "Axones que emanan de las dendritas: repercusiones filogenéticas con matices cajalianos". Frontiers in Neuroanatomy . 8 : 133. doi : 10.3389/fnana.2014.00133 . PMC 4235383 . PMID 25477788.
- ^ Yau KW (diciembre de 1976). "Campos receptivos, geometría y bloqueo de la conducción de las neuronas sensoriales en el sistema nervioso central de la sanguijuela". The Journal of Physiology . 263 (3): 513–38. doi :10.1113/jphysiol.1976.sp011643. PMC 1307715 . PMID 1018277.
- ^ abcd Squire, Larry (2013). Neurociencia fundamental (4.ª ed.). Ámsterdam: Elsevier/Academic Press. pp. 61–65. ISBN 978-0-12-385-870-2.
- ^ abc Luders E, Thompson PM, Toga AW (agosto de 2010). "El desarrollo del cuerpo calloso en el cerebro humano sano". The Journal of Neuroscience . 30 (33): 10985–90. doi :10.1523/JNEUROSCI.5122-09.2010. PMC 3197828 . PMID 20720105.
- ^ abcde Debanne D, Campanac E, Bialowas A, Carlier E, Alcaraz G (abril de 2011). "Fisiología del axón" (PDF) . Revisiones fisiológicas . 91 (2): 555–602. doi :10.1152/physrev.00048.2009. PMID 21527732. S2CID 13916255.
- ^ Nelson AD, Jenkins PM (2017). "Membranas axónicas y sus dominios: ensamblaje y función del segmento inicial del axón y el nodo de Ranvier". Frontiers in Cellular Neuroscience . 11 : 136. doi : 10.3389/fncel.2017.00136 . PMC 5422562 . PMID 28536506.
- ^ Leterrier C, Clerc N, Rueda-Boroni F, Montersino A, Dargent B, Castets F (2017). "Los socios de membrana de Ankyrin G impulsan el establecimiento y mantenimiento del segmento inicial del axón". Frontiers in Cellular Neuroscience . 11 : 6. doi : 10.3389/fncel.2017.00006 . PMC 5266712 . PMID 28184187.
- ^ Leterrier C (febrero de 2018). "El segmento inicial del axón: un punto de vista actualizado". The Journal of Neuroscience . 38 (9): 2135–2145. doi :10.1523/jneurosci.1922-17.2018. PMC 6596274 . PMID 29378864.
- ^ Rasband MN (agosto de 2010). "El segmento inicial del axón y el mantenimiento de la polaridad neuronal". Nature Reviews. Neuroscience . 11 (8): 552–62. doi :10.1038/nrn2852. PMID 20631711. S2CID 23996233.
- ^ abcd Jones SL, Svitkina TM (2016). "Citoesqueleto del segmento inicial del axón: arquitectura, desarrollo y función en la polaridad neuronal". Plasticidad neuronal . 2016 : 6808293. doi : 10.1155/2016/6808293 . PMC 4967436. PMID 27493806 .
- ^ Clark BD, Goldberg EM, Rudy B (diciembre de 2009). "Ajuste electrogénico del segmento inicial del axón". The Neuroscientist . 15 (6): 651–68. doi :10.1177/1073858409341973. PMC 2951114 . PMID 20007821.
- ^ ab Yamada R, Kuba H (2016). "Plasticidad estructural y funcional en el segmento inicial del axón". Frontiers in Cellular Neuroscience . 10 : 250. doi : 10.3389/fncel.2016.00250 . PMC 5078684 . PMID 27826229.
- ^ ab Susuki K, Kuba H (marzo de 2016). "Regulación dependiente de la actividad de dominios axónicos excitables". The Journal of Physiological Sciences . 66 (2): 99–104. doi : 10.1007/s12576-015-0413-4 . PMC 10717305 . PMID 26464228. S2CID 18862030.
- ^ abcde Alberts B (2004). Biología celular esencial: una introducción a la biología molecular de la célula (2.ª ed.). Nueva York: Garland. pp. 584–587. ISBN 978-0-8153-3481-1.
- ^ ab Alberts B (2002). Biología molecular de la célula (4.ª ed.). Nueva York: Garland. pp. 979–981. ISBN 978-0-8153-4072-0.
- ^ Ozgen, H; Baron, W; Hoekstra, D; Kahya, N (septiembre de 2016). "Dinámica de la membrana oligodendroglial en relación con la biogénesis de la mielina". Ciencias de la vida celular y molecular . 73 (17): 3291–310. doi :10.1007/s00018-016-2228-8. PMC 4967101 . PMID 27141942.
- ^ Sadler, T. (2010). Embriología médica de Langman (11.ª ed.). Filadelfia: Lippincott William & Wilkins. pág. 300. ISBN 978-0-7817-9069-7.
- ^ Hess A, Young JZ (noviembre de 1952). "Los nodos de Ranvier". Actas de la Royal Society de Londres. Serie B, Ciencias Biológicas . Serie B. 140 (900): 301–20. Bibcode :1952RSPSB.140..301H. doi :10.1098/rspb.1952.0063. JSTOR 82721. PMID 13003931. S2CID 11963512.
- ^ "Definición médica de bouton" (botón). www.merriam-webster.com . Consultado el 21 de septiembre de 2024 .
- ^ abc Gu C (2021). "Desarrollo rápido y reversible de varicosidades axónicas: una nueva forma de plasticidad neuronal". Front Mol Neurosci . 14 : 610857. doi : 10.3389/fnmol.2021.610857 . PMC 7886671 . PMID 33613192.
- ^ ab Weber MT, Arena JD, Xiao R, Wolf JA, Johnson VE (mayo de 2019). "CLARITY revela un curso temporal más prolongado de hinchazón y desconexión axonal que lo descrito previamente después de una lesión cerebral traumática". Brain Pathol . 29 (3): 437–450. doi :10.1111/bpa.12677. PMC 6482960 . PMID 30444552.
- ^ Robbins AA, Fox SE, Holmes GL, Scott RC, Barry JM (noviembre de 2013). "Las formas de onda de corta duración registradas extracelularmente de ratas en movimiento libre son representativas de la actividad axonal". Frontiers in Neural Circuits . 7 (181): 181. doi : 10.3389/fncir.2013.00181 . PMC 3831546 . PMID 24348338.
- ^ Rongjing Ge, Hao Qian y Jin-Hui Wang* (2011) Cerebro molecular 4 (19), 1 ~ 11
- ^ Rongjing Ge, Hao Qian, Na Chen y Jin-Hui Wang* (2014) Molecular Brain 7(26):1-16
- ^ Chen N, Yu J, Qian H, Ge R, Wang JH (julio de 2010). "Los axones amplifican picos somáticos incompletos en amplitudes uniformes en neuronas piramidales corticales de ratón". PLOS ONE . 5 (7): e11868. Bibcode :2010PLoSO...511868C. doi : 10.1371/journal.pone.0011868 . PMC 2912328 . PMID 20686619.
- ^ Wolpert, Lewis (2015). Principios del desarrollo (5.ª ed.). Oxford University Press. pp. 520–524. ISBN 978-0-19-967814-3.
- ^ Fletcher TL, Banker GA (diciembre de 1989). "El establecimiento de la polaridad por las neuronas del hipocampo: la relación entre la etapa de desarrollo de una célula in situ y su posterior desarrollo en cultivo". Biología del desarrollo . 136 (2): 446–54. doi :10.1016/0012-1606(89)90269-8. PMID 2583372.
- ^ Jiang H, Rao Y (mayo de 2005). "Formación axonal: destino versus crecimiento". Nature Neuroscience . 8 (5): 544–6. doi :10.1038/nn0505-544. PMID 15856056. S2CID 27728967.
- ^ Goslin K, Banker G (abril de 1989). "Observaciones experimentales sobre el desarrollo de la polaridad en neuronas del hipocampo en cultivo". The Journal of Cell Biology . 108 (4): 1507–16. doi :10.1083/jcb.108.4.1507. PMC 2115496 . PMID 2925793.
- ^ Lamoureux P, Ruthel G, Buxbaum RE, Heidemann SR (noviembre de 2002). "La tensión mecánica puede especificar el destino axonal en las neuronas del hipocampo". The Journal of Cell Biology . 159 (3): 499–508. doi :10.1083/jcb.200207174. PMC 2173080 . PMID 12417580.
- ^ ab Arimura N, Kaibuchi K (marzo de 2007). "Polaridad neuronal: de señales extracelulares a mecanismos intracelulares". Nature Reviews. Neuroscience . 8 (3): 194–205. doi :10.1038/nrn2056. PMID 17311006. S2CID 15556921.
- ^ La neuroglia y las neuronas pioneras expresan UNC-6 para proporcionar señales de netrina globales y locales para guiar las migraciones en C. elegans
- ^ Serafini T, Kennedy TE, Galko MJ, Mirzayan C, Jessell TM, Tessier-Lavigne M (agosto de 1994). "Las netrinas definen una familia de proteínas promotoras del crecimiento axonal homólogas a la UNC-6 de C. elegans". Cell . 78 (3): 409–24. doi :10.1016/0092-8674(94)90420-0. PMID 8062384. S2CID 22666205.
- ^ Hong K, Hinck L, Nishiyama M, Poo MM, Tessier-Lavigne M, Stein E (junio de 1999). "Una asociación controlada por ligando entre los dominios citoplasmáticos de los receptores de la familia UNC5 y DCC convierte la atracción del cono de crecimiento inducida por netrina en repulsión". Cell . 97 (7): 927–41. doi : 10.1016/S0092-8674(00)80804-1 . PMID 10399920. S2CID 18043414.
- ^ Hedgecock EM, Culotti JG, Hall DH (enero de 1990). "Los genes unc-5, unc-6 y unc-40 guían las migraciones circunferenciales de los axones pioneros y las células mesodérmicas en la epidermis de C. elegans". Neuron . 4 (1): 61–85. doi :10.1016/0896-6273(90)90444-K. PMID 2310575. S2CID 23974242.
- ^ Huang EJ, Reichardt LF (2003). "Receptores Trk: funciones en la transducción de señales neuronales". Revisión anual de bioquímica . 72 : 609–42. doi :10.1146/annurev.biochem.72.121801.161629. PMID 12676795. S2CID 10217268.
- ^ ab Da Silva JS, Hasegawa T, Miyagi T, Dotti CG, Abad-Rodriguez J (mayo de 2005). "La actividad asimétrica de la gangliósido sialidasa de membrana especifica el destino axonal". Nature Neuroscience . 8 (5): 606–15. doi :10.1038/nn1442. PMID 15834419. S2CID 25227765.
- ^ Bradke F, Dotti CG (marzo de 1999). "El papel de la inestabilidad local de la actina en la formación de axones". Science . 283 (5409): 1931–4. Bibcode :1999Sci...283.1931B. doi :10.1126/science.283.5409.1931. PMID 10082468.
- ^ Furley AJ, Morton SB, Manalo D, Karagogeos D, Dodd J, Jessell TM (abril de 1990). "La glicoproteína axonal TAG-1 es un miembro de la superfamilia de inmunoglobulinas con actividad promotora del crecimiento de neuritas". Cell . 61 (1): 157–70. doi : 10.1016/0092-8674(90)90223-2 . PMID 2317872. S2CID 28813676.
- ^ Alberts, Bruce (2015). Biología molecular de la célula (sexta edición). pág. 947. ISBN 9780815344643.
- ^ Kunik D, Dion C, Ozaki T, Levin LA, Costantino S (2011). "Transección de un solo axón basada en láser para estudios de regeneración y lesión axonal de alto contenido". PLOS ONE . 6 (11): e26832. Bibcode :2011PLoSO...626832K. doi : 10.1371/journal.pone.0026832 . PMC 3206876 . PMID 22073205.
- ^ Schwab ME (febrero de 2004). "Nogo y regeneración axonal". Current Opinion in Neurobiology . 14 (1): 118–24. doi :10.1016/j.conb.2004.01.004. PMID 15018947. S2CID 9672315.
- ^ Gensel JC, Nakamura S, Guan Z, van Rooijen N, Ankeny DP, Popovich PG (marzo de 2009). "Los macrófagos promueven la regeneración axonal con neurotoxicidad concurrente". The Journal of Neuroscience . 29 (12): 3956–68. doi :10.1523/JNEUROSCI.3992-08.2009. PMC 2693768 . PMID 19321792.
- ^ Myers KA, Baas PW (septiembre de 2007). "La kinesina-5 regula el crecimiento del axón actuando como un freno en su matriz de microtúbulos". The Journal of Cell Biology . 178 (6): 1081–91. doi :10.1083/jcb.200702074. PMC 2064629 . PMID 17846176.
- ^ Rishal I, Kam N, Perry RB, Shinder V, Fisher EM, Schiavo G, Fainzilber M (junio de 2012). "Un mecanismo impulsado por motor para la detección de la longitud celular". Cell Reports . 1 (6): 608–16. doi :10.1016/j.celrep.2012.05.013. PMC 3389498 . PMID 22773964.
- ^ Karamched BR, Bressloff PC (mayo de 2015). "Modelo de retroalimentación retardada de detección de longitud axonal". Revista biofísica . 108 (9): 2408–19. Bibcode :2015BpJ...108.2408K. doi :10.1016/j.bpj.2015.03.055. PMC 4423051 . PMID 25954897.
- ^ Bressloff PC, Karamched BR (2015). "Un mecanismo de decodificación dependiente de la frecuencia para la detección de la longitud axonal". Frontiers in Cellular Neuroscience . 9 : 281. doi : 10.3389/fncel.2015.00281 . PMC 4508512 . PMID 26257607.
- ^ Folz F, Wettmann L, Morigi G , Kruse K (mayo de 2019). "Sonido del crecimiento de un axón". Physical Review E. 99 ( 5–1): 050401. arXiv : 1807.04799 . Código Bibliográfico : 2019PhRvE..99e0401F. doi : 10.1103/PhysRevE.99.050401. PMID: 31212501. S2CID : 118682719.
- ^ Andrew BL, Part NJ (abril de 1972). "Propiedades de las unidades motoras rápidas y lentas en los músculos de las extremidades traseras y de la cola de la rata". Quarterly Journal of Experimental Physiology and Cognate Medical Sciences . 57 (2): 213–25. doi : 10.1113/expphysiol.1972.sp002151 . PMID 4482075.
- ^ Russell NJ (enero de 1980). "Cambios en la velocidad de conducción axonal después de la tenotomía o deaferenciación muscular durante el desarrollo en la rata". The Journal of Physiology . 298 : 347–60. doi :10.1113/jphysiol.1980.sp013085. PMC 1279120 . PMID 7359413.
- ^ Pocock G, Richards CD, et al. (2004). Fisiología humana (2.ª ed.). Nueva York: Oxford University Press. págs. 187-189. ISBN 978-0-19-858527-5.
- ^ Dawodu ST (16 de agosto de 2017). «Traumatismo craneoencefálico (TCE): definición, epidemiología y fisiopatología». Medscape . Archivado desde el original el 12 de junio de 2018. Consultado el 14 de julio de 2018 .
- ^ Trauma y degeneración walleriana Archivado el 2 de mayo de 2006 en Wayback Machine , Universidad de California, San Francisco
- ^ Coleman MP, Freeman MR (1 de junio de 2010). "Degeneración walleriana, wld(s) y nmnat". Revisión anual de neurociencia . 33 (1): 245–67. doi :10.1146/annurev-neuro-060909-153248. PMC 5223592 . PMID 20345246.
- ^ Gilley J, Coleman MP (enero de 2010). "La Nmnat2 endógena es un factor de supervivencia esencial para el mantenimiento de axones sanos". PLOS Biology . 8 (1): e1000300. doi : 10.1371/journal.pbio.1000300 . PMC 2811159 . PMID 20126265.
- ^ Krämer-Albers EM, Gehrig-Burger K, Thiele C, Trotter J, Nave KA (noviembre de 2006). "Interacciones perturbadas de la proteína proteolipídica mutante/DM20 con el colesterol y las balsas lipídicas en la oligodendroglia: implicaciones para la desmielinización en la paraplejía espástica". The Journal of Neuroscience . 26 (45): 11743–52. doi :10.1523/JNEUROSCI.3581-06.2006. PMC 6674790 . PMID 17093095.
- ^ Matalon R, Michals-Matalon K, Surendran S, Tyring SK (2006). "Enfermedad de Canavan: estudios sobre el ratón knock-out". N-acetilaspartato . Avances en medicina y biología experimental. Vol. 576. págs. 77–93, discusión 361–3. doi :10.1007/0-387-30172-0_6. ISBN 978-0-387-30171-6. Número de identificación personal 16802706. Número de identificación personal 44405442.
- ^ Tkachev D, Mimmack ML, Huffaker SJ, Ryan M, Bahn S (agosto de 2007). "Más evidencia de biosíntesis de mielina alterada y disfunción glutamatérgica en la esquizofrenia". The International Journal of Neuropsychopharmacology . 10 (4): 557–63. doi : 10.1017/S1461145706007334 . PMID 17291371.
- ^ "Lesión cerebral traumática". Medcyclopaedia . GE . Archivado desde el original el 26 de mayo de 2011 . Consultado el 20 de junio de 2018 .
- ^ Wright DK, Brady RD, Kamnaksh A, Trezise J, Sun M, McDonald SJ, et al. (octubre de 2019). "Las lesiones cerebrales traumáticas leves repetidas inducen cambios persistentes en las proteínas plasmáticas y en los biomarcadores de resonancia magnética en la rata". Scientific Reports . 9 (1): 14626. Bibcode :2019NatSR...914626W. doi :10.1038/s41598-019-51267-w. PMC 6787341 . PMID 31602002.
- ^ "fibra nerviosa". Merriam-Webster . Consultado el 21 de abril de 2023 .
- ^ "fibra nerviosa". Diccionario Oxford de inglés . Consultado el 21 de abril de 2023 .
- ^ "fibra nerviosa". Diccionario médico de Taber . Consultado el 21 de abril de 2023 .
- ^ "fibra nerviosa". Diccionario APA de Psicología . Asociación Estadounidense de Psicología . Consultado el 21 de abril de 2023 .
- ^ Finger S (1994). Orígenes de la neurociencia: una historia de exploraciones sobre la función cerebral . Oxford University Press. pág. 47. ISBN 9780195146943. OCLC 27151391.
Kölliker daría al "axón" su nombre en 1896.
- ^ Grant G (diciembre de 2006). "Los Premios Nobel de 1932 y 1944 en fisiología o medicina: recompensas por estudios innovadores en neurofisiología". Revista de la historia de las neurociencias . 15 (4): 341–57. doi :10.1080/09647040600638981. PMID 16997762. S2CID 37676544.
- ^ Hellier, Jennifer L. (16 de diciembre de 2014). El cerebro, el sistema nervioso y sus enfermedades [3 volúmenes]. ABC-CLIO. ISBN 9781610693387Archivado desde el original el 14 de marzo de 2018.
- ^ Hsu K, Terakawa S (julio de 1996). "Fenestración en la vaina de mielina de las fibras nerviosas del camarón: un nuevo nodo de excitación para la conducción saltatoria". Journal of Neurobiology . 30 (3): 397–409. doi :10.1002/(SICI)1097-4695(199607)30:3<397::AID-NEU8>3.0.CO;2-#. PMID 8807532.
- ^ Salzer JL, Zalc B (octubre de 2016). "Mielination". Current Biology . 26 (20): R971–R975. Bibcode :2016CBio...26.R971S. doi : 10.1016/j.cub.2016.07.074 . PMID 27780071.
- ^ ab Höfflin F, Jack A, Riedel C, Mack-Bucher J, Roos J, Corcelli C, et al. (2017). "Heterogeneidad del segmento inicial del axón en interneuronas y células piramidales de la corteza visual de roedores". Frontiers in Cellular Neuroscience . 11 : 332. doi : 10.3389/fncel.2017.00332 . PMC 5684645 . PMID 29170630.
Enlaces externos
- Imagen de histología: 3_09 en el Centro de Ciencias de la Salud de la Universidad de Oklahoma – "Diapositiva 3 Médula espinal "

