Lamelipodio
This article needs additional citations for verification. (April 2012) |
El lamelipodio ( pl.: lamellipodia ) (del latín lamella , relacionado con lámina , "lámina delgada", y el radical griego pod- , "pie") es una proyección de actina de proteína citoesquelética en el borde delantero de la célula . Contiene una malla de actina cuasi bidimensional; toda la estructura propulsa a la célula a través de un sustrato. [1] Dentro de los lamelipodios hay costillas de actina llamadas microspikes , que, cuando se extienden más allá de la frontera del lamelipodio, se llaman filopodios . [2] El lamelipodio nace de la nucleación de actina en la membrana plasmática de la célula [1] y es el área primaria de incorporación de actina o formación de microfilamentos de la célula.
Descripción
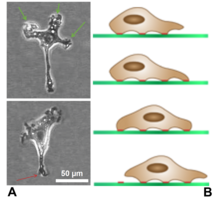
Los lamelipodios se encuentran principalmente en todas las células móviles, como los queratinocitos de los peces y las ranas, que participan en la rápida curación de las heridas . Los lamelipodios de estos queratinocitos les permiten moverse a velocidades de 10-20 μm/min sobre las superficies epiteliales . Cuando se separan de la parte principal de una célula, un lamelipodio todavía puede arrastrarse libremente por sí solo.
Los lamelipodios son un rasgo característico de la parte delantera, del borde delantero, de las células móviles. Se cree que son el motor real que empuja a la célula hacia adelante durante el proceso de migración celular . La punta del lamelipodio es el sitio donde se produce la exocitosis en las células migratorias de los mamíferos como parte de su ciclo endocítico mediado por clatrina . Esto, junto con la polimerización de actina allí, ayuda a extender la lámina hacia adelante y, por lo tanto, a hacer avanzar el frente de la célula. Por lo tanto, actúa como un dispositivo de dirección para las células en el proceso de quimiotaxis . También es el sitio desde el que las partículas o agregados adheridos a la superficie celular migran en un proceso conocido como formación de la tapa .
- Estructura
Estructuralmente, los extremos con púas de los microfilamentos ( monómeros de actina localizados en una forma unida a ATP ) miran hacia el borde "buscador" de la célula, mientras que los extremos puntiagudos (monómeros de actina localizados en una forma unida a ADP ) miran hacia la lámina que está detrás. [4] Esto crea un movimiento de rueda de ardilla en todo el lamelipodio, lo que ayuda al flujo retrógrado de partículas en todo el lamelipodio. [4] Los complejos Arp2/3 están presentes en las uniones microfilamento-microfilamento en los lamelipodios y ayudan a crear la red de actina. Arp2/3 solo puede unirse a microfilamentos previamente existentes, pero una vez unido crea un sitio para la extensión de nuevos microfilamentos, lo que crea ramificaciones. [5] Otra molécula que se encuentra a menudo en la polimerización de actina con Arp2/3 es la cortactina , que parece vincular la señalización de la tirosina quinasa con la reorganización del citoesqueleto en el lamelipodio y sus estructuras asociadas. [ 5]
Rac y Cdc42 son dos GTPasas de la familia Rho que normalmente son citosólicas pero que también se pueden encontrar en la membrana celular bajo ciertas condiciones. [2] Cuando Cdc42 se activa, puede interactuar con los receptores de la familia de proteínas del síndrome de Wiskott-Aldrich (WASp), en particular N-WASp , que luego activa Arp2/3. Esto estimula la ramificación de actina y aumenta la motilidad celular . [2] Rac1 induce a la cortactina a localizarse en la membrana celular, donde se une simultáneamente a la F-actina y a Arp2/3. El resultado es una reorganización estructural del lamelipodio y la consiguiente motilidad celular. [5] Rac promueve los lamelipodios mientras que cdc42 promueve los filopodios. [6]
Las proteínas Ena/VASP se encuentran en el borde delantero de los lamelipodios, donde promueven la polimerización de actina necesaria para la protrusión y la quimiotaxis de los lamelipodios. Además, Ena/VASP previene la acción de la proteína capping , que detiene la polimerización de actina. [7]
Referencias
- ^ ab Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002). Biología molecular de la célula (4.ª ed.). Nueva York, NY: Garland Science. págs. 908, 931, 973–975. ISBN 978-0-8153-3218-3.
- ^ abc Small, J. Victor; Stradal, Theresia; Vignal, Emmanuel; Rottner, Klemens (2002). "El lamelipodio: donde comienza la motilidad". Tendencias en biología celular . 12 (3): 112–120. doi :10.1016/S0962-8924(01)02237-1. PMID 11859023.
- ^ "¿Qué son los lamelipodios y las láminas?". MBInfo . Consultado el 4 de noviembre de 2022 .
- ^ ab Cramer, Louise P. (1997). "Mecanismo molecular del flujo retrógrado dependiente de actina en lamelipodios de células móviles" (PDF) . Frontiers in Bioscience . 2 (4): d260–270. doi :10.2741/a189. PMID 9206973.
- ^ abc Weed, Scott A.; Karginov, Andrei V.; Schafer, Dorothy A.; Weaver, Alissa M.; Kinley, Andrew W.; Cooper, John A.; Parsons, J. Thomas (2000). "La localización de la cortactina en los sitios de ensamblaje de actina en lamelipodios requiere interacciones con F-actina y el complejo Arp2/3". Journal of Cell Biology . 151 (1): 29–40. doi :10.1083/jcb.151.1.29. PMC 2189811 . PMID 11018051.
- ^ Hall, Alan (1998). "GTPasas Rho y el citoesqueleto de actina". Science . 279 (5350): 509–514. Bibcode :1998Sci...279..509H. doi :10.1126/science.279.5350.509. PMID 9438836.
- ^ Bear, James E.; Gertler, Frank B. (2009). "Ena/VASP: hacia la resolución de una controversia punzante en el extremo puntiagudo". Journal of Cell Science . 122 (12): 1947–1953. doi :10.1242/jcs.038125. PMC 2723151 . PMID 19494122.
Enlaces externos[1]
- MBInfo - Lamelipodios
- MBInfo - Ensamblaje de lamelipodios
- Recorrido en vídeo sobre la motilidad celular
- ^ "¿Qué son los lamelipodios y las láminas?". MBInfo . Consultado el 28 de noviembre de 2022 .
