Metionina
 Fórmula esquelética de la forma canónica de la metionina. | |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Metionina | |||
| Otros nombres Ácido 2-amino-4-(metiltio)butanoico | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| Abreviaturas | Conocí a M | ||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Banco de medicamentos | |||
| Tarjeta informativa de la ECHA | 100.000.393 | ||
| Número CE |
| ||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades [2] | |||
| C5H11NO2S | |||
| Masa molar | 149,21 g·mol −1 | ||
| Apariencia | Polvo cristalino blanco | ||
| Densidad | 1,340 g/ cm3 | ||
| Punto de fusión | 281 °C (538 °F; 554 K) se descompone | ||
| Soluble | |||
| Acidez (p K a ) | 2,28 (carboxilo), 9,21 (amino) [1] | ||
| Farmacología | |||
| V03AB26 ( OMS ) QA05BA90 ( OMS ), QG04BA90 ( OMS ) | |||
| Página de datos complementarios | |||
| Metionina (página de datos) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
La metionina (símbolo Met o M ) [3] ( / m ɪ ˈ θ aɪ ə n iː n / ) [4] es un aminoácido esencial en los seres humanos.
Como precursora de otros aminoácidos no esenciales como la cisteína y la taurina , compuestos versátiles como la SAM-e y el importante antioxidante glutatión , la metionina desempeña un papel fundamental en el metabolismo y la salud de muchas especies, incluidos los humanos. La metionina también participa en la angiogénesis y en varios procesos relacionados con la transcripción del ADN, la expresión epigenética y la regulación genética.
La metionina fue aislada por primera vez en 1921 por John Howard Mueller . [5] Está codificada por el codón AUG. Fue nombrada por Satoru Odake en 1925, como una abreviatura de su descripción estructural ácido 2-amino-4-( metiltio ) butanoico. [6]
Detalles bioquímicos
La metionina (abreviada como Met o M ; codificada por el codón AUG) es un α- aminoácido que se utiliza en la biosíntesis de proteínas . Contiene un grupo carboxilo (que está en la forma desprotonada −COO − en condiciones de pH biológico ), un grupo amino (que está en la forma protonada −NH+
3forma en condiciones de pH biológico) ubicada en posición α con respecto al grupo carboxilo, y una cadena lateral S -metiltioéter , clasificándolo como un aminoácido alifático no polar .
En los genes nucleares de los eucariotas y de las arqueas , la metionina está codificada por el codón de inicio , lo que significa que indica el inicio de la región codificante y es el primer aminoácido producido en un polipéptido naciente durante la traducción del ARNm . [7]
Un aminoácido proteinogénico
La cisteína y la metionina son los dos aminoácidos proteinogénicos que contienen azufre . Excluyendo las pocas excepciones en las que la metionina puede actuar como un sensor redox (por ejemplo, sulfóxido de metionina [8] ), los residuos de metionina no tienen un papel catalítico. [9] Esto contrasta con los residuos de cisteína, donde el grupo tiol tiene un papel catalítico en muchas proteínas. [9] Sin embargo, el tioéter dentro de la metionina tiene un papel estructural menor debido al efecto de estabilidad de las interacciones S/π entre el átomo de azufre de la cadena lateral y los aminoácidos aromáticos en un tercio de todas las estructuras proteicas conocidas. [9] Esta falta de un papel fuerte se refleja en experimentos donde se ve poco efecto en proteínas donde la metionina es reemplazada por norleucina , un aminoácido de cadena lateral de hidrocarburo lineal que carece del tioéter. [10] Se ha conjeturado que la norleucina estaba presente en las primeras versiones del código genético, pero la metionina se introdujo en la versión final del código genético debido al hecho de que se utiliza en el cofactor S -adenosilmetionina (SAM-e). [11] Esta situación no es única y puede haber ocurrido con la ornitina y la arginina . [12]
Codificación
La metionina es uno de los dos únicos aminoácidos codificados por un solo codón (AUG) en el código genético estándar ( el otro es el triptófano , codificado por UGG). Como reflejo del origen evolutivo de su codón, los otros codones AUN codifican isoleucina , que también es un aminoácido hidrófobo. En el genoma mitocondrial de varios organismos, incluidos los metazoos y las levaduras , el codón AUA también codifica la metionina. En el código genético estándar, AUA codifica isoleucina y el ARNt respectivo ( ileX en Escherichia coli ) utiliza la base inusual lisidina (bacterias) o agmatidina (arqueas) para discriminar contra AUG. [13] [14]
El codón AUG de metionina es también el codón de inicio más común. Un codón de "inicio" es un mensaje para un ribosoma que señala el inicio de la traducción de proteínas a partir del ARNm cuando el codón AUG está en una secuencia de consenso de Kozak . Como consecuencia, la metionina a menudo se incorpora en la posición N -terminal de las proteínas en eucariotas y arqueas durante la traducción, aunque puede eliminarse mediante modificación postraduccional . En las bacterias , el derivado N -formilmetionina se utiliza como aminoácido inicial.
Derivados
S-Adenosilmetionina
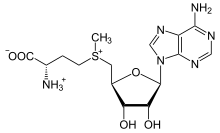
El derivado de la metionina, la S -adenosilmetionina (SAM-e), es un cofactor que actúa principalmente como donante de metilo . La SAM-e está compuesta por una molécula de adenosilo (a través del carbono 5') unida al azufre de la metionina, lo que la convierte en un catión sulfonio (es decir, tres sustituyentes y carga positiva). El azufre actúa como un ácido de Lewis blando (es decir, donante/electrófilo) que permite que el grupo S -metilo se transfiera a un sistema de oxígeno, nitrógeno o aromático, a menudo con la ayuda de otros cofactores como la cobalamina (vitamina B 12 en humanos). Algunas enzimas utilizan la SAM-e para iniciar una reacción radical; estas se denominan enzimas SAM-e radicales . Como resultado de la transferencia del grupo metilo, se obtiene la S -adenosilhomocisteína. En las bacterias, esto se regenera por metilación o se recupera eliminando la adenina y la homocisteína, dejando que el compuesto dihidroxipentanodiona se convierta espontáneamente en autoinductor-2 , que se excreta como un producto de desecho o señal de quórum.
Biosíntesis
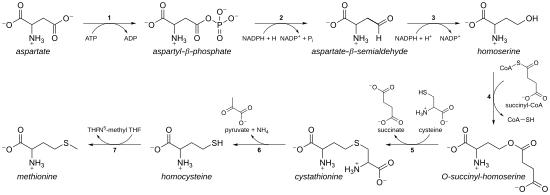
Como aminoácido esencial, la metionina no se sintetiza de novo en humanos y otros animales, que deben ingerir metionina o proteínas que contienen metionina. En plantas y microorganismos, la biosíntesis de metionina pertenece a la familia del aspartato , junto con la treonina y la lisina (a través del diaminopimelato , pero no a través del α-aminoadipato ). La cadena principal se deriva del ácido aspártico , mientras que el azufre puede provenir de cisteína , metanotiol o sulfuro de hidrógeno . [9]
- En primer lugar, el ácido aspártico se convierte a través del β-aspartil semialdehído en homoserina mediante dos pasos de reducción del grupo carboxilo terminal (la homoserina tiene, por lo tanto, un γ-hidroxilo, de ahí la serie homo- ). El aspartato semialdehído intermedio es el punto de ramificación con la vía de biosíntesis de lisina, donde en cambio se condensa con piruvato. La homoserina es el punto de ramificación con la vía de treonina, donde en cambio se isomeriza después de activar el hidroxilo terminal con fosfato (también utilizado para la biosíntesis de metionina en plantas). [9]
- Luego, la homoserina se activa con un grupo fosfato, succinilo o acetilo en el hidroxilo.
- En las plantas y posiblemente en algunas bacterias, [9] se utiliza fosfato. Este paso es compartido con la biosíntesis de treonina. [9]
- En la mayoría de los organismos, se utiliza un grupo acetilo para activar la homoserina. Esto puede ser catalizado en bacterias por una enzima codificada por metX o metA (no homólogas). [9]
- En las enterobacterias y en un número limitado de otros organismos, se utiliza succinato. La enzima que cataliza la reacción es MetA y la especificidad para acetil-CoA y succinil-CoA está determinada por un único residuo. [9] Se desconoce la base fisiológica de la preferencia por acetil-CoA o succinil-CoA, pero existen rutas alternativas de este tipo en otras vías ( por ejemplo , la biosíntesis de lisina y la biosíntesis de arginina).
- El grupo activador de hidroxilo se reemplaza luego con cisteína, metanotiol o sulfuro de hidrógeno. Una reacción de reemplazo es técnicamente una eliminación γ seguida de una variante de una adición de Michael . Todas las enzimas involucradas son homólogas y miembros de la familia de enzimas dependientes de PLP del metabolismo Cys/Met , que es un subconjunto del clado de tipo I de pliegue dependiente de PLP. Utilizan el cofactor PLP ( fosfato de piridoxal ), que funciona estabilizando los intermediarios de carbanión. [9]
- Si reacciona con la cisteína, produce cistationina , que se escinde para dar homocisteína . Las enzimas implicadas son la cistationina-γ-sintasa (codificada por metB en bacterias) y la cistationina-β-liasa ( metC ). La cistationina se une de forma diferente en las dos enzimas, lo que permite que se produzcan reacciones β o γ. [9]
- Si reacciona con sulfuro de hidrógeno libre, produce homocisteína. Esta reacción es catalizada por la O -acetilhomoserina aminocarboxipropiltransferasa (antes conocida como O -acetilhomoserina (tiol)-liasa). Está codificada por metY o metZ en las bacterias. [9]
- Si reacciona con metanotiol, produce metionina directamente. El metanotiol es un subproducto de la vía catabólica de ciertos compuestos, por lo que esta vía es menos común. [9]
- Si se produce homocisteína, el grupo tiol se metila, lo que da lugar a metionina. Se conocen dos sintetasas de metionina : una es dependiente de la cobalamina (vitamina B 12 ) y la otra es independiente. [9]
La vía que utiliza cisteína se denomina " vía de transulfuración ", mientras que la vía que utiliza sulfuro de hidrógeno (o metanotiol) se denomina "vía de sulfurilación directa".
La cisteína se produce de manera similar, es decir, se puede fabricar a partir de una serina activada y de homocisteína ("ruta de transsulfuración inversa") o de sulfuro de hidrógeno ("ruta de sulfuración directa"); la serina activada es generalmente O -acetilserina (a través de CysK o CysM en E. coli ), pero en Aeropyrum pernix y algunas otras arqueas se utiliza O -fosfoserina. [15] CysK y CysM son homólogos, pero pertenecen al clado de tipo III del pliegue PLP.
Vía de transsulfuración
Enzimas implicadas en la ruta de transsulfuración de la biosíntesis de metionina de E. coli :
- Aspartoquinasa
- Aspartato-semialdehído deshidrogenasa
- Homoserina deshidrogenasa
- Homoserina O -transsuccinilasa
- Cistationina-γ-sintasa
- Cistationina-β-liasa
- Metionina sintasa (en los mamíferos, este paso lo realiza la homocisteína metiltransferasa o betaína—homocisteína S -metiltransferasa ).
Otras vías bioquímicas

Aunque los mamíferos no pueden sintetizar metionina, aún pueden utilizarla en una variedad de vías bioquímicas:
Catabolismo
La metionina se convierte en S -adenosilmetionina (SAM-e) por (1) la metionina adenosiltransferasa .
SAM-e actúa como donante de metilo en muchas (2) reacciones de metiltransferasa y se convierte en S -adenosilhomocisteína (SAH).
(3) Cisteína adenosilhomocisteína .
Regeneración
La metionina se puede regenerar a partir de la homocisteína a través de la (4) metionina sintasa en una reacción que requiere vitamina B 12 como cofactor .
La homocisteína también puede remetilarse utilizando glicina betaína ( N , N , N -trimetilglicina, TMG) a metionina a través de la enzima betaína-homocisteína metiltransferasa (EC2.1.1.5, BHMT). La BHMT constituye hasta el 1,5% de toda la proteína soluble del hígado, y evidencia reciente sugiere que puede tener una mayor influencia en la homeostasis de la metionina y la homocisteína que la metionina sintasa.
Vía de transulfurilación inversa: conversión a cisteína
La homocisteína se puede convertir en cisteína.
- (5) La cistationina-β-sintasa (una enzima que requiere fosfato de piridoxal , la forma activa de la vitamina B6 ) combina homocisteína y serina para producir cistationina . En lugar de degradar la cistationina a través de la cistationina-β-liasa , como en la vía biosintética, la cistationina se descompone en cisteína y α-cetobutirato a través de la (6) cistationina-γ-liasa .
- (7) La enzima α-cetoácido deshidrogenasa convierte el α-cetobutirato en propionil-CoA , que se metaboliza a succinil-CoA en un proceso de tres pasos (ver propionil-CoA para conocer la vía).
Síntesis de etileno
Este aminoácido también es utilizado por las plantas para la síntesis de etileno . El proceso se conoce como ciclo Yang o ciclo de la metionina.
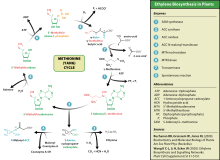
Enfermedades metabólicas
La degradación de la metionina se ve afectada en las siguientes enfermedades metabólicas :
- Aciduria combinada malónica y metilmalónica (CMAMMA)
- Homocistinuria
- Acidemia metilmalónica
- Acidemia propiónica
Síntesis química
La síntesis industrial combina acroleína , metanotiol y cianuro, lo que produce la hidantoína . [16] La metionina racémica también se puede sintetizar a partir de ftalimidomalonato de sodio y dietilo mediante alquilación con cloroetilmetilsulfuro (ClCH 2 CH 2 SCH 3 ) seguida de hidrólisis y descarboxilación. Véase también Metanol. [17]
Nutrición humana
No hay evidencia clínica concluyente sobre la suplementación con metionina. [18] La restricción dietética de metionina puede conducir a trastornos relacionados con los huesos. [18]
La suplementación con metionina puede beneficiar a quienes sufren de intoxicación por cobre . [19]
El consumo excesivo de metionina, el donante del grupo metilo en la metilación del ADN , está relacionado con el crecimiento del cáncer en varios estudios. [20] [21]
Requisitos
En 2002 , la Junta de Alimentos y Nutrición del Instituto de Medicina de los Estados Unidos estableció las cantidades dietéticas recomendadas (RDA) para los aminoácidos esenciales . Para la metionina combinada con cisteína, para adultos de 19 años o más, 19 mg/kg de peso corporal/día. [22]
Esto se traduce en aproximadamente 1,33 gramos por día para una persona de 70 kilogramos.
Fuentes dietéticas
| Alimento | gramos/100 gramos |
|---|---|
| Huevo , clara, seco, en polvo, reducido en glucosa | 3.204 |
| Harina de semillas de sésamo (baja en grasa) | 1.656 |
| Nueces de Brasil | 1.124 |
| Queso , parmesano, rallado | 1.114 |
| semilla de cáñamo , descascarada | 0,933 |
| Concentrado de proteína de soja | 0,814 |
| Pollo , pollos de engorde o pollos de asar, asado | 0.801 |
| Pescado , atún, claro, enlatado en agua, sólidos escurridos | 0,755 |
| Carne de res , curada, seca | 0,749 |
| Tocino | 0,593 |
| semillas de chia | 0,588 |
| Carne de res molida, 95 % carne magra/5 % grasa, cruda | 0,565 |
| Carne de cerdo molida, 96 % magra, 4 % grasa, cruda | 0,564 |
| Soja | 0,547 |
| Germen de trigo | 0,456 |
| Huevo , entero, cocido, duro | 0,392 |
| Avena | 0,312 |
| Miseria | 0,309 |
| Garbanzo | 0,253 |
| Maíz amarillo | 0,197 |
| Almendras | 0,151 |
| Frijoles pintos cocidos | 0,117 |
| Lentejas , cocidas | 0,077 |
| Arroz integral de grano medio, cocido | 0,052 |
Se pueden encontrar altos niveles de metionina en huevos, carne y pescado; semillas de sésamo, nueces de Brasil y algunas otras semillas de plantas; y granos de cereales . La mayoría de las frutas y verduras contienen muy poca. La mayoría de las legumbres , aunque ricas en proteínas, tienen un bajo contenido de metionina. Las proteínas sin la metionina adecuada no se consideran proteínas completas . [23] Por esa razón, a veces se agrega metionina racémica como ingrediente a los alimentos para mascotas . [24]
Salud
La pérdida de metionina se ha relacionado con el encanecimiento senil del cabello. Su falta conduce a una acumulación de peróxido de hidrógeno en los folículos pilosos , una reducción en la eficacia de la tirosinasa y una pérdida gradual del color del cabello. [25] La metionina aumenta la concentración intracelular de glutatión , promoviendo así la defensa celular mediada por antioxidantes y la regulación redox. También protege a las células contra la pérdida de células nigrales inducida por dopamina al unirse a metabolitos oxidativos. [26]
La metionina es un intermediario en la biosíntesis de cisteína , carnitina , taurina , lecitina , fosfatidilcolina y otros fosfolípidos . La conversión inadecuada de metionina puede provocar aterosclerosis [27] debido a la acumulación de homocisteína .
Otros usos
La DL -metionina se administra a veces como suplemento a los perros; ayuda a reducir las posibilidades de que se formen cálculos renales en los perros. También se sabe que la metionina aumenta la excreción urinaria de quinidina al acidificar la orina. Los antibióticos aminoglucósidos que se utilizan para tratar las infecciones del tracto urinario funcionan mejor en condiciones alcalinas, y la acidificación urinaria por el uso de metionina puede reducir su eficacia. Si un perro sigue una dieta que acidifica la orina, no se debe utilizar metionina. [28]
La metionina está permitida como suplemento en el alimento orgánico para aves de corral según el programa orgánico certificado de EE. UU. [29]
La metionina se puede utilizar como una opción de pesticida no tóxica contra las orugas gigantes de cola de golondrina , que son una plaga grave para los cultivos de naranja. [30]
Véase también
- Alantoína
- Formilmetionina
- Oxidación de metionina
- Intoxicación por paracetamol
- Metionina fotorreactiva
- S -metilcisteína
Referencias
- ^ Dawson RM, Elliott DC, Elliott WH, Jones KM (1959). Datos para la investigación bioquímica . Oxford: Clarendon Press.
- ^ Weast, Robert C., ed. (1981). Manual de química y física del CRC (62.ª edición). Boca Raton, FL: CRC Press. pág. C-374. ISBN 0-8493-0462-8..
- ^ "Nomenclatura y simbolismo de aminoácidos y péptidos". Comisión Conjunta IUPAC-IUB sobre Nomenclatura Bioquímica. 1983. Archivado desde el original el 9 de octubre de 2008. Consultado el 5 de marzo de 2018 .
- ^ "Metionina". Oxford University Press. Archivado desde el original el 27 de enero de 2018.
- ^ Pappenheimer AM (1987). "Una memoria biográfica de John Howard Mueller" (PDF) . Washington DC: Academia Nacional de Ciencias.
- ^ Odake, Satoru (1925). "Sobre la presencia de un aminoácido que contiene azufre en la levadura". Boletín de la Sociedad Química Agrícola de Japón . 1 (8): 87–89. doi :10.1271/bbb1924.1.87. ISSN 1881-1272.
- ^ Guedes RL, Prosdocimi F, Fernandes GR, Moura LK, Ribeiro HA, Ortega JM (diciembre de 2011). "Vías de biosíntesis de aminoácidos y asimilación de nitrógeno: una gran deleción genómica durante la evolución de los eucariotas". BMC Genomics . 12 (Suppl 4): S2. doi : 10.1186/1471-2164-12-S4-S2 . PMC 3287585 . PMID 22369087.
- ^ Bigelow DJ, Squier TC (enero de 2005). "Modulación redox de la señalización celular y el metabolismo a través de la oxidación reversible de sensores de metionina en proteínas reguladoras del calcio". Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics (manuscrito enviado). 1703 (2): 121–134. doi :10.1016/j.bbapap.2004.09.012. PMID 15680220.
- ^ abcdefghijklmn Ferla MP, Patrick WM (agosto de 2014). "Biosíntesis de metionina bacteriana". Microbiología . 160 (Pt 8): 1571–1584. doi : 10.1099/mic.0.077826-0 . PMID 24939187.
- ^ Cirino PC, Tang Y, Takahashi K, Tirrell DA, Arnold FH (septiembre de 2003). "La incorporación global de norleucina en lugar de metionina en el dominio hemo BM-3 del citocromo P450 aumenta la actividad de la peroxigenasa". Biotecnología y bioingeniería . 83 (6): 729–734. doi :10.1002/bit.10718. PMID 12889037. S2CID 11380413.
- ^ Alvarez-Carreño C, Becerra A, Lazcano A (octubre de 2013). "La norvalina y la norleucina pueden haber sido componentes proteínicos más abundantes durante las primeras etapas de la evolución celular". Orígenes de la vida y evolución de la biosfera . 43 (4–5): 363–375. Bibcode :2013OLEB...43..363A. doi :10.1007/s11084-013-9344-3. PMID 24013929. S2CID 17224537.
- ^ Jukes TH (agosto de 1973). "La arginina como intruso evolutivo en la síntesis de proteínas". Biochemical and Biophysical Research Communications . 53 (3): 709–714. doi :10.1016/0006-291x(73)90151-4. PMID 4731949.
- ^ Ikeuchi Y, Kimura S, Numata T, Nakamura D, Yokogawa T, Ogata T, Wada T, Suzuki T, Suzuki T (abril de 2010). "La citidina conjugada con agmatina en un anticodón de ARNt es esencial para la decodificación de AUA en arqueas". Nature Chemical Biology . 6 (4): 277–282. doi :10.1038/nchembio.323. PMID 20139989.
- ^ Muramatsu T, Nishikawa K, Nemoto F, Kuchino Y, Nishimura S, Miyazawa T, Yokoyama S (noviembre de 1988). "Las especificidades de codón y aminoácido de un ARN de transferencia se convierten mediante una única modificación postranscripcional". Nature . 336 (6195): 179–181. Bibcode :1988Natur.336..179M. doi :10.1038/336179a0. PMID 3054566. S2CID 4371485.
- ^ Mino K, Ishikawa K (septiembre de 2003). "Una nueva reacción de sulfhidrilación de O-fosfo-L-serina catalizada por la sulfhidrilasa de O-acetilserina de Aeropyrum pernix K1". FEBS Letters . 551 (1–3): 133–138. doi : 10.1016/S0014-5793(03)00913-X . PMID 12965218. S2CID 28360765.
- ^ Karlheinz Drauz; Ian Grayson; Axel Kleemann; Hans-Peter Krimmer; Wolfgang Leuchtenberger; Christoph Weckbecker (2006). Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a02_057.pub2. ISBN 978-3527306732.
- ^ Barger G, Weichselbaum TE (1934). "dl-Metionina". Síntesis orgánicas . 14 : 58; Volúmenes recopilados , vol. 2, pág. 384.
- ^ "Metionina". WebMD .
- ^ Cavuoto P, Fenech MF (2012). "Una revisión de la dependencia de la metionina y el papel de la restricción de metionina en el control del crecimiento del cáncer y la prolongación de la esperanza de vida". Cancer Treatment Reviews . 38 (6): 726–736. doi :10.1016/j.ctrv.2012.01.004. PMID 22342103.
- ^ Cellarier E, Durando X, Vasson MP, Farges MC, Demiden A, Maurizis JC, Madelmont JC, Chollet P (2003). "Dependencia de metionina y tratamiento del cáncer". Cancer Treatment Reviews . 29 (6): 489–499. doi :10.1016/S0305-7372(03)00118-X. PMID 14585259.
- ^ Instituto de Medicina (2002). "Proteínas y aminoácidos". Ingestas dietéticas de referencia para energía, carbohidratos, fibra, grasas, ácidos grasos, colesterol, proteínas y aminoácidos . Washington, DC: The National Academies Press. págs. 589–768. doi :10.17226/10490. ISBN. 978-0-309-08525-0.
- ^ Finkelstein JD (mayo de 1990). "Metabolismo de la metionina en mamíferos". The Journal of Nutritional Biochemistry . 1 (5): 228–237. doi :10.1016/0955-2863(90)90070-2. PMID 15539209. S2CID 32264340.
- ^ Palika L (1996). Guía del consumidor sobre alimentos para perros: qué contiene el alimento para perros, por qué está ahí y cómo elegir el mejor alimento para su perro . Nueva York: Howell Book House. ISBN 978-0-87605-467-3.
- ^ Wood JM, Decker H, Hartmann H, Chavan B, Rokos H, Spencer JD, et al. (julio de 2009). "Encanecimiento del cabello senil: el estrés oxidativo mediado por H2O2 afecta el color del cabello humano al atenuar la reparación del sulfóxido de metionina". FASEB Journal . 23 (7): 2065–75. arXiv : 0706.4406 . doi : 10.1096/fj.08-125435 . hdl :10454/6241. PMID 19237503. S2CID 16069417.
- ^ Pinnen F, et al. (2009). "Cofármacos que vinculan L -dopa y antioxidantes que contienen azufre: nuevas herramientas farmacológicas contra la enfermedad de Parkinson". Journal of Medicinal Chemistry . 52 (2): 559–63. doi :10.1021/jm801266x. PMID 19093882.
- ^ Refsum H, Ueland PM, Nygård O, Vollset SE (1998). "Homocisteína y enfermedades cardiovasculares". Revista Anual de Medicina . 49 (1): 31–62. doi :10.1146/annurev.med.49.1.31. PMID 9509248.
- ^ Grimshaw, Jane (25 de julio de 2011) Usos y efectos secundarios de la metionina para perros. critters360.com
- ^ "Reglas y reglamentos". Registro Federal . 76 (49): 13501–13504. 14 de marzo de 2011.
- ^ Lewis DS, Cuda JP, Stevens BR (diciembre de 2011). "Un nuevo pesticida biorracional: eficacia de la metionina contra Heraclides (Papilio) cresphontes, un sustituto del invasor Princeps (Papilio) demoleus (Lepidoptera: Papilionidae)". Journal of Economic Entomology . 104 (6): 1986–1990. doi : 10.1603/ec11132 . PMID 22299361. S2CID 45255198.