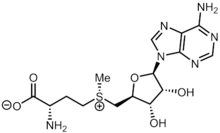
S-adenosil metionina
 | |
 | |
 | |
| Nombres | |
|---|---|
| Nombre sistemático de la IUPAC (2 S )-2-Amino-4-[( S )-{[(2 S ,3 S ,4 R ,5 R )-5-(4-amino-9 H -purin-9-il)-3,4-dihidroxioxolan-2-il]metil}metilsulfanioil]butanoato | |
| Otros nombres S -adenosil- L -metionina; SAM-e; SAMe, AdoMet , Heparab (India), ademetionina | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.045.391 |
| BARRIL | |
| Malla | S-adenosilmetionina |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C15H22N6O5S | |
| Masa molar | 398,44 g·mol −1 |
| Farmacología | |
| A16AA02 ( OMS ) | |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
La S -adenosil metionina ( SAM ), también conocida con los nombres comerciales de SAMe , SAM-e o AdoMet , es un cosustrato común que participa en las transferencias de grupos metilo , la transsulfuración y la aminopropilación. Aunque estas reacciones anabólicas ocurren en todo el cuerpo, la mayor parte de la SAM se produce y se consume en el hígado. [1] Se conocen más de 40 transferencias de metilo desde la SAM a varios sustratos como ácidos nucleicos , proteínas , lípidos y metabolitos secundarios . Se fabrica a partir de trifosfato de adenosina (ATP) y metionina por la metionina adenosiltransferasa . La SAM fue descubierta por primera vez por Giulio Cantoni en 1952. [1]
En las bacterias , la SAM está unida por el riboswitch SAM , que regula los genes implicados en la biosíntesis de metionina o cisteína . En las células eucariotas , la SAM actúa como regulador de una variedad de procesos, entre ellos la metilación del ADN , ARNt y ARNr ; la respuesta inmunitaria ; [2] el metabolismo de los aminoácidos; la transsulfuración ; y más. En las plantas, la SAM es crucial para la biosíntesis de etileno , una importante hormona vegetal y molécula de señalización. [3]
Estructura
La S -adenosil metionina está formada por el grupo adenosilo unido al azufre de la metionina, lo que le proporciona una carga positiva. Se sintetiza a partir de ATP y metionina por la enzima S -adenosilmetionina sintetasa mediante la siguiente reacción:
- ATP + L -metionina + H 2 O fosfato + difosfato + S -adenosil- L -metionina
El grupo funcional sulfonio presente en la S -adenosil metionina es el centro de su reactividad peculiar. Dependiendo de la enzima, la S -adenosil metionina puede convertirse en uno de tres productos:
- radical adenosilo, que se convierte en desoxiadenosina (AdO): reacción clásica de rSAM, también cogenera metionina
- S -adenosil homocisteína , liberando radical metilo
- metiltioadenosina (SMT), radical homoalanina
Bioquímica
Ciclo SAM
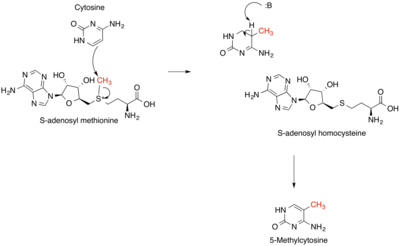
Las reacciones que producen, consumen y regeneran SAM se denominan ciclo SAM. En el primer paso de este ciclo, las metilasas dependientes de SAM (EC 2.1.1) que utilizan SAM como sustrato producen S -adenosil homocisteína como producto. [4] La S -adenosil homocisteína es un fuerte regulador negativo de casi todas las metilasas dependientes de SAM a pesar de su diversidad biológica. Esta es hidrolizada a homocisteína y adenosina por la S -adenosilhomocisteína hidrolasa EC 3.3.1.1 y la homocisteína se recicla de nuevo a metionina a través de la transferencia de un grupo metilo del 5-metiltetrahidrofolato , por una de las dos clases de metionina sintasas (es decir, dependiente de cobalamina (EC 2.1.1.13) o independiente de cobalamina (EC 2.1.1.14)). Esta metionina puede luego convertirse nuevamente en SAM, completando el ciclo. [5] En el paso limitante de la velocidad del ciclo SAM, la MTHFR (metilentetrahidrofolato reductasa) reduce irreversiblemente el 5,10-metilentetrahidrofolato a 5-metiltetrahidrofolato. [6]
Enzimas SAM radicales
Un gran número de enzimas escinden el SAM de forma reductiva para producir radicales: radical 5′-desoxiadenosilo 5′ , radical metilo y otros. Estas enzimas se denominan radicales SAM . Todas presentan un grupo hierro-azufre en sus sitios activos. [7] La mayoría de las enzimas con esta capacidad comparten una región de homología de secuencia que incluye el motivo CxxxCxxC o una variante cercana. Esta secuencia proporciona tres ligandos de tiolato de cisteinilo que se unen a tres de los cuatro metales en el grupo 4Fe-4S. El cuarto Fe se une al SAM.
Los intermediarios radicales generados por estas enzimas realizan una amplia variedad de reacciones químicas inusuales. Los ejemplos de enzimas SAM radicales incluyen la liasa de fotoproducto de esporas , las activasas de la liasa de formato de piruvato y las sulfatasas anaeróbicas, la lisina 2,3-aminomutasa y varias enzimas de biosíntesis de cofactores, modificación de péptidos, formación de grupos de metaloproteínas , modificación de ARNt , metabolismo de lípidos, etc. Algunas enzimas SAM radicales utilizan una segunda SAM como donante de metilo. Las enzimas SAM radicales son mucho más abundantes en bacterias anaeróbicas que en organismos aeróbicos. Se pueden encontrar en todos los dominios de la vida y están en gran parte inexploradas. Un estudio bioinformático reciente concluyó que esta familia de enzimas incluye al menos 114.000 secuencias que incluyen 65 reacciones únicas. [8]
Las deficiencias en las enzimas SAM radicales se han asociado con una variedad de enfermedades, incluidas la enfermedad cardíaca congénita , la esclerosis lateral amiotrófica y una mayor susceptibilidad viral. [8]
Biosíntesis de poliaminas
Otra función importante de la SAM es la biosíntesis de poliaminas . En este caso, la SAM es descarboxilada por la adenosilmetionina descarboxilasa (EC 4.1.1.50) para formar S -adenosilmetioninamina . Este compuesto luego dona su grupo n -propilamina en la biosíntesis de poliaminas como la espermidina y la espermina a partir de la putrescina . [9]
La SAM es necesaria para el crecimiento y la reparación celular. También participa en la biosíntesis de varias hormonas y neurotransmisores que afectan el estado de ánimo, como la epinefrina . Las metiltransferasas también son responsables de la adición de grupos metilo a los hidroxilos 2′ del primer y segundo nucleótidos junto a la tapa 5′ en el ARN mensajero . [10] [11]
Usos terapéuticos
Dolor de osteoartritis
En 2012, la evidencia no era concluyente en cuanto a si el SAM puede mitigar el dolor de la osteoartritis ; los ensayos clínicos que se habían realizado eran demasiado pequeños como para generalizar. [12]
Enfermedad del hígado
El ciclo SAM ha estado estrechamente vinculado al hígado desde 1947 porque las personas con cirrosis alcohólica del hígado acumularían grandes cantidades de metionina en su sangre. [13] Si bien múltiples líneas de evidencia de pruebas de laboratorio en células y modelos animales sugieren que SAM podría ser útil para tratar varias enfermedades hepáticas , hasta 2012 SAM no se había estudiado en ningún ensayo clínico aleatorizado controlado con placebo a gran escala que permitiera una evaluación de su eficacia y seguridad. [14] [15]
Depresión
Una revisión Cochrane de 2016 concluyó que, en el caso del trastorno depresivo mayor , "dada la ausencia de evidencia de alta calidad y la incapacidad de sacar conclusiones firmes basadas en esa evidencia, se debería investigar más a fondo el uso de SAMe para el tratamiento de la depresión en adultos". [16]
Una revisión sistemática de 2020 determinó que funcionó significativamente mejor que el placebo y tuvo resultados similares a otros antidepresivos de uso común (imipramina y escitalopram). [17]
Tratamiento contra el cáncer
Recientemente se ha demostrado que la SAM desempeña un papel en la regulación epigenética . La metilación del ADN es un regulador clave en la modificación epigenética durante el desarrollo y la diferenciación de las células de los mamíferos. En modelos de ratón, los niveles excesivos de SAM se han implicado en patrones de metilación erróneos asociados con la neuropatía diabética. La SAM actúa como donante de metilo en la metilación de la citosina, que es un proceso regulador epigenético clave. [18] Debido a este impacto en la regulación epigenética, la SAM se ha probado como un tratamiento contra el cáncer. En muchos cánceres, la proliferación depende de tener niveles bajos de metilación del ADN. Se ha demostrado que la adición in vitro en dichos cánceres remetila las secuencias promotoras de oncogenes y disminuye la producción de protooncogenes. [19] En cánceres como el cáncer colorrectal, la hipermetilación global aberrante puede inhibir las regiones promotoras de genes supresores de tumores. Contrariamente a la información anterior, los cánceres colorrectales (CCR) se caracterizan por hipometilación global y metilación del ADN específica del promotor. [20]
Farmacocinética
La SAM oral alcanza concentraciones plasmáticas máximas entre tres y cinco horas después de la ingestión de un comprimido con cubierta entérica (400–1000 mg). La vida media es de unos 100 minutos. [21]
Disponibilidad en diferentes países
En Canadá, el Reino Unido [22] y los Estados Unidos, el SAM se vende como suplemento dietético bajo el nombre comercial SAM-e (también escrito SAME o SAMe). [23] Se introdujo en los EE. UU. en 1999, después de que se aprobara la Ley de Salud y Educación sobre Suplementos Dietéticos en 1994. [24]
Se introdujo como medicamento de prescripción en Italia en 1979, en España en 1985 y en Alemania en 1989. [24] A partir de 2012, se vendió como medicamento de prescripción en Rusia, India, China, Italia, Alemania, Vietnam y México. [15]
Efectos adversos
El consumo de SAM puede provocar trastornos gastrointestinales, dispepsia y ansiedad . [21] Se desconocen los efectos a largo plazo. El SAM es un agente alquilante de ADN débil. [25]
Otro efecto secundario del SAM es el insomnio , por lo que el suplemento suele tomarse por la mañana. Otros efectos secundarios leves incluyen falta de apetito, estreñimiento, náuseas, sequedad de boca, sudoración y ansiedad/nerviosismo, pero en estudios controlados con placebo, estos efectos secundarios se producen con una incidencia similar en los grupos de placebo. [ cita médica requerida ]
Interacciones y contraindicaciones
Tomar SAM al mismo tiempo que algunos medicamentos puede aumentar el riesgo de síndrome serotoninérgico , una afección potencialmente peligrosa causada por un exceso de serotonina. Estos medicamentos incluyen, entre otros, dextrometorfano (Robitussin), meperidina (Demerol), pentazocina (Talwin) y tramadol (Ultram). [26]
El SAM también puede interactuar con muchos medicamentos antidepresivos, incluidos el triptófano y la medicina herbal Hypericum perforatum (hierba de San Juan), lo que aumenta el potencial de síndrome serotoninérgico u otros efectos secundarios, y puede reducir la eficacia de la levodopa para la enfermedad de Parkinson. [27] El SAM puede aumentar el riesgo de episodios maníacos en personas que tienen trastorno bipolar . [27]
Toxicidad
Un estudio de 2022 concluyó que la SAMe podría ser tóxica. Jean-Michel Fustin, de la Universidad de Manchester, dijo que los investigadores descubrieron que el exceso de SAMe se descompone en adenina y metiltioadenosina en el cuerpo, ambas produciendo el efecto paradójico de inhibir la metilación. Esto se encontró en ratones de laboratorio , causando daños a la salud, y en pruebas in vitro en células humanas. [28] [22]
Véase también
- ADN metiltransferasa
- Riboconmutador SAM-I
- Riboconmutador SAM-II
- Riboconmutador SAM-III
- Riboconmutador SAM-IV
- Riboconmutador SAM-V
- Riboconmutador SAM-VI
- Lista de antidepresivos en investigación
Referencias
- ^ ab Cantoni, GL (1952). "La naturaleza del donante de metilo activo formado enzimáticamente a partir de L-metionina y adenosina trifosfato". J Am Chem Soc . 74 (11): 2942–3. doi :10.1021/ja01131a519.
- ^ Ding, Wei; Smulan, Lorissa J.; Hou, Nicole S.; Taubert, Stefan; Watts, Jennifer L.; Walker, Amy K. (6 de octubre de 2015). "Los niveles de S-adenosilmetionina gobiernan la inmunidad innata a través de distintas vías dependientes de la metilación". Metabolismo celular . 22 (4): 633–645. doi :10.1016/j.cmet.2015.07.013. PMC 4598287 . PMID 26321661.
- ^ Wang, X.; Oh, MW; Komatsu, S. (1 de junio de 2016). "Caracterización de las sintetasas de S-adenosilmetionina en soja bajo estrés por inundación y sequía". Biologia Plantarum . 60 (2): 269–278. doi : 10.1007/s10535-016-0586-6 . ISSN 0006-3134. S2CID 15567646.
- ^ Finkelstein J, Martin J (2000). "Homocisteína". Revista internacional de bioquímica y biología celular . 32 (4): 385–9. doi :10.1016/S1357-2725(99)00138-7. PMID 10762063.
- ^ Födinger M, Hörl W, Sunder-Plassmann G (enero-febrero de 2000). "Biología molecular de la 5,10-metilentetrahidrofolato reductasa". J Nephrol . 13 (1): 20–33. PMID 10720211.
- ^ Goyette, P.; Sumner, JS; Milos, R.; Duncan, AM; Rosenblatt, DS; Matthews, RG; Rozen, R. (1994-06-01). "Metilenotetrahidrofolato reductasa humana: aislamiento de ADNc, mapeo e identificación de mutaciones". Nature Genetics . 7 (2): 195–200. doi :10.1038/ng0694-195. ISSN 1061-4036. PMID 7920641. S2CID 23877329.
- ^ Booker, SJ; Grove, TL (2010). "Versatilidad funcional y mecanicista de las enzimas SAM radicales". F1000 Biology Reports . 2 : 52. doi : 10.3410/B2-52 . PMC 2996862 . PMID 21152342.
- ^ ab Landgraf, Bradley J.; McCarthy, Erin L.; Booker, Squire J. (13 de junio de 2016). " Enzimas radicales S -adenosilmetionina en la salud y la enfermedad humanas". Revisión anual de bioquímica . 85 : 485–514. doi :10.1146/annurev-biochem-060713-035504. PMID 27145839.
- ^ Roje S (2006). " S -adenosil-L-metionina: más allá del donante universal de grupos metilo". Fitoquímica . 67 (15): 1686–98. Bibcode :2006PChem..67.1686R. doi :10.1016/j.phytochem.2006.04.019. PMID 16766004.
- ^ Loenen W (2006). " S -adenosilmetionina: ¿aprendiz de todo y maestro de todo?". Biochem Soc Trans . 34 (Pt 2): 330–3. doi :10.1042/BST20060330. PMID 16545107.
- ^ Chiang P, Gordon R, Tal J, Zeng G, Doctor B, Pardhasaradhi K, McCann P (1996). "S-adenosilmetionina y metilación". FASEB J . 10 (4): 471–80. doi : 10.1096/fasebj.10.4.8647346 . PMID 8647346. S2CID 11214528.
- ^ Rutjes, AW; Nüesch, E; Reichenbach, S; Jüni, P (7 de octubre de 2009). "S-adenosilmetionina para la osteoartritis de rodilla o cadera" (PDF) . Base de Datos Cochrane de Revisiones Sistemáticas . 2009 (4): CD007321. doi :10.1002/14651858.CD007321.pub2. PMC 7061276 . PMID 19821403.
- ^ Mato, Jose M (1997). " Síntesis de S -adenosilmetionina: mecanismos moleculares e implicaciones clínicas". Farmacología y terapéutica . 73 (3): 265–280. doi :10.1016/s0163-7258(96)00197-0. hdl : 10261/79246 . PMID 9175157.
- ^ Anstee, QM; Day, CP (noviembre de 2012). "Terapia con S-adenosilmetionina (SAMe) en la enfermedad hepática: una revisión de la evidencia actual y la utilidad clínica". Journal of Hepatology . 57 (5): 1097–109. doi : 10.1016/j.jhep.2012.04.041 . PMID 22659519.
- ^ ab Lu, SC; Mato, JM (octubre de 2012). "S-adenosilmetionina en la salud hepática, las lesiones y el cáncer". Physiological Reviews . 92 (4): 1515–42. doi :10.1152/physrev.00047.2011. PMC 3698976 . PMID 23073625.
- ^ Galizia, I; Oldani, L; Macritchie, K; Amari, E; Dougall, D; Jones, TN; Lam, RW; Massei, GJ; Yatham, LN; Young, AH (10 de octubre de 2016). "S-adenosil metionina (SAMe) para la depresión en adultos". Base de Datos Cochrane de Revisiones Sistemáticas . 2016 (10): CD011286. doi :10.1002/14651858.CD011286.pub2. PMC 6457972. PMID 27727432 .
- ^ Cuomo, Alessandro; Beccarini Crescenzi, Bruno; Bolognesi, Simone; Goracci, Arianna; Koukouna, Despoina; Rossi, Rodolfo; Fagiolini, Andrea (5 de septiembre de 2020). "S-adenosilmetionina (SAMe) en el trastorno depresivo mayor (TDM): una revisión sistemática orientada al médico". Anales de psiquiatría general . 19 (1). Springer Science and Business Media LLC: 50. doi : 10.1186/s12991-020-00298-z . ISSN 1744-859X. PMC 7487540 . PMID 32939220.
- ^ Varela-Rey, Marta (2014). "Los niveles de S-adenosilmetionina regulan el metiloma del ADN de las células de Schwann". Neuron . 81 (5): 1024–1039. doi :10.1016/j.neuron.2014.01.037. PMC 3960855 . PMID 24607226.
- ^ Schmidt, Thomas; Leha, Andreas; Salinas-Riester, Gabriela (31 de diciembre de 2016). "El tratamiento de células de cáncer de próstata con S -adenosilmetionina conduce a alteraciones en los perfiles de transcripción en todo el genoma". Gene . 595 (2): 161–167. doi :10.1016/j.gene.2016.09.032. PMID 27688072.
- ^ Tse, Janson (12 de septiembre de 2017). "Metilación aberrante del ADN en el cáncer colorrectal: ¿a qué debemos apuntar?". Biblioteca Nacional de Medicina . 3 (10): 698–712. doi :10.1016/j.trecan.2017.08.003. PMID 28958388.
- ^ ab Najm WI, Reinsch S, Hoehler F, Tobis JS, Harvey PW (febrero de 2004). "S-adenosil metionina (SAMe) versus celecoxib para el tratamiento de los síntomas de la osteoartritis: un ensayo cruzado doble ciego. ISRCTN36233495". BMC Musculoskelet Disord . 5 : 6. doi : 10.1186/1471-2474-5-6 . PMC 387830. PMID 15102339 .
- ^ ab McKie, Robin (10 de abril de 2022). "Los biólogos advierten contra el suplemento 'saludable' tóxico SAMe". The Observer .
- ^ Woolston, Chris (31 de diciembre de 2020). "¿Qué es SAM-e?". HealthDay . Archivado desde el original el 12 de agosto de 2020.
- ^ ab Bottiglieri, T (noviembre de 2002). "S-adenosil-L-metionina (SAMe): del laboratorio a la cabecera del paciente: base molecular de una molécula pleiotrófica". The American Journal of Clinical Nutrition . 76 (5): 1151S–1157S. doi : 10.1093/ajcn/76.5.1151S . PMID 12418493.
- ^ Rydberg B, Lindahl T (1982). "La metilación no enzimática del ADN por el donante intracelular de grupos metilo S-adenosil-L-metionina es una reacción potencialmente mutagénica". EMBO J . 1 (2): 211–6. doi :10.1002/j.1460-2075.1982.tb01149.x. PMC 553022 . PMID 7188181.
- ^ "SAMe - Clínica Mayo". Clínica Mayo .
- ^ ab "S-adenosil-L-metionina (SAMe): en profundidad". Centro Nacional de Salud Complementaria e Integral (NCCIH). 11 de enero de 2017.
- ^ Fukumoto, Kazuki; Ito, Kakeru; Saer, Benjamin; Taylor, George; Ye, Shiqi; Yamano, Mayu; Toriba, Yuki; Hayes, Andrew; Okamura, Hitoshi; Fustin, Jean-Michel (5 de abril de 2022). "El exceso de S-adenosilmetionina inhibe la metilación a través del catabolismo a adenina". Communications Biology . 5 (1). Nature Publishing Group : 313. doi : 10.1038/s42003-022-03280-5 . hdl : 2433/269415 . ISSN 2399-3642. PMC 8983724 . PMID 35383287.
Enlaces externos
- Número EINECS 249-946-8
- Shippy, R Andrew; Mendez, Douglas; Jones, Kristina; Cergnul, Irene; Karpiak, Stephen E (2004). "S-adenosilmetionina (SAM-e) para el tratamiento de la depresión en personas que viven con VIH/SIDA". BMC Psychiatry . 4 : 38. doi : 10.1186/1471-244X-4-38 . PMC 535560 . PMID 15538952.



