Propionil-CoA
 | |
| Nombres | |
|---|---|
| Nombre IUPAC 3′- O -Fosfonoadenosina 5′-{(3 R )-3-hidroxi-2,2-dimetil-4-oxo-4-[(3-oxo-3-{[2-(propanoilsulfanil)etil]amino}propil)amino]butil dihidrógeno difosfato} | |
| Nombre sistemático de la IUPAC O 1 -{[(2 R ,3 S ,4 R ,5 R )-5-(6-Amino-9 H -purin-9-il)-4-hidroxi-3-(fosfonooxi)oxolan-2-il]metil} O 3 -{(3 R )-3-hidroxi-2,2-dimetil-4-oxo-4-[(3-oxo-3-{[2-(propanoilsulfanil)etil]amino}propil)amino]butil} dihidrógeno difosfato | |
| Otros nombres Propionil coenzima A; Propanoil coenzima A | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh |
|
| Araña química | |
| Tarjeta informativa de la ECHA | 100.005.698 |
| Malla | propionil-coenzima+A |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C24H40N7O17P3S | |
| Masa molar | 823,60 g/mol |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El propionil-CoA es un derivado de la coenzima A del ácido propiónico . Está compuesto por una cadena de 24 carbonos en total (sin la coenzima, es una estructura de 3 carbonos) y su producción y destino metabólico dependen del organismo en el que esté presente. [1] Varias vías diferentes pueden conducir a su producción, como a través del catabolismo de aminoácidos específicos o la oxidación de ácidos grasos de cadena impar . [2] Posteriormente puede descomponerse por la carboxilasa del propionil-CoA o a través del ciclo del metilcitrato. [3] Sin embargo, en diferentes organismos, el propionil-CoA puede secuestrarse en regiones controladas, para aliviar su posible toxicidad a través de la acumulación. [4] Las deficiencias genéticas con respecto a la producción y descomposición del propionil-CoA también tienen una gran importancia clínica y humana. [5]
Producción
Existen varias vías diferentes a través de las cuales se puede producir propionil-CoA:
- El propionil-CoA, una estructura de tres carbonos, se considera una especie menor del ácido propiónico. Por lo tanto, las cadenas impares de ácidos grasos se oxidan para producir tanto propionil-CoA como acetil-CoA . El propionil-CoA se convierte luego en succinil-CoA a través de la propionil-CoA carboxilasa (PCC) dependiente de biotina y la metilmalonil-CoA mutasa (MCM) dependiente de b12, secuencialmente. [2]
- El propionil-CoA no solo se produce a partir de la oxidación de ácidos grasos de cadena impar, sino también de la oxidación de aminoácidos como la metionina , la valina , la isoleucina y la treonina . Además, el catabolismo de los aminoácidos también puede ser resultado de la conversión de propionil-CoA en metilmalonil-CoA por la carboxilasa de propionil-CoA . [1]
- La oxidación del colesterol , que forma los ácidos biliares , también forma propionil-CoA como producto secundario. En un experimento realizado por Suld et al., al combinar mitocondrias hepáticas y ácido propiónico con la adición de coenzima A, se degradaron los isótopos marcados del ácido psiónico. Sin embargo, después de la incubación con 5β-colestano-3α,7α,12α,26-tetrol-26,27-C14, se pudo rescatar el propionil-CoA junto con la formación de bilis . [6]
Destino metabólico
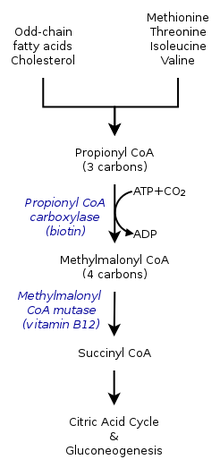
El destino metabólico (catabolismo) del propionil-CoA depende del entorno en el que se sintetiza. Por lo tanto, el propionil-CoA en un entorno anaeróbico podría tener un destino diferente al de un organismo aeróbico . Las múltiples vías de catabolismo, ya sea por la carboxilasa del propionil-CoA o por la metilcitrato sintasa, también dependen de la presencia de varios genes. [7]
Reacción con propionil-CoA carboxilasa
Dentro del ciclo del ácido cítrico en humanos, el propionil-CoA, que interactúa con el oxaloacetato para formar metilcitrato, también puede catalizarse en metilmalonil-CoA a través de la carboxilación por la propionil-CoA carboxilasa (PCC). La metilmalonil-CoA se transforma posteriormente en succinil-CoA para su posterior uso en el ciclo del ácido tricarboxílico . La PCC no solo cataliza la carboxilación del propionil-CoA a metilmalonil-CoA, sino que también actúa sobre varios acil-CoA diferentes. Sin embargo, su mayor afinidad de unión es con el propionil-CoA. Además, se demostró que la transformación del propionil-CoA se inhibe por la ausencia de varios marcadores de TCA , como el glutamato . El mecanismo se muestra en la figura de la izquierda. [2]
Mecanismo
En los mamíferos, el propionil-CoA se convierte en ( S ) -metilmalonil-CoA por acción de la propionil-CoA carboxilasa , una enzima dependiente de biotina que también requiere bicarbonato y ATP .
Este producto se convierte en ( R )-metilmalonil-CoA por la metilmalonil-CoA racemasa .
( R )-Metilmalonil-CoA se convierte en succinil-CoA , un intermediario en el ciclo del ácido tricarboxílico , por la metilmalonil-CoA mutasa , una enzima que requiere

cobalamina para catalizar la migración del enlace carbono-carbono.
El mecanismo de la metilmalonil-CoA mutasa comienza con la ruptura del enlace entre el CH 5'
2- de 5'-desoxiadenosilo y el cobalto, que se encuentra en su estado de oxidación 3+ (III), lo que produce un radical 5'-desoxiadenosilo y cobalamina en el estado de oxidación reducido Co(II).
A continuación, este radical extrae un átomo de hidrógeno del grupo metilo del metilmalonil-CoA, lo que genera un radical metilmalonil-CoA. Se cree que este radical forma un enlace carbono-cobalto con la coenzima, al que luego le sigue la reorganización del esqueleto carbonado del sustrato, produciendo así un radical succinil-CoA. Este radical luego extrae un hidrógeno de la 5'-desoxiadenosina producida previamente, creando nuevamente un radical desoxiadenosilo, que ataca a la coenzima para reformar el complejo inicial.
Un defecto en la enzima metilmalonil-CoA mutasa produce aciduria metilmalónica , un trastorno peligroso que causa una disminución del pH de la sangre. [8]

Ciclo del metilcitrato
La acumulación de propionil-CoA puede resultar tóxica para diferentes organismos. Dado que se han propuesto diferentes ciclos con respecto a cómo el propionil-CoA se transforma en piruvato, un mecanismo estudiado es el ciclo del metilcitrato . La reacción inicial es la beta-oxidación para formar el propionil-CoA que se descompone aún más por el ciclo. Esta vía involucra a las enzimas relacionadas tanto con el ciclo del metilcitrato como con el ciclo del ácido cítrico . Todas ellas contribuyen a la reacción general para desintoxicar las bacterias del propionil-CoA dañino. También se atribuye como una vía resultante debido al catabolismo de los ácidos grasos en las micobacterias. [3] Para continuar, el gen prpC codifica la metilcitrato sintasa y, si no está presente, el ciclo del metilcitrato no se producirá. En cambio, el catabolismo se produce a través de la propionil-CoA carboxilasa. [7] Este mecanismo se muestra a continuación a la izquierda junto con los reactivos, productos, intermediarios y enzimas participantes.
Metabolismo bacteriano
Micobacteria tuberculosismetabolismo
La oxidación de propionil-CoA para formar piruvato está influenciada por su necesidad en Mycobacterium tuberculosis . La acumulación de propionil-CoA puede conducir a efectos tóxicos. En Mycobacterium tuberculosis , se ha sugerido que el metabolismo de propionil-CoA está involucrado en la biogénesis de la pared celular . Por lo tanto, la falta de dicho catabolismo aumentaría la susceptibilidad de la célula a varias toxinas, particularmente a los mecanismos antimicrobianos de los macrófagos . Otra hipótesis con respecto al destino del propionil-CoA, en M. tuberculosis , es que dado que el propionil-CoA se produce por catabolismo de ácidos grasos de cadena impar beta, el ciclo del metilcitrato se activa posteriormente para negar cualquier toxicidad potencial, actuando como un mecanismo de amortiguación. [11]
Posible secuestro enR. sphaeroides
El propionil-CoA puede tener muchos efectos adversos y tóxicos en diferentes especies, incluidas las bacterias . Por ejemplo, la inhibición de la piruvato deshidrogenasa por una acumulación de propionil-CoA en Rhodobacter sphaeroides puede resultar mortal. Además, al igual que con E. coli , una afluencia de propionil-CoA en especies de Myobacterial puede resultar tóxica si no se trata de inmediato. Esta toxicidad es causada por una vía que involucra a los lípidos que forman la pared celular bacteriana . Mediante la esterificación de ácidos grasos de cadena larga, el exceso de propionil-CoA puede secuestrarse y almacenarse en el lípido, triacilglicerol (TAG), lo que conduce a la regulación de los niveles elevados de propionil-CoA. Tal proceso de ramificación de metilo de los ácidos grasos hace que actúen como sumideros para la acumulación de propion [4]
Escherichia colimetabolismo
En una investigación realizada por Luo et al., se utilizaron cepas de Escherichia coli para examinar cómo el metabolismo del propionil-CoA podría conducir potencialmente a la producción de ácido 3-hidroxipropiónico (3-HP). Se demostró que una mutación en un gen clave involucrado en la vía, la succinato CoA-transferasa, condujo a un aumento significativo del 3-HP. [7] Sin embargo, este es todavía un campo en desarrollo y la información sobre este tema es limitada. [12]

Metabolismo vegetal
El metabolismo de aminoácidos en plantas ha sido considerado un tema controvertido, debido a la falta de evidencia concreta de alguna vía en particular. Sin embargo, se ha sugerido que las enzimas relacionadas con la producción y uso de propionil-CoA están involucradas. Asociado con esto está el metabolismo de isobutiril-CoA . Estas dos moléculas se consideran intermediarias en el metabolismo de valina . Como el propionato consiste en la forma de propionil-CoA, se descubrió que el propionil-CoA se convierte en β-hidroxipropionato a través de una vía de β-oxidación enzimática peroxisomal . Sin embargo, en la planta Arabidopsis , no se observaron enzimas clave en la conversión de valina a propionil-CoA. A través de diferentes experimentos realizados por Lucas et al., se ha sugerido que en plantas, a través de enzimas peroxisomales , el propionil-CoA (y el isobutiril-CoA ) están involucrados en el metabolismo de muchos sustratos diferentes (actualmente se está evaluando su identidad), y no solo la valina . [13]

Metabolismo de los hongos
La producción de propionil-CoA a través del catabolismo de los ácidos grasos también está asociada con la tioesterificación . En un estudio sobre Aspergillus nidulans , se encontró que con la inhibición de un gen de metilcitrato sintasa , mcsA , de la vía descrita anteriormente, también se inhibió la producción de distintos policétidos . Por lo tanto, la utilización de propionil-CoA a través del ciclo del metilcitrato disminuye su concentración, mientras que posteriormente aumenta la concentración de policétidos. Un policétido es una estructura que se encuentra comúnmente en los hongos y que está hecha de acetil y malonil -CoA, lo que proporciona un producto con grupos carbonilo y grupos metileno alternados . Los policétidos y los derivados de policétidos a menudo son muy complejos estructuralmente y varios son altamente tóxicos. Esto ha llevado a la investigación sobre la limitación de la toxicidad de los policétidos en los cultivos agrícolas a través de hongos fitopatógenos . [14]
Propionilación de proteínas
El propionil-CoA también es un sustrato para la modificación postraduccional de proteínas al reaccionar con residuos de lisina en las proteínas, una reacción llamada propionilación de proteínas . [15] [16] Debido a las similitudes estructurales del acetil-CoA y el propionil-CoA, se cree que la reacción de propionilación utiliza muchas de las mismas enzimas utilizadas para la acetilación de proteínas. [16] Aunque las consecuencias funcionales de la propionilación de proteínas actualmente no se comprenden por completo, la propionilación in vitro de la enzima propionil-CoA sintetasa controla su actividad. [17]
Importancia clínica y humana

Gen5
De manera similar a cómo las enzimas peroxisomales de las plantas se unen al propionil-CoA y al isobutiliril-CoA, Gen5, una acetiltransferasa en humanos, se une al propionil-CoA y al butiril-CoA . Estos se unen específicamente al dominio catalítico de Gen5L2 . Esta acetiltransferasa conservada es responsable de la regulación de la transcripción por acetilación de lisina de las colas N-terminales de las histonas . Esta función de acetilación tiene una velocidad de reacción mucho mayor que la propionilación o la butirilación. Debido a la estructura del propionil-CoA, Gen5 distingue entre diferentes moléculas de acil-CoA . De hecho, se encontró que el grupo propilo del butiril-CoA no puede unirse debido a la falta de estereoespecificidad al sitio de unión activo de Gen5 debido a las cadenas de acilo insaturadas . Por otro lado, el tercer carbono del propionil-CoA puede encajar en el sitio activo de Gen5 con la orientación correcta. [18]
Acidemia propiónica
En las etapas de desarrollo neonatal , la acidemia propiónica , que es un problema médico definido como la falta de propionil-CoA carboxilasa, puede causar deterioro, discapacidad mental y muchos otros problemas. Esto es causado por una acumulación de propionil-CoA porque no se puede convertir en metilmalonil-CoA . A los recién nacidos se les realiza una prueba para detectar niveles elevados de propionilcarnitina. Otras formas de diagnosticar esta enfermedad incluyen muestras de orina. Los medicamentos que se utilizan para ayudar a revertir y prevenir los síntomas recurrentes incluyen el uso de suplementos para disminuir la producción de propionato . [5]
Referencias
- ^ ab Dasgupta A (1 de enero de 2019). "Capítulo 2: Biotina: farmacología, fisiopatología y evaluación del estado de la biotina". En Dasgupta A (ed.). Biotina y otras interferencias en los inmunoensayos . Elsevier. págs. 17–35. doi :10.1016/B978-0-12-816429-7.00002-2. ISBN 9780128164297.
- ^ abc Wongkittichote P, Ah Mew N, Chapman KA (diciembre de 2017). "Propionil-CoA carboxilasa: una revisión". Genética molecular y metabolismo . 122 (4): 145–152. doi :10.1016/j.ymgme.2017.10.002. PMC 5725275 . PMID 29033250.
- ^ ab Upton AM, McKinney JD (diciembre de 2007). "El papel del ciclo del metilcitrato en el metabolismo y la desintoxicación del propionato en Mycobacterium smegmatis". Microbiología . 153 (Pt 12): 3973–82. doi : 10.1099/mic.0.2007/011726-0 . PMID 18048912.
- ^ ab Dolan SK, Wijaya A, Geddis SM, Spring DR, Silva-Rocha R, Welch M (marzo de 2018). "Amar el veneno: el ciclo del metilcitrato y la patogénesis bacteriana". Microbiología . 164 (3): 251–259. doi : 10.1099/mic.0.000604 . PMID 29458664.
- ^ ab Shchelochkov OA, Carrillo N, Venditti C (1993). "Acidemia propiónica". En Adam MP, Ardinger HH, Pagon RA, Wallace SE, Bean LJ, Stephens K, Amemiya A (eds.). GeneReviews® . Universidad de Washington, Seattle. PMID 22593918 . Consultado el 13 de junio de 2019 .
- ^ Suld HM, Staple E, Gurin S (febrero de 1962). "Mecanismo de formación de ácidos biliares a partir del colesterol: oxidación de 5bita-choles-tane-3alpha,7alpha,12alpha-triol y formación de ácido propiónico a partir de la cadena lateral por mitocondrias de hígado de rata" (PDF) . The Journal of Biological Chemistry . 237 (2): 338–44. doi : 10.1016/S0021-9258(18)93925-6 . PMID 13918291.
- ^ abc Luo H, Zhou D, Liu X, Nie Z, Quiroga-Sánchez DL, Chang Y (2016-05-26). "Producción de ácido 3-hidroxipropiónico a través de la vía propionil-CoA utilizando cepas recombinantes de Escherichia coli". PLOS ONE . 11 (5): e0156286. Bibcode :2016PLoSO..1156286L. doi : 10.1371/journal.pone.0156286 . PMC 4882031 . PMID 27227837.
- ^ Halarnkar PP, Blomquist GJ (1 de enero de 1989). "Aspectos comparativos del metabolismo del propionato". Comparative Biochemistry and Physiology. B, Comparative Biochemistry . 92 (2): 227–31. doi :10.1016/0305-0491(89)90270-8. PMID 2647392.
- ^ Liu WB, Liu XX, Shen MJ, She GL, Ye BC (abril de 2019). "El regulador de nitrógeno GlnR controla directamente la transcripción del operón prpDBC involucrado en el ciclo del metilcitrato en Mycobacterium smegmatis". Revista de bacteriología . 201 (8). doi :10.1128/JB.00099-19. PMC 6436344 . PMID 30745367.
- ^ Ryan DG, Murphy MP, Frezza C, Prag HA, Chouchani ET, O'Neill LA, Mills EL (enero de 2019). "Acoplamiento de los metabolitos del ciclo de Krebs a la señalización en la inmunidad y el cáncer". Nature Metabolism . 1 (1): 16–33. doi :10.1038/s42255-018-0014-7. PMC 6485344 . PMID 31032474.
- ^ Muñoz-Elías EJ, Upton AM, Cherian J, McKinney JD (junio de 2006). "El papel del ciclo del metilcitrato en el metabolismo, el crecimiento intracelular y la virulencia de Mycobacterium tuberculosis". Microbiología molecular . 60 (5): 1109–22. doi :10.1111/j.1365-2958.2006.05155.x. PMID 16689789.
- ^ Han J, Hou J, Zhang F, Ai G, Li M, Cai S, et al. (mayo de 2013). "Vías de suministro de propionil coenzima A múltiples para la producción del bioplástico poli(3-hidroxibutirato-co-3-hidroxivalerato) en Haloferax mediterranei". Microbiología Aplicada y Ambiental . 79 (9): 2922–31. Bibcode :2013ApEnM..79.2922H. doi :10.1128/AEM.03915-12. PMC 3623125 . PMID 23435886.
- ^ Lucas KA, Filley JR, Erb JM, Graybill ER, Hawes JW (agosto de 2007). "Metabolismo peroxisomal del ácido propiónico y del ácido isobutírico en plantas". The Journal of Biological Chemistry . 282 (34): 24980–9. doi : 10.1074/jbc.M701028200 . PMID 17580301.
- ^ Zhang YQ, Brock M, Keller NP (octubre de 2004). "Conexión del metabolismo de propionil-CoA con la biosíntesis de policétidos en Aspergillus nidulans". Genética . 168 (2): 785–94. doi :10.1534/genetics.104.027540. PMC 1448837 . PMID 15514053.
- ^ Chen Y, Sprung R, Tang Y, Ball H, Sangras B, Kim SC, et al. (mayo de 2007). "La propionilación y butirilación de lisina son nuevas modificaciones postraduccionales en las histonas". Molecular & Cellular Proteomics . 6 (5): 812–9. doi : 10.1074/mcp.M700021-MCP200 . PMC 2911958 . PMID 17267393.
- ^ ab Cheng Z, Tang Y, Chen Y, Kim S, Liu H, Li SS, et al. (enero de 2009). "Caracterización molecular de propionilisinas en proteínas no histónicas". Molecular & Cellular Proteomics . 8 (1): 45–52. doi : 10.1074/mcp.M800224-MCP200 . PMC 2621001 . PMID 18753126.
- ^ Garrity J, Gardner JG, Hawse W, Wolberger C, Escalante-Semerena JC (octubre de 2007). "La propionilación de N-lisina controla la actividad de la propionil-CoA sintetasa". The Journal of Biological Chemistry . 282 (41): 30239–45. doi : 10.1074/jbc.m704409200 . PMID 17684016.
- ^ Ringel AE, Wolberger C (julio de 2016). "Base estructural para la discriminación de grupos acilo por Gcn5L2 humano". Acta Crystallographica Sección D . 72 (Pt 7): 841–8. Bibcode :2016AcCrD..72..841R. doi :10.1107/S2059798316007907. PMC 4932917 . PMID 27377381.


