Cistationina gamma-sintasa
| cistationina gamma-sintasa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Homotetrámero de cistationina gamma-sintasa, Helicobacter pylori | |||||||||
| Identificadores | |||||||||
| N.º CE | 2.5.1.48 | ||||||||
| N.º CAS | 9030-70-0 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista de IntEnz | ||||||||
| BRENDA | Entrada de BRENDA | ||||||||
| Expasí | Vista de NiceZyme | ||||||||
| BARRIL | Entrada de KEGG | ||||||||
| MetaCiclo | vía metabólica | ||||||||
| PRIAMO | perfil | ||||||||
| Estructuras del PDB | RCSB AP APBE APSUMA | ||||||||
| Ontología genética | AmiGO / QuickGO | ||||||||
| |||||||||
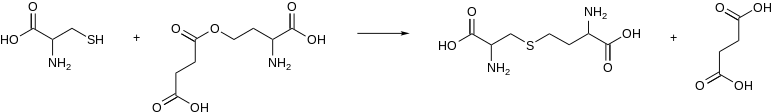
En enzimología , una cistationina gamma-sintasa ( EC 2.5.1.48) es una enzima que cataliza la formación de cistationina a partir de cisteína y un derivado activado de homoserina , por ejemplo:
En los microorganismos, el sustrato activado de esta enzima es la O4-succinil-L-homoserina o la O4-acetil-L-homoserina. La cistationina gamma-sintasa de las plantas utiliza en su lugar el fosfato de L-homoserina. [1]
Esta enzima pertenece a la familia de las transferasas , específicamente aquellas que transfieren grupos arilo o alquilo distintos de los grupos metilo. El nombre sistemático de esta clase de enzimas es O4-succinil-L-homoserina:L-cisteína S-(3-amino-3-carboxipropil)transferasa . Otros nombres de uso común incluyen O-succinil-L-homoserina succinato-liasa (adición de cisteína) , O-succinilhomoserina (tiol)-liasa , homoserina O-transsuccinilasa , O-succinilhomoserina sintasa , O-succinilhomoserina sintetasa , cistationina sintasa , cistationina sintetasa , homoserina transsuccinilasa , 4-O-succinil-L-homoserina:L-cisteína y S-(3-amino-3-carboxipropil)transferasa . Esta enzima participa en cuatro vías metabólicas : metabolismo de la metionina , metabolismo de la cisteína , metabolismo del selenio y metabolismo del azufre . Utiliza un cofactor , el fosfato de piridoxal .
Referencias
- ^ Steegborn C, Laber B, Messerschmidt A, Huber R, Clausen T (agosto de 2001). "Las estructuras cristalinas de los complejos inhibidores de la cistationina gamma-sintasa racionalizan la mayor afinidad de un nuevo inhibidor". Journal of Molecular Biology . 311 (4): 789–801. doi :10.1006/jmbi.2001.4880. PMID 11518531.
- Flavin M, Slaughter C (marzo de 1967). "Síntesis enzimática de homocisteína o metionina directamente a partir de O-succinil-homoserina". Biochimica et Biophysica Acta . 132 (2): 400–5. doi :10.1016/0005-2744(67)90158-1. PMID 5340123.
- Kaplan MM, Flavin M (octubre de 1966). "Cistationina gamma-sintetasa de Salmonella. Propiedades catalíticas de una nueva enzima en la biosíntesis bacteriana de metionina". The Journal of Biological Chemistry . 241 (19): 4463–71. doi : 10.1016/S0021-9258(18)99743-7 . PMID 5922970.
- Wiebers JL, Garner HR (enero de 1967). "Homocisteína y cisteína sintetasas de Neurospora crassa. Purificación, propiedades y control de retroalimentación de la actividad". The Journal of Biological Chemistry . 242 (1): 12–23. doi : 10.1016/S0021-9258(18)96312-X . PMID 6016326.
- Wiebers JL, Garner HR (diciembre de 1967). "Derivados acilo de homoserina como sustratos para la síntesis de homocisteína en Neurospora crassa, levadura y Escherichia coli". The Journal of Biological Chemistry . 242 (23): 5644–9. doi : 10.1016/S0021-9258(18)99405-6 . PMID 12325384.
- Clausen T, Huber R, Prade L, Wahl MC, Messerschmidt A (diciembre de 1998). "Estructura cristalina de la cistationina gamma-sintasa de Escherichia coli a una resolución de 1,5 A". The EMBO Journal . 17 (23): 6827–38. doi :10.1093/emboj/17.23.6827. PMC 1171030 . PMID 9843488.
- Ravanel S, Gakière B, Job D, Douce R (abril de 1998). "Cystationine gamma-synthase from Arabidopsis thaliana: purification and biochemical characterization of the recombinant enzima overexpresed in Escherichia coli". The Biochemical Journal . 331 (Pt 2) (2): 639–48. doi :10.1042/bj3310639. PMC 1219399 . PMID 9531508.