Acetil-CoA
Este artículo tiene varios problemas. Ayúdenos a mejorarlo o a discutir estos problemas en la página de discusión . ( Aprenda cómo y cuándo eliminar estos mensajes )
|
 | |
 | |
 | |
| Nombres | |
|---|---|
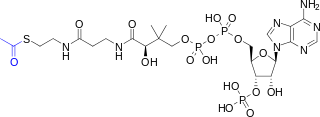
| Nombre IUPAC preferido O 1 -{(3 R )-4-[(3-{[2-(Acetilsulfanil)etil]amino}-3-oxopropil)amino]-3-hidroxi-2,2-dimetil-4-oxobutil} O 3 -{[(2 R ,3 S ,4 R ,5 R )-5-(6-amino-9 H -purin-9-il)-4-hidroxi-3-(fosfonooxi)oxolan-2-il]metil} dihidrógeno difosfato | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.000.719 |
| |
| BARRIL | |
| Malla | Acetilo+Coenzima+A |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C23H38N7O17P3S | |
| Masa molar | 809,57 g·mol −1 |
| UV-vis (λmáx . ) | 260 nm; 232 nm [1] |
| Absorbancia | ε 260 = 16,4 mM −1 cm −1 (adenosina) [1] ε 232 = 8,7 mM −1 cm −1 (tioéster) [1] Δ ε 232 en hidrólisis de tioéster = −4,5 mM −1 cm −1 [1] |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
La acetil-CoA ( acetil coenzima A ) es una molécula que participa en muchas reacciones bioquímicas en el metabolismo de proteínas, carbohidratos y lípidos . [2] Su función principal es entregar el grupo acetilo al ciclo del ácido cítrico (ciclo de Krebs) para ser oxidado para la producción de energía.
La coenzima A (CoASH o CoA) está formada por un grupo β-mercaptoetilamina unido al ácido pantoténico (vitamina B5) a través de un enlace amida [3] y ADP 3'-fosforilado. El grupo acetilo (indicado en azul en el diagrama estructural de la derecha) de la acetil-CoA está unido al sustituyente sulfhidrilo del grupo β-mercaptoetilamina. Este enlace tioéster es un enlace de "alta energía", que es particularmente reactivo. La hidrólisis del enlace tioéster es exergónica (−31,5 kJ/mol).
El CoA se acetila a acetil-CoA mediante la descomposición de carbohidratos a través de la glucólisis y mediante la descomposición de ácidos grasos a través de la β-oxidación . Luego, el acetil-CoA ingresa al ciclo del ácido cítrico, donde el grupo acetilo se oxida a dióxido de carbono y agua, y la energía liberada se captura en forma de 11 ATP y un GTP por grupo acetilo.
Konrad Bloch y Feodor Lynen recibieron el Premio Nobel de Fisiología o Medicina en 1964 por sus descubrimientos que vinculaban el acetil-CoA con el metabolismo de los ácidos grasos. Fritz Lipmann ganó el Premio Nobel en 1953 por su descubrimiento del cofactor coenzima A. [4]
Role
El acetil-CoA es un intermediario metabólico que interviene en muchas vías metabólicas en un organismo. Se produce durante la descomposición de la glucosa , los ácidos grasos y los aminoácidos , y se utiliza en la síntesis de muchas otras biomoléculas , incluidos el colesterol , los ácidos grasos y los cuerpos cetónicos . El acetil-CoA también es una molécula clave en el ciclo del ácido cítrico , que es una serie de reacciones químicas que ocurren en las mitocondrias de las células y es responsable de generar energía en forma de ATP . [5] [6]
Además, el acetil-CoA es un precursor para la biosíntesis de varias sustancias químicas acetiladas, actuando como intermediario para transferir un grupo acetilo durante la biosíntesis de dichas sustancias químicas acetiladas. El acetil-CoA también participa en la regulación de varios mecanismos celulares al proporcionar grupos acetilo a residuos de aminoácidos específicos para reacciones de acetilación postraduccional de proteínas.
Biosíntesis
La acetilación de CoA está determinada por las fuentes de carbono. [7] [8]
Extramitocondrial
- Cuando los niveles de glucosa son altos , la glucólisis se produce rápidamente, aumentando así la cantidad de citrato producido a partir del ciclo del ácido cítrico . Este citrato se exporta luego a otros orgánulos fuera de las mitocondrias para ser descompuesto en acetil-CoA y oxaloacetato por la enzima ATP citrato liasa (ACL). Esta reacción principal está acoplada con la hidrólisis del ATP. [9] [10]
- En niveles bajos de glucosa:
- La CoA se acetila utilizando acetato por la acetil-CoA sintetasa (ACS), también acoplada con la hidrólisis de ATP . [11]
- El etanol también sirve como fuente de carbono para la acetilación de CoA utilizando la enzima alcohol deshidrogenasa . [12]
- Se produce la degradación de aminoácidos cetogénicos de cadena ramificada como valina , leucina e isoleucina . Estos aminoácidos se convierten en α-cetoácidos por transaminación y, finalmente, en isovaleril-CoA mediante descarboxilación oxidativa por un complejo de α-cetoácido deshidrogenasa. El isovaleril-CoA sufre deshidrogenación , carboxilación e hidratación para formar otro intermediario derivado de CoA antes de escindirse en acetil-CoA y acetoacetato . [13] [ página necesaria ]
Intramitocondrial

- A niveles altos de glucosa, se produce acetil-CoA a través de la glucólisis . [14] El piruvato sufre una descarboxilación oxidativa en la que pierde su grupo carboxilo (como dióxido de carbono ) para formar acetil-CoA, emitiendo 33,5 kJ/mol de energía. La conversión oxidativa de piruvato en acetil-CoA se conoce como reacción de la piruvato deshidrogenasa . Es catalizada por el complejo de la piruvato deshidrogenasa . Son posibles otras conversiones entre piruvato y acetil-CoA. Por ejemplo, la piruvato formiato liasa desproporciona el piruvato en acetil-CoA y ácido fórmico .

- En niveles bajos de glucosa, la producción de acetil-CoA está vinculada a la β-oxidación de los ácidos grasos . Los ácidos grasos primero se convierten en acil-CoA. Luego, el acil-CoA se degrada en un ciclo de cuatro pasos de oxidación , hidratación , oxidación y tiolisis catalizado por cuatro enzimas respectivas, a saber, acil-CoA deshidrogenasa , enoil-CoA hidratasa , 3-hidroxiacil-CoA deshidrogenasa y tiolasa . El ciclo produce una nueva cadena de ácidos grasos con dos carbonos menos y acetil-CoA como subproducto. [15]
Funciones
Intermedios en diversas vías
- En la respiración celular
- Ciclo del ácido cítrico :
- A través de una serie de reacciones químicas, la energía almacenada se libera mediante la oxidación del acetil-CoA derivado de carbohidratos, grasas y proteínas en trifosfato de adenosina (ATP) y dióxido de carbono .
- Metabolismo de los ácidos grasos
- El acetil-CoA se produce por la descomposición de carbohidratos (por glucólisis ) y lípidos (por β-oxidación ). Luego ingresa al ciclo del ácido cítrico en la mitocondria al combinarse con oxaloacetato para formar citrato . [16] [17]
- Dos moléculas de acetil-CoA se condensan para formar acetoacetil-CoA , lo que da lugar a la formación de acetoacetato y β-hidroxibutirato . [16] El acetoacetato, el β-hidroxibutirato y su producto de degradación espontánea, la acetona [18], se conocen con frecuencia, aunque de forma confusa, como cuerpos cetónicos (ya que no son "cuerpos" en absoluto, sino sustancias químicas solubles en agua). Los cuerpos cetónicos son liberados por el hígado a la sangre. Todas las células con mitocondrias pueden tomar cuerpos cetónicos de la sangre y reconvertirlos en acetil-CoA, que luego puede usarse como combustible en sus ciclos de ácido cítrico, ya que ningún otro tejido puede desviar su oxaloacetato hacia la vía gluconeogénica de la forma en que lo hace el hígado. A diferencia de los ácidos grasos libres, los cuerpos cetónicos pueden atravesar la barrera hematoencefálica y, por lo tanto, están disponibles como combustible para las células del sistema nervioso central , actuando como un sustituto de la glucosa, con la que estas células normalmente sobreviven. [16] La aparición de altos niveles de cuerpos cetónicos en la sangre durante la inanición , una dieta baja en carbohidratos , ejercicio intenso prolongado y diabetes mellitus tipo 1 no controlada se conoce como cetosis , y en su forma extrema en la diabetes mellitus tipo 1 fuera de control, como cetoacidosis .
- Por otro lado, cuando la concentración de insulina en la sangre es alta y la de glucagón es baja (es decir, después de las comidas), el acetil-CoA producido por la glucólisis se condensa de forma normal con oxalacetato para formar citrato en la mitocondria. Sin embargo, en lugar de continuar a través del ciclo del ácido cítrico para convertirse en dióxido de carbono y agua, el citrato se elimina de la mitocondria hacia el citoplasma . [16] Allí es escindido por la ATP citrato liasa en acetil-CoA y oxalacetato. El oxalacetato se devuelve a la mitocondria como malato (y luego se convierte de nuevo en oxalacetato para transferir más acetil-CoA fuera de la mitocondria). [19] Este acetil-CoA citosólico puede usarse entonces para sintetizar ácidos grasos a través de la carboxilación por la acetil-CoA carboxilasa en malonil CoA , el primer paso comprometido en la síntesis de ácidos grasos. [19] [20] Esta conversión ocurre principalmente en el hígado, el tejido adiposo y las glándulas mamarias lactantes , donde los ácidos grasos se combinan con glicerol para formar triglicéridos , la principal reserva de combustible de la mayoría de los animales. Los ácidos grasos también son componentes de los fosfolípidos que forman la mayor parte de las bicapas lipídicas de todas las membranas celulares . [16]
- En las plantas, la síntesis de ácidos grasos de novo se produce en los plástidos . Muchas semillas acumulan grandes reservas de aceites de semillas para favorecer la germinación y el crecimiento temprano de la plántula antes de que se convierta en un organismo fotosintético neto .
- El acetil-CoA citosólico también puede condensarse con acetoacetil-CoA para formar 3-hidroxi-3-metilglutaril-CoA ( HMG-CoA ), que es el paso limitante que controla la síntesis de colesterol . [16] El colesterol se puede utilizar tal cual, como un componente estructural de las membranas celulares, o se puede utilizar para sintetizar hormonas esteroides , sales biliares y vitamina D. [ 16] [20]
- La acetil-CoA puede ser carboxilada en el citosol por la acetil-CoA carboxilasa , dando lugar a malonil-CoA , un sustrato necesario para la síntesis de flavonoides y policétidos relacionados , para la elongación de ácidos grasos para producir ceras , cutículas y aceites de semillas en miembros de la familia Brassica , y para la malonación de proteínas y otros fitoquímicos. [21] En las plantas, estos incluyen sesquiterpenos , brasinoesteroides (hormonas) y esteroles de membrana .
- Síntesis de esteroides :
- El acetil-CoA participa en la vía del mevalonato al intervenir en la síntesis de hidroximetilglutaril-CoA.
- Síntesis de acetilcolina :
- El acetil-CoA también es un componente importante en la síntesis biogénica del neurotransmisor acetilcolina . La colina , en combinación con el acetil-CoA, es catalizada por la enzima colina acetiltransferasa para producir acetilcolina y coenzima A como subproducto.
- Síntesis de melatonina
- Acetilación
- El acetil-CoA también es la fuente del grupo acetilo incorporado a ciertos residuos de lisina de proteínas histonas y no histonas en la acetilación de modificación postraduccional . Esta acetilación es catalizada por acetiltransferasas . Esta acetilación afecta el crecimiento celular , la mitosis y la apoptosis . [22]
- Regulador alostérico
- El acetil-CoA actúa como regulador alostérico de la piruvato deshidrogenasa quinasa (PDK). Regula la relación entre acetil-CoA y CoA. Una mayor concentración de acetil-CoA activa la PDK. [23]
- El acetil-CoA también es un activador alostérico de la piruvato carboxilasa . [24]
Mapa interactivo de rutas
Haga clic en los genes, las proteínas y los metabolitos que aparecen a continuación para visitar las páginas de Gene Wiki y los artículos de Wikipedia relacionados. La ruta se puede descargar y editar en WikiPathways.
Véase también
Referencias
- ^ abcd Dawson RM, Elliott DC, Elliott WH, Jones KM (2002). Datos para la investigación bioquímica (3.ª ed.). Clarendon Press. pág. 117. ISBN 978-0-19-855299-4.
- ^ "Encrucijadas del acetil-CoA". chemistry.elmhurst.edu . Archivado desde el original el 15 de noviembre de 2016. Consultado el 8 de noviembre de 2016 .
- ^ "Ácidos grasos: estructura del acetil CoA". library.med.utah.edu . Consultado el 2 de junio de 2017 .
- ^ "Todos los premios Nobel en Fisiología o Medicina". El Premio Nobel .
- ^ Zhang S, Yang W, Chen H, Liu B, Lin B, Tao Y (agosto de 2019). "Ingeniería metabólica para el suministro eficiente de acetil-CoA a partir de diferentes fuentes de carbono en Escherichia coli". Microb Cell Fact . 18 (1): 130. doi : 10.1186/s12934-019-1177-y . PMC 6685171 . PMID 31387584.
- ^ "5.12G: La vía del acetil-CoA". 9 de mayo de 2017.
- ^ Hynes MJ, Murray SL (1 de julio de 2010). "La ATP-citrato liasa es necesaria para la producción de acetil coenzima A citosólica y el desarrollo en Aspergillus nidulans". Eukaryotic Cell . 9 (7): 1039–1048. doi :10.1128/EC.00080-10. ISSN 1535-9778. PMC 2901662 . PMID 20495057.
- ^ Wellen KE, Thompson CB (1 de abril de 2012). "Una calle de doble sentido: regulación recíproca del metabolismo y la señalización". Nature Reviews Molecular Cell Biology . 13 (4): 270–276. doi :10.1038/nrm3305. ISSN 1471-0072. PMID 22395772. S2CID 244613.
- ^ Storey KB (25 de febrero de 2005). Metabolismo funcional: regulación y adaptación. John Wiley & Sons. ISBN 9780471675570.
- ^ "ACLY ATP citrate lyase [Homo sapiens (human)] - Gene - NCBI" (en inglés). www.ncbi.nlm.nih.gov . Consultado el 6 de noviembre de 2016 .
- ^ Ragsdale SW (2004). "La vida con monóxido de carbono". CRC Critical Reviews in Biochemistry and Molecular Biology . 39 (3): 165–195. doi :10.1080/10409230490496577. PMID 15596550. S2CID 16194968.
- ^ Chatterjea (1 de enero de 2004). Libro de texto de bioquímica para estudiantes de odontología, enfermería y farmacia. Jaypee Brothers Publishers. ISBN 9788180612046.[ enlace muerto permanente ]
- ^ Berg JM, Tymoczko JL, Stryer L (2002). Bioquímica (5ª ed.). WH Freeman. ISBN 978-0716730514.
- ^ Blackstock JC (28 de junio de 2014). Guía de bioquímica. Butterworth-Heinemann. ISBN 9781483183671.
- ^ Houten SM, Wanders RJ (2 de marzo de 2010). "Una introducción general a la bioquímica de la β-oxidación de los ácidos grasos mitocondriales". Journal of Inherited Metabolic Disease . 33 (5): 469–477. doi :10.1007/s10545-010-9061-2. ISSN 0141-8955. PMC 2950079 . PMID 20195903.
- ^ abcdefg Stryer L (1995). Bioquímica (cuarta edición). Nueva York: WH Freeman and Company. págs. 510–515, 559–565, 581–613, 614–623, 775–778. ISBN 978-0-7167-2009-6.
- ^ "Oxidación de ácidos grasos". 11-10-2013.
- ^ "Metabolismo de los cuerpos cetónicos". Universidad de Waterloo.
- ^ ab Ferre P, F. Foufelle (2007). "Factor de transcripción SREBP-1c y homeostasis lipídica: perspectiva clínica". Investigación hormonal . 68 (2): 72–82. doi : 10.1159/000100426 (inactivo el 7 de julio de 2024). PMID 17344645.
Este proceso se describe gráficamente en la página 73.
{{cite journal}}: CS1 maint: DOI inactive as of July 2024 (link) - ^ ab Voet D, Judith G. Voet, Charlotte W. Pratt (2006). Fundamentos de bioquímica, 2.ª edición. John Wiley and Sons, Inc., págs. 547, 556. ISBN 978-0-471-21495-3.
- ^ Fatland BL (2005). "Caracterización genética inversa de la generación de acetil-CoA citosólico por ATP-citrato liasa en Arabidopsis". The Plant Cell Online . 17 (1): 182–203. doi :10.1105/tpc.104.026211. PMC 544498 . PMID 15608338.
- ^ Yi CH, Vakifahmetoglu-Norberg H, Yuan J (1 de enero de 2011). "Integración de la apoptosis y el metabolismo". Simposios de Cold Spring Harbor sobre biología cuantitativa . 76 : 375–387. doi : 10.1101/sqb.2011.76.010777 . ISSN 0091-7451. PMID 22089928.
- ^ Pettit FH, Pelley JW, Reed LJ (22 de julio de 1975). "Regulación de la piruvato deshidrogenasa quinasa y fosfatasa por las proporciones acetil-CoA/CoA y NADH/NAD". Comunicaciones de investigación bioquímica y biofísica . 65 (2): 575–582. doi :10.1016/S0006-291X(75)80185-9. PMID 167775.
- ^ Jitrapakdee S, Maurice MS, Rayment I , Cleland WW, Wallace JC, Attwood PV (1 de agosto de 2008). "Estructura, mecanismo y regulación de la piruvato carboxilasa". The Biochemical Journal . 413 (3): 369–387. doi :10.1042/BJ20080709. ISSN 0264-6021. PMC 2859305. PMID 18613815 .
Enlaces externos
- Acetil + Coenzima + A en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.




