Química de los organosulfurados
La química de los organosulfurados es el estudio de las propiedades y la síntesis de compuestos organosulfurados , que son compuestos orgánicos que contienen azufre . [1] A menudo se asocian con malos olores, pero muchos de los compuestos más dulces conocidos son derivados organosulfurados, por ejemplo, la sacarina . La naturaleza está llena de compuestos organosulfurados; el azufre es vital para la vida. De los 20 aminoácidos comunes , dos ( cisteína y metionina ) son compuestos organosulfurados, y los antibióticos penicilina y sulfamidas contienen azufre. Si bien los antibióticos que contienen azufre salvan muchas vidas, la mostaza azufrada es un agente de guerra química mortal. Los combustibles fósiles , el carbón , el petróleo y el gas natural , que se derivan de organismos antiguos, necesariamente contienen compuestos organosulfurados, cuya eliminación es un objetivo principal de las refinerías de petróleo .
El azufre comparte el grupo calcógeno con el oxígeno , el selenio y el telurio , y se espera que los compuestos organosulfurados tengan similitudes con los compuestos carbono-oxígeno, carbono-selenio y carbono-telurio.
Una prueba química clásica para la detección de compuestos de azufre es el método halógeno Carius .
Clases estructurales
Los compuestos organosulfurados se pueden clasificar según los grupos funcionales que contienen azufre , que se enumeran (aproximadamente) en orden decreciente de aparición.
- Compuestos organosulfurados ilustrativos
- Alicina , el compuesto activo del sabor del ajo machacado
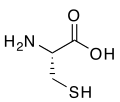
- ( R )- Cisteína , un aminoácido que contiene un grupo tiol
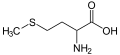
- Metionina , un aminoácido que contiene un sulfuro.
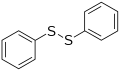
- Disulfuro de difenilo , un disulfuro representativo
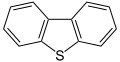
- Dibenzotiofeno , un componente del petróleo crudo
- Ácido perfluorooctanosulfónico , un surfactante controvertido
- Ácido lipoico , un cofactor esencial de cuatro complejos enzimáticos mitocondriales.
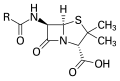
- Estructura del núcleo de la penicilina , donde "R" es el grupo variable.
- Mostaza de azufre , un tipo de sulfuro utilizado como agente de guerra química .
- Sulfurano de Martin con estructura de balancín, como la del SF 4 [2]
Sulfuros
Los sulfuros, anteriormente conocidos como tioéteres, se caracterizan por enlaces C−S−C [3] [4] En relación con los enlaces C−C, los enlaces C−S son ambos más largos, porque los átomos de azufre son más grandes que los átomos de carbono y aproximadamente un 10% más débiles. Las longitudes de enlace representativas en compuestos de azufre son 183 pm para el enlace simple S−C en metanotiol y 173 pm en tiofeno . La energía de disociación del enlace C−S para el tiometano es 89 kcal/mol (370 kJ/mol) en comparación con los 100 kcal/mol (420 kJ/mol) del metano y cuando el hidrógeno es reemplazado por un grupo metilo la energía disminuye a 73 kcal/mol (305 kJ/mol). [5] El enlace simple carbono-oxígeno es más corto que el del enlace C−C. Las energías de disociación de enlace para el sulfuro de dimetilo y el éter dimetílico son respectivamente 73 y 77 kcal/mol (305 y 322 kJ/mol).
Los sulfuros se preparan típicamente mediante la alquilación de tioles. Los agentes alquilantes incluyen no solo haluros de alquilo, sino también epóxidos, aziridinas y aceptores de Michael . [6]
También pueden prepararse mediante el reordenamiento de Pummerer .
En la reacción de Ferrario , el éter fenilo se convierte en fenoxatiína por acción del azufre elemental y el cloruro de aluminio . [7]
Los tioacetales y tiocetales presentan una secuencia de enlaces C−S−C−S−C. Representan una subclase de sulfuros. Los tioacetales son útiles en la " reducción " de grupos carbonilo. Los tioacetales y tiocetales también se pueden utilizar para proteger un grupo carbonilo en síntesis orgánicas.
Las clases anteriores de compuestos de azufre también existen en estructuras heterocíclicas saturadas e insaturadas, a menudo en combinación con otros heteroátomos , como lo ilustran los tiiranos , tiirenos , tietanos , tietos , ditietanos , tiolanos , tianos , ditianos , tiepanos , tiepinas , tiazoles , isotiazoles y tiofenos , entre otros. Los últimos tres compuestos representan una clase especial de heterociclos que contienen azufre que son aromáticos . La estabilización de resonancia del tiofeno es de 29 kcal/mol (121 kJ/mol) en comparación con 20 kcal/mol (84 kJ/mol) para el análogo de oxígeno furano . La razón de esta diferencia es la mayor electronegatividad del oxígeno que atrae electrones hacia sí mismo a expensas de la corriente del anillo aromático. Sin embargo, como sustituyente aromático, el grupo tio libera menos electrones que el grupo alcoxi. Los dibenzotiofenos (ver dibujo), heterociclos tricíclicos que consisten en dos anillos de benceno fusionados a un anillo central de tiofeno, se encuentran ampliamente presentes en las fracciones más pesadas del petróleo.
Tioles, disulfuros, polisulfuros
Los grupos tiol contienen la funcionalidad R−SH. Los tioles son estructuralmente similares al grupo alcohol , pero estas funcionalidades son muy diferentes en sus propiedades químicas. Los tioles son más nucleófilos , más ácidos y se oxidan más fácilmente. Esta acidez puede diferir en 5 unidades p K a . [8]
La diferencia de electronegatividad entre el azufre (2,58) y el hidrógeno (2,20) es pequeña y, por lo tanto, la formación de puentes de hidrógeno en los tioles no es prominente. Los tioles alifáticos forman monocapas sobre el oro , que son de actualidad en nanotecnología .
Se puede acceder a ciertos tioles aromáticos a través de una reacción de Herz .
Los disulfuros R−S−S−R con un enlace covalente de azufre a azufre son importantes para la reticulación : en bioquímica para el plegamiento y la estabilidad de algunas proteínas y en química de polímeros para la reticulación del caucho.
También se conocen cadenas de azufre más largas, como en el producto natural varacina , que contiene un anillo de pentatienpina inusual (cadena de 5 azufres ciclada sobre un anillo de benceno).
Tioésteres
Los tioésteres tienen la estructura general R−C(O)−S−R. Están relacionados con los ésteres regulares (R−C(O)−O−R), pero son más susceptibles a la hidrólisis y a las reacciones relacionadas. Los tioésteres formados a partir de la coenzima A son importantes en bioquímica, especialmente en la síntesis de ácidos grasos .
Sulfóxidos, sulfonas y tiosulfinatos
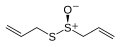
Un sulfóxido , R−S(O)−R, es el S -óxido de un sulfuro ("óxido de sulfuro"), una sulfona , R−S(O) 2 −R, es el S , S -dióxido de un sulfuro, un tiosulfinato , R−S(O)−S−R, es el S -óxido de un disulfuro, y un tiosulfonato , R−S(O) 2 −S−R, es el S , S -dióxido de un disulfuro. Todos estos compuestos son bien conocidos y tienen una química extensa, por ejemplo, dimetilsulfóxido , dimetilsulfona y alicina (ver dibujo).
Sulfimidas, sulfoximidas, sulfonediiminas
Las sulfimidas (también llamadas sulfiliminas) son compuestos de azufre y nitrógeno de estructura R 2 S=NR′, el análogo nitrogenado de los sulfóxidos. Son de interés en parte debido a sus propiedades farmacológicas. Cuando dos grupos R diferentes se unen al azufre, las sulfimidas son quirales. Las sulfimidas forman α-carbaniones estables. [9]
Las sulfoximidas (también llamadas sulfoximinas) son compuestos tetracoordinados de azufre y nitrógeno, isoelectrónicos con las sulfonas, en los que un átomo de oxígeno de la sulfona se reemplaza por un átomo de nitrógeno sustituido, por ejemplo, R 2 S(O)=NR′. Cuando dos grupos R diferentes se unen al azufre, las sulfoximidas son quirales. Gran parte del interés en esta clase de compuestos se deriva del descubrimiento de que la metionina sulfoximida (metionina sulfoximina) es un inhibidor de la glutamina sintetasa . [10]
Las sulfonadiiminas (también llamadas sulfodiiminas, sulfodiimidas o sulfonediimidas) son compuestos tetracoordinados de azufre y nitrógeno, isoelectrónicos con las sulfonas, en los que ambos átomos de oxígeno de la sulfona se reemplazan por un átomo de nitrógeno sustituido, por ejemplo, R 2 S(=NR′) 2 . Son de interés debido a su actividad biológica y como bloques de construcción para la síntesis de heterociclos. [11]
S-Nitrosotioles
Los S -nitrosotioles , también conocidos como tionitritos, son compuestos que contienen un grupo nitroso unido al átomo de azufre de un tiol, p. ej., R−S−N=O. Han recibido considerable atención en bioquímica porque sirven como donantes del ion nitrosonio, NO + , y óxido nítrico, NO, que pueden servir como moléculas de señalización en sistemas vivos, especialmente relacionadas con la vasodilatación. [12]
Haluros de azufre
Se conoce una amplia gama de compuestos de organoazufre que contienen uno o más átomos de halógeno ("X" en las fórmulas químicas que siguen) unidos a un único átomo de azufre, por ejemplo: haluros de sulfenilo , RSX; haluros de sulfinilo , RS(O)X; haluros de sulfonilo , RSO 2 X; tricloruros de alquilo y arilsulfuro, RSCl 3 y trifluoruros, RSF 3 ; [13] y pentafluoruros de alquilo y arilsulfuro, RSF 5 . [14] Menos conocidos son los tetrahaluros de dialquilsulfuro, representados principalmente por los tetrafluoruros, por ejemplo, R 2 SF 4 . [15]
Tiocetonas, tioaldehídos y compuestos relacionados
Los compuestos con enlaces dobles entre el carbono y el azufre son relativamente poco comunes, pero incluyen los compuestos importantes disulfuro de carbono , sulfuro de carbonilo y tiofosgeno . Las tiocetonas (RC(=S)R′) son poco comunes con sustituyentes de alquilo, pero un ejemplo es la tiobenzofenona . Los tioaldehídos son aún más raros, lo que refleja su falta de protección estérica (" tioformaldehído " existe como un trímero cíclico). Las tioamidas , con la fórmula R 1 C(=S)N(R 2 )R 3 son más comunes. Por lo general, se preparan mediante la reacción de amidas con el reactivo de Lawesson . Los isotiocianatos , con la fórmula R−N=C=S, se encuentran de forma natural. Los alimentos vegetales con sabores característicos debido a los isotiocianatos incluyen wasabi , rábano picante , mostaza , rábano , coles de Bruselas , berros , capuchinas y alcaparras .
S-Óxidos yS,S-dióxidos de compuestos de tiocarbonilo
Los S -óxidos de compuestos de tiocarbonilo se conocen como S -óxidos de tiocarbonilo: (R 2 C=S=O, y S , S -dióxidos de tiocarbonilo o sulfenos , R 2 C=SO 2 ). Los S -óxidos de tiona también se han conocido como sulfinas , y aunque la IUPAC considera este término obsoleto, [16] el nombre persiste en la literatura. [17] Estos compuestos son bien conocidos con una química extensa. [18] [19] Los ejemplos incluyen syn -propanetial- S -óxido y sulfeno .
Enlaces triples entre el carbono y el azufre
Los enlaces triples entre el azufre y el carbono en los sulfaalquinos son raros y se pueden encontrar en el monosulfuro de carbono (CS) [20] y se han sugerido para los compuestos F 3 CCSF 3 [21] [22] y F 5 SCSF 3 . [23] El compuesto HCSOH también se representa como si tuviera un enlace triple formal. [24]
Acidos tiocarboxílicos y tioamidas
Los ácidos tiocarboxílicos (RC(O)SH) y los ácidos ditiocarboxílicos (RC(S)SH) son bien conocidos. Son estructuralmente similares a los ácidos carboxílicos, pero más ácidos. Las tioamidas son análogas a las amidas.
Ácidos sulfónicos, sulfínicos y sulfénicos, ésteres, amidas y compuestos relacionados
Los ácidos sulfónicos tienen la funcionalidad R−S(=O) 2 −OH. [25] Son ácidos fuertes que son típicamente solubles en solventes orgánicos. Los ácidos sulfónicos como el ácido trifluorometanosulfónico es un reactivo usado frecuentemente en química orgánica . Los ácidos sulfínicos tienen la funcionalidad R−S(O)−OH mientras que los ácidos sulfénicos tienen la funcionalidad R−S−OH. En la serie de ácidos sulfónico—sulfínico—sulfénico, tanto la fuerza del ácido como la estabilidad disminuyen en ese orden. [26] [27] Las sulfonamidas, sulfinamidas y sulfenamidas , con fórmulas R−SO 2 NR′ 2 , R−S(O)NR′ 2 y R−SNR′ 2 , respectivamente, tienen cada una una química rica. Por ejemplo, las sulfamidas son sulfonamidas derivadas de la sulfonación aromática . Las sulfinamidas quirales se utilizan en la síntesis asimétrica, mientras que las sulfenamidas se utilizan ampliamente en el proceso de vulcanización para ayudar a la reticulación. Los tiocianatos , R−S−CN, están relacionados con los haluros y ésteres de sulfenilo en términos de reactividad.
Sulfonio, oxosulfonio y sales relacionadas
Un ion sulfonio es un ion cargado positivamente que presenta tres sustituyentes orgánicos unidos al azufre, con la fórmula [R 3 S] + . Junto con su contraparte cargada negativamente, el anión, los compuestos se denominan sales de sulfonio. Un ion oxosulfonio es un ion cargado positivamente que presenta tres sustituyentes orgánicos y un oxígeno unido al azufre, con la fórmula [R 3 S=O] + . Junto con su contraparte cargada negativamente, el anión, los compuestos se denominan sales de oxosulfonio. Las especies relacionadas incluyen los iones alcoxisulfonio y clorosulfonio, [R 2 SOR] + y [R 2 SCl] + , respectivamente.
Iluros de sulfonio, oxosulfonio y tiocarbonilo
La desprotonación de sales de sulfonio y oxosulfonio produce iluros , de estructura R 2 S + −C − −R′ 2 y R 2 S(O) + −C − −R′ 2 . Mientras que los iluros de sulfonio , por ejemplo en la reacción de Johnson–Corey–Chaykovsky utilizada para sintetizar epóxidos , a veces se dibujan con un doble enlace C=S, p. ej., R 2 S=CR′ 2 , el enlace carbono-azufre ylídico está altamente polarizado y se describe mejor como iónico. Los iluros de sulfonio son intermediarios clave en el reordenamiento de Stevens , sintéticamente útil . Los iluros de tiocarbonilo (RR′C=S + −C − −RR′) pueden formarse por apertura de anillo de tiiranos , fotociclización de sulfuros de arilo y vinilo, [28] así como por otros procesos.
Sulfuranos y persulfuranos
Los sulfuranos son grupos funcionales relativamente especializados que presentan azufre tetravalente , con la fórmula SR 4 [2] Del mismo modo, los persulfuranos presentan azufre hexavalente SR 6 .
Uno de los pocos persulfuranos totalmente de carbono tiene dos ligandos de metilo y dos de bifenileno : [29]
Se prepara a partir del sulfurano correspondiente 1 con difluoruro de xenón / trifluoruro de boro en acetonitrilo para el dicatión sulfuranilo 2 seguido de reacción con metil-litio en tetrahidrofurano para (un) persulfurano 3 estable como el isómero cis . La difracción de rayos X muestra longitudes de enlace C-S que varían entre 189 y 193 pm (más largas que la longitud de enlace estándar) con el átomo de azufre central en una geometría molecular octaédrica distorsionada .
Compuestos organosulfurados en la naturaleza
En la naturaleza se encuentran diversos compuestos organosulfurados. Los más abundantes son los aminoácidos metionina , cisteína y cistina . Las vitaminas biotina y tiamina , así como el ácido lipoico , contienen heterociclos de azufre. El glutatión es el principal antioxidante intracelular . [6] La penicilina y la cefalosporina son antibióticos que salvan vidas y que se derivan de hongos. La gliotoxina es una micotoxina que contiene azufre producida por varias especies de hongos que se está investigando como agente antiviral .
En combustibles fósiles
Compuestos organosulfurados comunes presentes en fracciones de petróleo en un nivel de 200–500 ppm. Los compuestos comunes son los tiofenos , especialmente los dibenzotiofenos . Mediante el proceso de hidrodesulfuración (HDS) en las refinerías, estos compuestos se eliminan como lo ilustra la hidrogenólisis del tiofeno: C 4 H 4 S + 8 H 2 → C 4 H 10 + H 2 S
Sabor y olor
Compuestos como la alicina y el ajoeno son responsables del olor del ajo . La lentionina contribuye al sabor de los hongos shiitake . Los compuestos organosulfurados volátiles también aportan características de sabor sutiles a los sabores del vino , las nueces, el queso cheddar , el chocolate , el café y las frutas tropicales. [30] Muchos de estos productos naturales también tienen importantes propiedades medicinales, como prevenir la agregación plaquetaria o combatir el cáncer.
Los seres humanos y otros animales tienen un sentido del olfato extremadamente sensible al olor de los compuestos organosulfurados de baja valencia, como los tioles, sulfuros y disulfuros. Los tioles volátiles malolientes son productos de degradación de proteínas que se encuentran en los alimentos en mal estado, por lo que la identificación sensible de estos compuestos es crucial para evitar la intoxicación. Los compuestos volátiles de azufre de baja valencia también se encuentran en áreas donde los niveles de oxígeno en el aire son bajos, lo que plantea un riesgo de asfixia.
El cobre es necesario para la detección altamente sensible de ciertos tioles volátiles y compuestos organosulfurados relacionados por los receptores olfativos en ratones. Todavía no se sabe si los seres humanos también necesitan cobre para la detección sensible de tioles. [31]
Referencias
- ^ Block, E. (1978). Reacciones de compuestos organosulfurados . Academic Press. ISBN 0-12-107050-6.
- ^ ab Martin, JC; Arhart, RJ; Franz, JA; Perozzi, EF; Kaplan, LJ "Bis[2,2,2-trifluoro-1-fenil-1-(trifluorometil)etoxi]difenilsulfurano". Organic Syntheses . 57 : 22. doi :10.15227/orgsyn.057.0022.
- ^ Química orgánica Libro Azul de la IUPAC. Reglas C-5: Compuestos que contienen azufre bivalente http://www.acdlabs.com/iupac/nomenclature/79/r79_25.htm
- ^ Química orgánica Libro Azul de la IUPAC. Recomendación R-5.7.1.3.4 Ácidos tiocarboxílicos y tiocarbónicos.[1]
- ^ Manual de química y física (81.ª edición). CRC Press. Junio de 2000. ISBN 0-8493-0481-4.
- ^ ab Chauhan, Pankaj; Mahajan, Suruchi; Enders, Dieter (2014). "Reacciones organocatalíticas de formación de enlaces carbono-azufre". Chemical Reviews . 114 (18): 8807–8864. doi :10.1021/cr500235v. PMID 25144663.
- ^ Suter, CM; Maxwell, Charles E. (1938). "Fenoxtina [fenoxatiina]". Síntesis orgánicas . 18 : 64. doi : 10.15227/orgsyn.018.0064.
- ^ Cremlyn, RJ (1996). Introducción a la química de los organosulfurados . Chichester: John Wiley and Sons. ISBN 0-471-95512-4.
- ^ García Ruano, JL; Cid, MB; Martín Castro, AM; Alemán, J. (2008). " S , S -Dialquilsulfimidas acíclicas". En Kambe, N. (ed.). Ciencia de la Síntesis . vol. 39. Thiéme. págs. 352–375. ISBN 978-1-58890-530-7.
- ^ Drabowicz, J.; Lewkowski, J.; Kudelska, W.; Girek, T. (2008). " S , S -Dialquilsulfoximidas". En Kambe, N. (ed.). Ciencia de la Síntesis . vol. 39. Thiéme. págs. 154-173. ISBN 978-1-58890-530-7.
- ^ Drabowicz, J.; Lewkowski, J.; Kudelska, W.; Girek, T. (2008). " S , S -Dialquilsulfondiiminas". En Kambe, N. (ed.). Ciencia de la Síntesis . vol. 39. Thiéme. págs. 173–180. ISBN 978-1-58890-530-7.
- ^ Zhang, Y.; Hogg, N. (2005). " S -Nitrosotioles: formación y transporte celular". Radic. Biol. Med . 38 (7): 831–838. doi :10.1016/j.freeradbiomed.2004.12.016. PMID 15749378.
- ^ Braverman, S.; Cherkinsky, M.; Levinger, S. (2008). "Trihaluros de alquilsulfuro". En Kambe, N. (ed.). Science of Synthesis . Vol. 39. Thieme. págs. 187–188. ISBN 978-1-58890-530-7.
- ^ Sheppard, WA (1962). "Pentafluoruros de arilsulfuro". J. Am. Chem. Soc. 84 (16): 3064–3072. doi :10.1021/ja00875a006.
- ^ Drabowicz, J.; Lewkowski, J.; Kudelska, W.; Girek, T. (2008). "Tetrahaluros de dialquilazufre". En Kambe, N. (ed.). Ciencia de la Síntesis . vol. 39. Thiéme. págs. 123-124. ISBN 978-1-58890-530-7.
- ^ IUPAC , Compendio de terminología química , 2.ª edición (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "sulfinas". doi :10.1351/goldbook.S06108
- ^ McCaw, Patrick G.; Buckley, Naomi M.; Collins, Stuart G.; Maguire, Anita R. (marzo de 2016). "Generación, reactividad y usos de sulfinas en síntesis orgánica". Revista Europea de Química Orgánica . 2016 (9): 1630–1650. doi :10.1002/ejoc.201501538.
- ^ Opitz, G. (febrero de 1967). "Sulfinas y sulfenos: los S-óxidos y S,S-dióxidos de tioaldehídos y tiocetonas". Angewandte Chemie International Edition en inglés . 6 (2): 107–123. doi :10.1002/anie.196701071.
- ^ Zwanenburg, Binne (mayo de 1989). "Química de la sulfina". Fósforo, azufre y silicio y elementos relacionados . 43 (1–2): 1–24. doi :10.1080/10426508908040276.
- ^ Moltzen, EK; Klabunde, KJ; Senning, A. (1988). "Monosulfuro de carbono: una revisión". Chem. Rev. 88 ( 2): 391. doi :10.1021/cr00084a003.
- ^ Pötter, B.; Seppelt, K. (1984). "Trifluoruro de azufre de trifluoroetilidinos, F 3 C−C≡SF 3 ". Angew. Chem. Int. Ed. Engl. 23 (2): 150. doi :10.1002/anie.198401501.
- ^ Buschmann, J.; Damerius, R.; Gerhardt, R.; Lentz, D.; Luger, P.; Marschall, R.; Preugschat, D.; Seppelt, K.; Simon, A. (1992). "Trifluoruro de (trifluoroetilidino)azufre, F 3 CC≡SF 3 : dos estructuras en estado sólido y reactividad como un carbeno". J. Am. Chem. Soc. 114 (24): 9465. doi :10.1021/ja00050a027.
- ^ Gerhardt, R.; Gerlbig, T.; Buschamann, J.; Luger, P.; Seppelt, K. (1988). "La unidad SF 5 como grupo protector estérico; síntesis y estructura de F 5 S−C≡SF 3 ". Angew. Chem. Int. Ed. Engl. 27 (11): 1534. doi :10.1002/anie.198815341.
- ^ Schreiner, P.; Reisenauer, H.; Romanski, J.; Mloston, G. (2009). "Un triple enlace carbono-azufre formal: H−C≡S−O−H". Angew. Chem. Int. Ed. Engl. 48 (43): 8133–8136. doi :10.1002/anie.200903969. PMID 19768827.
- ^ Química orgánica Libro Azul de la IUPAC. Haluros de azufre C-6, sulfóxidos, sulfonas y ácidos de azufre y sus derivados http://www.acdlabs.com/iupac/nomenclature/79/r79_26.htm
- ^ Braverman, S.; Cherkinsky, M.; Levinger, S. (2008). "Ácidos alcanosulfínicos y sales". En Kambe, N. (ed.). Science of Synthesis . Vol. 39. Thieme. págs. 196–211. ISBN 978-1-58890-530-7.
- ^ Drabowicz, J.; Kiełbasiński, P.; Łyżwa, P.; Zając, A.; Mikołajczyk, M. (2008). "Ácidos alcanosulfénicos". En Kambe, N. (ed.). Ciencia de la Síntesis . vol. 39. Thiéme. págs. 550–557. ISBN 978-1-58890-530-7.
- ^ Schultz, AG; DeTar, MB (1976). "Tiocarbonilo iluros. Reacciones de fotogeneración, reordenamiento y cicloadición". J. Am. Química. Soc. 98 (12): 3564–3572. doi :10.1021/ja00428a029.
- ^ Sato, S.; Matsunaga, K.; Cuerno, E.; Furukawa, N.; Nabeshima, T. (2006). "Aislamiento y estructura molecular de los organopersulfuranos [12-S-6 (C6)]". J. Am. Química. Soc. 128 (21): 6778–6779. doi :10.1021/ja060497y. PMID 16719444.
- ^ Qian, MC; Fan, X.; Mahattanatawee, K., eds. (2011). Compuestos volátiles de azufre en los alimentos . Serie de simposios de la ACS 1068. Vol. 1068. Sociedad Química Estadounidense. doi :10.1021/bk-2011-1068. ISBN . 978-0-8412-2616-6.
- ^ Duan, X.; Block, E.; Li, Z.; Connelly, T.; Zhang, J.; Huang, Z.; Su, X.; Pan, Y.; Wu, L.; Chi, Q.; Thomas, S.; Zhang, S.; Ma, M.; Matsunami, H.; Chen, G.-Q.; Zhang, H. (2012). "Papel crucial del cobre en la detección de odorantes que coordinan metales". Proc. Natl. Acad. Sci. USA . 109 (9): 3492–3497. Bibcode :2012PNAS..109.3492D. doi : 10.1073/pnas.1111297109 . PMC 3295281 . PMID 22328155.




![Sulfurano de Martin con estructura de balancín, como la del SF4[2]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/36/MartinSulfurane.svg/96px-MartinSulfurane.svg.png)

