Éter dimetílico
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Metoximetano [1] | |||
| Otros nombres Éter dimetílico [1] R-E170 Demeon Óxido de dimetilo Dymel A Éter metílico Óxido de metilo Mether Éter de madera | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| Abreviaturas | DME | ||
| 1730743 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.003.696 | ||
| Número CE |
| ||
| BARRIL | |||
| Malla | Dimetil+éter | ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 1033 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C2H6O | |||
| Masa molar | 46,069 g·mol −1 | ||
| Apariencia | Gas incoloro | ||
| Olor | Etéreo [2] | ||
| Densidad | 2,1146 kg m −3 (gas, 0 °C, 1013 mbar) [2] 0,735 g/mL (líquido, −25 °C) [2] | ||
| Punto de fusión | −141 °C; −222 °F; 132 K | ||
| Punto de ebullición | -24 °C; -11 °F; 249 K | ||
| 71 g/L (a 20 °C (68 °F)) | |||
| registro P | 0,022 | ||
| Presión de vapor | 592,8 kPa [3] | ||
| −26,3 × 10 −6 cm3 mol −1 | |||
| 1,30 D | |||
| Termoquímica | |||
Capacidad calorífica ( C ) | 65,57 JK −1 mol −1 | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −184,1 kJ mol −1 | ||
Entalpía estándar de combustión (Δ c H ⦵ 298 ) | −1460,4 kJ mol −1 | ||
| Peligros | |||
| Etiquetado SGA : [4] | |||
 | |||
| Peligro | |||
| H220 | |||
| P210 , P377 , P381 , P403 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | -41 °C (-42 °F; 232 K) | ||
| 350 °C (662 °F; 623 K) | |||
| Límites de explosividad | 27 % | ||
| Ficha de datos de seguridad (FDS) | ≥99 % Sigma-Aldrich | ||
| Compuestos relacionados | |||
Éteres relacionados | Éter dietílico | ||
Compuestos relacionados | Etanol | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El dimetiléter ( DME ; también conocido como metoximetano ) es un compuesto orgánico con la fórmula CH3OCH3 ( a veces simplificada de manera ambigua a C2H6O , ya que es un isómero del etanol ). Es el éter más simple y es un gas incoloro que es un precursor útil para otros compuestos orgánicos y un propulsor de aerosoles que actualmente se está demostrando para su uso en una variedad de aplicaciones de combustible.
El dimetiléter fue sintetizado por primera vez por Jean-Baptiste Dumas y Eugene Péligot en 1835 mediante la destilación de metanol y ácido sulfúrico. [5]
Producción
En 1985 se produjeron aproximadamente 50.000 toneladas en Europa Occidental mediante deshidratación de metanol : [6]
- 2CH3OH → ( CH3 ) 2O + H2O
El metanol requerido se obtiene a partir de gas de síntesis ( syngas ). [7] Otras posibles mejoras requieren un sistema de catalizador dual que permita tanto la síntesis de metanol como la deshidratación en la misma unidad de proceso, sin aislamiento ni purificación del metanol. [7] [8] Tanto los procesos de un solo paso como los de dos pasos anteriores están disponibles comercialmente. El proceso de dos pasos es relativamente simple y los costos de puesta en marcha son relativamente bajos. Se está desarrollando un proceso de un solo paso en fase líquida. [7] [9]
A partir de biomasa
El dimetiléter es un biocombustible sintético de segunda generación (BioDME), que se puede producir a partir de biomasa lignocelulósica . [10] La UE está considerando el BioDME en su posible combinación de biocombustibles en 2030; [11] También se puede producir a partir de biogás o metano de residuos animales, alimentarios y agrícolas, [12] [13] o incluso a partir de gas de esquisto o gas natural . [14]
El Grupo Volvo es el coordinador del proyecto BioDME del Séptimo Programa Marco de la Comunidad Europea [15] [16] , donde la planta piloto BioDME de Chemrec se basa en la gasificación de licor negro en Piteå , Suecia . [17]
Aplicaciones
El mayor uso del dimetiléter es como materia prima para la producción del agente metilante, sulfato de dimetilo , lo que implica su reacción con trióxido de azufre :
- CH 3 OCH 3 + SO 3 → (CH 3 ) 2 SO 4
El dimetiléter también se puede convertir en ácido acético utilizando tecnología de carbonilación relacionada con el proceso de ácido acético de Monsanto : [6]
- (CH 3 ) 2 O + 2 CO + H 2 O → 2 CH 3 CO 2 H
Reactivo y disolvente de laboratorio
El dimetiléter es un disolvente de baja temperatura y un agente de extracción, aplicable a procedimientos de laboratorio especializados. Su utilidad está limitada por su bajo punto de ebullición (−23 °C (−9 °F)), pero la misma propiedad facilita su eliminación de las mezclas de reacción. El dimetiléter es el precursor del útil agente alquilante , tetrafluoroborato de trimetiloxonio . [18]
Aplicaciones de nicho
Una mezcla de dimetiléter y propano se utiliza en algunos productos de venta libre en forma de " spray congelante " para tratar las verrugas congelándolas . [19] [20] En esta función, ha suplantado a los compuestos de halocarbono ( Freón ) .
El dimetiléter también es un componente de ciertas mezclas de gases para sopletes "Map-Pro" de alta temperatura , reemplazando el uso de mezclas de metil acetileno y propadieno . [21]
El dimetiléter también se utiliza como propulsor en productos en aerosol, como lacas para el cabello, repelentes de insectos y algunos pegamentos en aerosol.
Investigación
Combustible

Un uso potencialmente importante del éter dimetílico es como sustituto del propano en el GLP utilizado como combustible en los hogares y la industria. [22] El éter dimetílico también se puede utilizar como mezcla en el autogás propano . [23]
También es un combustible prometedor en motores diésel , [24] y turbinas de gas . Para los motores diésel, una ventaja es el alto número de cetano de 55, en comparación con el del combustible diésel de petróleo, que es de 40-53. [25] Solo se necesitan modificaciones moderadas para convertir un motor diésel para que queme dimetiléter. La simplicidad de este compuesto de cadena corta de carbono conduce a emisiones muy bajas de material particulado durante la combustión. Por estas razones, además de estar libre de azufre, el dimetiléter cumple incluso con las regulaciones de emisiones más estrictas en Europa ( EURO5 ), EE. UU. ( EE. UU. 2010) y Japón ( 2009 Japón). [26]
En el European Shell Eco Marathon , un campeonato mundial no oficial de kilometraje, un vehículo que funciona con éter dimetílico al 100 % recorrió 589 km/l (169,8 cm3 / 100 km), combustible equivalente a la gasolina con un motor de 2 tiempos de 50 cm3 de cilindrada. Además de ganar, batieron el antiguo récord de 306 km/litro (326,8 cm3 / 100 km), establecido por el mismo equipo en 2007. [27]
Para estudiar el dimetiléter para el proceso de combustión se requiere un mecanismo cinético químico [28] que pueda utilizarse para el cálculo de dinámica de fluidos computacional.
Refrigerante
El dimetiléter es un refrigerante con designación de refrigerante ASHRAE R-E170. También se utiliza en mezclas de refrigerantes con, por ejemplo, amoniaco , dióxido de carbono , butano y propeno . El dimetiléter fue el primer refrigerante. En 1876, el ingeniero francés Charles Tellier compró al ex-Elder-Dempster un carguero de 690 toneladas Eboe y le instaló una planta de refrigeración de metil-éter de su diseño. El barco fue rebautizado como Le Frigorifique e importó con éxito un cargamento de carne refrigerada de Argentina . Sin embargo, la maquinaria se pudo mejorar y en 1877 otro barco refrigerado llamado Paraguay con una planta de refrigeración mejorada por Ferdinand Carré se puso en servicio en la ruta sudamericana. [29] [30]
Seguridad
A diferencia de otros éteres alquílicos, el éter dimetílico resiste la autooxidación . [31] El éter dimetílico también es relativamente no tóxico, aunque es altamente inflamable. El 28 de julio de 1948, una fábrica de BASF en Ludwigshafen sufrió una explosión después de que 30 toneladas de éter dimetílico se filtraran de un tanque y se incendiaran en el aire. Murieron 200 personas y un tercio de la planta industrial quedó destruida. [32]
Ficha de datos
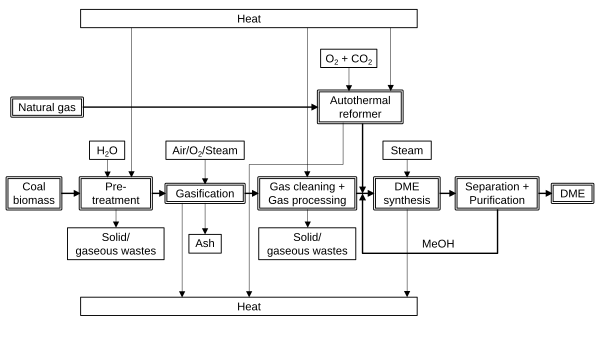
Rutas para producir dimetiléter
Presión de vapor
| Temperatura (K) | Presión (kPa) |
|---|---|
| 233.128 | 54,61 |
| 238.126 | 68,49 |
| 243.157 | 85,57 |
| 248.152 | 105,59 |
| 253.152 | 129,42 |
| 258,16 | 157,53 |
| 263,16 | 190,44 |
| 268.161 | 228,48 |
| 273.153 | 272,17 |
| 278.145 | 321,87 |
| 283.16 | 378,66 |
| 288.174 | 443,57 |
| 293.161 | 515,53 |
| 298.172 | 596.21 |
| 303.16 | 687.37 |
| 305.16 | 726.26 |
| 308.158 | 787.07 |
| 313.156 | 897,59 |
| 316.154 | 968,55 |
| 318.158 | 1018.91 |
| 323.148 | 1152.35 |
| 328.149 | 1298.23 |
| 333.157 | 1457.5 |
| 333.159 | 1457,76 |
| 338.154 | 1631.01 |
| 343.147 | 1818.8 |
| 348.147 | 2022.45 |
| 353.146 | 2242,74 |
| 353.158 | 2243.07 |
| 358.145 | 2479,92 |
| 363.148 | 2735.67 |
| 368.158 | 3010.81 |
| 373.154 | 3305.67 |
| 378,15 | 3622.6 |
| 383.143 | 3962.25 |
| 388.155 | 4331.48 |
| 393.158 | 4725.02 |
| 398.157 | 5146.82 |
| 400.378 | 5355.8 |
Véase también
Referencias
- ^ ab "CAPÍTULO P-6. Aplicaciones a clases específicas de compuestos". Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 (Libro azul) . Cambridge: The Royal Society of Chemistry . 2014. pág. 703. doi :10.1039/9781849733069-00648. ISBN . 978-0-85404-182-4.
- ^ abc Registro en la base de datos de sustancias GESTIS del Instituto de Seguridad y Salud Ocupacional
- ^ "Dimetiléter". 19 de octubre de 2018. Archivado desde el original el 6 de noviembre de 2021. Consultado el 10 de noviembre de 2020 .
- ^ GHS: Registro en la base de datos de sustancias GESTIS del Instituto de Seguridad y Salud en el Trabajo
- ^ Ann. chim. phys., 1835, [2] 58, pág. 19
- ^ ab Manfred Müller, Ute Hübsch, "Dimetil éter" en la Enciclopedia de química industrial de Ullmann, Wiley-VCH, Weinheim, 2005. doi :10.1002/14356007.a08_541
- ^ abc "CHEMSYSTEMS.COM" (PDF) . www.chemsystems.com . Archivado desde el original (PDF) el 22 de noviembre de 2009 . Consultado el 1 de abril de 2018 .
- ^ PS Sai Prasad et al., Tecnología de procesamiento de combustible, 2008, 89, 1281.
- ^ "Ofertas tecnológicas de Air Products". airproducts.com . Archivado desde el original el 12 de diciembre de 2007. Consultado el 1 de abril de 2018 .
- ^ "BioDME". www.biodme.eu . Archivado desde el original el 10 de abril de 2020 . Consultado el 1 de abril de 2018 .
- ^ "Biocarburantes en la Unión Europea, 2006" (PDF) . europa.eu . Archivado (PDF) del original el 3 de diciembre de 2019 . Consultado el 1 de abril de 2018 .
- ^ "Oberon Fuels pone en funcionamiento unidades de producción y lanza las primeras instalaciones de DME de grado combustible de América del Norte". 7 de junio de 2013. Archivado desde el original el 2021-05-06 . Consultado el 2018-08-04 .
- ^ "Utilización de gas asociado mediante mini GTL" (PDF) . Archivado (PDF) del original el 2018-08-04 . Consultado el 2018-08-04 .
- ^ Ogawa, Takashi; Inoue, Norio; Shikada, Tutomu; Inokoshi, Osamu; Ohno, Yotaro (2004). "Síntesis directa de dimetiléter (DME) a partir de gas natural". Natural Gas Conversion VII, Actas del 7.º Simposio de conversión de gas natural . Estudios en ciencia de superficies y catálisis. Vol. 147. págs. 379–384. doi :10.1016/S0167-2991(04)80081-8. ISBN 9780444515995.
- ^ "Inicio | Volvo Group". Archivado desde el original el 25 de mayo de 2009. Consultado el 4 de noviembre de 2011 .
- ^ "Volvo Group - Impulsando la prosperidad a través de soluciones de transporte". www.volvo.com . Archivado desde el original el 6 de junio de 2020 . Consultado el 1 de abril de 2018 .
- ^ Comunicado de prensa de Chemrec del 9 de septiembre de 2010 Archivado el 12 de junio de 2017 en Wayback Machine .
- ^ TJ Curphey (1988). "Tetrafluoroborato de trimetiloxonio". Síntesis orgánicas; Volúmenes recopilados , vol. 6, pág. 1019.
- ^ "Guía para farmacéuticos sobre terapias de venta libre: tratamientos de venta libre para verrugas". Julio de 2006. Archivado desde el original el 17 de junio de 2010. Consultado el 2 de mayo de 2009 .
- ^ "Copia archivada" (PDF) . Administración de Alimentos y Medicamentos . Archivado desde el original (PDF) el 20 de abril de 2009 . Consultado el 16 de diciembre de 2019 .
{{cite web}}: CS1 maint: copia archivada como título ( enlace ) - ^ "Copia archivada" (PDF) . Archivado desde el original (PDF) el 20 de diciembre de 2016. Consultado el 2 de marzo de 2016 .
{{cite web}}: CS1 maint: copia archivada como título ( enlace ) - ^ "Hoja informativa de la IDA sobre mezclas de DME y GLP 2010 v1" (PDF) . aboutdme.org . Archivado (PDF) del original el 24 de julio de 2011 . Consultado el 1 de abril de 2018 .
- ^ Fleisch, TH; Basu, A.; Sills, RA (noviembre de 2012). "El estado de los desarrollos de DME en China y más allá, 2012". Revista de ciencia e ingeniería del gas natural . 9 : 94–107. doi :10.1016/j.jngse.2012.05.012. Archivado desde el original el 2022-05-04 . Consultado el 2020-11-21 .
- ^ nycomb.se, empresa Nycomb Chemicals Archivado el 3 de junio de 2008 en Wayback Machine.
- ^ "Haldor Topsoe - Productos y servicios - Tecnologías - DME - Aplicaciones - DME como combustible diésel". Archivado desde el original el 2007-10-08 . Consultado el 2011-11-04 .topsoe.com
- ^ "Copia archivada" (PDF) . Archivado desde el original (PDF) el 7 de enero de 2009. Consultado el 4 de noviembre de 2011 .
{{cite web}}: CS1 maint: copia archivada como título ( enlace )Conferencia sobre el desarrollo y la promoción de vehículos pesados respetuosos con el medio ambiente, como los camiones DME , Washington DC, 17 de marzo de 2006 - ^ "El equipo danés Ecocar: lista de logros". dtu.dk . Archivado desde el original el 17 de octubre de 2009 . Consultado el 1 de abril de 2018 .
- ^ Shrestha, Krishna P.; Eckart, Sven; Elbaz, Ayman M.; Giri, Binod R.; Fritsche, Chris; Seidel, Lars; Roberts, William L.; Krause, Hartmut; Mauss, Fabian (2020). "Un modelo cinético integral para la oxidación de dimetiléter y dimetoximetano y la interacción de NO utilizando mediciones experimentales de velocidad de llama laminar a presión y temperatura elevadas". Combustion and Flame . 218 : 57–74. doi :10.1016/j.combustflame.2020.04.016. hdl : 10754/662921 . S2CID 219772095. Archivado desde el original el 2022-05-04 . Consultado el 2020-05-18 .
- ^ Una historia del comercio de carne congelada, páginas 26-28
- ^ http://www.ashrae.org/technology/page/1933#et Archivado el 3 de enero de 2012 en Wayback Machine Lista de refrigerantes de ASHRAE
- ^ Un estudio comparativo sobre la autooxidación del éter dimetílico (DME) en comparación con el éter dietílico (DEE) y el éter diisopropílico (DIPE) , Michie Naito, Claire Radcliffe, Yuji Wada, Takashi Hoshino, Xiongmin Liu, Mitsuru Arai, Masamitsu Tamura. Journal of Loss Prevention in the Process Industries, volumen 18, números 4 a 6, julio a noviembre de 2005, páginas 469 a 473 DOI
- ^ Mundo cinematográfico 167/1948 Archivado el 29 de enero de 2021 en Wayback Machine . filmothek.bundesarchiv.de
- ^ Wu, Jiangtao; Liu, Zhigang; Pan, Jiang; Zhao, Xiaoming (25 de noviembre de 2003). "Medidas de presión de vapor de dimetiléter de (233 a 399) K" . J. Chem. Eng. Data . 49 : 32–34. doi :10.1021/je0340046. Archivado desde el original el 4 de mayo de 2022 . Consultado el 7 de enero de 2022 .
Enlaces externos
- La Asociación Internacional de DME Archivado el 26 de noviembre de 2010 en Wayback Machine.
- Sitio de la NOAA para NFPA 704
- Instituto XTL y DME