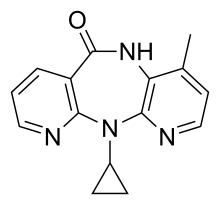
Nevirapina
 | |
 | |
| Datos clínicos | |
|---|---|
| Nombres comerciales | Viramune |
| AHFS / Drogas.com | Monografía |
| MedlinePlus | a600035 |
| Datos de licencia |
|
Categoría de embarazo |
|
| Vías de administración | Por la boca |
| Código ATC |
|
| Estatus legal | |
| Estatus legal |
|
| Datos farmacocinéticos | |
| Biodisponibilidad | 93% ± 9% |
| Metabolismo | Hígado |
| Vida media de eliminación | 45 horas |
| Excreción | Riñón : <6% (medicamento original) Conducto biliar : <5% (medicamento original) |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Banco de medicamentos | |
| Araña química | |
| UNIVERSIDAD |
|
| BARRIL | |
| Química biológica | |
| Base de datos de sustancias químicas del NIAID |
|
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.117.250 |
| Datos químicos y físicos | |
| Fórmula | C15H14N4O |
| Masa molar | 266,304 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
| (verificar) | |
La nevirapina ( NVP ), que se vende bajo la marca Viramune , entre otras, es un medicamento que se utiliza para tratar y prevenir el VIH/SIDA , específicamente el VIH-1 . [5] Generalmente se recomienda su uso con otros medicamentos antirretrovirales . [5] Puede utilizarse para prevenir la transmisión de madre a hijo durante el parto, pero no se recomienda después de otras exposiciones. [5] Se toma por vía oral. [5]
Los efectos secundarios comunes incluyen sarpullido, dolor de cabeza, náuseas, sensación de cansancio y problemas hepáticos . [5] Los problemas hepáticos y el sarpullido cutáneo pueden ser graves y deben controlarse durante los primeros meses de tratamiento. [5] [6] Parece ser seguro para su uso durante el embarazo . [5] Es un inhibidor no nucleósido de la transcriptasa inversa (NNRTI) y actúa bloqueando la función de la transcriptasa inversa . [5]
La nevirapina fue aprobada para uso médico en los Estados Unidos en 1996. [5] Está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud . [7] Está disponible como medicamento genérico . [5]
Usos médicos
La nevirapina se utiliza en personas de seis años o más infectadas con el VIH-1 como parte del tratamiento antirretroviral combinado (TAR o TARc). La monoterapia con nevirapina no está indicada debido a la rápida aparición de resistencia. [3] [4]
Se ha demostrado que la nevirapina en terapia de combinación triple suprime la carga viral de manera efectiva cuando se utiliza como terapia antirretroviral inicial ( es decir , en pacientes sin tratamiento antirretroviral previo). [8] Algunos ensayos clínicos han demostrado una supresión del VIH comparable con regímenes basados en nevirapina a la lograda con regímenes basados en un inhibidor de la proteasa (IP) [9] [10] o efavirenz . [11]
Por lo general, solo se debe considerar el uso de este medicamento si el recuento de células CD4 es muy bajo. [3]
Aunque se han planteado inquietudes acerca de los regímenes basados en nevirapina en aquellos que comienzan la terapia con una carga viral alta o un recuento bajo de CD4, algunos análisis sugieren que la nevirapina puede ser eficaz en este grupo de personas. [11]
La nevirapina también puede constituir un componente útil de los regímenes de rescate después de un fracaso virológico, generalmente en combinación con uno o más IP, así como con un inhibidor de la transcriptasa inversa de nucleótidos (NRTI), especialmente en aquellos que no han tomado previamente un NNRTI.
La dosificación en niños se basa en la superficie corporal (ASC), [3] sin embargo, se han publicado algoritmos de dosificación basados en el peso. Estas pautas incluyen algoritmos de dosificación para bebés recién nacidos. [12]
Prevención de la transmisión de madre a hijo
Aunque una dosis única de nevirapina administrada tanto a la madre como al niño redujo la tasa de transmisión del VIH en casi un 50% en comparación con un tratamiento profiláctico muy corto con zidovudina (AZT), en un ensayo clínico en Uganda [13] , una investigación de Associated Press descubrió que ese ensayo estaba plagado de "mantenimiento de registros descuidado" y posiblemente fraude. [14] Un estudio posterior en Tailandia mostró que la profilaxis con una dosis única de nevirapina además de zidovudina es más eficaz que la zidovudina sola. [15] Estos y otros ensayos han llevado a la Organización Mundial de la Salud a respaldar el uso de la profilaxis con nevirapina en dosis única en muchos entornos del mundo en desarrollo como una forma rentable de reducir la transmisión de madre a hijo. Sin embargo, en los Estados Unidos, el estudio de Uganda se consideró defectuoso [16] y hasta 2006 la FDA no ha aprobado dicha profilaxis con nevirapina. [17] Sin embargo, los partidarios del experimento HIVNET 012 argumentaron que las fallas en este experimento se debieron en gran medida a la incompetencia burocrática, mientras que los hallazgos sobre la seguridad y eficacia de la nevirapina de dosis única de este estudio fueron científicamente sólidos y demasiado importantes para descartarlos. [18] Además, se argumentó que imponer a los investigadores africanos que operaban en situaciones de escasez de recursos los mismos estándares morales y de procedimiento que a sus contrapartes occidentales era poco realista y marginaría aún más el papel de los investigadores africanos en la comunidad científica e impediría el progreso de la ciencia africana. [19] Otro ensayo clínico, Using Nevirapine to Prevent Mother-to-Child HIV Transmission During Breastfeeding , se completó en septiembre de 2013. [20]
Una de las principales preocupaciones de este enfoque es que las mutaciones de resistencia a los INNTI se observan comúnmente tanto en madres como en bebés después de una dosis única de nevirapina, [21] y pueden comprometer la respuesta a futuros regímenes que contengan INNTI. [ 22] El Grupo de Trabajo del Servicio de Salud Pública de los EE. UU. recomienda un tratamiento corto con lamivudina/zidovudina materna para reducir este riesgo. [23]
Profilaxis posexposición no ocupacional
La nevirapina está contraindicada para la profilaxis posterior a la exposición no ocupacional, incluso para mujeres embarazadas y no embarazadas, debido a su grave toxicidad hepática. [24]
Efectos adversos
El efecto adverso más común de la nevirapina es el desarrollo de una erupción cutánea leve o moderada (13%). [25] [26] Se han observado reacciones cutáneas graves o potencialmente mortales en el 1,5% de los pacientes, incluido el síndrome de Stevens-Johnson , la necrólisis epidérmica tóxica y la hipersensibilidad . [25]
La nevirapina puede causar toxicidad hepática grave o potencialmente mortal, que suele aparecer en las primeras seis semanas de tratamiento. [25] [27] En 2000, la Administración de Alimentos y Medicamentos de los EE. UU. emitió una advertencia de recuadro negro sobre la nevirapina, advirtiendo que podría causar toxicidad hepática potencialmente mortal y reacciones cutáneas. [4] El riesgo inaceptablemente alto de síntomas hepáticos graves en ciertos grupos de pacientes (mujeres con recuento de CD4 >250 y hombres >400) [11] [28] ha llevado al DHHS de los EE. UU. a recomendar la restricción del uso de nevirapina a aquellos con menor riesgo, a menos que el beneficio para el paciente supere claramente el riesgo; [27] aunque en el estudio 2NN que encontró estos límites de CD4, el efecto se observó solo en pacientes reclutados de Tailandia. Estudios más recientes sobre el uso de Nevirapina en personas con recuentos elevados de células CD4 han llegado a la siguiente conclusión: los pacientes con experiencia en el tratamiento que comienzan una terapia combinada basada en NVP con recuentos bajos de células CD4 actuales y pre-TAR bajos y una carga viral indetectable tienen una probabilidad similar de interrumpir la terapia con NVP debido a reacciones de hipersensibilidad (HSR), en comparación con los pacientes sin tratamiento previo con recuentos bajos de células CD4. Esto sugiere que la terapia combinada basada en NVP puede iniciarse de manera segura en dichos pacientes. Sin embargo, en pacientes similares con una carga viral detectable, es prudente continuar adhiriéndose a los umbrales actuales de recuento de células CD4. [29] El Grupo de Trabajo del Servicio de Salud Pública de los EE. UU. recomienda precaución en el uso de nevirapina durante el embarazo debido a problemas de toxicidad, que pueden exacerbarse durante el embarazo. [23]
También se han observado casos de síndrome de reconstitución inmune y redistribución de grasa con este fármaco. [4]
La Administración de Alimentos y Medicamentos de los Estados Unidos recomienda suspender el tratamiento con nevirapina si una persona experimenta: [4]
- Signos y síntomas de problemas hepáticos como la hepatitis.
- Aumento de las transaminasas además de erupción cutánea o síntomas sistémicos.
- Formación de erupción con síntomas sistémicos.
- Reacciones cutáneas o de hipersensibilidad graves
Además, la FDA de EE. UU . recomienda un control estricto durante las primeras 6 semanas de tratamiento para detectar los síntomas antes mencionados, ya que existe un alto riesgo durante este período. Se recomienda un control continuo durante las primeras 18 semanas de tratamiento. Si un paciente presenta hepatitis más exantema u otros síntomas sistémicos, o hipersensibilidad grave o exantema cutáneo, no se debe reiniciar el tratamiento con nevirapina. [4]
Interacciones farmacológicas
La nevirapina es un sustrato de las enzimas hepáticas CYP3A y CYP2B6 . La administración concomitante de fármacos inhibidores de estas enzimas puede aumentar significativamente los niveles séricos de nevirapina. Algunos ejemplos de estos fármacos incluyen ritonavir , fosamprenavir y fluconazol . Por otro lado, los fármacos inductores de estas enzimas, como la rifampicina , pueden reducir los niveles séricos de nevirapina. [30] [18]
Además, el uso concomitante de la hierba de San Juan (Hypericum perforatum , que ha demostrado inducir CYP3A4 y CYP1A2 [31] ) o productos que contienen hierba de San Juan puede reducir significativamente los niveles de nevirapina. [30]
La nevirapina es un inductor de las isoenzimas CYP3A4 y CYP2B6 del citocromo P450 . Puede reducir los niveles de varios fármacos administrados de forma conjunta, incluidos los antirretrovirales efavirenz , indinavir , lopinavir , nelfinavir y saquinavir , así como claritromicina , ketoconazol , formas de anticoncepción hormonal y metadona . [25]
Mecanismo de acción
La nevirapina pertenece a la clase de antirretrovirales inhibidores de la transcriptasa inversa no nucleósidos (NNRTI). [32] Tanto los ITR nucleósidos como los no nucleósidos inhiben el mismo objetivo, la enzima transcriptasa inversa , una enzima viral esencial que transcribe el ARN viral en ADN. A diferencia de los ITR nucleósidos , que se unen al sitio activo de la polimerasa, los NNRTI se unen a un bolsillo hidrofóbico en el subdominio de p66 que está a unos 10 angstroms de distancia del sitio activo (conocido como el bolsillo de NNRTI). Por lo tanto, este bolsillo de unión de NNRTI inhibirá la transcripción inversa de una manera que es distinta a la de los NRTI. [33]
La nevirapina no es eficaz contra el VIH-2, ya que el bolsillo de la transcriptasa inversa del VIH-2 tiene una estructura diferente, lo que confiere resistencia intrínseca a la clase NNRTI. [34]
La resistencia a la nevirapina se desarrolla rápidamente si la replicación viral no se suprime por completo. [8] Las mutaciones más comunes observadas después del tratamiento con nevirapina son Y181C y K103N, que también se observan con otros INNTI. [25] [35] Como todos los INNTI se unen dentro del mismo bolsillo, las cepas virales que son resistentes a la nevirapina generalmente también son resistentes a los otros INNTI, efavirenz y delavirdina . Sin embargo, los INNTI de segunda generación como rilpivirina y etravirina son eficaces en el tratamiento de cepas de VIH resistentes a la nevirapina y otros medicamentos de primera generación de esa misma clase.
Historia
La nevirapina fue descubierta por Karl D. Hargrave y sus colegas de Boehringer Ingelheim Pharmaceuticals, Inc., una de las empresas del grupo Boehringer Ingelheim . Está protegida por la patente estadounidense 5.366.972, archivada el 20 de septiembre de 2018 en Wayback Machine , y las patentes extranjeras correspondientes. La nevirapina fue el primer inhibidor no nucleósido de la transcriptasa inversa (NNTI) aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). Fue aprobado el 21 de junio de 1996 para adultos y el 11 de septiembre de 1998 para niños. También fue aprobado en Europa en 1997.
Sociedad y cultura
La financiación de 500 millones de dólares del PEPFAR del ex presidente estadounidense George W. Bush para ayudar a combatir la epidemia de SIDA en África incluyó nevirapina, entre otros medicamentos y programas.
En Sudáfrica, la Campaña de Acción por el Tratamiento demandó con éxito al gobierno por no haber hecho que la nevirapina estuviera ampliamente disponible. En el caso Minister of Health v Treatment Action Campaign, el Tribunal Constitucional de Sudáfrica ordenó al gobierno que "eliminara inmediatamente las restricciones que impiden que la nevirapina esté disponible con el fin de reducir el riesgo de transmisión del VIH de madre a hijo en hospitales y clínicas públicas que no sean centros de investigación y formación [y] permitiera y facilitara el uso de la nevirapina con el fin de reducir el riesgo de transmisión del VIH de madre a hijo y que la pusiera a disposición con este fin en hospitales y clínicas cuando, a juicio del médico que atienda al paciente, actuando en consulta con el superintendente médico del centro en cuestión, esto esté médicamente indicado, lo que, de ser necesario, incluirá que la madre en cuestión haya sido examinada y asesorada adecuadamente". [36] [37]
Referencias
- ^ "Lista de todos los medicamentos con advertencias de recuadro negro obtenida por la FDA (use los enlaces Descargar resultados completos y Ver consulta)". nctr-crs.fda.gov . FDA . Consultado el 22 de octubre de 2023 .
- ^ "Medicamentos de prescripción: registro de nuevos medicamentos genéricos y medicamentos biosimilares, 2017". Therapeutic Goods Administration (TGA) . 21 de junio de 2022. Consultado el 30 de marzo de 2024 .
- ^ abcd "Viramune- nevirapine suspension Viramune- nevirapine tablet". DailyMed . 28 de octubre de 2019 . Consultado el 19 de noviembre de 2020 .
- ^ abcdef "Viramune-comprimido de nevirapina, liberación prolongada". DailyMed . 25 de octubre de 2019 . Consultado el 19 de noviembre de 2020 .
- ^ abcdefghij «Nevirapina». Sociedad Estadounidense de Farmacéuticos de Sistemas de Salud. Archivado desde el original el 20 de diciembre de 2016. Consultado el 3 de diciembre de 2016 .
- ^ Hamilton R (2015). Farmacopea de bolsillo Tarascon 2015, edición de lujo para bata de laboratorio . Jones & Bartlett Learning. pág. 63. ISBN 9781284057560.
- ^ Organización Mundial de la Salud (2019). Lista modelo de medicamentos esenciales de la Organización Mundial de la Salud: 21.ª lista , 2019. Ginebra: Organización Mundial de la Salud. hdl : 10665/325771 . OMS/MVP/EMP/IAU/2019.06. Licencia: CC BY-NC-SA 3.0 IGO.
- ^ ab Montaner JS, Reiss P, Cooper D, Vella S, Harris M, Conway B, et al. (marzo de 1998). "Un ensayo aleatorio, doble ciego que compara combinaciones de nevirapina, didanosina y zidovudina para pacientes infectados por VIH: el ensayo INCAS. Estudio en Italia, Países Bajos, Canadá y Australia". JAMA . 279 (12): 930–937. doi : 10.1001/jama.279.12.930 . PMID 9544767.
- ^ van Leeuwen R, Katlama C, Murphy RL, Squires K, Gatell J, Horban A, et al. (mayo de 2003). "Un ensayo aleatorizado para estudiar la terapia combinada de primera línea con o sin un inhibidor de la proteasa en pacientes infectados por VIH-1". AIDS . 17 (7): 987–999. doi : 10.1097/00002030-200305020-00007 . PMID 12700448. S2CID 25420787.
- ^ Podzamczer D, Ferrer E, Consiglio E, Gatell JM, Perez P, Perez JL, et al. (junio de 2002). "Un ensayo clínico aleatorizado que compara nelfinavir o nevirapina asociados a zidovudina/lamivudina en pacientes sin tratamiento previo con infección por VIH (estudio Combine)". Antiviral Therapy . 7 (2): 81–90. doi : 10.1177/135965350200700202 . PMID 12212928. S2CID 31574879.
- ^ abc van Leth F, Andrews S, Grinsztejn B, Wilkins E, Lazanas MK, Lange JM, Montaner J (marzo de 2005). "El efecto del recuento basal de células CD4 y la carga viral del VIH-1 en la eficacia y seguridad de la TARGA de primera línea basada en nevirapina o efavirenz". SIDA . 19 (5): 463–471. doi : 10.1097/01.aids.0000162334.12815.5b . PMID 15764851. S2CID 20933620.
- ^ "Panel sobre terapia antirretroviral y manejo médico de niños infectados por VIH: pautas para el uso de agentes antirretrovirales en la infección pediátrica por VIH". AIDSinfo, Departamento de Salud y Servicios Humanos de los Estados Unidos (HHS). Marzo de 2016. Archivado desde el original el 7 de noviembre de 2016. Consultado el 5 de noviembre de 2016 .
- ^ Guay LA, Musoke P, Fleming T, Bagenda D, Allen M, Nakabiito C, et al. (Septiembre de 1999). "Nevirapina en dosis única intraparto y neonatal en comparación con zidovudina para la prevención de la transmisión maternoinfantil del VIH-1 en Kampala, Uganda: ensayo aleatorizado VIHNET 012". Lanceta . 354 (9181): 795–802. doi : 10.1016/S0140-6736(99)80008-7 . PMID 10485720. S2CID 6740488.
- ^ Solomon J. "Investigación defectuosa sobre medicamentos clave contra el SIDA".
- ^ Lallemant M, Jourdain G, Le Coeur S, Mary JY, Ngo-Giang-Huong N, Koetsawang S, et al. (julio de 2004). "Dosis única de nevirapina perinatal más zidovudina estándar para prevenir la transmisión de madre a hijo del VIH-1 en Tailandia". The New England Journal of Medicine . 351 (3): 217–228. doi : 10.1056/NEJMoa033500 . PMID 15247338.
- ^ El estudio HIVNET 012 y la seguridad y eficacia de la nevirapina en la prevención de la transmisión del VIH de madre a hijo, "El estudio HIVNET 012 y la seguridad y eficacia de la nevirapina en la prevención de la transmisión del VIH de madre a hijo". Archivado desde el original el 2009-02-01 . Consultado el 2009-01-23 .
- ^ Celia Farber, "Fuera de control: el sida y la corrupción de la ciencia" Farber C (marzo de 2006). "[Artículo] Fuera de control, por Celia Farber". Harper's Magazine . Vol. Marzo de 2006. Archivado desde el original el 2009-05-04 . Consultado el 2009-06-11 .
- ^ Crane J (diciembre de 2010). "Eventos adversos y efectos placebo: científicos africanos, VIH y ética en las 'ciencias de la salud global'"". Estudios Sociales de la Ciencia . 40 (6): 843–870. doi :10.1177/0306312710371145. PMID 21553555. S2CID 26027925.
- ^ Lock, M. y Nguyen, V 2010, Una antropología de la biomedicina, Malden, Wiley-Blackwell.
- ^ "Uso de nevirapina para prevenir la transmisión del VIH de madre a hijo durante la lactancia materna - Ver texto completo - ClinicalTrials.gov". Archivado desde el original el 2008-12-05 . Consultado el 2009-01-23 .
- ^ Johnson JA, Li JF, Morris L, Martinson N, Gray G, McIntyre J, Heneine W (julio de 2005). "Se subestima sustancialmente la aparición de VIH-1 resistente a fármacos tras la administración intraparto de una dosis única de nevirapina". The Journal of Infectious Diseases . 192 (1): 16–23. doi : 10.1086/430741 . PMID 15942889.
- ^ Jourdain G, Ngo-Giang-Huong N, Le Coeur S, Bowonwatanuwong C, Kantipong P, Leechanachai P, et al. (julio de 2004). "Exposición intraparto a nevirapina y respuestas maternas posteriores a la terapia antirretroviral basada en nevirapina". The New England Journal of Medicine . 351 (3): 229–240. doi : 10.1056/NEJMoa041305 . PMID 15247339.
- ^ ab Panel sobre el tratamiento de mujeres embarazadas infectadas por el VIH y la prevención de la transmisión perinatal. Recomendaciones para el uso de medicamentos antirretrovirales en mujeres embarazadas infectadas por el VIH-1 para la salud materna e intervenciones para reducir la transmisión perinatal del VIH en los Estados Unidos. "Recomendaciones para el uso de medicamentos antirretrovirales en mujeres embarazadas infectadas por el VIH-1 para la salud materna e intervenciones para reducir la transmisión perinatal del VIH en los Estados Unidos | Red Nacional de Información sobre Prevención | Conectando a los profesionales de la salud pública con información confiable y entre sí". Archivado (PDF) desde el original el 2014-04-12 . Consultado el 2014-04-11 .. Consultado el 16 de noviembre de 2016.
- ^ "Directrices actualizadas para la profilaxis posexposición a los antirretrovirales después de la exposición sexual, el uso de drogas inyectables u otra exposición no ocupacional al VIH: Estados Unidos, 2016". Centros para el Control y la Prevención de Enfermedades.
- ^ abcde Tabletas de Viramune (nevirapina); Información de prescripción de suspensión oral de Viramune (nevirapina) Archivado el 12 de noviembre de 2006 en Wayback Machine
- ^ "Hoja informativa de la Red de Datos sobre el Tratamiento del SIDA". Archivado desde el original el 13 de enero de 2006. Consultado el 16 de enero de 2006 .
- ^ Panel del DHHS. Pautas para el uso de agentes antirretrovirales en adultos y adolescentes infectados por VIH-1 (4 de mayo de 2006). (Disponible para descarga en AIDSInfo. Archivado el 6 de mayo de 2006 en Wayback Machine ).
- ^ Stern JO, Robinson PA, Love J, Lanes S, Imperiale MS, Mayers DL (septiembre de 2003). "Un análisis exhaustivo de la seguridad hepática de la nevirapina en diferentes poblaciones de pacientes infectados por el VIH". Journal of Acquired Immune Deficiency Syndromes . 34 (Supl 1): S21–S33. doi : 10.1097/00126334-200309011-00005 . PMID 14562855. S2CID 36971857.
- ^ Wit FW, Kesselring AM, Gras L, Richter C, van der Ende ME, Brinkman K, et al. (marzo de 2008). "Interrupción de nevirapina debido a reacciones de hipersensibilidad en pacientes con experiencia previa en tratamiento, en comparación con pacientes sin tratamiento previo: el estudio de cohorte ATHENA". Clinical Infectious Diseases . 46 (6): 933–940. doi : 10.1086/528861 . PMID 18271750.
- ^ ab "Información de prescripción de VIRAMUNE® (nevirapina)" (PDF) . Archivado (PDF) del original el 8 de noviembre de 2016.
- ^ Wenk M, Todesco L, Krähenbühl S (abril de 2004). "Efecto de la hierba de San Juan sobre las actividades de CYP1A2, CYP3A4, CYP2D6, N-acetiltransferasa 2 y xantina oxidasa en hombres y mujeres sanos". British Journal of Clinical Pharmacology . 57 (4): 495–499. doi :10.1111/j.1365-2125.2003.02049.x. PMC 1884478 . PMID 15025748.
- ^ Patel SS, Benfield P (octubre de 1996). "Nuevo perfil farmacológico: nevirapina". Inmunoterapia clínica . 6 (4): 307–317. doi :10.1007/BF03259093. S2CID 260490614.
- ^ Schauer GD, Huber KD, Leuba SH, Sluis-Cremer N (octubre de 2014). "Mecanismo de inhibición alostérica de la transcriptasa inversa del VIH-1 revelado por fluorescencia de moléculas individuales y de conjunto". Nucleic Acids Research . 42 (18): 11687–11696. doi :10.1093/nar/gku819. PMC 4191400 . PMID 25232099.
- ^ Ren J, Bird LE, Chamberlain PP, Stewart-Jones GB, Stuart DI, Stammers DK (octubre de 2002). "Estructura de la transcriptasa inversa del VIH-2 con una resolución de 2,35 A y el mecanismo de resistencia a los inhibidores no nucleósidos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 99 (22): 14410–14415. Bibcode :2002PNAS...9914410R. doi : 10.1073/pnas.222366699 . PMC 137897 . PMID 12386343.
- ^ Conway B, Wainberg MA, Hall D, Harris M, Reiss P, Cooper D, et al. (julio de 2001). "Desarrollo de resistencia a fármacos en pacientes que reciben combinaciones de zidovudina, didanosina y nevirapina". AIDS . 15 (10): 1269–1274. doi : 10.1097/00002030-200107060-00008 . PMID 11426071. S2CID 24944611.
- ^ Budlender S, Marcus G, Ferreira NM (octubre de 2014). Litigios de interés público y cambio social en Sudáfrica: estrategias, tácticas y lecciones (PDF) . The Atlantic Philanthropies.
- ^ "Ministro de Salud y otros contra Treatment Action Campaign y otros (n.º 2) (CCT8/02) [2002] ZACC 15; 2002 (5) SA 721; 2002 (10) BCLR 1033 (5 de julio de 2002)". Instituto Sudafricano de Información Legal . 5 de julio de 2002. Consultado el 31 de enero de 2022 .


