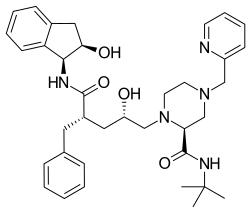
Indinavir
 | |
 | |
| Datos clínicos | |
|---|---|
| Nombres comerciales | Crixiván |
| AHFS / Drogas.com | Monografía |
| MedlinePlus | a696028 |
| Datos de licencia | |
| Vías de administración | Oral |
| Código ATC |
|
| Datos farmacocinéticos | |
| Biodisponibilidad | ~65% |
| Unión de proteínas | 60% |
| Metabolismo | Hepático a través de CYP3A4 |
| Vida media de eliminación | 1,8 ± 0,4 horas |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Banco de medicamentos | |
| Araña química | |
| UNIVERSIDAD |
|
| BARRIL | |
| EBICh | |
| Química biológica | |
| Base de datos de sustancias químicas del NIAID |
|
| Ligando PDB |
|
| Panel de control CompTox ( EPA ) |
|
| Datos químicos y físicos | |
| Fórmula | C36H47N5O4 |
| Masa molar | 613,803 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
 norte norte Y (¿que es esto?) (verificar) Y (¿que es esto?) (verificar) | |
El indinavir ( IDV ; nombre comercial Crixivan , fabricado por Merck ) es un inhibidor de la proteasa que se utiliza como componente de la terapia antirretroviral de gran actividad para tratar el VIH/SIDA . Es un polvo blanco soluble que se administra por vía oral en combinación con otros fármacos antivirales. El fármaco impide que la proteasa funcione normalmente. En consecuencia, los virus del VIH no pueden reproducirse, lo que provoca una disminución de la carga viral. El indinavir que se vende comercialmente es indinavir anhidro, que es indinavir con una amina adicional en la cadena principal de hidroxietileno. Esto mejora su solubilidad y biodisponibilidad oral, lo que facilita su ingesta por parte de los usuarios. Se produjo sintéticamente con el propósito de inhibir la proteasa en el virus del VIH. [1]
Actualmente, no se recomienda su uso en el tratamiento del VIH/SIDA debido a sus efectos secundarios. Además, es un medicamento controvertido por muchas razones, desde su desarrollo hasta su uso.
Fue patentado en 1991 y aprobado para uso médico en 1996. [2]
Usos médicos
El indinavir no cura el VIH/SIDA, pero puede prolongar la vida de una persona durante varios años al frenar la progresión de la enfermedad. El tipo de medicamento que se utiliza ampliamente y que ha creado Merck es el sulfato de indinavir. Las pastillas se crean a partir de sales de sulfato y se venden en dosis de 100, 200, 333 y 400 mg de indinavir. Normalmente se utiliza como uno de los tres medicamentos de una terapia de triple combinación para el virus del VIH. [1]
Las cápsulas disponibles comercialmente deben conservarse a una temperatura de entre 15 y 30 °C. Deben guardarse en un recipiente hermético para protegerlas de la humedad. Por lo tanto, se recomienda que los usuarios conserven las píldoras en el frasco provisto por el fabricante y no retiren el desecante. [1]
El efecto del indinavir desaparece rápidamente después de la dosificación. El indinavir sin potenciar requiere una dosis muy precisa de 400 mg cada ocho horas para impedir que el VIH forme mutaciones resistentes a los fármacos, incluidas las resistencias a otros inhibidores de la proteasa. El indinavir potenciado requiere dos cápsulas de indinavir de 400 mg con 1 a 2 cápsulas de ritonavir de 100 mg dos veces al día. En ambos casos, los fármacos deben tomarse con abundante agua una o dos horas después de una comida. Se recomienda que los usuarios beban al menos 1,5 litros al día cuando toman el fármaco. Los usuarios de fármacos deben aumentar significativamente su ingesta de agua debido a la baja solubilidad del indinavir que puede hacer que se cristalice. Existen restricciones sobre qué tipo de alimentos se pueden comer simultáneamente con el tratamiento con indinavir sin potenciar. Además, ya no se recomienda su uso en los Estados Unidos para tratamientos iniciales debido a la carga de pastillas y al riesgo de cálculos renales. [4]
Resistencia viral
Muchas personas se mostraron escépticas y no se mostraron demasiado optimistas con el indinavir debido a los acontecimientos previos que se produjeron con el AZT . La resistencia viral al fármaco hace que éste se vuelva inútil, ya que el virus evoluciona para tener células que son capaces de resistir al inhibidor de la proteasa. Para evitar esto tanto como sea posible, es importante que los usuarios tomen siempre la cantidad exacta del fármaco en los momentos asignados. Este miedo a la resistencia viral hizo que muchos usuarios desconfiaran del fármaco. [5]
Efectos secundarios
Los efectos secundarios más comunes del indinavir incluyen:
- Trastornos gastrointestinales (dolor abdominal, diarrea, náuseas, vómitos) [4]
- Malestar general y fatiga [4]
- Nefrolitiasis/urolitiasis (formación de cálculos renales ), que a veces puede derivar en afecciones más graves, incluida insuficiencia renal.
- Alteraciones metabólicas que incluyen hiperlipidemia ( elevación del colesterol o triglicéridos ) e hiperglucemia.
- Alteraciones en la forma corporal ( lipodistrofia ), conocida coloquialmente como “vientre de Crix” [6]
- Aumento de los niveles de bilirrubina , [7] lo que hace que la piel y las partes blancas de los ojos se tornen amarillas [8]
- Inhibe la producción de óxido nitroso urinario y puede inhibir la producción de óxido nítrico.
- Anormalidades renales, leucocituria estéril y aclaramiento de creatinina reducido . [9]
- Altera la función endotelial en hombres VIH negativos sanos y puede acelerar la enfermedad aterosclerótica . [10]
Propiedades químicas

El indinavir es un polvo blanco cristalino, muy soluble en agua y metanol. Cada cápsula contiene sal de sulfato además de lactosa anhidra y estearato de magnesio. La cubierta de la cápsula está hecha de gelatina y dióxido de titanio. Su punto de fusión o temperatura de descomposición es de 150 – 153 °C, a partir de la cual comienza a emitir vapores tóxicos como óxidos de nitrógeno y óxidos de azufre.
[4]
El fármaco se introduce en la proteasa, impidiéndole funcionar con normalidad. Como resultado, no se pueden formar las proteínas estructurales, resultantes de los productos polipeptídicos de los genes gag y gag-pol. Estas proteínas estructurales son necesarias para la síntesis de nuevos viriones del VIH. Con el tiempo, la carga viral disminuye debido a la falta de reproducción. [1]
Historia
El inicio oficial de su desarrollo se produjo en diciembre de 1986, cuando el presidente de Merck, Edward Scolnick , anunció que iniciarían un programa integral de investigación sobre el SIDA. Pusieron en marcha un laboratorio dedicado a la investigación del SIDA en West Point, Pensilvania , y pusieron a Emilio Emini a cargo del laboratorio. [11] Un par de meses después, en enero de 1987, un equipo de investigadores formado por Emilio Emini, Joel Huff e Irving Sigal, dio el puntapié inicial a sus estudios basando su proyecto en investigaciones anteriores sobre la enzima proteasa, renina . [5] Fueron ellos quienes iniciaron el proceso de investigación y desarrollo de los inhibidores de la proteasa y su relación con el virus. Más de un año después, en julio de 1988, Nancy Kohl, Emilio Emini, et al., publicaron en las Actas de la Academia Nacional de Ciencias sobre la idea de inhibir la proteasa. [11] En febrero de 1989, Manuela Navia, Paula Fitzgerald y otros publicaron un artículo que mostraba la estructura tridimensional de la enzima proteasa del VIH. [5] Otros investigadores afirman que este estudio ayudó a determinar la trayectoria futura del desarrollo del inhibidor. Después de mucha investigación, en marzo de 1990, los investigadores dirigidos por Reider recibieron una patente para sintetizar parte del compuesto L-689, 502. Estos eran similares a los inhibidores existentes. Sin embargo, no superaron las evaluaciones de seguridad debido a su toxicidad. [11]
Al ver que la investigación sobre su fármaco iba encaminada a conseguir que finalmente saliera al mercado, Merck decidió crear un consejo asesor comunitario compuesto por activistas del SIDA que ayudarían con el esfuerzo de desarrollo del fármaco en marzo de 1991. [ cita requerida ] Más tarde, Merck enfrentó una reacción grave de los miembros de la comunidad a quienes, sin embargo, no les gustaba el precio y la distribución del fármaco. [ cita requerida ]
En enero de 1992, los investigadores sintetizaron el sulfato de indinavir (Crixivan), al que se le asignó el número de compuesto L-735,524. Comenzaron a probar el L-735,524 en animales un par de meses después y descubrieron que era seguro para los animales. En consecuencia, la empresa decidió que era seguro comenzar los ensayos en humanos en septiembre del mismo año. [11] Bruce D. Dorsey, James P. Guare, Joseph P. Vacca, M. Katherine Holloway y Randall W. Hungate fueron nombrados inventores del año por los propietarios de la propiedad intelectual de Crixivan. [12] [13]
La Administración de Alimentos y Medicamentos (FDA) aprobó el indinavir en marzo de 1996, convirtiéndose en el octavo fármaco antirretroviral aprobado. La FDA le dio su aprobación por primera vez el 1 de marzo y luego lo aprobó tan sólo 42 días después de que la empresa presentara el medicamento a la FDA. Una de las principales razones de esta rápida aprobación fue la presentación que Merck hizo al comité con los resultados del estudio 035 (véase más abajo). El hecho de que tuvieran una aprobación rápida generó problemas con grupos como Treatment Action Group , que pensaban que la aprobación acelerada de medicamentos no era beneficiosa para las personas infectadas con VIH/SIDA. [5]
A partir de entonces, el uso de indinavir junto con inhibidores duales de la transcriptasa inversa (INTI) estableció un nuevo estándar para el tratamiento del VIH/SIDA. Los inhibidores de la proteasa cambiaron la naturaleza del SIDA, que pasó de ser una enfermedad terminal a una enfermedad relativamente manejable. Aumentaron significativamente la expectativa de vida y redujeron los síntomas notorios de las enfermedades infecciosas que eran el resultado de un sistema inmunológico debilitado por el virus. Actualmente, se lo está reemplazando por medicamentos más nuevos que son más convenientes de tomar, tienen menos probabilidades de promover la resistencia del virus y son menos tóxicos, como el darunavir o el atazanavir . [5]
Ensayos clínicos
En enero de 1996, Merck & Co. demostró que el indinavir era un fármaco clínicamente eficaz basándose en datos de ensayos en humanos. Pudieron demostrar que el indinavir, cuando se utilizaba con otros dos fármacos anti-VIH, podía reducir significativamente la carga viral del VIH. [5]
Estudio 035
El objetivo del estudio era mostrar los diferentes efectos de los distintos tratamientos antivirales. Se asignaron aleatoriamente 97 pacientes a uno de los tres grupos: monoterapia con indinavir, AZT y lamivudina , o los tres agentes. Los pacientes elegibles fueron aquellos que recibieron AZT durante al menos 6 meses y tenían recuentos de células CD4 entre 50 y 400, cargas virales de al menos 200.000 copias/ml y no habían recibido terapia antirretroviral previa con inhibidor de la proteasa o lamivudina. [14]
Los resultados del estudio demostraron que el tratamiento más eficaz fue el de tres fármacos. Después de 24 semanas de tratamiento, 24 pacientes de los 28 que recibieron los tres fármacos lograron tener niveles de carga viral inferiores a 500 copias/ml. Doce de los 28 pacientes bajo monoterapia con indinavir alcanzaron 500 copias/ml, y ninguno de los treinta pacientes del grupo de AZT y lamivudina bajó de 500 copias. [14]
Acta 320
Este estudio examinó la eficacia clínica de los diferentes tratamientos. Los pacientes debían tener recuentos de células CD4 inferiores a 200 y al menos 3 meses de terapia con AZT antes de los ensayos. 1156 pacientes con una media de recuentos de células CD4 de 87 y una carga viral media de 100.000 copias/ml fueron asignados aleatoriamente a uno de los dos grupos: AZT más lamivudina o AZT más lamivudina más indinavir. Al igual que en el estudio 035, los pacientes no podían participar en el estudio si habían recibido tratamiento previo con inhibidores de la proteasa o lamivudina durante más de una semana. El punto final del estudio fue la muerte o el desarrollo de infecciones oportunistas. [15]
Después de 38 semanas, el 6% de las personas del grupo de tres fármacos murió, mientras que el 11% de las personas del grupo de dos fármacos murió. Hubo recuentos de células CD4 más altos y una carga viral menor en los pacientes asignados al grupo de tres fármacos, lo que demuestra que un tratamiento con tres fármacos es más eficiente que uno con dos fármacos. [15]
Controversia
Suministrar
Merck no tuvo tiempo suficiente para preparar suficientes medicamentos para distribuirlos a todos los infectados. Entre 650.000 y 900.000 personas se infectaron con el virus y Merck sólo pudo proporcionar medicamentos a unas 25.000 o 30.000 personas. Además, el medicamento debe tomarse de forma constante o, de lo contrario, los usuarios se enfrentan a peligros, lo que significa que la empresa tiene que tener en cuenta las recargas para los usuarios que toman los medicamentos. Esta situación de suministro limitado provocó que muchos activistas se enfadaran por el hecho de que estuvieran vendiendo en cantidades tan limitadas. [16]
Distribución
Debido a la escasez de suministros, Merck decidió adoptar un sistema de distribución única, en el que enviaría indinavir a una sola empresa farmacéutica minorista. Lo vendió a la farmacia de Stadtalnder y cantidades limitadas a los hospitales de la Administración de Veteranos y a algunas organizaciones de atención médica administrada. Esto provocó un aumento de los precios y limitó el número de personas que podían tener acceso a este fármaco que podría salvar vidas. [17]
Precio
El precio de Indinavir es de unos 12 dólares por dosis diaria, un 24% menos que el de Invirase y un 33% menos que el de Norvir. [16] Como la empresa utilizaba un sistema de distribución único para vender sus medicamentos, el precio de venta al público se incrementaba en un 37% en la farmacia que lo vendía. En respuesta a este elevado precio, Merck afirmó que la investigación y el desarrollo del medicamento costaban mucho dinero y que no tenían suficientes suministros para venderlo a través de un sistema de distribución normal. Los activistas protestaron contra este precio porque dificultaba el acceso de la gente al medicamento. [17]
Referencias
- ^ abcd "Indinavir". PubChem . Biblioteca Nacional de Medicina de EE. UU . . Consultado el 22 de octubre de 2018 .
- ^ Fischer J, Ganellin CR (2006). Descubrimiento de fármacos basado en análogos. John Wiley & Sons. pág. 509. ISBN 9783527607495.
- ^ Liu F, Boross PI, Wang YF, Tozser J, Louis JM, Harrison RW, et al. (diciembre de 2005). "Cambios cinéticos, de estabilidad y estructurales en las estructuras cristalinas de alta resolución de la proteasa del VIH-1 con mutaciones resistentes a fármacos L24I, I50V y G73S". Journal of Molecular Biology . 354 (4): 789–800. doi :10.1016/j.jmb.2005.09.095. PMC 1403828 . PMID 16277992.
- ^ abcd "Crixivan (sulfato de indinavir): efectos secundarios, interacciones, advertencias, dosis y usos". RxList . Consultado el 8 de noviembre de 2018 .
- ^ abcdef Cohen J (junio de 1996). "Inhibidores de la proteasa: una historia de dos empresas". Science . 272 (5270): 1882–1883. Bibcode :1996Sci...272.1882C. doi :10.1126/science.272.5270.1882. PMID 8658156. S2CID 84869965.
- ^ Capaldini L (agosto de 1997). "Efectos secundarios metabólicos de los inhibidores de la proteasa: colesterol, triglicéridos, azúcar en sangre y "vientre de Crix". Entrevista con Lisa Capaldini, MD Entrevista realizada por John S. James". AIDS Treatment News (277): 1–4. PMID 11364559.
- ^ "Indinavir". livertox.nih.gov . 2012. PMID 31643176 . Consultado el 21 de octubre de 2018 .
- ^ MacGill M (24 de julio de 2018). «Niveles altos de bilirrubina: significado, síntomas y pruebas». Medical News Today . Consultado el 21 de octubre de 2018 .
- ^ Eira M, Araujo M, Seguro AC (agosto de 2006). "Excreción urinaria de NO3 e insuficiencia renal en pacientes tratados con indinavir". Revista Brasileira de Pesquisas Medicas e Biologicas = Revista Brasileira de Pesquisas Medicas e Biologicas . 39 (8): 1065–1070. doi : 10.1590/s0100-879x2006000800009 . PMID 16906281.
- ^ Shankar SS, Dubé MP, Gorski JC, Klaunig JE, Steinberg HO (noviembre de 2005). "El indinavir altera la función endotelial en hombres VIH negativos sanos". American Heart Journal . 150 (5): 933.e1–933.e7. doi :10.1016/j.ahj.2005.06.005. PMID 16290967.
- ^ abcd "Historia y descubrimiento y desarrollo de Crixivan". quod.lib.umich.edu . 1996 . Consultado el 24 de octubre de 2018 .
- ^ Elser C (27 de abril de 1997). "Los científicos de Merck descubren que la persistencia da sus frutos en la búsqueda de un fármaco contra el VIH". The Morning Call .
- ^ Chartrand S (21 de abril de 1997). "PATENTES - Forrest Gump, mejor que nunca. Inserten su imagen, por ejemplo, en el estadio Ebbets Field a fines de los años 40. Se rinde homenaje a los investigadores del SIDA". The New York Times .
- ^ ab Gulick RM, Mellors JW, Havlir D, Eron JJ, Gonzalez C, McMahon D, et al. (septiembre de 1997). "Tratamiento con indinavir, zidovudina y lamivudina en adultos con infección por el virus de la inmunodeficiencia humana y terapia antirretroviral previa". The New England Journal of Medicine . 337 (11): 734–739. doi : 10.1056/nejm199709113371102 . PMID 9287228.
- ^ ab Hammer SM, Squires KE, Hughes MD, Grimes JM, Demeter LM, Currier JS, et al. (septiembre de 1997). "Un ensayo controlado de dos análogos de nucleósidos más indinavir en personas con infección por el virus de la inmunodeficiencia humana y recuentos de células CD4 de 200 por milímetro cúbico o menos. Equipo de estudio del AIDS Clinical Trials Group 320". The New England Journal of Medicine . 337 (11): 725–733. doi : 10.1056/nejm199709113371101 . PMID 9287227. S2CID 24043435.
- ^ ab Tanouye E, Waldholz M (7 de mayo de 1996). "Merck genera controversia con la comercialización de un fármaco contra el sida". Wall Street Journal . Consultado el 8 de noviembre de 2018 .
- ^ ab Hilts PJ (15 de marzo de 1996). "Con una velocidad récord, la FDA aprueba un nuevo fármaco contra el sida". The New York Times . Consultado el 24 de octubre de 2018 .

