Cristalografía de rayos X

La cristalografía de rayos X es la ciencia experimental que determina la estructura atómica y molecular de un cristal , en la que la estructura cristalina hace que un haz de rayos X incidentes se difracte en direcciones específicas. Al medir los ángulos y las intensidades de la difracción de rayos X , un cristalógrafo puede producir una imagen tridimensional de la densidad de electrones dentro del cristal y las posiciones de los átomos, así como sus enlaces químicos , el desorden cristalográfico y otra información.
La cristalografía de rayos X ha sido fundamental en el desarrollo de muchos campos científicos. En sus primeras décadas de uso, este método determinó el tamaño de los átomos, las longitudes y tipos de enlaces químicos y las diferencias a escala atómica entre diversos materiales, especialmente minerales y aleaciones . El método también ha revelado la estructura y función de muchas moléculas biológicas, incluidas vitaminas , fármacos, proteínas y ácidos nucleicos como el ADN . La cristalografía de rayos X sigue siendo el método principal para caracterizar la estructura atómica de los materiales y para diferenciar materiales que parecen similares en otros experimentos. Las estructuras cristalinas de rayos X también pueden ayudar a explicar propiedades electrónicas o elásticas inusuales de un material, arrojar luz sobre interacciones y procesos químicos o servir como base para diseñar productos farmacéuticos contra enfermedades .
El trabajo moderno implica una serie de pasos, todos ellos importantes. Los pasos preliminares incluyen la preparación de muestras de buena calidad, el registro cuidadoso de las intensidades difractadas y el procesamiento de los datos para eliminar los artefactos. A continuación se utilizan diversos métodos para obtener una estimación de la estructura atómica, denominados genéricamente métodos directos. Con una estimación inicial se utilizan otras técnicas computacionales, como las que implican mapas de diferencias, para completar la estructura. El paso final es un refinamiento numérico de las posiciones atómicas frente a los datos experimentales, a veces asistido por cálculos ab initio . En casi todos los casos, las nuevas estructuras se depositan en bases de datos disponibles para la comunidad internacional.
Historia
Los cristales, aunque admirados durante mucho tiempo por su regularidad y simetría, no fueron investigados científicamente hasta el siglo XVII. Johannes Kepler planteó la hipótesis en su obra Strena seu de Nive Sexangula (Un regalo de Año Nuevo de nieve hexagonal) (1611) de que la simetría hexagonal de los cristales de los copos de nieve se debía a un empaquetamiento regular de partículas esféricas de agua. [1] El científico danés Nicolas Steno (1669) fue pionero en las investigaciones experimentales de la simetría de los cristales. Steno demostró que los ángulos entre las caras son los mismos en cada ejemplar de un tipo particular de cristal. [2] René Just Haüy (1784) descubrió que cada cara de un cristal puede describirse mediante patrones simples de apilamiento de bloques de la misma forma y tamaño. Por lo tanto, William Hallowes Miller en 1839 pudo dar a cada cara una etiqueta única de tres pequeños números enteros, los índices de Miller que siguen utilizándose para identificar las caras de los cristales. El estudio de Haüy condujo a la idea de que los cristales son una matriz tridimensional regular (una red de Bravais ) de átomos y moléculas ; una única celda unitaria se repite indefinidamente a lo largo de tres direcciones principales. En el siglo XIX, Johan Hessel , [3] Auguste Bravais , [4] Evgraf Fedorov , [5] Arthur Schönflies [6] y (tardíamente) William Barlow (1894) elaboraron un catálogo completo de las posibles simetrías de un cristal . Barlow propuso varias estructuras cristalinas en la década de 1880 que fueron validadas más tarde mediante cristalografía de rayos X; [7] sin embargo, los datos disponibles eran demasiado escasos en la década de 1880 para aceptar sus modelos como concluyentes.

Wilhelm Röntgen descubrió los rayos X en 1895. [8] Los físicos no estaban seguros de la naturaleza de los rayos X, pero sospechaban que eran ondas de radiación electromagnética . La teoría de Maxwell de la radiación electromagnética fue bien aceptada, y los experimentos de Charles Glover Barkla mostraron que los rayos X exhibían fenómenos asociados con las ondas electromagnéticas, incluyendo polarización transversal y líneas espectrales similares a las observadas en las longitudes de onda visibles. Barkla creó la notación de rayos X para las líneas espectrales agudas, notando en 1909 dos energías separadas, primero nombrándolas "A" y "B" y luego suponiendo que puede haber líneas anteriores a "A", comenzó una numeración alfabética que comienza con "K". [9] [10] Los experimentos de una sola rendija en el laboratorio de Arnold Sommerfeld sugirieron que los rayos X tenían una longitud de onda de aproximadamente 1 angstrom . [11] Los rayos X no son sólo ondas, sino que también tienen propiedades de partículas, lo que provocó que Sommerfeld acuñara el nombre de Bremsstrahlung para los espectros continuos cuando se formaban cuando los electrones bombardeaban un material. [10] Albert Einstein introdujo el concepto de fotón en 1905, [12] pero no fue ampliamente aceptado hasta 1922, [13] [14] cuando Arthur Compton lo confirmó mediante la dispersión de rayos X de los electrones. [15] Las propiedades similares a partículas de los rayos X, como su ionización de los gases, habían llevado a William Henry Bragg a argumentar en 1907 que los rayos X no eran radiación electromagnética. [16] [17] [18] [19] La opinión de Bragg resultó impopular y la observación de la difracción de rayos X por Max von Laue en 1912 [20] confirmó que los rayos X son una forma de radiación electromagnética.

La idea de que los cristales pudieran utilizarse como rejilla de difracción de rayos X surgió en 1912 en una conversación entre Paul Peter Ewald y Max von Laue en el Jardín Inglés de Múnich. Ewald había propuesto un modelo de resonador de cristales para su tesis, pero este modelo no podía ser validado utilizando luz visible , ya que la longitud de onda era mucho mayor que el espaciamiento entre los resonadores. Von Laue se dio cuenta de que se necesitaba radiación electromagnética de una longitud de onda más corta, y sugirió que los rayos X podrían tener una longitud de onda comparable al espaciamiento de la celda unitaria en los cristales. Von Laue trabajó con dos técnicos, Walter Friedrich y su asistente Paul Knipping, para hacer brillar un haz de rayos X a través de un cristal de sulfato de cobre y registrar su difracción en una placa fotográfica . Después de ser revelada, la placa mostró una gran cantidad de puntos bien definidos dispuestos en un patrón de círculos que se entrecruzaban alrededor del punto producido por el haz central. Los resultados fueron presentados a la Academia Bávara de Ciencias y Humanidades en junio de 1912 como "Interferenz-Erscheinungen bei Röntgenstrahlen" (Fenómenos de interferencia en rayos X). [20] [21] Von Laue desarrolló una ley que conecta los ángulos de dispersión y el tamaño y la orientación de los espaciamientos de las celdas unitarias en el cristal, por la que recibió el Premio Nobel de Física en 1914. [22]

Después de la investigación pionera de Von Laue, el campo se desarrolló rápidamente, sobre todo por los físicos William Lawrence Bragg y su padre William Henry Bragg . En 1912-1913, el joven Bragg desarrolló la ley de Bragg , que conecta la dispersión con planos espaciados uniformemente dentro de un cristal. [8] [23] [24] [25] Los Bragg, padre e hijo, compartieron el Premio Nobel de Física de 1915 por su trabajo en cristalografía. Las primeras estructuras eran generalmente simples; a medida que los métodos computacionales y experimentales mejoraron en las décadas siguientes, se hizo factible deducir posiciones atómicas confiables para arreglos más complicados de átomos.
Las primeras estructuras eran cristales y minerales inorgánicos simples, pero incluso estos revelaron leyes fundamentales de la física y la química. La primera estructura de resolución atómica que se "resuelve" (es decir, se determina) en 1914 fue la de la sal de mesa . [26] [27] [28] La distribución de electrones en la estructura de la sal de mesa mostró que los cristales no están necesariamente compuestos de moléculas unidas covalentemente y demostró la existencia de compuestos iónicos . [29] La estructura del diamante se resolvió en el mismo año, [30] [31] probando la disposición tetraédrica de sus enlaces químicos y mostrando que la longitud del enlace simple C–C era de aproximadamente 1,52 angstroms. Otras estructuras tempranas incluyeron cobre, [32] fluoruro de calcio (CaF 2 , también conocido como fluorita ), calcita (CaCO 3 ) y pirita (FeS 2 ) [33] en 1914; espinela (MgAl 2 O 4 ) en 1915; [34] [35] las formas rutilo y anatasa del dióxido de titanio (TiO 2 ) en 1916; [36] pirocroíto (Mn(OH) 2 ) y, por extensión, brucita (Mg(OH) 2 ) en 1919. [37] [38] También en 1919, el nitrato de sodio (NaNO 3 ) y el dicloroyoduro de cesio (CsICl 2 ) fueron determinados por Ralph Walter Graystone Wyckoff , y la estructura de la wurtzita (ZnS hexagonal) fue determinada en 1920. [39]
La estructura del grafito fue resuelta en 1916 [40] mediante el método relacionado de difracción de polvos , [41] que fue desarrollado por Peter Debye y Paul Scherrer e, independientemente, por Albert Hull en 1917. [42] La estructura del grafito fue determinada a partir de la difracción de un solo cristal en 1924 por dos grupos de forma independiente. [43] [44] Hull también utilizó el método del polvo para determinar las estructuras de varios metales, como el hierro [45] y el magnesio. [46]
Contribuciones en diferentes áreas
Química
La cristalografía de rayos X ha llevado a una mejor comprensión de los enlaces químicos y las interacciones no covalentes . Los estudios iniciales revelaron los radios típicos de los átomos y confirmaron muchos modelos teóricos de enlace químico, como el enlace tetraédrico del carbono en la estructura del diamante, [30] el enlace octaédrico de los metales observado en el hexacloroplatinato de amonio (IV), [47] y la resonancia observada en el grupo de carbonatos planar [33] y en moléculas aromáticas. [48] La estructura de hexametilbenceno de Kathleen Lonsdale de 1928 [49] estableció la simetría hexagonal del benceno y mostró una clara diferencia en la longitud de enlace entre los enlaces C–C alifáticos y los enlaces C–C aromáticos; este hallazgo condujo a la idea de la resonancia entre enlaces químicos, que tuvo profundas consecuencias para el desarrollo de la química. [50] Sus conclusiones fueron anticipadas por William Henry Bragg , quien publicó modelos de naftaleno y antraceno en 1921 basados en otras moléculas, una forma temprana de reemplazo molecular . [48] [51]
La primera estructura de un compuesto orgánico, la hexametilentetramina , se resolvió en 1923. [52] Esto fue seguido rápidamente por varios estudios de diferentes ácidos grasos de cadena larga , que son un componente importante de las membranas biológicas . [53] [54] [ 55] [56] [57] [58] [59] [60] [61] En la década de 1930, las estructuras de moléculas mucho más grandes con complejidad bidimensional comenzaron a resolverse. Un avance significativo fue la estructura de la ftalocianina , [62] una gran molécula plana que está estrechamente relacionada con las moléculas de porfirina importantes en biología, como el hemo , la corrina y la clorofila .
En la década de 1920, Victor Moritz Goldschmidt y, posteriormente, Linus Pauling desarrollaron reglas para eliminar estructuras químicamente improbables y para determinar los tamaños relativos de los átomos. Estas reglas condujeron a la estructura de la brookita (1928) y a la comprensión de la estabilidad relativa de las formas rutilo , brookita y anatasa del dióxido de titanio .
La distancia entre dos átomos enlazados es una medida sensible de la fuerza del enlace y su orden de enlace ; por lo tanto, los estudios cristalográficos de rayos X han llevado al descubrimiento de tipos de enlace aún más exóticos en la química inorgánica , como los enlaces dobles metal-metal, [63] [64] [65] los enlaces cuádruples metal-metal, [66] [67] [68] y los enlaces de tres centros y dos electrones. [69] La cristalografía de rayos X (o, estrictamente hablando, un experimento de dispersión Compton inelástica ) también ha proporcionado evidencia del carácter parcialmente covalente de los enlaces de hidrógeno . [70] En el campo de la química organometálica , la estructura de rayos X del ferroceno inició estudios científicos de compuestos sándwich , [71] [72] mientras que la de la sal de Zeise estimuló la investigación sobre el "enlace posterior" y los complejos metal-pi. [73] [74] [75] [76] Finalmente, la cristalografía de rayos X tuvo un papel pionero en el desarrollo de la química supramolecular , particularmente en la clarificación de las estructuras de los éteres corona y los principios de la química anfitrión-huésped . [ cita requerida ]
Ciencia de los materiales y mineralogía

La aplicación de la cristalografía de rayos X a la mineralogía comenzó con la estructura del granate , que fue determinada en 1924 por Menzer. En la década de 1920 se realizó un estudio cristalográfico sistemático de los silicatos mediante rayos X. Este estudio mostró que, a medida que se altera la relación Si / O , los cristales de silicato presentan cambios significativos en sus disposiciones atómicas. Machatschki extendió estos conocimientos a los minerales en los que el aluminio sustituye a los átomos de silicio de los silicatos. La primera aplicación de la cristalografía de rayos X a la metalurgia también se produjo a mediados de la década de 1920. [78] [79] [80] [81] [82] [83] En particular, la estructura de la aleación Mg2Sn de Linus Pauling [84] condujo a su teoría de la estabilidad y la estructura de los cristales iónicos complejos. [85] Se han analizado muchos sistemas inorgánicos y organometálicos complejos utilizando métodos de monocristal, como fulerenos , metaloporfirinas y otros compuestos complejos. La difracción de monocristal también se utiliza en la industria farmacéutica . La base de datos estructural de Cambridge contiene más de 1.000.000 de estructuras a junio de 2019; la mayoría de estas estructuras se determinaron mediante cristalografía de rayos X. [86]
El 17 de octubre de 2012, el rover Curiosity en el planeta Marte en " Rocknest " realizó el primer análisis de difracción de rayos X del suelo marciano . Los resultados del analizador CheMin del rover revelaron la presencia de varios minerales, incluidos feldespato , piroxenos y olivino , y sugirieron que el suelo marciano en la muestra era similar a los " suelos basálticos erosionados " de los volcanes hawaianos . [77]

Cristalografía macromolecular biológica
La cristalografía de rayos X de moléculas biológicas despegó con Dorothy Crowfoot Hodgkin , quien resolvió las estructuras del colesterol (1937), la penicilina (1946) y la vitamina B 12 (1956), por lo que recibió el Premio Nobel de Química en 1964. En 1969, logró resolver la estructura de la insulina , en la que trabajó durante más de treinta años. [87]

Las estructuras cristalinas de las proteínas (que son irregulares y cientos de veces más grandes que el colesterol) comenzaron a resolverse a fines de la década de 1950, comenzando con la estructura de la mioglobina de cachalote por Sir John Cowdery Kendrew , [88] por la que compartió el Premio Nobel de Química con Max Perutz en 1962. [89] Desde ese éxito, se han determinado más de 130.000 estructuras cristalinas de rayos X de proteínas, ácidos nucleicos y otras moléculas biológicas. [90] El método competidor más cercano en número de estructuras analizadas es la espectroscopia de resonancia magnética nuclear (RMN) , que ha resuelto menos de una décima parte. [91] La cristalografía puede resolver estructuras de moléculas arbitrariamente grandes, mientras que la RMN en estado de solución está restringida a las relativamente pequeñas (menos de 70 k Da ). La cristalografía de rayos X se utiliza de manera rutinaria para determinar cómo un fármaco farmacéutico interactúa con su objetivo proteico y qué cambios podrían mejorarlo. [92] Sin embargo, las proteínas de membrana intrínsecas siguen siendo difíciles de cristalizar porque requieren detergentes u otros desnaturalizantes para solubilizarlos de forma aislada, y dichos detergentes a menudo interfieren con la cristalización. Las proteínas de membrana son un gran componente del genoma e incluyen muchas proteínas de gran importancia fisiológica, como los canales iónicos y los receptores . [93] [94] La criogenia con helio se utiliza para prevenir el daño por radiación en los cristales de proteínas. [95]
Métodos
Descripción general

A menudo se utilizan dos casos limitantes de cristalografía de rayos X: la cristalografía de "moléculas pequeñas" (que incluye sólidos inorgánicos continuos) y la cristalografía "macromolecular". La cristalografía de moléculas pequeñas generalmente involucra cristales con menos de 100 átomos en su unidad asimétrica ; tales estructuras cristalinas suelen estar tan bien resueltas que los átomos pueden discernirse como "manchas" aisladas de densidad electrónica. En contraste, la cristalografía macromolecular a menudo involucra decenas de miles de átomos en la celda unitaria. Tales estructuras cristalinas generalmente están menos resueltas; los átomos y enlaces químicos aparecen como tubos de densidad electrónica, en lugar de átomos aislados. En general, las moléculas pequeñas también son más fáciles de cristalizar que las macromoléculas; sin embargo, la cristalografía de rayos X ha demostrado ser posible incluso para virus y proteínas con cientos de miles de átomos, a través de imágenes y tecnología cristalográficas mejoradas. [96]
La técnica de cristalografía de rayos X de monocristales consta de tres pasos básicos. El primero, y a menudo el más difícil, es obtener un cristal adecuado del material en estudio. El cristal debe ser lo suficientemente grande (normalmente mayor de 0,1 mm en todas las dimensiones), puro en su composición y regular en su estructura, sin imperfecciones internas significativas como grietas o maclado . [ cita requerida ]
En el segundo paso, el cristal se coloca en un haz intenso de rayos X, generalmente de una sola longitud de onda ( rayos X monocromáticos ), produciendo el patrón regular de reflexiones. Se miden los ángulos e intensidades de los rayos X difractados, y cada compuesto tiene un patrón de difracción único. [97] A medida que el cristal gira gradualmente, las reflexiones anteriores desaparecen y aparecen otras nuevas; la intensidad de cada punto se registra en cada orientación del cristal. Es posible que se deban recopilar varios conjuntos de datos, cada uno de los cuales cubre un poco más de la mitad de una rotación completa del cristal y, por lo general, contiene decenas de miles de reflexiones. [ cita requerida ]
En el tercer paso, estos datos se combinan computacionalmente con información química complementaria para producir y refinar un modelo de la disposición de los átomos dentro del cristal. El modelo final y refinado de la disposición atómica, ahora llamado estructura cristalina , generalmente se almacena en una base de datos pública. [ cita requerida ]
Cristalización

Aunque la cristalografía se puede utilizar para caracterizar el desorden en un cristal impuro o irregular, generalmente requiere un cristal puro de alta regularidad para resolver la estructura de una disposición complicada de átomos. A veces se pueden obtener cristales puros y regulares a partir de materiales naturales o sintéticos, como muestras de metales, minerales u otros materiales macroscópicos. La regularidad de dichos cristales a veces se puede mejorar con el recocido de cristales macromoleculares [98] [99] [100] y otros métodos. Sin embargo, en muchos casos, la obtención de un cristal con calidad de difracción es la principal barrera para resolver su estructura de resolución atómica. [101]
La cristalografía de moléculas pequeñas y macromoleculares difieren en el rango de posibles técnicas utilizadas para producir cristales de calidad de difracción. Las moléculas pequeñas generalmente tienen pocos grados de libertad conformacional y pueden cristalizarse mediante una amplia gama de métodos, como la deposición química en fase de vapor y la recristalización . Por el contrario, las macromoléculas generalmente tienen muchos grados de libertad y su cristalización debe llevarse a cabo de manera que mantengan una estructura estable. Por ejemplo, las proteínas y las moléculas de ARN más grandes no pueden cristalizarse si su estructura terciaria se ha desplegado ; por lo tanto, el rango de condiciones de cristalización está restringido a las condiciones de solución en las que dichas moléculas permanecen plegadas. [ cita requerida ]
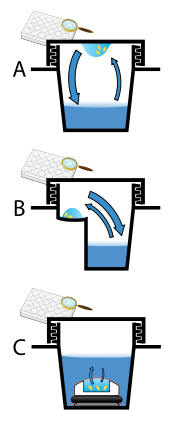
Los cristales de proteínas casi siempre se cultivan en solución. El método más común consiste en reducir la solubilidad de las moléculas que las componen de forma muy gradual; si esto se hace demasiado rápido, las moléculas precipitarán de la solución y formarán un polvo inútil o un gel amorfo en el fondo del recipiente. El crecimiento de cristales en solución se caracteriza por dos pasos: la nucleación de un cristalito microscópico (que posiblemente tenga solo 100 moléculas), seguida del crecimiento de ese cristalito, idealmente hasta un cristal de calidad de difracción. [102] [103] Las condiciones de la solución que favorecen el primer paso (nucleación) no siempre son las mismas condiciones que favorecen el segundo paso (crecimiento posterior). Las condiciones de la solución deberían desfavorecer el primer paso (nucleación) pero favorecer el segundo (crecimiento), de modo que solo se forme un cristal grande por gota. Si se favorece demasiado la nucleación, se formará una lluvia de pequeños cristalitos en la gota, en lugar de un cristal grande; si se favorece demasiado poco, no se formará ningún cristal. Otros métodos implican la cristalización de proteínas bajo aceite, donde las soluciones acuosas de proteínas se dispensan bajo aceite líquido y el agua se evapora a través de la capa de aceite. Diferentes aceites tienen diferentes permeabilidades de evaporación, por lo tanto, producen cambios en las tasas de concentración de diferentes mezclas de percipiente/proteína. [104]
Es difícil predecir buenas condiciones para la nucleación o el crecimiento de cristales bien ordenados. [105] En la práctica, las condiciones favorables se identifican mediante un cribado ; se prepara un lote muy grande de moléculas y se prueba una amplia variedad de soluciones de cristalización. [106] Generalmente se prueban cientos, incluso miles, de condiciones de solución antes de encontrar la exitosa. Las diversas condiciones pueden utilizar uno o más mecanismos físicos para reducir la solubilidad de la molécula; por ejemplo, algunas pueden cambiar el pH, algunas contienen sales de la serie de Hofmeister o productos químicos que reducen la constante dieléctrica de la solución, y otras contienen polímeros grandes como el polietilenglicol que expulsan la molécula de la solución por efectos entrópicos. También es común probar varias temperaturas para estimular la cristalización, o reducir gradualmente la temperatura para que la solución se sobresature. Estos métodos requieren grandes cantidades de la molécula objetivo, ya que utilizan una alta concentración de la(s) molécula(s) a cristalizar. Debido a la dificultad de obtener cantidades tan grandes ( miligramos ) de proteína apta para cristalización, se han desarrollado robots capaces de dispensar con precisión gotas de cristalización de un volumen del orden de 100 nanolitros . Esto significa que se utiliza 10 veces menos proteína por experimento en comparación con los ensayos de cristalización realizados a mano (del orden de 1 microlitro ). [107]
Se sabe que varios factores inhiben la cristalización. Los cristales en crecimiento generalmente se mantienen a una temperatura constante y se protegen de golpes o vibraciones que podrían perturbar su cristalización. Las impurezas en las moléculas o en las soluciones de cristalización a menudo son perjudiciales para la cristalización. La flexibilidad conformacional en la molécula también tiende a hacer que la cristalización sea menos probable, debido a la entropía. Las moléculas que tienden a autoensamblarse en hélices regulares a menudo no están dispuestas a ensamblarse en cristales. [ cita requerida ] Los cristales pueden verse afectados por maclado , que puede ocurrir cuando una celda unitaria puede empaquetarse igualmente favorablemente en múltiples orientaciones; aunque los avances recientes en métodos computacionales pueden permitir resolver la estructura de algunos cristales maclados. Después de no haber logrado cristalizar una molécula objetivo, un cristalógrafo puede intentarlo nuevamente con una versión ligeramente modificada de la molécula; incluso pequeños cambios en las propiedades moleculares pueden conducir a grandes diferencias en el comportamiento de cristalización. [ cita requerida ]
Recopilación de datos
Montaje del cristal
El cristal se monta para las mediciones de modo que pueda mantenerse en el haz de rayos X y rotarse. Existen varios métodos de montaje. En el pasado, los cristales se cargaban en capilares de vidrio con la solución de cristalización (el licor madre ). Los cristales de moléculas pequeñas se suelen unir con aceite o pegamento a una fibra de vidrio o un bucle, que está hecho de nailon o plástico y unido a una varilla sólida. Los cristales de proteína se recogen con un bucle y luego se congelan instantáneamente con nitrógeno líquido . [108] Esta congelación reduce el daño por radiación de los rayos X, así como el movimiento térmico (el efecto Debye-Waller). Sin embargo, los cristales de proteína sin tratar a menudo se agrietan si se congelan instantáneamente; por lo tanto, generalmente se sumergen previamente en una solución crioprotectora antes de congelarlos. [109] Este remojo previo puede hacer que el cristal se agriete, arruinándolo para la cristalografía. Generalmente, las condiciones criogénicas exitosas se identifican por ensayo y error. [ cita requerida ]
El capilar o asa se monta sobre un goniómetro , lo que permite posicionarlo con precisión dentro del haz de rayos X y rotarlo. Dado que tanto el cristal como el haz suelen ser muy pequeños, el cristal debe estar centrado dentro del haz con una precisión de ~25 micrómetros, lo que se logra con una cámara enfocada en el cristal. El tipo más común de goniómetro es el "goniómetro kappa", que ofrece tres ángulos de rotación: el ángulo ω, que gira alrededor de un eje perpendicular al haz; el ángulo κ, alrededor de un eje a ~50° del eje ω; y, finalmente, el ángulo φ alrededor del eje asa/capilar. Cuando el ángulo κ es cero, los ejes ω y φ están alineados. La rotación κ permite un montaje conveniente del cristal, ya que el brazo en el que está montado el cristal puede oscilar hacia el cristalógrafo. Las oscilaciones llevadas a cabo durante la recopilación de datos (mencionadas a continuación) involucran solo el eje ω. Un tipo más antiguo de goniómetro es el goniómetro de cuatro círculos y sus parientes, como el goniómetro de seis círculos. [ cita requerida ]
Grabando las reflexiones

Las intensidades relativas de las reflexiones proporcionan información para determinar la disposición de las moléculas dentro del cristal con detalle atómico. Las intensidades de estas reflexiones se pueden registrar con una película fotográfica , un detector de área (como un detector de píxeles ) o con un sensor de imagen de dispositivo acoplado a carga (CCD). Los picos en ángulos pequeños corresponden a datos de baja resolución, mientras que los de ángulos altos representan datos de alta resolución; por lo tanto, se puede determinar un límite superior en la resolución final de la estructura a partir de las primeras imágenes. Algunas medidas de la calidad de la difracción se pueden determinar en este punto, como la mosaicidad del cristal y su desorden general, como se observa en los anchos de los picos. Algunas patologías del cristal que lo harían inadecuado para resolver la estructura también se pueden diagnosticar rápidamente en este punto. [ cita requerida ]
Un conjunto de puntos no es suficiente para reconstruir el cristal entero; representa sólo una pequeña porción del conjunto tridimensional completo. Para recopilar toda la información necesaria, el cristal debe rotarse paso a paso 180°, con una imagen registrada en cada paso; en realidad, se requiere un poco más de 180° para cubrir el espacio recíproco , debido a la curvatura de la esfera de Ewald . Sin embargo, si el cristal tiene una simetría más alta, se puede registrar un rango angular más pequeño, como 90° o 45°. El eje de rotación debe cambiarse al menos una vez, para evitar desarrollar un "punto ciego" en el espacio recíproco cerca del eje de rotación. Es habitual balancear el cristal ligeramente (entre 0,5 y 2°) para capturar una región más amplia del espacio recíproco. [ cita requerida ]
Para determinados métodos de determinación de fases pueden ser necesarios varios conjuntos de datos . Por ejemplo, la determinación de fases por dispersión anómala de longitudes de onda múltiples requiere que la dispersión se registre en al menos tres longitudes de onda (y normalmente cuatro, por redundancia) de la radiación de rayos X entrante. Un único cristal puede degradarse demasiado durante la recopilación de un conjunto de datos, debido al daño por radiación; en tales casos, deben tomarse conjuntos de datos sobre varios cristales. [110]
Simetría cristalina, celda unitaria y escala de imagen
La serie registrada de patrones de difracción bidimensionales, cada uno correspondiente a una orientación cristalina diferente, se convierte en un conjunto tridimensional. El procesamiento de datos comienza con la indexación de las reflexiones. Esto significa identificar las dimensiones de la celda unitaria y qué pico de imagen corresponde a qué posición en el espacio recíproco. Un subproducto de la indexación es determinar la simetría del cristal, es decir, su grupo espacial . Algunos grupos espaciales se pueden eliminar desde el principio. Por ejemplo, las simetrías de reflexión no se pueden observar en moléculas quirales; por lo tanto, solo se permiten 65 grupos espaciales de 230 posibles para moléculas de proteína que casi siempre son quirales. La indexación generalmente se logra utilizando una rutina de autoindexación . [111] Una vez asignada la simetría, los datos se integran . Esto convierte los cientos de imágenes que contienen los miles de reflexiones en un solo archivo, que consta (como mínimo) de registros del índice de Miller de cada reflexión y una intensidad para cada reflexión (en este estado, el archivo a menudo también incluye estimaciones de error y medidas de parcialidad (qué parte de una reflexión dada se registró en esa imagen)).
Un conjunto completo de datos puede constar de cientos de imágenes separadas tomadas en diferentes orientaciones del cristal. Estas deben fusionarse y escalarse utilizando los picos que aparecen en dos o más imágenes ( fusión ) y el escalado para que haya una escala de intensidad consistente. Optimizar la escala de intensidad es fundamental porque la intensidad relativa de los picos es la información clave a partir de la cual se determina la estructura. La técnica repetitiva de recopilación de datos cristalográficos y la simetría a menudo alta de los materiales cristalinos hacen que el difractómetro registre muchas reflexiones equivalentes a la simetría varias veces. Esto permite calcular el factor R relacionado con la simetría , un índice de confiabilidad basado en cuán similares son las intensidades medidas de las reflexiones equivalentes a la simetría, [ aclaración necesaria ] evaluando así la calidad de los datos.
Fases iniciales
La intensidad de cada "punto" de difracción es proporcional al cuadrado del módulo del factor de estructura . El factor de estructura es un número complejo que contiene información relacionada con la amplitud y la fase de una onda . Para obtener un mapa de densidad electrónica interpretable , se deben conocer tanto la amplitud como la fase (un mapa de densidad electrónica permite a un cristalógrafo construir un modelo inicial de la molécula). La fase no se puede registrar directamente durante un experimento de difracción: esto se conoce como el problema de la fase . Las estimaciones iniciales de la fase se pueden obtener de diversas formas:
- Métodos directos ode fase ab initio : este suele ser el método de elección para moléculas pequeñas (<1000 átomos que no sean hidrógeno) y se ha utilizado con éxito para resolver los problemas de fase de las proteínas pequeñas. Si la resolución de los datos es mejor que 1,4 Å (140 pm),métodos directospara obtener información de fase, explotando las relaciones de fase conocidas entre ciertos grupos de reflexiones.[112][113]
- Reemplazo molecular : si se conoce una estructura relacionada, se puede utilizar como modelo de búsqueda en el reemplazo molecular para determinar la orientación y la posición de las moléculas dentro de la celda unitaria. Las fases obtenidas de esta manera se pueden utilizar para generar mapas de densidad electrónica. [114]
- Dispersión anómala de rayos X ( fase MAD o SAD ): la longitud de onda de los rayos X puede escanearse más allá de un borde de absorción [a] de un átomo, lo que cambia la dispersión de una manera conocida. Al registrar conjuntos completos de reflexiones en tres longitudes de onda diferentes (muy por debajo, muy por encima y en el medio del borde de absorción), se puede resolver la subestructura de los átomos que difractan anómalamente y, por lo tanto, la estructura de toda la molécula. El método más popular para incorporar átomos de dispersión anómala en proteínas es expresar la proteína en un auxótrofo de metionina (un huésped incapaz de sintetizar metionina) en un medio rico en seleno-metionina, que contiene átomos de selenio . Luego se puede realizar un experimento de dispersión anómala de múltiples longitudes de onda (MAD) alrededor del borde de absorción, que luego debería producir la posición de cualquier residuo de metionina dentro de la proteína, proporcionando fases iniciales. [115]
- Métodos de átomos pesados ( reemplazo isomorfo múltiple ): si se pueden introducir átomos de metal densos en electrones en el cristal, se pueden utilizar métodos directos o métodos de espacio de Patterson para determinar su ubicación y obtener fases iniciales. Dichos átomos pesados se pueden introducir sumergiendo el cristal en una solución que contenga átomos pesados o mediante cocristalización (haciendo crecer los cristales en presencia de un átomo pesado). Al igual que en la fase de dispersión anómala de múltiples longitudes de onda, los cambios en las amplitudes de dispersión se pueden interpretar para producir las fases. Aunque este es el método original por el que se resolvieron las estructuras cristalinas de las proteínas, ha sido reemplazado en gran medida por la fase de dispersión anómala de múltiples longitudes de onda con selenometionina. [114]
Construcción de modelos y refinamiento de fases


Una vez obtenidas las fases iniciales, se puede construir un modelo inicial. Las posiciones atómicas en el modelo y sus respectivos factores de Debye-Waller (o factores B , que representan el movimiento térmico del átomo) se pueden refinar para ajustarse a los datos de difracción observados, lo que idealmente produce un mejor conjunto de fases. Luego se puede ajustar un nuevo modelo al nuevo mapa de densidad electrónica y se llevan a cabo rondas sucesivas de refinamiento. Este proceso iterativo continúa hasta que se maximiza la correlación entre los datos de difracción y el modelo. La concordancia se mide mediante un factor R definido como
donde F es el factor de estructura . Un criterio de calidad similar es R free , que se calcula a partir de un subconjunto (~10%) de reflexiones que no se incluyeron en el refinamiento de la estructura. Ambos factores R dependen de la resolución de los datos. Como regla general, R free debe ser aproximadamente la resolución en angstroms dividida por 10; por lo tanto, un conjunto de datos con una resolución de 2 Å debe producir un R free final de ~ 0,2. Las características de los enlaces químicos, como la estereoquímica, los enlaces de hidrógeno y la distribución de las longitudes y ángulos de los enlaces, son medidas complementarias de la calidad del modelo. En la construcción iterativa de modelos, es común encontrar sesgo de fase o sesgo del modelo: debido a que las estimaciones de fase provienen del modelo, cada ronda de mapa calculado tiende a mostrar densidad dondequiera que el modelo tenga densidad, independientemente de si realmente hay una densidad. Este problema se puede mitigar mediante la ponderación de máxima verosimilitud y la comprobación mediante mapas de omisión . [118]
Puede que no sea posible observar todos los átomos de la unidad asimétrica. En muchos casos, el desorden cristalográfico mancha el mapa de densidad electrónica. Los átomos que se dispersan débilmente, como el hidrógeno, son rutinariamente invisibles. También es posible que un solo átomo aparezca varias veces en un mapa de densidad electrónica, por ejemplo, si una cadena lateral de proteína tiene múltiples conformaciones permitidas (<4). En otros casos, el cristalógrafo puede detectar que la estructura covalente deducida para la molécula era incorrecta o estaba alterada. Por ejemplo, las proteínas pueden escindirse o sufrir modificaciones postraduccionales que no se detectaron antes de la cristalización.
Trastorno
Un desafío común en el refinamiento de las estructuras cristalinas resulta del desorden cristalográfico. El desorden puede tomar muchas formas pero en general implica la coexistencia de dos o más especies o conformaciones. No reconocer el desorden da como resultado una interpretación errónea. Los peligros de un modelado inadecuado del desorden se ilustran con la hipótesis descontada de isomería de estiramiento de enlace . [119] El desorden se modela con respecto a la población relativa de los componentes, a menudo solo dos, y su identidad. En estructuras de moléculas grandes e iones, el solvente y los contraiones a menudo están desordenados.
Análisis computacional de datos aplicado
El uso de métodos computacionales para el análisis de datos de difracción de rayos X de polvos se ha generalizado en la actualidad. Normalmente, se comparan los datos experimentales con el difractograma simulado de una estructura modelo, teniendo en cuenta los parámetros instrumentales, y se refinan los parámetros estructurales o microestructurales del modelo utilizando un algoritmo de minimización basado en mínimos cuadrados . La mayoría de las herramientas disponibles que permiten la identificación de fases y el refinamiento estructural se basan en el método de Rietveld , [120] [121] algunas de ellas son software abierto y gratuito como FullProf Suite, [122] [123] Jana2006, [124] MAUD, [125] [126] [127] Rietan, [128] GSAS, [129] etc. mientras que otras están disponibles bajo licencias comerciales como Diffrac.Suite TOPAS, [130] Match!, [131] etc. La mayoría de estas herramientas también permiten el refinamiento de Le Bail (también conocido como coincidencia de perfiles), es decir, el refinamiento de los parámetros de la celda en función de las posiciones de los picos de Bragg y los perfiles de pico, sin tener en cuenta la estructura cristalográfica por sí misma. Herramientas más recientes permiten el refinamiento de datos tanto estructurales como microestructurales, como por ejemplo el programa FAULTS incluido en FullProf Suite, [132] que permite el refinamiento de estructuras con defectos planares (por ejemplo, fallas de apilamiento, maclados, intercrecimientos).
Deposición de la estructura
Una vez que se ha finalizado el modelo de la estructura de una molécula, a menudo se deposita en una base de datos cristalográfica como la Base de Datos Estructural de Cambridge (para moléculas pequeñas), la Base de Datos de Estructuras Cristalinas Inorgánicas (ICSD) (para compuestos inorgánicos) o el Banco de Datos de Proteínas (para proteínas y, a veces, ácidos nucleicos). Muchas estructuras obtenidas en emprendimientos comerciales privados para cristalizar proteínas de importancia médica no se depositan en bases de datos cristalográficas públicas.
Contribución de las mujeres a la cristalografía de rayos X
Varias mujeres fueron pioneras en la cristalografía de rayos X en una época en la que estaban excluidas de la mayoría de las demás ramas de la ciencia física. [133]
Kathleen Lonsdale fue una estudiante de investigación de William Henry Bragg , que tenía 11 mujeres estudiantes de investigación de un total de 18. Es conocida tanto por su trabajo experimental como teórico. Lonsdale se unió a su equipo de investigación de cristalografía en la Royal Institution de Londres en 1923, y después de casarse y tener hijos, volvió a trabajar con Bragg como investigadora. Confirmó la estructura del anillo de benceno, realizó estudios sobre el diamante, fue una de las dos primeras mujeres en ser elegidas para la Royal Society en 1945, y en 1949 fue nombrada la primera profesora titular de química y jefa del Departamento de Cristalografía en el University College de Londres . [134] Lonsdale siempre abogó por una mayor participación de las mujeres en la ciencia y dijo en 1970: "Cualquier país que quiera hacer pleno uso de todo su potencial científico y tecnólogo podría hacerlo, pero no debe esperar conseguir mujeres tan fácilmente como consigue hombres. ... Es utópico, entonces, sugerir que cualquier país que realmente quiera que las mujeres casadas regresen a una carrera científica, cuando sus hijos ya no necesiten su presencia física, debería hacer arreglos especiales para alentarlas a hacerlo". [135] Durante este período, Lonsdale comenzó una colaboración con William T. Astbury en un conjunto de 230 tablas de grupos espaciales que se publicaron en 1924 y se convirtieron en una herramienta esencial para los cristalógrafos.
.jpg/440px-Molecular_model_of_Penicillin_by_Dorothy_Hodgkin_(9663803982).jpg)
En 1932, Dorothy Hodgkin se unió al laboratorio del físico John Desmond Bernal, quien fue alumno de Bragg, en Cambridge, Reino Unido. Ella y Bernal tomaron las primeras fotografías de rayos X de proteínas cristalinas. Hodgkin también jugó un papel en la fundación de la Unión Internacional de Cristalografía . Recibió el Premio Nobel de Química en 1964 por su trabajo utilizando técnicas de rayos X para estudiar las estructuras de la penicilina, la insulina y la vitamina B12. Su trabajo sobre la penicilina comenzó en 1942 durante la guerra y sobre la vitamina B12 en 1948. Si bien su grupo creció lentamente, su enfoque predominante fue el análisis de rayos X de productos naturales. Es la única mujer británica que ha ganado un Premio Nobel en una materia científica.

Rosalind Franklin tomó la fotografía de rayos X de una fibra de ADN que resultó clave para el descubrimiento de la doble hélice por parte de James Watson y Francis Crick , por el que ambos ganaron el Premio Nobel de Fisiología o Medicina en 1962. Watson reveló en su relato autobiográfico del descubrimiento de la estructura del ADN, La doble hélice , [136] que había utilizado la fotografía de rayos X de Franklin sin su permiso. Franklin murió de cáncer a los 30 años, antes de que Watson recibiera el Premio Nobel. Franklin también llevó a cabo importantes estudios estructurales del carbono en el carbón y el grafito, y de virus vegetales y animales.
Isabella Karle, del Laboratorio de Investigación Naval de los Estados Unidos, desarrolló un método experimental para la teoría matemática de la cristalografía. Su trabajo mejoró la velocidad y la precisión de los análisis químicos y biomédicos. Sin embargo, sólo su marido Jerome compartió el Premio Nobel de Química de 1985 con Herbert Hauptman, "por sus destacados logros en el desarrollo de métodos directos para la determinación de las estructuras cristalinas". Otros organismos que otorgan premios han colmado de premios a Isabella por derecho propio.
Las mujeres han escrito muchos libros de texto y artículos de investigación en el campo de la cristalografía de rayos X. Durante muchos años, Lonsdale editó las Tablas internacionales para cristalografía , que proporcionan información sobre redes cristalinas, simetría y grupos espaciales, así como datos matemáticos, físicos y químicos sobre estructuras. Olga Kennard , de la Universidad de Cambridge , fundó y dirigió el Centro de datos cristalográficos de Cambridge , una fuente internacionalmente reconocida de datos estructurales sobre moléculas pequeñas, desde 1965 hasta 1997. Jenny Pickworth Glusker , científica británica, fue coautora de Crystal Structure Analysis: A Primer , [137] publicado por primera vez en 1971 y a partir de 2010 en su tercera edición. Eleanor Dodson , bióloga nacida en Australia, que comenzó como técnica de Dorothy Hodgkin, fue la principal instigadora detrás de CCP4 , el proyecto de computación colaborativa que actualmente comparte más de 250 herramientas de software con cristalógrafos de proteínas en todo el mundo.
Premios Nobel relacionados con la cristalografía de rayos X
| Año | Laureado | Premio | Razón fundamental |
|---|---|---|---|
| 1914 | Max von Laue | Física | "Por su descubrimiento de la difracción de rayos X por cristales" [138] |
| 1915 | William Henry Bragg | Física | "Por sus servicios en el análisis de la estructura cristalina por medio de rayos X" [139] |
| William Lawrence Bragg | |||
| 1962 | Max F. Perutz | Química | "por sus estudios de las estructuras de las proteínas globulares " [140] |
| Juan C. Kendrew | |||
| 1962 | James Dewey Watson | Medicamento | "Por sus descubrimientos sobre la estructura molecular de los ácidos nucleicos y su importancia para la transferencia de información en el material vivo" [141] |
| Francis Harry Compton Crick | |||
| Maurice Hugh Frederick Wilkins | |||
| 1964 | Dorothy Hodgkin | Química | "Por sus determinaciones mediante técnicas de rayos X de las estructuras de importantes sustancias bioquímicas" [142] |
| 1972 | Stanford Moore | Química | "Por su contribución a la comprensión de la conexión entre la estructura química y la actividad catalítica del centro activo de la molécula de ribonucleasa " [143] |
| William H. Stein | |||
| 1976 | William N. Lipscomb | Química | "Por sus estudios sobre la estructura de los boranos que arrojaron luz sobre los problemas del enlace químico" [144] |
| 1985 | Jerome Karle | Química | "Por sus destacados logros en el desarrollo de métodos directos para la determinación de estructuras cristalinas" [145] |
| Herbert A. Hauptman | |||
| 1988 | Johann Deisenhofer | Química | "Para la determinación de la estructura tridimensional de un centro de reacción fotosintética " [146] |
| Hartmut Michel | Química | ||
| Roberto Huber | Química | ||
| 1997 | John E. Walker | Química | "Por su elucidación del mecanismo enzimático subyacente a la síntesis de trifosfato de adenosina (ATP)" [147] |
| 2003 | Roderick MacKinnon | Química | "Por los descubrimientos relativos a los canales en las membranas celulares [...] por los estudios estructurales y mecanísticos de los canales iónicos " [148] |
| Pedro Agre | "Por los descubrimientos relativos a los canales en las membranas celulares [...] por el descubrimiento de los canales de agua " [148] | ||
| 2006 | Roger D. Kornberg | Química | "Por sus estudios sobre las bases moleculares de la transcripción eucariota " [149] |
| 2009 | Ada E. Yonath | Química | "Para estudios de la estructura y función del ribosoma " [150] |
| Thomas A. Steitz | |||
| Venkatraman Ramakrishnan | |||
| 2012 | Brian Kobilka | Química | "Para estudios de receptores acoplados a proteína G " [151] |
Véase también
- Tira de Beevers-Lipson
- Difracción de Bragg
- Base de datos cristalográfica
- Grupos puntuales cristalográficos
- Mapa de densidad de diferencia
- Difracción de electrones
- Difracción de rayos X por dispersión de energía
- Parámetro Flack
- Difracción de incidencia rasante
- Límite de Henderson
- Año Internacional de la Cristalografía
- Formalismo de densidad multipolar
- Difracción de neutrones
- Difracción de polvo
- Pticografía
- Ecuación de Scherrer
- Dispersión de rayos X de ángulo pequeño (SAXS)
- Determinación de la estructura
- Rayos X ultrarrápidos
- Dispersión de rayos X de ángulo amplio (WAXS)
- Difracción de rayos X
Notas
- ^ El borde de absorción se conoce originalmente a partir de la espectroscopia de absorción de rayos X. Véase "Dispersión anómala de rayos X". skuld.bmsc.washington.edu .para una guía sobre la dispersión anómala.
Referencias
- ^ Kepler J (1611). Strena seu de Nive Sexangula. Fráncfort: G. Tampach. ISBN 3-321-00021-0Archivado desde el original el 19 de septiembre de 2011. Consultado el 25 de agosto de 2008 .
- ^ Steno N (1669). De solido intra solidum naturaliter contento dissertationis prodromus . Florentiae.
- ^ Hessel JF (1831). Kristallometrie o Kristallonomie und Kristallographie . Leipzig.
- ^ Bravais A (1850). "Mémoire sur les systèmes formés par des points distribués regulièrement sur un plan ou dans l'espace". Revista de la Escuela Politécnica . 19 : 1.
- ^ Shafranovskii II, Belov NV (1962). Paul Ewald (ed.). "ES Fedorov" (PDF) . 50 años de difracción de rayos X. Springer: 351. ISBN 90-277-9029-9. Archivado (PDF) del original el 28 de septiembre de 2007. Consultado el 25 de septiembre de 2007 .
- ^ Schönflies A (1891). Kristallsysteme und Kristallstruktur . Leipzig.
- ^ Barlow W (1883). «Naturaleza probable de la simetría interna de los cristales». Nature . 29 (738): 186. Bibcode :1883Natur..29..186B. doi : 10.1038/029186a0 . Archivado desde el original el 29 de marzo de 2020 . Consultado el 10 de septiembre de 2019 .Véase también Barlow W (1883). "Naturaleza probable de la simetría interna de los cristales". Nature . 29 (739): 205. Bibcode :1883Natur..29..205B. doi : 10.1038/029205a0 . Sohncke L (1884). "Naturaleza probable de la simetría interna de los cristales". Nature . 29 (747): 383. Bibcode :1884Natur..29..383S. doi :10.1038/029383a0. S2CID 4072817. Archivado desde el original el 2020-03-29 . Consultado el 2019-09-10 . Barlow WM (1884). "Naturaleza probable de la simetría interna de los cristales". Nature . 29 (748): 404. Bibcode :1884Natur..29..404B. doi : 10.1038/029404b0 . S2CID 4016086. Archivado desde el original el 2020-03-29 . Consultado el 2019-09-10 .
- ^ ab Stoddart C (1 de marzo de 2022). «Biología estructural: cómo las proteínas consiguieron su primer plano». Revista Knowable . doi : 10.1146/knowable-022822-1 . Archivado desde el original el 7 de abril de 2022. Consultado el 25 de marzo de 2022 .
- ^ Barkla, Charles G. (1911). "XXXIX. Los espectros de las radiaciones fluorescentes de Röntgen". Revista filosófica. Serie 6. 22 (129): 396–412. doi:10.1080/14786440908637137.
- ^ ab Michael Eckert, Descubrimiento controvertido: los inicios de la difracción de rayos X en cristales en 1912 y sus repercusiones, enero de 2011, Acta crystallographica. Sección A, Fundamentos de la cristalografía 68(1):30–39 Este artículo del centenario de Laue también se ha publicado en Zeitschrift für Kristallographie [Eckert (2012). Z. Kristallogr. 227, 27–35].
- ^ Nisio, Sigeko. "La formación de la teoría cuántica de Sommerfeld de 1916". (1974) JSHS, n.º 12, págs. 39-78.
- ^ Einstein A (1905). "Über einen die Erzeugung und Verwandlung des Lichtes betreffenden heuristischen Gesichtspunkt" [Un modelo heurístico de la creación y transformación de la luz]. Annalen der Physik (en alemán). 17 (6): 132. Código bibliográfico : 1905AnP...322..132E. doi : 10.1002/andp.19053220607 .Una traducción al inglés está disponible en Wikisource .
- ^ Comparar: Einstein A (1909). "Über die Entwicklung unserer Anschauungen über das Wesen und die Konstitution der Strahlung" [El desarrollo de nuestras opiniones sobre la composición y esencia de la radiación]. Physikalische Zeitschrift (en alemán). 10 : 817.Una traducción al inglés está disponible en Wikisource .
- ^ Pais A (1982). Sutil es el Señor: La ciencia y la vida de Albert Einstein. Oxford University Press . ISBN 0-19-853907-X.
- ^ Compton A (1923). "Una teoría cuántica de la dispersión de rayos X por elementos ligeros" (PDF) . Phys. Rev . 21 (5): 483. Bibcode :1923PhRv...21..483C. doi : 10.1103/PhysRev.21.483 . Archivado (PDF) desde el original el 2020-08-10 . Consultado el 2019-09-15 .
- ^ Bragg WH (1907). "La naturaleza de los rayos Röntgen". Transacciones de la Royal Society of Science of Australia . 31 : 94.
- ^ Bragg WH (1908). «La naturaleza de los rayos gamma y X». Nature . 77 (1995): 270. Bibcode :1908Natur..77..270B. doi :10.1038/077270a0. S2CID 4020075. Archivado desde el original el 29 de marzo de 2020 . Consultado el 10 de septiembre de 2019 .Véase también Bragg WH (1908). "La naturaleza de los rayos γ y X". Nature . 78 (2021): 271. Bibcode :1908Natur..78..271B. doi : 10.1038/078271a0 . S2CID 4039315. Archivado desde el original el 27 de marzo de 2021 . Consultado el 3 de junio de 2020 . Bragg WH (1908). "La naturaleza de los rayos gamma y X". Nature . 78 (2022): 293. Bibcode :1908Natur..78..293B. doi :10.1038/078293d0. S2CID 3993814. Bragg WH (1908). "La naturaleza de los rayos X". Nature . 78 (2035): 665. Bibcode :1908Natur..78R.665B. doi : 10.1038/078665b0 . S2CID 4024851. Archivado desde el original el 2021-03-27 . Consultado el 2020-08-27 .
- ^ Bragg WH (1910). "Las consecuencias de la hipótesis corpuscular de los rayos gamma y X, y el rango de los rayos beta". Phil. Mag . 20 (117): 385. doi :10.1080/14786441008636917. Archivado desde el original el 29 de marzo de 2020. Consultado el 10 de septiembre de 2019 .
- ^ Bragg WH (1912). "Sobre la naturaleza directa o indirecta de la ionización por rayos X". Phil. Mag . 23 (136): 647. doi :10.1080/14786440408637253.
- ^ abc Friedrich W, Knipping P, von Laue M (1912). "Interferenz-Erscheinungen bei Röntgenstrahlen" (PDF) . Sitzungsberichte der Mathematisch-Physikalischen Classe der Königlich-Bayerischen Akademie der Wissenschaften zu München [ Fenómenos de interferencia en rayos X ]. 1912 : 303. Archivado (PDF) desde el original el 21 de mayo de 2024 . Consultado el 14 de julio de 2024 .
- ^ von Laue M (1914). "Sobre la detección de interferencias de rayos X" (PDF) . Conferencias Nobel de Física . 1901–1921. Archivado (PDF) desde el original el 2010-12-07 . Consultado el 2009-02-18 .
- ^ Dana ES, Ford WE (1932). Un libro de texto de mineralogía (cuarta edición). Nueva York: John Wiley & Sons. pág. 28.
- ^ Bragg WL (1912). "La reflexión especular de los rayos X". Nature . 90 (2250): 410. Bibcode :1912Natur..90..410B. doi : 10.1038/090410b0 . S2CID 3952319. Archivado desde el original el 29 de marzo de 2020 . Consultado el 10 de septiembre de 2019 .
- ^ Bragg WL (1913). "La difracción de ondas electromagnéticas cortas por un cristal". Actas de la Sociedad Filosófica de Cambridge . 17 : 43.
- ^ Bragg WL (1914). "Die Reflexion der Röntgenstrahlen". Jahrbuch der Radioaktivität und Elektronik . 11 : 350.
- ^ Bragg WL (1913). "La estructura de algunos cristales según lo indicado por su difracción de rayos X". Proc. R. Soc. Lond . A89 (610): 248–277. Bibcode :1913RSPSA..89..248B. doi : 10.1098/rspa.1913.0083 . JSTOR 93488.
- ^ Bragg WL, James RW, Bosanquet CH (1921). "La intensidad de la reflexión de los rayos X por la sal de roca". Phil. Mag . 41 (243): 309. doi :10.1080/14786442108636225. Archivado desde el original el 29 de marzo de 2020. Consultado el 10 de septiembre de 2019 .
- ^ Bragg WL, James RW, Bosanquet CH (1921). "La intensidad de la reflexión de los rayos X por la sal de roca. Parte II". Phil. Mag . 42 (247): 1. doi :10.1080/14786442108633730. Archivado desde el original el 29 de marzo de 2020. Consultado el 10 de septiembre de 2019 .
- ^ Bragg WL, James RW, Bosanquet CH (1922). "La distribución de electrones alrededor del núcleo en los átomos de sodio y cloro". Phil. Mag . 44 (261): 433. doi :10.1080/14786440908565188. Archivado desde el original el 29 de marzo de 2020. Consultado el 10 de septiembre de 2019 .
- ^ ab Bragg WH, Bragg WL (1913). «La estructura del diamante». Nature . 91 (2283): 557. Bibcode :1913Natur..91..557B. doi : 10.1038/091557a0 . S2CID 3987932. Archivado desde el original el 26 de marzo de 2021 . Consultado el 27 de agosto de 2020 .
- ^ Bragg WH, Bragg WL (1913). "La estructura del diamante". Proc. R. Soc. Lond . A89 (610): 277. Bibcode :1913RSPSA..89..277B. doi : 10.1098/rspa.1913.0084 .
- ^ Bragg WL (1914). "La estructura cristalina del cobre". Phil. Mag . 28 (165): 355. doi :10.1080/14786440908635219. Archivado desde el original el 29 de marzo de 2020. Consultado el 10 de septiembre de 2019 .
- ^ ab Bragg WL (1914). "El análisis de cristales mediante el espectrómetro de rayos X". Proc. R. Soc. Lond . A89 (613): 468. Bibcode :1914RSPSA..89..468B. doi : 10.1098/rspa.1914.0015 .
- ^ Bragg WH (1915). «La estructura del grupo de cristales de la espinela». Phil. Mag . 30 (176): 305. doi :10.1080/14786440808635400. Archivado desde el original el 29 de marzo de 2020. Consultado el 10 de septiembre de 2019 .
- ^ Nishikawa S (1915). "Estructura de algunos cristales del grupo de la espinela". Proc. Tokyo Math. Phys. Soc . 8 : 199.
- ^ Vegard L (1916). "Resultados del análisis de cristales". Phil. Mag . 32 (187): 65. doi :10.1080/14786441608635544. Archivado desde el original el 29 de marzo de 2020. Consultado el 10 de septiembre de 2019 .
- ^ Aminoff G (1919). "Estructura cristalina de pirocroita". Estocolmo Geol. Foren. Förh . 41 : 407. doi : 10.1080/11035891909447000. Archivado desde el original el 29 de marzo de 2020 . Consultado el 10 de septiembre de 2019 .
- ^ Aminoff G (1921). "Über die Struktur des Magnesiumhydroxids". Z. Kristallogr . 56 : 505.
- ^ Bragg WL (1920). «La estructura cristalina del óxido de zinc». Phil. Mag . 39 (234): 647. doi :10.1080/14786440608636079. Archivado desde el original el 25 de octubre de 2021. Consultado el 3 de junio de 2020 .
- ^ Debije P , Scherrer P (1916). "Interferenz an regellos orientierten Teilchen im Röntgenlicht I". Physikalische Zeitschrift . 17 : 277.
- ^ Federico W (1913). "Eine neue Interferenzerscheinung bei Röntgenstrahlen". Physikalische Zeitschrift . 14 : 317.
- ^ Hull AW (1917). "Un nuevo método de análisis de cristales mediante rayos X". Phys. Rev. 10 ( 6): 661. Bibcode :1917PhRv...10..661H. doi :10.1103/PhysRev.10.661.
- ^ Bernal JD (1924). "La estructura del grafito". Proc. R. Soc. Lond . A106 (740): 749–773. JSTOR 94336.
- ^ Hassel O, Mack H (1924). "Über die Kristallstruktur des Graphits". Zeitschrift für Physik . 25 (1): 317. Código bibliográfico : 1924ZPhy...25..317H. doi :10.1007/BF01327534. S2CID 121157442.
- ^ Hull AW (1917). "La estructura cristalina del hierro". Phys. Rev . 9 (1): 84. Bibcode :1917PhRv....9...83.. doi :10.1103/PhysRev.9.83.
- ^ Hull AW (julio de 1917). "La estructura cristalina del magnesio". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 3 (7): 470–473. Bibcode :1917PNAS....3..470H. doi : 10.1073/pnas.3.7.470 . PMC 1091290 . PMID 16576242.
- ^ Wyckoff RW, Posnjak E (1921). "La estructura cristalina del cloroplatinato de amonio". J. Am. Chem. Soc . 43 (11): 2292. doi :10.1021/ja01444a002. Archivado desde el original el 13 de abril de 2021. Consultado el 3 de junio de 2020 .
- ^ ab Bragg WH (1921). "La estructura de los cristales orgánicos". Proc. R. Soc. Lond . 34 (1): 33. Bibcode :1921PPSL...34...33B. doi :10.1088/1478-7814/34/1/306. S2CID 4098112. Archivado desde el original el 2021-04-13 . Consultado el 2020-08-27 .
- ^ Lonsdale K (1928). "La estructura del anillo de benceno". Nature . 122 (3082): 810. Bibcode :1928Natur.122..810L. doi : 10.1038/122810c0 . S2CID 4105837.
- ^ Pauling L (1960). La naturaleza del enlace químico (3.ª ed.). Ithaca, NY: Cornell University Press . ISBN 0-8014-0333-2.
- ^ Bragg WH (1922). "La estructura cristalina del antraceno". Proc. R. Soc. Lond . 35 (1): 167. Bibcode :1922PPSL...35..167B. doi :10.1088/1478-7814/35/1/320. Archivado desde el original el 2021-04-13 . Consultado el 2020-08-27 .
- ^ Dickinson RG, Raymond AL (1923). "La estructura cristalina de la hexametilen-tetramina" (PDF) . J. Am. Chem. Soc. 45 : 22. doi :10.1021/ja01654a003. Archivado (PDF) desde el original el 2020-08-11 . Consultado el 2019-09-10 .
- ^ Müller A (1923). "La investigación de los ácidos grasos mediante rayos X". Journal of the Chemical Society . 123 : 2043. doi :10.1039/ct9232302043.
- ^ Saville WB, Shearer G (1925). "Una investigación de rayos X de cetonas alifáticas saturadas". Journal of the Chemical Society . 127 : 591. doi :10.1039/ct9252700591.
- ^ Bragg WH (1925). "La investigación de películas delgadas por medio de rayos X". Nature . 115 (2886): 266. Bibcode :1925Natur.115..266B. doi : 10.1038/115266a0 .
- ^ de Broglie M , Trillat JJ (1925). "Sur l'interprétation physique des specters X d'acides gras". Comptes rendus hebdomadaires des séances de l'Académie des sciences . 180 : 1485.
- ↑ Trillat JJ (1926). "Rayons X et Composeés organiques à longe chaine. Investigaciones espectrográficas sobre sus estructuras y orientaciones de sus líneas". Anales de Física . 10 (6): 5. Código Bib : 1926AnPh...10....5T. doi : 10.1051/anphys/192610060005.
- ^ Caspari WA (1928). "Cristalografía de los ácidos dicarboxílicos alifáticos". Revista de la Sociedad Química . ? : 3235. doi :10.1039/jr9280003235.
- ^ Müller A (1928). "Investigación con rayos X de compuestos de cadena larga (n. hidrocarburos)". Proc. R. Soc. Lond. 120 (785): 437. Bibcode :1928RSPSA.120..437M. doi : 10.1098/rspa.1928.0158 .
- ^ Piper SH (1929). "Algunos ejemplos de información obtenible a partir de los grandes espaciamientos de los ácidos grasos". Transactions of the Faraday Society . 25 : 348. doi :10.1039/tf9292500348.
- ^ Müller A (1929). "La conexión entre la estructura en zigzag de la cadena de hidrocarburos y la alternancia en las propiedades de los compuestos de cadena de numeración par e impar". Proc. R. Soc. Lond . 124 (794): 317. Bibcode :1929RSPSA.124..317M. doi : 10.1098/rspa.1929.0117 .
- ^ Robertson JM (1936). "Estudio de rayos X de las ftalocianinas, parte II". Journal of the Chemical Society : 1195. doi :10.1039/jr9360001195.
- ^ Powell HM, Ewens RV (1939). "La estructura cristalina del eneacarbonilo de hierro". J. Chem. Soc. : 286. doi :10.1039/jr9390000286.
- ^ Bertrand JA, Cotton FA, Dollase WA (1963). "El anión complejo polinuclear unido metal-metal en CsReCl 4 ". J. Am. Chem. Soc . 85 (9): 1349. doi :10.1021/ja00892a029.
- ^ Robinson WT, Fergusson JE, Penfold BR (1963). "Configuración del anión en CsReCl 4 ". Actas de la Sociedad Química de Londres : 116.
- ^ Cotton FA , Curtis NF, Harris CB, Johnson BF, Lippard SJ, Mague JT, et al. (septiembre de 1964). "Química mononuclear y polinuclear del renio (III): su homofilia pronunciada". Science . 145 (3638): 1305–1307. Bibcode :1964Sci...145.1305C. doi :10.1126/science.145.3638.1305. PMID 17802015. S2CID 29700317.
- ^ Cotton FA , Harris CB (1965). "La estructura cristalina y molecular del octaclorodihidrogenado(III) dipotásico dihidratado". Química inorgánica . 4 (3): 330. doi :10.1021/ic50025a015.
- ^ Algodón FA (1965). "Enlace metal-metal en iones [Re 2 X 8 ] 2− y otros grupos de átomos metálicos". Química inorgánica . 4 (3): 334. doi :10.1021/ic50025a016.
- ^ Eberhardt WH, Crawford Jr W, Lipscomb WN (1954). "La estructura de valencia de los hidruros de boro". J. Chem. Phys . 22 (6): 989. Código Bibliográfico :1954JChPh..22..989E. doi :10.1063/1.1740320.
- ^ Martin TW, Derewenda ZS (mayo de 1999). "El nombre es enlace: enlace H". Nature Structural Biology . 6 (5): 403–406. doi :10.1038/8195. PMID 10331860. S2CID 27195273.
- ^ Dunitz JD, Orgel LE, Rich A (1956). "La estructura cristalina del ferroceno". Acta Crystallographica . 9 (4): 373. Bibcode :1956AcCry...9..373D. doi : 10.1107/S0365110X56001091 .
- ^ Seiler P, Dunitz JD (1979). "Una nueva interpretación de la estructura cristalina desordenada del ferroceno". Acta Crystallographica B . 35 (5): 1068. Bibcode :1979AcCrB..35.1068S. doi :10.1107/S0567740879005598.
- ^ Wunderlich JA, Mellor DP (1954). "Una nota sobre la estructura cristalina de la sal de Zeise". Acta Crystallographica . 7 (1): 130. Bibcode :1954AcCry...7..130W. doi : 10.1107/S0365110X5400028X .
- ^ Jarvis JA, Kilbourn BT, Owston PG (1970). "Una nueva determinación de la estructura cristalina y molecular de la sal de Zeise, KPtCl 3 .C 2 H 4 .H 2 O. Una corrección". Acta Crystallographica B . 26 (6): 876. Bibcode :1970AcCrB..26..876J. doi :10.1107/S056774087000328X.
- ^ Jarvis JA, Kilbourn BT, Owston PG (1971). "Una redeterminación de la estructura cristalina y molecular de la sal de Zeise, KPtCl3.C2H4.H2O". Acta Crystallographica B . 27 (2): 366. Bibcode :1971AcCrB..27..366J. doi : 10.1107/S0567740871002231 .
- ^ Love RA, Koetzle TF, Williams GJ, Andrews LC, Bau R (1975). "Estudio de difracción de neutrones de la estructura de la sal de Zeise, KPtCl 3 (C 2 H 4 ). H 2 O". Química inorgánica . 14 (11): 2653. doi :10.1021/ic50153a012.
- ^ ab Brown D (30 de octubre de 2012). «Los primeros estudios del suelo del rover de la NASA ayudan a encontrar huellas de minerales marcianos». NASA . Archivado desde el original el 3 de junio de 2016. Consultado el 31 de octubre de 2012 .
- ^ Westgren A, Phragmén G (1925). "Análisis de rayos X de las aleaciones Cu-Zn, Ag-Zn y Au-Zn". Fil. Mag . 50 : 311. doi : 10.1080/14786442508634742.
- ^ Bradley AJ, Thewlis J (1926). "La estructura del latón gamma". Proc. R. Soc. Lond . 112 (762): 678. Bibcode :1926RSPSA.112..678B. doi : 10.1098/rspa.1926.0134 .
- ^ Hume-Rothery W (1926). "Investigaciones sobre la naturaleza, propiedades y condiciones de formación de compuestos intermetálicos (con especial referencia a ciertos compuestos de estaño)". Journal of the Institute of Metals . 35 : 295.
- ^ Bradley AJ, Gregory CH (1927). "La estructura de ciertas aleaciones ternarias". Nature . 120 (3027): 678. Bibcode :1927Natur.120..678.. doi : 10.1038/120678a0 .
- ^ Westgren A (1932). "Zur Chemie der Legierungen". Angewandte Chemie . 45 (2): 33. Bibcode : 1932AngCh..45...33W. doi : 10.1002/ange.19320450202.
- ^ Bernal JD (1935). "La teoría electrónica de los metales". Informes anuales sobre el progreso de la química . 32 : 181. doi :10.1039/AR9353200181.
- ^ Pauling L (1923). "La estructura cristalina del estannuro de magnesio". J. Am. Chem. Soc . 45 (12): 2777. doi :10.1021/ja01665a001.
- ^ Pauling L (1929). "Los principios que determinan la estructura de los cristales iónicos complejos". J. Am. Chem. Soc . 51 (4): 1010. doi :10.1021/ja01379a006.
- ^ "Base de datos estructural de Cambridge | CCDC". www.ccdc.cam.ac.uk . Archivado desde el original el 2024-05-07 . Consultado el 2024-05-07 .
- ^ Hodgkin DC (1935). "Fotografías de insulina con cristales individuales mediante rayos X". Nature . 135 (3415): 591. Bibcode :1935Natur.135..591C. doi : 10.1038/135591a0 . S2CID 4121225.
- ^ Kendrew JC , Bodo G, Dintzis HM, Parrish RG, Wyckoff H, Phillips DC (marzo de 1958). "Un modelo tridimensional de la molécula de mioglobina obtenida por análisis de rayos X". Nature . 181 (4610): 662–666. Bibcode :1958Natur.181..662K. doi :10.1038/181662a0. PMID 13517261. S2CID 4162786.
- ^ "El Premio Nobel de Química 1962". www.nobelprize.org . Archivado desde el original el 2018-01-31 . Consultado el 2018-01-31 .
- ^ "Tabla de entradas del PDB, ordenadas por método experimental". Archivado desde el original el 11 de julio de 2017. Consultado el 24 de julio de 2017 .
- ^ "PDB Statistics". Banco de datos de proteínas del RCSB. Archivado desde el original el 5 de septiembre de 2009. Consultado el 9 de febrero de 2010 .
- ^ Scapin G (2006). "Biología estructural y descubrimiento de fármacos". Current Pharmaceutical Design . 12 (17): 2087–2097. doi :10.2174/138161206777585201. PMID 16796557.
- ^ Lundstrom K (noviembre de 2006). "Genómica estructural para proteínas de membrana". Ciencias de la vida celular y molecular . 63 (22): 2597–2607. doi : 10.1007/s00018-006-6252-y . PMC 11136435 . PMID 17013556. S2CID 13432321.
- ^ Lundstrom K (agosto de 2004). "Genómica estructural de proteínas de membrana: mini revisión". Química combinatoria y cribado de alto rendimiento . 7 (5): 431–439. doi :10.2174/1386207043328634. PMID 15320710.
- ^ Chinte U, Shah B, Chen YS, Pinkerton AA, Schall CA, Hanson BL (abril de 2007). "El enfriamiento criogénico (<20 K) con helio mitiga el daño por radiación a los cristales de proteínas". Acta Crystallographica. Sección D, Cristalografía biológica . 63 (Pt 4): 486–492. Bibcode :2007AcCrD..63..486C. doi :10.1107/s0907444907005264. PMID 17372353.
- ^ Jones N (enero de 2014). «Cristalografía: secretos atómicos». Nature . 505 (7485): 602–603. Bibcode :2014Natur.505..602J. doi : 10.1038/505602a . PMID 24476871.
- ^ "Análisis de morfología por difracción de rayos X | IMR TEST LABS" www.imrtest.com . Consultado el 30 de abril de 2018 .[ enlace muerto permanente ]
- ^ Harp JM, Timm DE, Bunick GJ (julio de 1998). "Recocido de cristales macromoleculares: superación del aumento de la mosaicidad asociada con la criocristalografía". Acta Crystallographica. Sección D, Cristalografía biológica . 54 (Pt 4): 622–628. Bibcode :1998AcCrD..54..622H. doi :10.1107/S0907444997019008. PMID 9761858.
- ^ Harp JM, Hanson BL, Timm DE, Bunick GJ (julio de 1999). "Recocido de cristales macromoleculares: evaluación de técnicas y variables". Acta Crystallographica. Sección D, Cristalografía biológica . 55 (Pt 7): 1329–1334. Bibcode :1999AcCrD..55.1329H. doi :10.1107/S0907444999005442. PMID 10393299.
- ^ Hanson BL, Harp JM, Bunick GJ (2003). "El cristal proteico bien templado: recocido de cristales macromoleculares". Cristalografía macromolecular, parte C. Métodos en enzimología. Vol. 368. págs. 217–35. doi :10.1016/S0076-6879(03)68012-2. ISBN 978-0-12-182271-2. Número de identificación personal 14674276.
- ^ Geerlof A, Brown J, Coutard B, Egloff MP, Enguita FJ, Fogg MJ, et al. (octubre de 2006). "El impacto de la caracterización de proteínas en la proteómica estructural". Acta Crystallographica. Sección D, Cristalografía biológica . 62 (Pt 10): 1125–1136. Bibcode :2006AcCrD..62.1125G. doi : 10.1107/S0907444906030307 . PMC 7161605 . PMID 17001090.
- ^ Chernov AA (abril de 2003). "Cristales de proteínas y su crecimiento". Journal of Structural Biology . 142 (1): 3–21. doi :10.1016/S1047-8477(03)00034-0. PMID 12718915.
- ^ Bergfors T (2016). "Tutorial de cristalización de proteínas". Archivado desde el original el 25 de diciembre de 2019. Consultado el 17 de enero de 2020 .
- ^ Chayen N (1997). "Limitaciones de la cristalización bajo aceite". Cell . 5 (10): 1269–1274. doi : 10.1016/s0969-2126(97)00279-7 . PMID 9351804.
- ^ Rupp B, Wang J (noviembre de 2004). "Modelos predictivos para la cristalización de proteínas". Métodos . 34 (3): 390–407. doi :10.1016/j.ymeth.2004.03.031. PMID 15325656.
- ^ Chayen NE (julio de 2005). "Métodos para separar la nucleación y el crecimiento en la cristalización de proteínas". Progreso en biofísica y biología molecular . 88 (3): 329–337. doi : 10.1016/j.pbiomolbio.2004.07.007 . PMID 15652248.
- ^ Stock D, Perisic O, Löwe J (julio de 2005). "Cristalización robótica de nanolitros de proteínas en el Laboratorio de Biología Molecular del MRC". Progreso en biofísica y biología molecular . 88 (3): 311–327. doi : 10.1016/j.pbiomolbio.2004.07.009 . PMID 15652247.
- ^ Jeruzalmi D (2006). "Primer análisis de cristales macromoleculares: bioquímica y difracción de rayos X". Protocolos de cristalografía macromolecular, volumen 2. Métodos en biología molecular. Vol. 364. págs. 43–62. doi :10.1385/1-59745-266-1:43. ISBN. 1-59745-266-1. Número de identificación personal 17172760.
- ^ Helliwell JR (junio de 2005). "Perfección de cristales de proteínas y su aplicación". Acta Crystallographica. Sección D, Cristalografía biológica . 61 (Pt 6): 793–798. Bibcode :2005AcCrD..61..793H. doi : 10.1107/S0907444905001368 . PMID 15930642.
- ^ Ravelli RB, Garman EF (octubre de 2006). "Daños por radiación en la criocristalografía macromolecular". Current Opinion in Structural Biology . 16 (5): 624–629. doi :10.1016/j.sbi.2006.08.001. PMID 16938450.
- ^ Powell HR (octubre de 1999). "El algoritmo de autoindexación de Rossmann Fourier en MOSFLM". Acta Crystallographica. Sección D, Cristalografía biológica . 55 (Pt 10): 1690–1695. Bibcode :1999AcCrD..55.1690P. doi : 10.1107/S0907444999009506 . PMID 10531518.
- ^ Hauptman H (octubre de 1997). "Métodos de fase para cristalografía de proteínas". Current Opinion in Structural Biology . 7 (5): 672–680. doi :10.1016/S0959-440X(97)80077-2. PMID 9345626.
- ^ Usón I, Sheldrick GM (octubre de 1999). "Avances en métodos directos para cristalografía de proteínas". Current Opinion in Structural Biology . 9 (5): 643–648. doi : 10.1016/S0959-440X(99)00020-2 . PMID 10508770.
- ^ ab Taylor G (noviembre de 2003). "El problema de las fases". Acta Crystallographica. Sección D, Cristalografía biológica . 59 (Pt 11): 1881–1890. Bibcode :2003AcCrD..59.1881T. doi : 10.1107/S0907444903017815 . PMID 14573942.
- ^ Ealick SE (octubre de 2000). "Avances en cristalografía de difracción anómala de longitud de onda múltiple". Current Opinion in Chemical Biology . 4 (5): 495–499. doi : 10.1016/S1367-5931(00)00122-8 . PMID 11006535.
- ^ Del archivo PDB 2NRL, residuos 17–32.
- ^ "Laboratorio Garman: Interconversión de especificidades enzimáticas lisosomales – Proteopedia, vida en 3D". proteopedia.org . Archivado desde el original el 2018-11-28 . Consultado el 2018-11-28 .
- ^ Lamb, AL; Kappock, TJ; Silvaggi, NR (abril de 2015). "Estás perdido sin un mapa: navegando por el mar de las estructuras proteínicas". Biochimica et Biophysica Acta (BBA) - Proteínas y proteómica . 1854 (4): 258–68. doi :10.1016/j.bbapap.2014.12.021. PMC 5051661. PMID 25554228 .
- ^ Parkin G (1993). "Isomería de estiramiento de enlaces en complejos de metales de transición: una reevaluación de datos cristalográficos". Chem. Rev. 93 ( 3): 887–911. doi :10.1021/cr00019a003.
- ^ Rietveld HM (2 de junio de 1969). "Un método de refinamiento de perfiles para estructuras nucleares y magnéticas". Journal of Applied Crystallography . 2 (2): 65–71. Bibcode :1969JApCr...2...65R. doi : 10.1107/S0021889869006558 .
- ^ Young RA (1993). El método Rietveld . [Chester, Inglaterra]: Unión Internacional de Cristalografía. ISBN 0198555776.OCLC 26299196 .
- ^ "IUCr". www.iucr.org . Archivado desde el original el 6 de abril de 2019 . Consultado el 6 de abril de 2019 .
- ^ "Fullprof". www.ill.eu . Archivado desde el original el 2 de abril de 2019 . Consultado el 6 de abril de 2019 .
- ^ Petříček V, Dušek M, Palatinus L (1 de enero de 2014). "Sistema de Computación Cristalográfica JANA2006: Características generales". Zeitschrift für Kristallographie – Materiales cristalinos . 229 (5): 345–352. doi :10.1515/zkri-2014-1737. ISSN 2196-7105. S2CID 101692863.
- ^ Lutterotti L (febrero de 2010). "Ajuste total de patrones para la determinación combinada de tamaño-deformación-tensión-textura en difracción de película delgada". Instrumentos y métodos nucleares en la investigación en física, sección B: interacciones de haces con materiales y átomos . 268 (3–4): 334–340. Bibcode :2010NIMPB.268..334L. doi :10.1016/j.nimb.2009.09.053. ISSN 0168-583X.
- ^ Lutterotti L, Bortolotti M, Ischia G, Lonardelli I, Wenk HR (2007), "Análisis de textura de Rietveld a partir de imágenes de difracción", Décima Conferencia europea sobre difracción de polvo , OLDENBOURG WISSENSCHAFTSVERLAG, págs. 125-130, doi :10.1524/9783486992540-020 , ISBN 9783486992540
- ^ Lutterotti L, Matthies S, Wenk HR, Schultz AS, Richardson Jr JW (15 de enero de 1997). "Análisis combinado de textura y estructura de piedra caliza deformada a partir de espectros de difracción de neutrones de tiempo de vuelo". Journal of Applied Physics . 81 (2): 594–600. Bibcode :1997JAP....81..594L. doi :10.1063/1.364220. ISSN 0021-8979.
- ^ "Archivos de distribución para el paquete RIETAN-FP-VENUS". fujioizumi.verse.jp . Archivado desde el original el 2019-08-10 . Consultado el 2019-04-06 .
- ^ Toby BH, Von Dreele RB (14 de marzo de 2013). "GSAS-II: la génesis de un moderno paquete de software de cristalografía multipropósito de código abierto". Journal of Applied Crystallography . 46 (2): 544–549. Bibcode :2013JApCr..46..544T. doi :10.1107/s0021889813003531. ISSN 0021-8898.
- ^ "DIFFRAC.SUITE TOPAS - Software XRD, difracción de rayos X". Bruker.com . Archivado desde el original el 2019-04-02 . Consultado el 2019-04-06 .
- ^ "Match! – Identificación de fases a partir de difracción de polvos". www.crystalimpact.com . Archivado desde el original el 2019-04-02 . Consultado el 2019-04-06 .
- ^ Casas-Cabanas M, Reynaud M, Rikarte J, Horbach P, Rodríguez-Carvajal J (2016-12-01). "FAULTS: un programa para el refinamiento de estructuras con defectos extendidos". Journal of Applied Crystallography . 49 (6): 2259–2269. Bibcode :2016JApCr..49.2259C. doi :10.1107/S1600576716014473. ISSN 1600-5767.
- ^ Kahr, Bart (2015). "Impactos más amplios de las mujeres en la cristalografía". Crystal Growth & Design . 15 (10): 4715–4730. doi :10.1021/acs.cgd.5b00457. ISSN 1528-7483.
- ^ Ferry, Georgina (2014). «Historia: Mujeres en cristalografía». Nature . 505 (7485): 609–611. Bibcode :2014Natur.505..609F. doi : 10.1038/505609a . ISSN 1476-4687. PMID 24482834.
- ^ Sanz-Aparicio, Julia (2015). "Vista de El legado de las mujeres a la cristalografía | Arbor". Cenador . 191 (772): a216. doi : 10.3989/arbor.2015.772n2002 . hdl : 10261/130728 . Archivado desde el original el 7 de septiembre de 2015.
- ^ Watson, James D. (2000), Descubriendo la doble hélice, Cold Spring Harbor Laboratory, ISBN 978-0-87969-622-1, OCLC 48554849
- ^ Glusker, Jenny Pickworth; Trueblood, Kenneth N; Unión Internacional de Cristalografía (2020). Análisis de la estructura cristalina: una introducción. ISBN 978-0-19-191790-5.OCLC 1241842166 .
- ^ "El Premio Nobel de Física 1914". Fundación Nobel. Archivado desde el original el 15 de septiembre de 2008. Consultado el 9 de octubre de 2008 .
- ^ "El Premio Nobel de Física 1915". Fundación Nobel. Archivado desde el original el 19 de octubre de 2008. Consultado el 9 de octubre de 2008 .
- ^ "El Premio Nobel de Química 1962". Nobelprize.org. Archivado desde el original el 24 de septiembre de 2008. Consultado el 6 de octubre de 2008 .
- ^ "El Premio Nobel de Fisiología o Medicina 1962". Fundación Nobel. Archivado desde el original el 26 de diciembre de 2018. Consultado el 28 de julio de 2007 .
- ^ "El Premio Nobel de Química 1964". Nobelprize.org. Archivado desde el original el 15 de octubre de 2008. Consultado el 6 de octubre de 2008 .
- ^ "El Premio Nobel de Química 1972". Nobelprize.org. Archivado desde el original el 11 de octubre de 2008. Consultado el 6 de octubre de 2008 .
- ^ "El Premio Nobel de Química 1976". Nobelprize.org. Archivado desde el original el 25 de diciembre de 2008. Consultado el 6 de octubre de 2008 .
- ^ "El Premio Nobel de Química 1985". Nobelprize.org. Archivado desde el original el 25 de diciembre de 2008. Consultado el 6 de octubre de 2008 .
- ^ "El Premio Nobel de Química 1988". Nobelprize.org. Archivado desde el original el 25 de diciembre de 2008. Consultado el 6 de octubre de 2008 .
- ^ "El Premio Nobel de Química 1997". Nobelprize.org. Archivado desde el original el 21 de octubre de 2008. Consultado el 6 de octubre de 2008 .
- ^ ab "El Premio Nobel de Química 2003". Nobelprize.org. Archivado desde el original el 29 de septiembre de 2008. Consultado el 6 de octubre de 2008 .
- ^ "El Premio Nobel de Química 2006". Nobelprize.org. Archivado desde el original el 17 de octubre de 2008. Consultado el 6 de octubre de 2008 .
- ^ "El Premio Nobel de Química 2009". Nobelprize.org. Archivado desde el original el 10 de octubre de 2009. Consultado el 7 de octubre de 2009 .
- ^ "El Premio Nobel de Química 2012". Nobelprize.org. Archivado desde el original el 13 de octubre de 2012. Consultado el 13 de octubre de 2012 .
Lectura adicional
Tablas internacionales de cristalografía
- Hahn T, ed. (2002). Tablas internacionales para cristalografía. Volumen A, Simetría de grupos espaciales (5.ª ed.). Dordrecht: Kluwer Academic Publishers , para la Unión Internacional de Cristalografía . ISBN 0-7923-6590-9.
- Rossmann MG, Arnold E, eds. (2001). Tablas internacionales de cristalografía. Volumen F, Cristalografía de moléculas biológicas . Dordrecht: Kluwer Academic Publishers, para la Unión Internacional de Cristalografía. ISBN 0-7923-6857-6.
- Hahn T, ed. (1996). Tablas internacionales para cristalografía. Edición breve para la enseñanza del volumen A, Simetría de grupos espaciales (4.ª ed.). Dordrecht: Kluwer Academic Publishers, para la Unión Internacional de Cristalografía. ISBN 0-7923-4252-6.
Colecciones encuadernadas de artículos
- Carter Jr CW, Sweet RM, eds. (1997). Cristalografía macromolecular, parte A (Métodos en enzimología, v. 276) . San Diego: Academic Press. ISBN 0-12-182177-3.
- Carter Jr CW, Sweet RM, eds. (1997). Cristalografía macromolecular, parte B (Métodos en enzimología, v. 277) . San Diego: Academic Press. ISBN 0-12-182178-1.
- Ducruix A, Giegé R, eds. (1999). Cristalización de ácidos nucleicos y proteínas: un enfoque práctico (2.ª ed.). Oxford: Oxford University Press. ISBN 0-19-963678-8.
Libros de texto
- Birkholz M, Fewster PF, Genzel C (2005). "Capítulo 1: Principios de la difracción de rayos X". Análisis de película delgada por dispersión de rayos X. Weinheim: Wiley-VCH. ISBN 978-3-527-31052-4– a través de ResearchGate.
- Blow D (2002). Esquema de cristalografía para biólogos . Oxford: Oxford University Press. ISBN 0-19-851051-9.
- Burns G, Glazer AM (1990). Grupos espaciales para científicos e ingenieros (2.ª ed.). Boston: Academic Press, Inc. ISBN 0-12-145761-3.
- Clegg W (1998). Determinación de la estructura cristalina (Oxford Chemistry Primer) . Oxford: Oxford University Press. ISBN 0-19-855901-1.
- Cullity BD (1978). Elementos de difracción de rayos X (2.ª ed.). Reading, Massachusetts: Addison-Wesley Publishing Company. ISBN 0-534-55396-6.
- Drenth J (1999). Principios de la cristalografía de rayos X de proteínas . Nueva York: Springer-Verlag. ISBN 0-387-98587-5.
- Giacovazzo C (1992). Fundamentos de cristalografía . Oxford: Oxford University Press. ISBN 0-19-855578-4.
- Glusker JP, Lewis M, Rossi M (1994). Análisis de la estructura cristalina para químicos y biólogos . Nueva York: VCH Publishers. ISBN 0-471-18543-4.
- Massa W (2004). Determinación de la estructura cristalina . Berlín: Springer. ISBN 3-540-20644-2.
- McPherson A (1999). Cristalización de macromoléculas biológicas . Cold Spring Harbor, Nueva York: Cold Spring Harbor Laboratory Press. ISBN 0-87969-617-6.
- McPherson A (2003). Introducción a la cristalografía macromolecular . John Wiley & Sons. ISBN 0-471-25122-4.
- McRee DE (1993). Cristalografía práctica de proteínas. San Diego: Academic Press. ISBN 0-12-486050-8.
- O'Keeffe M, Hyde BG (1996). Estructuras cristalinas; I. Patrones y simetría . Washington, DC: Mineralogical Society of America, Serie de monografías. ISBN 0-939950-40-5.
- Rhodes G (2000). Cristalografía con una claridad cristalina (PDF) . San Diego: Academic Press. ISBN 0-12-587072-8Archivado (PDF) del original el 8 de octubre de 2021. Consultado el 16 de septiembre de 2007 , a través de UW-Eau Claire, Chem 406, otoño de 2005.
- Rupp B (2009). Cristalografía biomolecular: principios, práctica y aplicación a la biología estructural . Nueva York: Garland Science. ISBN 978-0-8153-4081-2.
- Warren BE (1969). Difracción de rayos X. Nueva York: Dover Publications. ISBN. 0-486-66317-5.
- Zachariasen WH (1945). Teoría de la difracción de rayos X en cristales . Nueva York: Dover Publications. LCCN 67026967.
Análisis computacional de datos aplicado
- Young RA, ed. (1993). El método de Rietveld . Oxford: Oxford University Press y Unión Internacional de Cristalografía. ISBN 0-19-855577-6.
Histórico
- Bijvoet MJ , Burgers WG, Hägg G, eds. (1969). Early Papers on Diffraction of X-rays by Crystals (Primeros artículos sobre difracción de rayos X por cristales ). Vol. I. Utrecht: publicado para la Unión Internacional de Cristalografía por A. Oosthoek's Uitgeversmaatschappij NV
- Bijvoet JM, Burgers WG, Hägg G, eds. (1972). Primeros artículos sobre difracción de rayos X mediante cristales . vol. II. Utrecht: publicado para la Unión Internacional de Cristalografía por Uitgeversmaatschappij NV de A. Oosthoek
- Bragg WL, Phillips DC, Lipson H (1992). El desarrollo del análisis de rayos X. Nueva York: Dover. ISBN 0-486-67316-2.
- Ewald PP , et al., eds. (1962). Cincuenta años de difracción de rayos X . Utrecht: publicado para la Unión Internacional de Cristalografía por A. Oosthoek's Uitgeversmaatschappij NV doi :10.1007/978-1-4615-9961-6. ISBN 978-1-4615-9963-0.
- Ewald PP (ed.). "50 años de difracción de rayos X". Unión Internacional de Cristalografía. Archivado desde el original el 23 de marzo de 2008. Consultado el 11 de diciembre de 2006.
Reimpreso en formato pdf para el XVIII Congreso de la IUCr, Glasgow, Escocia.
- Federico W. (1922). "Die Geschichte der Auffundung der Röntgenstrahlinterferenzen". Die Naturwissenschaften . 10 (16): 363. Código bibliográfico : 1922NW.....10..363F. doi :10.1007/BF01565289. S2CID 28141506. Archivado desde el original el 29 de marzo de 2020 . Consultado el 3 de diciembre de 2019 .
- Lonsdale K (1949). Cristales y rayos X. Nueva York: D. van Nostrand.
Enlaces externos
Tutoriales
- Aprendiendo Cristalografía
- Introducción sencilla y no técnica
- La Colección de Cristalografía, serie de vídeos de la Royal Institution
- "Cristalización de moléculas pequeñas" ( PDF ) en el sitio web del Instituto Tecnológico de Illinois
- Unión Internacional de Cristalografía
- Cristalografía 101
- Tutorial interactivo sobre el factor de estructura, que demuestra las propiedades del patrón de difracción de un cristal 2D.
- Libro de imágenes de transformadas de Fourier, que ilustra la relación entre el cristal y el patrón de difracción en 2D.
- Apuntes de clase sobre cristalografía de rayos X y determinación de estructuras
- Conferencia en línea sobre métodos modernos de dispersión de rayos X para el análisis de materiales a escala nanométrica, a cargo de Richard J. Matyi
- Cronología de la cristalografía interactiva Archivado el 30 de junio de 2021 en Wayback Machine desde la Royal Institution
Bases de datos primarias
- Base de datos abierta de cristalografía (COD)
- Banco de datos de proteínas ( PDB )
- Banco de datos de ácidos nucleicos (NDB)
- Base de datos estructural de Cambridge ( CSD )
- Base de datos de estructuras cristalinas inorgánicas ( ICSD )
- Base de datos de cristalización de macromoléculas biológicas (BMCD)
Bases de datos derivadas
- PDBsuma
- Proteopedia: la enciclopedia colaborativa en 3D de proteínas y otras moléculas
- Base de ARN
- Base de datos HIC-Up de ligandos PDB Archivado el 8 de agosto de 2020 en Wayback Machine
- Base de datos de clasificación estructural de proteínas
- Clasificación de la estructura de la proteína CATH
- Lista de proteínas transmembrana con estructura 3D conocida Archivado el 11 de abril de 2011 en Wayback Machine
- Base de datos de orientaciones de proteínas en membranas
Validación estructural
- Paquete de validación estructural MolProbity
- ProSA-web
- NQ-Flipper (verificación de rotámeros desfavorables de residuos de Asn y Gln)
- Servidor DALI (identifica proteínas similares a una proteína dada)

