Hemo

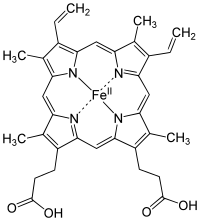
El hemo ( en inglés americano ) o haem ( en inglés de la Commonwealth , ambos pronunciados / hi:m / HEEM ) es un componente molecular de la hemoglobina que contiene hierro y tiene forma de anillo , el cual es necesario para unir el oxígeno en el torrente sanguíneo . Está compuesto por cuatro anillos de pirrol con 2 cadenas laterales de vinilo y 2 de ácido propiónico . [1] El hemo se biosintetiza tanto en la médula ósea como en el hígado . [2]
El hemo desempeña un papel fundamental en múltiples reacciones redox diferentes en los mamíferos, debido a su capacidad para transportar la molécula de oxígeno. Las reacciones incluyen el metabolismo oxidativo ( citocromo c oxidasa , succinato deshidrogenasa ), la desintoxicación de xenobióticos a través de las vías del citocromo P450 (incluido el metabolismo de algunos fármacos), la detección de gases ( guanil ciclasas , óxido nítrico sintasa) y el procesamiento de microARN (DGCR8). [3] [4]
El hemo es un complejo de coordinación "que consiste en un ion de hierro coordinado a un tetrapirrol que actúa como un ligando tetradentado , y a uno o dos ligandos axiales". [5] La definición es vaga y muchas descripciones omiten los ligandos axiales. [6] Entre las metaloporfirinas desplegadas por las metaloproteínas como grupos prostéticos , el hemo es uno de los más utilizados [7] y define una familia de proteínas conocidas como hemoproteínas . Los hemo se reconocen más comúnmente como componentes de la hemoglobina , el pigmento rojo de la sangre , pero también se encuentran en varias otras hemoproteínas biológicamente importantes como la mioglobina , los citocromos , las catalasas , la hemo peroxidasa y la óxido nítrico sintasa endotelial . [8] [9]
La palabra hemo se deriva del griego αἷμα haima ‘sangre’.
Función

Las hemoproteínas tienen diversas funciones biológicas, incluyendo el transporte de gases diatómicos , catálisis química , detección de gases diatómicos y transferencia de electrones . El hierro del hemo sirve como fuente o sumidero de electrones durante la transferencia de electrones o química redox . En las reacciones de peroxidasa , la molécula de porfirina también sirve como fuente de electrones, siendo capaz de deslocalizar electrones radicales en el anillo conjugado. En el transporte o detección de gases diatómicos, el gas se une al hierro del hemo. Durante la detección de gases diatómicos, la unión del ligando de gas al hierro del hemo induce cambios conformacionales en la proteína circundante. [10] En general, los gases diatómicos solo se unen al hemo reducido, como Fe(II) ferroso mientras que la mayoría de las peroxidasas realizan ciclos entre Fe(III) y Fe(IV) y las hemoproteínas involucradas en redox mitocondrial, oxidación-reducción, realizan ciclos entre Fe(II) y Fe(III).
Se ha especulado que la función evolutiva original de las hemoproteínas era la transferencia de electrones en vías de fotosíntesis primitivas basadas en azufre en organismos ancestrales similares a las cianobacterias antes de la aparición del oxígeno molecular . [11]
Las hemoproteínas logran su notable diversidad funcional modificando el entorno del macrociclo del hemo dentro de la matriz proteica. [12] Por ejemplo, la capacidad de la hemoglobina para entregar oxígeno de manera efectiva a los tejidos se debe a residuos de aminoácidos específicos ubicados cerca de la molécula de hemo. [13] La hemoglobina se une reversiblemente al oxígeno en los pulmones cuando el pH es alto y la concentración de dióxido de carbono es baja. Cuando la situación se invierte (pH bajo y altas concentraciones de dióxido de carbono), la hemoglobina liberará oxígeno a los tejidos. Este fenómeno, que establece que la afinidad de unión al oxígeno de la hemoglobina es inversamente proporcional tanto a la acidez como a la concentración de dióxido de carbono, se conoce como el efecto Bohr . [14] El mecanismo molecular detrás de este efecto es la organización estérica de la cadena de globina ; un residuo de histidina , ubicado adyacente al grupo hemo, se carga positivamente en condiciones ácidas (que son causadas por el CO 2 disuelto en los músculos que trabajan, etc.), liberando oxígeno del grupo hemo. [15]
Tipos
Hemes principales
Existen varios tipos de hemo biológicamente importantes:
| Hemo A | Hemo B | Hemo C | Hemo O | ||
|---|---|---|---|---|---|
| Número de PubChem | 7888115 | 444098 | 444125 | 6323367 | |
| Fórmula química | C49H56O6N4Fe | C34H32O4N4Fe | C34H36O4N4S2Fe | C49H58O5N4Fe | |
| Grupo funcional en C 3 |  | –CH(OH)CH 2 Lejos | –CH= CH2 | –CH( cisteína- S -il )CH 3 | –CH(OH)CH 2 Lejos |
| Grupo funcional en C 8 | –CH= CH2 | –CH= CH2 | –CH( cisteína- S -il )CH 3 | –CH= CH2 | |
| Grupo funcional en C 18 | –CH=O | –C 3 | –C 3 | –C 3 | |

El tipo más común es el hemo B ; otros tipos importantes incluyen el hemo A y el hemo C. Los hemo aislados se designan comúnmente con letras mayúsculas, mientras que los hemo unidos a proteínas se designan con letras minúsculas. El citocromo a se refiere al hemo A en combinación específica con la proteína de membrana que forma una parte de la citocromo c oxidasa . [18]
Otros hemo
- El siguiente sistema de numeración de carbono de las porfirinas es un sistema de numeración más antiguo utilizado por los bioquímicos y no el sistema de numeración 1-24 recomendado por la IUPAC , que se muestra en la tabla anterior.
- El hemo l es el derivado del hemo B que está unido covalentemente a la proteína de la lactoperoxidasa , la peroxidasa de eosinófilos y la peroxidasa tiroidea . La adición de peróxido con el glutamil -375 y el aspartil -225 de la lactoperoxidasa forma enlaces éster entre estos residuos de aminoácidos y los grupos hemo 1 y 5-metil, respectivamente. [19] Se cree que se forman enlaces éster similares con estos dos grupos metilo en las peroxidasas de eosinófilos y tiroideas. El hemo l es una característica importante de las peroxidasas animales; las peroxidasas vegetales incorporan el hemo B. La lactoperoxidasa y la peroxidasa de eosinófilos son enzimas protectoras responsables de la destrucción de bacterias y virus invasores. La peroxidasa tiroidea es la enzima que cataliza la biosíntesis de las importantes hormonas tiroideas. Debido a que la lactoperoxidasa destruye los organismos invasores en los pulmones y los excrementos, se cree que es una enzima protectora importante. [20]
- El hemo m es el derivado del hemo B unido covalentemente al sitio activo de la mieloperoxidasa . El hemo m contiene los dos enlaces éster en los grupos hemo 1 y 5-metil también presentes en el hemo l de otras peroxidasas de mamíferos, como la lactoperoxidasa y la peroxidasa de eosinófilos. Además, se forma un enlace iónico sulfonamida único entre el azufre de un residuo de aminoácido metionilo y el grupo hemo 2-vinilo, lo que le da a esta enzima la capacidad única de oxidar fácilmente los iones cloruro y bromuro a hipoclorito e hipobromito. La mieloperoxidasa está presente en los neutrófilos de los mamíferos y es responsable de la destrucción de bacterias invasoras y agentes virales. Quizás sintetice hipobromito por "error". Tanto el hipoclorito como el hipobromito son especies muy reactivas responsables de la producción de nucleósidos halogenados, que son compuestos mutagénicos. [21] [22]
- El hemo D es otro derivado del hemo B, pero en el que la cadena lateral de ácido propiónico en el carbono de la posición 6, que también está hidroxilada, forma una γ- espirolactona . El anillo III también está hidroxilado en la posición 5, en una conformación trans al nuevo grupo lactona. [23] El hemo D es el sitio de reducción de oxígeno a agua de muchos tipos de bacterias a baja tensión de oxígeno. [24]
- El hemo S está relacionado con el hemo B al tener un grupo formilo en la posición 2 en lugar del grupo 2-vinilo. El hemo S se encuentra en la hemoglobina de algunas especies de gusanos marinos. Las estructuras correctas del hemo B y del hemo S fueron dilucidadas por primera vez por el químico alemán Hans Fischer . [25]
Los nombres de los citocromos generalmente (pero no siempre) reflejan los tipos de hemo que contienen: el citocromo a contiene el hemo A, el citocromo c contiene el hemo C, etc. Esta convención puede haberse introducido por primera vez con la publicación de la estructura del hemo A.
Uso de letras mayúsculas para designar el tipo de hemo
La práctica de designar hemo con letras mayúsculas fue formalizada en una nota al pie en un artículo de Puustinen y Wikstrom, [26] que explica bajo qué condiciones se debe usar una letra mayúscula: "preferimos el uso de letras mayúsculas para describir la estructura del hemo como aislada. Las letras minúsculas pueden entonces usarse libremente para citocromos y enzimas, así como para describir grupos hemo unidos a proteínas individuales (por ejemplo, complejos de citocromo bc y aa3, citocromo b 5 , hemo c 1 del complejo bc 1 , hemo a 3 del complejo aa 3 , etc.)". En otras palabras, el compuesto químico se designaría con una letra mayúscula, pero instancias específicas en estructuras con minúsculas. Así, la citocromo oxidasa, que tiene dos hemo A (hemo a y hemo a 3 ) en su estructura, contiene dos moles de hemo A por mol de proteína. El citocromo bc 1 , con los hemo b H , b L y c 1 , contiene hemo B y hemo C en una proporción de 2:1. La práctica parece haberse originado en un artículo de Caughey y York en el que el producto de un nuevo procedimiento de aislamiento del hemo del citocromo aa3 se denominó hemo A para diferenciarlo de las preparaciones anteriores: "Nuestro producto no es idéntico en todos los aspectos al hemo a obtenido en solución por otros investigadores mediante la reducción de la hemina a aislada previamente (2). Por esta razón, designaremos nuestro producto hemo A hasta que se puedan racionalizar las diferencias aparentes". [27] En un artículo posterior, [28] el grupo de Caughey utiliza letras mayúsculas para los hemo B y C aislados, así como para A.
Síntesis

El proceso enzimático que produce el hemo se denomina propiamente síntesis de porfirinas , ya que todos los intermediarios son tetrapirroles que se clasifican químicamente como porfirinas. El proceso está muy conservado en la biología. En los seres humanos, esta vía sirve casi exclusivamente para formar el hemo. En las bacterias , también produce sustancias más complejas como el cofactor F430 y la cobalamina ( vitamina B 12 ). [29]
La vía se inicia con la síntesis de ácido δ-aminolevulínico (dALA o δALA) a partir del aminoácido glicina y succinil-CoA del ciclo del ácido cítrico (ciclo de Krebs). La enzima limitante de la velocidad responsable de esta reacción, la ALA sintasa , está regulada negativamente por la concentración de glucosa y hemo. El mecanismo de inhibición de los ALA por el hemo o la hemina es mediante la disminución de la estabilidad de la síntesis de ARNm y mediante la disminución de la ingesta de ARNm en las mitocondrias. Este mecanismo es de importancia terapéutica: la infusión de arginato de hemo o hematina y glucosa puede abortar los ataques de porfiria intermitente aguda en pacientes con un error innato del metabolismo de este proceso, al reducir la transcripción de la ALA sintasa. [30]
Los órganos principalmente involucrados en la síntesis del hemo son el hígado (en el que la tasa de síntesis es muy variable, dependiendo del pool sistémico de hemo) y la médula ósea (en la que la tasa de síntesis del hemo es relativamente constante y depende de la producción de la cadena de globina), aunque cada célula requiere del hemo para funcionar correctamente. Sin embargo, debido a sus propiedades tóxicas, se requieren proteínas como la emopexina (Hx) para ayudar a mantener las reservas fisiológicas de hierro para que puedan ser utilizadas en la síntesis. [31] El hemo es visto como una molécula intermediaria en el catabolismo de la hemoglobina en el proceso del metabolismo de la bilirrubina . Los defectos en varias enzimas en la síntesis del hemo pueden conducir a un grupo de trastornos llamados porfirias, que incluyen porfiria intermitente aguda , porfiria eritropoyética congénita , porfiria cutánea tarda , coproporfiria hereditaria , porfiria variegata y protoporfiria eritropoyética . [32]
Síntesis para alimentos
Impossible Foods , productores de sustitutos de carne a base de plantas , utiliza un proceso acelerado de síntesis de hemo que involucra leghemoglobina de raíz de soja y levadura , agregando el hemo resultante a productos como hamburguesas sin carne ( veganas ) Impossible. El ADN para la producción de leghemoglobina se extrajo de los nódulos de la raíz de soja y se expresó en células de levadura para sobreproducir hemo para su uso en las hamburguesas sin carne. [33] Este proceso pretende crear un sabor a carne en los productos resultantes. [34] [35]
Degradación
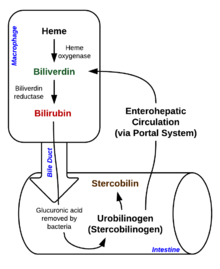
La degradación comienza dentro de los macrófagos del bazo , que eliminan los eritrocitos viejos y dañados de la circulación.
En el primer paso, el hemo se convierte en biliverdina por la enzima hemooxigenasa (HO). [36] El NADPH se utiliza como agente reductor, el oxígeno molecular entra en la reacción, se produce monóxido de carbono (CO) y el hierro se libera de la molécula como ion ferroso (Fe 2+ ). [37] El CO actúa como mensajero celular y funciona en la vasodilatación. [38]
Además, la degradación del hemo parece ser una respuesta conservada evolutivamente al estrés oxidativo . En resumen, cuando las células se exponen a radicales libres , hay una rápida inducción de la expresión de la isoenzima hemooxigenasa-1 sensible al estrés (HMOX1) que cataboliza el hemo (ver más abajo). [39] La razón por la que las células deben aumentar exponencialmente su capacidad para degradar el hemo en respuesta al estrés oxidativo sigue sin estar clara, pero esto parece ser parte de una respuesta citoprotectora que evita los efectos nocivos del hemo libre. Cuando se acumulan grandes cantidades de hemo libre, los sistemas de desintoxicación/degradación del hemo se ven abrumados, lo que permite que el hemo ejerza sus efectos dañinos. [31]
| hemo | hemo oxigenasa-1 | biliverdina + Fe 2+ | |
 |  | ||
| H ++ NADPH + O2 | NADP + + CO | ||
 | |||
En la segunda reacción, la biliverdina se convierte en bilirrubina por acción de la biliverdina reductasa (BVR): [40]
| biliverdina | biliverdina reductasa | bilirrubina | |
 |  | ||
| H ++ NADPH | NADP + | ||
 | |||
La bilirrubina se transporta al hígado mediante difusión facilitada unida a una proteína ( albúmina sérica ), donde se conjuga con ácido glucurónico para volverse más soluble en agua. La reacción es catalizada por la enzima UDP- glucuronosiltransferasa . [41]
| bilirrubina | UDP -glucuronosiltransferasa | diglucurónido de bilirrubina | |
 |  | ||
| 2 UDP-glucurónido | 2 UMP + 2 Pi | ||
 | |||
Esta forma de bilirrubina se excreta desde el hígado en la bilis . La excreción de bilirrubina desde el hígado a los canalículos biliares es un proceso activo, dependiente de la energía y limitante de la velocidad. Las bacterias intestinales desconjugan el diglucurónido de bilirrubina liberando bilirrubina libre, que puede ser reabsorbida o reducida a urobilinógeno por la enzima bacteriana bilirrubina reductasa. [42]
| bilirrubina | bilirrubina reductasa | urobilinógeno | |
 |  | ||
| 4NAD (P)H + 4H + | 4NAD(P) + | ||
 | |||
Una parte del urobilinógeno es absorbido por las células intestinales y transportado a los riñones , donde se excreta con la orina ( urobilina , que es el producto de la oxidación del urobilinógeno y es responsable del color amarillo de la orina). El resto viaja por el tracto digestivo y se convierte en estercobilinógeno . Este se oxida a estercobilina , que se excreta y es responsable del color marrón de las heces . [43]
En la salud y en la enfermedad
En homeostasis , la reactividad del hemo está controlada por su inserción en los "bolsillos del hemo" de las hemoproteínas. [ cita requerida ] Sin embargo, bajo estrés oxidativo, algunas hemoproteínas, por ejemplo la hemoglobina, pueden liberar sus grupos prostéticos hemo. [44] [45] El hemo no unido a proteínas (libre) producido de esta manera se vuelve altamente citotóxico, probablemente debido al átomo de hierro contenido dentro de su anillo de protoporfirina IX, que puede actuar como un reactivo de Fenton para catalizar de manera desenfrenada la producción de radicales libres. [46] Cataliza la oxidación y agregación de proteínas, la formación de peróxido lipídico citotóxico a través de la peroxidación lipídica y daña el ADN a través del estrés oxidativo. Debido a sus propiedades lipofílicas, daña las bicapas lipídicas en orgánulos como las mitocondrias y los núcleos. [47] Estas propiedades del hemo libre pueden sensibilizar a una variedad de tipos de células para que experimenten una muerte celular programada en respuesta a agonistas proinflamatorios, un efecto nocivo que desempeña un papel importante en la patogénesis de ciertas enfermedades inflamatorias como la malaria [48] y la sepsis . [49]
Cáncer
Existe una asociación entre una alta ingesta de hierro hemo proveniente de la carne y un mayor riesgo de cáncer colorrectal . [50]
El Instituto Americano para la Investigación del Cáncer (AICR) y el Fondo Mundial para la Investigación del Cáncer Internacional (WCRF) concluyeron en un informe de 2018 que hay evidencia limitada pero sugerente de que los alimentos que contienen hierro hemo aumentan el riesgo de cáncer colorrectal. [51] Una revisión de 2019 encontró que la ingesta de hierro hemo está asociada con un mayor riesgo de cáncer de mama . [52]
Genes
Los siguientes genes forman parte de la vía química para la producción de hemo:
- ALAD : ácido aminolevulínico, δ-, deshidratasa (la deficiencia causa porfiria por deficiencia de ala-deshidratasa) [53]
- ALAS1 : aminolevulinato, δ-, sintasa 1
- ALAS2 : aminolevulinato, δ-, sintasa 2 (la deficiencia causa anemia sideroblástica/hipocrómica)
- CPOX : coproporfirinógeno oxidasa (su deficiencia causa coproporfiria hereditaria) [54]
- FECH : ferroquelatasa (su deficiencia causa protoporfiria eritropoyética )
- HMBS : hidroximetilbilano sintasa (la deficiencia causa porfiria intermitente aguda) [55]
- PPOX : protoporfirinógeno oxidasa (su deficiencia causa porfiria variegata) [56]
- UROD : uroporfirinógeno descarboxilasa (su deficiencia causa porfiria cutánea tarda) [57]
- UROS : uroporfirinógeno III sintasa (su deficiencia causa porfiria eritropoyética congénita)
Notas y referencias
- ^ Hodgson E, Roe RM, Mailman RB, Chambers JE, eds. (2015). "H". Diccionario de toxicología (3.ª ed.). Academic Press. págs. 173-184. doi :10.1016/B978-0-12-420169-9.00008-4. ISBN 978-0-12-420169-9. Recuperado el 21 de febrero de 2024 .
- ^ Bloomer JR (1998). "Metabolismo hepático de porfirinas y hemo". Revista de Gastroenterología y Hepatología . 13 (3): 324–329. doi : 10.1111/j.1440-1746.1998.01548.x . PMID 9570250. S2CID 25224821.
- ^ Dutt S, Hamza I, Bartnikas TB (22 de agosto de 2022). "Mecanismos moleculares del metabolismo del hierro y el hemo". Revisión anual de nutrición . 42 (1): 311–335. doi :10.1146/annurev-nutr-062320-112625. ISSN 0199-9885. PMC 9398995 . PMID 35508203.
- ^ Ogun AS, Joy NV, Valentine M (2024), "Bioquímica, síntesis de hemo", StatPearls , Treasure Island (FL): StatPearls Publishing, PMID 30726014 , consultado el 22 de febrero de 2024
- ^ Química IU (2009). "Hemes (derivados del hemo)". Compendio de terminología química de la IUPAC . IUPAC. doi :10.1351/goldbook.H02773. ISBN 978-0-9678550-9-7Archivado desde el original el 22 de agosto de 2017 . Consultado el 28 de abril de 2018 .
- ^ Un texto de bioquímica estándar define el hemo como el "grupo prostético de hierro-porfirina de las proteínas hemo" (Nelson, DL; Cox, MM "Lehninger, Principles of Biochemistry" 3rd Ed. Worth Publishing: Nueva York, 2000. ISBN 1-57259-153-6 .)
- ^ Poulos TL (9 de abril de 2014). "Estructura y función de la enzima hemo". Chemical Reviews . 114 (7): 3919–3962. doi :10.1021/cr400415k. ISSN 0009-2665. PMC 3981943 . PMID 24400737.
- ^ Paoli M (2002). "Relaciones estructura-función en las hemoproteínas" (PDF) . DNA Cell Biol . 21 (4): 271–280. doi :10.1089/104454902753759690. hdl :20.500.11820/67200894-eb9f-47a2-9542-02877d41fdd7. PMID 12042067. S2CID 12806393. Archivado (PDF) desde el original el 24 de julio de 2018.
- ^ Alderton W (2001). "Sintasas de óxido nítrico: estructura, función e inhibición". Biochem. J. 357 ( 3): 593–615. doi :10.1042/bj3570593. PMC 1221991. PMID 11463332 .
- ^ Milani M (2005). "Bases estructurales para la unión del grupo hemo y el reconocimiento de ligandos diatómicos en hemoglobinas truncadas". J. Inorg. Biochem . 99 (1): 97–109. doi :10.1016/j.jinorgbio.2004.10.035. PMID 15598494.
- ^ Hardison R (1999). "La evolución de la hemoglobina: los estudios de una proteína muy antigua sugieren que los cambios en la regulación genética son una parte importante de la historia evolutiva". American Scientist . 87 (2): 126. doi :10.1511/1999.20.809. S2CID 123532036.
- ^ Poulos T (2014). "Estructura y función de la enzima hemo". Chem. Rev. 114 ( 7): 3919–3962. doi :10.1021/cr400415k. PMC 3981943. PMID 24400737 .
- ^ Thom CS (2013). "Variantes de la hemoglobina: propiedades bioquímicas y correlatos clínicos". Cold Spring Harbor Perspectives in Medicine . 3 (3): a011858. doi :10.1101/cshperspect.a011858. PMC 3579210 . PMID 23388674.
- ^ Bohr, Hasselbalch, Krogh. "Acerca de una relación biológicamente importante: la influencia del contenido de dióxido de carbono de la sangre en su unión al oxígeno". Archivado desde el original el 18 de abril de 2017.
{{cite journal}}: Requiere citar revista|journal=( ayuda ) - ^ Ackers GK, Holt JM (2006). "Cooperatividad asimétrica en un tetrámero simétrico: hemoglobina humana". J. Biol. Chem . 281 (17): 11441–3. doi : 10.1074/jbc.r500019200 . PMID: 16423822. S2CID : 6696041.
- ^ Caughey WS, Smythe GE, O'Keeffe DH, Maskasky JE, Smith ML (1975). "Hemo A de la citocromo c oxidasa: Estructura y propiedades: comparaciones con los hemo B, C y S y derivados". J. Biol. Chem . 250 (19): 7602–7622. doi : 10.1016/S0021-9258(19)40860-0 . PMID 170266.
- ^ Hegg EL (2004). "La hemo A sintasa no incorpora oxígeno molecular en el grupo formilo del hemo A". Bioquímica . 43 (27): 8616–8624. doi :10.1021/bi049056m. PMID 15236569.
- ^ Yoshikawa S (2012). "Estudios estructurales sobre la citocromo c oxidasa del corazón bovino". Biochim. Biophys. Acta . 1817 (4): 579–589. doi : 10.1016/j.bbabio.2011.12.012 . PMID 22236806.
- ^ Rae T, Goff H (1998). "El grupo prostético del hemo de la lactoperoxidasa. Características estructurales del hemo l y de los hemo l-péptidos". The Journal of Biological Chemistry . 273 (43): 27968–27977. doi : 10.1074/jbc.273.43.27968 . PMID 9774411. S2CID 25780396.
- ^ Purdy M (1983). "Efecto de la fase de crecimiento y la estructura de la envoltura celular en la susceptibilidad de Salmonella triumphant al sistema lactoperoxidasa-tiocianato-peróxido de hidrógeno". Infect. Inmun . 39 (3): 1187–95. doi :10.1128/IAI.39.3.1187-1195.1983. PMC 348082 . PMID 6341231.
- ^ Ohshima H (2003). "Base química de la carcinogénesis inducida por inflamación". Arch. Biochem. Biophys . 417 (1): 3–11. doi :10.1016/s0003-9861(03)00283-2. PMID 12921773.
- ^ Henderson J (2003). "Los fagocitos producen 5-clorouracilo y 5-bromouracilo, dos productos mutagénicos de la mieloperoxidasa, en el tejido inflamatorio humano". J. Biol. Chem . 278 (26): 23522–8. doi : 10.1074/jbc.m303928200 . PMID: 12707270. S2CID : 19631565.
- ^ Murshudov G, Grebenko A, Barynin V, Dauter Z, Wilson K, Vainshtein B, Melik-Adamyan W, Bravo J, Ferrán J, Ferrer JC, Switala J, Loewen PC, Fita I (1996). "Estructura del hemo d de las catalasas de Penicillium vitale y Escherichia coli" (PDF) . La Revista de Química Biológica . 271 (15): 8863–8868. doi : 10.1074/jbc.271.15.8863 . PMID 8621527. Archivado (PDF) desde el original el 24 de julio de 2018.
- ^ Belevich I (2005). "Complejo oxigenado del citocromo bd de Escherichia coli: estabilidad y fotolabilidad". FEBS Letters . 579 (21): 4567–70. doi :10.1016/j.febslet.2005.07.011. PMID 16087180. S2CID 36465802.
- ^ Fischer H, Orth H (1934). Die Chemie des Pyrrols. Liepzig: Isquemia Verlagsgesellschaft.
- ^ Puustinen A, Wikström M. (1991). "Los grupos hemo del citocromo o de Escherichia coli". Proc. Natl. Sci. USA . 88 (14): 6122–6. Bibcode :1991PNAS...88.6122P. doi : 10.1073/pnas.88.14.6122 . PMC 52034 . PMID 2068092.
- ^ Caughey WS, York JL (1962). "Aislamiento y algunas propiedades del hemo verde de la citocromo oxidasa del músculo cardíaco de res". J. Biol. Chem . 237 (7): 2414–6. doi : 10.1016/S0021-9258(19)63456-3 . PMID: 13877421.
- ^ Caughey WS, Smythe GA, O'Keeffe DH, Maskasky JE, Smith ML (1975). "Hemo A de la citocromo c oxidasa. Estructura y propiedades: comparaciones con los hemo B, C y S y derivados". J. Biol. Chem . 250 (19): 7602–22. doi : 10.1016/S0021-9258(19)40860-0 . PMID 170266.
- ^ Battersby AR (2000). "Tetrapirroles: los pigmentos de la vida". Natural Product Reports . 17 (6): 507–526. doi :10.1039/B002635M. PMID 11152419.
- ^ Sridevi K (28 de abril de 2018). Regulación positiva de la enzima ALA sintasa-1 de la vía del hemo por glutetimida y ácido 4,6-dioxoheptanoico y regulación negativa por glucosa y hemo: una disertación. EScholarship@UMMS (Tesis). Facultad de Medicina de la Universidad de Massachusetts. doi :10.13028/yyrz-qa79. Archivado desde el original el 8 de agosto de 2016 . Consultado el 28 de abril de 2018 .
- ^ ab Kumar S, Bandyopadhyay U (julio de 2005). "Toxicidad del hemo libre y sus sistemas de desintoxicación en humanos". Toxicology Letters . 157 (3): 175–188. doi :10.1016/j.toxlet.2005.03.004. PMID 15917143.
- ^ Puy H, Gouya L, Deybach JC (marzo de 2010). "Porfirias". The Lancet . 375 (9718): 924–937. doi :10.1016/S0140-6736(09)61925-5. PMID 20226990. S2CID 208791867.
- ^ Fraser RZ, Shitut M, Agrawal P, Mendes O, Klapholz S (11 de abril de 2018). "Evaluación de la seguridad de la preparación de proteína de leghemoglobina de soja derivada de Pichia pastoris, destinada a usarse como catalizador de sabor en carne de origen vegetal". Revista internacional de toxicología . 37 (3): 241–262. doi :10.1177/1091581818766318. ISSN 1091-5818. PMC 5956568 . PMID 29642729.
- ^ "Dentro de la extraña ciencia de la carne falsa que 'sangra'". Wired . 20 de septiembre de 2017. Archivado desde el original el 24 de marzo de 2018 . Consultado el 28 de abril de 2018 .
- ^ "Silicon Valley se aficiona a la comida". The Economist . 2015-03-05. ISSN 0013-0613 . Consultado el 2019-04-08 .
- ^ Maines MD (julio de 1988). "Heme oxygenase: function, multiplicity, regulatory mechanisms, and clinical applications" (Hemooxigenasa: función, multiplicidad, mecanismos reguladores y aplicaciones clínicas). The FASEB Journal . 2 (10): 2557–2568. doi : 10.1096/fasebj.2.10.3290025 . ISSN 0892-6638. PMID 3290025. S2CID 22652094.
- ^ Principios de bioquímica de Lehninger (5.ª ed.). Nueva York: WH Freeman and Company. 2008. pp. 876. ISBN 978-0-7167-7108-1.
- ^ Hanafy K (2013). "El monóxido de carbono y el cerebro: es hora de repensar el dogma". Curr. Pharm. Des . 19 (15): 2771–5. doi :10.2174/1381612811319150013. PMC 3672861. PMID 23092321 .
- ^ Abraham N, Kappas A (2008). "Aspectos farmacológicos y clínicos de la hemooxigenasa". Pharmacol. Rev . 60 (1): 79–127. doi :10.1124/pr.107.07104. PMID 18323402. S2CID 12792155.
- ^ Florczyk U, Jozkowicz A, Dulak J (enero-febrero de 2008). "Biliverdina reductasa: nuevas características de una enzima antigua y su posible importancia terapéutica". Pharmacological Reports . 60 (1): 38–48. PMC 5536200 . PMID 18276984.
- ^ King C, Rios G, Green M, Tephly T (2000). "UDP-Glucuronosyltransferases". Metabolismo farmacológico actual . 1 (2): 143–161. doi :10.2174/1389200003339171. PMID 11465080.
- ^ Hall B, Levy S, Dufault-Thompson K, Arp G, Zhong A, Ndjite GM, Weiss A, Braccia D, Jenkins C, Grant MR, Abeysinghe S, Yang Y, Jermain MD, Wu CH, Ma B (3 de enero de 2024). "BilR es una enzima microbiana intestinal que reduce la bilirrubina a urobilinógeno". Nature Microbiology . 9 (1): 173–184. doi : 10.1038/s41564-023-01549-x . ISSN 2058-5276. PMC 10769871 . PMID 38172624.
- ^ Helmenstine AM. "Los productos químicos responsables del color de la orina y las heces". ThoughtCo . Consultado el 24 de enero de 2020 .
- ^ Bunn HF, Jandl JH (septiembre de 1966). "Intercambio de hemo entre moléculas de hemoglobina". Proc. Natl. Sci. USA . 56 (3): 974–978. Bibcode :1966PNAS...56..974B. doi : 10.1073/pnas.56.3.974 . PMC 219955 . PMID 5230192.
- ^ Smith ML, Paul J, Ohlsson PI, Hjortsberg K, Paul KG (febrero de 1991). "Fisión de la proteína hemo en condiciones no desnaturalizantes". Proc. Natl. Sci. USA . 88 (3): 882–886. Bibcode :1991PNAS...88..882S. doi : 10.1073/pnas.88.3.882 . PMC 50918 . PMID 1846966.
- ^ Everse J, Hsia N (1197). "Las toxicidades de las hemoglobinas nativas y modificadas". Biología y medicina de radicales libres . 22 (6): 1075–1099. doi :10.1016/S0891-5849(96)00499-6. PMID 9034247.
- ^ Kumar S, Bandyopadhyay U (julio de 2005). "Toxicidad del hemo libre y sus sistemas de desintoxicación en humanos". Toxicology Letters . 157 (3): 175–188. doi :10.1016/j.toxlet.2005.03.004. PMID 15917143.
- ^ Pamplona A, Ferreira A, Balla J, Jeney V, Balla G, Epiphanio S, Chora A, Rodrigues CD, Gregoire IP, Cunha-Rodrigues M, Portugal S, Soares MP, Mota MM (junio de 2007). "La hemooxigenasa-1 y el monóxido de carbono suprimen la patogénesis de la malaria cerebral experimental". Medicina de la Naturaleza . 13 (6): 703–710. doi :10.1038/nm1586. PMID 17496899. S2CID 20675040.
- ^ Larsen R, Gozzelino R, Jeney V, Tokaji L, Bozza FA, Japiassú AM, Bonaparte D, Cavalcante MM, Chora A, Ferreira A, Marguti I, Cardoso S, Sepúlveda N, Smith A, Soares MP (2010). "Un papel central del hemo libre en la patogénesis de la sepsis grave". Medicina traslacional de la ciencia . 2 (51): 51ra71. doi :10.1126/scitranslmed.3001118. PMID 20881280. S2CID 423446.
- ^ Bastide NM, Pierre FH, Corpet DE (febrero de 2011). "Hierro hemo de la carne y riesgo de cáncer colorrectal: un metaanálisis y una revisión de los mecanismos implicados". Cancer Prevention Research (Filadelfia, Pensilvania) . 4 (2): 177–184. doi :10.1158/1940-6207.CAPR-10-0113. ISSN 1940-6215. PMID 21209396.
- ^ "Dieta, nutrición, actividad física y cáncer colorrectal". wcrf.org. Consultado el 12 de febrero de 2022.
- ^ Chang, Vicky C; Cotterchio, Michelle; Khoo, Edwin (2019). "Ingesta de hierro, estado de hierro corporal y riesgo de cáncer de mama: una revisión sistemática y metanálisis". BMC Cancer . 19 (1): 543. doi : 10.1186/s12885-019-5642-0 . PMC 6555759 . PMID 31170936.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Plewinska M, Thunell S, Holmberg L, Wetmur J, Desnick R (1991). "Porfiria deficiente en delta-aminolevulinato deshidratasa: identificación de las lesiones moleculares en un homocigoto severamente afectado". American Journal of Human Genetics . 49 (1): 167–174. PMC 1683193 . PMID 2063868.
- ^ Aurizi C, Lupia Palmieri G, Barbieri L, Macri A, Sorge F, Usai G, Biolcati G (febrero de 2009). "Cuatro nuevas mutaciones del gen de la coproporfirinógeno III oxidasa". Biología Celular y Molecular . 55 (1): 8–15. PMID 19267996.
- ^ Bustad HJ, Vorland M, Ronneseth E, Sandberg S, Martinez A, Toska K (8 de agosto de 2013). "Estabilidad conformacional y análisis de la actividad de dos mutantes de la hidroximetilbilano sintasa, K132N y V215E, con diferente asociación fenotípica con porfiria intermitente aguda". Bioscience Reports . 33 (4): 617–626. doi :10.1042/BSR20130045. PMC 3738108 . PMID 23815679.
- ^ Martinez di Montemuros F, Di Pierro E, Patti E, Tavazzi D, Danielli MG, Biolcati G, Rocchi E, Cappellini MD (diciembre de 2002). "Caracterización molecular de las porfirias en Italia: un diagrama de flujo de diagnóstico". Biología Celular y Molecular (Noisy-Le-Grand, Francia) . 48 (8): 867–876. ISSN 0145-5680. PMID 12699245.
- ^ Badenas C, To Figueras J, Phillips JD, Warby CA, Muñoz C, Herrero C (abril de 2009). "Identificación y caracterización de nuevas mutaciones del gen de la uroporfirinógeno descarboxilasa en una gran serie de pacientes y familiares de porfiria cutánea tardía". Clinical Genetics . 75 (4): 346–353. doi :10.1111/j.1399-0004.2009.01153.x. PMC 3804340 . PMID 19419417.