Trombosis venosa profunda
| Trombosis venosa profunda | |
|---|---|
| Otros nombres | Trombosis venosa profunda |
 | |
| TVP en la pierna derecha con hinchazón y enrojecimiento. | |
| Especialidad | Varios |
| Síntomas | Dolor, hinchazón , enrojecimiento, venas agrandadas en la extremidad afectada [1] |
| Complicaciones | Síndrome postrombótico , TEV recurrente [2] |
| Factores de riesgo | Cirugía reciente, edad avanzada, cáncer activo , obesidad , infección, enfermedades inflamatorias, síndrome antifosfolípido , antecedentes personales o familiares de TEV, lesiones, traumatismos, falta de movimiento, control hormonal de la natalidad , embarazo y período posterior al parto , factores genéticos [3] [4] |
| Método de diagnóstico | Ultrasonido [5] |
| Diagnóstico diferencial | Celulitis , quiste de Baker roto , hematoma , linfedema , insuficiencia venosa crónica , etc. |
| Prevención | Caminatas frecuentes, ejercicios para las pantorrillas, mantenimiento de un peso corporal saludable, anticoagulantes (diluyentes de la sangre), compresión neumática intermitente , medias de compresión graduada , aspirina [6] [7] |
| Tratamiento | Anticoagulación, trombólisis dirigida por catéter |
| Medicamento | Anticoagulantes orales directos , heparina de bajo peso molecular , fondaparinux , heparina no fraccionada , warfarina |
| Frecuencia | Entre 0,8 y 2,7 por 1000 personas por año, pero las poblaciones de China y Corea están por debajo de este rango [8] |
La trombosis venosa profunda ( TVP ) es un tipo de trombosis venosa que implica la formación de un coágulo de sangre en una vena profunda , más comúnmente en las piernas o la pelvis. [9] [a] Una minoría de TVP ocurren en los brazos. [11] Los síntomas pueden incluir dolor, hinchazón, enrojecimiento y venas agrandadas en el área afectada, pero algunas TVP no presentan síntomas. [1]
La preocupación más común que pone en riesgo la vida en el caso de la TVP es la posibilidad de que un coágulo se embolice (se desprenda de las venas), viaje como un émbolo a través del lado derecho del corazón y se aloje en una arteria pulmonar que suministra sangre a los pulmones . Esto se denomina embolia pulmonar (EP). La TVP y la EP comprenden la enfermedad cardiovascular denominada tromboembolia venosa (TEV). [2]
Aproximadamente dos tercios de los casos de TEV se manifiestan solo como TVP, y un tercio se manifiesta como EP con o sin TVP. [12] La complicación de TVP a largo plazo más frecuente es el síndrome postrombótico , que puede causar dolor, hinchazón, sensación de pesadez, picazón y, en casos graves, úlceras . [5] La TEV recurrente ocurre en aproximadamente el 30% de los casos en los diez años posteriores a una TEV inicial. [3]
El mecanismo detrás de la formación de TVP generalmente implica alguna combinación de disminución del flujo sanguíneo , mayor tendencia a coagularse , cambios en la pared de los vasos sanguíneos e inflamación. [13] Los factores de riesgo incluyen cirugía reciente, edad avanzada, cáncer activo , obesidad , infección, enfermedades inflamatorias, síndrome antifosfolípido , antecedentes personales y familiares de TEV, trauma, lesiones, falta de movimiento, control de la natalidad hormonal , embarazo y el período posterior al nacimiento . La TEV tiene un fuerte componente genético, que representa aproximadamente el 50 al 60% de la variabilidad en las tasas de TEV. [4] Los factores genéticos incluyen el tipo de sangre no O , deficiencias de antitrombina , proteína C y proteína S y las mutaciones del factor V Leiden y protrombina G20210A . En total, se han identificado docenas de factores de riesgo genéticos. [4] [14]
Las personas con sospecha de TVP pueden evaluarse utilizando una regla de predicción como la puntuación de Wells. También se puede utilizar una prueba de dímero D para ayudar a excluir el diagnóstico o para señalar la necesidad de realizar más pruebas. [5] El diagnóstico se confirma con mayor frecuencia mediante una ecografía de las venas sospechosas. [5] La TEV se vuelve mucho más común con la edad. La afección es rara en niños, pero se presenta en casi el 1 % de las personas ≥ 85 años anualmente. [3] Las personas asiáticas, asiático-americanas, nativas americanas e hispanas tienen un riesgo de TEV menor que los blancos o los negros. [4] [15] Las poblaciones de Asia tienen tasas de TEV de entre el 15 y el 20 % de lo que se observa en los países occidentales. [16]
El tratamiento estándar consiste en el uso de anticoagulantes . Entre los medicamentos más habituales se encuentran el rivaroxabán , el apixabán y la warfarina . Para comenzar el tratamiento con warfarina es necesario un anticoagulante no oral adicional, a menudo inyecciones de heparina . [17] [18] [19]
La prevención de la TEV en la población general incluye evitar la obesidad y mantener un estilo de vida activo. Las medidas preventivas después de una cirugía de bajo riesgo incluyen caminar temprano y con frecuencia. Las cirugías más riesgosas generalmente previenen la TEV con un anticoagulante o aspirina combinado con compresión neumática intermitente . [7]
Signos y síntomas

Los síntomas afectan clásicamente a una pierna y suelen desarrollarse en cuestión de horas o días, [20] aunque pueden aparecer de repente o en cuestión de semanas. [21] Las piernas son las afectadas principalmente, y entre el 4 y el 10 % de los casos de TVP se producen en los brazos. [11] A pesar de que los signos y síntomas son muy variables, [5] los síntomas típicos son dolor, hinchazón y enrojecimiento. Sin embargo, estos síntomas pueden no manifestarse en las extremidades inferiores de quienes no pueden caminar. [22] En quienes pueden caminar, la TVP puede reducir la capacidad para hacerlo. [23] El dolor puede describirse como punzante y puede empeorar con la carga de peso, lo que incita a uno a soportar más peso con la pierna no afectada. [21] [24]
Otros signos y síntomas incluyen dolor a la palpación, edema con fóvea ( ver imagen ), dilatación de las venas superficiales, calor, decoloración, una "sensación de tirón" e incluso cianosis (una decoloración azul o violácea) con fiebre. [5] [20] [21] La TVP también puede existir sin causar ningún síntoma. [22] Los signos y síntomas ayudan a determinar la probabilidad de TVP, pero no se utilizan solos para el diagnóstico. [19]
En ocasiones, la TVP puede causar síntomas en ambos brazos o ambas piernas, como en el caso de la TVP bilateral. [25] En raras ocasiones, un coágulo en la vena cava inferior puede provocar que ambas piernas se hinchen. [26] La trombosis venosa superficial , también conocida como tromboflebitis superficial , es la formación de un coágulo de sangre (trombo) en una vena cercana a la piel . Puede coexistir con la TVP y puede sentirse como un "cordón palpable". [20] La tromboflebitis migratoria ( síndrome de Trousseau) es un hallazgo observado en personas con cáncer de páncreas y está asociada con la TVP. [27]
Posibles complicaciones
Una embolia pulmonar (EP) ocurre cuando un coágulo de sangre de una vena profunda (TVP) se desprende de una vena ( emboliza ), viaja a través del lado derecho del corazón y se aloja como un émbolo en una arteria pulmonar que suministra sangre desoxigenada a los pulmones para oxigenación. [28] Se cree que hasta una cuarta parte de los casos de EP resultan en muerte súbita. [12] Cuando no es mortal, la EP puede causar síntomas como falta de aire o dolor en el pecho de aparición repentina , tos con sangre ( hemoptisis ) y desmayos ( síncope ). [29] [30] El dolor en el pecho puede ser pleurítico (empeorado por respiraciones profundas) [29] y puede variar según dónde se aloje el émbolo en los pulmones. Se estima que entre el 30 y el 50 % de las personas con EP tienen TVP detectable mediante ecografía de compresión . [30]
Una TVP rara y masiva que causa obstrucción significativa y decoloración (incluyendo cianosis) es la flegmasia cerulea dolens . [31] [32] Es potencialmente mortal, amenaza las extremidades y conlleva un riesgo de gangrena venosa . [33] La flegmasia cerulea dolens puede ocurrir en el brazo, pero afecta más comúnmente a la pierna. [34] [35] Si se encuentra en el contexto de un síndrome compartimental agudo , se justifica una fasciotomía urgente para proteger la extremidad. [36] El síndrome de la vena cava superior es una complicación rara de la TVP del brazo. [11]
Se cree que la TVP puede causar un accidente cerebrovascular en presencia de un defecto cardíaco . Esto se denomina embolia paradójica porque el coágulo viaja de manera anormal desde el circuito pulmonar al circuito sistémico mientras se encuentra dentro del corazón. Se cree que el defecto de un foramen oval permeable permite que los coágulos viajen a través del tabique interauricular desde la aurícula derecha hasta la aurícula izquierda. [37] [38]
- Una imagen de TC con flechas rojas que indican EP (gris) en las arterias pulmonares (blanco)
- Un caso de flegmasia cerúlea dolorosa en la pierna izquierda
- Representación de un foramen oval permeable
Diagnóstico diferencial
En la mayoría de los casos sospechosos, la TVP se descarta después de la evaluación. [39] La celulitis es un imitador frecuente de la TVP, con su tríada de dolor, hinchazón y enrojecimiento. [20] Los síntomas preocupantes de la TVP se deben con mayor frecuencia a otras causas, que incluyen celulitis, quiste de Baker roto , hematoma , linfedema e insuficiencia venosa crónica . [1] Otros diagnósticos diferenciales incluyen tumores, aneurismas venosos o arteriales , trastornos del tejido conectivo , [40] trombosis venosa superficial , trombosis de la vena muscular y venas varicosas . [41]
Clasificación
La TVP y la EP son las dos manifestaciones de la enfermedad cardiovascular, tromboembolia venosa (TEV). [2] La TEV puede ocurrir solo como TVP, TVP con EP o solo EP. [3] Aproximadamente dos tercios de la TEV se manifiesta solo como TVP, y un tercio se manifiesta como EP con o sin TVP. [12] La TEV, junto con la trombosis venosa superficial, son tipos comunes de trombosis venosa. [10]
La TVP se clasifica como aguda cuando los coágulos se están desarrollando o se han desarrollado recientemente, mientras que la TVP crónica persiste más de 28 días. [42] Las diferencias entre estos dos tipos de TVP se pueden ver con ecografía. [43] Un episodio de TEV después de uno inicial se clasifica como recurrente. [44] [45] La TVP bilateral se refiere a coágulos en ambas extremidades, mientras que unilateral significa que solo se ve afectada una sola extremidad. [46]
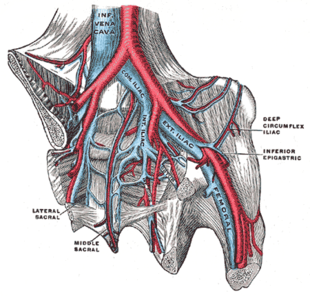
La TVP en una pierna por encima de la rodilla se denomina TVP proximal ( proximal ). La TVP en una pierna por debajo de la rodilla se denomina TVP distal ( distal ), también llamada TVP de pantorrilla cuando afecta a la pantorrilla, [47] [48] y tiene una importancia clínica limitada en comparación con la TVP proximal. [49] La TVP de pantorrilla representa aproximadamente la mitad de las TVP. [50] La TVP iliofemoral se describe como que afecta a la vena ilíaca o femoral común ; [51] en otros lugares, se ha definido como que afecta como mínimo a la vena ilíaca común , que está cerca de la parte superior de la pelvis. [19]
La TVP se puede clasificar en categorías provocadas y no provocadas. [52] Por ejemplo, la TVP que se presenta en asociación con cáncer o cirugía se puede clasificar como provocada. [52] Sin embargo, la Sociedad Europea de Cardiología en 2019 instó a abandonar esta dicotomía para fomentar evaluaciones de riesgo más personalizadas para la TEV recurrente. [53] La distinción entre estas categorías no siempre es clara. [54]
Causas
Tradicionalmente, los tres factores de la tríada de Virchow ( estasis venosa , hipercoagulabilidad y cambios en el revestimiento de los vasos sanguíneos endoteliales ) contribuyen a la TEV y se utilizaron para explicar su formación. [55] Más recientemente, se ha identificado que la inflamación desempeña un papel causal claro. [13] Otras causas relacionadas incluyen la activación de los componentes del sistema inmunológico , el estado de las micropartículas en la sangre, la concentración de oxígeno y la posible activación plaquetaria . [56] Varios factores de riesgo contribuyen a la TEV, incluidos los factores genéticos y ambientales, aunque muchos con múltiples factores de riesgo nunca la desarrollan. [57] [58]
Los factores de riesgo adquiridos incluyen el fuerte factor de riesgo de la edad avanzada, [5] que altera la composición de la sangre para favorecer la coagulación. [59] La TEV previa, particularmente la TEV no provocada, es un fuerte factor de riesgo. [60] Un coágulo remanente de una TVP previa aumenta el riesgo de una TVP posterior. [61] La cirugía mayor y el trauma aumentan el riesgo debido al factor tisular de fuera del sistema vascular que ingresa a la sangre. [62] Las lesiones menores, [63] la amputación de miembros inferiores, [64] la fractura de cadera y las fracturas de huesos largos también son riesgos. [9] En la cirugía ortopédica , la estasis venosa puede ser provocada temporalmente por un cese del flujo sanguíneo como parte del procedimiento. [56] La inactividad y la inmovilización contribuyen a la estasis venosa, como con los yesos ortopédicos , [65] la parálisis, estar sentado, los viajes de larga distancia, el reposo en cama, la hospitalización, [62] la catatonia , [66] y en los sobrevivientes de un accidente cerebrovascular agudo . [67] Las afecciones que implican un flujo sanguíneo comprometido en las venas son el síndrome de May-Thurner , donde se comprime una vena de la pelvis, y el síndrome del desfiladero torácico venoso , que incluye el síndrome de Paget-Schroetter , donde la compresión ocurre cerca de la base del cuello. [68] [69] [70]
Las infecciones, incluidas la sepsis , la COVID-19 , el VIH y la tuberculosis activa , aumentan el riesgo. [71] [72] [73] [74] [75] Las enfermedades inflamatorias crónicas y algunas enfermedades autoinmunes , [76] como la enfermedad inflamatoria intestinal , [77] la esclerosis sistémica , [78] el síndrome de Behçet , [79] el síndrome antifosfolípido primario , [80] y el lupus eritematoso sistémico (LES) [81] aumentan el riesgo. El LES en sí mismo se asocia con frecuencia con el síndrome antifosfolípido secundario. [82]
El cáncer puede crecer dentro y alrededor de las venas, causando estasis venosa, y también puede estimular niveles elevados de factor tisular. [83] Los cánceres de sangre, pulmón, páncreas, cerebro, estómago e intestino están asociados con un alto riesgo de TEV. [84] Los tumores sólidos como los adenocarcinomas pueden contribuir tanto a la TEV como a la coagulación intravascular diseminada . En casos graves, esto puede provocar coagulación y sangrado simultáneos. [85] El tratamiento de quimioterapia también aumenta el riesgo. [86] La obesidad aumenta el potencial de coagulación de la sangre, al igual que el embarazo. En el posparto , el desgarro placentario libera sustancias que favorecen la coagulación. Los anticonceptivos orales [b] y la terapia de reemplazo hormonal aumentan el riesgo a través de una variedad de mecanismos, incluidos los niveles alterados de proteína de coagulación sanguínea y la reducción de la fibrinólisis . [56]

Se han identificado docenas de factores de riesgo genéticos, [14] y representan aproximadamente el 50 al 60% de la variabilidad en las tasas de TEV. [4] Como tal, la historia familiar de TEV es un factor de riesgo para un primer TEV. [88] El factor V Leiden , que hace que el factor V sea resistente a la inactivación por la proteína C activada , [88] aumenta levemente el riesgo de TEV aproximadamente tres veces. [14] [88] Las deficiencias de tres proteínas que normalmente previenen la coagulación de la sangre ( proteína C , proteína S y antitrombina ) contribuyen a la TEV. Estas deficiencias en antitrombina , proteína C y proteína S [c] son raras pero fuertes, o moderadamente fuertes, factores de riesgo. [62] [56] Aumentan el riesgo aproximadamente 10 veces. [89] Tener un tipo de sangre diferente a O duplica aproximadamente el riesgo de TEV. [56] El tipo de sangre diferente a O es común a nivel mundial, lo que lo convierte en un factor de riesgo importante. [90] Las personas sin tipo de sangre O tienen niveles más altos de factor von Willebrand y factor VIII en sangre que aquellos con tipo de sangre O, lo que aumenta la probabilidad de coagulación. [90] Aquellos homocigotos para la variante común del gen del fibrinógeno gamma rs2066865 tienen un riesgo aproximadamente 1,6 veces mayor de TEV. [91] La variante genética protrombina G20210A , que aumenta los niveles de protrombina, [62] aumenta el riesgo aproximadamente 2,5 veces. [14] Además, aproximadamente el 5% de las personas han sido identificadas con un riesgo genético de fondo comparable a las mutaciones del factor V Leiden y protrombina G20210A. [14]
Las alteraciones sanguíneas, incluyendo disfibrinogenemia , [65] proteína S libre baja, [58] resistencia a la proteína C activada , [58] homocistinuria , [92] hiperhomocisteinemia , [62] niveles altos de fibrinógeno , [62] niveles altos de factor IX , [62] y niveles altos de factor XI [62] se asocian con un mayor riesgo. Otras afecciones asociadas incluyen trombocitopenia inducida por heparina , síndrome antifosfolípido catastrófico , [93] hemoglobinuria paroxística nocturna , [94] síndrome nefrótico , [58] enfermedad renal crónica , [95] policitemia vera , trombocitemia esencial , [96] uso de drogas intravenosas, [97] y tabaquismo. [d]
Algunos factores de riesgo influyen en la ubicación de la TVP en el cuerpo. En la TVP distal aislada, el perfil de factores de riesgo parece distinto al de la TVP proximal. Los factores transitorios, como la cirugía y la inmovilización, parecen predominar, mientras que las trombofilias [e] y la edad no parecen aumentar el riesgo. [101] Los factores de riesgo comunes para tener una TVP en la extremidad superior incluyen tener un cuerpo extraño existente (como un catéter venoso central, un marcapasos o una línea PICC de triple luz), cáncer y cirugía reciente. [11]
Fisiopatología

La sangre tiene una tendencia natural a coagularse cuando los vasos sanguíneos se dañan ( hemostasia ) para minimizar la pérdida de sangre. [102] La coagulación se activa mediante la cascada de coagulación y la eliminación de los coágulos que ya no son necesarios se logra mediante el proceso de fibrinólisis . Las reducciones en la fibrinólisis o los aumentos en la coagulación pueden aumentar el riesgo de TVP. [102]
La TVP a menudo se desarrolla en las venas de la pantorrilla y "crece" en la dirección del flujo venoso, hacia el corazón. [42] [103] La TVP afecta con mayor frecuencia las venas de la pierna o la pelvis [9], incluidas la vena poplítea (detrás de la rodilla), la vena femoral (del muslo) y las venas ilíacas de la pelvis. La TVP extensa de las extremidades inferiores puede incluso alcanzar la vena cava inferior (en el abdomen). [104] La TVP de las extremidades superiores afecta con mayor frecuencia las venas subclavia, axilar y yugular . [11]
El proceso de fibrinólisis, en el que los coágulos de TVP pueden disolverse nuevamente en la sangre, actúa para moderar el proceso de crecimiento del trombo. [105] Este es el proceso preferido. Aparte del proceso potencialmente mortal de embolización, un coágulo puede disolverse a través de la organización, lo que puede dañar las válvulas de las venas, causar fibrosis venosa y dar lugar a venas no distensibles. [106] [107] La organización de un trombo en la vena puede ocurrir en la tercera etapa de su desarrollo patológico , en la que el colágeno se convierte en el componente característico. La primera etapa patológica está marcada por los glóbulos rojos, y la segunda se caracteriza por la fibrina de textura media. [107]

En la trombosis arterial, se requiere daño a la pared del vaso sanguíneo, ya que inicia la coagulación , [108] pero la coagulación en las venas ocurre principalmente sin tal daño mecánico. [62] Se cree que el comienzo de la trombosis venosa surge de la "activación de células endoteliales, plaquetas y leucocitos, con inicio de inflamación y formación de micropartículas que activan el sistema de coagulación" a través del factor tisular. [77] La inflamación de la pared de la vena es probablemente el evento desencadenante. [77] Es importante destacar que el endotelio activado de las venas interactúa con los glóbulos blancos circulantes (leucocitos). [55] Si bien los leucocitos normalmente ayudan a prevenir la coagulación de la sangre (al igual que el endotelio normal), tras la estimulación, los leucocitos facilitan la coagulación. [109] Los neutrófilos se reclutan temprano en el proceso de formación de trombos venosos. [55] Liberan gránulos procoagulantes [109] y trampas extracelulares de neutrófilos (NET) o sus componentes, que desempeñan un papel en la formación de trombos venosos. [55] [110] Los componentes de NET son protrombóticos a través de las vías de coagulación intrínseca y extrínseca. [110] Las NET proporcionan "un andamiaje para la adhesión" de plaquetas, glóbulos rojos y múltiples factores que potencian la activación plaquetaria. [111] Además de las actividades procoagulantes de los neutrófilos, múltiples estímulos hacen que los monocitos liberen factor tisular. [109] Los monocitos también se reclutan temprano en el proceso. [55]
El factor tisular, a través del complejo factor tisular- factor VIIa , [112] activa la vía extrínseca de la coagulación y conduce a la conversión de protrombina en trombina, seguida de la deposición de fibrina. [86] Los coágulos venosos frescos son ricos en glóbulos rojos y fibrina . [42] Las plaquetas y los glóbulos blancos también son componentes. Las plaquetas no son tan prominentes en los coágulos venosos como lo son en los arteriales, pero pueden desempeñar un papel. [56] En el cáncer, el factor tisular es producido por células cancerosas. [84] El cáncer también produce sustancias únicas que estimulan el factor Xa , citocinas que promueven la disfunción endotelial y el inhibidor del activador del plasminógeno-1 , que inhibe la descomposición de los coágulos (fibrinólisis). [84]

A menudo, la TVP comienza en las válvulas de las venas. [105] El patrón de flujo sanguíneo en las válvulas puede causar bajas concentraciones de oxígeno en la sangre ( hipoxemia ) de un seno valvular. La hipoxemia, que empeora por la estasis venosa, activa vías, que incluyen el factor inducible por hipoxia-1 y la proteína 1 de respuesta al crecimiento temprano . La hipoxemia también da como resultado la producción de especies reactivas de oxígeno , que pueden activar estas vías, así como el factor nuclear-κB , que regula la transcripción del factor inducible por hipoxia-1 . [86] El factor inducible por hipoxia-1 y la proteína 1 de respuesta al crecimiento temprano contribuyen a la asociación de monocitos con proteínas endoteliales, como la P-selectina , lo que incita a los monocitos a liberar microvesículas llenas de factor tisular , que presumiblemente comienzan a coagularse después de unirse a la superficie endotelial. [86]
Los dímeros D son un producto de degradación de la fibrina , un subproducto natural de la fibrinólisis que se encuentra típicamente en la sangre. Un nivel elevado de [f] puede ser resultado de la disolución de un coágulo por parte de la plasmina , o de otras afecciones. [113] Los pacientes hospitalizados a menudo tienen niveles elevados por múltiples razones. [39] La anticoagulación , el tratamiento estándar para la TVP, previene un mayor crecimiento del coágulo y la EP, pero no actúa directamente sobre los coágulos existentes. [114]
Diagnóstico
Una evaluación de probabilidad clínica utilizando la puntuación de Wells (ver columna en la tabla a continuación) para determinar si una posible TVP es "probable" o "poco probable" es típicamente el primer paso del proceso de diagnóstico. La puntuación se utiliza en caso de sospecha de TVP de la primera extremidad inferior (sin ningún síntoma de EP) en atención primaria y en entornos ambulatorios, incluido el departamento de emergencias . [1] [5] El resultado numérico (puntuación posible de −2 a 9) se agrupa más comúnmente en categorías de "poco probable" o "probable". [1] [5] Una puntuación de Wells de dos o más significa que la TVP se considera "probable" (alrededor de un 28% de probabilidad), mientras que aquellos con una puntuación más baja se consideran "poco probables" de tener TVP (alrededor de un 6% de probabilidad). [39] En aquellos con poca probabilidad de tener TVP, un análisis de sangre de dímero D negativo excluye un diagnóstico. [1] En personas con TVP probable, la ecografía es la imagen estándar utilizada para confirmar o excluir un diagnóstico. [5] También se necesitan imágenes para pacientes hospitalizados con sospecha de TVP y aquellos inicialmente categorizados como poco probables de tener TVP pero que tienen una prueba de dímero D positiva. [1]
Si bien la escala de Wells es la regla de predicción clínica predominante y más estudiada para la TVP, [39] [115] tiene desventajas. La escala de Wells requiere una evaluación subjetiva con respecto a la probabilidad de un diagnóstico alternativo y funciona menos bien en los ancianos y aquellos con una TVP previa. La regla de atención primaria holandesa también ha sido validada para su uso. Contiene solo criterios objetivos pero requiere obtener un valor de dímero D. [116] Con esta regla de predicción, tres puntos o menos significa que una persona tiene un riesgo bajo de TVP. Un resultado de cuatro o más puntos indica que se necesita una ecografía. [116] En lugar de utilizar una regla de predicción, los médicos experimentados pueden hacer una evaluación de probabilidad de TVP previa a la prueba utilizando la evaluación clínica y la gestalt, pero las reglas de predicción son más confiables. [1]
| Criterios | Puntuación de Wells para TVP [g] | Normas holandesas sobre atención primaria |
|---|---|---|
| Cáncer activo (tratamiento en los últimos 6 meses o paliativo) | +1 punto | +1 punto |
| Hinchazón de la pantorrilla ≥ 3 cm en comparación con la pantorrilla asintomática (medida 10 cm por debajo de la tuberosidad tibial ) | +1 punto | +2 puntos |
| Venas superficiales unilaterales hinchadas (no varicosas, en pierna sintomática) | +1 punto | +1 punto |
| Edema unilateral con fóvea (en la pierna sintomática) | +1 punto | — |
| TVP documentada previamente | +1 punto | — |
| Hinchazón de toda la pierna | +1 punto | — |
| Dolor localizado a lo largo del sistema venoso profundo. | +1 punto | — |
| Parálisis, paresia o inmovilización reciente con yeso de las extremidades inferiores | +1 punto | — |
| Recientemente en cama ≥ 3 días, o cirugía mayor que requirió anestesia regional o general en las últimas 12 semanas | +1 punto | +1 punto |
| Diagnóstico alternativo al menos tan probable | -2 puntos | — |
| Dímero D positivo (≥ 0,5 mcg/ml o 1,7 nmol/l) | — | +6 puntos |
| Ausencia de traumatismo en las piernas | — | +1 punto |
| Sexo masculino | — | +1 punto |
| Uso de anticonceptivos orales | — | +1 punto [5] [116] |
La ecografía de compresión para la sospecha de trombosis venosa profunda es el método de diagnóstico estándar y es muy sensible para detectar una TVP inicial. [118] Una ecografía de compresión se considera positiva cuando las paredes de las venas normalmente comprimibles no colapsan bajo una presión suave. [39] A veces es posible visualizar el coágulo, pero no es necesaria. [119] Se pueden utilizar tres técnicas de exploración por ecografía de compresión, y dos de los tres métodos requieren una segunda ecografía algunos días después para descartar el diagnóstico. [118] La ecografía de toda la pierna es la opción que no requiere una ecografía repetida, [118] pero la ecografía de compresión proximal se utiliza con frecuencia porque la TVP distal rara vez es clínicamente significativa. [117] Se pueden utilizar métodos de ecografía, incluido el Doppler dúplex y el Doppler de flujo color, para caracterizar aún más el coágulo [117] y la ecografía Doppler es especialmente útil en las venas ilíacas no comprimibles. [119]
La venografía por tomografía computarizada , la venografía por resonancia magnética o una resonancia magnética sin contraste también son posibilidades diagnósticas. [120] El estándar de oro para evaluar los métodos de diagnóstico por imágenes es la venografía con contraste , que implica inyectar una vena periférica de la extremidad afectada con un agente de contraste y tomar radiografías para revelar si el suministro venoso ha sido obstruido. Debido a su costo, invasividad, disponibilidad y otras limitaciones, esta prueba rara vez se realiza. [39]
- Ecografía en la que se observa un coágulo de sangre en la vena femoral común izquierda (la vena femoral común se encuentra distal a la vena ilíaca externa).
- Ecografía Doppler que muestra ausencia de flujo y contenido hiperecogénico en una vena femoral coagulada (denominada subsartorial [h] ) distal al punto de ramificación de la vena femoral profunda . En comparación con este coágulo, los coágulos que obstruyen la vena femoral común (proximal a este punto de ramificación) causan efectos más graves debido a que afectan una porción significativamente más grande de la pierna. [122]
- Tomografía computarizada abdominal que muestra una TVP iliofemoral, con el coágulo en la vena ilíaca común derecha de la pelvis.
- Anatomía vascular para la ecografía en el punto de atención (POCUS) de la trombosis venosa profunda (TVP)
Gestión
El tratamiento de la TVP está justificado cuando los coágulos son proximales, distales y sintomáticos, o en las extremidades superiores y sintomáticos. [2] Proporcionar anticoagulación, o medicamentos anticoagulantes, es el tratamiento típico después de que se controle a los pacientes para asegurarse de que no estén sujetos a sangrado . [2] [i] Sin embargo, el tratamiento varía según la ubicación de la TVP. Por ejemplo, en casos de TVP distal aislada, se podría utilizar la vigilancia ecográfica (una segunda ecografía después de 2 semanas para verificar si hay coágulos proximales) en lugar de la anticoagulación. [5] [124] Sin embargo, aquellos con TVP distal aislada con un alto riesgo de recurrencia de TEV generalmente son anticoagulados como si tuvieran TVP proximal. Aquellos con un bajo riesgo de recurrencia pueden recibir un ciclo de anticoagulación de cuatro a seis semanas, dosis más bajas o ninguna anticoagulación en absoluto. [5] Por el contrario, aquellos con TVP proximal deben recibir al menos 3 meses de anticoagulación. [5]
Algunos anticoagulantes se pueden tomar por vía oral, y estos medicamentos orales incluyen warfarina (un antagonista de la vitamina K ), rivaroxabán (un inhibidor del factor Xa ), apixabán (un inhibidor del factor Xa), dabigatrán (un inhibidor directo de la trombina ) y edoxabán (un inhibidor del factor Xa). [2] Otros anticoagulantes no se pueden tomar por vía oral. Estos medicamentos parenterales (no orales) incluyen heparina de bajo peso molecular , fondaparinux y heparina no fraccionada . Algunos medicamentos orales son suficientes cuando se toman solos, mientras que otros requieren el uso de un anticoagulante parenteral adicional. Rivaroxabán y apixabán son los medicamentos típicos de primera línea y son suficientes cuando se toman por vía oral. [19] Rivaroxabán se toma una vez al día y apixabán se toma dos veces al día. [5] Warfarina, dabigatrán y edoxabán requieren el uso de un anticoagulante parenteral para iniciar la terapia anticoagulante oral. [19] [125] Cuando se inicia el tratamiento con warfarina para la TEV, se administra un mínimo de 5 días de un anticoagulante parenteral [j] junto con warfarina, seguido de una terapia con warfarina sola. [17] [18] La warfarina se toma para mantener un índice internacional normalizado (INR) [k] de 2,0 a 3,0, con 2,5 como objetivo. [128] El beneficio de tomar warfarina disminuye a medida que se extiende la duración del tratamiento, [129] y el riesgo de sangrado aumenta con la edad. [130] No es necesario el control periódico del INR cuando se utilizan anticoagulantes orales directos de primera línea. En general, la terapia anticoagulante es compleja y muchas circunstancias pueden afectar la forma en que se manejan estas terapias. [131]
La duración de la terapia anticoagulante (si durará de 4 a 6 semanas, [5] de 6 a 12 semanas, de 3 a 6 meses, [19] o indefinidamente) es un factor clave en la toma de decisiones clínicas . [52] Cuando la TVP proximal es provocada por cirugía o trauma, un ciclo de anticoagulación de 3 meses es estándar. [19] Cuando una primera TEV es una TVP proximal que no es provocada o está asociada con un factor de riesgo transitorio no quirúrgico, se puede utilizar una anticoagulación de dosis baja más allá de los 3 a 6 meses. [19] En aquellos con un riesgo anual de TEV superior al 9%, como después de un episodio no provocado, la anticoagulación prolongada es una posibilidad. [132] Aquellos que terminan el tratamiento con warfarina después de una TEV idiopática con un nivel elevado de dímero D muestran un mayor riesgo de TEV recurrente (alrededor del 9% frente a aproximadamente el 4% para los resultados normales), y este resultado podría usarse en la toma de decisiones clínicas. [133] Los resultados de las pruebas de trombofilia rara vez influyen en la duración del tratamiento. [80]
Se sugiere que el tratamiento de la TVP aguda en las piernas continúe en el hogar en caso de TVP sin complicaciones en lugar de la hospitalización. Los factores que favorecen la hospitalización incluyen síntomas graves o problemas médicos adicionales. [12] Se sugiere caminar temprano en lugar de reposo en cama. [134] Las medias de compresión graduadas, que aplican una presión más alta en los tobillos y una presión más baja alrededor de las rodillas [126], se pueden probar para el tratamiento sintomático de los síntomas de TVP aguda, pero no se recomiendan para reducir el riesgo de síndrome postrombótico , [125] ya que el beneficio potencial de usarlas para este objetivo "puede ser incierto". [5] Tampoco es probable que las medias de compresión reduzcan la recurrencia de la TVP. [135] Sin embargo, se recomiendan en aquellos con TVP distal aislada. [5]
Si alguien decide dejar de tomar anticoagulantes después de una TVP no provocada en lugar de tomarlos de por vida, se puede utilizar aspirina para reducir el riesgo de recurrencia, [136] pero su eficacia es solo un 33 % tan alta como la de los anticoagulantes para prevenir la TVP recurrente. [52] También se han investigado las estatinas por su potencial para reducir las tasas de TVP recurrente, y algunos estudios sugieren su eficacia. [137]
Investigaciones sobre el cáncer
Una TEV no provocada puede indicar la presencia de un cáncer desconocido, ya que es una afección subyacente en hasta el 10% de los casos no provocados. [1] Se necesita una evaluación clínica exhaustiva que debe incluir un examen físico , una revisión del historial médico y una detección universal del cáncer realizada en personas de esa edad. [19] [138] Se considera que vale la pena revisar las imágenes previas, así como "revisar los resultados de los análisis de sangre iniciales, incluido el hemograma completo , la función renal y hepática , el TP y el TTPA ". [138] No se recomienda obtener marcadores tumorales o una TC del abdomen y la pelvis en individuos asintomáticos. [1] NICE recomienda que no se justifiquen más investigaciones en aquellos sin signos o síntomas relevantes. [138]
Intervenciones
La trombólisis es la inyección de una enzima en las venas para disolver los coágulos de sangre, y aunque este tratamiento ha demostrado ser eficaz contra los coágulos de emergencia potencialmente mortales de los accidentes cerebrovasculares y los ataques cardíacos, los ensayos controlados aleatorios [139] [140] [141] no han establecido un beneficio neto en aquellos con TVP proximal aguda. [5] [142] Las desventajas de la trombólisis dirigida por catéter (el método preferido para administrar la enzima trombolítica [5] ) incluyen el riesgo de sangrado, la complejidad [l] y el costo del procedimiento. [125] Aunque, mientras que la anticoagulación es el tratamiento preferido para la TVP, [125] la trombólisis es una opción de tratamiento para aquellos con la forma grave de TVP de flegmasia cerula dorens ( imagen inferior izquierda ) y en algunos pacientes más jóvenes con TVP que afecta las venas ilíaca y femoral común. [12] Es de destacar que existe una variedad de contraindicaciones para la trombólisis . [125] En 2020, NICE mantuvo sus recomendaciones de 2012 de que se debe considerar la trombólisis dirigida por catéter en aquellos con TVP iliofemoral que tienen "síntomas que duran menos de 14 días, buen estado funcional, una expectativa de vida de 1 año o más y un bajo riesgo de sangrado". [138]
Un dispositivo de trombectomía mecánica puede eliminar los coágulos de TVP, en particular en la TVP iliofemoral aguda (TVP de las venas principales de la pelvis), pero hay datos limitados sobre su eficacia. Por lo general, se combina con trombólisis y, a veces, se colocan filtros temporales en la VCI para proteger contra la EP durante el procedimiento. [143] La trombólisis dirigida por catéter con trombectomía [141] contra la TVP iliofemoral se ha asociado con una reducción en la gravedad del síndrome postrombótico con una relación costo-efectividad estimada de aproximadamente $138 000 [m] por AVAC ganado . [144] [145] La flegmasia cerulea dolens podría tratarse con trombólisis dirigida por catéter y/o trombectomía. [19] [143]
En el caso de la TVP en el brazo, la primera costilla (la más alta) se puede extirpar quirúrgicamente como parte del tratamiento típico cuando la TVP se debe al síndrome del desfiladero torácico o al síndrome de Paget-Schroetter . Este tratamiento implica una anticoagulación inicial seguida de trombolisis de la vena subclavia y una resección por etapas de la primera costilla para aliviar la compresión del desfiladero torácico y prevenir la recurrencia de la TVP. [146]
- La primera costilla, que se extrae en una cirugía de resección de la primera costilla , está etiquetada como 1 en esta imagen.
- Venograma antes de la trombolisis dirigida por catéter para el síndrome de Paget-Schroetter , una TVP del brazo rara y grave que se muestra aquí en un practicante de judo, con un flujo sanguíneo altamente restringido en la vena.
- Después del tratamiento con trombolisis dirigida por catéter, el flujo sanguíneo en la vena axilar y subclavia mejoró significativamente. Posteriormente, una resección de la primera costilla permitió la descompresión. Esto reduce el riesgo de TVP recurrente y otras secuelas de la compresión del desfiladero torácico. [147]

La colocación de un filtro de vena cava inferior (filtro de VCI) es posible cuando el tratamiento estándar para la TVP aguda, la anticoagulación, está absolutamente contraindicado (no es posible), o si alguien desarrolla una EP a pesar de estar anticoagulado. [138] Sin embargo, una revisión NICE de 2020 encontró "poca evidencia buena" para su uso. [138] Un estudio de 2018 asoció la colocación de un filtro de VCI con una reducción del 50% en la EP, un aumento del 70% en la TVP y un aumento del 18% en la mortalidad a 30 días en comparación con la no colocación de VCI. [1] [148] Otros estudios, incluida una revisión sistemática y un metanálisis, no encontraron una diferencia en la mortalidad con la colocación de VCI. [30] Si alguien desarrolla una EP a pesar de estar anticoagulado, se debe tener cuidado para optimizar el tratamiento anticoagulante y abordar otras preocupaciones relacionadas antes de considerar la colocación de un filtro de VCI. [138]
Campo de la medicina
Los pacientes con antecedentes de TVP pueden ser tratados por atención primaria , medicina interna general , hematología , cardiología , cirugía vascular o medicina vascular . [149] Los pacientes con sospecha de TVP aguda a menudo son derivados al departamento de emergencias para evaluación. [150] La radiología intervencionista es la especialidad que generalmente coloca y recupera filtros de VCI, [151] y la cirugía vascular puede realizar trombosis dirigida por catéter para algunas TVP graves. [147]
Prevención
Para la prevención de coágulos sanguíneos en la población general, se recomienda incorporar ejercicios de piernas mientras se está sentado durante períodos prolongados o tomar descansos de una posición sentada y caminar, tener un estilo de vida activo y mantener un peso corporal saludable. [6] Caminar aumenta el flujo sanguíneo a través de las venas de las piernas. [152] El exceso de peso corporal es modificable a diferencia de la mayoría de los factores de riesgo, y las intervenciones o modificaciones del estilo de vida que ayudan a alguien con sobrepeso u obesidad a perder peso reducen el riesgo de TVP. [88] Se cree que evitar tanto fumar como una dieta de patrón occidental reduce el riesgo. [153] Las estatinas se han investigado para la prevención primaria (prevención de un primer TEV), y el ensayo JUPITER , que utilizó rosuvastatina , ha proporcionado alguna evidencia tentativa de efectividad. [14] [154] De las estatinas, la rosuvastatina parece ser la única con el potencial de reducir el riesgo de TEV. [155] Si es así, parece reducir el riesgo en aproximadamente un 15%. [153] Sin embargo, el número necesario a tratar para prevenir un TEV inicial es de aproximadamente 2000, lo que limita su aplicabilidad. [156]
Pacientes hospitalizados (no quirúrgicos)
Se recomienda que los pacientes hospitalizados con enfermedades agudas reciban un anticoagulante parenteral, aunque el beneficio neto potencial es incierto. [63] A los pacientes hospitalizados con enfermedades críticas se les recomienda que reciban heparina no fraccionada o heparina de bajo peso molecular en lugar de prescindir de estos medicamentos. [63]
Después de la cirugía

La cirugía ortopédica mayor ( reemplazo total de cadera , reemplazo total de rodilla o cirugía de fractura de cadera ) tiene un alto riesgo de causar TEV. [157] Si no se utiliza profilaxis después de estas cirugías, la TEV sintomática tiene alrededor de un 4 % de probabilidades de desarrollarse dentro de los 35 días. [158] Después de una cirugía ortopédica mayor, generalmente se combina un anticoagulante o aspirina con compresión neumática intermitente , que es la profilaxis mecánica preferida sobre las medias de compresión graduada. [7]
Las opciones para la prevención de la TEV en personas que se han sometido a una cirugía no ortopédica incluyen caminar temprano, profilaxis mecánica y anticoagulantes (heparina de bajo peso molecular y heparina no fraccionada en dosis bajas) según el riesgo de TEV, el riesgo de sangrado mayor y las preferencias de la persona. [159] Después de cirugías de bajo riesgo, caminar temprano y con frecuencia es la mejor medida preventiva. [7]
Embarazo
El riesgo de TEV aumenta durante el embarazo aproximadamente cuatro a cinco veces debido a un estado de mayor hipercoagulabilidad que protege contra la hemorragia posparto fatal . [28] La Sociedad Estadounidense de Hematología sugirió medidas preventivas para la TEV relacionada con el embarazo en 2018. [160] La warfarina, un antagonista común de la vitamina K, puede causar defectos de nacimiento y no se usa para la prevención durante el embarazo. [161]
Viajeros
.jpg/440px-Stuetzstrumpf_04_(fcm).jpg)
Viajar es una causa de TEV que se cita con frecuencia, pero que es relativamente poco común. [28] Las sugerencias para los viajeros de larga distancia con riesgo [n] incluyen ejercicios de pantorrilla, caminatas frecuentes y asientos en el pasillo en los aviones para facilitar la marcha. [162] [163] Las medias de compresión graduada han reducido drásticamente los niveles de TVP asintomática en pasajeros de aerolíneas, pero se desconoce el efecto sobre la TVP sintomática, la EP o la mortalidad, ya que ninguna de las personas estudiadas desarrolló estos resultados. [164] Sin embargo, no se recomiendan las medias de compresión graduada para los viajeros de larga distancia (>4 horas) sin factores de riesgo de TEV. Asimismo, no se recomiendan aspirina ni anticoagulantes en la población general que realiza viajes de larga distancia. [63] Se recomienda que las personas con factores de riesgo significativos de TEV [o] que realicen viajes de larga distancia utilicen medias de compresión graduada o HBPM para la prevención de la TEV. Si ninguno de estos dos métodos es factible, se sugiere aspirina. [63]
Pronóstico
La TVP es una enfermedad que se presenta con mayor frecuencia en personas mayores y que se presenta en hogares de ancianos, hospitales y cáncer activo. [3] Se asocia con una tasa de mortalidad a los 30 días de aproximadamente el 6%, siendo la EP la causa de la mayoría de estas muertes. [1] La TVP proximal se asocia con frecuencia con EP, a diferencia de la TVP distal, que rara vez se asocia con EP. [39] Alrededor del 56% de las personas con TVP proximal también tienen EP, aunque no es necesario realizar una TC de tórax simplemente por la presencia de TVP. [1] Si la TVP proximal no se trata, en los siguientes 3 meses aproximadamente la mitad de las personas experimentarán EP sintomática. [9]
Otra complicación frecuente de la TVP proximal, y la complicación crónica más frecuente, es el síndrome postrombótico, en el que los individuos presentan síntomas venosos crónicos. [5] Los síntomas pueden incluir dolor, picazón, hinchazón, parestesia , sensación de pesadez y, en casos graves, úlceras en las piernas . [5] Después de la TVP proximal, se estima que entre el 20 y el 50 % de las personas desarrollan el síndrome, y entre el 5 y el 10 % experimentan síntomas graves. [165] El síndrome postrombótico también puede ser una complicación de la TVP distal, aunque en menor medida que con la TVP proximal. [166]
En los 10 años posteriores a una TVP inicial, aproximadamente el 30% de las personas tendrán una recurrencia. [3] La recurrencia de la TVP en aquellos con TVP previa tiene más probabilidades de recurrir como TVP que como EP. [167] El cáncer [5] y la TVP no provocada son factores de riesgo importantes para la recurrencia. [60] Después de una TVP proximal inicial no provocada con y sin EP, el 16-17% de las personas tendrán una TEV recurrente en los 2 años posteriores a que completen su ciclo de anticoagulantes. La recurrencia de la TEV es menos común en la TVP distal que en la TVP proximal. [44] [45] En la TVP de las extremidades superiores, la recurrencia anual de la TEV es de aproximadamente el 2-4%. [130] Después de la cirugía, una TVP proximal provocada o una EP tiene una tasa de recurrencia anual de solo el 0,7%. [60]
Epidemiología
En los países de altos ingresos, aproximadamente 1,5 de cada 1000 adultos al año tienen una primera TEV. [168] [169] La afección se vuelve mucho más común con la edad. [3] La TEV rara vez ocurre en niños, pero cuando lo hace, afecta predominantemente a niños hospitalizados. [170] Los niños en América del Norte y los Países Bajos tienen tasas de TEV que varían de 0,07 a 0,49 de cada 10 000 niños al año. [170] Mientras tanto, casi el 1 % de las personas de 85 años o más experimentan TEV cada año. [3] Aproximadamente el 60 % de todas las TEV ocurren en personas de 70 años o más. [9] La incidencia es aproximadamente un 18 % mayor en hombres que en mujeres, [4] aunque hay edades en las que la TEV es más frecuente en mujeres. [15] La TEV se presenta en asociación con hospitalización o residencia en un hogar de ancianos aproximadamente el 60% de las veces, cáncer activo aproximadamente el 20% de las veces y un catéter venoso central o un marcapasos transvenoso aproximadamente el 9% de las veces. [3]
Durante el embarazo y después del parto, la TEV aguda ocurre en aproximadamente 1,2 de 1000 partos. A pesar de ser relativamente rara, es una de las principales causas de morbilidad y mortalidad materna . [160] Después de la cirugía con tratamiento preventivo, la TEV se desarrolla en aproximadamente 10 de 1000 personas después del reemplazo total o parcial de rodilla, y en aproximadamente 5 de 1000 después del reemplazo total o parcial de cadera. [171] Aproximadamente 400 000 estadounidenses desarrollan una TEV inicial cada año, con 100 000 muertes o más atribuibles a la EP. [169] Las personas asiáticas, asiático-americanas, nativas americanas e hispanas tienen un riesgo de TEV menor que los blancos o los negros. [4] [15] Las poblaciones de Asia tienen tasas de TEV del 15 al 20 % de lo que se ve en los países occidentales, con un aumento en la incidencia observado con el tiempo. [16] En las poblaciones de América del Norte y Europa, alrededor del 4-8% de las personas tienen una trombofilia, [89] más comúnmente el factor V de Leiden y la protrombina G20210A. En las poblaciones de China, Japón y Tailandia, predominan las deficiencias de proteína S, proteína C y antitrombina. [172] El tipo de sangre no O está presente en alrededor del 50% de la población general y varía con la etnia , y está presente en aproximadamente el 70% de las personas con TEV. [90] [173]
La TVP se presenta en las extremidades superiores en aproximadamente el 4-10% de los casos, [11] con una incidencia de 0,4-1,0 personas por cada 10.000 al año. [5] Una minoría de las TVP de las extremidades superiores se deben al síndrome de Paget-Schroetter, también llamado trombosis de esfuerzo, que se presenta en 1-2 personas por cada 100.000 al año, generalmente en varones atléticos de alrededor de 30 años de edad o en aquellos que realizan una cantidad significativa de trabajo manual por encima de la cabeza. [69] [147]
Social

Tomar anticoagulantes debido a una TVP puede cambiar la vida de las personas, ya que puede impedir que realicen actividades de su estilo de vida, como deportes de contacto o de invierno, para evitar hemorragias después de posibles lesiones. [175] Las lesiones en la cabeza que provocan hemorragias cerebrales son motivo de especial preocupación. Esto ha provocado que el piloto de NASCAR Brian Vickers haya renunciado a participar en carreras. Los jugadores profesionales de baloncesto, incluidos los jugadores de la NBA Chris Bosh y el miembro del Salón de la Fama Hakeem Olajuwon, han tenido que lidiar con coágulos sanguíneos recurrentes, [176] y la carrera de Bosh se vio significativamente obstaculizada por la TVP y la EP. [177]
La estrella del tenis Serena Williams fue hospitalizada en 2011 por EP que se cree que se originó a partir de TVP. [178] Años después, en 2017, debido a su conocimiento de TVP y EP, Serena abogó con precisión por que se le diagnosticara y tratara una EP. Durante este encuentro con TEV, fue hospitalizada después de una cirugía de cesárea y dejó de tomar anticoagulantes. Después de sentir la aparición repentina de un síntoma de EP, dificultad para respirar, se lo dijo a su enfermera y solicitó una tomografía computarizada y un goteo intravenoso de heparina, todo mientras jadeaba en busca de aire. Comenzó a recibir una ecografía para buscar TVP en las piernas, lo que la llevó a expresar su insatisfacción al personal médico porque no estaban buscando coágulos donde tenía síntomas (sus pulmones), y aún no estaban tratando su presunta EP. Después de que le diagnosticaran EP y no TVP, y después de recibir heparina por vía intravenosa, la tos por la EP hizo que se abriera el sitio quirúrgico de la cesárea y la heparina contribuyó al sangrado en el sitio. Posteriormente, Serena recibió un filtro de VCI mientras estaba en el hospital. [174] [179]
Otras personas notables se han visto afectadas por TVP. El expresidente de los Estados Unidos Richard Nixon tuvo TVP recurrente, [180] y también la exsecretaria de Estado Hillary Clinton . Fue diagnosticada por primera vez mientras era primera dama en 1998 y nuevamente en 2009. [181] A Dick Cheney le diagnosticaron un episodio mientras era vicepresidente , [182] y el presentador de programas de televisión Regis Philbin tuvo TVP después de una cirugía de reemplazo de cadera. [183] La TVP también ha contribuido a las muertes de personas famosas. Por ejemplo, la TVP y la EP jugaron un papel en la muerte del rapero Heavy D a los 44 años. [184] El periodista de la NBC David Bloom murió a los 39 años mientras cubría la guerra de Irak a causa de una EP que se pensó que había progresado a partir de una TVP no detectada, [185] y el actor Jimmy Stewart tuvo TVP que progresó a una EP cuando tenía 89 años. [183] [186]
Historia

El libro Sushruta Samhita , un texto ayurvédico publicado alrededor del 600-900 a. C., contiene lo que se ha citado como la primera descripción de TVP. [187] En 1271, los síntomas de TVP en la pierna de un hombre de 20 años se describieron en un manuscrito francés, que se ha citado como el primer caso o la primera referencia occidental a la TVP. [187] [188]
En 1856, el médico y patólogo alemán Rudolf Virchow publicó su análisis tras la inserción de cuerpos extraños en las venas yugulares de perros, que migraron a las arterias pulmonares. Estos cuerpos extraños causaron embolias pulmonares, y Virchow se centró en explicar sus consecuencias. [189] Citó tres factores, que ahora se entienden como hipercoagulabilidad, estasis y lesión endotelial. [190] No fue hasta 1950 que este marco se citó como la tríada de Virchow, [189] pero la enseñanza de la tríada de Virchow ha continuado a la luz de su utilidad como marco teórico y como reconocimiento del progreso significativo que Virchow hizo en la expansión de la comprensión de la TEV. [189] [190]
Los métodos para observar la TVP mediante ecografía se establecieron en la década de 1960. [120] Los diagnósticos se realizaban comúnmente mediante pletismografía de impedancia en las décadas de 1970 y 1980, [191] pero la ecografía, particularmente después de que se demostró la utilidad de la compresión de la sonda en 1986, se convirtió en el método de diagnóstico preferido. [187] Sin embargo, a mediados de la década de 1990, la venografía de contraste y la pletismografía de impedancia todavía se describían como comunes. [192]

En el siglo XX se introdujeron múltiples terapias farmacológicas para la TVP: anticoagulantes orales en la década de 1940, inyecciones subcutáneas de LDUH en 1962 e inyecciones subcutáneas de LMWH en 1982. [193] En 1974 se propuso por primera vez que la inflamación vascular y la trombosis venosa estaban relacionadas entre sí. [112] Durante unos 50 años, un régimen de warfarina (Coumadin) de meses de duración fue el pilar del tratamiento farmacológico. [194] [195] Para evitar el control de la sangre requerido con la warfarina y las inyecciones requeridas por la heparina y los medicamentos similares a la heparina, se desarrollaron los anticoagulantes orales directos (DOAC). [195] A finales de la década de 2000 y principios de la de 2010, los DOAC, incluidos rivaroxabán (Xarelto), apixabán (Eliquis) y dabigatrán (Pradaxa), llegaron al mercado. [60] El New York Times describió una "batalla furiosa" entre los tres fabricantes de estos medicamentos "por los recetarios de los médicos". [194]
Ciencias económicas
La TVP le cuesta al sistema de salud de los EE. UU. entre 7 y 10 mil millones de dólares al año. [169] Los costos iniciales y promedio de TVP para un paciente estadounidense hospitalizado son de aproximadamente 10 000 dólares (estimación de 2015). [196] En Europa, los costos de una hospitalización inicial por TVP son significativamente menores, y cuestan alrededor de 2000 a 4000 euros (estimación de 2011). [197] El síndrome postrombótico es un contribuyente significativo a los costos de seguimiento de la TVP. [198] El tratamiento ambulatorio reduce significativamente los costos, y los costos del tratamiento para la EP superan los de la TVP. [199]
Direcciones de investigación
Un estudio de 2019 publicado en Nature Genetics informó que los loci genéticos conocidos asociados con la TEV se duplicaron. [14] En sus pautas de práctica clínica actualizadas de 2018, la Sociedad Estadounidense de Hematología identificó 29 prioridades de investigación separadas, la mayoría de las cuales se relacionaban con pacientes con enfermedades agudas o críticas. [63] La inhibición del factor XI , la P-selectina , la E-selectina y una reducción en la formación de trampas extracelulares de neutrófilos son terapias potenciales que podrían tratar la TEV sin aumentar el riesgo de sangrado. [200]
Notas
- ^ La trombosis venosa asociada con el drenaje del cerebro ( trombosis del seno venoso cerebral ), los ojos ( trombosis de la vena retiniana ), el bazo y los intestinos (trombosis de la vena esplácnica), el hígado ( síndrome de Budd-Chiari ), los riñones ( trombosis de la vena renal ) y los ovarios (trombosis de la vena ovárica) son formas más inusuales de trombosis venosa y se consideran enfermedades separadas. [10]
- ^ Los anticonceptivos orales combinados (AOC) de tercera generación tienen un riesgo aproximadamente dos a tres veces mayor que los AOC de segunda generación. [64] El uso de píldoras que contienen solo progestágeno no está asociado con un mayor riesgo de TEV. [87]
- ^ Tipo I [58]
- ^ "Es importante señalar que fumar no es un factor de riesgo independiente, aunque aumenta el riesgo de cáncer y otras comorbilidades y funciona sinérgicamente con otros factores de riesgo independientes". [98]
- ^ El término "trombofilia" tal como se utiliza aquí se aplica a las cinco anomalías hereditarias de antitrombina, proteína C, proteína S, factor V y protrombina, como se hace en otros lugares. [89] [99] Estos 5 factores genéticos se han denominado trombofilias clásicas. [100]
- ^ Un nivel elevado es mayor que 250 ng /mL de unidades de dímero D (UDD) o mayor que 0,5 μg /mL de unidades equivalentes de fibrinógeno (UEF). Un nivel normal es menor que estos valores. [113]
- ^ La puntuación de Wells que se muestra aquí es la puntuación modificada más reciente, que agregó un criterio para una TVP documentada previamente y aumentó el rango de tiempo después de la cirugía de 4 a 12 semanas. [117]
- ^ Subsartorial es un nombre propuesto para una sección de la vena femoral. [121]
- ^ La evidencia sobre la anticoagulación proviene de estudios distintos a los ensayos controlados aleatorios definitivos que demuestran la eficacia y seguridad de la anticoagulación frente a placebo o el uso de AINE . [123]
- ^ La razón internacional normalizada debe ser ≥ 2,0 durante un mínimo de 24 horas, [18] pero si la razón es > 3,0, entonces no es necesario el anticoagulante parenteral durante cinco días. [126]
- ^ El INR se determina a partir de la relación entre el tiempo de protrombina (TP) de un paciente y un TP de control estandarizado. El INR normal para quienes no reciben anticoagulación es 1,0. Un valor de 5,0 o superior se considera un hallazgo crítico debido al aumento del riesgo de sangrado. [127]
- ^ "Hasta el 83% de los pacientes tratados con cualquier terapia basada en catéter necesitan angioplastia complementaria y colocación de stents". [5]
- ^ Estimado en dólares estadounidenses, estimación publicada en 2019
- ^ Incluidos aquellos con "TEV previo, cirugía o traumatismo reciente, neoplasia maligna activa, embarazo, uso de estrógenos, edad avanzada, movilidad limitada, obesidad grave o trastorno trombofílico conocido" [162]
- ^ Por ejemplo, “cirugía reciente, antecedentes de TEV, mujeres en posparto, neoplasia maligna activa o ≥2 factores de riesgo, incluidas combinaciones de los anteriores con terapia de reemplazo hormonal, obesidad o embarazo” [63]
Referencias
- ^ abcdefghijklm Kruger PC, Eikelboom JW, Douketis JD, Hankey GJ (junio de 2019). "Trombosis venosa profunda: actualización sobre diagnóstico y tratamiento". The Medical Journal of Australia . 210 (11): 516–24. doi :10.5694/mja2.50201. PMID 31155730. S2CID 173995098.
- ^ abcdef Bartholomew JR (diciembre de 2017). "Actualización sobre el tratamiento de la tromboembolia venosa" . Cleveland Clinic Journal of Medicine . 84 (12 Suppl 3): 39–46. doi : 10.3949/ccjm.84.s3.04 . PMID 29257737. S2CID 3707226.
- ^ abcdefghi Heit JA, Spencer FA, White RH (enero de 2016). "La epidemiología de la tromboembolia venosa". Revista de trombosis y trombólisis . 41 (1): 3–14. doi :10.1007/s11239-015-1311-6. PMC 4715842 . PMID 26780736.
- ^ abcdefg Crous-Bou M, Harrington LB, Kabrhel C (noviembre de 2016). "Factores de riesgo ambientales y genéticos asociados con la tromboembolia venosa". Seminarios sobre trombosis y hemostasia . 42 (8): 808–20. doi : 10.1055/s-0036-1592333. PMC 5146955. PMID 27764878.
- ^ abcdefghijklmnopqrstu vwxy Mazzolai L, Aboyans V, Ageno W, Agnelli G, Alatri A, Bauersachs R, et al. (diciembre de 2018). "Diagnóstico y tratamiento de la trombosis venosa profunda aguda: un documento de consenso conjunto de los grupos de trabajo de la Sociedad Europea de Cardiología sobre enfermedades vasculares periféricas y de la aorta y circulación pulmonar y función ventricular derecha". Revista Europea del Corazón . 39 (47): 4208–18. doi : 10.1093/eurheartj/ehx003 . PMID 28329262.
- ^ ab "¿Qué es la tromboembolia venosa?". Centros para el Control y la Prevención de Enfermedades . 14 de marzo de 2019. Consultado el 6 de enero de 2020 .
- ^ abcd Anderson DR, Morgano GP, Bennett C, Dentali F, Francis CW, Garcia DA, et al. (diciembre de 2019). "Pautas de 2019 de la Sociedad Estadounidense de Hematología para el tratamiento de la tromboembolia venosa: prevención de la tromboembolia venosa en pacientes hospitalizados por cirugía". Blood Advances . 3 (23): 3898–944. doi :10.1182/bloodadvances.2019000975. PMC 6963238 . PMID 31794602.
- ^ Raskob GE, Angchaisuksiri P, Blanco AN, Buller H, Gallus A, Hunt BJ, et al. (noviembre de 2014). "Trombosis: un importante contribuyente a la carga mundial de enfermedad". Arteriosclerosis, trombosis y biología vascular . 34 (11): 2363–71. doi : 10.1161/ATVBAHA.114.304488 . PMID 25304324.
- ^ abcde Phillippe HM (diciembre de 2017). «Descripción general del tromboembolismo venoso». The American Journal of Managed Care . 23 (20 Suppl): S376–82. PMID 29297660. Archivado desde el original el 30 de enero de 2020 . Consultado el 30 de enero de 2020 .
- ^ ab Abbattista M, Capecchi M, Martinelli I (enero de 2020). "Tratamiento de manifestaciones trombóticas inusuales". Sangre . 135 (5): 326–34. doi : 10.1182/blood.2019000918 . PMID 31917405.
- ^ abcdefg Heil J, Miesbach W, Vogl T, Bechstein WO, Reinisch A (abril de 2017). "Trombosis venosa profunda de la extremidad superior". Deutsches Ärzteblatt Internacional . 114 (14): 244–49. doi :10.3238/arztebl.2017.0244. PMC 5415909 . PMID 28446351.
- ^ abcde Ortel TL, Neumann I, Ageno W, Beyth R, Clark NP, Cuker A, et al. (octubre de 2020). "Pautas de 2020 de la Sociedad Estadounidense de Hematología para el tratamiento de la tromboembolia venosa: tratamiento de la trombosis venosa profunda y la embolia pulmonar". Blood Advances . 4 (19): 4693–738. doi :10.1182/bloodadvances.2020001830. PMC 7556153 . PMID 33007077.
- ^ ab Borgel D, Bianchini E, Lasne D, Pascreau T, Saller F (diciembre de 2019). "Inflamación en la trombosis venosa profunda: ¿un objetivo terapéutico?". Hematología . 24 (1): 742–50. doi : 10.1080/16078454.2019.1687144 . PMID 31736432.
- ^ abcdefg Klarin D, Busenkell E, Judy R, Lynch J, Levin M, Haessler J, et al. (noviembre de 2019). "El análisis de asociación de todo el genoma de la tromboembolia venosa identifica nuevos loci de riesgo y superposición genética con la enfermedad vascular arterial". Nature Genetics . 51 (11): 1574–79. doi :10.1038/s41588-019-0519-3. PMC 6858581 . PMID 31676865.
- ^ abc Wendelboe AM, Raskob GE (abril de 2016). "Carga mundial de trombosis: aspectos epidemiológicos". Circulation Research . 118 (9): 1340–47. doi : 10.1161/CIRCRESAHA.115.306841 . PMID 27126645.
- ^ ab Lee LH, Gallus A, Jindal R, Wang C, Wu CC (diciembre de 2017). "Incidencia de tromboembolia venosa en poblaciones asiáticas: una revisión sistemática". Trombosis y hemostasia . 117 (12): 2243–60. doi : 10.1160/TH17-02-0134 . PMID 29212112.
- ^ ab Keeling D, Alikhan R (junio de 2013). "Manejo de la tromboembolia venosa: controversias y futuro". British Journal of Haematology . 161 (6): 755–63. doi : 10.1111/bjh.12306 . PMID 23531017.
- ^ abc Guyatt y otros. 2012, pág. 20S: 2.4.
- ^ abcdefghij Tran HA, Gibbs H, Merriman E, Curnow JL, Young L, Bennett A, et al. (marzo de 2019). "Nuevas directrices de la Sociedad de Trombosis y Hemostasia de Australia y Nueva Zelanda para el diagnóstico y el tratamiento de la tromboembolia venosa". The Medical Journal of Australia . 210 (5): 227–35. doi :10.5694/mja2.50004. hdl : 11343/285435 . PMID 30739331. S2CID 73433650.
- ^ abcd Ratchford EV, Evans NS (marzo de 2017). "Abordaje del edema de las extremidades inferiores". Opciones actuales de tratamiento en medicina cardiovascular . 19 (3): 16. doi :10.1007/s11936-017-0518-6. PMID 28290004. S2CID 34922038.
- ^ abc Moll S (marzo de 2008). "Una perspectiva clínica del tromboembolismo venoso". Arteriosclerosis, trombosis y biología vascular . 28 (3): 373–79. doi : 10.1161/ATVBAHA.108.162818 . PMID: 18296592.
- ^ ab Lloyd NS, Douketis JD, Moinuddin I, Lim W, Crowther MA (marzo de 2008). "Profilaxis anticoagulante para prevenir la trombosis venosa profunda asintomática en pacientes médicos hospitalizados: una revisión sistemática y un metanálisis". Journal of Thrombosis and Haemostasis . 6 (3): 405–14. doi : 10.1111/j.1538-7836.2007.02847.x . PMID 18031292.
- ^ Conklin P, Soares GM, Dubel GJ, Ahn SH, Murphy TP (diciembre de 2009). "Trombosis venosa profunda aguda (TVP): evolución de las estrategias de tratamiento y terapia endovascular" (PDF) . Medicina y salud, Rhode Island . 92 (12): 394–97. PMID 20066826. Archivado (PDF) desde el original el 6 de febrero de 2013.
- ^ Stubbs MJ, Mouyis M, Thomas M (febrero de 2018). "Trombosis venosa profunda". BMJ . 360 (8142): k351. doi :10.1136/bmj.k351. PMID 29472180. S2CID 3454404.
- ^ Casella IB, Bosch MA, Sabbag CR (2009). "Incidencia y factores de riesgo de trombosis venosa profunda bilateral de miembros inferiores". Angiología . 60 (1): 99–103. doi :10.1177/0003319708316897. PMID 18504268. S2CID 30043830.
- ^ Kennedy D, Setnik G, Li J (noviembre de 2001). "Hallazgos del examen físico en la trombosis venosa profunda". Emergency Medicine Clinics of North America . 19 (4): 869–76. doi :10.1016/s0733-8627(05)70223-6. PMID 11762276.
- ^ Campello E, Ilich A, Simioni P, Key NS (agosto de 2019). "La relación entre el cáncer de páncreas y la hipercoagulabilidad: una revisión exhaustiva sobre cuestiones epidemiológicas y biológicas". British Journal of Cancer . 121 (5): 359–71. doi :10.1038/s41416-019-0510-x. PMC 6738049 . PMID 31327867.
- ^ abc Turetz M, Sideris AT, Friedman OA, Triphathi N, Horowitz JM (junio de 2018). "Epidemiología, fisiopatología e historia natural de la embolia pulmonar". Seminarios en radiología intervencionista . 35 (2): 92–98. doi :10.1055/s-0038-1642036. PMC 5986574. PMID 29872243 .
- ^ ab Doherty S (noviembre de 2017). "Embolia pulmonar: una actualización". Australian Family Physician . 46 (11): 816–20. PMID 29101916.
- ^ abc Konstantinides SV, Meyer G, Becattini C, Bueno H, Geersing GJ, Harjola VP, et al. (enero de 2020). "Guías ESC 2019 para el diagnóstico y el tratamiento de la embolia pulmonar aguda desarrolladas en colaboración con la Sociedad Respiratoria Europea (ERS)". Revista Europea del Corazón . 41 (4): 543–603. doi : 10.1093/eurheartj/ehz405 . PMID 31504429.
- ^ Chinsakchai K, Ten Duis K, Moll FL, de Borst GJ (enero de 2011). "Tendencias en el tratamiento de la flegmasia cerulea dolens". Cirugía vascular y endovascular . 45 (1): 5–14. doi :10.1177/1538574410388309. PMID 21193462. S2CID 64951.
- ^ Turner DPB (noviembre de 1952). "Un caso de flegmasia cerulea dolens". British Medical Journal . 2 (4795): 1183–85. doi :10.1136/bmj.2.4795.1183. PMC 2021962 . PMID 12997687.
- ^ Aggarwal DG, Bhojraj SS, Behrainwalla AA, Jani CK, Mehta SS (enero de 2018). "Phlegmasia cerulea dolens después de trombocitopenia inducida por heparina". Revista india de medicina de cuidados críticos . 22 (1): 51–52. doi : 10.4103/ijccm.IJCCM_183_16 . PMC 5793026 . PMID 29422736.
- ^ Owings JT (2005). "Manejo del tromboembolismo venoso". ACS Surgery . Colegio Americano de Cirujanos. Archivado desde el original el 27 de enero de 2012. Consultado el 16 de enero de 2012 .
- ^ Mazer BA, Hughes PG (noviembre de 2018). "Flegmasia cerulea dolens asociada a marcapasos tratada con trombolisis dirigida por catéter". Práctica clínica y casos en medicina de urgencias . 2 (4): 316–19. doi :10.5811/cpcem.2018.8.39444. PMC 6230348 . PMID 30443615.
- ^ Abdul W, Hickey B, Wilson C (abril de 2016). "Síndrome compartimental de las extremidades inferiores en el contexto de trombosis venosa profunda iliofemoral, flegmasia cerulea dolens y deficiencia del factor VII". BMJ Case Reports . 2016 : bcr2016215078. doi :10.1136/bcr-2016-215078. PMC 4854131. PMID 27113791 .
- ^ Zietz A, Sutter R, De Marchis GM (2020). "Trombosis venosa profunda y embolia pulmonar entre pacientes con accidente cerebrovascular criptogénico vinculado a foramen oval permeable: una revisión de la literatura". Frontiers in Neurology . 11 : 336. doi : 10.3389/fneur.2020.00336 . PMC 7214694 . PMID 32431661.
- ^ Pristipino C, Sievert H, D'Ascenzo F, Mas JL, Meier B, Scacciatella P, et al. (enero de 2019). "Documento de posición europeo sobre el tratamiento de pacientes con foramen oval permeable. Enfoque general y tromboembolia de la circulación izquierda". EuroIntervention . 14 (13): 1389–402. doi : 10.4244/EIJ-D-18-00622 . hdl : 2318/1691212 . PMID 30141306.
- ^ abcdefg Bates SM, Jaeschke R, Stevens SM, Goodacre S, Wells PS, Stevenson MD, et al. (febrero de 2012). "Diagnóstico de TVP: terapia antitrombótica y prevención de la trombosis, 9.ª ed.: guías de práctica clínica basadas en la evidencia del American College of Chest Physicians". Chest . 141 (2 Suppl): e351S–e418S. doi :10.1378/chest.11-2299. PMC 3278048 . PMID 22315267.
- ^ Arumilli BR, Lenin Babu V, Paul AS (enero de 2008). "Pierna hinchada y dolorosa: piense más allá de la trombosis venosa profunda o el quiste de Baker". Revista mundial de oncología quirúrgica . 6 : 6. doi : 10.1186/1477-7819-6-6 . PMC 2244628 . PMID 18205917.
- ^ Bauersachs RM (septiembre de 2012). "Presentación clínica de la trombosis venosa profunda y la embolia pulmonar". Mejores prácticas e investigación en hematología clínica . 25 (3): 243–51. doi : 10.1016/j.beha.2012.07.004 . PMID 22959541.
- ^ abc Mukhopadhyay S, Johnson TA, Duru N, Buzza MS, Pawar NR, Sarkar R, et al. (2019). "Fibrinólisis e inflamación en la resolución de trombos venosos". Frontiers in Immunology . 10 : 1348. doi : 10.3389/fimmu.2019.01348 . PMC 6587539 . PMID 31258531.
- ^ Karande GY, Hedgire SS, Sanchez Y, Baliyan V, Mishra V, Ganguli S, et al. (diciembre de 2016). "Imágenes avanzadas en trombosis venosa profunda aguda y crónica". Diagnóstico y terapia cardiovascular . 6 (6): 493–507. doi : 10.21037/cdt.2016.12.06 . PMC 5220209. PMID 28123971 .
- ^ ab Khan F, Rahman A, Carrier M, Kearon C, Weitz JI, Schulman S, et al. (julio de 2019). "Riesgo a largo plazo de tromboembolia venosa recurrente sintomática después de la interrupción del tratamiento anticoagulante para el primer evento de tromboembolia venosa no provocada: revisión sistemática y metanálisis". BMJ . 366 (8209): l4363. doi :10.1136/bmj.l4363. PMC 6651066 . PMID 31340984.
- ^ ab "Existe un riesgo significativo de otra trombosis si se suspende la anticoagulación". NIHR Evidence (Resumen en inglés simple). 31 de octubre de 2019. doi :10.3310/signal-000830. S2CID 242392407.
- ^ Casella IB, Bosch MA, Sabbag CR (2009). "Incidencia y factores de riesgo de trombosis venosa profunda bilateral de miembros inferiores". Angiología . 60 (1): 99–103. doi :10.1177/0003319708316897. PMID 18504268. S2CID 30043830.
- ^ Johnson SA, Stevens SM, Woller SC, Lake E, Donadini M, Cheng J, et al. (febrero de 2010). "Riesgo de trombosis venosa profunda después de una única ecografía de compresión de toda la pierna negativa: una revisión sistemática y un metanálisis". JAMA . 303 (5): 438–45. doi : 10.1001/jama.2010.43 . PMID 20124539.
- ^ Scarvelis D, Wells PS (octubre de 2006). "Diagnóstico y tratamiento de la trombosis venosa profunda". Revista de la Asociación Médica Canadiense . 175 (9): 1087–92. doi :10.1503/cmaj.060366. PMC 1609160 . PMID 17060659.
Scarvelis D, Wells PS (noviembre de 2007). "Corrección: diagnóstico y tratamiento de la trombosis venosa profunda". Revista de la Asociación Médica Canadiense . 177 (11): 1392. doi :10.1503/cmaj.071550. PMC 2072980 . - ^ Galanaud JP, Bosson JL, Quéré I (septiembre de 2011). "Factores de riesgo y resultados tempranos de pacientes con trombosis venosa profunda sintomática distal frente a proximal". Current Opinion in Pulmonary Medicine . 17 (5): 387–91. doi :10.1097/MCP.0b013e328349a9e3. PMID 21832920. S2CID 33536953.
- ^ Utter GH, Dhillon TS, Salcedo ES, Shouldice DJ, Reynolds CL, Humphries MD, et al. (septiembre de 2016). "Anticoagulación terapéutica para la trombosis venosa profunda aislada de la pantorrilla". JAMA Surgery . 151 (9): e161770. doi : 10.1001/jamasurg.2016.1770 . PMID 27437827.
- ^ Comerota AJ, Kearon C, Gu CS, Julian JA, Goldhaber SZ, Kahn SR, et al. (febrero de 2019). "Eliminación endovascular de trombos para trombosis venosa profunda iliofemoral aguda". Circulation . 139 (9): 1162–73. doi : 10.1161/CIRCULATIONAHA.118.037425 . PMC 6389417 . PMID 30586751.
- ^ abcd Kearon C, Kahn SR (enero de 2020). "Tratamiento a largo plazo de la tromboembolia venosa". Blood . 135 (5): 317–25. doi : 10.1182/blood.2019002364 . PMID 31917402.
- ^ Ageno W, Farjat A, Haas S, Weitz JI, Goldhaber SZ, Turpie AGG, et al. (febrero de 2021). "Tromboembolia venosa provocada versus no provocada: hallazgos de GARFIELD-VTE". Investigación y práctica en trombosis y hemostasia . 5 (2): 326–41. doi :10.1002/rth2.12482. PMC 7938631. PMID 33733032 .
- ^ Piazza G (19 de octubre de 2019). «Crónicas de coágulos: TEV no provocada frente a provocada». North American Thrombosis Forum . Archivado desde el original el 8 de mayo de 2021. Consultado el 8 de mayo de 2021 .
- ^ abcde Najem MY, Couturaud F, Lemarié CA (mayo de 2020). "Regulación de la tromboembolia venosa mediante citocinas y quimiocinas". Journal of Thrombosis and Haemostasis . 18 (5): 1009–19. doi : 10.1111/jth.14759 . PMID 32020753. S2CID 211037046.
- ^ abcdef Reitsma PH, Versteeg HH, Middeldorp S (marzo de 2012). "Visión mecanicista de los factores de riesgo de tromboembolismo venoso". Arteriosclerosis, trombosis y biología vascular . 32 (3): 563–68. doi : 10.1161/ATVBAHA.111.242818 . PMID: 22345594.
- ^ Kujovich JL (enero de 2011). "Trombofilia del factor V Leiden". Genética en Medicina . 13 (1): 1–16. doi : 10.1097/GIM.0b013e3181faa0f2 . PMID 21116184.
- ^ abcde Lijfering WM, Rosendaal FR, Cannegieter SC (junio de 2010). "Factores de riesgo de trombosis venosa: conocimiento actual desde un punto de vista epidemiológico". British Journal of Haematology . 149 (6): 824–33. doi : 10.1111/j.1365-2141.2010.08206.x . PMID 20456358.
- ^ Tzoran I, Hoffman R, Monreal M (octubre de 2018). "Hemostasia y trombosis en los ancianos más ancianos". Seminarios en Trombosis y Hemostasia . 44 (7): 624–31. doi :10.1055/s-0038-1657779. PMID 29920621. S2CID 49313388.
- ^ abcd Keeling D, Alikhan R (junio de 2013). "Manejo de la tromboembolia venosa: controversias y futuro". British Journal of Haematology . 161 (6): 755–63. doi : 10.1111/bjh.12306 . PMID 23531017.
- ^ Previtali E, Bucciarelli P, Passamonti SM, Martinelli I (abril de 2011). "Factores de riesgo de trombosis venosa y arterial". Transfusión de sangre . 9 (2): 120–38. doi :10.2450/2010.0066-10. PMC 3096855 . PMID 21084000.
- ^ abcdefghi Martinelli I, Bucciarelli P, Mannucci PM (febrero de 2010). "Factores de riesgo trombótico: fisiopatología básica". Medicina de cuidados críticos . 38 (2 Suppl): S3-9. doi :10.1097/CCM.0b013e3181c9cbd9. PMID 20083911. S2CID 34486553.
- ^ abcdefg Schünemann HJ, Cushman M, Burnett AE, Kahn SR, Beyer-Westendorf J, Spencer FA, et al. (noviembre de 2018). "Pautas de 2018 de la Sociedad Estadounidense de Hematología para el tratamiento de la tromboembolia venosa: profilaxis para pacientes médicos hospitalizados y no hospitalizados". Blood Advances . 2 (22): 3198–225. doi :10.1182/bloodadvances.2018022954. PMC 6258910 . PMID 30482763.
- ^ ab Wong P, Baglin T (2012). "Epidemiología, factores de riesgo y secuelas de la tromboembolia venosa". Flebología . 27 (Supl 2): 2–11. doi :10.1258/phleb.2012.012S31. PMID 22457300. S2CID 13564168.
- ^ ab Rosendaal FR, Reitsma PH (julio de 2009). "Genética de la trombosis venosa". Journal of Thrombosis and Haemostasis . 7 (Supl 1): 301–04. doi : 10.1111/j.1538-7836.2009.03394.x . PMID 19630821.
- ^ Ishida T, Sakurai H, Watanabe K, Iwashita S, Mimura M, Uchida H (julio de 2016). "Incidencia de trombosis venosa profunda en pacientes catatónicos: una revisión de historias clínicas". Psychiatry Research . 241 : 61–5. doi :10.1016/j.psychres.2016.04.105. PMID 27156025. S2CID 207452463.
- ^ Winstein CJ, Stein J, Arena R, Bates B, Cherney LR, Cramer SC, et al. (junio de 2016). "Directrices para la rehabilitación y recuperación de accidentes cerebrovasculares en adultos: una guía para profesionales de la salud de la Asociación Estadounidense del Corazón/Asociación Estadounidense de Accidentes Cerebrovasculares". Stroke . 47 (6): e98–e169. doi : 10.1161/STR.0000000000000098 . PMID 27145936.
- ^ Béliard S, Feuvrier D, Ducroux E, Salomon du Mont L (2018). "Síndrome de May Thurner revelado por claudicación venosa de la pantorrilla izquierda durante la carrera, informe de un caso". BMC Sports Science, Medicine & Rehabilitation . 10 : 3. doi : 10.1186/s13102-018-0092-6 . PMC 5796503 . PMID 29435334.
- ^ ab Hangge P, Rotellini-Coltvet L, Deipolyi AR, Albadawi H, Oklu R (diciembre de 2017). "Síndrome de Paget-Schroetter: tratamiento de la trombosis venosa y resultados". Diagnóstico y terapia cardiovascular . 7 (Supl. 3): S285–90. doi : 10.21037/cdt.2017.08.15 . PMC 5778512. PMID 29399532 .
- ^ Jabri H, Mukherjee S, Sanghavi D, Chalise S (2014). "TVP bilateral de las extremidades superiores en un hombre de 43 años: ¿es síndrome del desfiladero torácico?". Informes de casos en medicina . 2014 : 758010. doi : 10.1155/2014/758010 . PMC 4129160. PMID 25140182 .
- ^ Beristain-Covarrubias N, Perez-Toledo M, Thomas MR, Henderson IR, Watson SP, Cunningham AF (2019). "Entendiendo la trombosis inducida por infección: lecciones aprendidas de modelos animales". Frontiers in Immunology . 10 : 2569. doi : 10.3389/fimmu.2019.02569 . PMC 6848062 . PMID 31749809.
- ^ Kaplan D, Casper TC, Elliott CG, Men S, Pendleton RC, Kraiss LW, et al. (noviembre de 2015). "Incidencia de TEV y factores de riesgo en pacientes con sepsis grave y choque séptico". Chest . 148 (5): 1224–30. doi :10.1378/chest.15-0287. PMC 4631038 . PMID 26111103.
- ^ Jiménez D, García-Sanchez A, Rali P, Muriel A, Bikdeli B, Ruiz-Artacho P, et al. (marzo de 2021). "Incidencia de TEV y sangrado entre pacientes hospitalizados con enfermedad por coronavirus 2019: una revisión sistemática y un metanálisis". Chest . 159 (3): 1182–96. doi :10.1016/j.chest.2020.11.005. PMC 7670889 . PMID 33217420.
- ^ Rokx C, Borjas Howard JF, Smit C, Wit FW, Pieterman ED, Reiss P, et al. (mayo de 2020). "Riesgo de tromboembolismo venoso recurrente en pacientes con infección por VIH: un estudio de cohorte a nivel nacional". PLOS Medicine . 17 (5): e1003101. doi : 10.1371/journal.pmed.1003101 . PMC 7224453 . PMID 32407386.
- ^ Danwang C, Bigna JJ, Awana AP, Nzalie RN, Robert A (febrero de 2021). "Epidemiología global de la tromboembolia venosa en personas con tuberculosis activa: una revisión sistemática y un metanálisis". Revista de trombosis y trombólisis . 51 (2): 502–12. doi :10.1007/s11239-020-02211-7. PMID 32627124. S2CID 220337035.
- ^ Borjas-Howard JF, Leeuw K, Rutgers A, Meijer K, Tichelaar VYIG (marzo de 2019). "Riesgo de tromboembolismo venoso recurrente en enfermedades autoinmunes: una revisión sistemática de la literatura" (PDF) . Seminarios en Trombosis y Hemostasia . 45 (2): 141–49. doi :10.1055/s-0038-1661387. PMID 29954011. S2CID 49606106.
- ^ abc Branchford BR, Carpenter SL (2018). "El papel de la inflamación en la tromboembolia venosa". Frontiers in Pediatrics . 6 : 142. doi : 10.3389/fped.2018.00142 . PMC 5974100 . PMID 29876337.
- ^ Henke PK, Kahn SR, Pannucci CJ, Secemksy EA, Evans NS, Khorana AA, et al. (junio de 2020). "Llamado a la acción para prevenir la tromboembolia venosa en pacientes hospitalizados: una declaración de política de la American Heart Association". Circulation . 141 (24): e914–31. doi : 10.1161/CIR.0000000000000769 . PMID 32375490.
- ^ Becatti M, Emmi G, Bettiol A, Silvestri E, Di Scala G, Taddei N, Prisco D, Fiorillo C (marzo de 2019). "El síndrome de Behçet como herramienta para diseccionar los mecanismos de la tromboinflamación: aspectos clínicos y patogénicos". Inmunología clínica y experimental . 195 (3): 322–33. doi : 10.1111/cei.13243 . PMC 6378375 . PMID 30472725.
- ^ ab Baglin T (abril de 2012). "Factores de riesgo heredados y adquiridos para la tromboembolia venosa". Seminarios en Medicina Respiratoria y de Cuidados Intensivos . 33 (2): 127–37. doi :10.1055/s-0032-1311791. PMID 22648484. S2CID 6925903.
- ^ Knight CL, Nelson-Piercy C (2017). "Manejo del lupus eritematoso sistémico durante el embarazo: desafíos y soluciones". Open Access Rheumatology: Research and Reviews . 9 : 37–53. doi : 10.2147/OARRR.S87828 . PMC 5354538 . PMID 28331377.
- ^ Svenungsson E, Antovic A (enero de 2020). "El síndrome antifosfolípido: ¿causa a menudo ignorada de oclusiones vasculares?". Journal of Internal Medicine . 287 (4): 349–72. doi : 10.1111/joim.13022 . PMID 31957081.
- ^ Falanga A, Russo L, Milesi V, Vignoli A (octubre de 2017). "Mecanismos y factores de riesgo de trombosis en el cáncer". Critical Reviews in Oncology/Hematology . 118 : 79–83. doi :10.1016/j.critrevonc.2017.08.003. PMID 28917273.
- ^ abc Fernandes CJ, Morinaga LTK, Alves JL, Castro MA, Calderaro D, Jardim CVP, et al. (marzo de 2019). "Trombosis asociada al cáncer: cuándo, cómo y por qué". European Respiratory Review . 28 (151): 180119. doi : 10.1183/16000617.0119-2018 . PMC 9488553 . PMID 30918022.
- ^ Levi M, Scully M (febrero de 2018). "Cómo trato la coagulación intravascular diseminada". Sangre . 131 (8): 845–54. doi : 10.1182/blood-2017-10-804096 . PMID 29255070.
- ^ abcd Bovill EG, van der Vliet A (2011). "Hipoxia y trombosis asociadas a estasis valvular venosa: ¿cuál es el vínculo?". Revisión anual de fisiología . 73 : 527–45. doi :10.1146/annurev-physiol-012110-142305. PMID 21034220.
- ^ Mantha S, Karp R, Raghavan V, Terrin N, Bauer KA, Zwicker JI (agosto de 2012). "Evaluación del riesgo de eventos tromboembólicos venosos en mujeres que toman anticonceptivos que contienen solo progestina: un metanálisis". BMJ . 345 (7872): e4944. doi :10.1136/bmj.e4944. PMC 3413580 . PMID 22872710.
- ^ abcd Shaheen K, Alraies MC, Alraiyes AH, Christie R (abril de 2012). "Factor V Leiden: ¿cuán grande es el riesgo de tromboembolia venosa?" . Cleveland Clinic Journal of Medicine . 79 (4): 265–72. doi : 10.3949/ccjm.79a.11072 . PMID 22473726. S2CID 23139811.
- ^ abc Varga EA, Kujovich JL (enero de 2012). "Manejo de la trombofilia hereditaria: guía para profesionales de la genética". Genetics Clinical . 81 (1): 7–17. doi :10.1111/j.1399-0004.2011.01746.x. PMID 21707594. S2CID 9305488.
- ^ abc Dentali F, Sironi AP, Ageno W, Turato S, Bonfanti C, Frattini F, et al. (julio de 2012). "El tipo de sangre distinto del O es el factor de riesgo genético más común para la TEV: resultados de un metanálisis de la literatura". Seminarios sobre trombosis y hemostasia . 38 (5): 535–48. doi :10.1055/s-0032-1315758. PMID 22740183. S2CID 5203474.
- ^ Paulsen B, Skille H, Smith EN, Hveem K, Gabrielsen ME, Brækkan SK y otros. (octubre de 2019). "Gen de fibrinógeno gamma rs2066865 y riesgo de tromboembolismo venoso relacionado con el cáncer". Hematológica . 105 (7): 1963–68. doi : 10.3324/haematol.2019.224279 . PMC 7327659 . PMID 31582554.
- ^ Eslamiyeh H, Ashrafzadeh F, Akhondian J, Beiraghi Toosi M (2015). "Homocistinuria: un trastorno poco común que se presenta como trombosis sinovenosa cerebral". Revista iraní de neurología infantil . 9 (2): 53–57. PMC 4515342 . PMID 26221164.
- ^ Ortel TL, Erkan D, Kitchens CS (septiembre de 2015). "Cómo trato los síndromes trombóticos catastróficos". Blood . 126 (11): 1285–93. doi : 10.1182/blood-2014-09-551978 . PMID 26179082.
- ^ Lazo-Langner A, Kovacs MJ, Hedley B, Al-Ani F, Keeney M, Louzada ML, et al. (junio de 2015). "Detección de clones de hemoglobinuria paroxística nocturna en pacientes con tromboembolia venosa idiopática". Thrombosis Research . 135 (6): 1107–09. doi :10.1016/j.thromres.2015.04.006. PMID 25890452.
- ^ Lu HY, Liao KM (agosto de 2018). "Aumento del riesgo de trombosis venosa profunda en pacientes con enfermedad renal terminal". BMC Nephrology . 19 (1): 204. doi : 10.1186/s12882-018-0989-z . PMC 6097196 . PMID 30115029.
- ^ Reikvam H, Tiu RV (abril de 2012). "Tromboembolia venosa en pacientes con trombocitemia esencial y policitemia vera". Leucemia . 26 (4): 563–71. doi : 10.1038/leu.2011.314 . PMID 22076463.
- ^ Kyrle PA, Eichinger S (2005). "Trombosis venosa profunda". Lancet . 365 (9465): 1163–74. doi :10.1016/S0140-6736(05)71880-8. PMID 15794972. S2CID 54379879.
- ^ McLendon K, Goyal A, Bansal P, Attia M (2020). "Factores de riesgo de trombosis venosa profunda". StatPearls [Internet] . Treasure Island, FL. PMID 29262230.
- ^ Middeldorp S (2011). "¿Son útiles las pruebas de trombofilia?". Hematología. Sociedad Estadounidense de Hematología. Programa Educativo . 2011 (1): 150–55. doi : 10.1182/asheducation-2011.1.150 . PMID 22160027.
- ^ Zöller B, Svensson PJ, Dahlbäck B, Lind-Hallden C, Hallden C, Elf J (septiembre de 2020). "Factores de riesgo genéticos de tromboembolia venosa". Revisión experta de hematología . 13 (9): 971–81. doi : 10.1080/17474086.2020.1804354 . PMID 32731838.
- ^ Palareti G, Schellong S (enero de 2012). "Trombosis venosa profunda distal aislada: lo que sabemos y lo que estamos haciendo". Journal of Thrombosis and Haemostasis . 10 (1): 11–19. doi : 10.1111/j.1538-7836.2011.04564.x . PMID 22082302.
- ^ ab Chapin JC, Hajjar KA (enero de 2015). "Fibrinólisis y control de la coagulación sanguínea". Blood Reviews . 29 (1): 17–24. doi :10.1016/j.blre.2014.09.003. PMC 4314363 . PMID 25294122.
- ^ Chan WS, Spencer FA, Ginsberg JS (abril de 2010). "Distribución anatómica de la trombosis venosa profunda en el embarazo". Revista de la Asociación Médica Canadiense . 182 (7): 657–60. doi :10.1503/cmaj.091692. PMC 2855912 . PMID 20351121.
- ^ Kim ES, Bartholomew JR. "Tromboembolismo venoso". Disease Management Project . Cleveland Clinic. Archivado desde el original el 23 de febrero de 2011. Consultado el 15 de febrero de 2011 .
- ^ ab Saha P, Humphries J, Modarai B, Mattock K, Waltham M, Evans CE, et al. (marzo de 2011). "Leucocitos y la historia natural de la trombosis venosa profunda: conceptos actuales y direcciones futuras". Arteriosclerosis, trombosis y biología vascular . 31 (3): 506–12. doi :10.1161/ATVBAHA.110.213405. PMC 3079895 . PMID 21325673.
- ^ Ro A, Kageyama N, Mukai T (junio de 2017). "Fisiopatología de la tromboembolia venosa con respecto a las características anatómicas de las venas profundas de los miembros inferiores: una revisión". Anales de enfermedades vasculares . 10 (2): 99–106. doi :10.3400/avd.ra.17-00035. PMC 5579784 . PMID 29034034.
- ^ ab Nicklas JM, Gordon AE, Henke PK (marzo de 2020). "Resolución de la trombosis venosa profunda: paradigmas inmunológicos propuestos". Revista Internacional de Ciencias Moleculares . 21 (6): 2080. doi : 10.3390/ijms21062080 . PMC 7139924 . PMID 32197363.
- ^ López JA, Chen J (2009). "Fisiopatología de la trombosis venosa". Thrombosis Research . 123 (Suppl 4): S30–34. doi :10.1016/S0049-3848(09)70140-9. PMID 19303501.
- ^ abc Swystun LL, Liaw PC (agosto de 2016). "El papel de los leucocitos en la trombosis". Sangre . 128 (6): 753–62. doi : 10.1182/blood-2016-05-718114 . PMID 27354721.
- ^ ab Thålin C, Hisada Y, Lundström S, Mackman N, Wallén H (septiembre de 2019). "Trampas extracelulares de neutrófilos: villanos y objetivos en la trombosis arterial, venosa y asociada al cáncer". Arteriosclerosis, trombosis y biología vascular . 39 (9): 1724–38. doi :10.1161/ATVBAHA.119.312463. PMC 6703916 . PMID 31315434.
- ^ Laridan E, Martinod K, De Meyer SF (febrero de 2019). "Trampas extracelulares de neutrófilos en la trombosis arterial y venosa". Seminarios sobre trombosis y hemostasia . 45 (1): 86–93. doi :10.1055/s-0038-1677040. PMID 30634198. S2CID 58594612.
- ^ ab Myers DD (marzo de 2015). "Fisiopatología de la trombosis venosa". Flebología . 30 (1 Suppl): 7–13. doi :10.1177/0268355515569424. PMID 25729062. S2CID 22467822.
- ^ ab "DDI/9290 clinical: D-dimer, plasma". Mayo Medical Laboratories. Archivado desde el original el 8 de octubre de 2012. Consultado el 27 de agosto de 2012 .
- ^ Vedantham S, Goldhaber SZ, Kahn SR, Julian J, Magnuson E, Jaff MR, et al. (abril de 2013). "Fundamento y diseño del estudio ATTRACT: un ensayo aleatorizado multicéntrico para evaluar la trombólisis farmacomecánica dirigida por catéter para la prevención del síndrome postrombótico en pacientes con trombosis venosa profunda proximal". American Heart Journal . 165 (4): 523–530.e3. doi :10.1016/j.ahj.2013.01.024. PMC 3612268 . PMID 23537968.
- ^ Geersing GJ, Zuithoff NP, Kearon C, Anderson DR, Ten Cate-Hoek AJ, Elf JL, et al. (marzo de 2014). "Exclusión de la trombosis venosa profunda mediante la regla de Wells en subgrupos clínicamente importantes: metaanálisis de datos de pacientes individuales". BMJ . 348 (7949): g1340. doi :10.1136/bmj.g1340. PMC 3948465 . PMID 24615063.
- ^ abc Pyzocha N (diciembre de 2019). "Diagnóstico de TVP en adultos no embarazadas en el ámbito de la atención primaria". American Family Physician . 100 (12): 778–80. PMID 31845779.
- ^ abc Stone J, Hangge P, Albadawi H, Wallace A, Shamoun F, Knuttien MG, et al. (diciembre de 2017). "Trombosis venosa profunda: patogenia, diagnóstico y tratamiento médico". Diagnóstico y terapia cardiovascular . 7 (Supl. 3): S276–84. doi : 10.21037 /cdt.2017.09.01 . PMC 5778510. PMID 29399531.
- ^ abc Wells PS, Ihaddadene R, Reilly A, Forgie MA (enero de 2018). "Diagnóstico de tromboembolia venosa: 20 años de progreso". Anales de Medicina Interna . 168 (2): 131–40. doi :10.7326/M17-0291. PMID 29310137. S2CID 34220435.
- ^ ab Le Gal G, Righini M (junio de 2015). "Controversias en el diagnóstico de tromboembolia venosa". Journal of Thrombosis and Haemostasis . 13 (Supl 1): S259–65. doi : 10.1111/jth.12937 . PMID 26149033.
- ^ ab Rahaghi FN, Minhas JK, Heresi GA (septiembre de 2018). "Diagnóstico de trombosis venosa profunda y embolia pulmonar: nuevas herramientas y modalidades de diagnóstico por imágenes". Clinics in Chest Medicine . 39 (3): 493–504. doi :10.1016/j.ccm.2018.04.003. PMC 6317734 . PMID 30122174.
- ^ Häggström, M (enero de 2019). "Vasos subsartoriales como nombres de reemplazo para los vasos femorales superficiales" (PDF) . Revista internacional de anatomía, radiología y cirugía . 8 (1): AV01–02. doi : 10.7860/IJARS/2019/40329:2458 .
- ^ Jaff MR, McMurtry MS, Archer SL, Cushman M, Goldenberg N, Goldhaber SZ, et al. (abril de 2011). "Manejo de la embolia pulmonar masiva y submasiva, la trombosis venosa profunda iliofemoral y la hipertensión pulmonar tromboembólica crónica: una declaración científica de la American Heart Association". Circulation . 123 (16): 1788–830. doi : 10.1161/CIR.0b013e318214914f . PMID 21422387.
- ^ Cundiff DK, Manyemba J, Pezzullo JC (enero de 2006). Cundiff DK (ed.). "Anticoagulantes versus antiinflamatorios no esteroides o placebo para el tratamiento de la tromboembolia venosa". Base de Datos Cochrane de Revisiones Sistemáticas . 2006 (1): CD003746. doi :10.1002/14651858.CD003746.pub2. PMC 7389637. PMID 16437461 .
- ^ Fleck D, Albadawi H, Wallace A, Knuttinen G, Naidu S, Oklu R (diciembre de 2017). "Trombosis venosa profunda (TVP) por debajo de la rodilla: patrones de diagnóstico y tratamiento". Diagnóstico y terapia cardiovascular . 7 (Supl. 3): S134–39. doi : 10.21037/cdt.2017.11.03 . PMC 5778527. PMID 29399516 .
- ^ abcde Kearon C, Akl EA, Ornelas J, Blaivas A, Jimenez D, Bounameaux H, et al. (febrero de 2016). "Terapia antitrombótica para la enfermedad de TEV: guía CHEST e informe del panel de expertos". Chest . 149 (2): 315–52. doi :10.1016/j.chest.2015.11.026. PMID 26867832.
- ^ ab Kearon C, Akl EA, Comerota AJ, Prandoni P, Bounameaux H, Goldhaber SZ, et al. (febrero de 2012). "Terapia antitrombótica para la enfermedad de TEV: terapia antitrombótica y prevención de la trombosis, 9.ª ed.: guías de práctica clínica basadas en la evidencia del American College of Chest Physicians". Chest . 141 (2 Suppl): e419S–96S. doi :10.1378/chest.11-2301. PMC 3278049 . PMID 22315268.
- ^ Shikdar S, Vashisht R, Bhattacharya PT (2021). "Razón internacional normalizada (INR)". StatPearls [Internet] . Treasure Island, Florida. PMID 29939529.
- ^ Guyatt y otros. 2012, pág. 22S: 3.2.
- ^ Middeldorp S, Prins MH, Hutten BA (agosto de 2014). "Duración del tratamiento con antagonistas de la vitamina K en la tromboembolia venosa sintomática". Base de datos Cochrane de revisiones sistemáticas . 2014 (8): CD001367. doi : 10.1002 /14651858.CD001367.pub3. PMC 7074008. PMID 25092359.
- ^ ab de Jong PG, Coppens M, Middeldorp S (agosto de 2012). "Duración de la terapia anticoagulante para la tromboembolia venosa: equilibrio entre beneficios y daños a largo plazo". British Journal of Haematology . 158 (4): 433–41. doi : 10.1111/j.1365-2141.2012.09196.x . PMID 22734929.
- ^ Witt DM, Nieuwlaat R, Clark NP, Ansell J, Holbrook A, Skov J, et al. (noviembre de 2018). "Pautas de 2018 de la Sociedad Estadounidense de Hematología para el tratamiento de la tromboembolia venosa: tratamiento óptimo de la terapia anticoagulante". Blood Advances . 2 (22): 3257–91. doi :10.1182/bloodadvances.2018024893. PMC 6258922 . PMID 30482765.
- ^ Keeling D, Baglin T, Tait C, Watson H, Perry D, Baglin C, et al. (agosto de 2011). "Directrices sobre anticoagulación oral con warfarina – cuarta edición". British Journal of Haematology . 154 (3): 311–24. doi : 10.1111/j.1365-2141.2011.08753.x . PMID 21671894.
- ^ Douketis J, Tosetto A, Marcucci M, Baglin T, Cushman M, Eichinger S, et al. (octubre de 2010). "Metaanálisis a nivel de paciente: efecto del momento de la medición, el umbral y la edad del paciente en la capacidad de la prueba del dímero D para evaluar el riesgo de recurrencia después de una tromboembolia venosa no provocada". Anales de Medicina Interna . 153 (8): 523–31. doi :10.7326/0003-4819-153-8-201010190-00009. PMID 20956709. S2CID 10659607.
- ^ Chatsis V, Visintini S (enero de 2017). Movilización temprana de pacientes con tromboembolia venosa: una revisión de la eficacia clínica y las directrices (informe). Ottawa, ON: Agencia Canadiense de Medicamentos y Tecnologías en Salud. PMID 30303669.
- ^ Berntsen CF, Kristiansen A, Akl EA, Sandset PM, Jacobsen EM, Guyatt G, et al. (abril de 2016). "Medias de compresión para la prevención del síndrome postrombótico en pacientes con trombosis venosa profunda". The American Journal of Medicine . 129 (4): 447.e1–447.e20. doi :10.1016/j.amjmed.2015.11.031. PMID 26747198.
- ^ Wigle P, Hein B, Bernheisel CR (octubre de 2019). "Anticoagulación: pautas actualizadas para el tratamiento ambulatorio". American Family Physician . 100 (7): 426–34. PMID 31573167.
- ^ Wallace A, Albadawi H, Hoang P, Fleck A, Naidu S, Knuttinen G, et al. (diciembre de 2017). "Estatinas como terapia preventiva para la tromboembolia venosa". Diagnóstico y terapia cardiovascular . 7 (Supl. 3): S207–18. doi : 10.21037/cdt.2017.09.12 . PMC 5778529. PMID 29399524 .
- ^ abcdefg «Descripción general | Enfermedades tromboembólicas venosas: diagnóstico, tratamiento y pruebas de trombofilia | Orientación | NICE». www.nice.org.uk . 26 de marzo de 2020 . Consultado el 16 de octubre de 2024 .
- ^ Enden T, Haig Y, Kløw NE, Slagsvold CE, Sandvik L, Ghanima W, et al. (enero de 2012). "Resultado a largo plazo después de una trombólisis adicional dirigida por catéter frente al tratamiento estándar para la trombosis venosa profunda iliofemoral aguda (estudio CaVenT): un ensayo controlado aleatorizado". Lancet . 379 (9810): 31–38. doi :10.1016/S0140-6736(11)61753-4. PMID 22172244. S2CID 21801157.
- ^ Haig Y, Enden T, Grøtta O, Kløw NE, Slagsvold CE, Ghanima W, et al. (febrero de 2016). "Síndrome postrombótico después de la trombolisis dirigida por catéter para la trombosis venosa profunda (CaVenT): resultados de seguimiento a 5 años de un ensayo controlado aleatorizado abierto". The Lancet Haematology . 3 (2): e64–71. doi :10.1016/S2352-3026(15)00248-3. PMID 26853645.
- ^ ab Vedantham S, Goldhaber SZ, Julian JA, Kahn SR, Jaff MR, Cohen DJ, et al. (diciembre de 2017). "Trombólisis dirigida por catéter farmacomecánica para la trombosis venosa profunda". The New England Journal of Medicine . 377 (23): 2240–52. doi :10.1056/NEJMoa1615066. PMC 5763501 . PMID 29211671.
- ^ Bhandari T (6 de diciembre de 2017). "Los fármacos anticoagulantes no se recomiendan para la mayoría de los pacientes con coágulos sanguíneos". Facultad de Medicina de la Universidad de Washington . Consultado el 21 de enero de 2020 .
- ^ ab "Descripción general | Trombectomía mecánica percutánea para la trombosis venosa profunda aguda de la pierna | Orientación | NICE". www.nice.org.uk . 12 de junio de 2019 . Consultado el 16 de octubre de 2024 .
- ^ Comerota AJ, Kearon C, Gu CS, Julian JA, Goldhaber SZ, Kahn SR, et al. (febrero de 2019). "Eliminación endovascular de trombos para trombosis venosa profunda iliofemoral aguda". Circulation . 139 (9): 1162–73. doi :10.1161/CIRCULATIONAHA.118.037425. PMC 6389417 . PMID 30586751.
- ^ Magnuson EA, Chinnakondepalli K, Vilain K, Kearon C, Julian JA, Kahn SR, et al. (octubre de 2019). "Relación coste-efectividad de la trombólisis dirigida por catéter farmacomecánica frente a la anticoagulación estándar en pacientes con trombosis venosa profunda proximal: resultados del ensayo ATTRACT". Circulation: Cardiovascular Quality and Outcomes . 12 (10): e005659. doi :10.1161/CIRCOUTCOMES.119.005659. PMC 6788761 . PMID 31592728.
- ^ Jones MR, Prabhakar A, Viswanath O, Urits I, Green JB, Kendrick JB, et al. (junio de 2019). "Síndrome del desfiladero torácico: una revisión exhaustiva de la fisiopatología, el diagnóstico y el tratamiento". Pain and Therapy . 8 (1): 5–18. doi :10.1007/s40122-019-0124-2. PMC 6514035 . PMID 31037504.
- ^ abc Ijaopo R, Oguntolu V, DCosta D, Garnham A, Hobbs S (marzo de 2016). "Un caso de síndrome de Paget-Schroetter (PSS) en un joven tutor de judo: informe de un caso". Journal of Medical Case Reports . 10 : 63. doi : 10.1186/s13256-016-0848-0 . PMC 4797165 . PMID 26987584.
- ^ Turner TE, Saeed MJ, Novak E, Brown DL (julio de 2018). "Asociación de la colocación de un filtro en la vena cava inferior para la enfermedad tromboembólica venosa y una contraindicación para la anticoagulación con mortalidad a los 30 días". JAMA Network Open . 1 (3): e180452. doi :10.1001/jamanetworkopen.2018.0452. PMC 6324296 . PMID 30646021.
- ^ Moll S (9 de mayo de 2012). "¿Qué tipo de médico necesito?". Clot Connect . Archivado desde el original el 28 de enero de 2020. Consultado el 28 de enero de 2020 .
- ^ Kitchen L, Lawrence M, Speicher M, Frumkin K (julio de 2016). "Manejo en el departamento de emergencias de la sospecha de trombosis venosa profunda de la vena de la pantorrilla: un algoritmo de diagnóstico". The Western Journal of Emergency Medicine . 17 (4): 384–90. doi :10.5811/westjem.2016.5.29951. PMC 4944794 . PMID 27429688.
- ^ "Colocación de filtro en la vena cava inferior (VCI)". Johns Hopkins Medicine . 2020 . Consultado el 28 de enero de 2020 .
- ^ Partsch H, Blättler W (noviembre de 2000). "Compresión y marcha versus reposo en cama en el tratamiento de la trombosis venosa profunda proximal con heparina de bajo peso molecular". Journal of Vascular Surgery . 32 (5): 861–69. doi : 10.1067/mva.2000.110352 . PMID 11054217.
- ^ ab Folsom AR, Cushman M (diciembre de 2020). "Explorando oportunidades para la prevención primaria de la tromboembolia venosa no provocada: ¿listos para el momento clave?". Journal of the American Heart Association . 9 (23): e019395. doi :10.1161/JAHA.120.019395. PMC 7763794 . PMID 33191841.
- ^ Li L, Zhang P, Tian JH, Yang K (diciembre de 2014). "Estatinas para la prevención primaria de la tromboembolia venosa". Base de datos Cochrane de revisiones sistemáticas . 2014 (12): CD008203. doi : 10.1002/14651858.CD008203.pub3 . PMC 11127252. PMID 25518837 .
- ^ Kunutsor SK, Seidu S, Khunti K (febrero de 2017). "Estatinas y prevención primaria de la tromboembolia venosa: una revisión sistemática y un metanálisis" (PDF) . The Lancet Haematology . 4 (2): e83–e93. doi :10.1016/S2352-3026(16)30184-3. hdl : 1983/5a398e70-6c7c-40bd-a8d4-53c24d84f1a2 . PMID 28089655. S2CID 24036108.
- ^ Biere-Rafi S, Hutten BA, Squizzato A, Ageno W, Souverein PC, de Boer A, et al. (junio de 2013). "Tratamiento con estatinas y riesgo de embolia pulmonar recurrente". European Heart Journal . 34 (24): 1800–06. doi : 10.1093/eurheartj/eht046 . PMID 23396492.
- ^ Sobieraj DM, Lee S, Coleman CI, Tongbram V, Chen W, Colby J, et al. (mayo de 2012). "Tromboprofilaxis venosa de duración prolongada versus estándar en cirugía ortopédica mayor: una revisión sistemática". Annals of Internal Medicine . 156 (10): 720–27. doi :10.7326/0003-4819-156-10-201205150-00423. PMID 22412039. S2CID 22797561.
- ^ Falck-Ytter Y, Francis CW, Johanson NA, Curley C, Dahl OE, Schulman S, et al. (febrero de 2012). "Prevención de la TEV en pacientes de cirugía ortopédica: terapia antitrombótica y prevención de la trombosis, 9.ª ed.: guías de práctica clínica basadas en la evidencia del American College of Chest Physicians". Chest . 141 (2 Suppl): e278S–e325S. doi :10.1378/chest.11-2404. PMC 3278063 . PMID 22315265.
- ^ Gould MK, Garcia DA, Wren SM, Karanicolas PJ, Arcelus JI, Heit JA, et al. (febrero de 2012). "Prevención de la TEV en pacientes quirúrgicos no ortopédicos: terapia antitrombótica y prevención de la trombosis, 9.ª ed.: guías de práctica clínica basadas en la evidencia del American College of Chest Physicians". Chest . 141 (2 Suppl): e227S–77S. doi :10.1378/chest.11-2297. PMC 3278061 . PMID 22315263.
- ^ ab Bates SM, Rajasekhar A, Middeldorp S, McLintock C, Rodger MA, James AH, et al. (noviembre de 2018). "Pautas de 2018 de la Sociedad Estadounidense de Hematología para el tratamiento de la tromboembolia venosa: tromboembolia venosa en el contexto del embarazo". Blood Advances . 2 (22): 3317–59. doi :10.1182/bloodadvances.2018024802. PMC 6258928 . PMID 30482767.
- ^ Bates SM, Greer IA, Middeldorp S, Veenstra DL, Prabulos AM, Vandvik PO (febrero de 2012). "TEV, trombofilia, terapia antitrombótica y embarazo: terapia antitrombótica y prevención de la trombosis, 9.ª ed.: guías de práctica clínica basadas en la evidencia del American College of Chest Physicians". Chest . 141 (2 Suppl): e691S–e736S. doi :10.1378/chest.11-2300. PMC 3278054 . PMID 22315276.
- ^ ab Kahn SR, Lim W, Dunn AS, Cushman M, Dentali F, Akl EA, et al. (febrero de 2012). "Prevención de TEV en pacientes no quirúrgicos: terapia antitrombótica y prevención de la trombosis, 9.ª ed.: Guías de práctica clínica basadas en la evidencia del American College of Chest Physicians". Chest . 141 (2 Suppl): e195S–e226S. doi :10.1378/chest.11-2296. PMC 3278052 . PMID 22315261. Consulte la sección 6.0, Viajes de larga distancia.
- ^ "Nuevas pautas sobre TVP: no hay evidencia que respalde el "síndrome de la clase económica"". American College of Chest Physicians. 7 de febrero de 2012. Archivado desde el original el 3 de junio de 2016. Consultado el 10 de febrero de 2012.
Los anticonceptivos orales, sentarse en un asiento de ventanilla, la edad avanzada y el embarazo aumentan el riesgo de TVP en viajeros de larga distancia
- ^ Clarke MJ, Broderick C, Hopewell S, Juszczak E, Eisinga A (abril de 2021). "Medias de compresión para prevenir la trombosis venosa profunda en pasajeros de aerolíneas". Base de datos Cochrane de revisiones sistemáticas . 2021 (4): CD004002. doi :10.1002/14651858.CD004002.pub4. PMC 8092568. PMID 33878207 .
- ^ Galanaud JP, Monreal M, Kahn SR (abril de 2018). "Epidemiología del síndrome postrombótico". Thrombosis Research . 164 : 100–09. doi :10.1016/j.thromres.2017.07.026. PMID 28844444.
- ^ Galanaud JP, Righini M, Le Collen L, Douillard A, Robert-Ebadi H, Pontal D, et al. (enero de 2020). "Riesgo a largo plazo de síndrome postrombótico después de una trombosis venosa profunda distal sintomática: el estudio CACTUS-PTS". Journal of Thrombosis and Haemostasis . 18 (4): 857–64. doi : 10.1111/jth.14728 . PMID 31899848.
- ^ Konstantinides SV, Torbicki A, Agnelli G, Danchin N, Fitzmaurice D, Galiè N, et al. (noviembre de 2014). "Guías ESC 2014 sobre el diagnóstico y el tratamiento de la embolia pulmonar aguda". European Heart Journal . 35 (43): 3033–69, 3069a–69k. doi : 10.1093/eurheartj/ehu283 . PMID 25173341.
- ^ Johannesen CD, Flachs EM, Ebbehøj NE, Marott JL, Jensen GB, Nordestgaard BG, et al. (enero de 2020). "Trabajo sedentario y riesgo de tromboembolismo venoso". Revista escandinava de trabajo, medio ambiente y salud . 46 (1): 69–76. doi : 10.5271/sjweh.3841 . PMID 31385593.
- ^ abc Grosse SD, Nelson RE, Nyarko KA, Richardson LC, Raskob GE (enero de 2016). "La carga económica de la tromboembolia venosa incidental en los Estados Unidos: una revisión de los costos de atención médica atribuibles estimados". Investigación sobre la trombosis . 137 : 3–10. doi :10.1016/j.thromres.2015.11.033. PMC 4706477 . PMID 26654719.
- ^ ab Monagle P, Cuello CA, Augustine C, Bonduel M, Brandão LR, Capman T, et al. (noviembre de 2018). "Pautas de 2018 de la Sociedad Estadounidense de Hematología para el manejo de la tromboembolia venosa: tratamiento de la tromboembolia venosa pediátrica". Blood Advances . 2 (22): 3292–316. doi :10.1182/bloodadvances.2018024786. PMC 6258911 . PMID 30482766.
- ^ Januel JM, Chen G, Ruffieux C, Quan H, Douketis JD, Crowther MA, et al. (enero de 2012). "Trombosis venosa profunda sintomática intrahospitalaria y embolia pulmonar después de una artroplastia de cadera y rodilla entre pacientes que reciben la profilaxis recomendada: una revisión sistemática". JAMA . 307 (3): 294–303. doi : 10.1001/jama.2011.2029 . PMID 22253396.
- ^ Margaglione M, Grandone E (febrero de 2011). "Genética poblacional del tromboembolismo venoso. Una revisión narrativa". Trombosis y hemostasia . 105 (2): 221–31. doi :10.1160/TH10-08-0510. PMID 20941456. S2CID 17552169.
- ^ "Tipos de sangre". Cruz Roja Americana. Archivado desde el original el 14 de agosto de 2012 . Consultado el 15 de agosto de 2012 .
- ^ ab Haskell R (10 de enero de 2018). "Serena Williams habla de la maternidad, el matrimonio y su regreso". Vogue . Consultado el 22 de enero de 2020 .
- ^ Golemi I, Salazar Adum JP, Tafur A, Caprini J (agosto de 2019). "Profilaxis del tromboembolismo venoso mediante la puntuación de Caprini". Enfermedad al mes . 65 (8): 249–98. doi :10.1016/j.disamonth.2018.12.005. PMID 30638566. S2CID 58564402.
- ^ Perez AJ (17 de febrero de 2016). «Experto: Chris Bosh, como muchos otros, corre el riesgo de sufrir una recurrencia de coágulos sanguíneos». USA Today . Consultado el 22 de enero de 2020 .
- ^ Martin J (4 de mayo de 2016). "Chris Bosh oficialmente fuera mientras el Heat avanza hacia los playoffs". CNN . Consultado el 22 de enero de 2020 .
- ^ Moisse K (2 de marzo de 2011). "Serena Williams hospitalizada tras embolia pulmonar". ABC News . Consultado el 22 de enero de 2020 .
- ^ Andrews BL, Friedman Ross L (febrero de 2021). "Las mujeres y los bebés negros importan". The American Journal of Bioethics . 21 (2): 93–95. doi :10.1080/15265161.2020.1861384. PMID 33534674. S2CID 231803661.
- ^ Pascarella L, Pappas TN (febrero de 2013). "Flebitis, embolia pulmonar y política presidencial: la complicada trombosis venosa profunda de Richard M. Nixon". The American Surgeon . 79 (2): 128–34. doi : 10.1177/000313481307900222 . PMID 23336651.
- ^ Frankel TC (11 de septiembre de 2016). «Hillary Clinton no ha sido rápida en compartir información sobre salud». The Washington Post . Consultado el 22 de enero de 2020 .
- ^ "Cheney diagnosticado con trombosis venosa profunda". The Guardian . 6 de marzo de 2007 . Consultado el 22 de enero de 2020 .
- ^ ab Rodriguez D (12 de octubre de 2018). "11 celebridades que lucharon contra el riesgo de trombosis venosa profunda". Everyday Health . Consultado el 22 de enero de 2020 .
- ^ "Forense: el rapero Heavy D murió de un coágulo de sangre en el pulmón". CNN . 27 de diciembre de 2011 . Consultado el 22 de enero de 2020 .
- ^ "Mi marido debería estar vivo hoy". HOY . 3 de marzo de 2005 . Consultado el 22 de enero de 2020 .
- ^ Eliot M (2006). Jimmy Stewart: una biografía . Nueva York: Random House. pág. 409. ISBN. 978-1400052226.
- ^ abc Goodman LR (octubre de 2013). "En busca de la tromboembolia venosa: los primeros 2913 años". American Journal of Roentgenology . 201 (4): W576-81. doi : 10.2214/AJR.13.10604 . PMID 24059395.
- ^ Galanaud JP, Laroche JP, Righini M (marzo de 2013). "Historia y tratamientos históricos de la trombosis venosa profunda". Journal of Thrombosis and Haemostasis . 11 (3): 402–11. doi : 10.1111/jth.12127 . PMID 23297815.
- ^ abc Kumar DR, Hanlin E, Glurich I, Mazza JJ, Yale SH (diciembre de 2010). "La contribución de Virchow a la comprensión de la trombosis y la biología celular". Medicina clínica e investigación . 8 (3–4): 168–72. doi :10.3121/cmr.2009.866. PMC 3006583 . PMID 20739582.
- ^ ab Bagot CN, Arya R (octubre de 2008). "Virchow y su tríada: una cuestión de atribución". British Journal of Haematology . 143 (2): 180–90. doi : 10.1111/j.1365-2141.2008.07323.x . PMID 18783400.
- ^ Dalen 2003, pág. 3.
- ^ Line BR, Peters TL, Keenan J (enero de 1997). "Comparaciones de pruebas diagnósticas en pacientes con trombosis venosa profunda" (PDF) . Revista de Medicina Nuclear . 38 (1): 89–92. PMID 8998158.
- ^ Dalen 2003, pág. 2.
- ^ ab Ornstein C, Jones RG (7 de enero de 2015). "Los medicamentos que las empresas promocionan a los médicos rara vez son avances". The New York Times .
- ^ ab Franchini M, Mannucci PM (septiembre de 2016). "Anticoagulantes orales directos y tromboembolia venosa". European Respiratory Review . 25 (141): 295–302. doi : 10.1183/16000617.0025-2016 . PMC 9487211 . PMID 27581829.
- ^ Dasta JF, Pilon D, Mody SH, Lopatto J, Laliberté F, Germain G, et al. (febrero de 2015). "Costos de hospitalización diaria en pacientes con trombosis venosa profunda o embolia pulmonar tratados con terapia anticoagulante". Thrombosis Research . 135 (2): 303–10. doi : 10.1016/j.thromres.2014.11.024 . PMID 25555319.
- ^ Ruppert A, Steinle T, Lees M (2011). "Carga económica de la tromboembolia venosa: una revisión sistemática". Revista de economía médica . 14 (1): 65–74. doi : 10.3111/13696998.2010.546465 . PMID 21222564.
- ^ Dobesh PP (agosto de 2009). "Carga económica de la tromboembolia venosa en pacientes hospitalizados". Farmacoterapia . 29 (8): 943–53. doi :10.1592/phco.29.8.943. PMID 19637948. S2CID 8966676.
- ^ Fernandez MM, Hogue S, Preblick R, Kwong WJ (2015). "Revisión del costo de la tromboembolia venosa". ClinicoEconomics and Outcomes Research . 7 : 451–62. doi : 10.2147/CEOR.S85635 . PMC 4559246 . PMID 26355805.
- ^ Metz AK, Diaz JA, Obi AT, Wakefield TW, Myers DD, Henke PK (2018). "Trombosis venosa y síndrome postrombótico: de nuevos biomarcadores a la biología". Methodist DeBakey Cardiovascular Journal . 14 (3): 173–81. doi :10.14797/mdcj-14-3-173. PMC 6217569 . PMID 30410646.
Literatura citada
- Dalen JE (2003). Tromboembolismo venoso. Prensa CRC. ISBN 978-0824756451.
- Guyatt GH, Akl EA, Crowther M, Gutterman DD, Schuünemann HJ (febrero de 2012). "Resumen ejecutivo: Terapia antitrombótica y prevención de la trombosis, 9.ª ed.: guías de práctica clínica basadas en la evidencia del American College of Chest Physicians". Chest . 141 (2 Suppl): 7S–47S. doi :10.1378/chest.1412S3. PMC 3278060 . PMID 22315257.




![Ecografía Doppler que muestra ausencia de flujo y contenido hiperecogénico en una vena femoral coagulada (denominada subsartorial[h]) distal al punto de ramificación de la vena femoral profunda. En comparación con este coágulo, los coágulos que obstruyen la vena femoral común (proximal a este punto de ramificación) causan efectos más graves debido a que afectan una porción significativamente más grande de la pierna.[122]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/4f/Ultrasonography_of_deep_vein_thrombosis_of_the_femoral_vein_-annotated.jpg/440px-Ultrasonography_of_deep_vein_thrombosis_of_the_femoral_vein_-annotated.jpg)


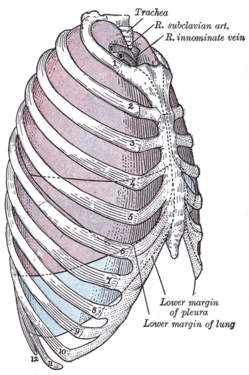

![Después del tratamiento con trombolisis dirigida por catéter, el flujo sanguíneo en la vena axilar y subclavia mejoró significativamente. Posteriormente, una resección de la primera costilla permitió la descompresión. Esto reduce el riesgo de TVP recurrente y otras secuelas de la compresión del desfiladero torácico.[147]](http://upload.wikimedia.org/wikipedia/commons/6/6e/A-case-of-Paget-Schroetter-syndrome-%28PSS%29-in-a-young-judo-tutor-a-case-report-13256_2016_848_Fig2_HTML.jpg)